摘要
背景
肌生长抑制素(MSTN)是一种转化生长因子ß超家族成员,是骨骼肌质量的主要调节因子。GDF-11与MSTN高度相关,在胚胎发育过程中发挥多种作用,包括调节中轴骨架、肾脏、神经系统和胰腺的发育。由于MSTN和GDF-11具有高度的氨基酸序列一致性,在细胞培养实验中表现几乎相同,并利用相似的调控和信号传导成分,一个关键的问题是,它们不同的生物学功能是由于它们与特定调控和信号传导成分相互作用能力的内在差异造成的,还是它们不同的生物学功能主要反映了它们不同的时空表达模式。
方法
我们生成并鉴定了小鼠,我们精确地在种系中替换了Mstn基因编码成熟的c端肽与相应的区域Gdf11.
结果
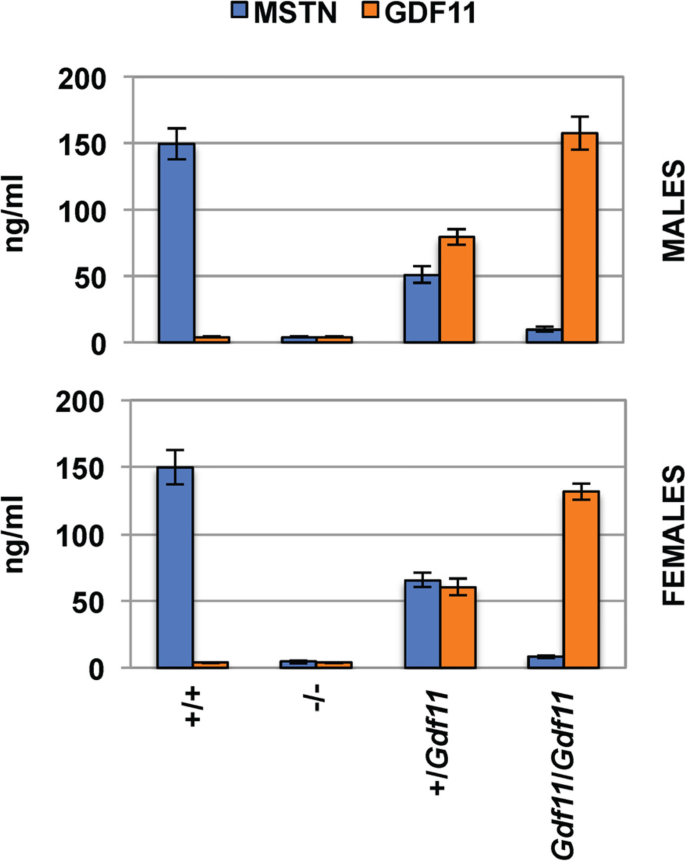
在敲入等位基因纯合的小鼠中,所有循环的MSTN蛋白都被GDF-11取代,导致循环的GDF-11水平增加了30 - 40倍。纯合子敲入等位基因的雄性小鼠肌肉重量略有下降,高脂肪饮食导致体重增加略有增加,血浆胆固醇和高密度脂蛋白水平略有增加,骨密度和骨量显著下降,而雌性小鼠大多不受影响。
结论
GDF-11似乎能够几乎完全在功能上取代MSTN控制肌肉质量。用GDF-11取代MSTN的发育和生理后果非常有限。
背景
肌生长抑制素(Myostatin, MSTN)是转化生长因子-ß (TGF-ß)超家族成员,通常起限制骨骼肌质量的作用[1].缺乏MSTN的小鼠全身肌肉质量显著增加,单个肌肉生长到正常大小的两倍左右。MSTN在进化中高度保守[2],以及基因中自然发生和工程突变MSTN基因也已被证明在许多其他哺乳动物中导致肌肉质量和/或功能的增加[2,3.,4,5,6,7,8,9,10,11,12,13,14,15,16], fish [17,18,19],和avian [20.,21)的物种。MSTN的缺失会导致发育过程中形成的肌肉纤维数量增加,以及单个纤维的大小增加[1].出生后,MSTN由肌纤维产生[1],在血液中循环[22],并将信号传回肌纤维以限制生长[23,24].基于MSTN的这种出生后功能,许多制药和生物技术公司已经开发了MSTN抑制剂,这些抑制剂已在肌肉和代谢疾病患者的临床试验中进行了测试(请参阅参考文献)。25])。
GDF-11,最初是用Mstn作为探针[1],是一种高度相关的TGF-ß家族成员,在蛋白的成熟部分与MSTN约90%相同[26,27].小鼠的基因靶向研究表明GDF-11的功能与MSTN不同。在胚胎发生过程中,GDF-11已被证明可以调节轴骨的前后模式[28]以及肾脏的发育[29],胰腺[30.,31],以及神经系统[32,33,34].虽然表型Mstn−−/而且Gdf11−−/小鼠似乎大多不重叠,这两个基因已被证明至少部分功能冗余的前后轴模式[35].我们对GDF-11的成人功能知之甚少,因为Gdf11−−/小鼠在出生后24小时内死亡。
MSTN和GDF-11在细胞培养检测中几乎难以区分,并且也有许多共同的调控和信号传导机制和成分。MSTN是以前体形式合成的,在蛋白水解过程之后,作为实际信号分子的c端二聚体以非共价的方式以非活性的潜在状态与前肽结合[36,37].金属蛋白酶BMP-1/tolloid家族成员对前肽的蛋白水解裂解可激活MSTN潜在复合体[38],这似乎是在体内起作用的主要机制[39].同样,GDF-11的c端二聚体和前肽也形成一个潜在的复合物,可被BMP-1/甲样体蛋白酶激活[40].MSTN也受到细胞外其他结合蛋白的调控,包括卵泡抑素(FST) [36], fstl-3 [41]、gas -1和gas -2 [42].基因研究表明,FST的缺失[43,44,45]和/或gas -1/ gas -2 [46]导致肌肉质量下降,纤维类型改变,这与它们在体内抑制MSTN的作用一致。这些结合蛋白也能抑制GDF-11,缺乏FST的小鼠[43]或GASP-1/GASP-2 [46]也表现出与GDF-11活性增加一致的轴向图形缺陷。最后,当没有抑制性结合蛋白时,MSTN能够结合2型受体ACVR2和ACVR2B [36],以及1型受体ALK4和ALK5 [47].在小鼠中靶向这些受体会导致肌肉质量增加,这与这些受体在体内介导MSTN信号传导中发挥的关键作用一致[24,48].GDF-11能够与这些受体结合Acvr2而且Acvr2b突变小鼠出现轴向图案和肾脏缺陷[49,50,51,52,53]类似于Gdf11突变体。
鉴于MSTN和GDF-11具有高度的氨基酸序列一致性,在细胞培养实验中表现几乎相同,并利用相似的调控和信号传导成分,一个关键的问题是,它们不同的生物学功能是由于它们与特定调控和信号传导成分相互作用能力的内在差异造成的,还是它们不同的生物学功能主要反映了它们不同的时空表达模式。鉴于MSTN和GDF-11都在血液中循环,另一个关键问题是这些配体是局部作用还是系统作用于向靶细胞发出信号。遗传学研究表明,MSTN具有自分泌/旁分泌和内分泌两种作用模式[54],尽管人们对GDF-11在成年动物中的功能及其作用模式知之甚少。尽管任一MSTN [22]或GDF-11 [55,56]已被证明可在成年小鼠中诱导恶病质样综合征,至少有一项研究报告了外源给予小鼠MSTN和GDF-11蛋白的明显效果,这表明这两种分子可能在生物学特性上存在内在差异[57].在这里,我们解决了这两个分子的功能等价替换的部分Mstn基因编码其成熟结构域的相应部分Gdf11在老鼠的生殖系中。
方法
所有的动物实验都是按照康涅狄格大学医学院和约翰霍普金斯大学医学院的动物护理和使用委员会批准的协议进行的。产生小鼠携带aMstnGdf11敲入等位基因,靶向结构被电穿孔到胚胎干细胞(ES)细胞,携带同源靶向等位基因的ES细胞被注射到囊胚中。从这些囊胚产生的嵌合小鼠被培育以识别那些表现出生殖系传播的目标等位基因。这些交配的后代然后与EIIa-Cre转基因小鼠[58],以删除种系中的新霉素抗性盒。从这些十字架中,我们得到了携带MstnGdf11敲入等位基因缺乏新卡带。
采用液相色谱-串联质谱法测定循环MSTN和GDF-11水平,如所述[59].在GDF-11试验中没有检测到MSTN的交叉反应,在MSTN试验中也没有检测到GDF-11;加入高达100 ng/mL的GDF-11对GDF-8的测量没有显著影响,加入高达100 ng/mL的GDF-8对GDF-11的测量没有影响。GDF-8和GDF-11的定量下限均为0.5 ng/mL。两种检测方法的线性范围为0 ~ 100 ng/mL。MSTN检测在低(8.7 ng/mL)、中(51.1 ng/mL)和高(97.6 ng/mL)质量控制池中的检测间变异系数分别为15.1%、11.3%和7.4%,GDF-11检测在低(3.4 ng/mL)、中(52.0 ng/mL)和高(104.7 ng/mL)质量控制池中相应的cv分别为8.7%、12.8%和17.1% [59].
为了测量肌肉重量,从10周大的小鼠两侧解剖单个肌肉,每块肌肉使用平均重量。用低温恒温器从腓肠肌最宽处横向切取连续切片(15 μm)。纤维类型分析使用Schiaffino等人开发的抗体(BA-D5、SC-71和BF-F3分别针对肌凝蛋白重链I型、IIa型和IIb型)进行。[60],并从发育研究杂交瘤库中获得,杂交瘤库是在国家儿童健康和人类发展研究所的赞助下开发的,由爱荷华大学维护。使用Piximus双能x线吸收仪(DXA)进行活体动物成像。葡萄糖耐量试验(GTT)是在禁食6小时后腹腔注射1g葡萄糖/kg体重。然后将小鼠置于60千卡%脂肪饮食(D12492, Research dietary, Inc.),并在4周后进行重复GTT;然后,小鼠继续保持高脂肪饮食4周。为了分析骨骼模式,新生小鼠被安乐死,剥皮,去内脏,在80%乙醇中固定,在95%乙醇中脱水1天,在丙酮中脱水3天。骨骼在含有0.003%茜素红和0.0045%阿利新蓝的10%乙酸乙醇中染色36小时。染色后,骨骼在1%氢氧化钾中清除,并在几天内转移到20%、50%、80%和100%甘油中。为了进行显微ct分析,将左股骨、左肱骨和腰椎置于70%乙醇中。μCT在8 μm的Scanco μCT40中进行3.决议。样品在55% kVp、145 μA强度、300 ms的70%乙醇中扫描。仪器每周使用Scanco幻影进行校准,所有扫描都通过了常规质量控制验证。采用标准方案进行骨骼分析,股骨小梁的阈值较低,为2485 HU,股骨皮质为4932 HU,椎骨小梁为3078 HU [61].根据这些阈值生成相应的表面效果图。对于所有数据,使用Student 's进行统计显著性评估t测试。
结果、讨论和结论
作为确定MSTN和GDF-11之间是否存在可导致体内不同生物活性的根本固有差异的一种方法,我们分析了在种系中用GDF-11取代MSTN的效果。如图所示。1,Mstn该基因包含三个外显子,成熟的c端结构域编码在外显子3内。我们生成了一个靶向结构,其中我们精确地替换了MSTN c端结构域的编码序列,从糠醛蛋白水解处理位点开始,编码GDF-11 c端结构域。因此,这个敲入等位基因(MstnGdf11)编码由MSTN前肽和GDF-11 c端结构域组成的混合前体蛋白,经过蛋白水解处理后,成熟的GDF-11信号分子将在通常产生MSTN的地方产生。已有研究表明MSTN前肽能够结合并抑制GDF-11 c端二聚体[37],因此我们的预期是来自该杂交蛋白的MSTN前肽能够像成熟的MSTN一样,将成熟的GDF-11 c端二聚体保持在潜伏状态[36].在胚胎干细胞中进行同源重组,将目标细胞注射到囊胚中,并将囊胚转移到假怀孕的雌性,我们获得了转移敲入等位基因的嵌合小鼠(MstnGdf11)通过生殖细胞。在使用种系表达的cre转基因去除新卡带后[58],在分析之前,我们将5代敲入等位基因回交到C57BL/6遗传背景上。
MstnGdf11 / Gdf11小鼠是可存活的,我们在10周大的小鼠上进行了所有分析Mstn+/+,Mstn+ / Gdf11,MstnGdf11 / Gdf11我们从杂交中培育出的老鼠Mstn+ / Gdf11老鼠。我们首先使用针对每种蛋白质高度特异性的液相色谱-串联质谱分析方法测量了这些小鼠血浆中的MSTN和GDF-11蛋白水平[59].如图所示。2,野生型小鼠循环MSTN和GDF-11水平分别在~ 150 ng/ml和~ 4 ng/ml范围内。老鼠携带MstnGdf11等位基因中MSTN和GDF-11的循环水平与MSTN完全被GDF-11取代一致。特别是,MstnGdf11 / Gdf11小鼠没有检测到循环的MSTN,其循环的GDF-11水平与正常的MSTN水平相当,比正常循环的GDF-11水平高约30 - 40倍。Mstn+ / Gdf11小鼠的两种蛋白质都处于中间水平。
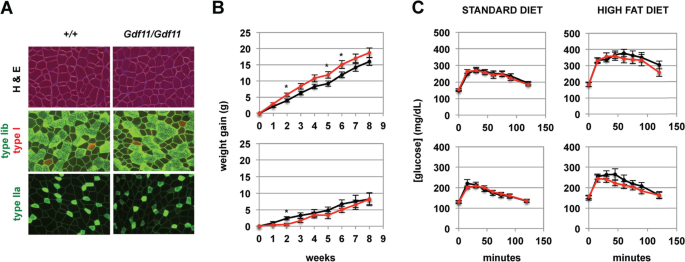
为了确定GDF-11是否可以在功能上替代MSTN,我们首先检查了体成分。在10周龄小鼠中,总体重和瘦体重(通过DXA分析)显示出小的(~ 6-8%)下降,但具有统计学意义MstnGdf11 / Gdf11相比Mstn+/+在雄性小鼠,而不是雌性小鼠(表1)。与这些瘦体重的减少相一致的是MstnGdf11等位基因对男性肌肉质量有剂量依赖效应,个体肌肉为MstnGdf11 / Gdf11小鼠体重大约比对照组轻10%Mstn+/+老鼠和Mstn+ / Gdf11表现出中间效应的小鼠(表2);肌肉重量的差异MstnGdf11 /Gdf11而且Mstn+/+雌性小鼠没有统计学意义。事实上肌肉重量并没有增加MstnGdf11 / Gdf11这表明GDF-11可以在负向调节肌肉质量方面替代MSTN。此外,权重略有下降的事实表明,由该敲入等位基因产生的GDF-11甚至可能比内源性MSTN更活跃。我们还进行了纤维类型的分析,如损耗Mstn已被证明会导致更多糖酵解2B纤维的转变[62].如图所示。3.A和表格3.,我们没有发现纤维类型分布的差异MstnGdf11 /Gdf11而且Mstn+/+老鼠。
一个腓肠肌代表性切片H&E染色(上板)或不同纤维类型的免疫荧光分析(中、下板)。请注意,给定基因型的三幅图像不是从相邻的部分拍摄的。B体重增加对高脂肪饮食有益Mstn+/+(n= 6M, 6F,黑线)和MstnGdf11 / Gdf11(n= 5M, 5F,红线)老鼠。*p< 0.05。C葡萄糖耐量试验Mstn+/+(黑线)和MstnGdf11 / Gdf11(红线)老鼠。小鼠数量为n= 9M, 6F为Mstn+/+,n= 9M, 7F为MstnGdf11 / Gdf11对于标准饮食的小鼠,以及n= 10M, 7F为Mstn+/+而且n= 9M, 7F为MstnGdf11 / Gdf11高脂肪饮食的老鼠。在任何时间点上的差异都没有统计学意义
除了调节肌肉质量外,MSTN还调节脂肪质量方面的身体成分Mstn−−/老鼠(63]以及MSTN受体(ACVR2和ACVR2B)在肌纤维中被靶向的小鼠[24从而降低全身脂肪总量。经DXA分析,两组总脂肪含量无明显差异MstnGdf11 / Gdf11相比Mstn+/+老鼠(表1)。此外,我们发现敲入小鼠的血浆瘦素水平与敲入小鼠相比没有显著差异野生型老鼠。Mstn−−/研究还显示,当小鼠被置于高脂肪饮食中时,其体重增加较少[64],在小鼠中也有发现Acvr2而且Acvr2b都是针对肌纤维的24].如图所示。3.B,男MstnGdf11 / Gdf11实际上,老鼠的体重增加比Mstn+/+虽然瘦素水平在两组之间相似MstnGdf11 / Gdf11而且Mstn+/+即使在高脂肪饮食8周后,小鼠仍然可以食用1);在喂食高脂肪食物的雌性小鼠中,体重增加或瘦素水平没有明显差异。我们还观察到男性血浆胆固醇和高密度脂蛋白水平有微小但显著的增加MstnGdf11 / Gdf11小鼠保持标准饮食相比Mstn+/+小鼠(分别增加19%和18%)以及高脂肪饮食8周后(分别增加24%和15%)(表1)。男性的LDL、甘油三酯或游离脂肪酸水平没有差异MstnGdf11 / Gdf11雌性小鼠或任何一种脂质水平MstnGdf11 / Gdf11老鼠。因此,尽管在雄性突变小鼠的骨骼肌质量和高脂肪体重增加方面都有一些微小的差异,但用GDF-11替换MSTN成熟结构域对整体身体构成的影响很小。
MSTN-GDF-11调节系统也已知对葡萄糖代谢有影响。特别是,Mstn−−/尽管胰岛素水平较低,小鼠仍能维持正常或较低的血糖水平[24,63].此外,已知GDF-11在胰腺发育中发挥重要作用[30.,31],而小鼠服用GDF-11蛋白(而非MSTN蛋白)已被证明可改善葡萄糖耐量[57].如表所示1的空腹血糖水平略高MstnGdf11 / Gdf11女性相比Mstn+/+对照组保持标准饮食,但在标准饮食的雄性小鼠或保持8周高脂肪饮食的雄性或雌性小鼠中,没有发现统计学上的显著差异。此外,MstnGdf11 / Gdf11而且Mstn+/+在葡萄糖耐量试验中,小鼠对葡萄糖挑战表现出类似的反应,无论是保持标准饮食的小鼠还是保持4周高脂肪饮食的小鼠。3.C).因此,GDF-11完全替代MSTN似乎对葡萄糖代谢影响很小。
除了分析GDF-11能否在功能上替代MSTN外,我们还研究了这些小鼠中GDF-11表达的增加是否会影响已知由GDF-11调节的其他生物学过程。特别地,我们检查了中轴骨模式是否受到影响MstnGdf11 / Gdf11老鼠。先前的研究表明,GDF-11的缺失导致轴向骨骼的前定向同型异型转化[28] GDF-11抑制剂的缺失,特别是FST和/或GASP-1/GASP-2,导致后向转化[43,46].25个野生型和30个阿利新蓝染色骨架的分析MstnGdf11 / Gdf11在55只新生小鼠中,7个颈椎,13个胸椎和6个腰椎显示正常模式。此外,在颈椎区,所有小鼠的C6上都存在前结核,在胸椎区,所有小鼠的前7根肋骨都附着在胸骨上,后6根肋骨保持漂浮。因此,轴向骨图型似乎是正常的MstnGdf11 / Gdf11并没有表现出可能由GDF-11过量活动导致的后定向同型异型转化。
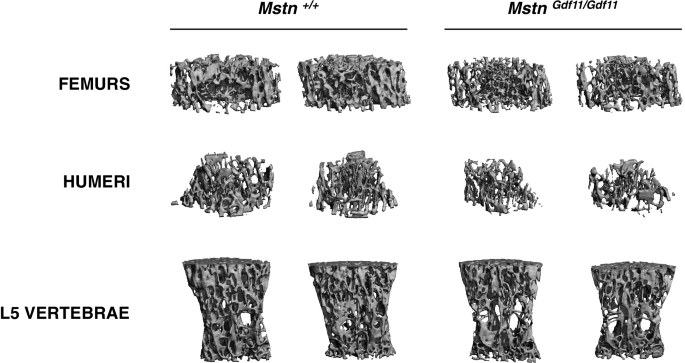
最后,我们检查了骨头MstnGdf11 / Gdf11老鼠。Mstn−−/据报道,小鼠骨密度增加[65],这可能是肌肉增加的次要影响。GDF-11在调节骨稳态中的作用一直存在争议,一项研究报告了成年小鼠外源性给药GDF-11后骨密度下降[66],另一项研究报告称,骨量下降不仅发生在新生儿身上Gdf11在无效小鼠和年轻成年小鼠中,他莫西芬诱导的crec介导的重组被用于靶向aGdf11液氧等位基因(67].无论GDF-11在骨中发挥何种具体作用,以MSTN/GDF-11/激活素A信号通路为靶点,无论是在药理学上使用ACVR2的诱饵形式[68]或ACVR2B [69,70,71,72,73或者通过基因定位Acvr2/Acvr2b[74]或Alk4/Alk5[45]已被证明会导致骨量和骨密度的显著增加。为了评估敲入等位基因对骨骼的可能影响,我们首先用DXA评估骨密度。如表所示1时,我们观察到全身骨密度有轻微(~ 5%)但显著下降MstnGdf11 / Gdf11与雄性小鼠相比Mstn+/+控制老鼠。在身体的多个区域,包括上肢和下肢长骨以及腰椎,都存在类似的差异,但在雌性小鼠中没有发现差异。为了更详细地分析骨结构,我们对肱骨、股骨和腰椎进行了显微ct分析。如表所示4和无花果。4时,骨表面、BV/TV、连通性密度、小梁数、小梁厚度、骨密度等众多显微ct参数均显著降低MstnGdf11 / Gdf11相比Mstn+/+雄性老鼠;例如,股骨的BV/TV和骨密度分别降低了43%和48%,肱骨分别降低了26%和34%,L5椎分别降低了19%和22%。与DXA数据一致,女性显微ct参数的唯一显著差异是L5椎体BV/TV和骨密度的小幅下降(分别减少8%和9%)。
从这里给出的结果来看,两个普遍结论似乎很明显。首先,成熟的GDF-11似乎能够在控制肌肉质量方面完全取代成熟的MSTN;事实上,根据肌肉量的轻微减少可以看到MstnGdf11 / Gdf11在雄性小鼠中,由敲入等位基因制成的成熟GDF-11实际上似乎比成熟的MSTN在控制肌肉质量方面更活跃。在雄性小鼠中,与野生型等位基因表达导致的循环MSTN水平相比,我们确实观察到由敲入等位基因表达导致的循环GDF-11水平更高的趋势,但这些差异在统计学上不显著。在携带敲入等位基因的小鼠中,这种增强的活性可能反映了成熟MSTN与成熟GDF-11生物学特性的内在差异,或者潜在MSTN复合体与成熟GDF-11结合到MSTN前肽的混合潜在复合体的激活水平的差异。其次,成熟的GDF-11完全取代成熟的MSTN并不会导致GDF-11过表达所预期的一些发育或生理变化。发育,MstnGdf11 / Gdf11小鼠表现出完全正常的轴向骨骼模式。考虑到这一点,这可能并不令人惊讶Gdf11而且Mstn在胚胎发生过程中有不同的表达模式,与Gdf11在妊娠中期胚胎尾芽和原始条纹区表达[28),Mstn在发育体细胞的肌隔室中表达[1].尽管有这些不同的表达模式,然而,已知这两个基因在轴向模式方面有部分功能冗余Gdf11/Mstn双突变体表现出更广泛的前定向同型异型转化Gdf11单个突变体[35].因此,正常的骨骼形态在MstnGdf11 / Gdf11结果表明,成熟的GDF-11和成熟的MSTN在轴向模式调控方面具有相似的生物活性。生理上,MstnGdf11 / Gdf11小鼠的循环GDF-11水平增加了30 - 40倍,但葡萄糖代谢似乎相对正常。根据报道,纯化的GDF-11可改善糖耐量,而MSTN不能改善[57,人们可能会这样想MstnGdf11 / Gdf11与野生型小鼠相比,小鼠对葡萄糖挑战的反应有所改善,但我们没有观察到显著差异MstnGdf11 / Gdf11野生型小鼠在标准或高脂肪饮食的糖耐量测试中。在高脂肪饮食的小鼠的糖耐量测试中,我们确实观察到了葡萄糖值降低的趋势,但这些差异在统计上并不显著,事实上,MstnGdf11 / Gdf11实际上,雌性小鼠的空腹血糖水平略有升高,具有统计学意义。
用GDF-11替换MSTN后,一个组织受到了实质性的影响,即骨组织MstnGdf11 / Gdf11BV/TV、小梁数量、小梁厚度和骨密度显著降低的小鼠,至少在雄性中是如此。尽管关于GDF-11在骨调节中的作用有相互矛盾的报道,但GDF-11的表型MstnGdf11 / Gdf11在小鼠中,使用激活素2型受体的诱饵形式在药理学上阻断这一途径所观察到的效果是一致的[68,69,70,71,72,73或者基因定位Acvr2/Acvr2b[74]或Alk4/Alk5[45在成骨细胞中。骨量的减少MstnGdf11 / Gdf11这与由杂交前体蛋白合成的GDF-11比内源性MSTN更活跃的可能性是一致的,正如在敲入小鼠中看到的肌肉质量轻微下降所表明的那样。或者,骨表型可能是由GDF-11水平本身增加引起的,这可能反映了GDF-11和MSTN在调节骨骼能力方面的内在差异。
在解释这些研究结果时,重要的是要记住不仅GDF-11是在控制下表达的Mstn而且GDF-11蛋白是由含有MSTN前肽的混合前体蛋白制成的。虽然MSTN前肽和GDF-11前肽都能结合成熟的GDF-11,并被BMP-1/tolloid蛋白酶裂解以激活潜伏期[37,38,40],这些前肽可能具有不同的特性,在MSTN与GDF-11执行的生物功能方面赋予了一定程度的特异性。因此,需要进行额外的实验,例如用GDF-11前肽替换MSTN的种系前肽,或者用MSTN的相应部分反向替换GDF-11前肽和/或成熟结构域,以充分了解这些分子的各种结构域在功能上的等效程度。
在目前围绕GDF-11在体内生物活性的不确定性的背景下,我们的发现具有重要意义。一系列论文表明,GDF-11可能在组织衰老中发挥关键作用。据报道,小鼠体内循环的GDF-11水平随着衰老而下降[75],而向老年小鼠注射纯化的GDF-11蛋白被证明可以逆转年龄相关的心脏肥厚[75],刺激老年小鼠神经系统血管重塑,促进神经发生[76],并改善衰老小鼠的卫星细胞功能及肌肉再生和功能[77].这些研究表明,将GDF-11水平恢复到年轻水平可能是一种新的治疗策略,可以在广泛的组织中预防或逆转与年龄相关的组织功能障碍。其他一些研究没有发现GDF-11水平在衰老过程中下降。随后的研究表明,用于测量循环中GDF-11水平的测定方法可能已经检测到了循环中的MSTN,并且GDF-11水平在衰老过程中要么没有变化,要么甚至可能增加[59,78,79].关于GDF-11促进肌肉再生的报道也不确定;考虑到MSTN信号的丢失或抑制已被证明在急性肌肉损伤和慢性肌肉退行性变的情况下可以改善肌肉再生,这一发现是出乎意料的(综述,参见参考文献[80,81,82])。事实上,随后的研究报告称,给小鼠注射纯化的GDF-11会损害肌肉再生的能力[78,83],这更符合MSTN和GDF-11在体外生物学特性上几乎无法区分的事实。虽然实验程序和剂量方案的差异可能导致研究结果的差异,外源性给药GDF-11可能与内源性产生的MSTN表现不同,但我们的发现与GDF-11能够在体内功能取代MSTN一致。
数据和材料的可用性
在这项研究中产生或分析的所有数据都包含在这篇发表的文章中。
缩写
- MSTN:
-
肌肉生长抑制素
- TGF -ß:
-
转化生长因子-ß
- ES:
-
胚胎干细胞
- 测定仪:
-
双能x射线吸收率仪
- GTT:
-
葡萄糖耐量试验
- 胡:
-
Hounsfield单位
参考文献
麦费龙,罗磊,李世杰。一种新的tgf - β超家族成员对小鼠骨骼肌质量的调节。大自然。1997;387:83。
李世杰,李世杰。由于肌肉生成抑制素基因的突变,牛的肌肉加倍。美国国家科学研究院。1997; 94:12457。
陈志伟,陈志伟,陈志伟,等。牛肌肉生成抑制素基因的缺失导致了牛的双肌肉表型。纳特·热内,1997;17:71。
Kambadur R, Sharma M, Smith TP, Bass JJ。双肌肉比利时蓝牛和皮埃蒙特牛的肌肉生长抑制素(GDF8)突变。基因组决议1997;7:10 10。
许尔克M,瓦格纳KR, Stolz LE, Hübner C, Riebel T, Kömen W,等。与儿童肌肉肥大相关的肌肉生长抑制素突变。中华医学杂志,2004;35:482。
Clop A, Marcq F, Takeda H, Pirottin D, Tordoir X, Bibé B,等。在肌肉生长抑制素基因中产生潜在非法microRNA靶点的突变影响绵羊的肌肉。Nat Genet, 2006;38:813。
Mosher DS, Quignon P, Bustamante CD, Sutter NB, Mellersh CS, Parker HG,等。肌肉生长抑制素基因的突变可以增加肌肉质量,提高杂合子狗的比赛成绩。PLoS Genet, 2007;3:e79。
刘志刚,刘志刚,张志刚,张志刚,等。MSTN序列多态性预测纯种马的冲刺能力和比赛耐力。科学通报。2010;5:e8645。
Dall’olio S, Fontanesi L, Nanni Costa L, Tassinari M, Minieri L, Falaschini A.不同形态类型马肌肉生长抑制素基因分析及单核苷酸多态性鉴定。中国生物医学工程学报。2010;
王晓明,王晓明,王晓明,王晓明,等。一项全基因组snp关联研究证实了马肌肉生长抑制素(MSTN)基因的序列变异(g.66493737C>T)是纯种马最佳比赛距离的最有力预测因子。BMC基因组学。2010;11:552。
Tozaki T, Sato F, Hill EW, Miyake T, Endo Y, Kakoi H,等。肌肉生长抑制素基因位点的序列变异影响纯种马的身体成分。中华兽医医学杂志2011;73:1617。
吕强,袁磊,邓杰,陈明,王勇,曾杰,等。利用CRISPR/Cas9高效生成肌肉生长抑制素基因突变兔。科学通报2016;6:25029。
顾华,曹勇,邱波,周震,邓锐,陈震,等。Mstn基因敲除大鼠的建立及表型分析。生物化学生物物理研究,2016;477:115。
王凯,唐旭,谢震,邹霞,李明,袁宏,等。CRISPR/ cas9介导的中国二花莲猪肌肉生长抑制素基因敲除转基因res 2017;26:799。
Rooney MF, Hill EW, Kelly VP, Porter RK。肌肉生长抑制素的“速度基因”效应出现在纯种马由于启动子近端插入sin。PLoS One. 2018;13:e0205664。
何忠,张涛,姜林,周明,吴东,梅娟,等。利用CRISPR/Cas9技术通过受精卵微注射有效地靶向山羊肌肉生长抑制素,从而在山羊中产生双肌肉表型。生物科学通报2018;38:BSR20180742。
阿科斯塔J,卡皮奥Y,博罗托I, González O,埃斯特拉达议员。经RNAi沉默的肌肉生长抑制素基因显示斑马鱼巨型表型。中国生物工程学报,2005;19(3):324。
李春春,胡淑云,龚海海,陈明明,陆建科,吴建林。基于载体的RNA干扰抑制肌肉生长抑制素,在转基因斑马鱼中引起双肌肉效应。生物化学与生物物理学报。2009;37:766。
哈利勒·K,埃拉亚特·M,哈利法·E,达格哈什·S,埃拉斯瓦德·A,米勒·M,等。通过CRISPR/Cas9系统合子注射生成肌肉生长抑制素基因编辑的通道鲶鱼(Ictalurus punctatus)。科学代表2017;7:7301。
李娟,金德华,李强。MSTN前肽单氨基酸缺失对日本鹌鹑肌肉增生的影响。国际分子生物学杂志,2020;21:1504。
金东东,李俊华,宋松,金文文,韩建生,申世平,等。D10A-Cas9切割酶介导的肌生长抑制素敲除鸡的生成。Faseb j . 2020;34:5688。
Zimmers TA, Davies MV, Koniaris LG, Haynes P, Esquela AF, Tomkinson KN,等。全身给药肌肉生长抑制素诱导小鼠恶病质的研究。科学。2002;296:1486。
Lee SJ, Huynh TV, Lee YS, Sebald SM, Wilcox-Adelman SA, Iwamori N,等。卫星细胞与肌纤维在肌肉肥大诱导抑制肌肉生长抑制素/激活素信号通路的作用。美国国家科学研究院。2012; 109: E2353。
李世杰,李哈尔,刘勇,李昌,范庆明,米肖,等。I型和II型受体在肌肉生长抑制素和激活素调节骨骼肌生长中的功能冗余。2020; 117:30907。
李SJ。针对肌肉生成抑制素信号通路治疗肌肉损失和代谢功能障碍。中国临床医学杂志。2021;31:e148372。
Gamer LW, Wolfman NM, Celeste AJ, Hattersley G, Hewick R, Rosen V.在发育的小鼠肢体、脊髓和尾芽中表达的一种新型BMP是爪蟾胚胎中有效的中胚层诱导物。Dev Biol, 1999;208:222。
Nakashima M, Toyono T, Akamine A, Joyner A. BMP/TGFbeta超家族新成员生长/分化因子11在小鼠胚胎发生过程中的表达。《Mech Dev》1999;80:185。
麦费龙,罗磊,李世杰。生长/分化因子对中轴骨架前/后模式的调节Nat Genet 1999;22:26 6。
Esquela AF, Lee SJ。生长/分化因子调节后肾发育发展生物学,2003;257:356。
Harmon EB, Apelqvist AA, Smart NG, Gu X, Osborne DH, Kim SK. GDF11在胰腺发育中调节NGN3+胰岛祖细胞数量并促进β细胞分化。发展。2004;131:6163。
张志刚,张志刚,张志刚,等。gdf11缺陷小鼠胰腺内分泌发育的研究进展。Dev Dyn. 2006;235:3016。
吴洪辉,Ivkovic S, Murray RC, Jaramillo S, Lyons KM, Johnson JE,等。GDF11神经发生的自我调节。神经元。2003;37:197。
金俊杰,吴洪辉,陆德华,李丽娟,马祖克,等。GDF11在视网膜发育过程中控制祖细胞能力的时间。科学。2005;308:1927。
刘JP。生长/分化因子11 (Gdf11)在发育中的脊髓前突模式中的功能。发展。2006;133:2865。
McPherron AC, Huynh TV, Lee SJ。肌肉生长抑制素和生长/分化因子11功能的冗余。BMC发展生物学。2009;9:24。
李世杰,李建平。肌肉生长抑制素活性与肌肉生长的关系。美国国家科学研究院。2001; 98:9306。
Thies RS, Chen T, Davies MV, Tomkinson KN, Pearson AA, Shakey QA,等。GDF-8前肽与GDF-8结合,通过抑制GDF-8受体结合拮抗生物活性。《生长因子》,2001;18:251。
Wolfman NM, McPherron AC, Pappano WN, Davies MV, Song K, Tomkinson KN,等。金属蛋白酶的BMP-1/tolloid家族激活潜在的肌肉生长抑制素。美国国家科学研究院。2003; 100:15842。
李SJ。蛋白水解在潜在肌生成抑制素激活中的作用的遗传分析。科学通报。2008;3:e1628。
葛庚,霍普金斯博士,何文斌,格林斯潘DS。GDF11形成骨形态发生蛋白1激活的潜在复合物,可调节神经生长因子诱导的PC12细胞分化。中国生物医学工程学报,2005;
Hill JJ, Davies MV, Pearson AA, Wang JH, Hewick RM, Wolfman NM,等。肌肉生成抑制素前肽和卵泡抑素相关基因是正常血清中肌肉生成抑制素的抑制结合蛋白。生物化学杂志,2002;277:40735。
Hill JJ, Qiu Y, Hewick RM, Wolfman NM。生长与分化因子相关血清蛋白-1对体内肌肉生长抑制素的调控:一种具有蛋白酶抑制剂和卵泡抑素结构域的新蛋白。Mol Endocrinol. 2003;17:1144。
李志刚,李志刚,李志刚。卵泡抑素缺乏对小鼠围产期死亡的影响。大自然。1995;374:360。
李世杰,李ys, Zimmers TA, Soleimani A, Matzuk MM, Tsuchida K,等。卵泡抑素和激活素对肌肉质量的调节。分子内分泌。2010;24:8 8。
刘勇,李海霞,李永明,杨志强,等。转化生长因子-β信号通路组分对骨骼和骨骼肌质量的局部和全身控制。美国国家科学研究院。2021; 118: e2111401118。
李ys,李世杰。GDF-11和肌生成抑制素活性由GDF-11 -1和GASP-2调节。美国国家科学研究院。2013; 110: E3713。
Rebbapragada A, Benchabane H, Wrana JL, Celeste AJ, Attisano L.肌肉生长抑制素通过转化生长因子β样信号通路阻断脂肪形成。《细胞生物学》2003;23:7230。
李SJ, Reed LA, Davies MV, Girgenrath S, Goad ME, Tomkinson KN,等。通过激活素II型受体的多种配体信号通路调节肌肉生长。美国国家科学研究院。2005; 102:18117。
IIB型激活素受体介导的信号通路控制小鼠轴向模式和横向不对称。基因发展1997;11:1812。
吴sp, Yeo CY, Lee Y, Schrewe H, Whitman M, Li E.激活素IIA型和IIB受体介导椎体轴向模式中Gdf11信号通路。基因开发2002;16:2749。
Andersson O, Reissmann E, Ibáñez CF.生长分化因子11通过转化生长因子- β受体ALK5信号划分前后轴。EMBO代表2006;7:831。
陈志伟,刘志伟,陈志伟,等。激活素受体IIb型胞外结构域配体结合功能的表征。生物化学学报。2010;285:21037。
葛培尔,李志强,李志强,等。激活素类三元受体复合物的结构特征揭示了受体特异性的第三种范式。美国国家科学研究院。2019; 116:15505。
李ys,黄氏电视,李世杰。肌肉生长抑制素作用的旁分泌和内分泌模式。应用物理学报(1985)。2016; 120:592。
齐默斯·塔,蒋勇,王敏,梁文涛,鲁普·杰,欧埃德,等。外源性GDF11可引起心脏和骨骼肌功能障碍和消瘦。《心血管基础研究》2017;112:48。
Jones JE, Cadena SM,龚超,王旭,陈震,王世祥,等。上生理给药GDF11部分是通过上调GDF15来诱导恶病质的。Cell rep 2018;22:3375。
王志强,王志强,王志强,等。外源性GDF11,而非GDF8,可降低小鼠体重并改善葡萄糖稳态。科学通报2020;10:4561。
李志强,李志强,李志强,等。合子阶段小鼠基因组序列的有效体内操作。美国国家科学研究院。1996; 93:5860。
彭玲,Gagliano-Jucá T, Pencina KM, Krishnan S, Li Z, Tracy RP,等。使用液相色谱串联质谱法测定健康男性生长与分化因子-11和肌肉生长抑制素水平的年龄趋势:对睾酮的不同反应。中华老年医学杂志。2021:glab146。https://doi.org/10.1093/gerona/glab146.
Schiaffino S, Gorza L, Sartore S, Saggin L, Ausoni S, Vianello M,等。2型骨骼肌纤维中的三种肌球蛋白重链异构体。中华肌肉科学杂志,1989;10:197。
鲍克盛ML,博伊德SK, Christiansen BA, Guldberg RE, Jepsen KJ, Müller R.利用微计算机断层扫描评估啮齿动物骨微观结构的指南。J Bone Miner Res. 2010;25:1468。
Girgenrath S, Song K, Whittemore LA。肌生成抑制素表达的缺失改变纤维型分布和肌凝蛋白重链异构体在慢速型和快速型骨骼肌中的表达。肌肉神经。2005;31:34。
李世杰,李世杰。肌肉生长抑制素缺乏小鼠体内脂肪积累的抑制。《投资管理》,2002;
Hamrick MW, Pennington C, Webb CN, Isales CM。喂食高脂肪饮食的“双肌肉”小鼠对体脂增加的抵抗力。Int J Obes(伦敦)。2006; 30:868。
Hamrick MW, McPherron AC, Lovejoy CO.成年肌生长抑制素缺乏小鼠肱骨骨矿物质含量和密度。钙化组织杂志2002;71:63。
刘伟,周磊,周超,张松,景杰,谢磊,等。GDF11通过刺激破骨细胞发生和抑制成骨细胞分化来降低骨量。Nat Commun. 2016;7:12794。
徐俊,金宁,李硕,严志华,李勇,朴继杰,等。与MSTN相反,GDF11促进成骨,MSTN/GDF11抑制剂follistatin增加肌肉质量,但削弱骨骼。美国国家科学研究院。2020; 117:4910。
杨晓东,张晓东,张晓东,等。可溶性激活素型IIA受体诱导骨形成和改善骨骼完整性。美国国家科学研究院。2008; 105:7082。
赵春春,Peekhaus N, Weber H, Adamski S, Murray EM, Zhang HZ,等。actriib - fc处理的成熟啮齿动物肌肉力量产生和骨密度增加。中华老年医学杂志,2013;68:1181。
李晓霞,张建平,张建平,等。肌肉生成抑制素和激活素诱骗受体增强小鼠骨形成。骨头。2014;60:162。
DiGirolamo DJ, Singhal V, Chang X, Lee SJ, Germain-Lee EL。可溶性激活素受体2B在成骨不全小鼠模型中增加骨和肌肉质量。骨决议2015;3:14042。
郭伟,penina KM, O'Connell K, Montano M, Peng L, Westmoreland S,等。激活素受体IIB配体陷阱保护雄性幼年恒河猴免受猴免疫缺陷病毒相关的骨质流失。骨头。2017;97:209。
李世杰,李海燕,朱梅,李文杰,等。针对肌肉生长抑制素/激活素A可以防止在太空飞行中骨骼肌和骨质流失。美国国家科学研究院。2020; 117:23942。
Goh BC, Singhal V, Herrera AJ, Tomlinson RE, Kim S, Faugere MC,等。激活素受体2A (ACVR2A)直接作用于成骨细胞,作为骨质量的负调节因子。中国生物化学杂志,2017;
罗瑞德,陈志强,陈志强,等。生长分化因子11是一种循环因子,可逆转与年龄相关的心脏肥厚。细胞。2013;153:828。
Katsimpardi L, Litterman NK, Schein PA, Miller CM, Loffredo FS, Wojtkiewicz GR,等。年轻系统因子对衰老小鼠大脑的血管和神经再生。科学。2014;344:630。
张玉春,吴杰,孔丹,吴恩义,马诺哈尔,等。恢复全身GDF11水平逆转小鼠骨骼肌年龄相关功能障碍。科学。2014;344:649。
german MA, Cadena SM, Gilbert JA, Meyer A, Nelson HN, Swalley SE,等。GDF11随着年龄增长而增加,并抑制骨骼肌再生。Cell Metab, 2015;22:164。
Schafer MJ, Atkinson EJ, Vanderboom PM, Kotajarvi B, White TA, Moore MM,等。GDF11和肌肉生长抑制素在人类衰老和心血管疾病中的定量研究Cell Metab. 2016;23:12 7。
Hoogaars WMH, Jaspers RT.针对肌肉生长抑制素和相关信号通路对抗肌肉萎缩的过去、现在和未来展望。Adv Exp医学生物学。2018;1088:153。
德国MA,玻璃DJ。GDF11在衰老和骨骼肌、心脏和骨骼稳态中的作用。Crit Rev生物化学Mol生物学。2019;54:174。
罗杰斯BD,沃德CW。肌肉中肌生成抑制素/激活素受体配体及减活性药物的发展现状。Endocr Rev. 2021:bnab030。
欣肯AC,鲍尔斯JM,罗G,霍尔特JA,比林AN,拉塞尔AJ。缺乏证据表明GDF11是衰老骨骼肌卫星细胞的返老还不老剂。《衰老细胞》2016;15:582。
确认
我们感谢安·劳勒和查尔斯·霍金斯在约翰·霍普金斯转基因核心实验室进行的ES细胞转染和囊胚注射,以及杰克逊实验室临床化学服务对血浆瘦素、胰岛素和血脂水平的测量。
资金
本出版物中报道的研究得到了NIH拨款R01AR060636(给S-J.L.), R01AG052962(给S-J.L.), R56AG052972(给SB)以及Neil Esposito和Donna Hughes 1型糖尿病基金(给E.L.G-L.)和Bessette家族1型糖尿病基金(给E.L.G-L.)的慷慨捐赠。在约翰霍普金斯大学时,s。得到了布朗咨询公司合伙人迈克尔·汉金和安·汉金以及詹姆斯·希金斯和朱丽叶·希金斯的慷慨捐赠。
作者信息
作者及隶属关系
贡献
主持实验:S-JL、AL、RR、YL。管理项目:S-JL、DWY、SB、ELG-L。撰写论文:S-JL, SB, ELG-L。所有作者都阅读并批准了最终的手稿。
相应的作者
道德声明
伦理批准并同意参与
不适用。
发表同意书
不适用。
相互竞争的利益
作者宣称他们之间没有利益冲突。
额外的信息
出版商的注意
伟德体育在线施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条所提供的资料,除非在资料的信用额度中另有说明。
关于本文
引用本文
李,SJ。,Lehar, A., Rydzik, R.et al。GDF-11在小鼠生殖系中肌肉生长抑制素的功能性替代。骨骼肌12, 7(2022)。https://doi.org/10.1186/s13395-022-00290-z
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s13395-022-00290-z
关键字
- 肌肉生长抑制素
- GDF-11
- 基因敲入
- 身体成分
- 肌肉
- 脂肪
- 骨
- 新陈代谢