摘要
背景
阻塞性睡眠呼吸暂停(OSA)通过慢性间歇性缺氧(CIH)增加血管和代谢风险,并损害骨骼肌功能。由于针对肢体肌肉的研究很少,运动能力较低的原因尚不清楚。我们假设cih相关的神经肌肉连接(NMJ)和线粒体完整性的形态学改变可能是骨骼肌功能障碍的原因。
方法
小鼠在6周的CIH(交替7%和21% O2与常氧(NOX)相比,每30秒,8小时/天,5天/周)。分析包括神经肌肉连接(NMJ)突触后形态和完整性、纤维横截面积(CSA)和组成(atp酶)、线粒体超微结构(透射电镜)和相关转录物(RT-qPCR)。除了野生型(WT),我们还包括了诱导型一氧化氮合酶敲除小鼠(iNOS)−−/),以评估iNOS是具有保护作用还是具有风险中介作用。
结果
在WT比目鱼肌中,CIH与NOX使NMJ尺寸减小(−37.0%,p< 0.001)和长度(−25.0%,p< 0.05)和IIa型纤维CSA (- 14%,p< 0.05)和增加中心核纤维分数(p< 0.001)。此外,CIH与NOX相比增加了受损线粒体的比例(1.8倍,p< 0.001)。与WT相比,iNOS−−/与NOX相似,NMJ面积和长度减少(- 55%,p< 0.001和−33%,p分别< 0.05)或伴有CIH(−37%,p< 0.05和- 29%,p< 0.05),但无纤维萎缩。此外,受损部分增加(2.1倍,p< 0.001)或肿胀(> 6倍,p< 0.001)用iNOS观察线粒体−−/与NOX和CIH下WT的比较。都是CIH-和iNOS−−/细胞因子抑制信号-3 (SOCS3) >大幅上调10倍,而IL6 mRNA表达没有变化。此外,炎症标志物如CD68(巨噬细胞)和IL1β在CIH中明显低于NOX。CIH-或iNOS均无上述形态学改变−−/在腓肠肌中检测到。值得注意的是,在WT肌肉中检测不到iNOS的表达,而不像肝脏,在CIH中iNOS的表达大幅下降。
结论
CIH可选择性地导致WT慢肌纤维萎缩/中心核化相关的NMJ和线粒体损伤。这一效应在很大程度上被iNOS模拟−−/在NOX(萎缩除外)。这两种情况都涉及大量SOCS3上调,可能是通过去神经而没有Il6上调,但伴有巨噬细胞密度下降,特别是在去神经终板附近。在WT缺乏肌肉iNOS表达的情况下,这种损伤可能源于肌肉外,例如,运动神经元iNOS缺陷(通过CIH或敲除)等待功能评估。
简介
阻塞性睡眠呼吸暂停(OSA)是指在睡眠过程中上呼吸道的重复塌陷,会引起反复发作的低通气甚至呼吸暂停,从而导致慢性间歇性缺氧(CIH)。在过去的二十年里,睡眠呼吸暂停的患病率以两位数的数字增长[1,2,3.,4,5].在一项以人群为基础的40- 85岁成年人研究中,49.7%的男性和23.4%的女性患有中度至重度OSA,定义为呼吸暂停低通气指数(AHI)≥15 [6].由于肥胖率的增长被怀疑是最强烈的因果诱因之一,预计与睡眠相关的疾病将进一步增加[1].
在各种合并症中,阻塞性睡眠呼吸暂停综合症患者经常出现肌肉疲劳和体能下降[7]导致日常活动受限,生活质量下降。事实上,最近的荟萃分析显示,在循环测功仪测试条件下,(严重)osaas患者的最大摄氧量(有氧能力)显著降低[8,9],并可通过持续气道正压(CPAP)治疗得到改善[10].O2AHI与有氧能力成反比关系的转运或肌肉功能尚不清楚,但可能不包括组织形态学的肌肉微血管化,至少在胫骨前肌中发现微血管化增加[11].令人惊讶的是,阻塞性睡眠呼吸暂停患者的运动肌肉组织形态学数据很少,但对横纹肌上气道肌肉的几项研究表明了各种重要的改变,如纤维类型分组[12,13],纤维截面积减少[14],肌纤维萎缩[12],位于中心的核[13],或线粒体分布异常[15].因此,运动肌肉功能损害的机制仍有待评估。值得注意的是,足够的肌肉功能不仅依赖于肌肉纤维本身的完整性,还依赖于完整的神经肌肉信号通过有髓运动神经元、神经肌肉连接处(NMJ)和突触后肌膜传递[16].NMJ的完整性和可塑性被认为是肌肉功能的关键:虽然一些研究已经证明了突触前和突触后区域的增加与增强的神经肌肉活动以及增强的抗疲劳能力之间的关系[17,18,19,20.],年龄相关的NMJ改变,如NMJ区域破碎或降低,被认为是肌肉减少症的原因[21,22].此外,对缺乏抗氧化酶(SOD)的小鼠的研究−−/)或过度表达解偶联蛋白(UCP1)支持了这一假设,即氧化应激可能引发与线粒体功能障碍相关的NMJ退化[23,24].与OSA最为相关的是,活性氧/氮(ROS/RNS)的大量产生以及相关的过度氧化和亚硝化应激被归因于重复的夜间缺氧-再氧循环,类似于重复的缺血和再灌注损伤[25,26].事实上,有证据表明阻塞性睡眠呼吸暂停(OSA)患者体内超氧化物的产生增加,而在CPAP治疗下,超氧化物的产生已恢复正常[27],以及降低抗氧化能力[28,29].此外,对OSA患者和CIH动物模型的研究发现,通过涉及NF-κB激活的炎症触发因子,诱导型一氧化氮合酶(iNOS)过度表达,特别是在神经元或心血管组织中,如激活的巨噬细胞[30.,31,32].iNOS可能成为大量一氧化氮(NO)的来源,仅受缺乏底物或辅酶的限制,后者作为一种高活性自由基形成过氧亚硝酸盐和其他影响线粒体呼吸、细胞膜完整性或胰岛素信号的RNS [33].在肥胖/糖尿病成人(2型纤维)骨骼肌中观察到iNOS的表达,但很少在健康的年轻受试者中观察到,除非运动,而啮齿动物肌肉中iNOS的表达主要在大鼠中检测和研究[34].
本研究以CIH与常氧对照(NOX)相比作为野生型(WT)小鼠OSA模型,研究OSA对骨骼肌NMJ完整性、纤维大小和组成的组织形态学指标以及超微结构线粒体完整性的过渡电子显微镜(TEM)参数的长期影响。此外,除WT外,我们还包括了iNOS-deficient (iNOS−−/)小鼠进行分析,以评估iNOS在CIH暴露引起的促氧化应激或促炎症应激中假定的风险中介作用。据我们所知,这是cih诱导的WT小鼠运动肌肉中NMJ、纤维组织形态或线粒体超微结构的肌肉特异性损伤的第一篇报道,该损伤意外地不受iNOS缺乏的抑制,但NOX已经惊人地模仿。
材料与方法
CIH小鼠OSA模型
如Schulz et al.所述,OSA小鼠模型基于长期暴露于CIH (Schulz et al. 2014)。雄性C57BL/ 6j小鼠(WT, Charles River Deutschland GmbH, Sulzfeld, Germany)和iNOS缺陷小鼠(iNOS−−/;应变B6.129P2-Nos2tm1Lau/J) 8-10周大鼠在pc控制的常压气室中进行6周的CIH实验(8h/day 5 days/week)2浓度在7 - 21%之间,周期为120秒,对应AHI为30h−1即介于中度到重度睡眠呼吸暂停之间。年龄匹配WT和iNOS的NOX控制条件−−/小鼠用相同的室内空气冲洗系统(21% O2).CIH和对照组干预仅限于白天,因为小鼠在夜间活动。给所有动物提供标准饮食和自由饮水。所有小鼠在干预前和安乐死前立即称重。
CIH/对照干预6周后,小鼠安乐死,肱三头肌(腓肠肌、比目鱼肌和跖肌)以及股外侧肌小心移除,立即休克冷冻在液氮冷却异戊烷中,- 80°C保存。获得7 μm (microtom Hyrax C60, Carl Zeiss AG, Oberkochen, - 20°C)的横向冷冻切片用于(免疫)组织化学。用卡尺仔细测定胫骨长度。
肌纤维组成、大小和中心核化
肌纤维类型(1,2a, 2x)通过酸敏感肌原纤维atp酶(腺苷三磷酸酶,Sigma-Aldrich Co. LLC,圣路易斯,密苏里州)在pH值4.55下染色(friedman - bette et al. 2010),在蔡司Axio成像仪以200倍放大倍数随机分布的两到三张图像中进行识别。M2显微镜(卡尔蔡司公司;由Axio-Cam HRc/AxioVision (Carl Zeiss GmbH)成像系统数字化后(Oberkochen,德国)。类型特定纤维横截面积(CSA)通过使用标准成像软件ImageJ (Scion Image,美国国立卫生研究院,Bethesda, USA)手动环绕至少100根纤维的每个横截面来确定。此外,横向冷冻切片用苏木精和伊红染色,以确定中心核化纤维的百分比。因此,每一个完全成像的纤维都是人工计数的。在第二步中,识别具有集中核的纤维。平均每块肌肉有164 +/−24根纤维被分析。
突触后NMJ形态和完整性
用4% PFA/PBS(多聚甲醛/磷酸盐缓冲盐水pH 7.4)固定10分钟,用3% H阻断内源性过氧化物酶后,NMJ分析基于冰冻切片α-白兔毒素(BTX)染色2O2.之后,pbs清洗的切片与生物素化的BTX (1:500;Invitrogen Eugene, USA)置于湿室,PBS洗涤,用2%牛血清白蛋白(BSA)/PBS阻塞,再次PBS洗涤,并与辣根过氧化物酶(HRP)结合链霉霉素孵育(Jackson免疫研究实验室)。公司,西格罗夫,美国)。以3,3 ' -二氨基联苯胺(DAB)为显色底物。用Mayer’s苏木精(Carl Roth GmbH,德国)对细胞核进行反染色。
从蔡司Axio成像仪获得的数字图像(200倍放大)中,每块肌肉连续三个完整的横截面识别出NMJ。M2显微镜(卡尔蔡司公司;Oberkochen,德国)结合Axio-Cam HRc/AxioVision (Carl Zeiss GmbH)。使用ImageJ软件(Scion Image, National Institutes of Health)手动确定NMJ的长度和面积,以及相应的肌纤维CSA和周长。当btx染色区被分割成几部分时,单个NMJ被认为是“碎片化”的。进一步的计算包括每个肌纤维CSA的NMJ面积,每个肌纤维周长的NMJ长度,以及NMJ碎片化的百分比(McLoon et al. 2016)。平均每比目鱼或腓肠肌分析21±2(16±3)个NMJ。
免疫组织化学
对于IL1β和CD68免疫组化,低温切片(7 μm)用4% PFA/PBS固定(10 min,室温)。用1%正常猪血清(Dako Deutschland GmbH, Hamburg, Germany)在PBS中阻断非特异性位点。通过培养多克隆抗IL1ß (1:100: Abcam;Cambridge, UK)或单克隆抗cd68一抗(1:50;AbD Serotec, Kidlington, UK)与山羊多克隆hrp偶联抗兔(1:200;LINARIS GmbH, Dossenheim, Germany)或抗鼠药(1:100;AbD Serotec, Kidlington, UK)抗体;3% H抑制内源性过氧化物酶活性2O2在PBS;然后,切片用DAB溶液(Roche Diagnostics)孵育。用Mayer’s苏木精对细胞核进行反染色(Carl Roth GmbH & Co. KG, Karlsruhe, Germany)。
突触前和突触后NMJ共染色
采用NMJ突触前、突触后双染色,比目鱼横切面(WT:n= 8 nox,n= 8 cih;伊诺−−/:n= 8 nox,n= 8 CIH)和股肌(WT:n= 4nox,n= 6 cih;伊诺−−/:n= 6 nox,n= 6 CIH)用生物素- xx偶联BTX (Invitrogen Eugene, USA)和RvAChT(泡状乙酰胆碱转运体)抗体(Lee Eiden, 80259 Laborchargen-Nr)进行免疫荧光染色。: bl. 6/97)。具体来说,切片在4% PFA/PBS中固定10分钟,1% BSA/PBS堵塞30分钟后,用生物素化BTX(1:500)或vAChT 80259(1:100)在4℃的湿度室中孵育过夜。第二天,洗涤后分别用Alexa Fluor®488标记的驴抗兔IgG (1:200, MoBiTec GmbH, Göttingen,德国)或cy3偶联链霉亲和素(1:200,Dianova GmbH,汉堡,德国)孵育2小时。最后,使用immunu - mount™(Fisher Scientific GmbH, Schwerte, Germany)和玻璃盖玻片安装载玻片。对照部分同样处理,但没有一抗以排除二抗的非特异性染色。在比目鱼肌中,我们增加了第四种抗cd68抗体染色(1:50;AbD Serotec, Kidlington, UK),由Alexa Fluor®647标记的驴抗大鼠IgG (1:200, MoBiTec GmbH, Göttingen,德国)检测,以可视化NMJ旁边的巨噬细胞。
共焦图像由扫描激光显微镜C2 (Nikon GmbH, Düsseldorf,德国)使用NIS-Elements AR 4.30.01(实验室成像)软件拍摄。每个NMJ以250 Hz的630倍放大率扫描,图像大小为1024 × 1024像素。随后,使用斐济软件(美国国家卫生研究所,Bethesda, USA)进行形态分析,确定BTX和vAChT免疫标记区域及其重叠区域。
透射电子显微镜
比目鱼和腓肠肌的线粒体超微结构如前所述使用透射电镜进行评估[35].图像在10000倍放大下拍摄,使用ImageJ软件(Scion Image,美国国立卫生研究院,Bethesda, USA)分析每只小鼠两侧肌肉的10张随机图片。平均线粒体大小是通过手动包围所有已识别的线粒体来确定的。线粒体结构的改变通过“正常”或“损坏”的分类进行评估:显示嵴损失超过50%或外膜破坏超过50%的线粒体被分配为“损坏”或“正常”。结果以线粒体总数的百分比给出。此外,还测定了肿胀的线粒体和含有多层体的线粒体的百分比。
RT-qPCR
根据制造商的说明,使用peqGOLD Isolation Systems TriFast™(PEQLAB biotechnology GmbH, Erlangen, Germany)进行RNA的提取。RNA质量(OD260 nm/OD280 nm = 1.7 ~ 2.0)和浓度使用NanoDrop 2000c分光光度计(Thermo Scientific, Schwerte, Germany)测定。RNA完整性通过芯片实验室技术确认,使用RNA 6000 NanoChip试剂盒在Agilent 2100生物分析仪(Agilent Technologies, Waldbronn, Germany)上进行。总RNA (0.7 μg)用1单位DNAse处理(Thermo Scientific, St. Leon-Rot, Germany;30分钟,37°C)。然后,用500ng的寡核苷酸(dT)进行RNA的逆转录。12 - 18引物,20单位的Affinity Script多温cDNA合成(Agilent), 24单位的Ribo LockTMRNAse抑制剂;1小时,42°C)和4 mM dNTP-Mix。定量聚合酶链式反应(qPCR)使用QIAGEN GmbH (Hilden, Germany)的定量引物分析进行重复。为了确认引物特异性和单个扩增子的存在,对扩增产物进行了熔解曲线(55-95°C)。使用Mx3005P™QPCR系统(Stratagene)进行扩增和数据分析。对于每个样本,通过从cDNA池生成的各自标准曲线进行线性回归分析计算相对数量。在Actb, Gapdh和Tbp转录本中,Tbp被NormFinder软件确定为最稳定的参比基因,用于感兴趣基因的RNA规范化(附加文件)1).
统计数据
数据以均数±均数的标准误差(SEM)表示。CIH与NOX或iNOS的差异−−/采用方差分析(ANOVA)和Student 's法检测t-test(事后测试),或者,在非正态分布数据的情况下,通过Kruskal-Wallis方差分析和Dunn的事后测试。一个p< 0.05为有统计学意义。所有统计程序均使用SigmaPlot 14.0软件(Systat software, Inc, Chicago, USA)。
结果
体重
CIH对WT的影响
在WT小鼠中,与NOX相比,6周的CIH显著减少了介入前至介入后的体重增加,即2至3.5月龄之间的体重增加(从9.1%的高基线开始)(表1).
CIH对iNOS的影响
在NOX条件下,iNOS−−/与WT相比,小鼠的体重增加显著降低(表1),增幅由10.7%起(p< 0.001)干预前体重高于WT小鼠。当暴露于CIH时,iNOS−−/小鼠甚至表现出体重减轻,因此与NOX条件相比有显著差异(表1).
比目鱼肌纤维形态及组分
CIH对WT的影响
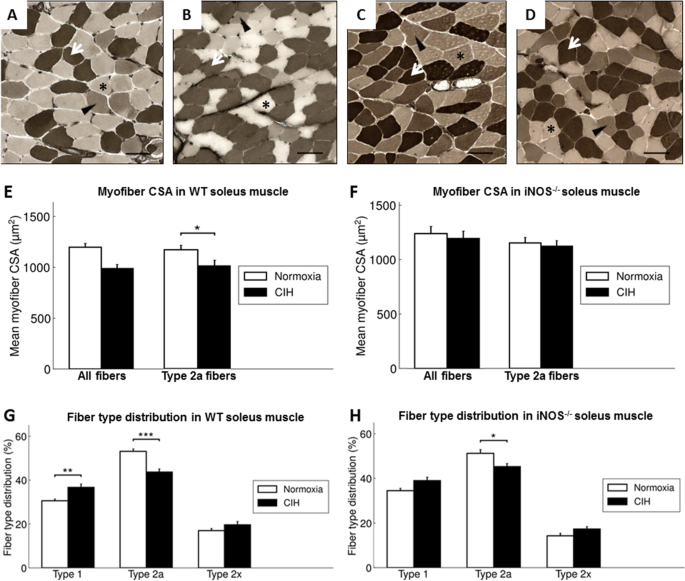
CIH干预和NOX在WT中覆盖比目鱼肌中所有纤维类型的平均CSA没有显著差异(图2)。1A - b;E,左),尽管它与体重增加显著正相关(r= 0.41;p= 0.047)。一项针对纤维类型的分析表明,与NOX相比,CIH导致仅2a型纤维的纤维CSA显著降低13.5% (p< 0.05)(图1E,正确的).因此,与NOX相比,CIH导致1型纤维分数增加(37% vs. 31%;p< 0.01),与2a型纤维分数降低相关(44% vs. 53%;p在2x型纤维分数不变时< 0.001)。1A - b;G)。
WT-NOX小鼠在ph4.55预孵育后比目鱼肌横截面atp酶染色的代表性图像(200倍放大,比例尺= 50 μm) (一个)、WT-CIH小鼠(B),进气阀打开−−/-NOX鼠标(C),以及iNOS−−/-CIH鼠标(D).1型纤维染成深色(白色箭头),2a型纤维染成浅色(黑色星号),2x型纤维染成中间色(黑色箭头)。E整体肌纤维CSA [μm2),FWT和iNOS比目鱼肌2a型肌纤维CSA−−/老鼠。比目鱼肌纤维型分布[%]。与NOX对照组相比,6周CIH后WT小鼠1型、2a型和2x型纤维的百分比(G)和iNOS−−/小鼠(H)。数值为均值+ SEM;n= 8 ~ 14只/组。*p< 0.05, **p< 0.01, ***p< 0.001, CIH与NOX显著性
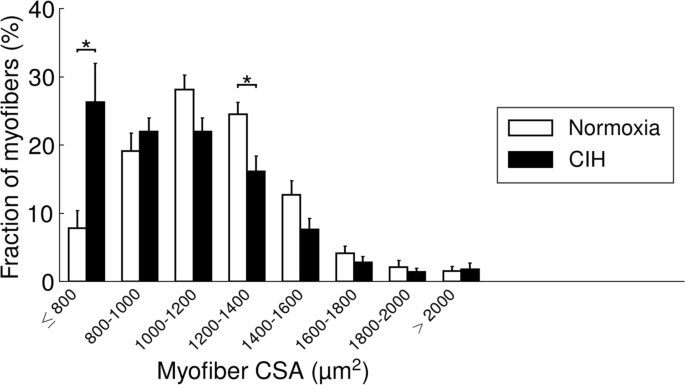
CSA对纤维分布的平行分析表明,与NOX相比,CIH显著增加了CSA < 800μm的小纤维的分数2)在比目鱼肌(图。2).
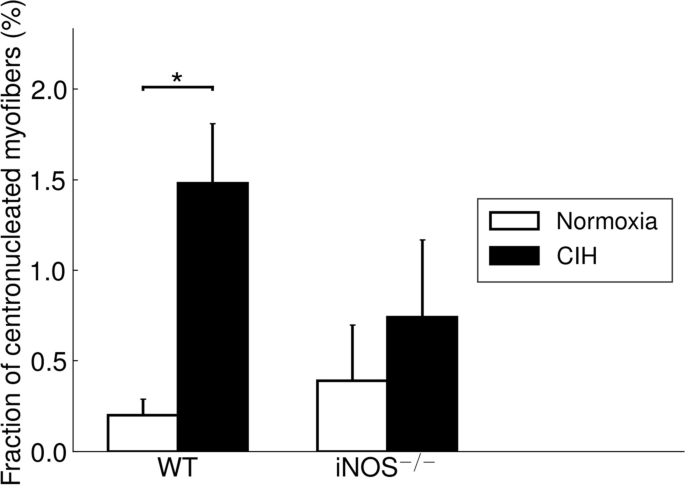
此外,与氮氧化物相比,CIH的中心核化纤维比例明显更高(1.5% vs. 0.2%;p= 0.01),如he染色切片所示。3.,左).在经过CIH或NOX处理的WT中,中心核化纤维的比例与纤维群的CSA呈显著的负相关(r=−0.417;p= 0.043)。
CIH对iNOS的影响
在这两种情况下,NOX和CIH, iNOS−−/与WT相比,对总纤维种群的纤维CSA或类型1、2a或2x的纤维CSA没有任何显著影响。在伊诺−−/与NOX相比,CIH对小鼠纤维的CSA总量和类型均无明显变化(图2)。1F),而与cih相关的纤维组成变化与WT部分相似(图。1A, C, H): CIH与iNOS中NOX的比较−−/小鼠2a型纤维含量下降(45% vs. 51%;p< 0.05),在2x型纤维分数不变的情况下,1型纤维分数无显著增加(39% vs 35%)。1C, D, H)。在iNOS中,两个基因型之间以及CIH与NOX之间均未检测出显著差异−−/老鼠(图。3.).
腓肠肌中纤维的形态和组分
与比目鱼肌相比,腓肠肌主要由2x型纤维组成,CIH对NOX和iNOS无明显影响−−/与WT或其组合有关的CSA(附加文件2)或中心核的百分比(附加文件3.).
比目鱼肌NMJ形态/完整性
CIH对WT小鼠的影响
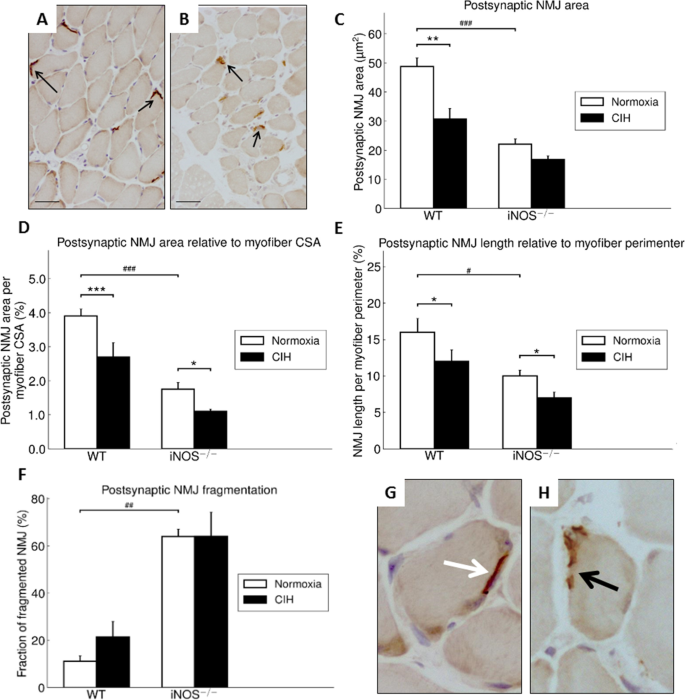
在WT小鼠比目鱼肌中,NMJ的BTX染色显示,与NOX相比,CIH导致突触后NMJ面积显著减小37%(图2)。4得了,左).当计算NMJ相对于光纤CSA的面积时,(图;4D,左),与NOX相比,CIH显著降低了突触后NMJ的大小。与氮氧化物相比,另一种将NMJ长度归一化到纤维周长的方法类似地降低了CIH下NMJ的大小。4E,左).在WT小鼠中,NMJ碎片的比例没有发生明显的cih相关变化。4F,左;G)。
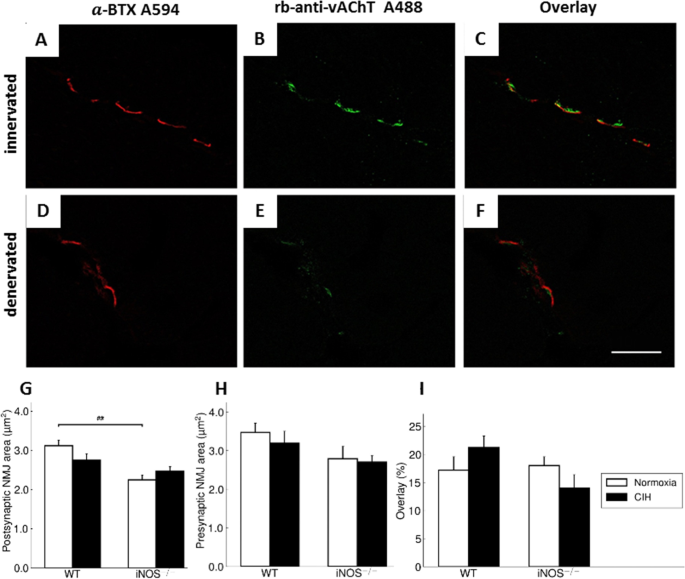
WT-NOX BTX染色比目鱼肌横截面代表性图像(200倍放大,比例尺= 50 μm) (一个)及WT-CIH (B)。比目鱼肌突触后NMJ区(C).突触后NMJ区归一化至肌纤维CSA (D)和NMJ相对于肌纤维周长(E),以及比目鱼肌中NMJ碎片的百分比(F).比目鱼肌NMJ中btx染色AChR分布的代表性图像(400倍放大)(G,H).GWT-NOX小鼠突触后btx染色的NMJ(白色箭头)。HWT-CIH小鼠突触后btx染色NMJ片段为(黑色箭头)。数值为平均值+ SEM;n每组8只。*p< 0.05, **p< 0.01, ***p< 0.001, CIH与NOX显著性;#p< 0.05,# #p< 0.01,# # #p< 0.001, WT和iNOS之间有显著性−−/
iNOS效应−−/w / o CIH
与WT相比,iNOS−−/在NOX条件下,小鼠的NMJ面积显著减少了55%(图。4C),在纤维CSA突触后NMJ区域正常化时,这种影响也很显著(图。4D)或突触后NMJ长度为纤维周长(图。4E). CIH与NOX干预iNOS的比较−−/小鼠导致NMJ面积(绝对值)进一步下降(图。4C,正确的);然而,当纤维CSA的突触后NMJ区域正常化时,这种效应达到了显著性(图2)。4D,正确的)或者,或者,突触后NMJ的纤维周长(图。4E,正确的).值得注意的是,iNOS选择性地观察到NMJ碎片的百分比显著更高−−/与WT在两种条件下的比较(图;4F,正确的;H)。
腓肠肌和股肌中的NMJ形态/完整性
腓肠肌肌肉
与比目鱼肌相比,WT小鼠腓肠肌在CIH下NMJ的大小明显增加(72%,p< 0.05,附加文件4).然而,当对纤维CSA的突触后核磁共振区域进行归一化时,这种差异被消除了。此外,与比目鱼肌不同,腓肠肌在iNOS中−−/小鼠未发现突触后NMJ区域有显著变化,上述NMJ区域或CSA纤维长度或周长的正常化也是如此。
股肌肉
为了进一步评估NMJ功能的完整性,在股肌中使用双荧光染色来量化NMJ突触前神经末梢的面积(抗vachht抗体,图。5A, D),突触后NMJ (BTX,图。5B, E)及其耦合(叠加,图。5C, F)。与比目鱼肌(而非腓肠肌)的结果一致,显著减少了27.9% (p< 0.01)的突触后NMJ在iNOS中的表达−−/与WT在NOX条件下的比较(图;5G),而WT和iNOS中不存在与NOX相比的CIH效应−−/老鼠。突触前末端,定义为vAChT免疫反应区,仍然抵抗CIH或基因型相关的影响(5H)。由此产生的覆盖面积百分比(NMJ完整性的衡量标准)没有受到CIH干预或iNOS的显著影响−−/(无花果。5我)。
来自股肌的代表性NMJ的共聚焦投影图像为突触后AChR染色(BTX,一个而且D,红色)和神经末梢vAChT (B而且E、绿色)。合并显示了BTX和vAChT (C而且F).例如,神经支配的肌肉NMJ, btx染色区大部分被vAChT染色所覆盖(一个- - - - - -C).相比之下,D- - - - - -F显示NMJ,其中achr染色区域仅部分被vAChT染色覆盖,代表去神经。面板中的比例尺F为10 μm。平均突触后(G)和突触前(H) BTX和vAChT的NMJ区域和覆盖区域(我)在股肌。数值为平均值+ SEM;n=每组4 ~ 6只动物。# #p< 0.01, WT与iNOS有显著性差异−−/
比目鱼和腓肠肌中的炎症标志物(IL1β, CD68)
在WT比目鱼肌肉中,与NOX相比,CIH下IL 1ß-阳性细胞的密度显著降低了近9% (p< 0.05)(图6E)和iNOS−−/与WT以及iNOS相比−−/CIH与NOX无显著差异(图2)。6E).腓肠肌无CIH-或iNOS−−/检测到相关的变化。
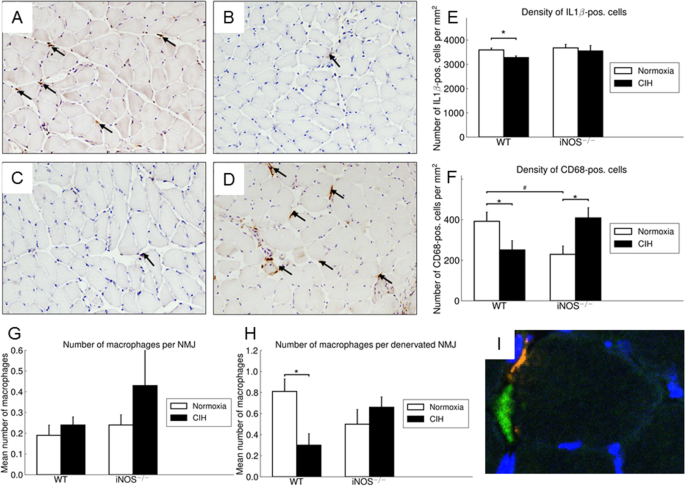
WT-NOX CD68染色比目鱼肌横截面代表性图像(200倍放大,比例尺= 50 μm) (一个), wt-cih (B),进气阀打开−−/氮氧化物(C),以及iNOS−−/cih (D)。cd68阳性细胞用箭头标记。IL 1β- (E)和CD68- (F比目鱼肌内可见阳性细胞。平均每NMJ巨噬细胞数(G)和每个去神经的NMJ的平均巨噬细胞数(H).神经末梢vAChT(绿色)和CD68(红色)染色的比目鱼肌代表性NMJ的共聚焦投影图像合并显示NMJ和巨噬细胞的共定位(H).数值为平均值+ SEM,n每组8只。*p< 0.05, CIH与NOX显著;#pWT与iNOS < 0.05,差异有统计学意义−−/
分析间质巨噬细胞(cd68阳性细胞)的状态,WT小鼠比目鱼切片显示,CIH与NOX相比,巨噬细胞密度显著降低36%。6A, B, F),而腓肠肌中没有发现这种差异。与WT相比,iNOS−−/与NOX相比,CIH条件下小鼠的CD68密度显著增加78%(图2)。6C, D, F)。此外,iNOS显著降低了密度−−/与NOX下WT相比(p< 0.05)(图6A c f)。
鉴于巨噬细胞被报道存在于神经损伤后的NMJ中,我们使用双荧光染色研究了比目鱼肌中完整和受损NMJ附近的巨噬细胞数量(图2)。6I).当BTX和vAChT染色的覆盖层小于10%时,NMJ被认为是去神经的。
覆盖比目鱼肌肉所有NMJ的巨噬细胞的平均数量在CIH干预和NOX在WT或iNOS中没有显著差异−−/(无花果。6G)。对去神经的NMJ进行特异性分析显示,与NOX相比,CIH导致终板旁巨噬细胞显著减少(0.30 vs. 0.81;p< 0.02)(图;6H)。
比目鱼肌巨噬细胞密度与BTX和vAChT重叠面积呈显著正相关(r= 0.55;p= 0.004),与去神经化NMJ (r=−0.59;p= 0.001)。
比目鱼肌线粒体超微结构研究
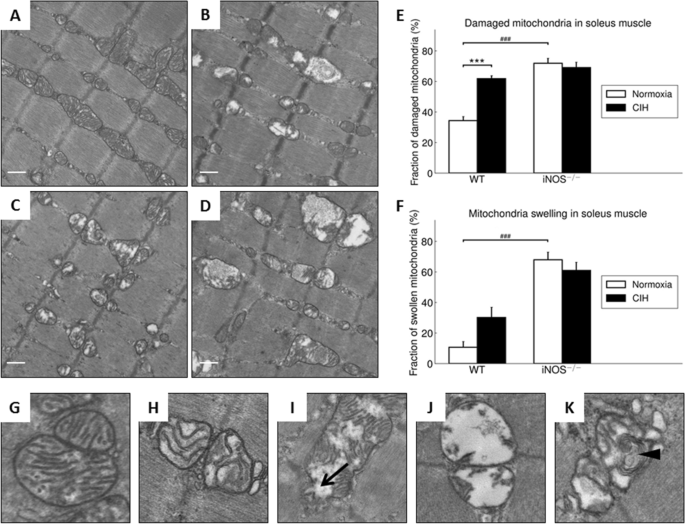
在暴露于NOX的WT比目鱼肌中量化了以下超微结构线粒体异常(图2)。7A)或CIH(图。7B)在iNOS中也是如此−−/小鼠NOX(图;7C)或CIH(图。7D):膨胀矩阵(图;7H),线粒体外膜的破坏(图。7I),内部结构完全丧失(图;7J)和具有多层体的线粒体(图。7K)。
CIH对WT的影响
损伤线粒体的百分比,分类为<50%充满嵴,CIH与NOX相比明显高出1.8倍(图2)。7E,左),而CIH时线粒体肿胀百分比的增加没有达到显著性(图。7F,左).CIH与NOX在含有多层体的线粒体百分比方面的差异不显著(12.8% vs. 6.6%;p> 0.05)。
iNOS效应−−/w / o CIH
有点让人想起WT中的CIH vs. NOX效应,iNOS−−/与NOX条件下的WT小鼠相比,显示线粒体损伤显著增加2.1倍(图2)。7E).此外,iNOS中肿胀线粒体的百分比−−/与WT小鼠相比,两种条件下(NOX > 6倍;CIH > 5-fold)(图7F)。
腓肠肌线粒体超微结构
在腓肠肌中,CIH vs NOX WT和iNOS均未观察到上述线粒体改变−−/(附加文件5而且6).
NMJ纤维与线粒体形态的相关性
在比目鱼肌中,NMJ区域与受损线粒体的百分比显著相关(r= 0.584,p= 0.002)以及1型和2a型纤维之间的比值(r= 0.397,p= 0.05)2).
iNOS、SOCS3、IL6、SOD2和促/抗凋亡标记物的转录本
值得注意的是,在接受NOX或CIH干预的WT小鼠比目鱼(以及腓肠肌)肌肉中检测不到iNOS的mRNA表达3.).然而,重要的是,在WT小鼠的肝脏中可以很好地检测到iNOS的表达,其表达以0.12因子的幅度显著大幅下降(表2)3.) cih处理后。在iNOS的肝脏和比目鱼(和腓肠肌)肌肉中证实了iNOS表达的缺失−−/老鼠。
重要的是,在WT小鼠比目鱼肌中,SOCS3的表达被发现与NOX相比,CIH使>增加了10倍(表2)3.).同样,进气阀打开−−/导致SOCS3上调,与NOX时的WT相比,NOX时>上调10倍,CIH时>上调4倍(表2)3.).值得注意的是,在WT小鼠腓肠肌中未检测到SOCS3的mRNA表达。比较伊诺−−/CIH、NOX、SOCS3增加2.8倍。
IL6作为SOCS3的上游因子,既没有CIH-也没有iNOS−−/比目鱼肌的相关变化(表3.).在WT小鼠腓肠肌中,CIH与NOX相比导致IL6 mRNA表达降低50%,而iNOS表达降低50%−−/CIH与NOX无相关差异。
此外,在WT小鼠中,与NOX相比,CIH导致比目鱼肌中mtSOD mRNA表达减少近50%。同样,进气阀打开−−/在NOX和CIH处理下,比目鱼中SOD2的表达分别降低了33%和45%(表2)3.).
此外,凋亡标志物(BAX, BCL2, caspase 3)的筛选既没有CIH-也没有iNOS−−/比目鱼肌的相关变化(表3.).
讨论
本研究使用长期暴露于CIH的小鼠作为OSA模型,首次表明与NOX相比,CIH会导致“红色”(比目鱼)而不是“白色”(腓肠肌)肌肉的潜在功能相关性损伤。这包括突触后NMJ的面积、长度和完整性的减少,以及2a型纤维的大小(CSA)和比例(在较高的1型纤维比例下)的减少。此外,这些变化与相当大的线粒体损伤有关,这与NMJ区域的(损失)显著相关(r=−0.71,p< 0.001),同样仅限于比目鱼肌,而腓肠肌未显示明显的线粒体损伤。
本研究进一步包括了iNOS−−/将小鼠纳入CIH vs. NOX对骨骼肌影响的分析,以验证iNOS缺乏至少在一定程度上可以通过CIH防止促炎/促氧化作用,即缺氧-再氧应激导致来自各种来源的ROS生成[36].与预期相反,我们的数据表明,与WT相比,iNOS−−/其本身(即在NOX条件下)也会导致高度显著的突触后NMJ面积减少和碎片化,并伴有线粒体损伤和肿胀,这与CIH在WT小鼠中观察到的情况惊人地相似并超过。值得注意的是,在iNOS缺失的情况下,CIH应激能够进一步加重损伤,至少在突触后NMJ面积或纤维CSA或周长归一化后分别进一步减少。CIH(相对于WT中的NOX)与iNOS之间的相似性−−/(与NOX中的WT相比)仅限于NMJ和线粒体损伤,而CIH与NOX中观察到的纤维CSA降低(包括其与NMJ的相关性)和中心核化在iNOS中不存在−−/小鼠,即,他们显示没有萎缩,尽管有去神经的迹象。
另一个惊人的相似之处是,我们发现在WT和iNOS中,CIH与NOX相比,SOCS3的表达增加了> 10倍−−/比目鱼肌肉(混合样本)中NOX的WT对比。现有证据证明SOCS3是将线粒体损伤与NMJ恶化机械联系起来的候选者:SOCS3上调已被证明是坐骨神经横断骨骼肌去神经后的早期事件[37].
SOCS3过表达已被证明会导致线粒体损伤,如胫骨前肌肿胀或断裂,这让人想起目前在比目鱼肌中观察到的情况,但在腓肠肌中没有。此外,SOCS3过表达与线粒体基因Smtck和Slc25a3的抑制表达有关[38],但也可能包括目前被发现下调的mtSOD。作为瘦素和胰岛素信号的抑制剂,肌肉SOCS3表达的增加被认为是线粒体功能障碍、脂肪酸氧化受损的主要原因,与衰老、代谢综合征和炎症有关[39,40,41].这些严重的代谢影响,结合先前的证据,SOCS3过表达扩张肌浆网,脱位和抑制钙调磷酸酶(与SOCS3共定位),并降低骨骼肌能量消耗、摄氧量和活动[38可能会导致肌纤维萎缩,如在CIH中观察到的那样。虽然我们没有发现凋亡信号增加的证据,但SOCS3上调似乎与老年人再生干细胞功能受损有关[41],并可能在目前CIH观察到的中心核增多中发挥潜在作用。
虽然本研究假定SOCS3上调是对局部炎症信号的响应,特别是通过IL6,但在CIH暴露下,没有发现IL6表达的差异。相反,我们甚至在比目鱼中观察到较低水平的炎症标志物,如il - 1β和减少的巨噬细胞密度,但腓肠肌中没有。此外,在比目鱼肌中,与常氧对照相比,cih暴露的WT小鼠在去神经支配的NMJ附近的巨噬细胞数量减少,而在完整的NMJ方面没有差异。先前的研究证明巨噬细胞在NMJ的神经再生中起着有益的作用[42],因此,CIH暴露下去神经化NMJ巨噬细胞的损失可能表明受损NMJ的再生能力较低。此外,脊髓性肌肉萎缩小鼠的骨骼肌中巨噬细胞的损失被描述为随着疾病的恶化,这与NMJ的破坏有关[43,44].在我们的研究中观察到,在SMA条件下,慢抽搐肌的NMJ破坏比快抽搐肌更严重[44].
此外,目前在CIH和iNOS (NOX或CIH)比目鱼肌肉中观察到的mtSOD表达的中度下降,在较小程度上也可能在纤维萎缩和线粒体退化中发挥作用:Sod1−−/小鼠,作为年龄相关性肌肉萎缩(肌肉减少症)神经肌肉损伤的小鼠模型,显示IIa型纤维的肌纤维CSA减少[45,46].事实上,目前观察到IIa型纤维的CSA减少与最显著的mtSOD下降相关(约。50%),较低的体重增加,线粒体超微结构和NMJ形态的改变。此外,观察到纤维代谢表型的变化,即,CIH(相对于WT)和iNOS时,1型纤维含量增加,2型纤维含量减少−−/(相对于NOX下的WT)可能归因于mtSOD表达的降低,而不是SOCS3的上调,后者降低了氧化纤维的特性[38].mtSOD缺乏,代表抗氧化防御受损,也可能涉及大量与年龄相关的特征,这些特征可能源于快速运动神经元的丧失,随后是缓慢运动神经元的神经再生[47].在本研究中,纤维类型比例(1型/ 2a型)与NMJ碎片显著相关,与NMJ大小呈负相关,表明神经再支配在纤维类型转移中的作用。
因此,我们对CIH的观察可能与涉及SOCS3和mtSOD的年龄相关神经肌肉退化有一些相似之处。这与之前在其他啮齿类动物CIH模型中的研究一致,揭示了通过下调HIF-2α来下调mtSOD/SOD2 [48]及OSA患者血浆CuZnSOD/SOD1降低的临床观察[49].
然而,我们基于cih的OSA小鼠模型与OSA患者的活检研究不一致,后者显示与对照组相比,胫骨前肌纤维大小没有变化[11]或在未改变纤维类型组成的情况下,股四头肌2a型纤维的直径甚至增大[50].然而,我们应该记住,CIH小鼠模型并没有模拟某些OSA固有因素,如胸内压和血pCO的变化2以及通气过度,但同时涉及更严重的O2无气道阻塞的去饱和。此外,小鼠的遗传背景可能会影响萎缩的程度[51].
更重要的是,我们的数据提供了第一个证据,证明cih暴露在比目鱼和腓肠肌之间的显著差异效应,即(混合)“红色”和“白色”肌肉,这在转化研究中必须考虑到。事实上,与比目鱼肌相比,腓肠肌在CIH中既没有线粒体损伤,也没有NMJ改变(而是增大而不是缩小)。比目鱼体位肌(在安静站立时始终保持运动)和腓肠肌运动肌(提供快速有力的收缩)之间的不同运动强度[52可能会影响CIH和iNOS中这些肌肉特异性的发现−−/在肌肉衰老或神经退行性疾病中,大量的肌肉(纤维)特异性差异也与此有关[53,54,55].
然而,我们在cih小鼠比目鱼肌中发现的线粒体超微结构和基因表达受损可能与人类腭肌(OSA病理生理学的主要研究焦点)一致,显示出异常的线粒体功能和组织[56].观察到受损线粒体比例与NMJ碎片呈密切正相关(或与NMJ面积呈负相关),但没有发现因果关系的线索。作为第一个假设,CIH(缺氧-再氧应激)期间线粒体来源的氧化应激可能会损害NMJ [57]与其他ROS来源(如上调的NOX2)联合作用,如目前使用的CIH小鼠模型的报道[58].然而,重要的是,iNOS−−/在很大程度上模拟了CIH效应,即NMJ和线粒体损伤以及SOCS3上调和mtSOD下调,尽管NOX和CIH暴露均未检测到WT比目鱼或腓肠肌iNOS mRNA表达。相比之下,WT小鼠显示肝脏iNOS的表达,与NOX相比,CIH显著降低(> 8倍),因此有理由认为骨骼肌外的iNOS缺乏同时表达CIH和iNOS−−/效果。因此,NMJ损伤,与上述两种情况相似,强烈表明外周神经(即运动神经元或雪旺细胞的周核)中的iNOS缺乏是NMJ损伤的原因,尽管髓系iNOS表达也可能具有肌肉保护作用[59].周围神经损伤可显著上调雪旺氏细胞中低组成型iNOS的表达,iNOS缺失可导致损伤远端肌肉NMJ再生有髓纤维更小和神经再生延迟[60].事实上,阻塞性睡眠呼吸暂停患者的周围神经功能障碍似乎是早期事件[61],而去神经可能先于肌肉功能障碍,如人类上呼吸道肌肉[37,62,63]并通过增加的肌膜N-CAM染色来支持[15].到目前为止,还没有关于阻塞性睡眠呼吸暂停患者的相应神经肌肉数据。然而,需要它们来评估这些改变的功能相关性,并从衰老和退行性疾病的过程中分离osa对NMJ、线粒体、代谢和相关纤维功能障碍的特异性影响[21,64,65].值得注意的是,目前接受测试的小鼠的年龄(4个月)与人类成年早期(20-30岁)相对应[66].
iNOS表达(骨骼肌外)可能具有神经保护作用并与“红色”(有氧)肌肉功能相关的结论可能有点违反直觉,因为iNOS上调导致NO的增加,而NO具有抗菌或抗肿瘤作用,但对正常组织也具有细胞毒性[67].此外,它还与胰岛素抵抗和糖尿病有因果关系。尽管如此,基础NO生成速率(主要但不完全由nNOS和eNOS产生)在人类生理上是必需的(由[34])。有证据表明NO可能传递生理氧化信号[68]而神经保护性抗氧化防御则需要一定的iNOS的产生[69],例如通过NO的ROS清除功能[67,69].关于骨骼肌组织的数据很少;然而,据报道,iNOS缺乏导致心肌功能障碍的线粒体损伤(阿霉素小鼠模型)。有趣的是,过表达mtSOD可以消除这种影响[70,71],目前发现CIH和iNOS缺失导致其下调。
作为限制,本研究没有包括关于NMJ和骨骼肌的功能数据来挑战形态学改变的相关性。此外,我们的小鼠模型涉及每周5天的有限CIH暴露,这可能允许每周2天常氧的适应性或保护作用。尽管如此,已有研究表明,本文所使用的CIH小鼠模型能够准确反映临床OSA的动脉高血压等病理生理变化[58].
结论
综上所述,这是第一个证明CIH作为中重度OSA模型可引发WT小鼠慢肌NMJ和线粒体损伤并伴有纤维萎缩的研究,所有这些都可能导致OSA患者运动(有氧)能力降低。我们进一步证明,iNOS缺乏,而不是产生骨骼肌对CIH应激的保护,导致常氧状态下NMJ和线粒体的类似结构损伤,并可能导致WT中的CIH效应,推测是通过神经支配受损。
数据和材料的可用性
本研究中使用和/或分析的数据集可根据合理要求从通讯作者处获得。本研究中使用的材料可以在市面上买到。
改变历史
5月14日
在本文最初发表之后,本文的资金声明已被更正,并添加了以下注释:由Projekt DEAL启用和组织的开放获取资金。
缩写
- 阻塞性睡眠呼吸暂停综合症:
-
阻塞性睡眠呼吸暂停
- CIH:
-
慢性间歇性缺氧
- NMJ:
-
神经肌肉接头
- 氮:
-
Normoxia
- 客服人员:
-
横截面积
- ATP:
-
三磷酸腺苷
- 透射电镜:
-
透射电子显微镜
- WT:
-
野生型
- 伊诺:
-
诱导型一氧化氮合酶
- SOCS3:
-
细胞因子信号通路抑制因子3
- 你好:
-
低通气指数
- CPAP:
-
持续气道正压
- 跟单信用证:
-
解偶联蛋白
- ROS:
-
活性氧
- RNS:
-
活性氮
- 没有:
-
一氧化氮
- BTX:
-
α金环蛇毒素
- PFA:
-
多聚甲醛
- PBS:
-
磷酸盐
- 合:
-
辣根过氧化物酶
- BSA:
-
牛血清白蛋白
- 轻拍:
-
3, 3 ' -Diaminobenzidine
- vAChT:
-
囊泡乙酰胆碱转运体
- Actb:
-
肌动蛋白β
- GADPH:
-
甘油醛3-磷酸脱氢酶
- 真沸点:
-
TATA-box-binding蛋白质
- 扫描电镜:
-
均值的标准误差
- mtSOD:
-
线粒体超氧化物歧化酶
- 伯灵顿:
-
bcl -2相关X蛋白
- BCL2:
-
B细胞性淋巴瘤2
- MURF-1:
-
肌肉无名指蛋白-1
- sMtCK:
-
肌酸线粒体肌酸激酶
- Slc25a3:
-
溶质载体家族25个成员3
- nNOS:
-
神经元型一氧化氮合酶
- 以挪士:
-
内皮型一氧化氮合酶
参考文献
杨晓东,王志强,等。成人睡眠呼吸障碍患病率增加。中华流行病学杂志,2013;29(3):344 - 344。
张建平,张建平,张建平,等。睡眠呼吸障碍随体重变化的进展和消退:睡眠心脏健康研究。中国临床医学杂志,2005;26(4):344 - 344。
杨永强,李志强,等。中年人睡眠呼吸障碍的发生。中华实用医学杂志,1993;29(4):529 - 529。
Young T, Peppard PE, Gottlieb DJ。阻塞性睡眠呼吸暂停的流行病学:人口健康的视角。中华呼吸急救杂志,2002;29(9):337 - 337。
Young T, Peppard PE, Taheri s体重超标,睡眠呼吸障碍。应用物理学杂志(贝塞斯达,马里兰州:1985年)。2005年,99(4):1592 - 9。
王志强,王志强,王志强,等。睡眠呼吸障碍在普通人群中的患病率:HypnoLaus研究中国呼吸医学杂志,2015;3(4):310-8。
阻塞性睡眠呼吸暂停的嗜睡、疲劳、疲倦和缺乏精力。胸部。2000;118(2):372 - 9。
Berger M, Kline CE, Cepeda FX等。阻塞性睡眠呼吸暂停是否会影响运动能力和运动后的血流动力学反应?个体患者数据和聚合元分析。睡眠医学Rev. 2019; 45:42-53。
Mendelson M, Marillier M, Bailly S,等。阻塞性睡眠呼吸暂停综合征患者的最大运动能力:系统回顾和荟萃分析。中国生物医学工程学报,2018;29(6):379 - 379。
张建平,李龙,等。持续气道正压对阻塞性睡眠呼吸暂停患者最大运动能力的影响:系统回顾和荟萃分析。临床睡眠医学杂志,2020;16(11):1847-55。
Wåhlin杨晓明,王晓明,王晓明,等。阻塞性睡眠呼吸暂停综合征患者的骨骼肌形态和有氧能力。呼吸。2008;76(1):21-7。
Edström L, Larsson H, Larsson L.神经源性对阻塞性睡眠呼吸暂停患者腭咽肌的影响:肌肉活检研究。中华神经外科杂志。1992;55(10):916-20。
Friberg D, Ansved T, Borg K,等。组织学显示上呼吸道肌肉有进行性鼾症。中华呼吸急救杂志,1998;19(2):366 - 366。
Lindman R, Stål PS.睡眠呼吸障碍患者腭咽肌形态异常。中华神经科学杂志,2002;19(1):11-23。
王志强,王志强,等。阻塞性睡眠呼吸暂停患者上呼吸道肌肉炎症和去神经改变。中华呼吸急救杂志。2004;17(5):541-6。
Ko c p。神经肌肉系统。在:国际百科全书的社会和行为科学。阿姆斯特丹:爱思唯尔;2001.p . 10595 - 600。
张志刚,张志刚,张志刚,等。神经肌肉连接处。肌纤维类型的差异,可塑性和对活动增加和减少的适应性。运动医学(奥克兰,N.Z.)。1994; 17(6): 358 - 72。
杜晓东,李志强,李志强,等。抗阻训练对神经肌肉连接形态的影响。肌肉神经。2000;23(10):1576-81。
陈志伟,陈志伟,陈志伟,等。不同强度运动训练对神经肌肉连接形态的影响。中华神经细胞杂志,1993;22(8):603-15。
安东尼亚MH,法希姆MA。耐力运动改变大鼠快、慢收缩神经肌肉连接的形态。国际运动医学杂志,1988;9(3):218-23。
陈志伟,陈志伟。肌肉卸载后突触可塑性与年龄相关的差异。中华神经生物学杂志,2003;37(3):344 - 344。
马亚丹,李志强,李志强,等。肌肉纤维和它们的突触不同地适应衰老和耐力训练。Exp Gerontol. 2018; 106:183-91。
张玉春,范Remmen H.年龄相关性神经肌肉连接处改变。研究进展。2011;29(3):344 - 344。
Dupuis L, Gonzalez de Aguilar J-L, Echaniz-Laguna A,等。肌肉线粒体解耦使神经肌肉连接处解体,并引发远端运动神经元变性。公共科学学报。2009;4(4):e5390。
Evans JL, Maddux BA, Goldfine ID。氧化应激诱导胰岛素抵抗的分子基础。抗氧化氧化还原信号。2005;7(7-8):1040-52。
马沙维,孙文杰,等。阻塞性睡眠呼吸暂停的代谢功能障碍:潜在机制的关键检查。睡眠生物节律。2015;13(1):2-17。
张志刚,张志刚,张志刚,等。阻塞性睡眠呼吸暂停患者多形核中性粒细胞超氧化物释放增强。持续气道正压治疗的影响。中华呼吸危重症杂志,2000;32(1):566-70。
王晓明,王晓明,王晓明,等。阻塞性睡眠呼吸暂停、氧化应激和心血管疾病:动物研究的经验教训。《氧化医学细胞》2013;2013:234631。
Eisele H-J, Markart P, Schulz R.阻塞性睡眠呼吸暂停,氧化应激和心血管疾病:来自人类研究的证据。氧化医学细胞。2015;2015:608438。
张国强,王志强,王志强,等。长期间歇性缺氧诱导型一氧化氮合酶:嗜睡与脑损伤。中华呼吸急救杂志,2005;29(12):344 - 344。
hsp70与iNOS在骨骼肌损伤与修复中的相互作用。运动康复杂志。2015;11(5):240-3。
张晓东,叶晓东,张晓东,等。慢性间歇性缺氧可激活体内心血管组织中的核因子- kappab。生物化学学报。2006;36(2):591-6。
李志刚,李志刚,李志刚,等。重度慢性阻塞性肺疾病支气管黏膜的亚硝化应激。中华过敏临床免疫杂志,2005;16(5):1028-35。
王志强,王志强,等。骨骼肌一氧化氮(NO)合酶和NO信号在“糖尿病”中的作用——运动训练干预的相关性如何?一氧化氮。2014;37:28-40。
李国强,李国强,等。纤维肌痛模型中雄性和雌性小鼠腓肠肌和比目鱼肌的形态改变。PLoS One. 2016;11(3):e0151116。
李丽娟,李丽娟。OSAHS患者心血管疾病的分子机制:氧化应激关系。中国地质大学学报(自然科学版);2009;33(6):1467-84。
吴超,唐磊,倪霞,等。红景天苷通过负向调节促炎细胞因子抑制去神经诱导的骨骼肌萎缩。前沿物理。2019;10:665。
李国强,李国强,等。细胞因子信号-3抑制因子在骨骼肌中的组成性表达导致小鼠活动能力下降和超重。Diabetologia。2009;52(10):2201 - 12所示。
乔根森SB,欧尼尔HM, Sylow L,等。骨骼肌SOCS3缺失可预防肥胖患者的胰岛素抵抗。糖尿病。2013;62(1):56 - 64。
杨喆,胡伟文,李国强,等。肌肉抑制细胞因子信号3 (SOCS3)对胰岛素和瘦素信号的调节。公共科学学报,2012;7(10):e47493。
麦凯BR, Ogborn DI, Baker JM,等。SOCS3升高和IL-6信号通路改变与年龄相关的人类肌肉干细胞功能障碍有关。中国生物医学工程学报。2013;30(8):829 - 829。
李志强,李志强,李志强,等。巨噬细胞在周围神经系统损伤和病理中的作用:神经肌肉连接恢复的盟友。中国生物医学工程学报。2021;
李国强,李国强,等。严重脊髓性肌萎缩小鼠神经肌肉连接组织缺陷和出生后肌生成。中华神经外科杂志,2011;29(6):344 - 344。
Murray LM, Comley LH, Thomson D,等。脊髓性肌萎缩小鼠模型中神经肌肉交界处运动神经元的选择性脆弱和突触前和突触后病理的解离。胡文杰。2008;17(7):949-62。
王晓燕,王晓燕,王晓燕,等。成年Sod1纯合基因敲除小鼠骨骼肌结构的适应性变化。中国生物医学工程学报,2007;27(3):595-605。
张志强,李志强,等。线粒体ROS引起突触不活跃引起的运动缺陷:对突触修剪的影响。氧化还原生物学。2018;16:344-51。
Kadhiresan VA, Hassett CA, Faulkner JA。成年和老年大鼠腓肠肌内侧单个运动单元的性质。中国生物医学杂志,1996;29(3):344 - 344。
南都里J,王楠,袁刚,等。间歇性缺氧通过calpain降解HIF-2alpha导致氧化应激:对复发性呼吸暂停诱发的疾病的影响。中国科学院学报(自然科学版),2009;26(4):366 - 366。
李志强,李志强,等。睡眠呼吸暂停综合征对超重和肥胖患者血液中氧化剂-抗氧化平衡的影响。中国药物学杂志。2008;59(增刊6):761-9。
王志刚,García-Palmer王志刚,王志刚,等。阻塞性睡眠呼吸暂停综合征患者的骨骼肌变化。中华呼吸外科杂志,2003;29(4):344 - 344。
Kostrominova TY. SOD1敲除小鼠骨骼肌中与年龄相关的高级去神经和纤维类型分组。中国生物医学杂志,2010;49(10):1582-93。
Charles JP, Cappellari O, Spence AJ,等。小鼠后肢的肌肉骨骼几何、肌肉结构和功能特殊化。PLoS One. 2016;11(4):e0147669。
王志强,李志强,等。特定肌肉的神经肌肉连接处共同抵抗衰老和渐冻症。公共科学学报,2012;7(4):e34640。
王志强,王志强,王志强,等。哺乳动物神经肌肉连接结构和功能的年龄相关变化。中国生物医学工程学报,2018;
Deschenes MR, Roby MA, Glass EK。衰老影响神经肌肉连接处对耐力训练的适应。神经科学。2011;190:56 - 66。
Stål PS, Johansson B.阻塞性睡眠呼吸暂停长期打鼾者上颚肌肉中异常的线粒体组织和氧化活性。呼吸。2012;83(5):407 - 17所示。
王志强,崔东,等。线粒体蛋白s -亚硝化对骨骼肌神经肌肉连接处缺血再灌注诱导的去神经保护作用。《自由基生物医学》2018;117:180-90。
舒尔兹R, Murzabekova G, Egemnazarov B,等。睡眠呼吸暂停小鼠模型中的动脉高血压:NADPH氧化酶2的作用。中华外科杂志,2014;32(2):300-5。
李文强,李文强,等。HIF脯氨酸羟化酶抑制对骨骼肌偏心收缩损伤的保护作用。骨骼肌。2018;8(1):35。
李伟,李永强。缺乏诱导型一氧化氮合酶的小鼠延迟周围神经变性、再生和疼痛。中华神经外科杂志,2001;26(5):531 - 531。
杨晓东,杨晓明,杨晓明,等。睡眠呼吸暂停的周围神经病变。夜间饱和度下降严重程度的组织标志。中华呼吸急救杂志,1999;19(1):319 - 319。
Eckert DJ, Saboisky JP, Jordan AS,等。上气道肌病在阻塞性睡眠呼吸暂停的病理生理学中并不重要。临床睡眠医学杂志,2007;3(6):570-3。
李志强,李志强,李志强,等。阻塞性睡眠呼吸暂停的舌下神经传导表现。肌肉神经。2010;42(2):257-61。
刘伟,魏拉皮埃尔,Klose A,等。成人骨骼肌干细胞的诱导耗竭损害神经肌肉连接的再生。ELife。2015; 4: e09221。
张志刚,张志刚,张志刚,等。小鼠神经肌肉连接处的年龄相关变化序列和自愿运动的保护作用。公共科学学报,2013;8(7):e67970。
柯瑞尔JM,哈里森德。衰老研究中的小鼠模型。入:Fox JG, Davisson MT, Quimby FW,等编辑。生物医学研究中的老鼠,第三卷。阿姆斯特丹:爱思唯尔学术出版社;2007.p . 637 - 72。
Hemmrich K, Suschek CV, Lerzynski G等。iNOS活性对于内皮应激基因表达保护抗氧化损伤至关重要。应用物理学杂志(贝塞斯达,马里兰州:1985年)。2003年,95(5):1937 - 46所示。
杨晓明,杨晓明,杨晓明,等。活性氧和氮的生物化学与辐射诱导的信号转导机制。致癌基因。2003;22(37):5734 - 54。
王志强,王志强,王志强,等。创伤性脑损伤后iNOS缺陷小鼠氧化应激增强:支持iNOS的神经保护作用。中国脑血流学杂志,2005;25(6):673-84。
蔡维荣,柯尔,伊塔拉,等。锰超氧化物歧化酶和诱导型一氧化氮合酶在急性阿霉素诱导的线粒体毒性中改变早期氧化事件。中华癌症杂志2005;4(7):1056-64。
Cole MP, Chaiswing L, Oberley TD,等。一氧化氮和超氧化物歧化酶在阿霉素诱导的心脏毒性中的保护作用。中华心血管病杂志,2006;69(1):186-97。
确认
作者感谢Claudia Keppler, Michael Dreher, Steffi Zügel和Irmgard Dammshäuser的专家实验室协助。
资金
这项工作得到了von-Behring-Röntgen-Stiftung(项目580071)的资助。由Projekt DEAL启动和组织的开放获取资金。
作者信息
作者及隶属关系
贡献
RK和WH构想、管理和监督该项目,设计实验,并获得资金。RS和NW参与了研究设计并编辑了手稿。LB和SM根据GB、MB和SK的贡献进行了实验和分析数据。LB和WH根据所有作者的输入撰写了手稿。作者们阅读并批准了最终的手稿。
相应的作者
道德声明
伦理批准并同意参与
动物实验得到了区域委员会的批准(RP Giessen, Hesse, Germany;Az: V 54-19 c 20 15 h 01 GI 20/10 Nr. 84/2011),符合德国动物福利法和欧洲科学目的动物保护立法(2010/63/EU)。
发表同意书
不适用。
相互竞争的利益
作者宣称他们没有相互竞争的经济利益。
额外的信息
出版商的注意
伟德体育在线施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条所提供的资料,除非在资料的信用额度中另有说明。
关于本文
引用本文
班诺,L.,博纳特拉,g.a.,伯特恩,M.。et al。慢性间歇性缺氧(CIH)对小鼠慢、快收缩骨骼肌神经肌肉连接和线粒体的影响——iNOS的作用。骨骼肌12, 6(2022)。https://doi.org/10.1186/s13395-022-00288-7
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s13395-022-00288-7
关键字
- 去神经
- 肌肉萎缩
- 线粒体
- 纤维类型
- 氧化应激
- 神经肌肉接头
- 伊诺