- 研究gydF4y2Ba
- 开放获取gydF4y2Ba
- 发表:gydF4y2Ba
小鼠肌膜中的新型γ-肌聚糖互作物gydF4y2Ba
骨骼肌gydF4y2Ba体积gydF4y2Ba12gydF4y2Ba,文章号:gydF4y2Ba2gydF4y2Ba(gydF4y2Ba2022gydF4y2Ba)gydF4y2Ba
摘要gydF4y2Ba
背景gydF4y2Ba
肌聚糖复合物(SC)是连接横纹肌细胞骨架和基底膜的网络的一部分。SC协调磷酸化和钙的变化gydF4y2Ba++gydF4y2Ba在机械变形过程中,这些过程被γ -肌聚糖(Sgcg)的功能丧失突变中断,导致肢带肌营养不良2C/R5。gydF4y2Ba
方法gydF4y2Ba
为了深入了解SC如何介导肌肉中的机械信号,我们利用LC-MS/MS蛋白质组学对富集的肌层部分的免疫沉淀物中的SC相关蛋白进行了研究。纳入标准为与来自C57BL/6对照肌肉的抗sgcg共免疫沉淀,以及与无sgcg肌肉和非特异性IgG平行实验的代表性不足。在人RH30横纹肌肉瘤细胞的共表达实验中验证了相互作用。gydF4y2Ba
结果gydF4y2Ba
我们确定了19个候选蛋白作为Sgcg的直接或间接相互作用,包括其他3个SC蛋白。新的潜在相互作用物包括蛋白磷酸酶-1-催化亚基- β (Ppp1cb, PP1b)和钠gydF4y2Ba+gydF4y2Ba- kgydF4y2Ba+gydF4y2BaclgydF4y2Ba−gydF4y2Ba-共转运蛋白NKCC1 (SLC12A2)。NKCC1在人RH30横纹肌肉瘤细胞中共表达后与Sgcg共定位,其细胞质结构域在免疫沉淀后从细胞裂解物中消除Sgcg,洗涤剂渗透后与Sgcg共定位。在体内,NKCC1定位于邻近costameres的dystrophin复合物。布美他尼在离体肌肉中抑制NKCC1共转运体活性减少了sc依赖的,应变诱导的细胞外信号调节激酶1和2磷酸化的增加(ERK1/2)。硅分析表明,候选SC互作因子可能与存活信号通路(包括p53、雌激素受体和TRIM25)相互作用。gydF4y2Ba
结论gydF4y2Ba
结果表明NKCC1是一种新的sc相关信号蛋白。此外,其他候选SC相互作用体的身份提示了SC和NKCC1以及其他Sgcg相互作用体(如膜-细胞骨架连接蛋白大绒毛蛋白)可能调节激酶-和Ca的方式gydF4y2Ba++gydF4y2Ba骨骼肌中-介导的生存信号。gydF4y2Ba
背景gydF4y2Ba
肌萎缩蛋白糖蛋白复合物(DGC)是一种主要的肌层复合物,将细胞外基质(ECM)连接到细胞内肌动蛋白细胞骨架[gydF4y2Ba1gydF4y2Ba,gydF4y2Ba2gydF4y2Ba].连同整合素相关的局灶黏附复合物[gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba4gydF4y2Ba], DGC稳定细胞膜,感知机械应力,并通过包括磷酸化信号激酶在内的信号蛋白向细胞核传递“由外而内”的信息[gydF4y2Ba5gydF4y2Ba,gydF4y2Ba6gydF4y2Ba].DGC与肌动蛋白的主要连接是通过肌营养不良蛋白,肌营养不良蛋白将肌动蛋白细胞骨架与肌营养不良聚糖连接起来,进而在ECM中结合层粘连蛋白[gydF4y2Ba1gydF4y2Ba,gydF4y2Ba2gydF4y2Ba].肌聚糖复合物(SC)是DGC的一个亚复合物,由骨骼肌中的α-、β-、δ-和γ-肌聚糖(Sgca、Sgcb、Sgcd、Sgcg)组成[gydF4y2Ba7gydF4y2Ba].这些蛋白质形成异质四聚体,每个都有一个短的细胞内结构域,一个单一的跨膜α-螺旋结构域和一个大的细胞外结构域。肌层DGC蛋白集中在与t小管口部相关的costameres,含有大量信号蛋白[gydF4y2Ba2gydF4y2Ba,gydF4y2Ba8gydF4y2Ba,gydF4y2Ba9gydF4y2Ba,gydF4y2Ba10gydF4y2Ba,gydF4y2Ba11gydF4y2Ba,gydF4y2Ba12gydF4y2Ba,gydF4y2Ba13gydF4y2Ba].gydF4y2Ba
许多DGC蛋白的缺乏是人类肌肉营养不良症的原因,其特征是长胞体紊乱、进行性肌肉损失和寿命缩短[gydF4y2Ba14gydF4y2Ba,gydF4y2Ba15gydF4y2Ba].人类或小鼠中任何SC蛋白的缺失都会导致整个亚复合物的显著减少,并导致肢体带性肌肉营养不良(LGMD) [gydF4y2Ba15gydF4y2Ba].lgmd的特征是严重的病理,包括血清肌酸激酶水平升高,肌肉变性和再生周期,以及广泛的纤维化,但也有不同的机械脆弱性[gydF4y2Ba16gydF4y2Ba,gydF4y2Ba17gydF4y2Ba].缺乏功能性SC的小鼠通过丝裂原激活蛋白激酶(MAPK)显示信号改变,包括细胞外信号调节激酶1和2 (ERK1/2) [gydF4y2Ba18gydF4y2Ba,gydF4y2Ba19gydF4y2Ba,gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba21gydF4y2Ba]和p38 [gydF4y2Ba22gydF4y2Ba],以及细胞内钙离子水平的增加[gydF4y2Ba23gydF4y2Ba]发生在骨骼肌偏心收缩(ECC)期间。虽然信号通路尚未阐明,但Sgcg酪氨酸-6对于磷酸化ERK1/2水平的sc依赖性变化是必需的[gydF4y2Ba18gydF4y2Ba,gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba24gydF4y2Ba],而Sgcg-Y6突变与严重的自体隐性肌营养不良有关(在[gydF4y2Ba5gydF4y2Ba])。酵母双杂交相互作用子已被描述为四种SC蛋白的胞质n端[gydF4y2Ba25gydF4y2Ba,gydF4y2Ba26gydF4y2Ba],但蛋白质组学分析一直被肌肉中这些蛋白质的相对稀缺所困扰。gydF4y2Ba
一个候选的互动伙伴是archvillin [gydF4y2Ba27gydF4y2Ba],是一种直接与营养不良蛋白结合的膜相关细胞质蛋白,在酵母双杂交实验中与Sgcg相互作用,是人类肌肉结构完整性所必需的[gydF4y2Ba26gydF4y2Ba,gydF4y2Ba28gydF4y2Ba].Archvillin与肌肉中erk1 /2调节的生存信号有关[gydF4y2Ba29gydF4y2Ba], Sgcg也是如此。平滑肌大绒毛蛋白支架B-Raf和ERK1/2促进ERK信号通路[gydF4y2Ba30.gydF4y2Ba].在骨骼肌中,Sgcg在ECC后调节大粗蛋白与P-ERK1/2的关联,在缺乏Sgcg或肌营养不良蛋白时消融,并导致基础P-ERK1/2升高,主动机械扰动后核P-ERK1/2升高,以及对被动拉伸的非耦合信号响应[gydF4y2Ba26gydF4y2Ba].一种非肌肉异构体(超级绒毛,SV1),由与大绒毛相同的Svil基因编码[gydF4y2Ba27gydF4y2Ba,gydF4y2Ba31gydF4y2Ba],调节局灶性黏附形成和细胞存活[gydF4y2Ba32gydF4y2Ba,gydF4y2Ba33gydF4y2Ba,gydF4y2Ba34gydF4y2Ba].gydF4y2Ba
虽然Sgcg和大绒毛蛋白协同调节肌肉中的机械信号,但它为其他直接或间接蛋白质相互作用体参与这些作用提供了可能性。为了寻找这种Sgcg相关蛋白,我们开发了一种中等通量的方法来进行Sgcg和其他肌层蛋白的co-IPs。通过LC - MS-MS分析单只小鼠肌肉中含有和不含SG复合物的co-IPs,我们确定了16种新的Sgcg相互作用体。我们证实了Sgcg N端与大绒毛蛋白c端直接结合,并证明了SC与Na的N端和c端细胞质畴的相互作用gydF4y2Ba+gydF4y2Ba- kgydF4y2Ba+gydF4y2Ba2氯gydF4y2Ba−gydF4y2Ba转运蛋白(NKCC1)。我们还首次报道了NKCC1免疫荧光与在肌膜处的costameric dystrophin重叠,并且NKCC1共转运体活性是ecc诱导的激活ERK增加所必需的gydF4y2BaSgcggydF4y2Ba−−/gydF4y2Ba老鼠的肌肉。这些结果是第一次将NKCC1定位在肌肉costameres或附近,并将该通道与sg介导的信号传导联系起来。gydF4y2Ba
方法gydF4y2Ba
亲和纯化兔多克隆抗-γ-肌聚糖和抗大反派蛋白gydF4y2Ba
针对小鼠γ-肌聚糖(Sgcg, NCBI参考序列NP_036022.1)细胞外残基72-290和小鼠大粘蛋白(mAV, Swiss Protein Q8K463.1)氨基酸121-568的兔多克隆抗体是在Cocalico Biologicals, Inc. (Stevens, PA)针对细菌表达的蛋白质生成的。亲和纯化采用含有相应的gst标记蛋白的色谱柱和先前详细描述的针对人类超级绒毛蛋白的高亲和性抗体的方案[gydF4y2Ba35gydF4y2Ba].经过一系列严格的洗涤后,高亲和度抗体用4.5 M MgCl从共价结合的免疫原柱中洗脱gydF4y2Ba2gydF4y2Ba, 72.5 mM Tris-HCl pH 6.0-7.0。PCR模板为Elizabeth McNally博士的小鼠Sgcg质粒[gydF4y2Ba36gydF4y2Ba]和egfp标记的mAV质粒[gydF4y2Ba27gydF4y2Ba),分别。PCR引物包括用于定向限制性克隆的下划线位点,如附加文件所示gydF4y2Ba1gydF4y2Ba,补充表S1。PCR产物使用Pfu Turbo DNA聚合酶(Agilent Technologies, Santa Clara, CA)根据制造商说明生成,凝胶纯化,克隆到TOPO-pCR2.1载体(ThermoFisher Scientific, Waltham, MA),并通过DNA测序进行验证。Sgcg和mAV的编码序列从双重消化的载体中恢复,并连接到相同消化的pGEX-6P-1 (Sigma-Aldrich, St. Louis, MO)。可溶性GST-mAV从Rosetta 2(DE3)pLysS化学活性细菌(EMD-Millipore-Sigma, Burlington, MA)中分离出来,用0.2 mM异丙基b- d -巯基半乳糖吡喃苷诱导过夜,并用谷胱甘肽- sepharose™(Sigma-Aldrich)纯化。用PreScission蛋白酶(Sigma-Aldrich)裂解生成~ 26-kDa mAV免疫原,透析去除残留的谷胱甘肽,用第二谷胱甘肽- sepharose柱去除GST纯化,然后在15%丙烯酰胺sds -凝胶上电泳[gydF4y2Ba37gydF4y2Ba].由于GST-Sgcg被纳入包涵体中,且尿素复性后分裂不良,通过克隆his标记SgcggydF4y2BaBamHIgydF4y2Ba而且gydF4y2BaEcoRIgydF4y2BaDNA片段进入双切pET-30a载体(Sigma-Aldrich)。尿素溶解的His-Sgcg在Ni-NTA琼脂糖柱上纯化(Qiagen, Germantown, MD),如所述[gydF4y2Ba38gydF4y2Ba],在柱缓冲液(7 M尿素,5 mM甘氨酸,50 mM Tris-HCl, pH 8.0, 0.3 M NaCl, 0.5 mM DTT, 1 mM PMSF)中,以10-250 mM组氨酸阶梯梯度的50-100 mM组氨酸洗脱。~ 29-kDa His-Sgcg经1 mM DTT、PBS、pH 7.4透析后仍可溶解,无需进一步纯化即可作为免疫原。增强兔子,直到免疫印迹上观察到高滴度,每个抗体都用相应的gst标记蛋白与cnbr激活的Sepharose共价结合(Sigma-Aldrich, C9142) [gydF4y2Ba35gydF4y2Ba].亲和纯化后,兔抗mav抗体按1:5000 - 1:10000进行免疫印迹(IB),兔抗sgcg按1:5000进行IB,兔抗sgcg按1:200进行免疫荧光显微镜(IF)。gydF4y2Ba
商业的抗体gydF4y2Ba
稀释是指用于IB、IF和免疫沉淀(IP)的稀释。小鼠单克隆抗ha - tag (6E2, #2367;IB: 1:1500, IF: 1:20 00)和抗dykddddk /Flag表位(9A3, #8146;IB: 1:1000, IF: 1:20 00)抗体来自Cell Signaling Technologies (Beverly, MA)。从Developmental Studies hybridoma Bank (Iowa City, IA)获得小鼠单克隆杂交瘤上清,用于染色抗肌萎缩蛋白(MANDRA1, 7A10, IB: 1:100;Mandys1, 3b7,如果1:10)[gydF4y2Ba39gydF4y2Ba], α-肌聚糖(IVD3(1)A9;IB 1:50), β- dysstroglycan (MANDAG1 (7A11);IB 1:200),收缩肌球蛋白II (A4.1025;依1:100)[gydF4y2Ba40gydF4y2Ba,gydF4y2Ba41gydF4y2Ba],肌钙蛋白T (JLT12;IB 1:300)和SERCA1 (CaF2-5D2;IB 1:70)。兔单克隆抗ha (C29F4, #3724;IB: 1:1000, IP: 18 μl/60 μl的Dynabeads)和亲和纯化兔多克隆抗dykddddk (#2368;抗体IB: 1:1000, IP: 18 μl / 60 μl)来自Cell Signaling Technologies公司。兔抗pp1 β单克隆抗体来自Abcam (#ab53315, Cambridge, MA, USA;Ib: 1:1000,如果:1:100)。亲和纯化兔MYPT2多克隆抗体(#13366-1-AP;Ib: 1:100), nkcc1 (# 13884-1-ap; IB: 1:1000, IF: 1:500) and Sgcg (#18102-1-AP; IB: 1:1000, IF: 1:100) were purchased from Proteintech Group Inc. (Rosemont, IL). Other rabbit polyclonal antibodies were anti-PP1β (#LS-C482256, Life Span BioSciences Inc., Seattle, WA; IB: 1:500), anti-NKCC1 (#ANT-071, Alomone Labs, Radassah Einkerem, Jerusalem, Israel; IB: 1:500, IF: 1:50), and anti-ERK1/2 (#ABS44, EMD Millipore Sigma; IB: 1:1000). Isotype-specific control antibodies were rabbit IgG (EMD-Millipore #12-370) and mouse IgG2a (#401502, BioLegend, San Diego, CA). For chemiluminescence detection in IB, we used horseradish peroxidase-conjugated donkey anti-mouse (#715-035-150) and donkey anti-rabbit (#711-035-152) secondary antibodies from Jackson ImmunoResearch (West Grove, PA) at 1:20,000 dilution. IB with near-infrared fluorescent detection used primary antibodies from Cell Signaling Technology against phospho-ERK1/2 (#9101; 1:2000) and total-ERK1/2 (#9102; 1:2000). Primary antibodies against NKCC1 were rabbit T-NKCC (1:2000, #13884-1-AP; Proteintech) and sheep polyclonal antibodies against P-NKCC1: phospho Thr 203, Thr 207, Thr 212 (IB: 1:1000, #S763B) and phospho Thr 212, Thr 217 (IB: 1:1000, #S603D), both from the MRC Protein Phosphorylation and Ubiquitylation Unit, University of Dundee, (United Kingdom). Secondary antibodies (#925-68071, anti-rabbit and #925-32214, anti-mouse, both 1:15,000) were from Li-Cor Biosciences (Lincoln, NE). IF signals from transfected RH30 cells were visualized with goat-anti-mouse Alexafluor 350 (#A 21049) and goat anti-rabbit Alexafluor 568 (#A11036) conjugated antibodies, and the actin cytoskeleton was stained with Alexafluor 350- or 488-conjugated phalloidin (all from ThermoFisher Scientific, diluted 1:500). Nuclei were stained using 4,6-diamidine-2-phenylindole dihydrochloride (DAPI, Sigma-Aldrich).
动物模型gydF4y2Ba
本研究中使用的所有动物均按照佛罗里达大学和马萨诸塞大学医学院动物护理和使用委员会制定的标准进行饲养、安置和处理。基因突变为零的小鼠gydF4y2BaSgcggydF4y2Ba基因的产生、繁殖和表型,如前所述[gydF4y2Ba16gydF4y2Ba].小鼠缺乏长肌肉特异性大绒毛(SV2)剪接形式编码gydF4y2BaSvilgydF4y2Ba基因由Ingenious靶向实验室(Ronkonkoma, NY)生成。这种突变的生化和功能后果正在研究中,将在其他地方详细描述。简单地说,引导rna 5 ' - tgtagggcgatccaaagaagagag -3 '和5 ' - tcttcaatgcttacctggctcg -3 '和CRISPR/Cas9被用于生成靶向载体,其中609-nt外显子3在gydF4y2BaSvilgydF4y2Ba基因,在最初的cDNA克隆论文中称为外显子2 [gydF4y2Ba27gydF4y2Ba],由两侧有759 bp和838 bp基因组序列的ivNeo选择盒所取代[gydF4y2Ba42gydF4y2Ba].目标结构通过DNA测序验证,与线性化gydF4y2BaNotIgydF4y2Ba,电穿孔进入C57BL/6胚胎干细胞。将靶向的C57BL/6 FLP ES细胞微量注射到Balb/c囊胚中,将得到的具有高比例黑色毛色的嵌合体与C57BL/6 (WT)小鼠交配,生成种系Neo-deleted小鼠,通过PCR筛选尾DNA进行鉴定。将Neo-deleted小鼠与C57BL/6NCrl小鼠(Charles River Laboratories, Wilmington, MA)进行4次回交,并通过PCR筛选FLP转基因基因的缺失和适当的整合gydF4y2BaSvilgydF4y2Ba轨迹。兔抗大绒毛蛋白n端序列多克隆抗体免疫印迹证实骨骼肌中全长大绒毛蛋白的缺失(附加文件)gydF4y2Ba2gydF4y2Ba,图S1A)。gydF4y2Ba
小鼠肌肉细胞膜gydF4y2Ba
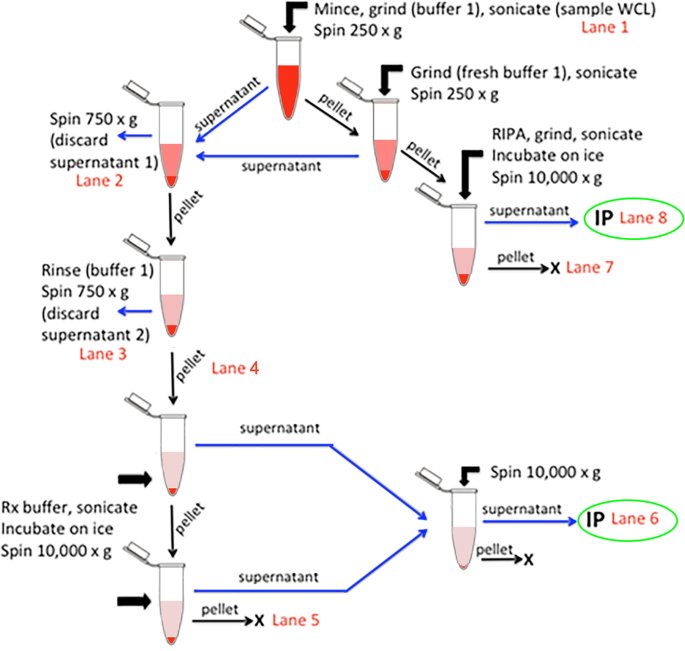
将小鼠腓肠肌解剖并切除多余组织,切成2块~ 100mg(湿组织块),在液氮中快速冷冻。为了准备co-IP,一块冷冻的肠肠肌在室温下用剃须刀片在称量纸上非常细地切碎,同时解冻,转移到1.5 ml的塑料砂浆管(#749520-0090,kimbl - kontes, DWK生命科学,米尔维尔,新泽西州),并根据一种新方法进行处理,该方法改编自用于检测葡萄糖转运蛋白4 [gydF4y2Ba43gydF4y2Ba],以及其他肌肉膜蛋白[gydF4y2Ba44gydF4y2Ba,gydF4y2Ba45gydF4y2Ba,gydF4y2Ba46gydF4y2Ba,gydF4y2Ba47gydF4y2Ba,gydF4y2Ba48gydF4y2Ba,gydF4y2Ba49gydF4y2Ba(图。gydF4y2Ba1gydF4y2Ba).用900 μl Buffer 1 (50 mM Tris, pH 8.0, 0.5 mM DTT, 0.1% NP-40, 10%甘油和蛋白酶抑制剂鸡尾酒(Sigma-Aldrich #P8340)覆盖切碎的肌肉,用蓝色塑料kimbl - kontes研锤手动研磨5-10 s。一次最多处理4个样品,每个步骤之间都保存在冰上。当一个组中的所有样品被研磨后,立即用Branson Sonifier Cell Disrupter (Emerson Electric, Danbury, CT)上的微探针对它们进行30个脉冲超声处理,占空比设置为25%,输出~ 1.5。每个样品取100 μl进行凝胶分析(Muscle Lysate, WCL)。剩余体积250×离心gydF4y2BaggydF4y2Ba在4℃下加热1分钟。将浑浊的上清液移至1.5 ml新鲜聚丙烯微离心管中,在剩余颗粒中加入450 μl Buffer 1,再次手动研磨5-10 s并超声处理。再以250×离心1 mingydF4y2BaggydF4y2Ba,将同样浑浊的上清液与上清液混合,在4°C下750×离心10 mingydF4y2BaggydF4y2Ba.剩余250×gydF4y2BaggydF4y2Ba在2倍RIPA1缓冲液(100 mM MOPS, pH 7.5, 0.3 M NaCl, 2% IGEPAL CA-630, 1%脱氧胆酸,0.2% SDS,外加蛋白酶抑制剂)中均质,并在冰中孵育,同时进一步处理其他馏分;该潜伏期在超声检查前≥25分钟(见下文)。上清液750×gydF4y2BaggydF4y2Ba去除旋液(丢弃上清液1),剩余的膜球(白色且略蓬松)在450 μl Buffer 1中涡旋重悬。膜在750×下再次沉淀gydF4y2BaggydF4y2Ba去除上清液(丢弃上清液2),在600 μl冷Rx Buffer (25 mM MOPS, pH 7.5, 0.1 M NaCl, 0.5 M KCL, 10 mM MgCl)中进行短暂涡旋重悬gydF4y2Ba2gydF4y2Ba, 5毫米ATP(新鲜制作),60毫米辛基吡葡糖甙,0.5% IGEPAL CA-630, 10%甘油,蛋白酶抑制剂)。然后对膜进行三次超声处理,如图所示,中间在冰上孵育1分钟,直到悬浮液略呈珍珠色。来自ripa1溶解膜的颗粒也在此期间进行了一次超声处理,并且在最后一次超声处理后将两个馏分在冰上孵育10分钟。所有试管在10000 ×下离心10 mingydF4y2BaggydF4y2Ba上清液移至新鲜管中。Rx膜颗粒在400 μl Rx缓冲液中短暂涡旋悬吊,超声一次,10,000×离心gydF4y2BaggydF4y2Ba将最后的Rx颗粒重新悬浮在等体积的2倍Laemmli样品缓冲液[gydF4y2Ba37gydF4y2Ba].将两种Rx上清液结合,最后在10000 ×下离心gydF4y2BaggydF4y2Ba将RIPA1颗粒重悬在与相应RIPA上清体积相当的Laemmli样品缓冲液中。gydF4y2Ba
小鼠肌肉快速富集膜的流程图。骨骼肌的分馏如图所示,并在“gydF4y2Ba方法gydF4y2BaLane数是指对总蛋白和免疫印迹的肌层蛋白的分析,如图所示。gydF4y2Ba2gydF4y2Ba.用抗sgcg抗体对两种Rx缓冲液中的提取物进行免疫沉淀(IP,绿色椭圆形)(高盐,Rx缓冲液中0.5% IGEPAL CA-630;6通道)或RIPA缓冲液(1% IGEPAL CA-630, 0.5%脱氧胆酸盐,0.1% SDS;8). WCL,全细胞裂解液gydF4y2Ba
光和共聚焦显微镜gydF4y2Ba
提取肌膜的相位图像使用徕卡DMI 6000B倒置荧光显微镜,徕卡DFC 365 FX相机,徕卡HCX PL Fluotar 10x/0.30 PH1镜头,徕卡Application Suite 3.2.0.9625软件(徕卡微系统,Exton, PA)。免疫荧光图像使用Leica HC PL APO 63x/1.40-0.60油镜头在同一系统上拍摄。在徕卡SP5 (II) AOBS激光扫描共聚焦显微镜上,HCX PL APO CS 40.0×/1.30油紫外镜头,使用徕卡Application Suite Advanced Fluorescence (LAS-AF) 2.7.3.9723软件(徕卡Microsystems CMS GmbH, Mannheim, Germany)获得荧光染色的肌肉切片图像。光学gydF4y2BazgydF4y2Ba通过肌肉样品的每个颜色通道依次获得0.29 μm的-截面。选择长度不超过1.2 μm的顺序切片gydF4y2BazgydF4y2Ba使用软件中的最大强度投影功能对-厚度进行处理。所有图像导出为TIF文件,然后使用Adobe Photoshop CS3软件(Adobe Systems, Inc., San Jose, CA)进行统一调整和组装。gydF4y2Ba
免疫印迹和分析gydF4y2Ba
蛋白质被电转移到Amersham™protan™0.45 μm硝化纤维膜上过夜(GE医疗生命科学,Marlborough, MA;# 10600002)。化学发光信号通过SuperSignal West Pico或Femto试剂(ThermoFisher Scientific)在Chemidoc MP成像系统上进行可视化,使用ImageLab™软件,4.1版(Bio-Rad生命科学研究,Hercules, CA)。用GelQuant测定蛋白条带密度。Net(版本1.7.8,BiochemLabSolutions.com;加州大学旧金山分校的软件。使用Microsoft Excel (Microsoft, Redmond, WA)计算未绑定与输入信号的比值,并使用GraphPad Prism 8.4.0软件(GraphPad software, L.L.C, La Jolla, CA)进行分析。多个数据集的比较使用标准或非参数单因素方差分析进行,如图图例所示。使用Adobe Photoshop CS6软件对免疫印迹进行统一调整和组装。gydF4y2Ba
对于P/T-ERK1/2和P/T-NKCC1免疫印迹,gydF4y2Ba指长伸肌gydF4y2Ba(EDL)肌肉和gydF4y2Ba胫骨前gydF4y2Ba(TA)肌肉在干冰中使用研臼和研杵磨粉,并在添加PMSF和蛋白酶抑制剂的RIPA2缓冲液中均质(#P8340;Sigma-Aldrich)和磷酸酶(#P5726;Sigma-Aldrich)。匀浆在冰上孵育60分钟,15,000×离心gydF4y2BaggydF4y2Ba肌肉裂解物的蛋白质定量由Bradford试验(#1863028;赛默飞世尔科学公司)。对于P/T-ERK1/2分析,EDL裂解物(20 μg蛋白质)装入4-12%的bi - tris Midi蛋白凝胶(#WG1402A,赛默飞世尔科学公司)并电转移到硝化纤维中。每个膜在室温下用5% BSA (BP9703100,赛默飞世尔科学公司)在TBS中封闭90分钟。印迹用抗磷酸化erk1 /2和抗总erk1 /2一抗在4℃孵育过夜,洗净并在室温下用二抗孵育90分钟(锂- cor Biosciences)。gydF4y2Ba
对于P/T-NKCC1分析,TA裂解物(20 μg蛋白)装入3-8% Bis-Tris Gel 1.0 mm (WG1002BOX;然后转移到Immobilon-FL PVDF,孔隙率0.45 μm (IPFL00010, EMD-Millipore),在40 mA的条件下,在10%甲醇、0.01% SDS、0.1% NuPage抗氧化剂中浸泡16小时(NP0005, Thermo Fisher Scientific)。每个膜在室温下用5% BSA在TBS中阻塞120分钟。用10 μg/ml的非磷多肽预孵育30 min。洗涤后,印迹在室温下与二抗(#925-68071,抗兔;# 925 - 32214抗体/羊;都是1:15 000)来自Li-Cor生物科学公司。清洗后,用奥德赛CLx成像系统(Li-Cor Biosciences)扫描所有印迹。带强度由附带的软件Image Studio v.5.2 (Li-Cor Biosciences)自动确定。gydF4y2Ba
来自肌肉膜的Co-IPsgydF4y2Ba
肌肉裂解物的每个IP,每50 μl Dynabeads Protein A使用15 μg抗体(ThermoFisher Scientific;# 10001 d)。蛋白a结合IgG使用20 mM二甲吡甲酯(DMP, Pierce/ThermoFisher Scientific)交联,如前所述[gydF4y2Ba35gydF4y2Ba].用等量不含KCL或ATP的Rx缓冲液(25 mM MOPS, pH 7.5, 0.1 M NaCl, 10 mM MgCl)稀释Rx膜裂解液gydF4y2Ba2gydF4y2Ba, 60 mM辛基吡喃葡萄糖苷,0.5% IGEPAL CA-630, 10%甘油),RIPA1提取液用RIPA1缓冲液稀释至750 μl。稀释后的Rx和RIPA1裂解液均用20 μl Dynabeads Protein A (Rx或RIPA1缓冲液中预冲洗)在4℃下清除30 min。在处理每个IP之前,删除一个100 μl的“输入”。将裂解物平均分配给IP抗体(RIPA1每个200 μl, Rx每个300 μl),在4℃温和旋转下孵育2 h。磁法收集动力薄膜,将未结合的上清液转移到新鲜试管中。用500 μl低温0.5 × TBST (5 mM Tris, pH 7.5, 83 mM NaCl, 0.05% Tween-20)漂洗5次;在第二次冲洗时,珠子被转移到新鲜的管子中。免疫沉淀蛋白在缺乏二硫苏糖醇(DTT)的Laemmli样品缓冲液中在非还原条件下洗脱[gydF4y2Ba37gydF4y2Ba],洗脱液转移到新鲜试管中。gydF4y2Ba
凝胶蛋白消化和LC-MS/MS分析gydF4y2Ba
IPs和分析使用每种抗体和肌肉基因型的三份生物样本进行。gydF4y2Ba腓肠肌gydF4y2Ba含有SC的肌肉来自C57BL/6 (WT)小鼠和一种新的纯合子小鼠品系,用于基因切除大的5 '编码外显子gydF4y2BaSvilgydF4y2Ba基因(gydF4y2BaSvilgydF4y2Ba−−/gydF4y2Ba).阴性对照为gydF4y2Ba腓肠肌gydF4y2Ba肌肉的gydF4y2BaSgcggydF4y2Ba−−/gydF4y2Ba老鼠(gydF4y2Ba16gydF4y2Ba]和含有非特异性兔IgG的IPs。在免疫沉淀样品中加入DTT(终浓度为2 mM),然后电泳成10% Laemmli溶解凝胶[gydF4y2Ba37gydF4y2Ba],不加堆叠凝胶,直到染色前距离装入孔底部约1厘米;至少有两个空白井分离样品。然后使用Invitrogen Novex胶体蓝染色试剂盒,根据制造商的协议(ThermoFisher Scientific;# LC6025)。每个IP样品被切割成单个凝胶片。凝胶片经DTT还原和碘乙酰胺烷基化后进行凝胶内胰蛋白酶消化。从凝胶中洗脱的肽经冻干后,在5%乙腈和0.1% (v/v)三氟乙酸(TFA) 25 μl中重新悬浮。注射量为3 μl,肽由Waters nanoAcquity UPLC (Waters Corp., Milford, MA)在5%乙腈(0.1%甲酸(v/v))中以4.0 μl/min的速度加载到100 μm id的熔融二氧化硅预柱(Kasil熔块)中,填料为2厘米厚的5 μm (200Å) Magic C18AQ(布鲁克- michrom, Billerica, MA)。然后,以300 nl/min的速度,通过75 μm id的重力拉拔分析柱,填充25 cm的3 μm (100Å) Magic C18AQ,从5-35%B(流动相a,水+ 0.1% (v/v)甲酸;流动相B,乙腈+ 0.1% (v/v)甲酸)超过90分钟。离子通过液体结电极正电喷雾电离引入Thermo Scientific Q Exactive混合质谱仪。 Mass spectra were acquired overm / zgydF4y2Ba300-1750, 70000分辨率(gydF4y2Bam / zgydF4y2Ba200)使用AGC(自动增益控制)目标离子人口1e6。数据依赖采集选择了前10个最丰富的前驱体离子进行串联质谱,使用高能量c陷阱解离(HCD),隔离宽度为1.6 Da,标准化碰撞能量为27,最大离子填充时间为110 ms, AGC目标离子居群为1e5。串联质谱在17,500 (gydF4y2Bam / zgydF4y2Ba200)决议。gydF4y2Ba
蛋白质组学数据分析gydF4y2Ba
使用Proteome Discoverer(版本1.4,Thermo Scientific)对原始数据文件进行峰值处理,然后使用Mascot(版本2.5,Matrix Science, Boston, MA)对SwissProt进行识别gydF4y2Ba亩骶gydF4y2Ba数据库(下载04/2018)。搜索参数包括胰蛋白酶的完全特异性,最多2个缺失的裂解,半胱氨酸卡酰胺甲基化的固定修饰,蛋氨酸氧化的可变修饰,谷氨酰胺转化为焦谷氨酸,蛋白质n端乙酰化。分配使用前体的质量公差为10ppm,片段的质量公差为0.05 Da。所有未经过滤的搜索结果均由Scaffold软件(版本4.4.4,Proteome software, Inc., Portland)处理。OR),利用跨蛋白质组学管道(系统生物学研究所,西雅图,华盛顿州)。Rx提取物和RIPA1提取物分别进行分析。对于这两种提取物,多肽的阈值设置为80% (Rx提取物的错误发现率(FDR)为0.45%,RIPA提取物为0.53%),蛋白质的阈值设置为99%(最少2个肽;Rx提取物,FDR 20.0%;RIPA提取物,FDR 12.0%)。在Scaffold软件中进行定量比较,使用归一化加权光谱,具有ANOVA显著性水平gydF4y2BaPgydF4y2Ba无后测< 0.05。应用Benjamini-Hochberg多重测试校正排除了所有Rx缓冲相互作用物和β-肌聚糖以及所有蛋白的显著性gydF4y2BaPgydF4y2Ba值在RIPA1缓冲区,但整体gydF4y2BaPgydF4y2Ba价值观没有改变。互动演员按增加顺序排列gydF4y2BaPgydF4y2Bavalue from both Rx(附加文件gydF4y2Ba3.gydF4y2Ba,表S2)和RIPA(附加文件gydF4y2Ba4gydF4y2Ba(表S3)为候选Sgcg交互器提取并手动编辑,如下所述。gydF4y2Ba
特异性与Sgcg共免疫沉积的蛋白质被定义为在C57BL/6野生型肌肉和/或svir靶向的(gydF4y2BaSvilgydF4y2Ba−−/gydF4y2Ba)肌肉,与光谱计数相比gydF4y2BaSgcggydF4y2Ba−−/gydF4y2Ba与来自任何肌肉类型的对照IgG进行IPs光谱计数。光谱计数基于每种蛋白质的预测分子质量进行归一化。“最佳候选相互作用子”由≥3个WT或gydF4y2BaSvilgydF4y2Ba−−/gydF4y2Ba肌肉和选择的基础gydF4y2BaPgydF4y2Ba值< 0.05和定量剖面显示总归一化光谱计数增加≥2倍于两种类型的阴性对照。在大多数情况下,总归一化光谱计数大大减少gydF4y2BaSgcggydF4y2Ba−−/gydF4y2Ba用IgG对照抗体观察到少量计数。“其他候选互动者”也有gydF4y2BaPgydF4y2Ba值< 0.05,但低于2倍谱数阈值或仅在gydF4y2BaSvilgydF4y2Ba−−/gydF4y2Ba肌肉。两种蛋白(肌动蛋白、肌动蛋白)在首先减去对照IgG观察到的高背景计数时,会终止这种作用。因为肌动素和肌动素突变分别导致了LGMD, 2J型和1A型[gydF4y2Ba50gydF4y2Ba],我们将统计学显著性的分界点画在gydF4y2BaPgydF4y2Ba在这些条件下< 0.05。α-和β-肌聚糖除外,已知它们是SC [gydF4y2Ba51gydF4y2Ba],候选pp1 β结合相互作用体接近任意2倍截止点。一组f -肌动蛋白结合蛋白,例如,spectrin, dystrophin和丝蛋白C,从抗sgcg的所有三种肌肉类型中以大约相等的丰度被恢复,而不是对照IgG,并且没有进一步考虑(附加文件gydF4y2Ba3.gydF4y2Ba而且gydF4y2Ba4gydF4y2Ba;表S2和S3)。gydF4y2Ba
这种实验方法可能固有地受到残余肌动蛋白丝与IgG结合的限制[gydF4y2Ba52gydF4y2Ba],导致f -肌动蛋白结合蛋白的高背景。Co-IPs还使用针对肌动蛋白结合蛋白大反派蛋白(抗mav)的亲和纯化抗体以及WT肌肉和大反派蛋白缺失肌肉的Rx和RIPA1提取物进行。由于与兔IgG的高背景结合,没有发现与大反派蛋白相关的候选相互作用因子。gydF4y2Ba
候选Sgcg相互作用体之间的直接和间接结构和信号关系是使用匠心路径分析(IPA)路径设计软件中的Connect命令确定的,版本01-14 (Qiagen生物信息学,Redwood City, CA) Sgcg与Svil的相互作用[gydF4y2Ba26gydF4y2Ba]和NKCC1是手动添加的,并使用IPA Auto-Layout命令定位。手动添加B-Raf、MEK1/2和ERK1/2信号级联,以及它们与肌层蛋白的连接。交互器的颜色和名称使用Adobe Photoshop CS6 (Adobe系统公司)进行了清晰的处理。gydF4y2Ba
质粒gydF4y2Ba
Elizabeth McNally(西北大学范伯格医学院,芝加哥,IL)慷慨地提供了编码未标记小鼠Sgcg的质粒[gydF4y2Ba36gydF4y2Ba].Myc-DDK (Flag)标记的小鼠β- (#MR204617), δ- (#MR221060)和γ- (#MR223013)肌聚糖cdna来自OriGene技术公司(Rockville, MD),同样来自Myc-DDK标记的编码小鼠Ppp1r12b/MYPT2 (#MR226968)和小鼠紧张素2(紧张素类C1结构域含磷酸酶,isoform 1/Tenc1;# MR211954)。编码EGFP-PP1β/δ (EGFP-C1载体)的质粒由Mathieu Bollen (KU Leuven, Leuven, Belgium)通过A. J. Baucum (Indiana University- purdue University, Indianapolis, IN)获得[gydF4y2Ba53gydF4y2Ba].编码人类PP1β-EGFP的质粒(EGFP-N3载体)是Angus Lamond和Laura Trinkle-Mulcahy赠送的礼物(Addgene质粒#44223;gydF4y2Bahttp://n2t.net/addgene:44223gydF4y2Ba;RRID: Addgene_44223) [gydF4y2Ba54gydF4y2Ba].egfp -紧张素2(人类)是David Critchley和Kenneth Yamada (Addgene质粒#105298;gydF4y2Bahttp://n2t.net/addgene:105298gydF4y2Ba;RRID: Addgene_105298) [gydF4y2Ba55gydF4y2Ba].ha标记的人NKCC1 (pdDNA3.1-HA-CFP-hNKCC1 WT (NT15-H))是Biff Forbush的礼物(Addgene质粒#49077;gydF4y2Bahttp://n2t.net/addgene:49077gydF4y2Ba;RRID: Addgene_49077 (gydF4y2Ba56gydF4y2Ba])。gydF4y2Ba
GST-bSV1398-1792已被描述[gydF4y2Ba57gydF4y2Ba].在EcoRI和BamHI位点克隆的全长人Sgcg的pIRES2-EGFP载体[gydF4y2Ba58gydF4y2Ba]作为模板,构建只编码35个n端残基与c端EGFP融合的质粒。通过使用QuikChange site - directed Mutagenesis试剂盒将Leu-36转化为甘氨酸,将tir -37转化为丝氨酸,该载体首先被修改为包含内部BamHI位点(Agilent Technologies;#200519)以及附加文件中的l36y37 - bamhi -义和l36y37 - bamhi -反义引物gydF4y2Ba1gydF4y2Ba,表S1。用BamHI和NotI酶切修饰载体,将pEGFP-N3中同样酶切的EGFP盒定向连接到Sgcg细胞质结构域内,即残基1-35。然后将Sgcg1-35-EGFP载体作为模板生成hSgcg-1-35-EGFP片段,并使用Sgcg-BglII-start-For和Sgcg-EcoRI-end-Rev引物对克隆到用于his标记的pET30a载体中或克隆到pMALc5x载体中(New England BioLabs, Beverly, MA;使用Sgcg-For-EcoRV-1Met和scgc - eci -end- rev引物对进行麦芽糖结合蛋白标记。通过BamHI-NotI双摘要从pEGFPN3克隆到pET30a,通过XmnI-EcoRI双摘要从pET30a-EGFP克隆到pMALc5x, EGFP对照克隆到相同的载体。然后使用QuikChange突变试剂盒和scgc - y6a义和反义引物对将含有野生型hSgcg-1-35-EGFP的载体在tir -6位点突变为Ala。所有限制性内切酶均来自New England BioLabs (Beverly, MA)。gydF4y2Ba
具有方便酶切位点的x3 - ha标记人NKCC1合成cDNA质粒[gydF4y2Ba56gydF4y2Ba有两种修改方式。首先,我们用双限制酶切去除了编码所有跨膜结构域和大部分细胞质结构域的序列gydF4y2Ba高致病性禽流感gydF4y2Ba而且gydF4y2BaEcoRVgydF4y2Ba.然后,我们重新结扎粗端以生成3xHA-CFP- hnkcc1 -cyto,它编码3xHA-CFP标签,然后是细胞质NKCC1 n端氨基酸glu2到val141和细胞质NKCC1 c端91个残基(I-1118到S-1196) [gydF4y2Ba56gydF4y2Ba].其次,我们使用QuikChange®II XL位点定向突变试剂盒,通过PCR将TAA终止密码子插入cfp编码序列的下游,生成了编码对照3XHA-CFP蛋白的质粒(Agilent Technologies;引物HA-CFP-Stp For和HA-CFP-Stp Rev(附加文件)gydF4y2Ba1gydF4y2Ba,表S1)。所有质粒均经末端测序验证。gydF4y2Ba
细胞培养,外源表达蛋白筛选,近距离连接试验gydF4y2Ba
人RH30横纹肌肉瘤细胞(SJC-RH30, American Type Culture Collection #CRL-2061, Manassas, VA)维持在37°C和5% COgydF4y2Ba2gydF4y2Ba在rmi -1640培养基中,修改为含有2 mM L-谷氨酰胺,10 mM HEPES, 1 mM丙酮酸钠,4500 mg/L葡萄糖,1.5 g/L碳酸氢钠(#A1049101,赛默飞世尔科学公司),补充10%热灭活胎牛血清,另外2 mM L-谷氨酰胺和pens - strep。用Lipofectamine 2000(赛默飞世尔科学公司)和制造商说明书的缩小版在6厘米的培养皿中进行转染,培养皿前一天已镀好,这样细胞融合度≤60%。首先,在总浓度为0.3 μg/μl的水中制备c端myc- ddk标记的β—δ—和γ-肌聚糖cdna的等摩尔混合物。在一个6厘米的培养皿中共转染,有或没有覆盖物,然后将5 μl该混合物(1.5 μg)或1.5 μg空Flag载体对照与1.5 μg另一种哺乳动物表达质粒混合,然后在OptiMEM减毒血清培养基中稀释至250 μl(#31985,赛默飞世尔科学公司)。同时,Lipofectamine 2000每次转染10 μl,用OptiMEM稀释至250 μl。将两种溶液在室温下孵育5分钟,然后混合(每个转染盘500 μl),再在室温下孵育10分钟。将每个培养皿中的培养基替换为4.5 ml新鲜培养基,然后在每个培养皿中滴入OptiMEM中的质粒DNA复合物。然后在37°C和5% CO下孵育3 - 4小时gydF4y2Ba2gydF4y2Ba然后用5ml新鲜生长培养基替换培养基,继续孵育一夜。6孔板盖上的细胞用同样的方法培养和转染,但质粒DNA和Lipofectamine 2000用100 μl OptiMEM,每孔2 ml。转染后23 - 25小时收集细胞用于co-IP或固定用于免疫荧光或近距离连接试验(PLA)。固定方法如前所述[gydF4y2Ba59gydF4y2Ba],使用冰冷甲醇15分钟或4%多聚甲醛在CSK缓冲液(10mm PIPES, pH 6.8, 300mm蔗糖,100mm氯化钠,3mm氯化镁,1mm EGTA [gydF4y2Ba60gydF4y2Ba])冰敷30分钟。预提取实验包括在固定和免疫荧光成像之前,用0.1% Triton X-100在CSK缓冲液中在冰上处理覆盖层上的细胞4分钟,并用PBS短暂冲洗,如上所述。gydF4y2Ba
根据制造商的说明,使用Duolink In Situ Orange试剂盒(Sigma #DUO92102)进行PLA,以小鼠抗ha (Cell Signaling #2367, 1:200)和兔子抗sgcg (Proteintech #18102-AP, 1:200)作为一抗。信号反转后用手计数PLA散斑,并使用Adobe Photoshop进行~3倍放大。零斑点相关的细胞核被认为是未转染的细胞。使用GraphPad Prism进行图形和统计分析。gydF4y2Ba
Co-IPs和上清液消耗测定gydF4y2Ba
用改良的RIPA1(无SDS)提取RH30细胞后,进行标准co-IP实验和上清液消耗实验。在6 cm培养皿中,传代5至28之间的细胞按以下方法转染:(1)Myc-DDK (Flag)标记的小鼠β-、δ-、γ-肌聚糖和HA-CFP、HA-CFP- cyto或HA-CFP- nkcc1的混合物;或(2)myc -Flag标记的肌聚糖,或空的Flag载体,以及PP1β-EGFP, EGFP- PP1β或EGFP。转染细胞培养24 h后,用350 μl预冷冻的改良RIPA1缓冲液(无SDS)加蛋白酶和磷酸酶抑制剂(# P8340, P2850, P5726, Sigma-Aldrich)冰提15 min,细胞融合50-60%。刮取提取物,转移到1.5 ml聚丙烯离心管中,用布兰森声波仪超声25脉冲,如上所示,18000 ×离心gydF4y2BaggydF4y2Ba在4℃下放置10分钟。将得到的上清液移至1.5 ml的新鲜试管中,用于co-IPs或上清液消耗试验。gydF4y2Ba
对于RH30细胞裂解物中ha标记蛋白的实验,Protein A Dynabeads与兔抗ha单克隆抗体C29F4(用于HA-CFP-NKCC1实验)或兔多克隆抗flag在室温下孵育1小时。珠子用RIPA1缓冲液冲洗一次,并分成相等的分数。从每个试管中取出漂洗液,将珠粒重悬于每个细胞提取物300 μl中,在4℃下旋转孵育1 h。在涉及EGFP的实验中,每个IP使用25 μl GFP-Trap Dynabeads(产品代码gtd, Chromotek Inc., Islandia, NY, USA),在加入细胞提取物之前用冰冷的RIPA1缓冲液清洗一次。gydF4y2Ba
Co-IPs和上清液消耗试验同样进行,不同之处是Co-IPs侧重于颗粒中蛋白质的数量(“结合”),而上清液消耗试验侧重于离心前后(“输入”)蛋白质浓度的差异。后一种方法可以更好地检测低亲和度相互作用[gydF4y2Ba61gydF4y2Ba].在上清液消耗实验中,将20 μl抗ha抗体结合珠或25 μl GFP-Trap Dynabeads与每个细胞提取物300 μl在4℃下混合1 h。取100 μl“输入”样品,使用窄孔BioRad管(#223-9502)和摆动斗转子,以800×的速度将每种混合物的剩余部分快速沉积在含20%糖的RIPA1缓冲垫中gydF4y2BaggydF4y2Ba取前100 μl为“脱绑”样品。输入和未绑定的样品在12%的sds -聚丙烯酰胺凝胶上分解并电印迹。gydF4y2Ba
上清液消耗测定[gydF4y2Ba61gydF4y2Ba]也用纯化的、重组的n端标记的大绒毛蛋白c端和c端标记的Sgcg细胞质畴进行表达。GST-bSV1398-1792蛋白与小鼠和人类大恶棍蛋白相应序列的同源性分别为94.43%和96.96%(来自Clustal2.1, Conway Institute UCD, Dublin, Ireland),其制备方法如上所述[gydF4y2Ba57gydF4y2Ba].所有重组EGFP蛋白均在Rosetta 2 pLyS细菌(#71400,Novagen/Sigma-Aldrich)中制备,如抗原生产所述。根据制造商的说明,his - egfp标记的蛋白通过NiNTA琼脂糖(Qiagen)纯化,mbp标记的蛋白通过直链淀粉纯化(New England BioLabs)。我们从两组蛋白质中去除标签(His标签为凝血酶消化,MBP为Xa因子蛋白水解),并分别用NiNTA琼脂糖或离子交换层析重新纯化它们。GST-bSV-1398-1792与EGFP蛋白以250 μl的总体积混合,在4℃旋转孵育30 min后加入25 μl谷胱甘肽- sepharose珠粒(#17-0756-01,GE Healthcare)。再孵育30 min后,取100 μl总浆液作为“输入”样品;其余的被装载在25%的蔗糖垫在一个窄直径管和离心,如上所述。输入和未绑定的样品在12%的sds -聚丙烯酰胺凝胶上分解并电印迹。gydF4y2Ba
肌肉免疫染色gydF4y2Ba
为了确定NKCC1在EDL肌肉中的定位,从C57和EDL肌肉中获得10 μm冷冻切片gydF4y2BaSgcggydF4y2Ba−−/gydF4y2Ba老鼠。纵向和横截面均被利用。切片在PBS中清洗三次,每次清洗10分钟。切片在4%多聚甲醛的PBS中固定5分钟,然后用0.5% Triton-X, PBS渗透。在室温下用5%牛血清白蛋白(BSA)在PBS中阻塞1小时后,切片在4℃下用5%牛血清白蛋白稀释的抗肌萎缩蛋白的一抗(mandys1,3b7)孵育过夜[gydF4y2Ba39gydF4y2Ba]和NKCC1 (1:500 NKCC1, rabbit pAb 13884-1-AP;Proteintech)或单独用5% BSA作为阴性对照。然后切片在PBS中洗涤三次,每次洗涤10分钟,并在室温黑暗中与5% BSA稀释的二抗(1:10 000,Alexafluor 488 IgG抗小鼠(#A11029)孵育1小时;1:1000 Alexafluor 568 IgG抗兔(#A11036) (Invitrogen)。切片在黑暗中再次清洗(PBS 3次,每次10分钟),风干,并涂上安装剂(ProLongTM Diamond Antifade with Dapi, Cat#P36962,赛默飞世尔科学公司)和封面。gydF4y2Ba
体内抑制NKCC1gydF4y2Ba
EDL肌肉来自C57或gydF4y2BaSgcggydF4y2Ba−−/gydF4y2Ba分离出小鼠(9-14 WKS龄),并按照先前描述的方法进行肌肉力学准备[gydF4y2Ba62gydF4y2Ba].带缝合环的edl通过一个刚性钩子和一个伺服马达臂连接到800A体外肌肉装置(Aurora Scientific, Ontario, CAN)上。肌肉被放置在两个铂板电极之间,并在一个充满95% O平衡的林格溶液的Radnoti容器中gydF4y2Ba2gydF4y2Ba/ 5%股份有限公司gydF4y2Ba2gydF4y2Ba并保持在22℃。使用Aurora Scientific (Ontario, CAN)的硬件和软件(即大功率双相电流刺激器、300C双电机液位系统、数字控制器接口和DMC v5.420)控制和执行EDL刺激。在确定最佳长度(Lo)后,对肌肉进行三次150 Hz的超最大刺激,持续500 ms,间隔3分钟,以获得最大等距力(Max force)。在初始刺激完成后,用溶解于100%乙醇(终浓度50 μM布美他尼,1%乙醇)或单独使用乙醇载液(终浓度1%乙醇)处理EDLs 20-30分钟。进行第二组Max Force测量,以确定治疗后抽搐和破伤风力的潜在变化。在5分钟的休息时间后,EDLs经历了5次偏心收缩,包括在最后200 ms刺激期间10%的Lo延长,刺激之间有5分钟的休息间隔。肌肉力学之后是30分钟的等待期。然后将edl轻轻干燥,称重,快速冷冻,并在−80°C保存。对于那些处于静止状态的edl,将它们松散地固定在含有50 μM丁美他尼、1%乙醇或两者都没有的含氧Ringers溶液的培养皿中30分钟。同样,非力学edl随后被快速冷冻,并储存在−80°C下,用于未来的生化和组织学分析。gydF4y2Ba
P/T-ERK1/2和P/T-NKCC1激活检测gydF4y2Ba
EDL和TA肌肉在干冰中使用研锤和研杵磨粉,并在添加PMSF和蛋白酶抑制剂的RIPA2缓冲液中均质(P8340;Sigma-Aldrich)和磷酸酶(P5726;Sigma-Aldrich)。匀浆在冰上孵育60分钟,15,000×离心gydF4y2BaggydF4y2Ba肌肉裂解物的蛋白质定量由Bradford试验(#1863028;赛默飞世尔科学公司)。对于P/T-ERK1/2分析,EDL裂解物(20 μg蛋白质)装入4-12%的bi - tris Midi蛋白凝胶(#WG1402A,赛默飞世尔科学公司)并电转移到硝化纤维中。每个膜在室温下用5% BSA (BP9703100,赛默飞世尔科学公司)在TBS中封闭90分钟。印迹用抗磷酸化erk1 /2和抗总erk1 /2一抗在4℃孵育过夜,洗净并在室温下用二抗孵育90分钟(锂- cor Biosciences)。gydF4y2Ba
对于P/T-NKCC1测定,TA裂解物(20 μg蛋白)装入3-8% Bis-Tris凝胶1.0 mm (WG1002BOX;然后转移到Immobilon-FL PVDF,孔隙率0.45 μm (IPFL00010, EMD-Millipore),在40 mA的条件下,在10%甲醇、0.01% SDS、0.1% NuPage抗氧化剂中浸泡16小时(NP0005, Thermo Fisher Scientific)。每个膜在室温下用5% BSA在TBS中阻塞120分钟。用10 μg/ml的非磷多肽预孵育30 min。洗涤后,印迹在室温下与二抗(#925-68071,抗兔;# 925 - 32214抗体/羊;都是1:15 000)来自Li-Cor生物科学公司。清洗后,用奥德赛CLx成像系统(Li-Cor Biosciences)扫描所有印迹。带强度由附带的软件Image Studio v.5.2 (Li-Cor Biosciences)自动确定。gydF4y2Ba
结果gydF4y2Ba
新候选肌聚糖互作剂的鉴定gydF4y2Ba
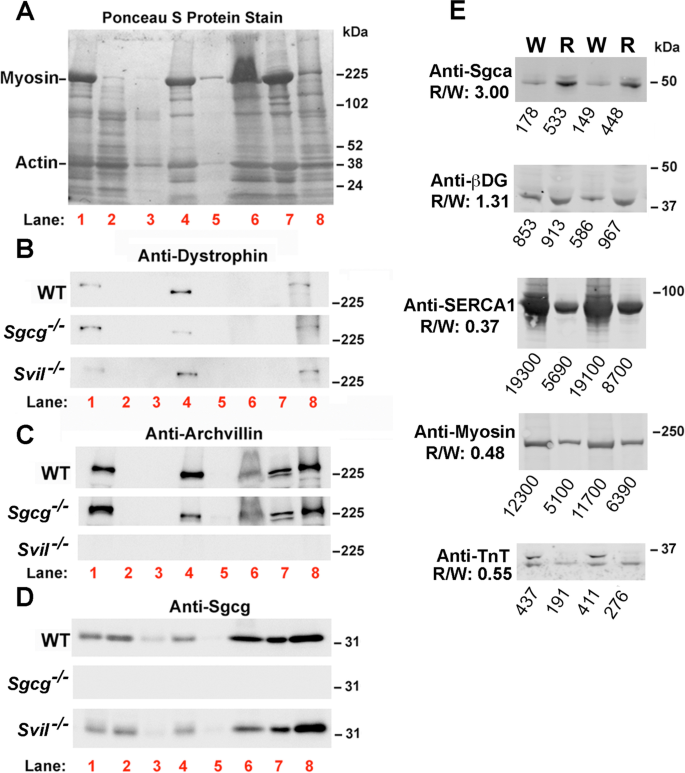
为补充先前用于识别肌聚糖互作物的双杂交筛选[gydF4y2Ba25gydF4y2Ba,gydF4y2Ba26gydF4y2Ba],我们使用了一种新的免疫共沉淀(co-IP)和无标签蛋白质组学方法来鉴定与Sgcg直接或间接相关的蛋白质(图。gydF4y2Ba1gydF4y2Ba).消除耗时的超离心和碳水化合物交联凝集素[gydF4y2Ba46gydF4y2Ba,gydF4y2Ba47gydF4y2Ba],我们对Yamamoto等人的方法进行了改进[gydF4y2Ba43gydF4y2Ba]从单个小鼠肌肉(50毫克至100毫克湿质量)中富集肌层蛋白,使用大多数研究实验室中可用的台式设备。我们的方法避免了由于细胞外凝集素引起的碳水化合物凝集而产生的潜在错误关联,但牺牲了先前方法的高肌层纯度。我们相对快速的方法需要不到3小时,从单个小鼠肌肉中提取最多4个样本(图2)。gydF4y2Ba1gydF4y2Ba).在用细胞骨架破坏和松弛(Rx)缓冲液提取相对低密度的膜和用含有sds的RIPA1缓冲液提取密度更高的细胞骨架相关部分后,对sgcg相关蛋白进行了检测(图2)。gydF4y2Ba1gydF4y2Ba而且gydF4y2Ba2gydF4y2Ba).据我们所知,还没有对肌聚糖或其他dgc相关蛋白的高密度、细胞骨架相关部分进行过探索。每个洗涤剂上清含有肌膜标记蛋白营养不良蛋白,大绒毛蛋白和Sgcg(图。gydF4y2Ba2gydF4y2BaRIPA1提取物富含与DGC相关的蛋白质(dystrophin, archvillin, Sgcg, Sgca, β-dystroglycan)(图。gydF4y2Ba2gydF4y2BaB-E),与肌浆网(SERCA1)和收缩装置(肌动蛋白,肌凝蛋白II,肌钙蛋白t)相关的蛋白质减少(图。gydF4y2Ba2gydF4y2BaA, E)。Rx上清液比RIPA上清液含有更多更大的颗粒,但没有大的膜片保留(附加文件gydF4y2Ba5gydF4y2Ba,图S2)。gydF4y2Ba
肌层蛋白从Rx(6通道)和RIPA1(8通道)缓冲中恢复。腓肠肌(~ 100mg)来自C57BL/6 (WT)小鼠或缺乏γ-肌聚糖(SgcggydF4y2Ba−−/gydF4y2Ba)或全长大反派(SvilgydF4y2Ba−−/gydF4y2Ba)进行分馏,如图所示。gydF4y2Ba1gydF4y2Ba;红色车道号与图对应。gydF4y2Ba1gydF4y2Ba.污点被染色gydF4y2Ba一个gydF4y2Ba用Ponceau S蛋白检测肌层蛋白gydF4y2BaBgydF4y2Ba肌营养不良蛋白,gydF4y2BaCgydF4y2Baarchvillin,gydF4y2BaDgydF4y2Baγ-肌聚糖(Sgcg,使用我们的新抗体)。大量肌动蛋白被缓冲液1 (gydF4y2Ba一个gydF4y2Ba, 2-3车道);大部分肌凝蛋白II是由Rx缓冲液中的高盐提取的(gydF4y2Ba一个gydF4y2Ba, 6车道)或不溶于RIPA1缓冲液(gydF4y2Ba一个gydF4y2Ba, lane 7). Blots代表每个基因型3个生物重复。分数1-6归一化为总蛋白;分数7-8之间由体积归一化;分数8中的总蛋白质近似于分数1。第1道,全肌肉提取物。2-3车道,丢弃的衣物。第四道,提取前富集膜。第五道,废弃的Rx颗粒。6道,Rx上清液。7巷,废弃的不溶性RIPA1颗粒。 Lane 8, RIPA1 supernatants.EgydF4y2Ba通过免疫印迹法比较全组织裂解物(W)和RIPA1裂解物(R)的蛋白质丰度。每种条件下使用相同的蛋白质负荷(基于BCA定量)。DGC蛋白Sgca和β-dystroglycan (β-DG)富集于野生型C57BL/6肌肉RIPA1提取物中(相当于r8)gydF4y2Ba一个gydF4y2Ba- - - - - -gydF4y2BaDgydF4y2Ba),与全肌肉裂解物(相当于在gydF4y2Ba一个gydF4y2Ba- - - - - -gydF4y2BaDgydF4y2Ba),而肌浆网标记物SERCA1和收缩装置蛋白肌球蛋白II和快速肌钙蛋白T (TnT)则被耗尽。ImageStudio软件的平均条带强度显示在每个通道下方,用于计算RIPA1与全肌肉裂解液(R/W)的比值,显示在每个印迹左侧gydF4y2Ba
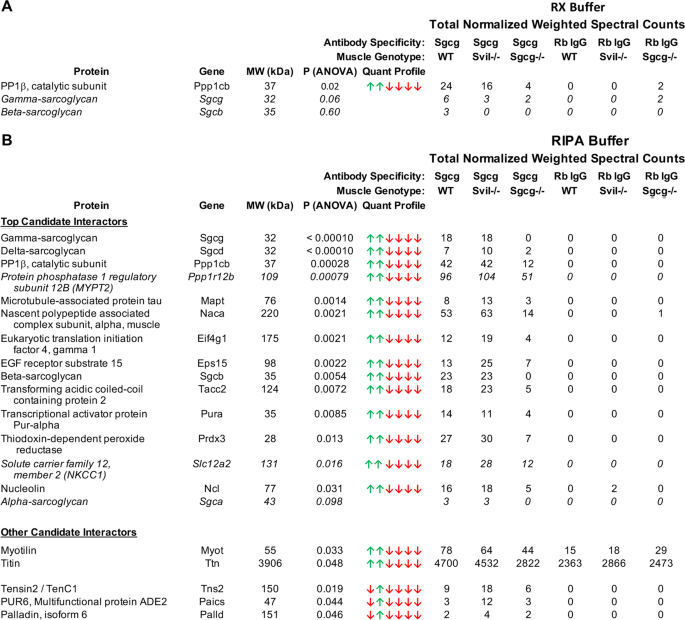
我们通过比较使用我们新的高亲和度抗sgcg抗体交联到磁珠上所回收的蛋白质与从阴性对照中获得的蛋白质,确定了SC的新的候选直接或间接相互作用伙伴(图2)。gydF4y2Ba3.gydF4y2Ba;附加文件gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba4gydF4y2Ba;表S2和S3)。gydF4y2Ba腓肠肌gydF4y2Ba含有SC的肌肉来自C57BL/6 (WT)小鼠和一种新的纯合子小鼠品系,用于基因切除大的5 '编码外显子gydF4y2BaSvilgydF4y2Ba基因(gydF4y2BaSvilgydF4y2Ba−−/gydF4y2Ba).阴性对照为gydF4y2Ba腓肠肌gydF4y2Ba肌肉的gydF4y2BaSgcggydF4y2Ba−−/gydF4y2Ba老鼠(gydF4y2Ba16gydF4y2Ba]和含有非特异性兔IgG的IPs。gydF4y2Ba
Sgcg免疫沉淀蛋白。总归一化光谱计数通过添加来自Rx或RIPA提取物的co-IPs的三个生物重复计数来确定,并对蛋白质质量的差异进行加权。通过方差分析(ANOVA)确定蛋白质丰度的增加(绿色箭头),与光谱计数统计上较少的样本(红色箭头)相比;箭头顺序对应于总归一化加权光谱计数的列。候选直接或间接交互者,如“gydF4y2Ba方法gydF4y2Ba,按增加顺序排列gydF4y2BaPgydF4y2Ba价值。gydF4y2Ba一个gydF4y2BaRx缓冲液中只有蛋白磷酸酶1B,催化亚基(PP1β)显著。gydF4y2BaBgydF4y2Ba来自ripa1溶解膜的最佳候选交互作用被定义为从含有Sgcg的两种肌肉基因型(WT,gydF4y2BaSvilgydF4y2Ba−gydF4y2Ba/gydF4y2Ba−gydF4y2Ba),并在两组对照ip中分别用少于一半的归一化加权光谱计数表示。一个对照组是含有抗sgcg抗体的IPsgydF4y2BaSgcggydF4y2Ba−gydF4y2Ba/gydF4y2Ba−gydF4y2Ba肌肉;第二种是从任何基因型的肌肉中提取非特异性兔IgG (Rb IgG)的IPs。其他候选人互动gydF4y2BaPgydF4y2Ba值< 0.05或高于预期背景计数,或仅在gydF4y2BaSvilgydF4y2Ba−gydF4y2Ba/gydF4y2Ba−gydF4y2Ba肌肉。未标记为统计显著性的肌聚糖值以斜体显示,以便与新确定的候选Sgcg相互作用体进行比较。候选交互器MYPT2和NKCC1也用斜体表示,因为其中的计数数gydF4y2BaSgcggydF4y2Ba−gydF4y2Ba/gydF4y2Ba−gydF4y2Ba肌肉没有达到50%的阈值。其他候选人互动团员分为两类。肌动素和肌动素相遇了gydF4y2BaSgcggydF4y2Ba−gydF4y2Ba/gydF4y2Ba−gydF4y2Ba如果首先从总归一化计数中减去对照IgG观察到的背景的平均值,则为肌肉截断准则。tensin2、PUR6和palladin仅满足gydF4y2BaSvilgydF4y2Ba−gydF4y2Ba/gydF4y2Ba−gydF4y2Ba肌肉gydF4y2Ba
所有四种糖聚糖都用WT和抗sgcg免疫沉淀gydF4y2BaSvilgydF4y2Ba−−/gydF4y2BaRIPA1提取尽管gydF4y2BaPgydF4y2BaSgca是最不紧密结合的肌聚糖亚基[gydF4y2Ba63gydF4y2Ba,gydF4y2Ba64gydF4y2Ba],仅为0.095,这是由于特定光谱计数数量较少(图2)。gydF4y2Ba3.gydF4y2Ba).这些结果与之前的观察一致,即SC在含sds的缓冲液中是稳定的[gydF4y2Ba65gydF4y2Ba],并提示其他特异性共免疫沉淀蛋白在这里被鉴定(图。gydF4y2Ba3.gydF4y2Ba)都是优秀的SC新候选互动角色。gydF4y2Ba
Rx和RIPA1提取物中最主要的免疫共沉淀非肌聚糖蛋白是丝氨酸/苏氨酸蛋白磷酸酶催化亚基1B (PP1β,也称为PP1δ)(图1)。gydF4y2Ba3.gydF4y2Ba).与大型抗洗涤剂结构相关的肌膜蛋白的RIPA1提取物中出现了其他候选相互作用体(图。gydF4y2Ba3.gydF4y2Ba由于PP1β是最主要的候选者,已知或预测与PP1β结合的MYPT2、NKCC1和tensin2的存在也很有趣(图2)。gydF4y2Ba3.gydF4y2Ba).Na的n端尾部gydF4y2Ba+gydF4y2Ba- kgydF4y2Ba+gydF4y2Ba2氯gydF4y2Ba−gydF4y2BaNKCC1基因gydF4y2BaSlc12a2gydF4y2Ba)可支持PP1β和调节激酶相互控制NKCC共转运活性[gydF4y2Ba66gydF4y2Ba].NKCC1支持电压激活Ca的开启gydF4y2Ba++gydF4y2Ba通过累积Cl形成通道gydF4y2Ba−gydF4y2Ba胞外钠离子通过共转运进入细胞质gydF4y2Ba+gydF4y2Ba和KgydF4y2Ba+gydF4y2Ba在肌肉收缩时丢失[gydF4y2Ba67gydF4y2Ba].MYPT2,由gydF4y2BaPpp1r12bgydF4y2Ba基因,沿肌球蛋白II丝浓缩PP1催化亚基[gydF4y2Ba68gydF4y2Ba,gydF4y2Ba69gydF4y2Ba],并定位于gydF4y2BaZgydF4y2Ba-线和心肌线粒体[gydF4y2Ba70gydF4y2Ba].张紧素2在结构上与局点黏附相关的机械感觉蛋白张紧素1相关,后者直接与PP1α和整合素结合,以调节细胞迁移和黏附[gydF4y2Ba71gydF4y2Ba,gydF4y2Ba72gydF4y2Ba,gydF4y2Ba73gydF4y2Ba].因此,PP1β或PP1β相关蛋白可能调节先前观察到的sgcg介导的ERK1/2信号通路[gydF4y2Ba18gydF4y2Ba,gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba24gydF4y2Ba,直接或间接地,作为一个更大的信号综合体的一部分。gydF4y2Ba
图中其他候选的糖聚糖相互作用体。gydF4y2Ba3.gydF4y2BaB也是机械合理的。虽然这些候选相互作用体中的许多并不是肌膜的组成部分,但就其本身而言,它们证明了富集策略的实用性,因为它们代表了连接肌膜与其他细胞隔室的蛋白质,以及功能突变丧失导致神经肌肉疾病的位点。例如,肌动素和肌动素的突变是导致LGMD的原因[gydF4y2Ba50gydF4y2Ba], Sgcg结合titin序列[gydF4y2Ba25gydF4y2Ba].Palladin支持细胞骨架结构的形成,包括costameres [gydF4y2Ba74gydF4y2Ba,gydF4y2Ba75gydF4y2Ba].其他这些蛋白参与膜运输(Ep215, TACC2, Mapt),细胞应激反应(Naca, Prdx3)和核功能(eIF4G, PURA,核仁素)。gydF4y2Ba
PP1β、MYPT2和NKCC1在Rx和RIPA缓冲液中的提取率在不同基因型之间大致相当(附加文件)gydF4y2Ba6gydF4y2Ba,图S3)。在RIPA摘录中,这些新的候选相互作用体的数量之间没有明显的相关性gydF4y2Ba6gydF4y2Ba,图S3)和co-IP与anti-Sgcg从肌肉中获得的归一化谱数(图3)。gydF4y2Ba3.gydF4y2Ba),尤其是糖基化和非糖基化的NKCC1 [gydF4y2Ba76gydF4y2Ba,gydF4y2Ba77gydF4y2Ba](附加文件gydF4y2Ba6gydF4y2Ba,图S3C)。这些结果表明,无论是蛋白表达水平的巨大变化,还是可萃取性,都不能解释co-IPs中光谱计数数量的减少gydF4y2BaSgcggydF4y2Ba−−/gydF4y2Ba这些蛋白质在IP中的减少是由于失去了与Sgcg的直接或间接相互作用。gydF4y2Ba
我们在人横纹肌肉瘤细胞(RH30)中使用免疫荧光共定位作为二次筛选,以研究SC与PP1β以及缺乏高水平肌肉蛋白组织的细胞类型中PP1β相互作用蛋白的潜在相互作用。其基本原理是,在没有大量肌肉蛋白质组合的情况下,信号接近性与只需要少量蛋白质的关联是一致的。我们使用编码标记NKCC1、PP1β、MYPT2和tensin2的cdna,与未标记的Sgcg或Sgcg- flag共表达,有或没有Sgcb-Flag共表达;这三种糖聚糖一起形成SC核心[gydF4y2Ba51gydF4y2Ba,gydF4y2Ba64gydF4y2Ba].我们还使用抗体进行了蛋白质定位,包括两种不同的特异性Sgcg抗体(附加文件)gydF4y2Ba7gydF4y2Ba,gydF4y2Ba8gydF4y2Ba,gydF4y2Ba9gydF4y2Ba;无花果。S4, S5和S6)。gydF4y2Ba
NKCC1是Sgcg交互子gydF4y2Ba
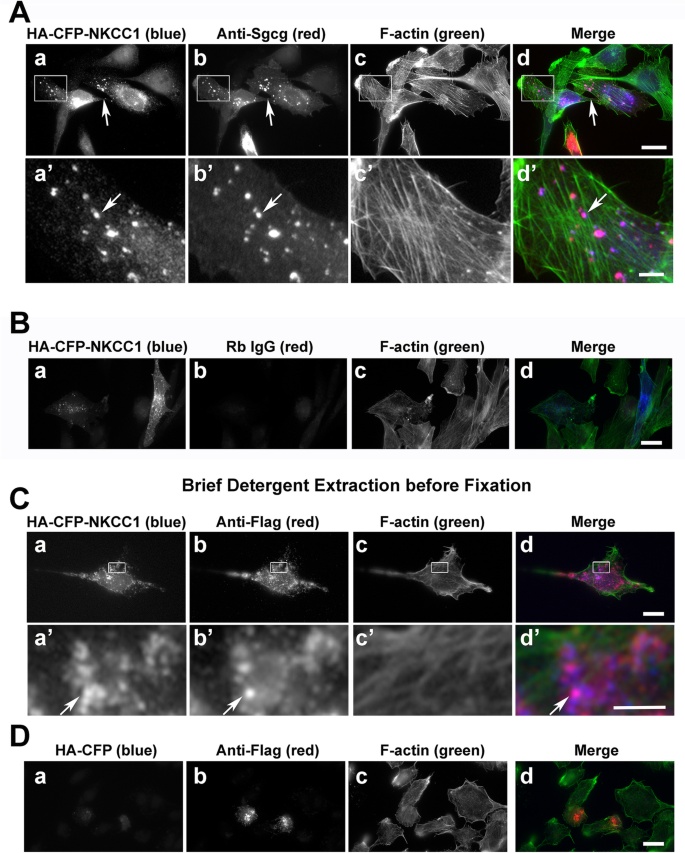
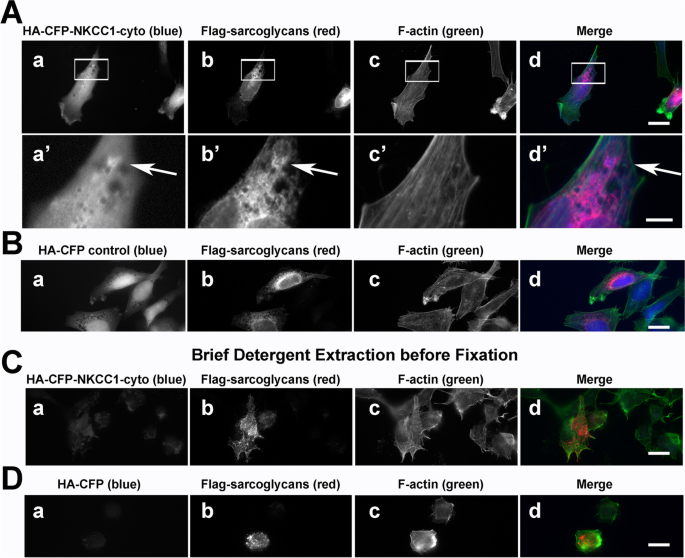
在RH30细胞中,与共表达Sgcg共定位最强的新型候选交互物是NKCC1(图3)。gydF4y2Ba4gydF4y2Ba).RH30细胞表达骨骼肌蛋白水平降低,支持评估独立于有组织的收缩装置存在的直接或间接蛋白质-蛋白质相互作用[gydF4y2Ba78gydF4y2Ba].用Sgcg抗体证实NKCC1与标记SC蛋白的阳性共定位(图2)。gydF4y2Ba4gydF4y2BaA,箭头,vs. B)和反旗(图。gydF4y2Ba4gydF4y2BaC).大多数共定位在提示细胞内囊泡的点状结构中。为了测试这些重叠是否仅仅是由于这些膜蛋白共存于同一脂质双分子层,我们在固定和染色前用洗涤剂简单地提取了表达这两种蛋白的RH30细胞。在这些条件下,细胞质对照HA-CFP扩散(图。gydF4y2Ba4gydF4y2BaD),但来自NKCC1和肌聚糖的信号仍然存在,因为明显的信号重叠(图。gydF4y2Ba4gydF4y2BaC,红色)。gydF4y2Ba
NKCC1与肌聚糖复合物共同定位于大的,洗涤剂稳定的水泡结构。gydF4y2Ba一个gydF4y2Ba,gydF4y2BaBgydF4y2Baha - cfp标记的NKCC1(面板a, a ',蓝色合并)在与两者可视化的点位中共同定位gydF4y2Ba一个gydF4y2Ba亲和纯化抗sgcg和gydF4y2BaBgydF4y2Ba通过标记Sgcg、Sgcd和Sgcb在RH30横纹肌肉瘤细胞中表达后,Proteintech组(PTG)的抗Sgcg (b, b ',合并红色)。面板a -d中框内区域的放大图(a ' -d ')。gydF4y2BaCgydF4y2Ba特异性对照用非免疫兔IgG替代抗sgcg。gydF4y2BaDgydF4y2BaHA-CFP-NKCC1(图a, a ',蓝色合并)和肌聚糖复合物(图a, a ',红色合并)的信号重叠即使在固定前用0.1% Triton X-100短暂提取细胞也会持续存在。gydF4y2BaEgydF4y2Ba单独的HA-CFP标签(图a,合并部分蓝色)在与Flag-tagged Sgcg, Sgcd和Sgcb(合并部分红色)共转染的预提取的RH30细胞中不存在。gydF4y2Ba一个gydF4y2Ba- - - - - -gydF4y2BaEgydF4y2Baphalloidin染色的肌动蛋白丝描绘细胞边界(c, c ',绿色合并)。棒材(d), 20 μm;杆(d '), 5 μm。洋红色(箭头)的HA和Flag信号重叠gydF4y2Ba
在转染的RH30细胞中,观察到肌聚糖和HA-CFP融合蛋白与截断的NKCC1蛋白(包含胞浆n端直接与胞浆c端融合的NKCC1-cyto)的信号重叠不太明显;这种NKCC1截断缺乏12个跨膜结构域和细胞外序列[gydF4y2Ba56gydF4y2Ba(图。gydF4y2Ba5gydF4y2Ba).与全长NKCC1不同(图;gydF4y2Ba4gydF4y2BaA),这种NKCC1-cyto蛋白主要是胞质的(图。gydF4y2Ba5gydF4y2Ba一个);肌聚糖点附近的胞质信号增强(图2)。gydF4y2Ba5gydF4y2Ba一个箭头)。更多的NKCC1-cyto蛋白位于细胞质中,而更多的HA-CFP控制蛋白位于细胞核中(图2)。gydF4y2Ba5gydF4y2BaB). NKCC1-cyto(图;gydF4y2Ba5gydF4y2BaC)和HA-CFP(图;gydF4y2Ba5gydF4y2BaD)在用洗涤剂预提取的细胞中,蛋白质从肌聚糖点扩散,这表明SC和NKCC1细胞质结构域之间的任何关联必须是低亲和性的。gydF4y2Ba
ha - cfp - nkcc1细胞质结构域似乎与标记SC蛋白松散相关。RH30细胞与flag标记的肌聚糖平行共转染,染色如图所示。gydF4y2Ba4gydF4y2Ba.gydF4y2Ba一个gydF4y2Baha - cfp - nkcc1 -细胞质结构域和gydF4y2BaBgydF4y2BaHA-CFP(阴性对照;面板a, a ';用Flag-tagged肌聚糖(面板b, b ';红色合并)和f -肌动蛋白(面板c, c ';绿色合并)。0.1% Triton X-100预萃取后,gydF4y2BaCgydF4y2Baha - cfp - nkcc1残留胞质域信号与gydF4y2BaDgydF4y2BaHA-CFP残留。洋红色(箭头)中HA和Flag信号重叠。棒材(d), 20 μm;Bar (d '), 5 μmgydF4y2Ba
相比之下,我们观察到在局灶粘连处没有肌聚糖与标记的张力蛋白2共定位(附加文件)gydF4y2Ba10gydF4y2Ba,图S7),与MYPT2信号重叠有限(附加文件gydF4y2Ba11gydF4y2Ba,图S8)或PP1β(附加文件gydF4y2Ba12gydF4y2Ba,图S9)。MYPT2主要定位于phalloidin染色的肌动蛋白丝(附加文件gydF4y2Ba11gydF4y2Ba,图S8),提示与应力纤维中的肌球蛋白II相互作用[gydF4y2Ba79gydF4y2Ba].在一些细胞中,MYPT2与亮染的近核Sgcg点状结构重叠,但未观察到与细胞外围大的含Sgcg点状结构相关(附加文件gydF4y2Ba11gydF4y2Ba,图S8)。同样,在EGFP两端标记的共表达Sgcg和PP1β的信号与EGFP对照没有明显差异(附加文件)gydF4y2Ba12gydF4y2Ba(图S9),即使在诱导PP1α从细胞核转位到细胞质的低渗条件下[gydF4y2Ba80gydF4y2Ba].这些阴性结果并不能排除与Sgcg相互作用的可能性,但表明任何与PP1β或MYPT2的结合都需要翻译后修饰或肌肉特异性相互作用伙伴。gydF4y2Ba
Sgcg与NKCC1细胞质结构域相互作用gydF4y2Ba
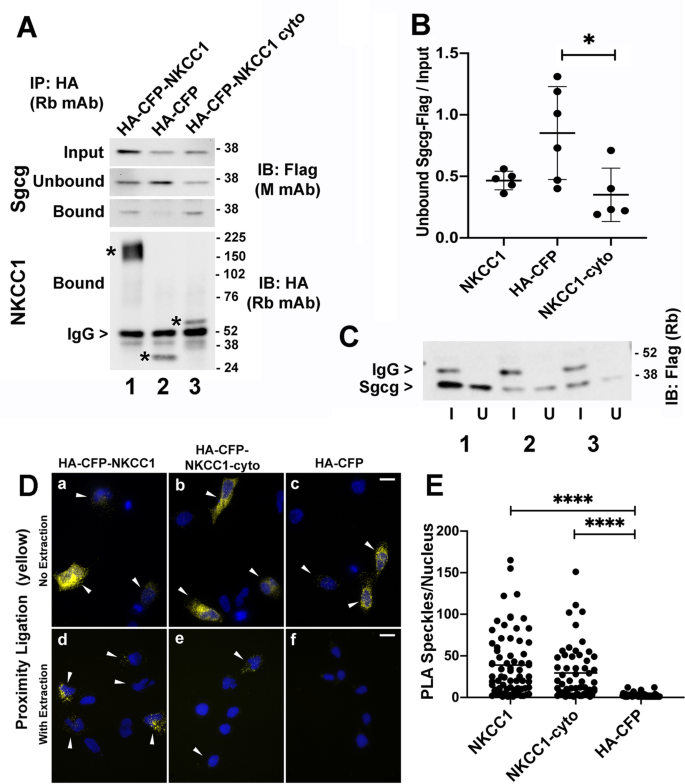
为了进一步研究SC与NKCC1和NKCC1-cyto结构域的相互作用,我们在RH-30细胞中共同过表达标记蛋白,并使用标记进行co-IP、上清液消耗试验和PLA(图3)。gydF4y2Ba6gydF4y2Ba).使用简短、低严格洗涤的初始co-IP实验表明,与与flag标记的肌聚糖(Sgcb, Sgcd, Sgcg)共同沉积的HA-CFP- nkcc1和NKCC1-cyto蛋白相比,HA-CFP阴性对照有更多的HA-CFP- nkcc1和NKCC1-cyto蛋白(图5)。gydF4y2Ba6gydF4y2BaA).然而,如果细胞裂解物经过冻融或IP颗粒被严格清洗,信号就会丢失,这表明任何相互作用都是低亲和度的gydF4y2Ba在体外gydF4y2Ba.因此,为了更好地量化低亲和度相互作用,我们采用了上清液消耗试验[gydF4y2Ba61gydF4y2Ba].在这些实验中,在结合蛋白沉淀前后监测上清液中未结合伴侣蛋白的数量,以量化初始结合平衡[gydF4y2Ba61gydF4y2Ba].未绑定-输入比揭示了与绑定颗粒一起损失的目标蛋白的数量,而不要求相互作用能够承受稀释和冲洗所需的时间。小于1的比率与绑定相互作用一致。与HA-CFP对照蛋白相比,我们始终发现全长HA-CFP- nkcc1或HA-CFP- nkcc1 -cyto沉积的Sgcg-Flag的未结合/输入比值小于1,尽管由于对照的可变性,只有HA-CFP- nkcc1 -cyto的结果具有统计学意义(图2)。gydF4y2Ba6gydF4y2BaB, C)。唯一观察到的flag相关信号来自Sgcg-Flag,可能是由于这些细胞中存在内源性Sgcb和Sgcd (gydF4y2Bahttps://www.proteinatlas.orggydF4y2Ba).相比之下,在使用anti-Flag或anti-EGFP的co-IP实验中,使用共表达flag标记的肌聚糖和在两端使用EGFP标记的PP1β的上清液消耗实验导致未绑定与输入的比值不低于1。转染细胞的PLA进一步支持SC和NKCC1之间存在直接或间接的相互作用(图2)。gydF4y2Ba6gydF4y2BaD, E)。在未提取的共转染细胞中,所有HA-CFP标记的构建物都显示与SC接近(图。gydF4y2Ba6gydF4y2BaD,最上面一行)。在用低水平的洗涤剂预提取以消除游离的细胞质蛋白后,与HA-CFP阴性对照相比,NKCC1和NKCC1-cyto的SC观察到明显更多的PLA信号(图2)。gydF4y2Ba6gydF4y2BaD, E)。这些结果支持外源表达的肌聚糖和NKCC1细胞质结构域之间存在低亲和性关联。gydF4y2Ba
标记Sgcg直接或间接与ha - cfp标记的NKCC1蛋白结合。gydF4y2Ba一个gydF4y2Ba与HA-CFP阴性对照相比,最成功的co-IP的免疫印迹显示更多的Sgcg-Flag与NKCC1和NKCC1-cyto(结合)沉积;沉降后上清液相应减少(未结合)。细胞裂解液中的Sgcg-Flag数量也显示出来(输入)。在RH-30细胞中,标记Sgcg、Sgcb和Sgcd蛋白与HA-CFP- nkcc1 (lane 1)、HA-CFP (lane 2)或HA-CFP- nkcc1细胞质结构域(NKCC1-cyto, lane 3)共表达,并与抗ha免疫沉淀。结合的NKCC1蛋白用抗ha标记(星号);兔抗ha重链IgG。gydF4y2BaBgydF4y2Ba从上清液消耗测定Sgcg-Flag的未结合/输入比的密度定量,如中所示gydF4y2BaCgydF4y2Ba,采用Tukey多元比较检验进行单因素方差分析。gydF4y2BaPgydF4y2BaHA-CFP对照与HA-CFP- nkcc1和HA-CFP- nkcc1 -cyto的平均差异值分别为0.12和0.02 (*gydF4y2BaPgydF4y2Ba< 0.05)。中央条形,表示;误差条,sdgydF4y2BaCgydF4y2Ba具有代表性的免疫印迹法用于上清液消耗测定gydF4y2BaBgydF4y2Ba,与输入(I)相比,显示Unbound lanes (U)的条带强度降低。IP使用兔单克隆抗HA (HA);Sgcg-Flag用rabbit anti-Flag (Flag)可视化;HA-CFP标记的NKCC1(通道1),HA-CFP单独(通道2),或HA-CFP-NKCC1细胞质域(通道3)。gydF4y2BaDgydF4y2Ba,gydF4y2BaEgydF4y2Ba在共转染Flag-tagged Sgcg, Sgcb和Sgcd的RH30细胞中,SC与HA-CFP- nkcc1, HA-CFP- nkcc1 -cyto或HA-CFP对照相互作用的PLA的代表性图像和定量。gydF4y2BaDgydF4y2Ba在固定的细胞中,没有洗涤剂预处理以去除游离的细胞质蛋白(图。gydF4y2Ba4gydF4y2BaD和gydF4y2Ba5gydF4y2BaD), PLA斑点表明抗sgcg和抗ha的邻近,观察到所有三种HA-CFP结构(gydF4y2BaDgydF4y2Baa - c)。简要的洗涤剂预萃取显示,SC复合物与NKCC1和NKCC1-cyto的接近程度持续存在,但与HA-CFP标签无关(gydF4y2BaDgydF4y2Bad-f,gydF4y2BaEgydF4y2Ba).PLA斑点为伪黄色;dapi标记的细胞核为蓝色。尺寸棒材,20 μm。gydF4y2BaEgydF4y2Ba预提取细胞每个细胞核的PLA散斑图。没有PLA斑点的细胞被认为是未转染的,不包括在内。横柱,表示2个实验的结果组合,计算细胞总数:NKCC1 (70), NKCC1-cyto (56), HA-CFP(65)。转染效率从36%到65%不等,HA-CFP的转染效率较高,尽管PLA斑点的比例较低。****gydF4y2BaPgydF4y2Ba< 0.0001;NKCC1与NKCC1-cyto的P值为0.6140 (ns),来自Kruskal-Wallis多重比较检验的单向方差分析gydF4y2Ba
NKCC1与DGC共定位,影响肌肉中sgcg依赖的ERK激活gydF4y2Ba
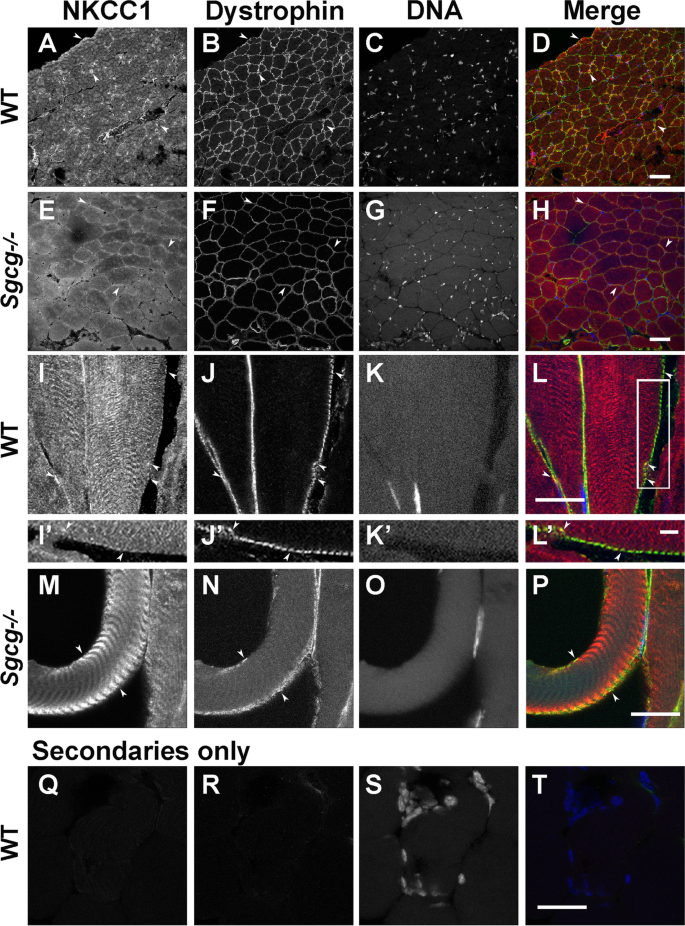
看看NKCC1是否定位于SC附近,因此可能相关gydF4y2Ba在活的有机体内gydF4y2Ba,我们将NKCC1定位于小鼠EDL肌肉(图2)。gydF4y2Ba7gydF4y2Ba).已知NKCC1存在于骨骼肌纤维中[gydF4y2Ba81gydF4y2Ba],但其定位相对于肌纤维中costameres的dystrophin [gydF4y2Ba8gydF4y2Ba,gydF4y2Ba9gydF4y2Ba未被探索。在免疫染色的肌肉冷冻切片中,抗nkcc1信号在对照组肌肉中Sgcg的存在时表现出与肌膜营养不良蛋白相同的分布(图2)。gydF4y2Ba7gydF4y2BaA, B, I, J),如果肌肉中没有gydF4y2BaSgcggydF4y2Ba−−/gydF4y2Ba老鼠(图。gydF4y2Ba7gydF4y2BaE, F, M, N)。额外的NKCC1信号与内部条纹相关(图。gydF4y2Ba7gydF4y2BaI, M),与t小管网络上或附近的定位一致,t小管网络同步肌肉内的钙释放,并且似乎集中在costameres的t小管口附近[gydF4y2Ba82gydF4y2Ba,gydF4y2Ba83gydF4y2Ba].在SC存在和不存在的情况下,相似的信号分布表明NKCC1不需要Sgcg进行表达和运输到肌膜。这些结果使NKCC1在体内与DGC接近。gydF4y2Ba
NKCC1和dystrophin在EDL肌肉中的共聚焦显微镜观察gydF4y2BaSgcggydF4y2Ba−gydF4y2Ba/gydF4y2Ba−gydF4y2Ba老鼠。gydF4y2Ba一个gydF4y2Ba- - - - - -gydF4y2BaHgydF4y2Ba横切面显示在肌膜处有重叠信号(箭头;合并黄色),以及两种基因型的内部肌原纤维NKCC1染色。gydF4y2Ba我gydF4y2Ba- - - - - -gydF4y2BaPgydF4y2Ba纵断面内染色显示与t小管有关,t小管终止于肌膜中肌萎缩蛋白相关的costameres [gydF4y2Ba8gydF4y2Ba,gydF4y2Ba9gydF4y2Ba,gydF4y2Ba82gydF4y2Ba].gydF4y2Ba我gydF4y2Ba- - - - - -gydF4y2BaL 'gydF4y2Ba放大框内的区域gydF4y2BalgydF4y2Ba.gydF4y2Ba问gydF4y2Ba- - - - - -gydF4y2BaTgydF4y2Ba仅用二抗染色的切片。酒吧是gydF4y2Ba一个gydF4y2Ba- - - - - -gydF4y2BaHgydF4y2Ba50μm;gydF4y2Ba我gydF4y2Ba- - - - - -gydF4y2BaTgydF4y2Ba20μm;gydF4y2Ba我gydF4y2Ba- - - - - -gydF4y2BaL 'gydF4y2Ba5μmgydF4y2Ba
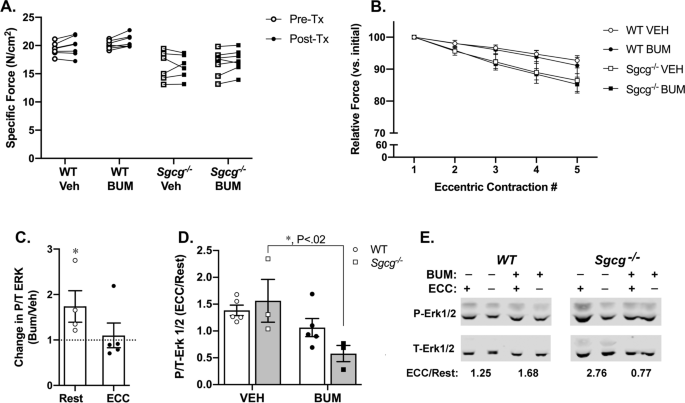
我们还探讨了NKCC1共转运蛋白活性是否影响sc介导的ERK信号通路[gydF4y2Ba18gydF4y2Ba,gydF4y2Ba24gydF4y2Ba].NKCC1共转运蛋白活性增加KgydF4y2Ba+gydF4y2Ba通过促进氯反离子的流入而诱导肌肉中的钙瞬态[gydF4y2Ba84gydF4y2Ba].我们发现NKCC1活性也改变P-ERK反应。NKCC1共转运抑制剂布美他尼对EDL肌肉收缩的特定力或一系列偏心收缩后的相对力损失没有显著影响(图2)。gydF4y2Ba8gydF4y2Ba然而,在布美他尼培养的静息WT肌肉中,P-ERK明显增加(图2)。gydF4y2Ba8gydF4y2BaC).偏心收缩(ECC)后,布美他尼抑制ERK磷酸化gydF4y2BaSgcggydF4y2Ba−−/gydF4y2Ba但WT肌肉中没有。gydF4y2Ba8gydF4y2BaD, E). NKCC1总糖基化和NKCC1磷酸化中sgcg依赖的变化,NKCC1激活的测量方法[gydF4y2Ba66gydF4y2Ba,gydF4y2Ba85gydF4y2Ba,gydF4y2Ba86gydF4y2Ba],在ECC应变时可能发生,但差异无统计学意义(附加文件gydF4y2Ba13gydF4y2Ba;图S10)。这些结果支持NKCC1在sgcg依赖的ERK激活中响应ECC的作用[gydF4y2Ba18gydF4y2Ba],没有sgcg依赖的NKCC1磷酸化改变。gydF4y2Ba
NKCC1抑制对肌肉力产生和ERK磷酸化的影响。gydF4y2Ba一个gydF4y2Ba与对照(VEH)相比,布美他尼(BUM)孵育不改变EDL肌肉的等距破伤风力产生。在林格氏溶液中作为预处理(Pre-Tx)的力的原始值,以及在50 μM布美他尼或载体(乙醇)中孵育20 - 30分钟后作为后处理(Post-Tx)的力。gydF4y2BaBgydF4y2Ba布美他尼孵育不影响偏心收缩(ECC)后力的减少。力相对于第一个椭圆曲线中的初始力。意味着显示;误差条SEM。gydF4y2BaCgydF4y2Ba野生型小鼠静息EDL肌肉中磷酸化ERK水平升高,但P-ERK对ECC的反应不受影响。(*,gydF4y2BaPgydF4y2Ba< 0.05,同只小鼠肌肉布美他尼与载体培养之间的配对t检验)。gydF4y2BaDgydF4y2Ba在没有Sgcg的情况下,布美他尼孵育可抑制ecc诱导的P/T-ERK的增加。gydF4y2BaNgydF4y2Ba= 3-6块肌肉。*品系内对照剂与布美他尼的显著差异(gydF4y2BaPgydF4y2Ba= 0.0196),采用2向方差分析,然后进行Sidak多重比较检验。gydF4y2BaCgydF4y2Ba,gydF4y2BaDgydF4y2Ba中心线,意味着;误差条,SEM。gydF4y2BaEgydF4y2Ba代表免疫印迹。确定每种条件下磷酸化(P)到总(T) ERK信号的信号,然后用ECC后P/T ERK信号的比值除以每种条件下对应的静止比值(ECC/ rest)gydF4y2Ba
新的候选Sgcg交互作用将SC与生存信号通路联系起来gydF4y2Ba
我们还使用体外实验来评估Sgcg和大绒毛蛋白之间相互作用的直接性,大绒毛蛋白是一种膜-细胞骨架连接蛋白,是ERK1/2信号传导的支架[gydF4y2Ba27gydF4y2Ba,gydF4y2Ba30.gydF4y2Ba].这种相互作用最初是通过酵母双杂交试验确定的,并得到co-IP的支持[gydF4y2Ba26gydF4y2Ba].由于最初的co-IPs表明了类似于Sgcg和NKCC1蛋白的低亲和性相互作用,我们使用纯化的重组Sgcg n端(Sgcg 1-35-EGFP, WT)和保守的大绒毛蛋白/超绒毛蛋白c端进行了上清消耗实验(图3)。gydF4y2Ba9gydF4y2Ba).可溶性EGFP和Sgcg 1-35-EGFP蛋白被纯化,并与纯化的gst标记的大绒毛蛋白c端一起使用。gydF4y2Ba9gydF4y2BaA, B)或GST单独(图。gydF4y2Ba9gydF4y2BaC, D)在GST-pulldown测定中。我们观察到大绒毛c端和WT Sgcg之间有统计学意义的直接相互作用(图2)。gydF4y2Ba9gydF4y2BaA, B).此外,Sgcg 1-35-EGFP与tir -6突变(Y6A),残留涉及肌肉中的P-ERK信号[gydF4y2Ba24gydF4y2Ba],显示出平均未结合/输入比,介于Sgcg WT和EGFP对照之间,但从这两个值来看都不具有统计学意义。用GST对照珠没有观察到蛋白质之间的差异(图。gydF4y2Ba9gydF4y2BaC, D).这些结果支持先前描述的Sgcg与大反派相互作用的直接性[gydF4y2Ba26gydF4y2Ba并提示Sgcg-Y6可能参与了Sgcg-archvillin相互作用。gydF4y2Ba
重组Sgcg n端直接结合到保守的大绒毛蛋白/超绒毛蛋白c端。上清液消耗试验显示,上清液中重组Sgcg-1-35-EGFP明显损失,但重组EGFP没有损失gydF4y2Ba一个gydF4y2Ba,gydF4y2BaBgydF4y2Bagst标记牛超绒毛蛋白(bSV)残基1398-1792或gydF4y2BaCgydF4y2Ba,gydF4y2BaDgydF4y2Ba销售税。Sgcg中酪氨酸-6突变为丙氨酸(Y6A)可能会影响这种相互作用。gydF4y2Ba一个gydF4y2Ba,gydF4y2BaCgydF4y2Ba输入(I)和未绑定(U)部分的代表性免疫印迹。gydF4y2BaBgydF4y2Ba,gydF4y2BaDgydF4y2Ba重复实验的密度定量。统计分析采用单因素方差分析,后测采用Tukey-Cramer多重比较。gydF4y2BaNgydF4y2Ba= 3-5,如图所示;*gydF4y2BaPgydF4y2Ba< 0.05。中心线,意味着;误差条,sdgydF4y2Ba
图中报道了Sgcg-archvillin直接相互作用和新的候选直接或间接相互作用。gydF4y2Ba3.gydF4y2Ba然后使用IPA软件进行分析,以图形方式将此处描述的新关联与已发表的数据整合在一起[gydF4y2Ba87gydF4y2Ba(图。gydF4y2Ba10gydF4y2Ba).大多数候选蛋白属于两种途径之一:(1)营养不良蛋白和肌聚糖相关的DGC或(2)包含p53(基因名)的互连信号通路gydF4y2BaTP53gydF4y2Ba)、雌激素受体β (gydF4y2BaESR2gydF4y2Ba)和泛素E3连接酶TRIM25。13个最佳候选互动者中的11个(图。gydF4y2Ba3.gydF4y2Ba而且gydF4y2Ba10gydF4y2Ba,蓝色),包括NKCC1(基因gydF4y2BaSlc12a2gydF4y2Ba,绿色),archvillin (gydF4y2BaSvilgydF4y2Ba,黄色),以及其他5个候选相互作用体中的3个(图。gydF4y2Ba10gydF4y2Ba(灰色)在Sgcg IPs中识别(图;gydF4y2Ba3.gydF4y2Ba),被程序指定为生存信号通路或肌层网络的组成部分。随着Sgcg-archvillin相互作用的增加[gydF4y2Ba26gydF4y2Ba(图。gydF4y2Ba9gydF4y2Ba)和新的Sgcg候选相互作用子(图。gydF4y2Ba3.gydF4y2Ba),该软件很容易将肌层和信号通路合并成一个更大的网络(图2)。gydF4y2Ba10gydF4y2Ba).然后,我们手动添加了额外的链接,以显示β-dystroglycan(基因)对ERK和ERK激活激酶MEK2的公开支架gydF4y2BaDAGgydF4y2Ba) [gydF4y2Ba88gydF4y2Ba], ERK和mek1 /2激活激酶B-Raf(基因gydF4y2BaBRAFgydF4y2Ba)由大绒毛蛋白平滑肌亚型(基因gydF4y2BaSVILgydF4y2Ba,无花果。gydF4y2Ba10gydF4y2Ba,黄色)[gydF4y2Ba30.gydF4y2Ba]和Sgcg之间的相互作用(图。gydF4y2Ba10gydF4y2Ba粉红色)和NKCC1(基因gydF4y2BaSLC12A2gydF4y2Ba)(无花果。gydF4y2Ba4gydF4y2Ba,gydF4y2Ba5gydF4y2Ba,gydF4y2Ba6gydF4y2Ba).这些相互作用体合并成一个单一的网络,这与肌聚糖相互作用体在ERK调节和肌肉生存信号传导中的作用是一致的。gydF4y2Ba
途径分析表明,相互关联的生存信号通路与肌膜肌聚糖、肌营养不良蛋白和大绒毛蛋白之间存在交叉作用。图中所示的与Sgcg共免疫沉淀或结合蛋白的基因名是用IPA软件在默认的有机视图中排列的。13个顶级候选Sgcg交互者中的11个,以及5个其他候选交互者中的3个(图。gydF4y2Ba3.gydF4y2Ba),被分配到TP53/ESR2/ trim25相关信号网络或肌糖、肌萎缩蛋白、肌糖相关肌层网络。颜色突出SGCG(洋红色),SVIL(黄色),NKCC1/SLC12A2(绿色),其他顶级候选交互器(蓝色)和其他候选交互器(灰色)。IPA软件添加了额外的基因(白色)和直接(实线)和间接(虚线)相互作用。B-Raf、MEK1/2和ERK1/2信号级联(橙色)与β- dysstroglycan /DAG的相互作用[gydF4y2Ba88gydF4y2Ba]及SVIL [gydF4y2Ba30.gydF4y2Ba手动添加]gydF4y2Ba
讨论gydF4y2Ba
使用一种优化的肌肉膜蛋白回收的蛋白质组学方法,我们确定了新的Sgcg候选直接或间接相互作用物,并扩展到SC。我们的筛选确定了SC的所有亚单位,以及16个其他蛋白质,这些蛋白质与含有SC的肌肉中的高亲和性Sgcg抗体特异性共ip,但在肌肉中减少gydF4y2BaSgcggydF4y2Ba−−/gydF4y2Ba缺乏这些蛋白质的小鼠(图;gydF4y2Ba3.gydF4y2Ba).我们的方法与以往研究的不同之处包括对膜的预先富集以及使用带有SDS的IP缓冲液对细胞骨架相关的耐洗涤剂膜进行分析。使用gydF4y2BaSgcggydF4y2Ba−−/gydF4y2Ba肌肉作为特异性对照,消除了存在于co-IPs中的蛋白质,这是由于免疫印迹或IF无法识别的低亲和性抗体交叉反应(其他文件)gydF4y2Ba3.gydF4y2Ba而且gydF4y2Ba4gydF4y2Ba;表S2和S3)。特别值得注意的是,图中大多数确定的顶部和其他候选交互者。gydF4y2Ba3.gydF4y2Ba很容易被分组到一个单一的信号通路中,该通路将ERK调节与生存信号联系起来(图2)。gydF4y2Ba10gydF4y2Ba).gydF4y2Ba
在二次筛选中,NKCC1作为与Sgcg的潜在交互作用体出现,其中包括共定位外源表达的SC蛋白和候选交互作用体(图2)。gydF4y2Ba4gydF4y2Ba,其他文件gydF4y2Ba10gydF4y2Ba,gydF4y2Ba11gydF4y2Ba,gydF4y2Ba12gydF4y2Ba,无花果。S7, S8, S9)。免疫荧光共定位(图gydF4y2Ba5gydF4y2Ba), co-IP(图;gydF4y2Ba6gydF4y2BaA),上清液消耗试验(图;gydF4y2Ba6gydF4y2BaB, C)和PLA(图。gydF4y2Ba6gydF4y2BaD, E)与SC和NKCC1细胞质畴之间的低亲和度直接或间接相互作用一致,这种相互作用的大小可能与Sgcg n端与大绒毛c端直接的低亲和度结合相当(图5)。gydF4y2Ba9gydF4y2Ba).我们还发现,NKCC1与肌营养不良蛋白在骨骼肌的costameres和内部肌肉条纹处重叠(图2)。gydF4y2Ba7gydF4y2Ba),这些位点可能是t小管参与细胞内CagydF4y2Ba++gydF4y2Ba规定(gydF4y2Ba82gydF4y2Ba,gydF4y2Ba89gydF4y2Ba].NKCC1抑制剂布美他尼的生理分析也表明Na的作用gydF4y2Ba+gydF4y2BaKgydF4y2Ba+gydF4y2Ba2氯gydF4y2Ba−gydF4y2Basc介导的ERK信号在骨骼肌中的共转运(图;gydF4y2Ba8gydF4y2Ba).NKCC1在t小管附近的定位以及在ECC应变后NKCC1共同转运在肌聚糖调控信号中的明显作用支持了NKCC1与SC的直接或间接相互作用。gydF4y2Ba
在含有sds的RIPA1缓冲液中,在co-IP过程中观察到全长NKCC1和Sgcg之间的高亲和性关联。gydF4y2Ba3.gydF4y2Ba),在IF中用洗涤剂预萃取后(图;gydF4y2Ba4gydF4y2Ba)表明这种关联不仅仅涉及我们体外实验中使用的NKCC1细胞质结构域(图2)。gydF4y2Ba6gydF4y2Ba).在上清液消耗试验或PLA中观察到的相互作用,如Sgcg与NKCCI细胞质域的相互作用(图2)。gydF4y2Ba6gydF4y2Ba)和archvillin(图。gydF4y2Ba9gydF4y2Ba),亲水性可能较低。Sgcg和大绒毛蛋白之间的低亲和性相互作用与其在酵母双杂交试验中的鉴定一致[gydF4y2Ba26gydF4y2Ba],也能探测弱相互作用[gydF4y2Ba90gydF4y2Ba].低亲和度相互作用通常是累积的,受翻译后修饰的调节,已知在信号网络中发挥重要作用[gydF4y2Ba91gydF4y2Ba,gydF4y2Ba92gydF4y2Ba].涉及NKCC1跨膜或细胞外结构域的其他相互作用可能是在体内与Sgcg紧密结合所必需的,无论是通过直接结合还是通过与这个新兴信号网络中的其他蛋白质的间接结合。跨膜结构域本身通过在膜表面定向和集中两个伙伴,可以将结合的亲和性提高约100倍[gydF4y2Ba93gydF4y2Ba].NKCC1与DGC之间的多个连接也被认为是由NKCC1的sc独立定位gydF4y2BaSgcggydF4y2Ba−−/gydF4y2Ba肌肉(图。gydF4y2Ba7gydF4y2Ba).因此,与dgc相关的信号网络可能由许多转录后调节的相互作用与可变的和可调节的活性组成。gydF4y2Ba
虽然涉及PP1β、MYPT2和紧张素的二级筛选结果不支持与SC的相互作用,但这些结果并不能消除间接或条件关联的可能性。例如,PP1β可能通过与NKCC1结合而间接与Sgcg结合[gydF4y2Ba66gydF4y2Ba].此外,在细胞裂解液中使用PP1β的测定受到了约200种已知的PP1β结合蛋白的挑战,这些蛋白可以作为内源性竞争抑制剂[gydF4y2Ba94gydF4y2Ba].考虑到SC和P-ERK信号之间的相互作用,Sgcg仍有可能调控PP1β在costameres的定位或功能[gydF4y2Ba18gydF4y2Ba,gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba24gydF4y2Ba].gydF4y2Ba
我们的新方法扩展了sc相互作用候选蛋白的列表,从而补充了之前研究的结果[gydF4y2Ba95gydF4y2Ba,gydF4y2Ba96gydF4y2Ba].我们的大多数候选相互作用子是从细胞骨架相关的膜片段中获得的,通常没有被询问。此外,在RIPA1缓冲液中包含SDS可能破坏了许多先前报道的相互作用。例如,β-反stroglycan是一种被广泛接受的SC [gydF4y2Ba5gydF4y2Ba,gydF4y2Ba97gydF4y2Ba在我们的RIPA1裂解液中(图。gydF4y2Ba2gydF4y2BaE),但在我们的co- ip中并没有作为特定的相互作用者出现(图。gydF4y2Ba3.gydF4y2Ba).公认的β-反糖甘聚糖- sc相互作用来自于co-IPs与非离子洗涤剂提取物的膜没有紧密结合到细胞骨架[gydF4y2Ba95gydF4y2Ba,gydF4y2Ba96gydF4y2Ba].程序上的差异可能解释了β-营养不良聚糖和其他已发表的sc相关蛋白从我们的候选相互作用物列表中缺席。gydF4y2Ba
NKCC1在骨骼肌机械传导中的作用与先前的研究一致。NKCC1长期以来一直被认为是肌肉体积控制的必要条件,而肌肉体积控制是由P-ERK在渗透而非高渗透条件下调节的[gydF4y2Ba98gydF4y2Ba].NKCC1参与成肌细胞分化和运动诱导的骨骼肌肥大[gydF4y2Ba84gydF4y2Ba],以及苯肾上腺素介导的平滑肌节律性收缩[gydF4y2Ba99gydF4y2Ba].NKCC1活性还促进低钾周期性瘫痪小鼠模型肌肉力量的短暂下降[gydF4y2BaOne hundred.gydF4y2Ba,gydF4y2Ba101gydF4y2Ba].其作用机制被认为与细胞内钙离子的短暂积聚增加有关,而细胞内钙离子的短暂积聚是由肌膜下依赖nkcc1的氯反离子浓度的增加而增强的[gydF4y2Ba99gydF4y2Ba,gydF4y2Ba102gydF4y2Ba,gydF4y2Ba103gydF4y2Ba].ECC促进CagydF4y2Ba++gydF4y2Ba穿过肌膜[gydF4y2Ba104gydF4y2Ba],而由许多遗传机制引起的钙内流增加足以诱发肌营养不良[gydF4y2Ba105gydF4y2Ba,gydF4y2Ba106gydF4y2Ba].因此,NKCC1在SC的功能可能与导致长期肌肉损伤的分子事件有关。gydF4y2Ba
我们的生理学分析表明,NKCC1转运蛋白活性降低了静息野生型肌肉中ERK的激活,并促进了ECC后sc依赖性P-ERK的增加。ERK1/2活化保护肌纤维免受损伤,并有助于心脏肥厚和骨骼肌中营养不良蛋白和营养不良蛋白的表达[gydF4y2Ba29gydF4y2Ba,gydF4y2Ba107gydF4y2Ba,gydF4y2Ba108gydF4y2Ba].因此,NKCC1转运蛋白活性可能拮抗静息肌中的ERK激活,并有助于ECC后刺激诱导的ERK激活。事实上,先前的研究已经将NKCC1活性定位于ERK激活的上游和下游。抑制气管上皮细胞ERK信号通路降低布美他尼敏感性gydF4y2Ba36gydF4y2BaClgydF4y2Ba−gydF4y2Ba摄取,NKCC1活性的测量方法[gydF4y2Ba109gydF4y2Ba].然而,NKCC1的抑制或耗尽减弱了成纤维细胞中的P/T ERK磷酸化[gydF4y2Ba110gydF4y2Ba,gydF4y2Ba111gydF4y2Ba],星形胶质细胞[gydF4y2Ba112gydF4y2Ba],海拉细胞[gydF4y2Ba113gydF4y2Ba],以及受伤的大鼠脑[gydF4y2Ba114gydF4y2Ba].表皮生长因子刺激角膜上皮细胞促进NKCC1和P-ERK1/2的co-IP [gydF4y2Ba115gydF4y2Ba,表明刺激介导的关联。P-ERK1/2的上调也与NKCC1在癌细胞中的抗凋亡活性一致[gydF4y2Ba116gydF4y2Ba].因此,NKCC1为SC协调Ca提供了一条途径gydF4y2Ba++gydF4y2Ba和P-ERK信号,静息肌和刺激肌之间的差异是由于PP1β和信号激酶的NKCC1脚手架的调节[gydF4y2Ba66gydF4y2Ba].肌肉劳损也可能影响NKCC1与大恶棍蛋白/激酶/PP1β支架与SC结合的协调或竞争。gydF4y2Ba
肌肉中NKCC1和肌营养不良蛋白之间的信号重叠区域暗示着邻近的costameres, SC信号的可能位置。Costameres是富含小泡蛋白-3、胆固醇、不溶性洗涤脂类和细胞骨架蛋白的结构化脂质微域,是一种“脂筏”[gydF4y2Ba117gydF4y2Ba].富含胆固醇的脂筏通过改变构象或与其他蛋白质的结合来调节许多离子通道[gydF4y2Ba118gydF4y2Ba,gydF4y2Ba119gydF4y2Ba].caveolin-3的缺失导致costameric Sgca的缺失和ERK信号的增强[gydF4y2Ba117gydF4y2Ba].NKCC1与脂质筏相关蛋白共同从大鼠脑中分离,NKCC1活性因破坏原生膜中的这些结构域而受到抑制[gydF4y2Ba120gydF4y2Ba],表明肋虫脂筏可上调NKCC1活性。相反,NKCC1已被证明与胰岛素调节、l型氨基酸转运蛋白LAT1/SLC7A5相互作用并抑制[gydF4y2Ba121gydF4y2Ba],导致ERK、Akt和mTOR信号通路降低[gydF4y2Ba113gydF4y2Ba].因此,Costameric NKCC1可以通过构象变化或其他Costameric蛋白的定位转移来调节ERK信号。gydF4y2Ba
虽然sc介导的信号传导的全部机制仍有待阐明,但这里确定的候选Sgcg相互作用体提示了许多肌病的干预机制。NKCC1促进氯摄取的作用[gydF4y2Ba67gydF4y2Ba]可能具有重要的机制,因为由此导致的细胞质Cl的增加gydF4y2Ba−gydF4y2Ba能够支持细胞内CagydF4y2Ba++gydF4y2Ba负责肌肉损伤的钙gydF4y2Ba++gydF4y2Ba抗衡离子(gydF4y2Ba106gydF4y2Ba].雌激素-、TRIM25-和tp53相关信号通路的候选相互作用物也提示与抗凋亡通路的交叉作用[gydF4y2Ba122gydF4y2Ba以及进一步研究的其他途径,包括与基于nkcc1的遗传疾病的潜在相关性[gydF4y2Ba123gydF4y2Ba].gydF4y2Ba
结论gydF4y2Ba
我们的结果表明,NKCC1直接或间接地与小鼠肌肉中的肌聚糖复合物相关。NKCC1转运活性的抑制与ECC后肌聚糖介导的ERK1/2信号调节的作用一致。对其他候选Sgcg相互作用体的通路分析表明,生存信号机制可能是肢带肌营养不良和其他肌病的可操作临床靶点。gydF4y2Ba
数据和材料的可用性gydF4y2Ba
提供蛋白质组学实验的抗体特征、阴性数据和MS Excel格式的样本报告作为补充数据。质谱蛋白质组学数据已通过PRIDE存入ProteomeXchange Consortium [gydF4y2Ba124gydF4y2Ba数据集标识符为PXD028584和10.6019/PXD028584。支架4.4.4蛋白质组学文件是图的基础。gydF4y2Ba3.gydF4y2Ba可以从通讯作者那里获得,以及来自新的svil突变小鼠菌株的快速冷冻肌肉。自制的亲和纯化抗sgcg和抗mav兔多克隆抗体也可根据合理要求提供,供应截止。gydF4y2Ba
缩写gydF4y2Ba
- ATP:gydF4y2Ba
-
三磷酸腺苷gydF4y2Ba
- CagydF4y2Ba++gydF4y2Ba:gydF4y2Ba
-
钙离子gydF4y2Ba
- 埋头:gydF4y2Ba
-
细胞骨架的缓冲gydF4y2Ba
- 及其它:gydF4y2Ba
-
肌萎缩蛋白糖蛋白复合物gydF4y2Ba
- 德勤:gydF4y2Ba
-
二硫苏糖醇gydF4y2Ba
- ECC:gydF4y2Ba
-
偏心收缩gydF4y2Ba
- 发射极耦合逻辑:gydF4y2Ba
-
增强化学发光gydF4y2Ba
- ECM:gydF4y2Ba
-
细胞外基质gydF4y2Ba
- 联盟:gydF4y2Ba
-
指长伸肌gydF4y2Ba
- ERK1/2:gydF4y2Ba
-
细胞外调节激酶1和2gydF4y2Ba
- 销售税:gydF4y2Ba
-
谷胱甘肽s-transferasegydF4y2Ba
- IB:gydF4y2Ba
-
免疫印迹gydF4y2Ba
- 如果:gydF4y2Ba
-
免疫荧光gydF4y2Ba
- 知识产权:gydF4y2Ba
-
免疫沉淀反应gydF4y2Ba
- 异丙醇:gydF4y2Ba
-
匠心路径分析软件gydF4y2Ba
- LAT1 / SLC7A5:gydF4y2Ba
-
中性氨基酸转运体大,亚基1小gydF4y2Ba
- 质/女士:gydF4y2Ba
-
液相色谱串联质谱gydF4y2Ba
- LGMD:gydF4y2Ba
-
四肢肌营养不良gydF4y2Ba
- MAPK:gydF4y2Ba
-
丝裂原激活蛋白激酶gydF4y2Ba
- 微型飞机:gydF4y2Ba
-
小鼠archvillingydF4y2Ba
- MEK1/2:gydF4y2Ba
-
MAPK/ERK激酶1和2gydF4y2Ba
- 拖把:gydF4y2Ba
-
3-Morpholinopropane-1-sulfonic酸gydF4y2Ba
- MYPT2 / PPP1r12b:gydF4y2Ba
-
肌球蛋白磷酸酶靶亚基2/蛋白磷酸酶1,调节亚基12BgydF4y2Ba
- NKCC1:gydF4y2Ba
-
氯化钠钾共转运体1gydF4y2Ba
- 计划:gydF4y2Ba
-
接近结扎法gydF4y2Ba
- PMSF:gydF4y2Ba
-
Phenylmethylsulfonyl氟化gydF4y2Ba
- PP1β:gydF4y2Ba
-
丝氨酸/苏氨酸蛋白磷酸酶催化亚基1 βgydF4y2Ba
- (P / T) -ERK1/2:gydF4y2Ba
-
(磷/总)ERK1/2gydF4y2Ba
- RH30:gydF4y2Ba
-
SJC-RH30人横纹肌肉瘤细胞gydF4y2Ba
- 里帕:gydF4y2Ba
-
放射免疫沉淀测定缓冲液gydF4y2Ba
- 处方:gydF4y2Ba
-
放松的缓冲gydF4y2Ba
- SLC12A2:gydF4y2Ba
-
溶质载体家族12个成员2gydF4y2Ba
- SC:gydF4y2Ba
-
Sarcoglycan复杂gydF4y2Ba
- Sgca:gydF4y2Ba
-
Alpha-sarcoglycangydF4y2Ba
- Sgcb:gydF4y2Ba
-
Beta-sarcoglycangydF4y2Ba
- Sgcd:gydF4y2Ba
-
Delta-sarcoglycangydF4y2Ba
- Sgcg:gydF4y2Ba
-
Gamma-sarcoglycangydF4y2Ba
- Svil SV:gydF4y2Ba
-
SupervillingydF4y2Ba
- 助教:gydF4y2Ba
-
胫前肌gydF4y2Ba
- 水控制法:gydF4y2Ba
-
全细胞裂解液gydF4y2Ba
参考文献gydF4y2Ba
埃尔瓦斯蒂JM,坎贝尔KP。肌萎缩蛋白-糖蛋白复合物作为层粘连蛋白和肌动蛋白之间的跨膜连接物的作用。中国生物医学工程学报,2001;29(4):344 - 344。gydF4y2Ba
Henderson CA, Gomez CG, Novak SM, Mi-Mi L, Gregorio CC.肌肉细胞骨架概述。中国生物医学工程学报,2017;7(3):891-944。gydF4y2Ba
整合素信号在心肌细胞生长和存活中的重要性。第2002;90(12):1240-2。gydF4y2Ba
刘玲,徐华,王志强,王志强,等。整合素(alpha7beta1)在肌肉功能和生存中的作用。蛋白缺失性先天性肌营养不良的中断表达。中国科学(d辑),2005;gydF4y2Ba
Barton ER, Pacak CA, Stoppel WL, Kang PB。结合的纽带:肢带肌营养不良的功能集群。骨骼肌。2020;10(1):22。gydF4y2Ba
Ervasti JM, Sonnemann KJ。横纹肌营养不良蛋白-糖蛋白复合物的生物学研究。中国生物医学杂志,2008;26(2):366 - 366。gydF4y2Ba
张志刚,张志刚。骨骼肌中肌聚糖复合物的研究。前沿生物科学(Landmark Ed)。2016; 21:744-56。gydF4y2Ba
Pardo JV, Siliciano JD, Craig SW。骨骼肌中含有vinkin的皮质晶格:横向晶格元件(“costameres”)标记肌原纤维和肌膜之间的附着位点。美国国家科学研究院。1983年,80(4):1008 - 12所示。gydF4y2Ba
布洛赫RJ,冈萨雷斯-塞拉托斯H.横向力传输在骨骼肌。运动运动科学,2003;31(2):73-8。gydF4y2Ba
Ervasti JM。肋肌:大力士肌肉的致命弱点。中国生物医学工程学报,2003;29(3):342 - 344。gydF4y2Ba
陈杰,陈志勇,陈志勇,陈志勇,陈志勇。横纹肌中肋节是连接肌节和肌膜的桥梁。儿科心脏病进展。2011;31(2):83-8。gydF4y2Ba
Sit B, Gutmann D, Iskratsch T. Costameres,密集斑块和podosomes:心血管机械感应中的细胞基质粘连。中华肌肉科学杂志,2019;40(2):197-209。gydF4y2Ba
膜交通蛋白在肌肉膜应激反应中的非传统作用。《细胞生物学》杂志,2020;65:42-9gydF4y2Ba
肌肉疾病:肌肉营养不良。《病理学年鉴》2007;2:87-109。gydF4y2Ba
肌肉营养不良症与肌肉蛋白遗传缺陷相关的谱系研究。生物化学学报,2015;1852(4):585-93。gydF4y2Ba
Hack AA, Ly CT, Jiang F, Clendenin CJ, Sigrist KS, Wollmann RL,等。-肌聚糖缺乏导致肌膜缺陷和独立于肌营养不良蛋白的细胞凋亡。中国生物医学工程学报,1998;29(5):339 - 339。gydF4y2Ba
张志刚,张志刚,张志刚。四肢肌营养不良症的发病机制及遗传基础研究进展。中国生物医学工程学报。2019;34(6):844 - 844。gydF4y2Ba
巴顿。肌聚糖复合物对小鼠骨骼肌机械信号转导的影响。中国生物医学工程学报。2006;29(2):529 - 529。gydF4y2Ba
Hack AA, Cordier L, Shoturma DI, Lam MY, Sweeney HL, McNally EM.肌糖缺乏症中无机械损伤的肌肉退变。中国科学(d辑),1999;26(3):339 - 344。gydF4y2Ba
Moorwood C, Philippou A, Spinazzola J, Keyser B, Macarak EJ, Barton ER。γ -肌聚糖的缺失改变P70S6激酶对小鼠骨骼肌机械扰动的反应。骨骼肌。2014;4:13。gydF4y2Ba
Thompson TG, Chan YM, Hack AA, Brosius M, Rajala M, Lidov HG,等。丝蛋白2 (FLN2):一种肌肉特异性肌聚糖相互作用蛋白。中国生物医学工程学报,2000;29(1):326 - 326。gydF4y2Ba
马剑锋,冯海燕,马志强,刘志强,等。γ -糖聚糖缺乏增加细胞收缩力、凋亡和mapk通路激活,但不影响粘附。中国生物医学工程学报,2005;29(7):344 - 344。gydF4y2Ba
杨晓东,张志强,张志强,张志强,等。Na+失调加上Ca2+通过NCX1进入促进小鼠肌肉营养不良。分子生物学杂志,2014;34(11):1991-2002。gydF4y2Ba
巴顿。小鼠骨骼肌中γ -肌聚糖定位的恢复和机械信号转导是独立的。中国生物医学工程学报,2010;29(2):339 - 339。gydF4y2Ba
Blandin G, Marchand S, Charton K, Daniele N, Gicquel E, Boucheteil JB,等。一种以肌肉营养不良蛋白为中心的人类骨骼肌相互作用组:LGMD相互作用组。骨骼肌。2013;3(1):3。gydF4y2Ba
斯皮纳佐拉JM,史密斯TC,刘m,卢娜EJ,巴顿ER。-肌聚糖是骨骼肌中大绒毛蛋白对机械刺激的反应所必需的。中国生物科学。2015;24(9):2470-81。gydF4y2Ba
Oh SW, Pope RK, Smith KP, Crowley JL, Nebl T, Lawrence JB,等。大绒毛蛋白是一种肌肉特异性的超绒毛蛋白亚型,是肋膜骨架的早期表达成分。中国生物医学工程学报(英文版)2003;11): 2261 - 75。gydF4y2Ba
Hedberg-Oldfors C, Meyer R, Nolte K, Abdul Rahim Y, Lindberg C, Karason K,等。超绒毛蛋白缺失引起肌病,伴有肌原纤维紊乱和自噬空泡。大脑。2020;143(8):2406 - 20。gydF4y2Ba
Boyer JG, Prasad V, Song T, Lee D, Fu X, Grimes KM,等。ERK1/2信号传导诱导骨骼肌慢纤维类型转换,降低肌肉营养不良疾病的严重程度。江森自控。洞察力。2019;5。gydF4y2Ba
甘格帕德哈伊,Kengni E, Appel S, Gallant C, Kim HR, Leavis P,等。平滑肌大绒毛蛋白是ERK支架蛋白。中国生物医学工程学报,2009;26(4):457 - 457。gydF4y2Ba
Pestonjamasp KN, Pope RK, Wulfkuhle JD, Luna EJ。超级绒毛蛋白(P205):绒毛蛋白/胶质蛋白超家族中一种新的膜相关的f -肌动蛋白结合蛋白。中国生物医学工程学报,1997;39(5):529 - 529。gydF4y2Ba
方志勇,卢娜。超绒毛蛋白介导的P53蛋白抑制增强细胞存活。中国生物医学工程学报,2013;29(4):529 - 529。gydF4y2Ba
Takizawa N, Smith TC, Nebl T, Crowley JL, Palmieri SJ, Lifshitz LM,等。涉及TRIP6/ZRP-1的局灶粘连的超绒毛调节。中国生物医学工程学报。2006;29(3):344 - 344。gydF4y2Ba
竹泽N,池部R,池部M,卢娜EJ。超级绒毛蛋白通过促进细胞外围肌球蛋白II的激活来减缓细胞的扩散。中国生物医学工程学报,2007;29(4):379 - 379。gydF4y2Ba
Nebl T, Pestonjamasp KN, Leszyk JD, Crowley JL, Oh SW, Luna EJ。中性粒细胞质膜抗洗涤剂膜骨架的蛋白质组学分析。中国生物医学工程学报,2002;27(4):439 - 439。gydF4y2Ba
高QQ, Wyatt E, Goldstein JA, LoPresti P, Castillo LM, Gazda A,等。利用外显子跳跃式重组跨膜蛋白治疗肌营养不良。中国临床医学杂志,2015;29(4):344 - 344。gydF4y2Ba
Laemmli英国。在T4噬菌体头部组装过程中结构蛋白的切割。自然(Lond)。1970; 227:680-5。gydF4y2Ba
博恩霍斯特JA,法尔克JJ。利用多组氨酸亲和标记纯化蛋白质。方法酶制剂,2000;326:245-54。gydF4y2Ba
阮氏M, Cartwright AJ, Morris GE, Love DR, Bloomfield JF, Davies KE。该单克隆抗体对抗肌营养不良蛋白的特定区域。中国科学(d辑:自然科学)。gydF4y2Ba
Hughes SM, Cho M, Karsch-Mizrachi I, Travis M, Silberstein L, Leinwand LA,等。三种慢肌球蛋白重链在发育中的哺乳动物骨骼肌中依次表达。中国生物医学工程学报,1993;29(1):344 - 344。gydF4y2Ba
韦伯斯特C,西尔伯斯坦L,海斯AP,布劳HM。杜氏肌营养不良症优先影响快肌纤维。细胞。1988;52(4):503 - 13所示。gydF4y2Ba
丛林,冉发,考克斯,林s,巴雷托R,哈比布N,等。利用Crispr/Cas系统进行多重基因组工程。科学。2013;339(6121):819 - 23所示。gydF4y2Ba
Yamamoto N, Yamashita Y, Yoshioka Y, Nishiumi S, Ashida H.质膜组分的快速制备:western blot检测肌肉和脂肪细胞和组织质膜易位葡萄糖转运蛋白4。中国生物工程学报(自然科学版)2016;85:29.18.1-29.18.12。gydF4y2Ba
白色的直流。严格收缩和各种磷酸盐化合物对甘油化昆虫飞行和脊椎动物肌肉的影响。中国生物医学工程学报,2000,19(3):344 - 344。gydF4y2Ba
Del Buono BJ, Luscinskas FW, Simons ER。人多形核白细胞质膜囊泡的制备与表征。中国生物医学工程学报(英文版)。gydF4y2Ba
欧伦迪克,埃尔瓦斯提,斯努克,坎贝尔。肌萎缩蛋白-糖蛋白复合物在离体骨骼肌肌膜中高度富集。中国生物医学工程学报,2001;29(1):344 - 344。gydF4y2Ba
宋ks,李S,冈本T, Quilliam LA, Sargiacomo M, Lisanti MP。ras与小泡微结构域的一种完整的膜蛋白——小泡蛋白(caveolin)共纯化及直接相互作用。无洗涤剂净化小泡微域。中国生物化学杂志,1996;271(16):9690-7。gydF4y2Ba
Joe MK, Kee C, Tomarev SI。心肌蛋白与复合营养因子相互作用,是肌萎缩蛋白相关蛋白复合物的成员。中国生物医学工程学报,2012;gydF4y2Ba
Arias-Calderon M, Almarza G, Diaz-Vegas A, Contreras-Ferrat A, Valladares D, Casas M,等。涉及骨骼肌兴奋-转录偶联的多蛋白复合物的特征。骨骼肌。2016;6:15。gydF4y2Ba
四肢肌营养不良症的遗传基础:2014年更新。肌醇学报,2014;33(1):1 - 12。gydF4y2Ba
霍尔特K,坎贝尔KP。糖聚糖复合物的组装。对肌肉萎缩症的见解。中国生物医学工程学报,1998;29(3):342 - 344。gydF4y2Ba
费奇海默M,戴斯JL,斑马JJ。免疫球蛋白与肌动蛋白的相互作用。中华免疫杂志,1979;16:881-8。gydF4y2Ba
Lesage B, Beullens M, Nuytten M, Van Eynde A, Keppens S, Himpens B,等。相互作用体介导的蛋白磷酸酶-1的核易位和保留。中国生物医学工程学报,2004;29(3):344 - 344。gydF4y2Ba
丁林-马尔卡希L,斯利曼JE,艾拉蒙。动态靶向蛋白磷酸酶1在活的哺乳动物细胞核内。中国生物医学工程学报,2001;23 (p23): 287 - 287。gydF4y2Ba
Clark K, Howe JD, Pullar CE, Green JA, Artym VV, Yamada KM,等。张力蛋白2通过Rhogap Dlc1调节3D胶原凝胶中的细胞收缩力。中国生物医学工程学报。2010;39(4):344 - 344。gydF4y2Ba
Somasekharan S, Monette MY, Forbush B.合成的基于卡带的cDNA的人NKCC1功能表达:引入细胞外表位标签和去除半胱氨酸。公共科学图书馆,2013;8(12):E82060。gydF4y2Ba
李文杰,李志刚,李志刚。超绒毛蛋白在早期细胞质分裂中的新相互作用和作用。细胞骨架(霍博肯)。2010, 67(6): 346 - 64。gydF4y2Ba
Spinazzola JM。-肌聚糖介导的骨骼肌机械传导[博士]。费城:宾夕法尼亚大学;2015.gydF4y2Ba
史密斯TC,索尔RG,巴顿ER,卢娜EJ。识别人类和小鼠超绒毛蛋白异构体的单克隆抗体的生成和特性。PLoS One. 2018;13(10):E0205910。gydF4y2Ba
瓦格纳S,奇奥西S,尼克森JA。SRm160的空间靶向和核基质结合域。中国科学(d辑:自然科学版),2003;26(6):366 - 366。gydF4y2Ba
波拉德道明。一个简单和信息丰富的绑定分析指南。Mol生物学杂志,2010;21(23):4061-7。gydF4y2Ba
Moorwood C,刘敏,田泽,Barton ER。从肌肉萎缩症小鼠模型中分离的骨骼肌的等距和偏心力产生评估。J Vis Exp 2013;(71):E50036。gydF4y2Ba
drviam RA, Wang B, Shand SH, Xiao X, Watkins SC. α -糖聚糖在无糖聚糖复合物组装的情况下从质膜回收。交通。2006;7(7):793 - 810。gydF4y2Ba
史伟,陈震,肖特费尔德J,斯塔尔RC,孔克尔LM,陈玉明。肌聚糖的特定组装途径依赖于-和-肌聚糖。肌肉神经。2004;29(3):409-19。gydF4y2Ba
Yoshida M, Suzuki A, Yamamoto H, Noguchi S, Mizuno Y, Ozawa E. n -辛基β - d -葡萄糖苷将营养不良蛋白及其相关蛋白复合物分解成几个独特的基团。生物化学学报,1994;22(3):1055-61。gydF4y2Ba
蛋白磷酸酶1 (PP1)的多种途径调节Na-K-2Cl共转运体(NkCC1)的功能:Na-K-2Cl共转运体的n端尾部作为ste20相关的富脯氨酸/丙氨酸激酶(SPAK)和PP1的调节支架。中国生物医学工程学报,2010;29(4):516 - 516。gydF4y2Ba
Delpire E, Gagnon KB。NagydF4y2Ba+gydF4y2Ba- kgydF4y2Ba+gydF4y2Ba2氯gydF4y2Ba-gydF4y2Ba共转运体(NKCC)在非极化细胞和转运上皮中的生理功能。中国生物医学工程学报,2018;8(2):871-901。gydF4y2Ba
莫法特LD,沃尔什MP,麦克唐纳JA。肌凝蛋白磷酸酶靶向蛋白(MYPT)家族:实现蛋白磷酸酶1delta催化亚基底物特异性的调控机制。中国生物医学工程学报。2011;29(2):357 - 357。gydF4y2Ba
Moorhead G, Johnson D, Morrice N, Cohen P.骨骼肌中的主要肌球蛋白磷酸酶是蛋白质磷酸酶1的β亚型和MYPT2基因产物之间的复合物。《科学通报》1998;438(3):141-4。gydF4y2Ba
冈本R,加藤T,沟口A,高桥N,中树T,水谷H,等。心肌肌凝蛋白磷酸酶靶亚基MYPT2的特征及功能。细胞信号。2006;18(9):1408-16。gydF4y2Ba
tensin是rho GTPase信号和细胞粘附的多功能调节因子。中国生物医学工程学报,2017;39(3):344 - 344。gydF4y2Ba
刘志刚,刘志刚,刘志刚。局部性粘连中紧张素n端蛋白酪氨酸磷酸酶结构域与蛋白磷酸酶-1 α亚型的关系。中国生物化学杂志,2007;82(24):17806-15。gydF4y2Ba
张志刚,张志刚,张志刚,等。磷酸腺苷活化蛋白激酶与整合素活化的关系。细胞生物学杂志,2017;27(10):703-11。gydF4y2Ba
Gehmlich K, Pinotsis N, Hayess K, van der Ven PF, Milting H, El Banayosy A,等。Paxillin和ponsin在肌肉细胞的新生costameres中相互作用。中华分子生物学杂志,2007;369(3):665-82。gydF4y2Ba
Otey CA, Rachlin A, Moza M, Arneman D, Carpen O.肌钙蛋白/肌钙蛋白家族的肌动蛋白相关支架。中国生物医学杂志,2005;46(1):1 - 5。gydF4y2Ba
李国强,李国强,李国强。在分泌Na+- k +- 2cl -共转运蛋白(NKCC1)的C端附近有一个保守的疏水四分体,这是其正确的细胞内处理所必需的。中国生物医学工程学报,2009;26(4):457 - 457。gydF4y2Ba
Singh R, Almutairi MM, Pacheco-Andrade R, Almiahuob MY, Di Fulvio M.混合和复杂n -聚糖对内源性氯离子共转运体SLC12A2表面靶向的影响。中国生物医学工程学报。2015;gydF4y2Ba
张敏,张晓明,张晓明,张晓明。MEF2D表达缺失抑制横纹肌肉瘤细胞分化并促进肿瘤发生。中华肿瘤杂志,2013;12(1):150。gydF4y2Ba
Bannert N, Vollhardt K, Asomuddinov B, Haag M, Konig H, Norley S,等。PDZ域介导的白介素-16前体蛋白与肌凝蛋白磷酸酶靶向亚基的相互作用。中国生物医学工程学报,2003;29(4):339 - 339。gydF4y2Ba
McMahon KA, Wu Y, Gambin Y, Sierecki E, Tillu VA, Hall T,等。细胞内cavin靶蛋白的鉴定揭示了cavin- pp1alpha相互作用调节凋亡。地理学报。2019;10(1):3279。gydF4y2Ba
王佳,傅林,施耐德EG, Thomason DB。Na(+)- k (+)- 2cl(-)共转运蛋白在大鼠骨骼肌中的表达的分子和功能证据。中国生物医学工程学报。1999;27(1):344 - 344。gydF4y2Ba
洪涛,邵梁。心脏t管显微解剖与功能。物理学报,2017;39(1):344 - 344。gydF4y2Ba
Murphy RM, Mollica JP, Lamb GD。大鼠骨骼肌纤维的质膜去除显示了横小管颈部的小穴蛋白-3热点。科学通报,2009;29(6):344 - 344。gydF4y2Ba
万大S,古川S, Kodaka M,畑Y,森T,野村N,等。循环利尿剂影响骨骼肌成肌细胞分化和运动诱导的肌肉肥大。科学通报2017;7:46369。gydF4y2Ba
Monette MY, Forbush B.调节激活伴随着Na-K-Cl共转运体(NKCC1) C端运动。中国生物医学工程学报,2012;gydF4y2Ba
陈志强,李志强,李志强,陈志强,等。SPAK/OSR1激酶与其上游激活物wnk1和下游底物NKCC1的功能相互作用。中国生物化学杂志,2006;36(1):344 - 344。gydF4y2Ba
Müller T, Schrotter A, Loosse C, Helling S, Stephan C, Ahrens M,等。蛋白质组学中通路分析软件的意义与无意义。中国生物工程学报(自然科学版),2011;10(12):5398-408。gydF4y2Ba
王志强,王志强,王志强。Dystroglycan, ERK-MAP激酶级联的支架。Embo报告2004;5(5):484-9。gydF4y2Ba
骨骼肌从兴奋到细胞内Ca(2+)运动:基本方面及相关临床疾病。神经肌肉失调。2018;28(5):394-401。gydF4y2Ba
李志强,李志强,李志强,等。双杂交亲和性数据与体外检测的相关性。分子生物学杂志,1995;15(10):5820-9。gydF4y2Ba
詹姆森SC,霍格奎斯特KA,比文MJ。胸腺细胞阳性选择。中华免疫杂志1995;13:93-126。gydF4y2Ba
Ivashkiv LB. ITAMs如何抑制信号。科学通报,2011;4(169):Pe20。gydF4y2Ba
谢志荣,陈娟,吴艳。膜蛋白三维和二维结合动力学的多尺度模拟。蛋白质科学,2014;23(12):1789-99。gydF4y2Ba
Brautigan DL, Shenolikar S.蛋白质丝氨酸/苏氨酸磷酸酶:解锁调控因子和底物的关键。生物化学,2018;87:921-64。gydF4y2Ba
Imamura M, Araishi K, Noguchi S, Ozawa E.肌聚糖-营养不良聚糖复合物在周围神经系统中锚定Dp116和utrophin。《中国科学》2000;9(20):3091-100。gydF4y2Ba
尹俊,徐瑞,陈志强,陈志强,陈志强。野生型、Mdx和Galgt2转基因小鼠骨骼肌反糖甘聚糖相关蛋白的蛋白质组学分析。中国生物医学工程学报,2012;11(9):413 - 424。gydF4y2Ba
杜林,贾根,墨菲,朱文杰,王文杰,等。肌营养不良蛋白节点作为骨骼肌中细胞骨架组织、横向力传递、纤维稳定性和细胞信号的整合器。蛋白质组。2021;9(1):9。gydF4y2Ba
戈斯马诺夫AR,林丁格MI, Thomason DB。驾驭潮流:肌肉Na+-K+- 2cl -共转运活性对K+浓度和容量的调节。科学通报2003;18:196-200。gydF4y2Ba
沈斌,傅洁,郭洁,张洁,王霞,潘霞,等。钠的作用gydF4y2Ba+gydF4y2Ba- kgydF4y2Ba+gydF4y2Ba2氯gydF4y2Ba-gydF4y2Ba苯肾上腺素诱导小鼠主动脉节律性收缩中的共转运体1:NagydF4y2Ba+gydF4y2Ba- kgydF4y2Ba+gydF4y2Ba2氯gydF4y2Ba-gydF4y2BaCa2+火花和KCa通道共同转运蛋白1。细胞物理与生物化学。2015;37(2):747-58。gydF4y2Ba
吴峰,米伟,坎农。布美他尼对低钾性周期性麻痹小鼠Cav1.1-R528h模型的影响。《大脑》,2013;36(Pt 12): 3766-74。gydF4y2Ba
吴芳,米伟,甘农。布美他尼在小鼠低钾周期性麻痹中防止肌肉力量短暂性下降。神经学。2013;80(12):1110 - 6。gydF4y2Ba
Schobel N, Radtke D, Lubbert M, Gisselmann G, Lehmann R, Cichy A,等。小鼠三叉神经节神经元表现出细胞内氯离子积累和氯离子依赖性放大的辣椒素诱导反应。公共科学图书馆,2012;7(11):E48005。gydF4y2Ba
李志强,李志强,李志强,李志强,等。氯离子梯度在耳蜗核神经元发育中的作用。神经科学。2014;261:207-22。gydF4y2Ba
田中,田中,田中,田上,田上,等。大鼠骨骼肌偏心收缩时Ca(2+)沿近-中-远端肌轴进入的区域差异。应用物理学报(1985)。2019年,127(3):828 - 37。gydF4y2Ba
Allen DG, Gervasio OL, yang EW, Whitehead NP。钙与肌肉营养不良的损伤途径。中华药物学杂志,2010;29(2):344 - 344。gydF4y2Ba
Burr AR, Molkentin JD。小鼠的遗传证据证实了肌肉萎缩症中肌纤维死亡的钙假说。细胞死亡差异。2015;22(9):1402-12。gydF4y2Ba
Bueno OF, De Windt LJ, Tymitz KM, Witt SA, Kimball TR, Klevitsky R,等。MEK1-ERK1/2信号通路促进转基因小鼠代偿性心肌肥厚。中国科学院学报,2000;19(23):6341 - 502。gydF4y2Ba
Kehat I, Molkentin JD。心肌肥厚中的细胞外信号调节激酶1/2 (ERK1/2)信号转导中国科学(d辑),2010;gydF4y2Ba
Liedtke CM, Cole TS.高渗胁迫下人气管上皮细胞NKCC1的激活涉及PKC-delta和ERK。生物化学学报,2002;1589(1):77-88。gydF4y2Ba
潘晓明,王晓明,王晓明。Na+/K+/Cl-共转运蛋白激活map激酶级联下游蛋白激酶C和上游MEK。中国生物医学工程学报。2006;26(3):344 - 344。gydF4y2Ba
Panet R, Eliash M, Pick M, Atlan H. Na(+)/K(+)/Cl(-)共转运蛋白在成纤维细胞和淋巴细胞中激活丝裂原活化蛋白激酶。中国生物医学工程学报。2002;19(2):319 - 319。gydF4y2Ba
蔡玲,杜涛,宋东,李波,赫茨L,彭玲。星形胶质细胞ERK磷酸化先于K(+)诱导的肿胀,随后是低张力诱导的肿胀。神经病理学。2011;31(3):250 - 64。gydF4y2Ba
戴米安,姜c,刘s,卡普斯,等。离子转运蛋白NKCC1通过抑制mTORC1将细胞体积与细胞质量调节联系起来。Cell rep 2019;27(6): 1886-96.E6。gydF4y2Ba
卢春涛,程新宁,吴春春,杨丽丽。nkcc1介导的外伤性脑损伤脑水肿和神经元死亡的研究进展。重症监护医学。2008;36(3):917-22。gydF4y2Ba
王忠,杨海涛,杨艳,王志勇,王志勇。ERK1/2和NKCC1相互作用对角膜上皮细胞增殖的影响。细胞物理与生物化学。2011;28(4):703-14。gydF4y2Ba
丛东,朱伟,郭建军,胡松,孙东。脑肿瘤中的离子转运蛋白。高等医学杂志,2015;22(10):1171-81。gydF4y2Ba
吴志强,李志强,李志强,等。Caveolin-3敲除小鼠出现进步性心肌病,并表现出P42/44 MAPK级联的过度激活。中国生物医学工程学报,2002;27(4):489 - 497。gydF4y2Ba
Baenziger JE, Domville JA, Therien JPD。胆固醇在激活烟碱乙酰胆碱受体中的作用。Curr Top Membr. 2017; 80:95-137。gydF4y2Ba
Morales-Lazaro SL, Rosenbaum T.胆固醇调节瞬时受体电位离子通道的多种机制。Curr Top Membr. 2017; 80:139-61。gydF4y2Ba
张志刚,张志刚,张志刚,张志刚,等。膜筏扰动对KCC2和NKCC1转运活性的相反影响。中国神经化学杂志,2009;39(2):319 - 319。gydF4y2Ba
Javed K, Fairweather SJ。氨基酸转运蛋白在胰岛素分泌和信号调节中的作用。生物化学学报,2019;47(2):571-90。gydF4y2Ba
杨晓明,杨晓明,杨晓明。骨骼肌细胞17β -雌二醇信号通路与凋亡的关系。类固醇。2008;73(9):859 - 63。gydF4y2Ba
Koumangoye R, Bastarache L, Delpire E. NKCC1:一种新发现的人类致病离子转运蛋白。函数。2021;2 (1):Zqaa028。gydF4y2Ba
Vizcaino JA, Deutsch, EW,王r, Csordas A, Reisinger F, Ríos D,等。ProteomeXchange提供全球协调的蛋白质组学数据提交和传播。《自然·生物技术》2014;32:223-6。gydF4y2Ba
确认gydF4y2Ba
作者感谢博士。Michelle Dubuke和Xuni Li的UMASS质谱设备的样品分析和脚手架文件的组装。我们感谢UMASS儿科共聚焦核心获得徕卡SP5 (II) AOBS共聚焦显微镜。我们还要感谢麻省大学媒体设施的成员,他们为我们提供了专业的试剂制备,Donna Castellanos和Jennifer Capalbo为我们提供了专业的玻璃器皿清洗。我们非常感谢伊丽莎白·麦克纳利博士提供的肌聚糖质粒。gydF4y2Ba
资金gydF4y2Ba
由NIH R01-AR069660奖资助ERB和EJL。本报告的内容仅为作者的责任,并不代表美国国立卫生研究院的官方观点。美国国立卫生研究院在这篇手稿的设计、实施、解释或写作中没有发挥直接作用。gydF4y2Ba
作者信息gydF4y2Ba
作者及隶属关系gydF4y2Ba
贡献gydF4y2Ba
概念或设计:EJL, ERB, TCS。数据采集、分析或解释:TCS、GV、JMP、CHC、EJL、ERB、SAS。起草工作或大量修改工作:EJL, TCS, ERB, GV, JMP。作者阅读并批准最终的手稿。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
伦理批准并同意参与gydF4y2Ba
没有人体实验对象。本研究中使用的所有动物均按照佛罗里达大学和马萨诸塞大学医学院动物护理和使用委员会制定的标准进行饲养、安置和处理;协议号分别为201909220和A-1061。所有麻醉和安乐死技术均符合《美国兽医协会动物安乐死指南》(2020年)。gydF4y2Ba
发表同意书gydF4y2Ba
不适用。gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者宣称他们之间没有利益冲突。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Ba
伟德体育在线施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。gydF4y2Ba
补充信息gydF4y2Ba
附加文件1:表S1。gydF4y2Ba
本研究中使用的引物。gydF4y2Ba
附加文件2:图S1。gydF4y2Ba
新的和商用多克隆抗体的验证和SC蛋白在RH30细胞中的表达。新的亲和纯化兔(Rb)抗体针对小鼠大坏蛋(mAV)残基121-568(抗mAV)和抗Sgcg残基72-290(抗Sgcg)产生。全长免疫印迹显示(A)抗mav和(B)抗sgcg对小鼠肌肉中预期的~245 kda和~35 kda条带具有特异性,但RH30细胞裂解液中存在额外的条带。主要条带的特异性通过在缺乏免疫原的肌肉中不存在以及在转染细胞中染色增加来证实。(C)蛋白技术组(PTG)抗sgcg抗体染色相似。免疫印迹的gydF4y2Ba腓肠肌gydF4y2Ba来自野生型(WT,第1车道)和肌肉蛋白gydF4y2BaSvilgydF4y2Ba-/-gydF4y2Ba或gydF4y2BaSgcggydF4y2Ba-/-gydF4y2Ba肌肉(第2通道)、未转染的RH30细胞(第3通道)和转染了编码Sgcg- Flag(第4通道)、Sgcd- Flag(第5通道)或Sgcb- Flag(第6通道)的RH30细胞。在RH30细胞中证实了Flag标记的(B, C) Sgcg、(D) Sgcb和(E) Sgcd的外源性表达。RH30细胞中未检测到内源性肌聚糖。(B, C)将用于抗sgcg染色的印迹剥离,以抗肌动蛋白作为负载对照重新检测。抗sgcg与结构相似的Sgcd蛋白无交叉反应性。在RH30细胞中,在~70 kDa和~160 kDa存在少量的免疫反应性高分子质量条带。这些较大的条带可能代表肌聚糖的抗sds复合物[gydF4y2Ba49gydF4y2Ba,gydF4y2Ba63gydF4y2Ba].分子质量标记在kDa中的位置如图所示。箭头表示预期大小的特定带。gydF4y2Ba
附加文件3:表S2。gydF4y2Ba
从Rx缓冲液的免疫沉淀中鉴定的所有蛋白质的样品报告。在Rx缓冲液中进行的所有免疫沉淀的归一化加权谱计数;数据集,如中所述gydF4y2Ba方法gydF4y2Ba.gydF4y2Ba
附加文件4:表S3。gydF4y2Ba
从RIPA1缓冲液的免疫沉淀物中鉴定的所有蛋白质的样品报告。在RIPA1缓冲液中进行的所有免疫沉淀的归一化加权谱计数;数据集,如中所述gydF4y2Ba方法gydF4y2Ba.gydF4y2Ba
附加文件5:图S2。gydF4y2Ba
相对比显微照片gydF4y2Ba腓肠肌gydF4y2Ba肌膜分数。参考图中描述的分数。gydF4y2Ba1gydF4y2BaA, from (A, D, G, J) C57BL/6 (WT), (B, E, H, K)gydF4y2BaSgcggydF4y2Ba-/-gydF4y2Ba和(C, F, I, L)gydF4y2BaSvilgydF4y2Ba-/-gydF4y2Ba用相位对比显微镜观察小鼠。在(A-C)总肌肉提取物和(D-F)粗膜颗粒(Lane 4)中观察到大的膜碎片(箭头),但在(G-I) Rx或(J-L) RIPA1缓冲液提取后的上清液中只存在小颗粒。棒材,0.2 mm。gydF4y2Ba
附加文件6:图S3。gydF4y2Ba
从不同肌肉基因型中筛选出候选Sgcg相互作用子。从~100毫克骨骼肌中提取部分,如图所示。gydF4y2Ba1gydF4y2Ba对Sgcg候选相互作用子PP1β (Life Span Biosciences)、MYPT2 (Proteintech Group)或NKCC1 (Alomone Laboratories)进行免疫印迹和检测。所有分数归一化如图所示。gydF4y2Ba2gydF4y2Ba.每个免疫印迹代表3 (gydF4y2BaSgcg - / -gydF4y2Ba,gydF4y2BaSvil - / -gydF4y2Ba)或4 (WT)个独立的生物重复。NKCC1的多个条带是差异糖基化的结果[gydF4y2Ba74gydF4y2Ba,gydF4y2Ba75gydF4y2Ba].gydF4y2Ba
附加文件7:图S4。gydF4y2Ba
兔(Rb)抗Sgcg多克隆抗体用于免疫荧光显微镜的验证。评估Proteintech Group Inc. (PTG, A-D)和我们新的亲和纯化(我们的,E-H)抗sgcg抗体的免疫荧光显微镜,与非特异性Rb IgG (I-L)相比,转染编码Sgcg-Flag质粒的RH30细胞。两种抗sgcg抗体都能特异性识别带有anti-Flag标记的结构(箭头)。重叠的红色和绿色信号显示为黄色。gydF4y2Ba
附加文件8:图S5。gydF4y2Ba
兔(Rb)抗NKCC1多克隆抗体的验证。(A, C)转染HA-CFP-NKCC1和未转染HA-CFP-NKCC1的小鼠肌肉和RH30细胞的全长免疫印迹;(B, D) Anti-NKCC1(面板a, D;合并红色)和小鼠(M)抗ha染色(图b, e;在HA-CFP-NKCC1转染的RH30细胞中合并蓝色)。抗nkcc1抗体来自(A, B) Alomone Labs, #ANT-071和(C, D) Proteintech Group, #13884-1-AP。两种抗nkcc1抗体都能识别97-220 kDa分子质量范围内的预期条带(A, C)。类似的染色模式之前也有报道,条带的多样性归因于不同的剪接和糖基化的变化[gydF4y2Ba74gydF4y2Ba,gydF4y2Ba75gydF4y2Ba].在免疫荧光(B, D)中,只有Proteintech抗体(Da, Dd)在表达高水平外源性HA-CFP-NKCC1的RH30细胞中表现出增强的染色(B, D,箭头)。重叠信号在merge (c和f)中以洋红色显示。gydF4y2Ba
附加文件9:图S6。gydF4y2Ba
AbCam兔单克隆抗PP1β的IF信号与EGFP-PP1β或PP1β-EGFP中的EGFP信号相关。(A)转染PP1β-EGFP和未转染PP1β-EGFP的小鼠肌肉和RH30细胞的全长免疫印迹,如所示;车道1和5显示分子质量标记。(B)抗pp1 β(面板a, e;红色合并)和EGFP荧光(面板b, f;如图所示,PP1β cDNA转染RH30细胞。(A)在只有内源性PP1β的RH30细胞(通道3)和转染PP1β- egfp(通道4)后观察到~35 kDa和~68 kDa的预期条带。(B)在细胞骨架缓冲液+多聚甲醛(CSK-PFA)或-20°C甲醇(MeOH)固定后,观察到表达高水平PP1β的RH30细胞(B,箭头)抗PP1β染色增强。重叠信号在Merges (d, h)中以黄色显示。gydF4y2Ba
附加文件10:图S7。gydF4y2Ba
外源表达的Sgcg和紧张素2在RH30细胞中几乎没有信号重叠。(A)标记Sgcg、Sgcb和Sgcd与gfp标记的人张力蛋白2共表达。(B)未标记的Sgcg与标记的小鼠TenC1 / tensin 2共表达。在两种情况下,Sgcg均用Proteintech抗Sgcg染色(Aa, Ae, Ba, Bd,合并红色);使用(A) GFP信号(b, f,绿色(g)合并)或(b) anti-Flag抗体(b, e,绿色(g)合并)观察张力蛋白2。(A)肌动蛋白丝用荧光phalloidin染色(c, g,蓝色合并)。显示不同表达水平的细胞。Sgcg信号与内部结构有关,也与外围小点(箭头)有关。注意Aa图中未转染细胞未染色,箭头指向上面转染细胞的Sgcg点。人和小鼠的张力蛋白2异型都定位于肌动蛋白丝末端的局灶性粘连(箭头),但张力蛋白2富集的点不与Sgcg点同时定位。 Bars, 20 μm.
附加文件11:图S8。gydF4y2Ba
RH30细胞中Sgcg和MYPT2的信号重叠有限。用Proteintech抗Sgcg显示的未标记Sgcg (a, d, g,合并红色)转染RH30细胞,用Flag-MYPT2 (b, e, h,合并绿色)转染。偶有细胞在内部结构上显示Flag-MYPT2与Sgcg部分重叠(双箭头)。大多数Sgcg信号与内部结构和外周点(箭头)相关,而大多数MYPT2定位于phalloidin染色的肌动蛋白丝(箭头;Phalloidin染色未显示)。信号重叠显示为黄橙色。Bar, 20 μm。gydF4y2Ba
附加文件12:图S9。gydF4y2Ba
RH30细胞中Sgcg和egfp标记的PP1β信号重叠有限。(A)细胞共转染标记Sgcg, Sgcd, Sgcb和所示的EGFP构建物。Sgcg用Proteintech anti-Sgcg (a, e, i;红色合并);PP1β-EGFP (b), EGFP- PP1β (f)和EGFP (j)合并为绿色(d, h, l)。用AlexaFluor350 phalloidin观察丝状肌动蛋白,显示细胞轮廓(c,g,k;蓝色在合并)。(B)转染flag标记Sgcg、Sgcd和Sgcb的RH30细胞在切换到低渗透介质后固定(a-d) 10分钟和(e-f) 15分钟,并用抗flag抗体染色(a, e;红色合并)和Abcam抗体对抗内源性PP1β (b, f;绿色合并)。pp1 β相关信号不排除在sgcg相关结构中,但未观察到令人信服的共定位。 Nuclear DNA was visualized with DAPI (c, g; blue in merges). Bars, 20 μm.
附加文件13:图S10。gydF4y2Ba
总NKCC1和磷酸化(P)-NKCC1在WT和WT偏心收缩(ECC)应变响应中的变化gydF4y2BaSgcggydF4y2Ba-/-gydF4y2Ba联盟的肌肉。(A)代表性免疫印迹。(B)糖基化(170 kDa) NKCC1的相对量在ECC后趋于降低gydF4y2BaSgcggydF4y2Ba-/-gydF4y2Ba肌肉(gydF4y2BaPgydF4y2Ba= 0.06),但非糖基化(130 kDa) NKCC1多肽的数量没有变化(gydF4y2BaPgydF4y2Ba= 0.87)。(C) ECC后P/T-NKCC1与静止时P/T-NKCC1的比值gydF4y2BaSgcggydF4y2Ba-/-gydF4y2Ba肌肉。gydF4y2BaNgydF4y2Ba=每拉伤5-6对肌肉。gydF4y2BaPgydF4y2Ba= 0.07。中央条形,表示;误差条,S.D.学生的未配对t检验。gydF4y2Ba
附加文件14:图S11。gydF4y2Ba
图中所示的IPA图的放大。gydF4y2Ba10gydF4y2Ba.gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba.创作共用公共领域奉献弃权书(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)适用于本条所提供的资料,除非在资料的信用额度中另有说明。gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
史密斯,t.c.,瓦西拉科斯,G.,谢弗,S.A.gydF4y2Baet al。gydF4y2Ba小鼠肌膜中的新型γ-肌聚糖互作物。gydF4y2Ba骨骼肌gydF4y2Ba12gydF4y2Ba, 2(2022)。https://doi.org/10.1186/s13395-021-00285-2gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s13395-021-00285-2gydF4y2Ba
关键字gydF4y2Ba
- 四肢肌营养不良gydF4y2Ba
- 骨骼肌gydF4y2Ba
- 肌纤维膜gydF4y2Ba
- ArchvillingydF4y2Ba
- SvilgydF4y2Ba
- PP1β/δgydF4y2Ba
- SarcoglycansgydF4y2Ba
- NKCC1gydF4y2Ba