摘要
背景
骨骼肌细胞由于其独特的形态和分化后的多核性质,生物学特性的测量是困难的。在这里,我们开发了一个新的名为ViaFuse的斐济宏包(代表活力和融合)来测量骨骼肌细胞的活力和分化。为了测试ViaFuse,我们利用分化肌管的免疫荧光图像,与对照细胞相比,肌z线亚单位β (CAPZB)的帽状肌动蛋白被耗尽。
结果
我们首先将使用ViaFuse宏实现的值与研究人员手动量化的值进行了比较,然后将其与使用MATLAB肌肉中心软件MyoCount获得的值进行了比较。我们观察到所有量化方法之间都有高度的相关性。
结论
ViaFuse可以检测肌管的边界,并识别核团块,这是以前的肌肉中心成像软件的局限性。ViaFuse宏需要很少的计算机能力或空间来运行,用户对ViaFuse宏的输入是最小的,从而以一种快速、简单和准确的方式自动化分析过程。此外,ViaFuse宏可以与现有的骨骼肌研究人员广泛使用的成像软件Fiji一起工作。此外,ViaFuse与许多计算机系统兼容,具有非常直观的界面,并且不需要事先复杂的数学知识。因此,我们提出ViaFuse作为一种稳健而细致的方法来量化骨骼肌细胞的活力和分化。
背景
骨骼肌细胞易于培养,因此常被用于研究肌肉发生的不同分子和细胞方面[1].可以分析细胞活力和融合等特征,以确定特定蛋白质、培养条件或刺激对肌生成过程的作用。例如,蛋白质消耗后的低存活率可能表明其参与细胞生长(或凋亡)。骨骼肌细胞经过分化,单核成肌细胞相互融合,形成细长的多核肌管[2].肌细胞分化可以通过测量融合指数来估计,这是分化肌管内核的百分比。
通常很难以可靠和无错误的方式手动量化骨骼肌细胞的特征,因为它们的形态可能根据分化阶段而有很大差异。重要的是,量化是准确的,代表什么是生物学观察。一些实验室利用各种染色剂来测定肌管密度,但这些方法仅限于所有肌管表现出相似形态的实验[3.,4].许多组手动量化显微镜图像来估计细胞活力和融合,因为大多数软件不能准确地分割分化肌管,因为它们组在一起,很长,多核[3.,5,6,7,8].然而,人工量化也有局限性。首先,它可以根据研究人员的不同而有所不同,它需要以一种盲目的方式进行。其次,这是非常耗时的,特别是考虑到适当的准确性和统计分析,需要分析大量的图像。因此,真正需要一种以肌肉为中心的软件,能够以一致的方式测量骨骼肌细胞的各种特征,最大限度地减少人为错误,并花费合理的时间[9,10].
目前有一种以肌肉为中心的软件工具(MyoCount) [11该研究为成肌细胞融合的标准化和自动化量化提供了一种方法。MyoCount是一款基于matlab的软件,为用户提供了一系列可调参数,用于识别核和屏蔽肌管,允许基于图像质量优化分析。与人工图像量化相比,使用MyoCount的明显优势是能够执行高通量图像处理,同时减少人为偏差。然而,在簇核计数不准确、成肌细胞与紧密肌管的区分、完整肌管的轮廓、成肌细胞与肌管边界接近时的正确判断等方面,仍存在一些问题。MyoCount软件的计算能力也受到图像大小的限制,如果用户对MATLAB平台没有非常深入的了解,修改源代码可能是一个挑战。
在这里,我们介绍了ViaFuse(活力和融合),一个可访问的斐济(斐济只是ImageJ)宏包,快速,直观,准确地量化骨骼肌细胞活力(ViaFuse活力,ViaFuse- v)和成肌细胞分化成肌管(ViaFuse融合,ViaFuse- f)。我们比较了ViaFuse对capzb耗尽肌管的定量与手动和MyoCount进行的定量,并观察到两种方法之间的高度相关性。因此,我们得出结论,ViaFuse是一个分析骨骼肌细胞活力和分化的强大工具,它有几个优点:(i)它便于研究人员使用,(ii)它能够区分和解释核团块,(iii)它能够正确识别肌管边界,(iv)它能够区分附近的成肌细胞是多个未融合的成肌细胞而不是一个肌管,以及(v)它的设备要求最低。
实现
C2C12细胞培养
细胞在由Dulbecco 's modified Eagle 's medium (DMEM)、10%胎牛血清、2 mM组成的培养基中培养l-谷氨酰胺,0.01%青霉素和链霉素。当细胞融合度达到90%时,将培养基换成由DMEM、2%马血清、2 mM组成的分化培养基l-谷氨酰胺,0.01%青霉素和链霉素。
通过电穿孔递送小干扰rna (si-RNAs)
C2C12成肌细胞转染达尔玛康公司的两种不同的Capzb si- rna (si-Capzb-#1: #MQ-040494-01-0002和si-Capzb-#2: #MQ-040494-01-0004)或同样来自达尔玛康公司的si-GENOME阴性对照(#D-001210-01-05),最终浓度均为87 pmol/mL。使用Neon电穿孔系统(Thermo Fisher Scientific, MPK10096)将si- rna送入C2C12成肌细胞,按照制造商的说明:使用100 μL Neon移液管,在1650 V、宽度3 ms和3次脉冲的条件下,每孔电穿孔750,000个细胞。第2天(电穿孔后24小时)诱导成肌细胞分化为肌管。分化4天后,从细胞中提取蛋白裂解物或固定细胞,免疫染色,共聚焦显微镜观察。
蛋白质裂解物制备
将细胞置于冰上,用冷PBS清洗,并使用含有蛋白酶(Roche, #11873580001)和磷酸酶(Roche, #04906845001)抑制剂的冰冷RIPA缓冲液(50 mM Tris, 120 mM NaCl, 1% Triton X-100, 0.1%十二烷基硫酸钠(SDS), 0.5%脱氧胆酸钠)进行裂解。裂解物在冰上孵育15分钟,然后以75%振幅(强度)超声3分钟(开30秒,关30秒)。裂解物在冰上孵育15分钟,然后在4°C下以14000 rpm离心10分钟。上清液转移到新管中并保存在−80°C。使用Pierce BCA蛋白测定试剂盒(赛默飞世尔科学公司,#23225)测定蛋白质浓度。
Western blotting分析
蛋白质裂解液(30 μg)通过western blotting分析验证CAPZB的有效消耗。样品采用12% mini-Protean TGX无染色凝胶(BioRad, #4568044)上的聚丙烯酰胺凝胶电泳(SDS-PAGE)进行分析。运行缓冲液由200 mM甘氨酸、25 mM Tris碱和3.5 mM SDS组成。电泳在90 V下进行30分钟,然后再在150 V下进行30分钟。使用BioRad的ChemiDoc成像系统对凝胶进行成像。然后将蛋白质从凝胶转移到Amersham Hybond低荧光0.2 μm PVDF膜(GE Healthcare Life Sciences, #10600022),在100 V下转移缓冲液(100 mM甘氨酸,25 mM Tris和20%甲醇)中1小时。膜中的总蛋白使用来自BioRad的ChemiDoc成像系统进行可视化。然后用5%的脱脂干牛奶在含有tween 20 (TBST)的Tris缓冲盐水缓冲液(400 mM Tris碱,2.74 M NaCl, 0.1% tween 20, pH 7.6)中堵塞膜1小时。膜用TBST短暂清洗,然后用TBST稀释的适当一抗在4℃过夜孵育:小鼠抗lmna (Santa Cruz Biotechnologies, sc-7293,稀释1:500),兔抗capzb (Abcam, ab220669,稀释1:100)。第二天,膜用TBST洗涤三次(每次10分钟),然后用赛默飞世尔科学公司的山羊抗小鼠二级抗体Dylight 800 (SA5-35521,稀释1:10 000)孵育1小时。 Membranes were imaged using an Odyssey LiCor Imager.
免疫荧光分析
在分化第四天,将细胞固定在细胞培养基中2%多聚甲醛溶液中2分钟(4%多聚甲醛pbs溶液-由EMS制成16%多聚甲醛EM级水溶液,Fisher Scientific, #15710 -用细胞培养基稀释一半)。吸入含有多聚甲醛溶液的培养基,然后将细胞与2%的多聚甲醛在PBS中孵育20分钟。用PBS清洗细胞三次(每次10分钟),然后在室温下将细胞封闭在含有PBS、1%牛血清白蛋白和0.3% Triton的免疫荧光缓冲液(BIF)中1小时。接下来,细胞与小鼠多克隆IgG抗肌球蛋白重链(MYH) 3 (Santa Cruz Biotechnologies, sc-53091)在BIF中稀释(1:50),在4℃下孵育过夜。第二天,细胞用PBS洗涤三次(每次10分钟),然后在黑暗中和室温下与AlexaFluor 488(AlexaFluor 488((ab)) 2山羊抗小鼠IgG (HHL)片段,Thermo Fisher Scientific, A1101)偶联的抗小鼠抗体在BIF中稀释(1:500)孵育1小时。PBS清洗细胞3次(每次10 min),用PBS稀释的2 μM DAPI在室温下孵育5 min。细胞用PBS冲洗两次,并立即在PBS中成像。
共焦显微镜
细胞在北卡罗莱纳大学教堂山的Hooker成像核心中成像,使用蔡司LSM 880共聚焦显微镜,带有10倍Plan Apochromat (0.45 WD)目标,并使用Zen Black(蔡司)软件进行图像采集。每种情况均拍摄3 × 3缝合图像。使用以下激发参数:488 nm氩多线激光器(Alexa Fluor 488)和30mw 405 nm二极管(DAPI)。细胞在室温下成像。
人工图像分析
使用Fiji软件对捕获的图像进行分析。图像被拆解,DAPI被分配为红色,MYH被分配为绿色。DAPI和MYH图像可变地相乘,以确保所有图像看起来类似于量化。为了计算核的总数,首先对DAPI图像施加阈值使其成为二值,然后填充小孔,利用分水岭分离分离近核。尺寸在50 μm之间的核面积2250 μm2大于251 μm的2使用分析颗粒工具获取。为了确定核团中的核数,物体的面积大于251 μm2在50 μm2250 μm2.将得到的核团核数与面积在50 μm之间的核数相加2250 μm2生成图像中核的总数。最后,将图像中核的总数除以图像大小(单位:mm)2),以获得每单位面积的核总数(核数/毫米)2).为了计算融合指数,将DAPI图像与MYH图像进行融合。使用网格和计数细胞插件,计数myh阳性细胞外的细胞核和myh阳性细胞中有一个或两个细胞核的细胞核。融合指数计算公式如下:
安装ViaFuse宏的操作和指南
要运行ViaFuse宏,计算机必须是Windows XP或更高版本,Mac OS X 10.8“Mountain Lion”或更高版本,或amd64和× 86架构上的Linux。系统还必须运行Java 8或更高版本。要安装Fiji,应遵循以下步骤:(1)导航到https://Fiji.sc/,(2)滚动到“下载”部分,下载计算机的正确版本的Fiji(以下宏的MacOS版本为1.53c, Windows版本为1.53 h),以及(3)按照Fiji安装说明,并确保安装了正确的版本。
要下载ViaFuse宏,应该遵循两个步骤:(1)导航到https://github.com/tasneemsmacros/ViaFuse和(2)下载所需的宏(ViaFuse-V或ViaFuse-F)为您的操作系统,并将它们保存到您的计算机。每个宏的说明也可从该链接下载。
ViaFuse-V,宏计算总核
ViaFuse-V使用DAPI图像生成一个.csv文件,其中(i)尺寸大于251 μm的颗粒区域列表2, (ii)尺寸在50 μm之间的核数2250 μm2, (iii)尺寸在50 μm之间的核模态2250 μm2,和(iv)图像的面积(毫米)2).为了计算成团的核数,用户需要将大于251 μm的粒子大小进行划分2(由ViaFuse-V生成)由尺寸在50 μm之间的核模式产生2250 μm2(由ViaFuse-V生成)。这个数字可以增加到50 μm大小的核的数量2250 μm2(由ViaFuse-V生成)来生成图像中的总核数。然后用总核数除以以毫米为单位的图像大小2(由ViaFuse-V生成)来计算单位面积的核总数(总核数/mm)2).
要运行ViaFuse-V宏,请打开Fiji软件并上传所需的图像。Lsm格式的堆叠图像或“。tif”格式的未堆叠图像。如果使用堆叠的图像,将它们解堆栈(图像>堆栈>堆栈到图像),并关闭除核图像之外的所有图像。这是确保宏对正确图像执行分析的关键步骤。在映像上运行宏(Plugins>Macros>Run>Select宏)。宏将提示用户选择结果所在的文件夹。一旦用户选择了所需的文件夹,点击“打开”。将出现另一个对话框。第一个框将具有基于先前选择的文件路径。单击第二个框并键入结果的.csv文件的所需名称。完成后单击“确定”。 The program will then prompt the user for a multiplication value for the image being analyzed. A number will need to be typed and then click “OK” when done. The process will take a few minutes to finish. When the macro finishes the calculations, a “Calculations Complete!” message will be displayed. Click “OK” to exit the message. The results file can be found on the user’s computer where they chose to save it. This macro assumes that the units of the image are already in μm units. If this is not the case, the image needs to be converted accordingly. The numbers output from ViaFuse-V can be recorded into an excel that will generate the total number of nuclei (Supplementary Table1).
ViaFuse-F,宏计算融合指数
ViaFuse-F创建MYH图像的掩膜,并将其从DAPI图像中减去,以生成去除MYH阳性细胞中的细胞核的外部核图像。ViaFuse-F使用这个外部核图像生成一个.csv文件,其中(i)一个大于251 μm的粒子区域列表2, (ii)面积在50 μm之间的核数2250 μm2(iii) 50 μm之间的核面积模式2250 μm2.myh阳性细胞外核团中的核数是通过取大于251 μm的核的大小来确定的2在myh阳性细胞外(由ViaFuse-F生成),并将其除以外部核图像中大小为50 μm的核区域的模式2250 μm2(由ViaFuse-F生成)。少于三个核的myh阳性细胞的核数需要由用户统计。从ViaFuse-V得到的总核数用于最终的聚变指数方程。融合指数由下式计算:
要运行ViaFuse-F宏,请打开Fiji并在”中上传图像。lsm”格式。确保DAPI和MYH映像堆叠在一起。不要拆解图像。如果除了DAPI和MYH图像之外,还打开了其他图像,这将不会影响宏。该宏假定一个特定的堆栈顺序,该顺序在下载链接中的宏指令中指定。在映像上运行宏(Plugins>Macros>Run>Select宏)。将提示用户选择存放结果的文件夹。一旦用户选择了所需的文件夹,点击“打开”,就会出现一个对话框。第一个框将具有基于先前选择的文件路径。单击第二个框并键入结果的.csv文件的所需名称。 Click “OK” when finished. The program will then ask the user for a multiplication value for both the MYH image and DAPI image. Type in a number in each box, then click “OK” when done. The process will take a few minutes to finish. When the macro finishes the calculations, a “Calculations Complete!” message will be displayed. Click “OK” to exit the message. The .csv file can be found on the user’s computer in the folder where the user chose to deposit results. The merged .png image of the myotubes and nuclei counted can be found in the same location with the same name as the .csv file. The numbers output from ViaFuse-F together with the manually counted nuclei in myotubes with 1 or 2 nuclei can be recorded into an excel that will generate the fusion index (Supplementary Table1).
MyoCount使用的操作和指南
使用MyoCount进行量化的图像首先使用Fiji划分为3 × 3蒙太奇。如前所述,使用MyoCount程序对每张图像的九个面板进行批量处理[11].设置以下参数进行分析:smallstmyotubepixelcount = 200, smallstnucleuspixelcount = 50, NucFillSize = 2, MaxCircleRad = 30-35, MaxNucSizeDivisor = 200, TubeThresh = 0.73。
测试
研究人员量化了单位面积的核总数(毫米)2),利用斐济/ImageJ软件(MacOS版本1.53c, Windows版本1.53 h), MyoCount程序(Windows版本1.3.1,MATLAB Runtime版本9.4 R2018a),以及上述人工图像分析方法,对三次实验的9张免疫荧光染色肌管图像进行融合指数。对于ViaFuse宏量化,使用宏的默认设置,并且每个图像的乘法值由研究人员调整。Pearson相关系数被计算出来,将ViaFuse的值与手动或使用MyoCount程序获得的值进行比较。所有数据分析均使用Microsoft Excel进行。
统计分析
用Microsoft Excel (Microsoft)进行统计分析。显著性是用未配对的韦尔奇来确定的t测试(双尾)。两种情况之间的差异被认为具有统计学意义时p< 0.05。所有数据都以平均值加和减去来自平均值的标准误差(sem)的形式表示。
结果
CAPZB的缺失导致细胞活力和分化降低
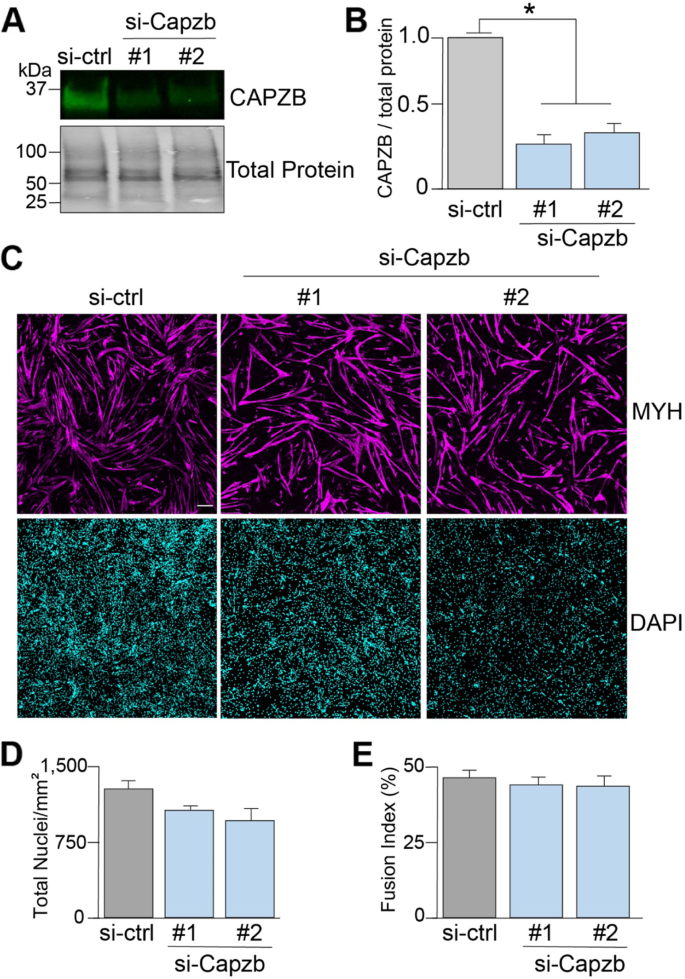
为了开发ViaFuse宏包,在C2C12成肌细胞中使用si-RNAs去除CAPZB蛋白,并检测骨骼肌细胞活力和分化。CAPZB覆盖肌动蛋白丝的有刺端,防止肌动蛋白的添加或降解,这对于确保肌动蛋白丝长度的恒定至关重要[12].小鼠整体敲除CAPZB可导致胚胎致死[13,14],但CAPZB在C2C12细胞中的作用尚未被研究。
与阴性对照相比,用两种不同si- rna(#1和#2)处理的细胞中CAPZB蛋白被显著敲除(图2)。1用DAPI(染色细胞核)和识别肌球蛋白重链蛋白(MYH)的抗体对细胞进行染色,MYH是肌肉细胞分化的标志(图。1C).可以通过计算细胞核总数来推断细胞活力水平。融合指数反映成肌细胞向肌管分化的水平[3.,5],定义为myh阳性细胞中具有三个或三个以上核的细胞核相对于视场中核总数的比例。人工计算显示,单位面积的总核数(总核/毫米)呈减少趋势2)(图。1D) (si-ctrl: 1280±87 # 1:1068±36 # 2:960±125 si-ctrl vs # 1:p= 0.1, si-ctrl vs #2:p= 0.1),与对照组相比,两种si- rna的融合指数仅略低(图2)。1E) (si-ctrl: 47±3 # 1:44±2,# 2:44±3 si-ctrl vs # 1:p= 0.6, si-ctrl vs #2:p= 0.5)。这表明CAPZB可能在骨骼肌细胞活力中起重要作用,但与成肌细胞向肌管分化的关系较小。
ViaFuse-V宏估计肌肉细胞活力
ViaFuse-V完全自动化了上面在斐济图像分析软件中用于手动量化的步骤。为了确定视场中核的总数,这个宏首先将图像乘以用户输入,以便更容易地识别核及其近似轮廓。然后,ViaFuse-V使用斐济的默认方法对图像应用阈值,使其成为二值图像(图2)。2A和表格1).接下来,ViaFuse-V应用中值滤波器来降低图像噪声,然后关闭小孔,进一步分水岭分割核以识别其中心点(图2)。2A和表格1).最后,为了检索相关核数据进行分析,ViaFuse-V对图像进行粒子分析分为两个步骤:(i)对50 μm范围内的粒子进行计数2250 μm2(ii)对大于251 μm的颗粒进行计数2(被认为是“核团”)(表1).要计算一个视场中核的总数,每个核的面积大于251 μm2(由ViaFuse-V生成)被所有面积在50 μm之间的核的模数所除2250 μm2(由ViaFuse-V生成)来确定大团块中的核数。然后我们将这个数字加到面积在50 μm之间的核总数中2250 μm2(由ViaFuse-V生成)来获取现场的核总数。最后,我们将发现的核的总数除以图像的面积(以毫米为单位)2,由ViaFuse-V生成),得到单位面积的核总数。
ViaFuse-F计算肌肉细胞融合指数
接下来,开发了ViaFuse-F来计算细胞融合指数。为了自动计数MYH阳性细胞外的细胞核,利用DAPI和MYH图像的融合指数计算。使用与前一节中描述的相同的过程分析DAPI图像,以获得图像中核的总数。为了计数myh阳性细胞外的细胞核,ViaFuse-F首先通过使用高斯模糊滤波器平滑图像来识别肌管及其轮廓,然后使用斐济的默认方法对图像应用阈值,使其成为二值图像,然后使用中值滤波器来减少噪声,然后填充小孔(图2)。2B左和表2).然后从细胞核图像中减去MYH图像,产生MYH阳性细胞外的细胞核图像(图2)。2B正确的和表2).为了检索myh阳性细胞外的核以进行分析,对减法得到的图像进行了以下分析:(i)在50 μm之间的粒子2250 μm2(ii)大于251 μm2.颗粒(团块)大于251 μm的面积2用面积在50 μm之间的所有核的面积模式来划分2250 μm2以确定大团块中的核数。因此,为了检索myh阳性细胞外的核数,用户将这个数字加到大小在50 μm之间的核总数中2250 μm2以获得myh阳性细胞外的细胞核数量。
为了计算融合指数,将myh阳性细胞外的核(用ViaFuse-F计数)和myh阳性细胞内的核(人工计数)相加,减去核总数(用ViaFuse-V获得),再除以场内的核总数(用ViaFuse-V获得),再乘以100。我们采用了严格的分化标准,不认为只有一个或两个核表达MYH的细胞为肌管。通过这种方式,融合指数表明肌管中核的比例(被认为是那些具有三个或更多核的myh阳性细胞)与图像中所有核的比例。
使用ViaFuse进行的量化与手动量化的值有很高的相关性
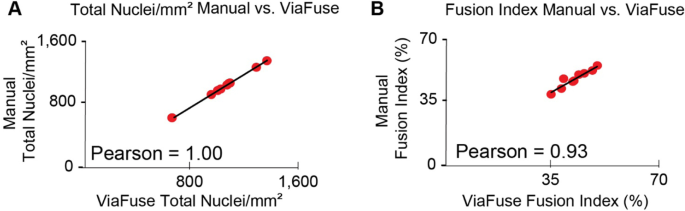
接下来使用ViaFuse-V宏分析与手动分析相同的图像,并对结果进行比较。ViaFuse-V宏生成的单位面积总核数与手动发现的值相同(Pearson = 1)(图。3.A),因此它是一种可靠的方法来测量原子核的数量。对于融合指数,ViaFuse-F得到的值与手工得到的值相似,具有较高的相关系数(Pearson = 0.93)(图。3.B),表明它也是测量融合指数的准确工具。
ViaFuse定量与MyoCount的定量高度相关
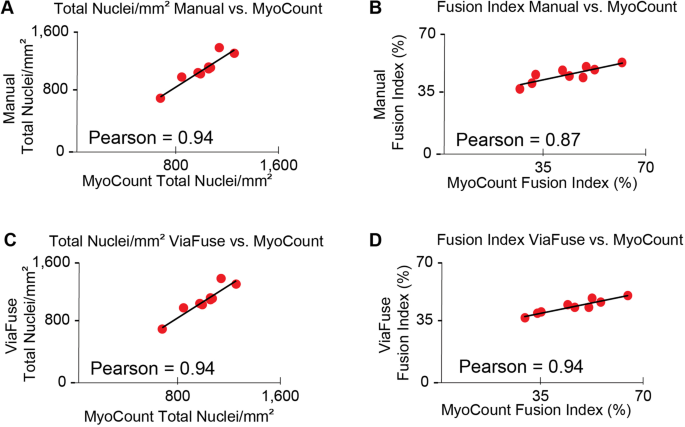
为了评估ViaFuse宏的准确性,使用ViaFuse获得的量化结果与现有软件工具MyoCount的结果进行了比较。11].我们首先证实,MyoCount计算出的单位面积总核数与手工计算的结果相似(Pearson = 0.94)(图。4A)和相似的融合指标值(Pearson = 0.87)(图。4B).接下来,我们将ViaFuse的结果与使用MyoCount程序获得的结果进行比较。我们发现,ViaFuse与MyoCount获得的单位面积核总数和融合指数值相似,Pearson相关系数为0.94(图4)。4C)和0.94(图;4D)。
ViaFuse克服了MyoCount的局限性
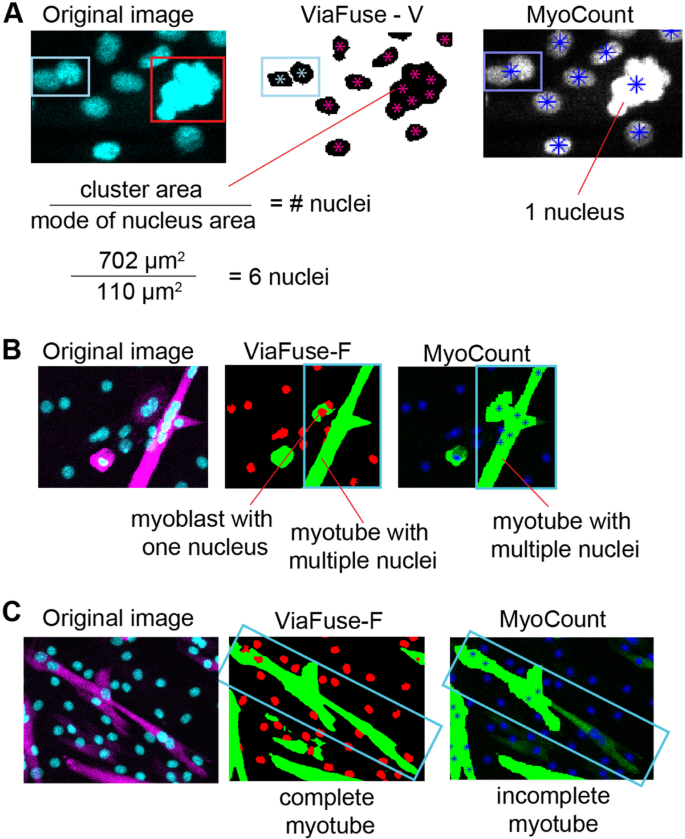
在使用MyoCount时,我们注意到一些限制。首先,在许多情况下,MyoCount不能正确识别聚集在一起的单个核,因此,将多个聚集的核视为一个核(图2)。5一个正确的).相比之下,ViaFuse-V可以更准确地识别一个团中的核数。这是因为我们在宏中使用了两个步骤。首先,ViaFuse-V更准确地利用分水岭来划分可能包含多个核的较大粒子(基于大小和形状)(图2)。5一个左(浅蓝色矩形),而MyoCount会将该粒子视为一个核(图。5一个正确的), ViaFuse-V将其分割并计算为两个核(图。5一个中间,浅蓝色矩形)。其次,ViaFuse-V包括一个计算核团(大小为> 251 μm的粒子)面积的步骤2),用户用50 μm之间的所有核面积的模态除以这个数2250 μm2.在这种方式下,一个核簇(图。5一个左(红色矩形)被MyoCount认为只有一个核(图。5一个正确的)通过ViaFuse-V估计含有大约6个核(图。5一个中间).
肌计数的第二个重要问题是,在某些情况下,它将单个成肌细胞视为邻近肌管的一部分。5B正确的).当这种情况发生时,这些成肌细胞核被算作分化肌管的一部分,导致融合指数被高估。反过来,ViaFuse-F通过区分接近的成肌细胞和肌管克服了这个问题。5B中间).
第三,与前一点相关,我们观察到在某些情况下,MyoCount无法区分彼此靠近的多个肌管或相邻的多个成肌细胞的边界(但显然没有融合)。这是一个值得关注的问题,特别是在测量融合指数时。
最后,在多个图像中,我们注意到MyoCount识别出不完整的肌管(图。5C左与正确的)而ViaFuse精确地确定了肌管的完整轮廓(图。5C左与中间).
讨论
在本文中,我们比较了三种量化骨骼肌细胞活力和融合的方法:人工计数、MyoCount程序[11],以及我们新开发的ViaFuse宏。总体而言,ViaFuse在结果方面与其他量化方法表现相似,但其可访问性、易用性和在解决核团块、区分成肌细胞与肌管近距离距离以及识别肌管边界方面的准确性使其优于其他量化方法。
手工量化骨骼肌细胞是非常准确的,但非常耗时,研究人员应该盲目,以避免计数偏差。MyoCount软件试图解决骨骼肌细胞定量的时间限制因素,通过自动化确定显微镜图像中核的总数和融合指标值的过程。然而,该软件仍然受到以下因素的严重限制:(a)无法解决核团块,(b)区分成肌细胞和肌管,(c)在多种情况下勾勒肌管,以及(e)重设备要求(大量计算机RAM),以及(f)用户需要对MATLAB有深入的数学知识。
成肌细胞分化为肌管的标志是多个成肌细胞融合在一起,经常导致核团块。成肌细胞的各种处理或培养条件也可以通过影响细胞-细胞融合来促进细胞核聚集。由于MyoCount无法区分核簇中的核,这导致了对核簇中的核的低估和聚变指数的膨胀。
MyoCount也难以估计肌管或成肌细胞的边界,这些边界靠得很近,这是肌肉细胞分化过程中自然发生的一种表型[11].这导致多个紧密的成肌细胞被算作一个肌管,这进一步提高了融合指数。MyoCount可以自动计算myh阳性细胞中三个核以下的细胞,生成融合指数;然而,这个数字并不完全准确,因为前面提到的解决核团块的问题,将成肌细胞计算为肌管,并定义肌管边界。此外,MyoCount对每张图像应用相同的计数参数;因此,如果一种治疗或条件显著改变了肌管形态,或导致更多的核团块,MyoCount无法解决这些变化。
ViaFuse解决了人工计数的时间限制和MyoCount无法解决核团块和适当的肌管和成肌细胞边界的问题。ViaFuse可以根据核簇的面积精确地分解成确切的数字。当用手量化图像时,决定权在于研究人员,他决定一个团中有多少个核,这可能导致一个更不稳定的计数,因为其他小组已经确定了[11].事实上,ViaFuse和人工量化之间融合指标值的差异可以归因于ViaFuse更准确地计数成团的核。在使用MyoCount进行的量化中,我们观察到与手动和ViaFuse量化相比,融合指数有更高的趋势,部分原因是无法识别团块中的核。当比较来自ViaFuse和MyoCount的核总数图像时,ViaFuse准确地确定了团块中核的确切数量。
ViaFuse通过计算三个或更多核的肌管外的核来计算融合指数(然后从核的总数中减去这个数字),而MyoCount通过计算三个或更多核的肌管内的核来计算融合指数[11].计数肌管外的核更精确,因为它更容易量化核团,并且黑色背景与核信号之间的对比度高于MYH和DAPI图像的背景与合并信号之间的对比度。ViaFuse-F要求用户调整的一个重要参数是MYH和DAPI图像的亮度。重要的是,MYH图像比DAPI图像更亮,以便从MYH图像中适当地减去核。研究人员在实验中和分析之前标准化DAPI和MYH图像的亮度水平是至关重要的,以避免巨大的差异。这个步骤不能自动化,因为它高度依赖显微镜图像。假设所有的MYH图像都是用相同的采集参数(应该是这样)多次拍摄的,由于图像和/或条件之间焦平面的最小变化,DAPI图像可以表现出亮度差异。标准化DAPI和MYH图像的亮度水平的最好方法是由研究人员有意识地进行。这也是在图像采集过程中需要考虑的问题。
为了克服骨骼肌细胞生物学的限制,包括核团块和肌管重叠和/或未融合肌管作为分化过程的产物,我们利用自动化和人工计数来精确估计融合指数。软件无法解析出核数少于3个的myh阳性细胞,因此使用ViaFuse,我们手动计算这些细胞中的核数,以生成最准确的融合指数值。事实上,使用MyoCount会导致融合指数膨胀,这是由于低估了细胞核总数,并将几个成肌细胞或肌管视为一个肌管。因此,ViaFuse是优越的,因为它结合了自动化的效率和人工计数的高精度。
除了生物学准确性之外,ViaFuse-V和ViaFuse-F很容易运行,因为它们是斐济插件,用户可以快速执行分析,而不需要有大量RAM的计算机。除非用户非常熟悉MATLAB代码,否则MyoCount通常很难进行故障排除。总之,ViaFuse是MyoCount的强大替代品,并解决了其局限性。
结论
ViaFuse宏包为用户提供了一个快速和简单的方法来分析视野中的核以及肌肉细胞融合接口斐济和需要最小的用户输入。此外,ViaFuse可以区分相邻的肌管和成肌细胞以及团块核,这是目前软件的一个局限性。我们预计ViaFuse宏将为研究人员节省大量分析骨骼肌细胞活力和分化的时间,并产生准确代表生物学的可靠结果。
可用性和需求
项目名称:ViaFuse。
项目首页:https://github.com/tasneemsmacros/ViaFuse
操作系统:Windows XP或更高版本,Mac OS X 10.8“Mountain Lion”或更高版本,或amd64和× 86架构上的Linux。
编程语言:ImageJ宏语言(IJM)。
其他要求:Java 8或更高版本。
许可:没有。
对非学者使用的任何限制:无。
数据和材料的可用性
本研究中使用和/或分析的数据集和材料可根据合理要求从通讯作者处获得。
缩写
- b如果:
-
免疫荧光缓冲液
- CAPZB:
-
肌z线β的顶帽肌动蛋白
- DAPI:
-
4, 6-diamidino-2-phenylindole
- DMEM:
-
杜尔贝科改良的鹰牌中号
- 斐济:
-
斐济就是ImageJ
- LMNA:
-
核纤层蛋白A / C
- MATLAB:
-
矩阵实验室
- MYH:
-
肌球蛋白重链
- PBS:
-
磷酸盐
- 内存:
-
随机存取存储器
- 转:
-
每分钟转数
- SDS:
-
十二烷基硫酸钠
- 扫描电镜:
-
均值的标准误差
- si-RNA:
-
小干扰RNA
- TBST:
-
tris缓冲盐水与tween
- ViaFuse:
-
生存能力与融合
- ViaFuse-F:
-
ViaFuse融合
- ViaFuse-V:
-
ViaFuse可行性
参考文献
Manabe Y, Miyatake S, Takagi M, Nakamura M, Okeda A, Nakano T,等。利用培养的C2C12肌管构建急性肌肉收缩模型。公共科学学报,2012;7(12):e52592。
Abmayr SM, Pavlath GK。成肌细胞融合:苍蝇和老鼠的经验教训。发展。2012;139(4):641 - 56。
McColl R, Nkosi M, Snyman C, Niesler C.体外成肌细胞融合用LADD多重染色分析和定量。生物学技术。2016;61(6):323 - 6。
Veliça P,邦斯CM。一种快速,简单,无偏倚的方法来量化C2C12肌源性分化。肌肉神经。2011;44(3):366-70。
Millay DP, O 'Rourke JR, Sutherland LB, Bezprozvannaya S, Shelton JM, basel - duby R,等。Myomaker是一种成肌细胞融合和肌肉形成的膜激活剂。大自然。2013;499(7458):301 - 5。
杜曼海提,马修森,赵丽丽,李志强,等。脑瘫儿童肌挛缩肌分离肌肉干细胞的肌生潜能和融合能力的丧失。中国生物医学工程学报。2018;32(2):344 - 344。
聂勇,蔡松,袁锐,丁松,张旭,陈林,等。Zfp422通过调节EphA7诱导成肌细胞适当凋亡来促进骨骼肌分化。细胞死亡差异。2020;27(5):1644-59。
Vadivelu SK, Kurzbauer R, Dieplinger B, Zweyer M, Schafer R, Wernig A,等。缺乏TIS7小鼠的肌肉再生和肌源性分化缺陷。分子生物学杂志,2004;24(8):3514-25。
马尤夫-劳查特A,哈迪D,索雷尔Q,鲁克斯P, Gueniot L, Briand D,等。MuscleJ:使用新的斐济工具研究骨骼肌的高含量分析方法。骨骼肌。2018;8(1):1 - 11。
encarnacon - rivera L, Foltz S, Hartzell HC, Choo H. Myosoft:使用斐济/ImageJ软件的机器学习算法的自动肌肉组织分析工具。PLoS One. 2020;15(3):e0229041。
墨菲DP,尼克尔森T,琼斯SW,奥利里MF。MyoCount:自动量化肌管表面积和核聚变指数的软件工具。Wellcome Open res 2019;4(5月):2-11。
谢弗DA,瓦德尔JA,库珀JA。CapZ在培养鸡肌肉肌纤维发生过程中的定位。细胞骨架。1993;25(4):317-35。
Pocaterra A, santino G, Romani P, Brian I, Dimitracopulos A, Ghisleni A,等。f -肌动蛋白动态调节哺乳动物器官生长、细胞命运维持和细胞命运维持。中华肝病杂志,2019;71(1):130-42。
Skarnes WC, Rosen B, West AP, Koutsourakis M, Iyer V, Mujica AO,等。为全基因组小鼠基因功能研究提供了一种有条件的敲除资源。大自然。2013;474(7351):337 - 42。
确认
我们感谢遗传学和分子生物学(GMB)课程和生物系统机械、跨学科研究(MiBio)研究生培训计划的支持。我们感谢北卡罗莱纳大学教堂山的胡克显微镜中心,显微镜成像发生在那里,以及罗伯特·柯林博士在使用他们的设备方面进行培训和教育。我们感谢Jason Franz博士,Daniel Keeley博士和北卡罗来纳大学教堂山分校(RRID:SCR_019060,部分由NINDS神经科学中心支持基金P30 NS045892和NICHD智力和发育障碍研究中心支持基金U54 HD079124资助)的神经科学显微镜核心的工作人员在这个项目期间进行了有益的讨论。
资金
这项工作得到了启动基金(J.G.)和北卡罗来纳大学教堂山分校的杰斐逊试点奖(J.G.)、美国国立卫生研究院(NIH-NIGMS R01GM130866) (J.G.)和美国心脏协会(19CDA34660248) (J.G.)的职业发展奖(J.G.)的支持。E.R.H.获得了NIH-NIAMS的F31博士预科奖学金(AR077381-01A1)和NIH-NIGMS的培训奖5T32GM007092的支持。G.M.G.获得了来自NIH-NIGMS的T32GM119999培训奖和来自美国国家科学基金会(NSF)的研究生研究奖学金计划(GRFP) (ge -1650116)的支持。
作者信息
作者及隶属关系
贡献
E.R.H.进行了细胞培养实验和人工定量免疫荧光分析。T.O.E.在E.R.H. G.M.G.的帮助下开发了ViaFuse宏,并使用MATLAB MyoCount软件对图像进行量化。J.G.设计并监督了这项研究。所有作者都分析了数据并撰写了手稿。所有作者都阅读并批准了最终的手稿。
相应的作者
道德声明
伦理批准并同意参与
不适用。
发表同意书
不适用。
相互竞争的利益
作者宣称他们之间没有利益冲突。
额外的信息
出版商的注意
伟德体育在线施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
补充信息
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条所提供的资料,除非在资料的信用额度中另有说明。
关于本文
引用本文
Hinkle,急诊室,Essader, T.O, Gentile, gmet al。ViaFuse:斐济宏计算骨骼肌细胞活力和融合指数。骨骼肌11, 28(2021)。https://doi.org/10.1186/s13395-021-00284-3
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s13395-021-00284-3
关键字
- 骨骼肌
- 肌细胞生成
- 骨骼肌细胞软件
- C2C12细胞分化定量
- 融合指数