摘要
运动单元重构包括反复去神经和神经再支配,贯穿整个生命。这一过程的效率随着年龄的增长而下降,导致神经肌肉缺陷。本研究以C57BL/6 J小鼠腓神经挤压后肌肉差异表达基因(DEG)为模型,建立运动单元重构模型。挤压后3天分离肌肉RNA,通过poly-A选择生成RNA文库,使用基因本体和通路工具进行测序和分析。与(4-6岁)成年小鼠相比,(26岁)静止肌肉中发现了334个DEG,神经挤压后成年小鼠的肌肉中也存在这些相同的DEG。腓骨挤压引起成年小鼠肌肉7133 DEG,老年小鼠肌肉699 DEG,尽管只有1 DEG (ZCCHC17)在直接比较老年小鼠和成年小鼠神经受损的肌肉时发现。这项分析揭示了肌肉反应的关键差异,这可能是老年小鼠神经损伤后修复能力下降的基础。
简介
骨骼肌质量和功能的丧失发生在晚年的很大一部分,在虚弱的发展中起着至关重要的作用,导致跌倒、行动不便、丧失独立性和生活质量下降的风险增加[68,93,112].随着年龄的增长,肌肉质量和功能的丧失主要是由于肌肉纤维的丧失以及人类和啮齿动物剩余纤维的萎缩和减弱[8,62,63,85].与人类相似,小鼠在衰老过程中,最大等距力比肌肉质量下降的程度更大,即使在相对于肌肉横截面积表示时也是如此[30.,38].因此,与年龄相关的肌肉力量损失不能仅仅用肌肉质量的损失来解释:老年动物的肌肉“数量”和“质量”都下降了[25],并有证据表明某些纤维类型发生了变化,这在人类身上尤为明显[63].
导致肌肉质量和功能损失的机制尚未完全阐明,但据肌电图研究估计,到70岁时,运动单位减少了40% [10,84].在青年人、成年人和动物中,运动单位转换发生在日常活动中,并通过受损神经轴突的萌发和再生来修复,从而导致神经肌肉连接处(NMJs)肌肉的快速神经再支配[24].这一复杂的过程涉及受损轴突、末梢雪旺细胞和去神经肌纤维的协调反应[52,60].随着年龄的增长,神经再支配发生的不恰当,效率较低,神经再支配发生的方式是从相邻的轴突发芽,而不是最初受损的轴突[60].这一过程导致了“巨大的”马达单元的形成,这些马达单元最终会消失[24,71].神经缺失可导致肌肉纤维萎缩和丧失[65,76].对老年小鼠单个肌肉纤维神经支配的研究表明,NMJs具有各种与年龄相关的结构改变,包括轴突肿胀、发芽、突触分离、轴突从一些突触后位点部分或完全消失,以及突触后专一化的碎片[11,105].目前尚不清楚NMJs的变化是否是由运动神经元和/或肌肉纤维的变化引起的。我们的数据显示,在老年小鼠的肌肉中,∼15%的肌肉纤维完全失去了神经∼80%的NMJs中断[108]和使用加速肌肉衰老小鼠模型的研究(缺乏CuZn超氧化物歧化酶的小鼠;SOD1)表明运动神经元和NMJ的完整性决定了肌肉纤维是否经历加速衰老[23,90,91,92,109,114].
轴突再生和再生长的过程是复杂的,但优雅的研究在可处理的模型等秀丽隐杆线虫和斑马鱼已经确定了损伤后再生的关键过程和信号通路[17,42,97].神经横断、神经挤压或肌肉麻痹可诱发轴突发芽[One hundred.]而这些过程导致损伤后早期(最早3天)从目标肌肉、雪旺细胞和浸润细胞释放“发芽因子”[98].这些因素被认为是导致“自我修复”,促进受损轴突的重新生长,并帮助重新生长的轴突招募到去神经支配的肌肉纤维。神经挤压后,成年小鼠NMJ的vital内成像显示这种再生长很明显[99],但老年小鼠的反应和反应背后的机制尚不清楚。数据表明,神经肌肉传输的缺乏是发芽因子释放的主要刺激因素,这些因子是早在损伤后3天就从雪旺细胞或肌肉纤维发出的顺行信号,最终导致发芽[28,98].先前对骨骼肌的微阵列研究强调了衰老如何导致显著的应激反应以及代谢和生物合成基因的低表达[111];探索失重诱导骨骼肌萎缩背后机制的研究再次强调了应激反应的激活,蛋白水解系统的激活,在一定程度上,成年啮齿动物的炎症反应;然而,成人和老年受试者对神经损伤/挤压的差异基因表达(DEG)的反应从未报道过。
本研究检测了成年和老年小鼠胫骨前肌(AT)的转录组谱,以及腓神经挤压损伤的成年和老年小鼠的子集。我们的目标是确定骨骼肌年龄相关衰退的潜在途径,以及成年和老年小鼠肌肉对神经挤压的反应之间的差异。
方法
实验动物
成年(6 ~ 8月龄)和老龄(26月龄)C57BL/6 J雄性小鼠来源于美国Charles River (North Carolina, USA)。所有动物都被安置在利物浦大学动物设施中一个温度控制的房间(22-25°C)中,在12小时的明暗循环中自由提供食物和水。所有实验程序都在英国内政部许可证下进行(内政部许可证编号P391895CA,批准日期为15/06/17),并符合1986年英国动物(科学程序)法案,并获得利物浦大学AWERB的伦理批准(伦理批准编号AWC0066,批准日期为23/3/17)。
腓神经挤压术
异氟醚麻醉小鼠,后肢剃毛,涂抹抗菌洁面乳(Videne),丁丙诺啡(100 μl, 0.3 mg/ml)。所有动物全程保持气体麻醉,所有手术均按照Staunton等人的要求进行。[99].在肢体外侧做一个小切口(5毫米),暴露腓神经。使用弯曲的微针夹压碎神经10秒,神经完全压碎可通过出现横跨神经的半透明带来证实[101].然后将周围的结缔组织放回使用Clinisorb 6.0缝合线(Akacia Medical, UK)缝合的神经和皮肤上,并让小鼠在有潮湿食物的加热室中恢复,直到观察到正常的运动、进食和探索行为。各组小鼠经过3天的恢复后被处死,解剖组织用于进一步分析。这项研究共使用了20只小鼠;n= 5/成人对照,n= 5/成人暗恋n= 5/旧的控制,n= 5/旧情人。
RNAseq的RNA分离和文库制备
通过附表1程序(颈椎脱位)杀死小鼠,解剖AT肌并在液氮中冷冻。RNA提取使用RNeasy纤维组织试剂盒(Qiagen, UK),按照制造商的说明进行。使用超turrax (IKA匀浆机,Sigma,英国)在缓冲RLT中裂解并均质约30mg组织,然后进行蛋白酶K消化步骤,总RNA结合,然后进行几个洗涤步骤,DNase消化和总RNA洗脱。使用Bioanalyzer (Agilent Technologies, USA)确认总RNA完整性。核糖体RNA (rRNA)按照制造商的说明使用ribozero™rRNA去除试剂盒(Epicentre, USA)从RNA样品中去除。
RNA数据处理
使用NEB Next®poly (A) mRNA磁分离模块为poly A选择无DNA总RNA。RNA - seq文库使用NEBNext®Ultra™Directional RNA Library Prep Kit for Illumina®#E7420从富集材料制备。使用AMPure XP珠纯化库。每个文库使用量子位进行量化,使用安捷伦2100生物分析仪评估大小分布。使用Qubit®dsDNA HS Assay Kit评估数量,而使用High Sensitivity DNA Kit评估质量和平均大小。随后,使用Illumina®KAPA文库定量试剂盒(KAPA生物系统公司,威尔明顿,美国)进行qPCR检测,专门用于检测Illumina文库侧面的适配器序列。RNA文库在Illumina®HiSeq 4000平台上进行测序,使用版本1的化学合成测序(SBS)技术,生成2 × 150 bp的配对末端reads。测序工作在利物浦大学基因组研究中心进行(https://www.liverpool.ac.uk/genomic-research/).
生物信息分析和读数比对
通过CASAVA版本1.8.2 (Illumina)执行索引读取的基本缩放和解复用以生成FASTQ格式。使用Cutadapt版本1.2.1裁剪原始FASTQ文件以删除Illumina适配器序列[70].读数被进一步修剪以去除低质量的碱基,使用镰刀版本1.200,最低窗口质量分数为20。修剪后,删除小于20 bp的读数。然后使用TopHat 2.1.0版本将Reads与基因组序列进行比对[59]和使用HTSeq2进行转录本组装。
差异基因表达分析
原始计数随后被用作R(版本1.2.5042)的输入,以利用DESeq2包[67]用于鉴别差异表达基因(DEG)。数据通过两两比较、相关热图和使用R由归一化计数数据生成的PCA图进行评估。R包“factorMineR”和“factoextra”用于PCA分析和“热图”。“gplots”中的2”函数用于绘制热图[61].
折数变化和错误发现率(FDR)阈值调整p使用Benjamini-Hochberg方法生成的值< 0.05,在某些情况下,与DEG相比有1.4 log2倍的变化(Log2FC),用于进行功能分析,特别是使用豹分类系统的基因本体(GO)生物过程进行富集分析[74],京都基因和基因组百科全书(KEGG)路径富集分析,使用clusterProfiler v. 3.8.1中的"浓缩铀KEGG "命令[113]来自Bioconductor v. 3.7 [36]以老鼠为参考生物。FDR < 0.05的GO项和KEGG通路被认为显著富集。
使用Ingenuity通路分析包(IPA, Qiagen Redwood City, USA)“核心分析”设置进行进一步的生物信息学,以确定年龄和/或碾压相关的DEG、规范通路、上游调控因子、因果/主调控因子和网络分析的相互作用。核心分析以实验观察数据为基础,在分子间间接关系和直接关系的设置下进行,并在匠心知识库的小鼠数据库中考虑数据源。所有网络得分由IPA计算为负指数p根据Calvano等人的描述,为该网络计算的值。[9].此外,利用STRING数据库9.0版本(http://string-db.org).对于成年对照组和老年对照组,使用SarcoAtlas数据库进行了额外的分析,将结果与成年(10个月)和老年(30个月)雄性C57BL/6JRj小鼠TA骨骼肌的mRNA谱进行比较(https://sarcoatlas.scicore.unibas.ch/) [6,40,41].这项比较只使用了野生型小鼠,而没有使用任何药物治疗或专门饮食的小鼠。如果FDR < 0.05,则使用那些被认为具有DE表达的基因。
我们用欧几里得距离来测量治疗组之间的聚类分离,并使用R聚类显著性包检验统计学意义[94].基于Hilden的实践,使用R进行等效检验[43]和Lakens [57],使用归一化计数数据和包“EQUIVNONINF”和“TOSTER”。
完整数据可在EBI阵列快速数据库中获得,登录号为E-MTAB-10601。
结果
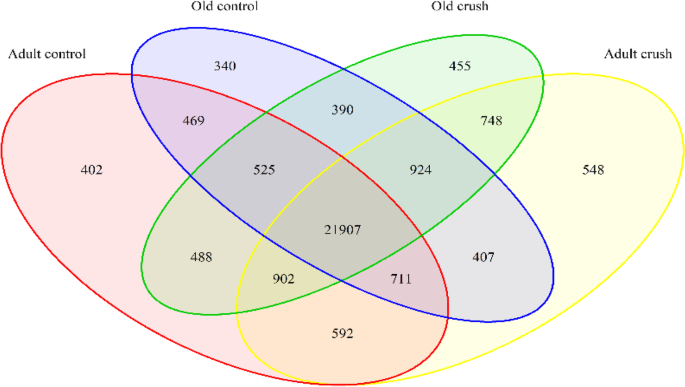
RNAseq分析来自对照成年和老年雄性小鼠的AT肌肉,以及经历了腓神经压迫模型去神经和再生的小鼠。所有研究均使用AT肌,生成2 × 150 bp的配对末端reads,然后对数据进行处理,在20个样本中共检测到29842个不同的基因转录本。图中的维恩图。1显示了每个治疗组中检测到的所有基因以及重叠的位置。所有治疗组共转录21907个基因。
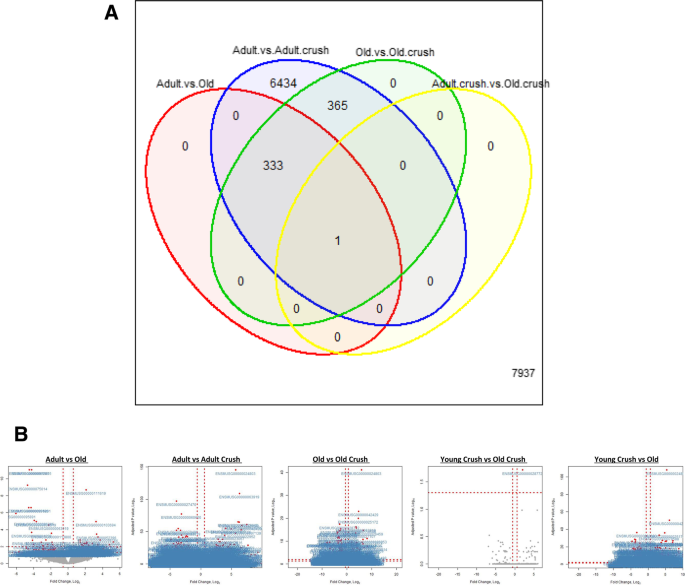
使用DESEQ2工具进行差异表达分析[67]和Table1概述了差异表达基因(DEG)的数量,包括在每个不同的比较中上调和下调的基因。图中的维恩图。2一个细节,有重叠的DEG之间的比较。成人与成人粉碎队列比较发现DEG数量最多,共检测到7133个DEG,增加和减少的基因数量相似(FDR < 0.05,n= 5/队列)(表1).每个对比的数据也可以在图中的火山图中可视化。2B表示个体基因,折叠变化和显著性水平。
成年(6个月)和老年(26个月)小鼠在休息和腓神经挤压后3天骨骼肌差异表达基因的比较。一个维恩图显示所有对比之间的DEG重叠(FDR < 0.05,n= 5 /组)。在成年小鼠和老年小鼠的对照组织中,共有334个DE基因,成年对照组和粉碎小鼠之间有7133个DE基因,老年对照组和粉碎小鼠之间有699个DE基因,成年粉碎小鼠与粉碎小鼠之间有1个DE基因,在检查成年粉碎小鼠与老年对照组时发现了1745个DEG基因。B火山图显示了骨骼肌基因在所有对比中表达差异的FDR,每个基因检测到的差异与log2折叠变化相关。FDR < 0.05的基因用红色表示,同时标记了相关的ENSMBL ID;那些不显著的基因用灰点表示
成年对照与老年对照——与成年小鼠相比,老年小鼠骨骼肌中哪些基因和通路表达不同?
通过比较成年和老年对照小鼠的肌肉,共发现了334个DEG;与成年小鼠相比,老年小鼠肌肉中上调了199个,下调了135个(FDR > 0.05,表1).这包括预期的基因变化,如氧化还原相关谷胱甘肽s转移酶(Gstp2),以及复合物1相关基因NADH:泛醌氧化还原酶(Ndufa13),以及热休克蛋白的上调(例如。hsp8).Log2FC上调最多的5个显著DEG是富亮氨酸重复激酶2/PARK8 (Lrrk2)、补体因子H (Cfh), atp酶Na+/K+转运亚基α 4 (Atp1a4), Kelch Repeat和含7 (Kbtbd7)和维生素k依赖蛋白S (Pros1).Log2FC下调最多的5个显著DEG是Syntaxin 11 (Stx11)、WD重复序列和HMG-box DNA结合蛋白1/CTF4 (Wdhd1)、血管生成素样蛋白3 (Angptl3)、TOX高迁移率基盒家族成员2 (Tox2)和半乳糖-3- o -磺基转移酶3 (Gal3st3).
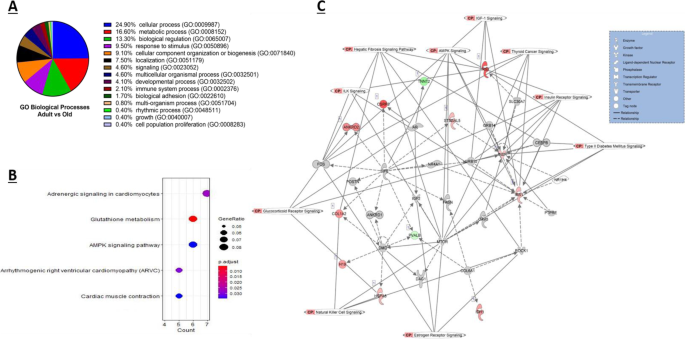
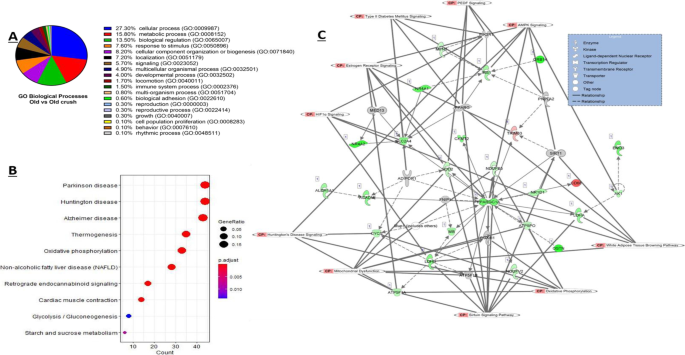
使用PANTHER进行基因本体(GO)分析,在检查从成年对照和老年对照中获得的DEG时,共报告了15个共同的GO生物过程,其中约25%的DEG被归为细胞过程类别(GO:0009987),其中包括细胞生长和/或细胞维持过程(图。3.A).统计过度表征测试显示,就氧化石墨烯分子功能而言,谷胱甘肽过氧化物酶活性(GO:0004602)和蛋白质结合(GO:0005515)均显著过度表征(p< 0.05, Fisher精确检验)。TRAF2-GSTP1复合物(GO:0097057)是细胞成分中最显著的GO术语,其次是内质网出口位点(GO:0070971)、I带(GO:0031674)和Z盘(GO:0030018)。
使用enrichment KEGG进行KEGG通路富集分析;共发现5个显著富集的KEGG类,如图所示。3.B.特别有趣的是,骨骼肌中已被广泛研究的谷胱甘肽代谢和AMPK信号通路在成人和老年骨骼肌的DEG基础上显著富集(图。3.B, fdr < 0.05)。
使用完善的匠心途径分析(IPA) (Qiagen Redwood City, USA),基于FDR < 0.05和1.4 log2倍变化切断/阈值(Log2FC),进一步分析了成年人与老年人肌肉比较的DEG。总共确定了16个显著丰富的典型通路(当使用Fisher 's Exact Test进行评分时)以及17个上游调控因子和7个因果网络(表中总结输出)2).前10个丰富的典型路径与日志p> 1.3以及各典型通路中具有代表性的DEG列于表中3..当丰富的KEGG通路(图;3.B)与那些从匠心知识库中提取的顶级规范路径进行比较(表2), KEGG和IPA均显著增强了AMPK信号。
IPA的高级分析允许识别上游调控因子,这些调控因子可能是观察到的基因变化的因果调控因子(“主调控因子”)。用这种方法,5个最重要的上游调节因子是dystrophin (DMD),溶质载体家族30个成员7 (SLC30A7)、脂肪酶E (时间)、雄激素受体(基于“增大化现实”技术)和VI α 1型胶原蛋白链(COL6A1).针对成人和老年DEG表达数据,我们确定了四个主要调控因子:TARDBP)、生长因子受体结合蛋白14 (GRB14)、生长因子受体结合蛋白10 (GRB10)和CCAAT增强子结合蛋白(CEBPB).
通过IPA网络分析算法在我们的数据中确定了相互连接的分子的六个关键网络。它们由几个焦点分子组成,是为连通性而构建的,所有网络分数都由IPA计算为的负指数p为该网络计算的值由[9].得分最高的网络得分为13分,由12个焦点分子组成,如图所示。3.C.所示的网络也覆盖了10个与网络中的DEG相关的规范路径。该网络主要与碳水化合物代谢、分子转运和小分子生物化学功能相关。该网络由编码热休克蛋白、营养不良蛋白、FOS和胶原蛋白的基因组成。这些DEG之间的所有交互/关系都由不同的线和图例连接起来。
使用交互式SarcoAtlas数据库,我们比较了这里的DEG与mRNA的轮廓胫骨前10个月和30个月的野生型小鼠的骨骼肌。使用FDR阈值< 0.05的基因表达输出,共输出1696个基因表达谱;然后将其与本研究中发现的334个DEG进行比较,总共发现了28个共享基因。RNA-Seq和微阵列之间的主要区别在于,前者允许对整个转录组进行完全测序,而后者仅通过杂交对预定义的转录本/基因进行测序,因此重叠只有28个基因也就不足为奇了。这些结果载于补充表S1.
然后利用等效检验来探索两个种群之间的潜在相似性;这项研究检查了所有检测到的基因,以评估在成年对照组和老年对照组人群之间统计上表达相似的基因数量。这项非参数检验使用归一化基因计数,并确定了2225/21388个成人和老年对照样本之间在统计学上表达相似的基因。
成年对照与成年挤压——成年小鼠腓神经挤压损伤对骨骼肌中哪些基因和通路有不同的修饰?
为了了解为什么运动单位周转随年龄的不同而不同,以及不同年龄对损伤的反应,我们建立了腓神经挤压模型,并在神经挤压后3天对对照组织和挤压组织的AT肌进行了检查。RNAseq分析共检测到29,842个基因,其中23%的基因在成人对照和粉碎组织之间差异表达(7133℃,n每组= 5,FDR < 0.05,见表1).粉碎后共上调3656个基因,下调3477个基因。Log2FC上调最多的5个显著DEG基因是阳离子通道精子相关基因1 (Catsper1)、生长/分化因子5/ BMP 14 (Gdf5)、神经元乙酰胆碱受体亚单位α -9 (Chrna9)、非典型钙粘蛋白2 (Fat2)和胆碱能受体尼古丁γ (Chrng), 5个下调最显著的基因为Synaptotagmin 8 (Syt8)、水通道蛋白4 (Aqp4), Kelch重复序列和含13 (Kbtbd13)、甲基转移酶样物21C (Mettl21c)和单酰甘油o -酰基转移酶2 (Mogat2).
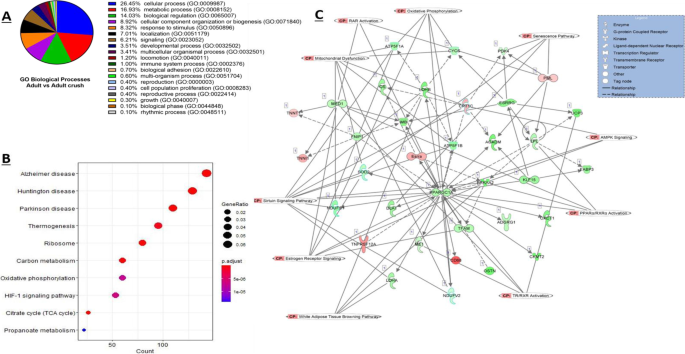
利用PANTHER对成年对照和成年挤压样品的上调和下调的DEG进行GO分析,发现了21条富集的生物学通路。富集程度最高的三个过程和属于这些类别的基因百分比分别是细胞过程(26.4%,GO: 0009987)、代谢过程(16.9%,GO: 0008152)和生物调控(14.0%,GO: 0065007)(图。4A)。使用统计过度代表检验的三个最显著的生物过程是2-氧戊二酸盐代谢过程(GO:0006103)和三羧酸循环(GO:0006099)和酰基辅酶A生物合成过程(GO:0071616) (p< 0.05, Fisher精确检验)。其中,核糖体结构组成(GO:0003735)、rRNA结合(GO:0019843)和电子转移活性(GO:0009055)是氧化石墨烯分子功能表现最为显著的3种(p< 0.05, Fisher精确检验)。
进一步的KEGG分析显示,与成人粉碎DEG相比,成人对照组共有77条KEGG通路显著富集(FDR < 0.05)。数字4B显示10个富集最显著的通路。一些神经退行性疾病通路显著增加(亨廷顿病(mmu05016),帕金森病(mmu05012)和阿尔茨海默病(mmu05010)),以及衰老相关通路,如FoxO信号通路(mmu04068), HIF-1信号通路(mmu04066), PI3K-Akt信号通路(mmu04151)和氧化磷酸化(mmu00190)(图。4B)。
进行了Ingenuity通路分析,以进一步研究神经挤压所见变化背后的机制,并揭示关键的规范通路、上游调控因子和因果网络。在516个检测到的典型通路中,共有41个显著富集(p< 0.05, Fisher精确检验,表4),并发现了17个上游调节器和8个因果网络/主调节器。
几种典型的通路包括与蛋白质稳态、整合素信号、白介素信号、线粒体功能障碍和衰老相关的通路,其中富集程度最高的10条通路以及与特定通路相关的分子和各自的对数折叠变化值见表4.最丰富的典型通路是TCA循环II(由16个分子和对数组成)p值8.62)。与成年对照相比,共有17个上游调控因子与成年对照的DEG显著相关,包括转录调控因子、受体和细胞因子,5个最重要的上游调控因子是:脂肪酶E (时间)、雌激素相关受体(ESRRG), PPARG共激活因子1 α (PPARGC1A),解偶联蛋白1(也称为热原蛋白;UCP1)和smooththelin Like 1 (SMTNL1).确定的主调控因子包括多种分子类型,如转录调控因子、转运因子和酶,前5位的主调控因子是雌激素相关受体γ (ESRRG)、组蛋白去乙酰化酶4 (HDAC4),解偶联蛋白1/热原蛋白(UCP1), smooththelin Like 1 (SMTNL1)和α -1复合营养素(SNTA1).
IPA分析共鉴定出25个显著网络,其中3个均与35个焦点分子相关,得分为13。顶部网络如图所示。4C,其中与网络相关的规范路径被覆盖。这个网络由几个基因组成,包括超氧化物歧化酶(SOD2),泛巨噬细胞标记CD68,苹果酶1(通常称为nadp依赖性苹果酶(组织)和线粒体肌酸激酶(MtCK),该网络与能量产生、分子转运和核酸代谢相关的功能最为丰富。
老年对照与老年挤压——在老年小鼠腓神经挤压损伤后,哪些基因表达不同?
为了了解老年小鼠的肌肉对运动神经挤压损伤的反应,将26个月大的小鼠的AT肌肉与3天前遭受腓神经挤压的26个月大的肌肉进行了比较。转录组分析显示,在检测到的29842个基因中,共有699个基因存在差异表达(n每组= 5,FDR < 0.05,见表1).在这699个DEG中,共有292个显著上调,407个显著下调。
5个最显著上调的DEG (LogFC)是胆碱能受体烟碱γ亚基(Chrng)、阳离子通道精子相关1 (Catsper蛋白)、肿瘤蛋白P53通路辅抑制因子1 (Trp53cor1)、凝集素甘露糖结合1 (Lman1l /ERGIC-53)和几丁质酶3-like-1 (Chil1).LogFC下调最多的5个基因为果糖胺3激酶(Fn3k)、EMAP Like 6 (Eml6)、外密纤维蛋白3样蛋白2 (Odf3l2)、钾电压门控通道调节器亚家族G成员4 (Kcng4)及含38 (Lrrc38).
旧对照与旧粉碎DEG的基因本体分析检测到19个相关的生物学过程(图2)。5A). DEG在细胞过程(GO: 0009987)、代谢过程(GO: 0008152)和生物调节(GO: 0065007)中所占比例最高,分别为27.9%、15.8%和13.5%;这些结果与上面讨论的成年对照鼠与老年对照鼠、成年对照鼠与成年神经受压小鼠的肌肉比较一致。在PANTHER通路方面,趋化因子和细胞因子信号通路(P00031)介导的炎症是得分最高的通路,old vs old粉碎数据集中8.7%的基因归为这一类。在研究统计上过度代表的氧化石墨烯功能时,糖原分解代谢过程(GO:0005980)、葡聚糖分解代谢过程(GO:0009251)、线粒体电子传递、NADH到泛醌(GO:0006120)以及线粒体电子传递、泛醇到细胞色素c (GO:0006122)是最显著的氧化石墨烯生物过程(p< 0.05, Fisher精确检验)。统计上代表过多的细胞成分为线粒体质子转运ATP合酶复合体、偶联因子F(o) (GO:0000276)、质子转运ATP合酶复合体、偶联因子F(o) (GO:0045263)和线粒体质子转运ATP合酶复合体(GO:0005753) (p< 0.05, Fisher精确检验)。在氧化石墨烯分子功能方面,3个最显著的超代表功能是嘧啶核苷酸结合(GO:0019103)、质子转运ATP合成酶活性、旋转机制(GO:0046933)和NADH脱氢酶活性(GO:0003954) (p< 0.05, Fisher精确检验)。
KEGG富集分析显示,在旧粉碎和旧粉碎DEG数据集中,共检测到的259条KEGG通路中,有12条显著富集(FDR < 0.05),富集程度最高的10条通路如图所示。5B所示。与三种神经退行性疾病途径相关的成人挤压基因被富集:帕金森病(mmu05012)、阿尔茨海默病(mmu05010)和亨廷顿病(mmu05016)。在旧粉碎DEG中富集的其他途径包括氧化磷酸化(mmu00190)以及钙信号(mmu04020)和产热(mmu04714)。
与旧对照和旧粉碎组织相比,在获得的DEG中鉴定出22个显著的典型通路富集通路p值< 0.05。其中包括氧化磷酸化、线粒体功能障碍和sirtuin信号通路,这是前3个富集途径。前10种典型路径见表5.
利用因果网络分析功能作为IPA知识库的一部分,我们能够检测并报告可能在旧对照和旧压痕数据集中控制差异表达基因的新上游调控因子。共检测到49个上游调控因子,其中包括转录调控因子、酶、配体依赖受体、细胞因子和转运蛋白,且有显著重叠(P< 0.05)。5个最显著富集的上游调控因子是过氧化物酶体增殖物激活受体γ辅激活因子1- α (PGC-1α) (PPARGC1A)、滑素样蛋白1 (SMTNL1通常被称为鸿沟)、雷帕霉素的哺乳动物靶点(MTOR)、脂联素受体1 (ADIPOR1)和普洛斯彼罗同源异构体蛋白1 (PROX1)(图。5C)。
在我们的数据集中确定了10个主调控因子,也就是说,调控因子可能没有直接列在我们的数据集中,但预计是可能激活或抑制其他通路的关键控制器。检测到的前5个主要调节因子是光滑素样蛋白1 (SMTNL1)、过氧化物酶体增殖物激活受体γ辅激活因子1- α (PGC-1α) (PPARGC1A)、普洛斯彼罗同源异构体蛋白1 (PROX1)、α -1胶原蛋白(VI) (COL6A1)和组蛋白去乙酰化酶4 (HDAC4).
当将老化的控制肌肉与遭受神经挤压的肌肉进行比较时,总共检测到15个重要的网络,这些网络可能具有关键的生物学作用。得分最高的网络共有25个焦点分子,得分为16,该网络与能量产生、核酸代谢和小分子生物化学有关;这个顶级评分网络如图所示。5C,其中与这些数据集和网络相关联的规范路径被覆盖(并且在它们旁边有一个CP标签)。
成年挤压与老年挤压——神经挤压后的老年小鼠与神经挤压后的成年小鼠肌肉中有哪些基因表达差异?
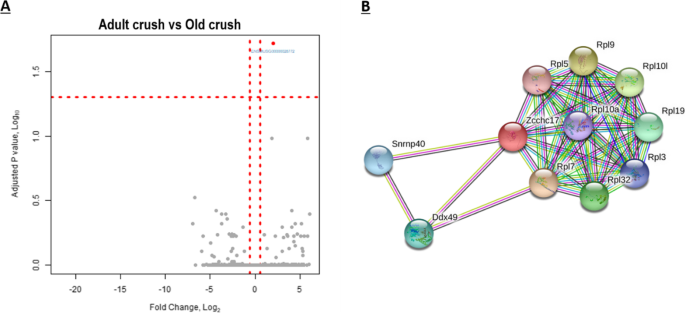
为了直接探索衰老如何影响肌肉对神经损伤的反应,比较了成年人和老年人挤压后的DEG。分析了29842个基因转录物,但只有一个基因锌指cchc型含有17 (ZCCHC17,也称为PNO40),差异表达(log2 fold-change为1.99±0.4,FDR < 0.05)。这表明在碾压后的这个时间点,两组人群的基因表达有实质性的协调。这可以在火山图中看到ZCCHC17为图中右上方红色区域的单个基因(图2)。6一个)。ZCCHC17在老年小鼠神经挤压后,qPCR也显示肌肉样本中表达上调(数据未显示)。
IPA基因观点将ZCCHC17归类为参与RNA和蛋白质结合的核仁蛋白。ZCCHC17所关联的氧化石墨烯分子功能为金属离子结合、核酸结合、蛋白质结合和RNA结合。IPA建议ZCCHC17由Kruppel Like Factor 3调控(KLF3)和SET核原癌基因(集),并与Syndecan结合蛋白2 (SDCBP2),锌指和BTB结构域含38 (ZBTB38), Jumonji域包含6 (JMJD6)、淀粉样前体蛋白(应用程序), Pinin (并通过)、Dynein轻链Tctex-Type 1 (DYNLT1)、核受体亚家族2 C族成员2 (NR2C2)、环GMP-AMP合酶(注册会计师),自噬相关16 Like 1 (ATG16L1), HECT和RLD结构域包含E3泛素蛋白连接酶2 (HERC2), HECT结构域E3泛素蛋白连接酶1 (HECTD1)、核糖体rna加工蛋白8 (RRP8)、铁蛋白轻链(FTL),多聚体IgA和IgM连接链(JCHAIN)和rna结合基序(遏制).
来自人类蛋白质图谱的表达数据表明ZCCHC17具有较低的组织特异性,但RNAseq数据库表明它主要在神经元组织中表达。与该基因相关的表型、疾病和性状包括异常细胞分化、细胞早期复制性衰老和氧化应激[83].
的蛋白质-蛋白质相互作用ZCCHC17被STRING标识,相互作用的伙伴如图所示。6B (50].对ZCCHC17一级蛋白相互作用组进行GO分析,发现14个显著富集的生物过程;见表6.
成年小鼠的神经挤压与老年对照——成年小鼠的神经挤压是否复制了老年小鼠肌肉衰老过程中所见的基因表达变化?
在与肌肉损失相关的老年小鼠中发现的广泛运动神经元损失和NMJ变性促使我们将对照老年小鼠AT肌肉中发现的DEG与成年小鼠神经后挤压中发现的DEG进行比较。为了研究由于老年去神经肌纤维的存在,肌肉中发生的DEG变化与神经挤压后成年小鼠肌肉中出现的DEG变化有多相似,我们比较了这些数据,并使用统计等效检验来获得关于两个数据集之间共性的进一步信息。
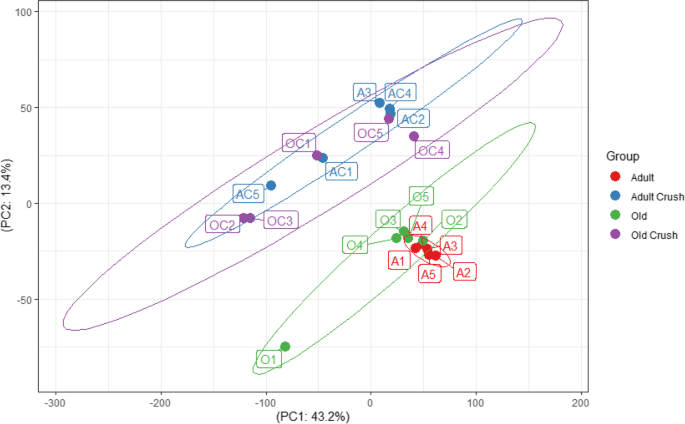
主成分分析(PCA)对所有4个数据集(成年、成年迷恋、老年和老年迷恋)都强调了人群之间的变异性,但没有根据基因来说明(图2)。7))。对归一化计数数据进行的PCA显示,处理(挤压vs对照)的样本有很强的聚类,但没有按年龄明显分开。成年挤压样本(标记为AC1-5)和旧对照样本(O1-5)不重叠或似乎密切相关。该图显示了基于规范化计数的数据的可视化表示,而不是完整的DE分析。欧几里得距离被计算为组间簇分离的度量。分析表明,神经粉碎成人肌的数据与老年对照组无明显差异(表2)7;p= 0.78)。
按基因(行)和种群(列)划分的层次聚类显示基因以类似的方式起作用(图。8A).两组的平均计数数据绘制为图中的散点图。8B概述了两组之间的基因相关性有多好,很少有明显的异常值。
进行等效检验,进一步探讨两个种群之间的潜在相似性;这项研究检查了所有检测到的基因,以评估在成年迷恋人群和老年对照组人群之间,有多少基因(以及哪些基因)在统计学上表达相似。这项非参数测试使用归一化的基因计数,并确定了2672/ 21269个基因在成人迷恋和旧对照样本之间的表达在统计上相似。
讨论
这项研究的目的是使用RNAseq分析来检测小鼠骨骼肌年龄相关衰退的基因表达差异,以确定老年小鼠中看到的差异是否与活跃退化或再生神经的存在有关,并确定老年小鼠和成年小鼠之间肌肉的急性转录反应之间的差异,这可能表明为什么老年小鼠的肌肉在神经损伤后表现出较差的神经再支配。挤压后的样本是在腓神经挤压后3天获得的,我们之前显示的时间点与远端轴突结构的显著损失和at肌肉线粒体产生过氧化物的增加有关,尽管at质量在该阶段保留了下来[99].
获得的数据已经确定了衰老肌肉中出现的DEG,并表明老年小鼠肌肉中发现的所有DEG都可以通过神经挤压在成年小鼠中诱导产生。在神经挤压后的成年小鼠中只发现了一个DEG,而在神经挤压后的老年小鼠肌肉中发现了这些DEG,这表明老年小鼠和成年小鼠肌肉之间的差异在挤压损伤的反应中最小化。
这项研究揭示了每种对比的DEG,其中很少有之前关于骨骼肌衰老和去神经的研究,但提供了一些有趣的预测通路富集和潜在的上游调控因子和网络分析。虽然检测到一系列的DEG可以控制成人和老年骨骼肌对损伤/去神经的反应,但重要的是要认识到这种方法的局限性。不能假定所有的DEG都来自肌纤维,因为所分析的肌肉组织包含许多其他细胞,包括神经元组织卫星细胞、成纤维细胞、终末施万细胞(tSCs)、脂肪细胞和免疫细胞,尽管数量较少,但可能有助于获得的数据,为了克服这一点,可以进行单细胞RNAseq,或者可能是单核RNAseq。重要的是要认识到,衰老的运动神经元已经改变了性质,可以参与观察到的表型。我们知道,在衰老过程中,小鼠的卫星细胞数量会减少[12,22]以特定于纤维类型的方式;纤维结缔组织和脂肪组织也会随着年龄的增长而增加[7,37].虽然RNAseq在识别重要基因和通路方面非常强大,与其他生物信息学分析一样,几个数据库/平台的使用具有不同的优势和弱点,并揭示了进一步干预的潜在治疗靶点和通路。当探索/比较这些GO或KEGG路径与丰富的IPA输出时,许多路径并不是完全重叠的,也不是在所有数据库中都可以看到的。这是因为许多人使用不同输入的数据库。同样,本研究报告了转录水平上的变化,并且认识到这可能不能反映蛋白质水平上的变化。
年龄对小鼠骨骼肌DEG的影响
通过比较成年和老年小鼠肌肉的DEG,研究骨骼肌对衰老的响应。通过比较,共鉴定出29842个基因中的334个DEG。这些基因中只有一小部分与骨骼肌生物学有关。途径富集分析用于确定这种差异基因表达如何导致与年龄相关的小鼠骨骼肌质量和功能损失。
其中的几个过程与神经退化或再生有关。因此,通过比较成年小鼠和老年小鼠对照肌数据发现,上调幅度最大的5个DEG与不同的生物学过程相关。富亮氨酸重复激酶2/PARK8 (Lrrk2)一种与神经障碍帕金森病相关的基因被发现表达差异[33].该基因在骨骼肌生理学方面尚未被详细研究,但它被广泛表达,并被认为在控制神经突形态和复杂性以及炎症、蛋白质降解和维持线粒体稳态方面发挥关键作用[16,32,110],这些蛋白在衰老过程中都会在骨骼肌中受到干扰。
另一个强烈上调的DEG是atp酶Na+/K+转运亚基α 4 (Atp1a4);该基因编码一个完整的膜蛋白,负责建立钠的电化学梯度+和K+离子(1].针对α亚型KO小鼠Na, k - atp酶泵的基因靶向研究表明,它们在调节Ca(2 +)与肌肉收缩有关的瞬间[66],这可能表明这种Atp1a4 DEG可能有助于SR Ca的损伤2 +释放,损伤被认为可以解释老年动物肌肉的物理性能缺陷[82].
Syntaxins是SNARE蛋白的一个家族,是一种主要定位于突触前活性区并参与囊泡胞吐的膜蛋白。句法素11 (STX11)随着年龄的增长而降低。syntaxin的变化与神经传递受损有关[35,45,96],但此前没有研究将syntaxin 11与骨骼肌衰老联系起来。
其他鉴定出的DEG与DNA损伤调节(如Wdhd1),但这在以前并没有与肌肉生理有关[34].的Pros1基因(蛋白S)在老年小鼠肌肉中表达明显下调。以前的工作很少被报道Pros1,但莫顿等人的一项研究[78]表明该基因是同心抵抗运动训练后在人类骨骼肌中观察到的富集途径的一部分。
KEGG分析显示谷胱甘肽代谢和AMPK信号通路是最富集的通路。这并不奇怪,因为这两种途径都被认为在肌肉稳态和衰老过程中发挥关键作用[54,75,86].当用KEGG和IPA评估成年和老年骨骼肌之间的DEG时,AMPK信号显著增强。
IPA上游分析发现白细胞介素9 (IL-9)信号,是与骨骼肌衰老相关的顶级典型途径之一。IL-9及其受体(IL-9R)主要在神经元细胞和免疫细胞中表达[55]是JAK/STAT信号转导通路的激活剂,将细胞因子与几种生物过程联系起来。IL-9主要靶向免疫细胞,并作为一种具有抗凋亡活性的生长因子[4这一观察结果表明,IL-9的调节可能会影响骨骼肌中随年龄变化而观察到的运动神经退行性变。主要由Th2辅助T细胞产生的IL-9是一种与炎症相关的典型细胞因子,因此这可能是由于老年小鼠骨骼肌内的免疫细胞激活引起的,尽管这还没有详细研究。损伤后,T细胞迅速渗入受损骨骼肌,Cheng等报道。[18研究人员发现,这种浸润大约在损伤后3天开始,并至少持续到再生的第10天,因此这里的IL-9很可能是免疫细胞活动的结果。从成人和老年骨骼肌的比较来看,胰岛素受体信号也是最丰富的典型通路。这与众所周知的肌肉胰岛素抵抗随着年龄的增长而发生的变化完全一致[39].
使用IPA中的高级分析还揭示了几个上游监管机构(UR)。UR鉴定方法通过对潜在UR的协调表达来检查与DEG的联系,这些UR可以是转录因子或实验观察到的影响基因表达的任何基因或小分子。在老年小鼠和成年小鼠样品中检测到的最高UR是关键结构蛋白dystrophin (DMD).令人惊讶的是,在这种类型的分析中显示了这种大蛋白质,但UR分析显示它与数据集中的4个靶基因相关(COL1A2,段H19,HSPA8和PVALB).肌萎缩蛋白除了众所周知的结构作用外,似乎还有调节作用。这已经在抗肌萎缩蛋白缺乏(mdx)小鼠的研究中得到证实,许多研究现在已经确定了代偿蛋白DMD它们被认为与神经肌肉连接结构的维持和肌肉稳态有关(Rouger等人。[89];休斯等人。[47].杜蒙等人[26]还发现,营养不良蛋白在调节卫星细胞极性和不对称分裂中起着重要作用。这对肌肉再生至关重要,在缺乏肌营养不良蛋白的情况下,肌纤维变得脆弱,由于固有的卫星细胞功能障碍,再生受损[13].
Pannérec等人的一项研究[81]评估了老年大鼠腓肠肌中的基因表达,并确定了几种“神经肌肉连接相关”基因,这些基因在比较成人(8个月)、早期肌肉减少症(18-20个月)和肌肉减少症(22-24个月)肌肉样本时表达差异。肌营养不良蛋白(DMD)(如上所述)和Thbs4被认为与神经肌肉连接有关。Thromonospondin (Thbs4),这种蛋白质可调节骨骼肌的完整性及其对肌肉萎缩症的易感性[106],在成年肌肉和老年肌肉之间有显著的DE (log2FC为1.27),在Pannérec等中观察到相同的表达模式。[81数据集。同样地,当比较成人与老年DEG以及Pannérec等人的GO富集术语时。[81],常见的丰富的生物学过程包括神经肌肉功能、细胞外基质重塑和纤维化、线粒体功能和炎症。
被认定的顶级监管机构之一是TARDBP;该基因编码TDP-43,一种高度保守且普遍表达的蛋白质,参与转录和RNA剪接调控。过度磷酸化和泛素化的TDP-43沉积物与几种神经退行性疾病有关,产生的沉积物在大脑和脊髓中起包涵体的作用[87].Olivé等。[79]的研究结果表明,TDP-43不仅在肌原纤维肌病中积累,而且在蛋白聚集肌病中异常蛋白质生产、修饰和积累的microRNA加工过程中起着关键作用,这些数据表明,年龄可能导致了相似性的发生。增强子结合蛋白(CEBPB)也被发现是一种主要的调节因子,这种特殊的基因突出了卫星细胞参与骨骼肌衰老的潜力。最近的研究表明CEBPB作为肌肉细胞再生过程中卫星细胞自我更新的新型调节因子[58,69].的CEBPB蛋白质最近也与ATF4有关,ATF4被认为介导肌肉萎缩[27].
上述途径和特定的DEG是通过检查肌肉组织获得的,因此本研究的局限性在于我们无法确认骨骼肌纤维类型比例变化的细胞来源和数据,在我们当前的研究中无法获得。Murgia等人。[77]对人类快纤维和慢纤维类型进行了单纤维蛋白质组学分析,他们的结果与我们的结果之间的相似性突出了几种途径以及单个蛋白质的作用。Murgia等人。[77]强调了慢纤维和快纤维中线粒体老化的特征,应激反应蛋白的作用以及与蛋白质稳态相关的蛋白质的作用以及伴侣的作用。我们的数据也证实了几种谷胱甘肽过氧化物酶基因(包括GPX3)和谷胱甘肽s转移酶基因(包括GTSP1)以及应激反应基因(ATP6V)和一些伴侣蛋白,特别是热休克蛋白(包括HSPA8),与Murgia等人的数据集相似。[77],支持使用这种方法。
神经挤压对成年小鼠肌肉DEG的影响
7133个骨骼肌基因在成年小鼠腓神经挤压损伤后表达有差异。实验数据表明,运动神经的切断或神经挤压导致失神经肌肉中退行性途径的快速激活,包括增加线粒体生成活性氧[76],促炎细胞因子的生成增加[46]和蛋白质稳态的破坏[102].神经切片后这些变化发生的时间过程表明,即使在较年轻动物中发生的相对较短的去神经和随后的肌肉纤维再支配期间,它们也必须发生。因此,我们已经证明,外周轴突和NMJ的结构在神经切片后3天内丢失;斯汤顿等人[99]和Jang等人。[49]报告肌肉线粒体H显著增加2O2这增加了线粒体H2O2神经横断后3天内就能明显释放。这种激活特定降解途径的效果尚不清楚,但我们推测,最初这可能反映了恢复神经支配的尝试,因为细胞因子等产物从肌纤维中释放出来,一些细胞因子已被提出刺激轴突发芽[28].发现的大量DEG(约占检测到的总基因的24%)反映了这一过程引起的肌肉的主要重构;这些变化包括运动神经退行性变、突触前NMJ的丧失、神经再生的早期阶段和肌肉萎缩。在DEG中检测到的是与所有这些过程相关的关键基因,包括神经元乙酰胆碱受体亚基α -9 (CHRNA9)、胆碱能受体烟碱γ (CHRNG)和生长分化因子5 (GDF5)和确定的典型途径包括mTOR信号,这是调节肌肉蛋白质稳态的关键。KEGG分析确定了成年小鼠神经挤压后肌肉中诱导的通路,这些通路与神经退行性疾病有关,如亨廷顿氏病、帕金森病和阿尔茨海默病(图2)。4B).虽然这可能表明在这些疾病和肌肉减少症中发生了共同的神经退行性途径,但这可能只是反映了这些疾病中正在进行的基础神经退行性和再生,这在实验神经挤压中得到了概括。运动神经元中的运动单元重组和炎症变化已知会降低复合肌肉动作电位的传导速度和振幅,导致神经肌肉损伤,这可能是为什么在这里发现了这些神经系统疾病[56].因此,IPA输出显示上游调控因子和主调控因子也与神经退行性疾病密切相关,如PPARG共激活因子1 α (PPARGC1A) [21,51,73]和线粒体解偶联蛋白热原素(UCP1) [19,44,53].
最令人惊讶的是,将成年小鼠神经挤压引起的骨骼肌中DEG与对照老年小鼠骨骼肌中DEG与对照成年小鼠相比进行比较,发现对照组肌肉中与衰老相关的所有344 DEG都是由成年小鼠肌肉中的神经挤压引起的,尽管在有挤压的成年小鼠中看到的DEG的全部程度要大得多。因此,在老年小鼠对照肌肉中看到的DEG并不能反映成年小鼠挤压后基因变化的全部程度。这些数据表明,就DEG而言,肌肉在衰老过程中所看到的所有变化都是由腓骨神经挤压在成年小鼠中所看到的DEG模式的一部分。
这些结果强调了运动神经丧失和再生(即运动单元翻转)在骨骼肌衰老所见的转录变化中的关键重要性,并从根本上影响衰老诱导的骨骼肌基因表达变化的解释方式。这一关于运动神经元和运动单位损失在引起与衰老有关的肌肉损失的原因中的重要性的结论,先前已根据生理学[10]和结构上的改变[5,108],但在此之前并未被DEG的分析所强调。
衰老是否会影响骨骼肌对神经挤压损伤的反应?
在神经挤压后的老年小鼠肌肉中检测到699个DEG。尽管检测到的总基因水平相似(成年小鼠和老年小鼠的肌肉分别为29,842和29,844),但这远低于神经挤压后成年小鼠肌肉中发现的7133 DEG。这意味着老年小鼠的肌肉对神经挤压的反应减弱了。老年小鼠的肌肉被认为有多个相互作用的功能失调系统[72],例如蛋白质平衡的改变[31]、脂肪组织及结缔组织渗入骨骼肌[104],线粒体功能障碍[48],无法引起细胞保护反应[107],卫星细胞数目减少[12,95],增加ROS的产生[80]和增加炎症[29],这些都可能导致这种反应机制的减弱。
相比之下,当直接比较成年小鼠和老年小鼠神经挤压后的肌肉时,老年小鼠的肌肉中只有一个DEG (ZCCHC17)上调(Log2 Fold变化1.99,经bh调整)p值0.01)。锌指cchc型含17 (ZCCHC17)蛋白质(也称为PNO40)定位于核仁,并与多种金属离子、核酸、蛋白质和RNA结合蛋白相互作用[14].ZCCHC17最近被认为是阿尔茨海默病的主要调节因子,在阿尔茨海默病早期神经元细胞中表达,在显著的神经元细胞损失或胶质细胞增生之前,神经元细胞的水平急剧下降。ZCCHC17还被认为支持突触基因网络的表达,并与钙信号和蛋白甘露糖基化有关[64,103].这项研究首次在DEG的基础上确定了这种与衰老相关的疾病与肌肉减少症之间的共同联系,并建议ZCCHC17可能是导致这两种疾病的潜在因素。
这项研究的最初目的是确定老年小鼠和成年小鼠在神经挤压后骨骼肌之间的差异反应,这可能解释与年龄相关的神经修复能力差异。据推测,老年小鼠肌肉中神经再支配缺陷的一个原因是未能从肌肉中释放适当的“发芽因子”。鉴定从短暂去神经的肌肉纤维中释放出的特定轴突“发芽因子”(这些因子不适当地从老年小鼠的肌肉中释放)被认为是潜在的治疗靶点,以帮助在衰老过程中保持肌肉纤维的适当神经支配。预计神经营养因子如NGF、BDNF、NT3和NT5将被鉴定出来。虽然在成年和老年小鼠的肌肉中检测到几种典型的神经营养因子,并可能作为骨骼肌维持、功能和再生的潜在调节因子,但它们的表达没有差异。检测到的其他基因也可能在NMJ的维持和修复中发挥作用,包括神经筋素(Nfasc) -参与突触形成、轴突引导和神经元-神经胶质细胞相互作用的细胞粘附蛋白[15,20.];Neuroplastin (NPTN-一种与神经突生长、神经元和突触可塑性相关的关键神经元细胞粘附分子[3.];及神经红蛋白(NGB)它被认为是一种压力传感器,促进神经元存活[2,88].
虽然我们通过将老年小鼠神经挤压后肌肉中的DEG与成年小鼠神经挤压后肌肉中的DEG进行直接比较,只鉴定出一个DEG (ZCCHC17),但成年小鼠神经挤压后肌肉中的DEG为7133 DEG,而老年小鼠神经挤压后肌肉中的DEG为699 DEG。因此,在神经压碎的老年人和神经压碎的成人肌肉的直接比较中,仅识别出单一的DEG是令人惊讶的,这可能反映了随着衰老发生的基线基因表达的显著增加的可变性。
老年神经受损小鼠与对照老年小鼠肌肉中IPA识别的前10个典型通路的比较(表2)5)与对照成年小鼠相比,神经受损的小鼠(表4)只揭示了一个共同的途径(sirtuin信号),因此,对成年小鼠神经挤压诱导的DEG与老年小鼠神经挤压诱导的DEG的进一步详细分析可能表明,在神经挤压反应中,老年小鼠肌肉中DEG反应减弱的潜在基因因素,因此可能是肌肉导致神经再生能力减弱的原因。
本研究的结果应考虑到一些局限性。小鼠的可用性只允许在雄性小鼠中检查这些影响。尽管几乎没有证据表明性别对老年失神经率或急性失神经后的差异影响有任何影响,但在雌性小鼠身上进行这些影响的检查是有必要的。由于缺乏组织可用性,排除了分析肌纤维类型组成变化对我们研究结果的影响,尽管AT主要是II型,因此我们预计纤维类型在我们的研究结果中作用不大。这项研究的重点是在相对较早的时间点对神经挤压的反应,所以我们不能排除在以后的时间点的任何额外影响。对整个肌肉组织的分析数据应始终谨慎检查,因为肌肉组织包含一系列影响局部环境的细胞类型。RNASeq数据分析的一个额外复杂性是,在某些情况下,这不能反映组织的蛋白质含量。然而,尽管在解释时需要谨慎,这些数据对于识别关键通路的差异控制和提供有效的结果是重要的。
总之,这项对成年和老年小鼠AT肌肉中差异表达基因的研究,以及成年和老年小鼠腓神经挤压伤的AT肌肉中差异表达基因的研究,揭示了骨骼肌年龄相关衰退背后的转录变化,以及成年和老年小鼠肌肉对神经挤压反应的差异。数据已经确定了肌肉中出现的344个DEG,并表明所有这些DEG都可以通过神经挤压在成年小鼠的肌肉中诱导,这表明老年小鼠肌肉变化中神经变性/重塑的主要组成部分。虽然只有一个度被发现通过直接比较老老鼠神经粉碎后的肌肉和肌肉的成年小鼠神经粉碎后,有7133度诱导成年老鼠的神经挤压肌肉与神经挤压肌肉引起的699度的老老鼠和进一步分析这些基因可能表明骨骼肌的关键差异度响应从老老鼠肌肉减少能力的基础,从老老鼠神经损伤后修复。
数据和材料的可用性
完整数据可在EBI阵列快速数据库中获得,登录号为E-MTAB-10601。
参考文献
杜德华,卡迪尔L,史黛西M,巴雷-乔利R.膜电位的新兴作用:超越动作电位的作用。9.《前沿物理》,2018;
贝兹E,埃切维里亚V,卡贝萨斯R, Ávila-Rodriguez M,加西亚-塞古拉LM,巴雷托GE。神经红蛋白表达在脑病理中的保护作用。7. Front Neurol. 2016;
Beesley PW, Herrera-Molina R, Smalla K-H, Seidenbecher C.神经塑质蛋白粘附分子:神经元可塑性和突触功能的关键调节因子。中华神经化学杂志,2014;
白介素-2家族细胞因子:T淋巴细胞的生存和增殖信号通路。免疫研究,2004;33:109-42。
Bhaskaran, S., Pollock, N., C Macpherson, P., Ahn, B., Piekarz, K.M., Staunton, C.A., Brown, J.L., Qaisar, R., Vasilaki, A., Richardson, A.等人(2020)。CuZnSOD的神经元特异性缺失导致老年小鼠的肌少症表型。老化细胞19,e13225-e13225。
Börsch A, Ham DJ, Mittal N, Tintignac LA, Migliavacca E, Feige JN,等。啮齿动物模型的分子和表型分析揭示了人类肌肉减少症的保守和物种特异性调节剂。通讯生物学。2021;4:194。
郭佳杰,郭志强,陈志强,等。衰老过程中Wnt信号的增加改变了肌肉干细胞的命运,增加了纤维化。科学。2007;317:807。
布鲁克斯SV,福克纳JA。年轻、成年和老年小鼠骨骼肌的收缩特性。中华医学杂志,1988;44:7 1 - 8。
张志刚,张志刚,张志刚,等。基于网络的人类全身炎症分析。大自然。2005;437:1032-7。
坎贝尔MJ,麦科马斯AJ,佩蒂托F.衰老肌肉的生理变化。中华神经外科杂志。1973;36:174-82。
蔡丽娟,王志强,王志强,王志强,等。老年小鼠神经肌肉接头失神经与腰椎运动神经元的相关性研究。科学通报。2011;6:e28090。
查卡拉卡尔JV,琼斯KM,巴森MA,布拉克AS。老化的生态位破坏肌肉干细胞的静止。大自然。2012;490:355-60。
Chang NC, Chevalier FP, Rudnicki MA。肌肉萎缩症中的卫星细胞-极性丢失。分子医学。2016;22:479-96。
张伟林,李德昌,吕淑娟,黄玉梅,欧阳平。一种新型核仁蛋白pNO40的分子特征。生物化学生物物理研究,2003;307:569-77。
Charles P, Tait S, Faivre-Sarrailh C, Barbin G, Gunn-Moore F, denisenco - nehrbass N,等。神经筋蛋白是一种神经胶质受体,在轴胶质连接处为帕诺丁/ caspr -接触蛋白轴突复合体。目前生物学:CB。2002; 12:217-20。
陈娟,陈勇,蒲娟。帕金森病的富亮氨酸重复激酶2:从发病机制到潜在治疗靶点。《神经科学》2018;79:256-65。
Chen L, Chisholm AD。轴突再生机制:来自秀丽隐杆线虫的见解。细胞生物学杂志,2011;21:577-84。
郑敏,阮兆明,范图齐,高志杰。内源性干扰素γ是高效骨骼肌再生所必需的。中国生物医学工程学报。2008;29(2):344 - 344。
克莱蒙斯,t.a.,杰尔克斯,N.T.O,莫尼克·万斯,L.和威廉姆斯,K.S.(2020)。第三章-神经炎症过程和氧化应激。《神经疾病中的氧化应激和膳食抗氧化剂》,C.R. Martin和V.R. Preedy编著。(学术出版社),第33-47页。
柯林森JM,马歇尔D,吉莱斯皮CS,布罗菲PJ。髓鞘形成开始时少突胶质细胞瞬时表达神经筋蛋白:轴突-神经胶质相互作用机制的意义。神经胶质。1998;23:11-23。
Corona JC, Duchen MR. PPARγ和PGC-1α是帕金森病的治疗靶点。神经化学,2015;40:308-16。
Day K, Shefer G, Shearer A, Yablonka-Reuveni Z.骨骼肌卫星细胞随着年龄的增长而耗竭,同时单个祖细胞产生储备子代的能力降低。开发生物学,2010;340:330-43。
Deepa SS, Van Remmen H, Brooks SV, Faulkner JA, Larkin L, McArdle A,等。铜锌超氧化物歧化酶敲除小鼠肌肉减少症加速。自由基生物医学2019;132:19-23。
衰老骨骼肌的神经控制。《衰老细胞》2003;2:21-9。
狄蒙提斯F, Piccirillo R, Goldberg AL, Perrimon N.骨骼肌衰老机制:从果蝇和哺乳动物模型的见解。机械工程学报。2013;6:1339-52。
杜蒙娜,王玉玉,冯·马尔扎恩J,帕苏特A,本辛格CF, Brun CE,等。肌营养不良蛋白的表达调节肌肉干细胞的极性和不对称分裂。医学杂志2015;21:1455-63。
Ebert SM, Bullard SA, Basisty N, Marcotte GR, Skopec ZP, Dierdorff JM,等。激活转录因子4 (ATF4)通过与转录调节因子C/EBPβ形成异源二聚体促进骨骼肌萎缩。中国生物化学杂志,2020;
英语啊。细胞因子,生长因子以及神经肌肉连接处的发芽。中华神经科学杂志,2003;32(4):344 - 344。
Fagiolo U, Cossarizza A, Scala E, Fanales-Belasio E, Ortolani C, Cozzi E,等。健康老年人单个核细胞细胞因子产生增加。中华免疫杂志1993;23:2375-8。
福克纳(j.a.),布鲁克斯(S.V),泽巴(1995)。随着年龄增长而出现的肌肉萎缩和无力:收缩性损伤是潜在的机制。J Gerontol a biosci med Sci 50 spec no, 124-129。
Fernando R, Drescher C, Nowotny K, Grune T, Castro JP。骨骼肌老化过程中蛋白质平衡受损。自由基生物医学2019;132:58-66。
Funk N, Munz M, Ott T, Brockmann K, Wenninger-Weinzierl A, Kühn R,等。帕金森病相关的富亮氨酸重复激酶2 (LRRK2)是胰岛素刺激的GLUT4易位所必需的。科学通报2019;9:4515。
甘地·PN,陈光生,Wilson-Delfosse AL.富含亮氨酸重复激酶2 (LRRK2)在帕金森病发病机制中的关键作用。中华神经科学杂志,2009;
张晓东,张晓东,张晓东,等。进化保守的DNA损伤反应基因的鉴定,改变对顺铂的敏感性。Oncotarget。2017;8:19156 - 71。
Garcia-Reitbock P, Anichtchik O, Bellucci A, Iovino M, Ballini C, Fineberg E,等。在帕金森病转基因小鼠模型中的SNARE蛋白再分配和突触失效。大脑。2010;133:2032-44。
mr . RC, Carey VJ, Bates DM, Bolstad B, Dettling M, Dudoit S,等。生物导体:用于计算生物学和生物信息学的开放软件开发。中国生物工程学报。2004;5:R80。
Goldspink G, Fernandes K, Williams PE, Wells DJ。mdx营养不良和正常小鼠肌肉中胶原蛋白基因表达的年龄相关变化。神经肌肉疾病:NMD。1994; 4:183 - 91。
来自小鼠EDL和比目鱼骨骼肌的单个完整的快纤维和慢纤维的年龄依赖性疲劳。机械老化发展,2001;122:1019-32。
Gupte, a.a., Bomhoff, g.l., and Geiger, P.C.(2008)。骨骼肌胰岛素信号的年龄相关差异:应激激酶和热休克蛋白的作用。应用生理学杂志(贝塞斯达,md: 1985) 105,839 -848。
Ham, d.j., Börsch, A., Chojnowska, K., Lin, S., Leuchtmann, a.b., Ham, a.s., Thürkauf, M., Delezie, J., Furrer, R., Burri, D., et al.(2021)。热量限制和雷帕霉素对衰老骨骼肌的显著和加性影响bioRxiv, 20121.2005.2028.446097。
Ham DJ, Börsch A, Lin S, Thürkauf M, Weihrauch M, Reinhard JR,等。神经肌肉连接处是肌肉减少症中mTORC1信号传递的焦点。Nat Commun. 2020;11:4510。
杨晓东,李志强,陈志强。线虫轴突再生研究进展。神经生物学杂志,2014;27:199-207。
检验统计等价假设。斯蒂芬·韦勒克,查普曼和霍尔/CRC,博卡拉顿,2003年。不。页数:xvi + 284页。ISBN 1-58488-160-7。统计医学2003;22:3111-2。
何普文,何景文,刘海峰,苏德华,谢志华,陈克辉,等。线粒体神经元解偶联蛋白:帕金森病潜在疾病修饰的靶点。Transl Neurodegener, 2012; 1:3-3。
侯超,王勇,刘娟,王超,龙杰。神经退行性疾病相关蛋白在病理证实中对snare -介导的膜融合有负面影响。神经科学进展。2017;10:66-6。
Howard EE, Pasiakos SM, Blesso CN, Fussell MA, Rodriguez NR.炎症在骨骼肌损伤恢复中的不同作用。11.《前沿物理》,2020;
Hughes DC, Marcotte GR, Marshall AG, West DWD, Baehr LM, Wallace MA,等。肌萎缩蛋白与年龄相关的差异:对力传递蛋白、膜完整性和神经肌肉连接稳定性的影响。中国老年医学杂志,2017;72:640-8。
Jackson MJ, McArdle A.骨骼肌活性氧生成的年龄相关变化和对活性氧的适应性反应。中国生物医学工程学报,2011;
张玉c, Lustgarten MS,刘勇,Muller FL, Bhattacharya A,梁红,等。体内超氧化物的增加通过线粒体功能障碍和神经肌肉连接处变性加速年龄相关的肌肉萎缩。王志强,2010;24:1376-90。
杨永强,李志强,李志强,等。STRING 8- 630个生物中蛋白质及其功能相互作用的全球观点。核酸研究,2009;37:D412-6。
Katsouri L, Blondrath K, Sastre M.过氧化物酶体增殖物激活受体γ辅助因子在神经退行性变中的作用。IUBMB Life. 2012; 64:958-64。
川池明,周佳杰,王珊珊,中村凯,刘文涛,平田凯。老年大鼠肌肉神经再生过程中雪旺细胞、轴突和突触后乙酰胆碱受体区域的时空关系。Anat Rec. 2001; 264:183-202。
Kim-Han JS, Dugan LL。中枢神经系统中的线粒体解偶联蛋白。抗氧化氧化还原信号。2005;7:1173-81。
J øbsted R, Hingst JR, Fentz J, Foretz M, Sanz M- n, Pehmøller C,等。AMPK在骨骼肌功能和代谢中的作用。王志强,2018;32:1741-77。
努普斯,L.和雷诺,J.C.(2004)。IL-9及其受体:从信号转导到肿瘤发生。生长因子(Chur,瑞士)22,207 -215。
Kwon YN, Yoon SS.肌肉减少症:神经学的观点。中华骨科杂志。2017;24:83-9。
等价检验:t检验、相关性和元分析的实用入门。心理学报。2017;8:355-62。
Lala-Tabbert N, AlSudais H, Marchildon F, Fu D, Wiper-Bergeron N.卫星细胞自我更新需要CCAAT/增强子结合蛋白β。骨骼肌。2016;6:40-0。
朗米德B,萨尔茨堡SL.快速间隙阅读对齐领结2。Nat Methods. 2012; 9:357-9。
陈志伟,陈志伟。衰老对运动单元的影响。神经生物学进展。1995;45:397-458。
Lê, S., Josse, J., and Husson, F.(2008)。FactoMineR:多元分析的R包。统计软件杂志;第1卷第1期(2008年)
李志强,李志强,李志强,等。人体骨骼肌中不同纤维类型的分布。三组15 - 83岁健康男性股外侧肌纤维类型排列。中华神经科学杂志(英文版)1986;
莱克塞尔J,泰勒CC, Sjostrom M.老化性萎缩的原因是什么?研究了15- 83岁男性股外侧肌中不同类型纤维的总数、大小和比例。中华神经科学杂志,1988;24(3):344 - 344。
李晓霞,龙俊,何涛,李晓霞,史建军。晚期阿尔茨海默病的发病机制及上游调控因子。科学通报2015;5:12393。
李勇,汤文杰。突触后肌纤维再生后,神经末梢生长重塑小鼠神经肌肉突触。中华神经科学杂志,2011;
林格尔,J.,莫斯利,A.,多斯坦尼奇,I.,库农,M.,何,S.,詹姆斯,P.,吴,A.,奥康纳,K.和诺伊曼,J.(2003)。Na, k - atp酶α亚型的功能作用。中国生物医学工程学报986,354-359。
Love, m.i., Anders, S., Kim, V.和Huber, W.(2015)。RNA-Seq工作流程:基因级探索性分析和差异表达。F1000Res 4,1070。
Luppa M, Luck T, Weyerer S, König HH, Brähler E, rieel - heller SG。老年人的机构化预测。系统回顾。老龄化。2010;39:31-8。
马志强,李志强,李志强,李志强。CCAAT/增强子结合蛋白β对损伤后肌肉卫星细胞凋亡的保护作用。细胞死亡,2016;7:e2109-9。
Martin M. Cutadapt从高通量测序读取中移除适配器序列。EMBnetjournal。2011; 17:10-2。
马修斯GD,黄晓玲,孙玲,Zaidi M.转化肌肉骨骼科学:骨骼肌减少症是骨质疏松症后的下一个临床目标吗?中国科学(d辑),2011;
McCormick R, Vasilaki a .骨骼肌的年龄相关变化:改变生活方式作为一种治疗。Biogerontology。2018;19:519-36。
McGill JK, Beal MF。PGC-1alpha,亨廷顿舞蹈病的新治疗靶点?细胞。2006;127:465-8。
Mi H, Muruganujan A, Thomas PD。2013年PANTHER:在系统进化树的背景下,对基因功能和其他基因属性的进化进行建模。核酸研究,2012;41:D377-86。
Mounier R, Théret M, Arnold L, Cuvellier S, Bultot L, Göransson O,等。AMPKα1在骨骼肌再生过程中炎症消退时调节巨噬细胞倾斜。Cell Metab, 2013; 18:51 - 64。
刘勇,宋伟,张玉春,刘勇,等。去神经诱导的骨骼肌萎缩与线粒体ROS生成增加有关。中国生物医学工程学报。2007;29(2):379 - 379。
Murgia M, Toniolo L, Nagaraj N, Ciciliot S, Vindigni V, Schiaffino S,等。单肌纤维蛋白质组学揭示了人类肌肉衰老的纤维类型特异性特征。Cell rep 2017; 19:2396-409。
Murton AJ, Billeter R, Stephens FB, Des Etages SG, Graber F, Hill RJ,等。同心圆阻力运动训练开始时人体骨骼肌中的瞬时转录事件。中国生物医学工程学报(英文版)。2014;
Olivé M, Janué A, Moreno D, Gámez J, Torrejón-Escribano B, Ferrer I. TAR dna结合蛋白43在蛋白聚合肌病中的积累。中华神经外科杂志,2009;29(2):366 - 366。
Palomero J, Vasilaki A, Pye D, McArdle A, Jackson MJ。衰老会增加静止时单个骨骼肌纤维中二氯氢荧光素的氧化,但在收缩时不会。中国生物医学杂志,2013;30(2):353 - 353。
Pannérec A,施普林格M, Migliavacca E, Ireland A, Piasecki M, Karaz S,等。强健的神经肌肉系统保护大鼠和人类骨骼肌免受肌肉减少症的侵害。衰老。2016;8:712-29。
Payne AM, Jimenez-Moreno R, Wang ZM, Messi ML, Delbono O. Ca2+、膜兴奋性和Ca2+存储在肌肉收缩衰竭中的作用。《中华人民共和国学报》,2009;29(4):366 - 366。
Peri S, Navarro JD, Kristiansen TZ, Amanchy R, Surendranath V, Muthusamy B,等。作为蛋白质组学发现资源的人类蛋白质参考数据库。核酸研究,2004;32:D497-501。
Piasecki M, Ireland A, Jones DA, McPhee JS。人类肢体肌肉中年龄依赖的运动单元重构。Biogerontology。2016;17:485 - 96。
李文杰,李文杰,李文杰。人体肌肉老化:结构、功能和适应性。中华医学杂志,1995;5:129-42。
Powers SK, Ji LL, Kavazis AN, Jackson MJ。活性氧:影响骨骼肌。《Compr Physiol》2011;1:941-69。
王志刚,王志刚,王志刚。肌萎缩性侧索硬化症患者TDP-43错误折叠的分子机制研究。12.《神经科学》2019;
Reuss S, saler - reinhardt S, Weich B, Wystub S, Reuss MH, Burmester T,等。鼠类组织中神经红蛋白mRNA的表达分析。神经科学。2002;115:645-56。
罗杰,李志强,李志强,李志强,等。抗肌萎缩蛋白缺乏(mdx)小鼠横膈膜和后肢肌肉的整体/短暂基因表达。中国生物医学工程学报。2002;29(2):344 - 344。
Sakellariou GK, Davis CS, Shi Y, Ivannikov MV, Zhang Y, Vasilaki A,等。CuZnSOD的神经元特异性表达可以防止纯合子CuZnSOD敲除小鼠肌肉质量和功能的损失。法西布j . 2014; 28:1666-81。
张志刚,张志刚,张志刚,张志刚,等。在缺乏Cu,Zn超氧化物歧化酶的小鼠中,超氧化物-一氧化氮相互作用在加速年龄相关肌肉质量损失中的作用。衰老细胞。2011;10:749-60。
张勇,张志刚,张志刚,张志刚,等。神经元特异性CuZnSOD的减少不足以引发完全的肌肉减少症表型。氧化还原生物学。2015;5:140-8。
Sayer AA, Syddall HE, Martin HJ, Dennison EM, Roberts HC, Cooper C.握力与健康相关的生活质量有关吗?来自赫特福德郡队列研究的发现。年龄老化。2006;35:409-15。
Serviss, j.t., Gådin, j.r., Eriksson, P., Folkersen, L., Grandér, D.(2017)。簇意义:一个生物导体包,便于在降维数据中对类簇分离进行统计分析。生物信息学(牛津,英国)33,3126-3128。
Shefer G, Van de Mark DP, Richardson JB, Yablonka-Reuveni Z.卫星细胞池大小确实很重要:定义衰老骨骼肌的生肌能力。Dev Biol, 2006; 294:50-66。
阿尔茨海默病和帕金森病中神经递质释放受损。神经变性药物,2010;7:80-3。
沈志强,陈志明。PNS轴突再生过程中生长锥内通道和受体的作用。神经科学。2010;23(3):344 - 344。
儿子Y-J,汤普森WJ。肌肉中的神经发芽是由雪旺氏细胞扩展的过程诱导和引导的。神经元。1995;14:133-41。
Staunton CA, Owen ED, Pollock N, Vasilaki A, Barrett-Jolley R, McArdle A,等。HyPer2成像显示体内失神经和衰老骨骼肌纤维的暂时性和异质性过氧化氢变化。科学通报2019;9:14461。
Tam SL, Gordon T.控制神经肌肉连接处轴突发芽的机制。中华神经科学杂志,2003;32:961-74。
田木T,平田M,素田S,中岛N,齐藤K,中中K,等。小鼠骨骼肌来源多能干细胞优先全面重建严重损伤坐骨神经。公共科学图书馆,2014;9:e91257。
Tang, H., Inoki, K., Lee, M., Wright, E., Khuong, A., Khuong, A., Sugiarto, S., Garner, M., Paik, J., DePinho, R.A等(2014)。mTORC1通过激活FoxO和E3泛素连接酶的机制促进去神经诱导的肌肉萎缩。科学信号7,ra18。
Tomljanovic, Z., Patel, M., Shin, W., Califano, A.和Teich, A.F.(2018)。ZCCHC17是阿尔茨海默病突触基因表达的主要调节因子。生物信息学(牛津,英国)34,367 -371。
Tuttle LJ, Sinacore DR, Mueller MJ。肌间脂肪组织是肌肉特异性的,与功能性能差有关。衰老研究杂志。2012; 2012:172957。
李志强,李志强,李志强,等。通过热量限制和运动减弱小鼠神经肌肉突触的年龄相关变化。中国科学院学报(自然科学版)2010;
范豪特,张志强,张志强,张志强,等。血栓反应蛋白在肌纤维中的表达稳定肌肉膜。Elife。2016;5。
Vasilaki A, Iwanejko L, McArdle F, Broome CS, Jackson MJ, McArdle A.老年雄性小鼠骨骼肌在收缩活动后无法适应。生物化学学报,2003;31:455-6。
Vasilaki, A., Pollock, N., Giakoumaki, I., Goljanek-Whysall, K., Sakellariou, G.K, Pearson, T., Kayani, A., Jackson, M.J, and McArdle, A.(2016)。延长收缩对成年和老年小鼠神经肌肉连接结构的影响。年龄(荷兰多德雷赫特)38,259 -272。
瓦西拉基,范德梅伦JH,拉金L,哈里森DC,皮尔逊T, van Remmen H,等。通过缺失Cu,Zn超氧化物歧化酶,在年轻小鼠中模拟骨骼肌收缩活动的适应性反应的年龄相关失败。衰老细胞,2010;9:979-90。
Weindel CG, Bell SL, Vail KJ, West KO, Patrick KL, Watson RO。LRRK2维持线粒体稳态并调节对结核分枝杆菌的先天免疫反应。Elife。2020;9。
Weindruch, R., Kayo, T., Lee, c.k.和Prolla, T.A.(2001)。小鼠衰老过程中基因表达的微阵列分析及其由热量限制引起的改变。营养学杂志131,918 -923。
年轻的A,斯凯尔顿检察官。老年力量与力量的应用生理学。国际体育医学杂志1994;15:49 - 51。
于刚,王乐林,韩勇,何启勇。clusterProfiler:一个R包,用于比较基因集群之间的生物学主题。组学。2012;16:284-7。
张勇,Davis C, Sakellariou GK, Shi Y, Kayani AC, Pulliam D,等。针对骨骼肌的CuZnSOD基因缺失导致成年小鼠收缩力丧失,但不会导致肌肉萎缩。王志强,2013;27:36 - 48。
确认
作者要感谢医学研究委员会(资助号MR/M012573/1),美国国家老龄化研究所(资助号AG051442)和生物技术和生物科学研究委员会(资助号BB/T002115/1)的慷慨资助。还要感谢利物浦大学生物医学服务部门在整个项目中提供的优秀动物护理。
作者信息
作者及隶属关系
贡献
所有作者都对研究的概念和设计、数据采集、分析和解释做出了实质性的智力贡献。所有作者都参与了数据解释和手稿准备工作,并批准了提交的最终版本。
相应的作者
道德声明
伦理批准并同意参与
所有实验程序都在英国内政部许可证下进行(内政部许可证编号P391895CA,批准日期为15/06/17),并符合1986年英国动物(科学程序)法案,并获得利物浦大学AWERB的伦理批准(伦理批准编号AWC0066,批准日期为23/3/17)。
发表同意书
不适用。
相互竞争的利益
作者宣称他们之间没有利益冲突。
额外的信息
出版商的注意
伟德体育在线施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
补充信息
附加文件1。
补充表S1
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条所提供的资料,除非在资料的信用额度中另有说明。
关于本文
引用本文
斯汤顿,C.A,欧文,E.D,海明斯,K。et al。骨骼肌转录组识别神经挤压损伤和衰老的共同途径。骨骼肌12, 3(2022)。https://doi.org/10.1186/s13395-021-00283-4
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s13395-021-00283-4
关键字
- 骨骼肌
- 运动神经元
- RNAseq
- 转录组
- 老化
- 粉碎
- 神经退化