摘要
背景
的Six1转录因子参与控制几种组织类型的发育,尤其是骨骼肌。Six1也有助于肌肉代谢,其活动与快速抽搐,糖酵解表型相关。Six1通过直接刺激其转录或通过长链非编码RNA间接作用调节快肌程序的某些基因的表达。我们假设了额外的作用机制Six1可能在起作用。
方法
结合基因表达谱分析和全基因组定位分析数据进行分析。结果通过体内RNA干扰功能丧失试验验证,随后通过RT-PCR和转录报告试验测量基因表达。
结果
的Slc16a10编码甲状腺激素跨膜转运蛋白MCT10的基因被鉴定为直接结合转录增强子的基因Six1并要求Six1在成年小鼠胫骨前肌中充分表达的活动,主要是快速收缩肌肉。在各种甲状腺激素转运蛋白中,MCT10 mRNA被发现在骨骼肌中最为丰富,并且在快肌组比慢肌组有更强的表达。胫前肌MCT10功能丧失总结了Six1对快收缩肌基因的表达和导致甲状腺激素受体依赖性报告基因活性降低。
结论
这些结果阐明了控制MCT10组织表达谱的分子机制,并确定了甲状腺激素信号通路的调节作为另一种机制Six1影响骨骼肌代谢。
背景
转录因子Six family (tf)是一组由六个同源结构域蛋白质组成的蛋白质,它们共享一个保守的、特征性的Six结构域[1,2].它们是通过互补实验发现的正眼果蝇果蝇复眼发育所必需的基因[3.].在整个动物界都发现了六种蛋白质家族的同源物[4,5,6]并且有强有力的证据表明,与六种tf相关的调节网络在脊椎动物分化之前就已经进化形成了[7].6个家族基因敲除模型强调,这些tf在包括骨骼肌在内的几种组织类型的发育中发挥着全球水平的关键作用[8],肾脏[9,10],神经元[11],心肌[12],眼睛[13]和生殖腺[14].
在骨骼肌中,Six1而且已被证明参与肌原蛋白的转录表达[15,16,17],是骨骼肌纤维末梢分化所必需的肌生调节因子[18,19].MRFs和六种tf之间的相互作用调节两个tf家族的下游靶点,表达肌肉干细胞增殖、融合和分化过程中的关键基因[17,20.,21,22,23].的作用Six1在发展肌肉是必不可少的,如Six1敲除小鼠出生时因横膈膜形成不当而死亡[24].在成人肌肉干细胞中,Six1和Six4对于损伤后的组织再生都是必不可少的[22,25].相比之下,六个tf在成人肌肉稳态中的作用可以说是不太清楚。在成人成熟的骨骼肌中,强行表达Six1和它的余子式Eya1足以将慢收缩氧化肌重新编程为快速收缩糖酵解表型[26].相反,myofiber-specificSix1条件敲除(Six1-cKO)小鼠表现出向慢肌收缩肌表型的切换,其典型表现为慢肌收缩肌球蛋白和肌钙蛋白异型的表达[27,28].
主要提出了机制Six1成人肌纤维类型的调节是通过对Linc-MYH(一种长链非编码RNA)的直接正向转录调控[28].林肯- myh击倒概括了大部分Six1敲除条件表型,尽管达到约80%的效应量级,并不能显著增加慢缩肌球蛋白亚型的表达。这部分概括了Six1敲除表型表明,调节纤维类型规格的其他途径可能同时处于下Six1监管控制。虽然许多调节网络涉及成人骨骼肌纤维类型的维持,包括钙调神经磷酸酶/NFAT信号[29], AMPK轴[30.], pgc-1α [31], Sox6 [32],以及甲状腺激素(TH)信号[33],在维持成人肌肉表型的不同信号和转录途径之间的确切层次和相互作用尚不清楚。
在这里,我们报告的研究结果的含义Six1对TH通路的调节与六大tf相似,TH在哺乳动物健康中起着至关重要的作用,参与大脑、肌肉、肝脏和胰腺等各种组织的发育、分化、生长和代谢稳态[34].TH主要有两种形式,T4和T3.并可通过基因组或非基因组调控影响细胞代谢[35].而T4已被证明在非基因组相互作用中有更大的作用[36), T3.是TH的主要基因组活性形式,作为配体激活甲状腺受体tf(编码Thra或Thrb基因)结合靶基因调控区TH反应元件(TREs)并调节其转录水平[37].
在骨骼肌中,TH活性调节肌生成和肌肉再生过程[38,39],收缩结构[40]、能量消耗[41]、线粒体产热、脂肪酸氧化[42],葡萄糖摄取[40]、胰岛素反应性[43],以及自噬[44].在肌纤维类型规范的背景下,甲状腺功能亢进促进快肌纤维表型,而甲状腺功能减退则与向慢肌纤维表型的转换有关[45,46].从机制上看,TH受体已被证明直接控制与快抽搐表型相关的某些基因的表达[47]以及通过上调miR-133a1间接拮抗慢抽搐程序,进而下调驱动慢抽搐程序的TF Tead1 [33,48].T3.已被证明可以调节多种mrf的表达,这得到了功能性TREs驱动Myod1[49),Myog[50].甲状腺功能亢进症已被证明能促使卫星细胞表达更多的Myod1[51],相反,甲状腺功能减退阻碍肌源性分化[52].
由于TH不能被动地穿过脂质双分子层扩散,组织特异性激素转运体对于T4和T3的细胞外排和摄取都是必需的[53].有几种蛋白质具有跨膜运输TH的能力。它们在底物特异性、组织表达谱以及主要作用于激素内流还是外流方面存在差异[54].MCT8, MCT10, OATP1C1, LAT1和LAT2(由基因编码Slc16a2,Slc16a10,Slco1c1,Slc7a5,Slc7a8,分别与TH细胞内流最相关[53].MCT8基因敲除小鼠骨骼肌基因表达从慢抽搐向快抽搐的调控转变[55,56].有趣的是,MCT8仅在骨骼肌中低水平表达,MCT8在该组织中功能丧失的影响可以通过这些动物体内循环T3水平的增加来解释,从而驱动激素流入和下游基因激活[55].mct8缺陷小鼠在肌肉损伤后也表现出肌肉再生受损[57].MCT8在肌肉卫星细胞中被检测到,而肌肉卫星细胞是负责这一过程的成体干细胞,该细胞类型中MCT8的特异性缺失会损害其分化,这表明构成性MCT8敲除小鼠的再生缺陷并不完全是由于它们上述的血清TH失衡[57].MCT10是一种与MCT8结构相关的蛋白质,与MCT8相比,MCT10在骨骼肌中表达水平更高[54].然而,人们对MCT10在骨骼肌中所起的作用知之甚少。最近有研究表明,在腓肠肌中,MCT10的mRNA水平在小鼠衰老过程中呈线性增加,而MCT8的mRNA水平则没有,这表明MCT10具有潜在的稳态调节作用[58].在啮齿动物中,OATP1C1的表达主要局限于大脑,但在体外培养激活的肌肉卫星细胞中也检测到其表达[57].最后,LAT1和LAT2也可参与TH的摄取[59,60].而LAT2在骨骼肌中表达最高[53]时,肌肉卫星细胞中LAT1的mRNA比LAT2的mRNA更丰富[57].肌肉特异性敲除LAT1减弱了亮氨酸暴露在该组织中mTOR-S6K通路的激活[61].
关于各种TH转运蛋白的组织特异性表达谱的机制缺乏研究[54,62].此外,据我们所知,没有研究直接调查了Six TF和TH功能之间的联系。两种途径在MRF表达调控中的重叠调控作用[15,50]及骨骼肌类型规格[28,33,63,64],表明了两个监管网络之间的相互作用值得研究。通过这项研究,我们证明了甲状腺转运蛋白MCT10在成人骨骼肌中受Six1的直接转录控制。
结果
Six1功能与快收缩肌程序有很强的相关性
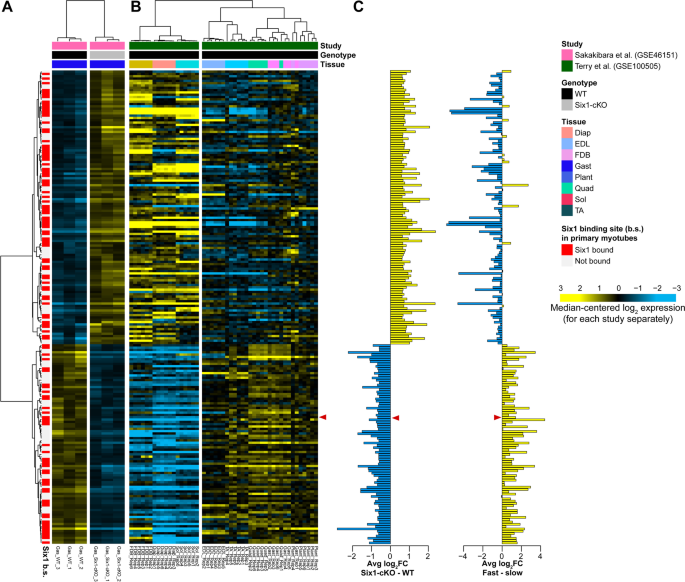
我们最初感兴趣的是识别Six1直接控制的基因,这些基因可能与快抽搐表型有关。为此,我们分析了两个基因表达谱数据集。首先,Sakakibara等人的数据集提供了野生型和肌肉特异性Six1敲除成年小鼠(Six1- cko)腓肠肌中的微阵列基因表达概况[28].其次,Terry等人的muscleDB数据集提供了几种不同小鼠肌肉群的RNA测序(RNA-seq)表达谱[65].我们从识别Six1- cko腓肠肌中差异表达的基因开始,发现204个基因需要Six1才能正常表达(图2)。1一个;Six1-cKO低表达86个基因,高表达118个基因)。为了研究Six1-cKO腓肠肌中失调控基因与快或慢抽搐特异性表达程序相关的比例,我们考虑了它们在muscleDB数据集中的表达。我们将分析局限于一个肌肉群的子集,主要是快速抽搐(指长伸肌(EDL)、股四头肌、胫骨前肌(TA)、腓肠肌、跖肌,分类在肌群中的第1簇)或缓慢抽搐(比目鱼、指短屈肌(FDB)、横膈膜,分类在肌群中的第2簇)。我们观察到Six1缺失时基因下调与快速收缩肌中正常高表达的基因之间存在显著关联,反之亦然,Six1- cko上调与慢收缩肌中较高的基因表达之间存在显著关联(图2)。1B). Pearson相关系数为−0.72与双尾T测验p计算这些基因的对数折叠变化(Six1-cKO - WT和fast - slow)之间小于0.05的值(图5)。1C)。
骨骼肌群分布及Six1基因表达依赖性。分析了Sakakibara等人的DNA微阵列基因表达谱,以确定野生型小鼠和Six1-cKO小鼠腓肠肌中的差异表达基因。所使用的截断是abs (log2FC) > 0.58和Benjamini-Hochberg调整p值< 0.05。根据基因的转录起始位点是否在原代肌管中six1结合位点(红色条)的50 kb范围内进行注释。对行(基因)和列(样本)采用Pearson相关层次聚类。为了进一步注释这些依赖six1的基因,还绘制了它们在来自muscleDB数据库的几个肌肉组织组中的RNA-seq表达(Terry等人)。行保留了Sakakibara研究的聚类解顺序,列通过Pearson相关独立聚类(聚类与Sakakibara数据分开执行)。日志2垂直直方图中分别用蓝色和黄色柱表示阴性值和阳性值,表示每个基因在两次实验中的倍数变化。的位置Slc16a10基因出现在这些图表中。图中基因符号也列在补充表S中7
为了增加这种分析所识别的基因是Six1的直接转录靶点的可能性,这些基因被注释为接近Six1结合位点。通过染色质免疫沉淀和高通量测序(ChIP-seq)鉴定了6个结合的基因组位点。分离出原代成肌细胞并保持在生长期(MB)或诱导分化48小时,在此期间产生大且完全分化的原代肌管(MT)。在MB和MT样本中使用抗six1抗体或对照IgG进行ChIP-seq。我们在MB中鉴定出11664个高置信峰,在MT中鉴定出7624个高置信峰;MB和MT中均有3985个区域被Six1结合(图。2A和表格S1和S2).约20%的结合位点靠近基因的转录起始位点(距离起始位点5 kb内);然而,大多数结合位点距离起始位点更远,这表明Six1的相当一部分靶位点代表远端转录增强子(图2)。2B和C)。总体而言,该结果与C2C12成肌细胞的ChIP-on-chip实验结果具有高度可比性[17];提供了ChIP-seq读密度覆盖的例子(图S1A).从头DNA序列motif分析发现MEF3序列元素是six1结合位点中最富集的(motif M1,图。2D),我们早期对C2C12细胞的研究也发现了这一结果[66].在7679个仅结合MB的区域中,4311个至少出现了一个MEF3基序(56%)。在仅与肌管结合的序列中,比例相似,为58%。更大比例(72%)的MB和MT中由Six1结合的区域至少有一个MEF3位点。tf识别的已知与肌肉发生有关的其他motif是最丰富的,包括AP-1 (M3 [67,68,69,70]), MRFs (E-box元素,M2 [71,72]), Runx1 (M5 [73,74,75])和Mef2因子(M6 [76,77,78])。在MB和MT中均发现的six1结合位点中,MEF3和E-box元件富集程度最高,而AP-1基序在MB或MB和MT中six1结合位点中富集程度最高。73同样,anti-MyoD ChIP-seq的信号在Six1结合的位点中也最高,在MB和MT中或仅在MT中(图S .1B). Six1和MyoD在染色质上的相似性强调了这两个因素在调节基因表达方面的合作[17].条件特异性的six1结合位点通过MB和MT中H3K4单甲基化(H3K4me1)的剖面反映出来(图S .)1B):仅以MB为结合单位的位点具有以MB为单位的最高H3K4me1 ChIP-seq信号,而以MT为结合单位的位点在相应样本类型中仅具有较高的H3K4me1信号。组蛋白H3赖氨酸27乙酰化(H3K27ac)也有类似的情况,MB中Six1结合与MB中H3K27ac信号最高相关,MT中Six1结合位点最高。培养MT中Six1结合位点与成熟骨骼肌组织相关,腓肠肌和比目鱼肌中表现出明显的H3K4me2和H3K27ac信号,染色质开放。在six1结合位点上H3K4me1和H3K4me2信号的存在加强了该TF结合功能远端增强子的概念。最后,利用基因本体(gene ontology, GO)术语富集分析来检测six1结合基因所参与的生物学过程(图。2E).正如预期的那样,与肌肉发育和功能相关的术语显示出显著的丰富。与几种信号通路相关的GO术语显著地表示在Six1-结合基因,包括Wnt, BMP, Hippo通路和MAPK级联。有趣的是,正如我们早期在C2C12细胞中进行的研究所指出的,GO术语与已知受影响的其他组织的发育相关Six1敲除小鼠的耳朵、肾脏和胸腺也显著富集[8,9,79].
原代成肌细胞和肌管中six1结合位点的发现和分析。一个显示MB和MT中six1结合峰重叠的维恩图。B在MB或MT中,重叠各种基因特征的six1结合位点的比例。在本分析中,启动子被定义为位于基因转录起始位点中心的2kb区域,下游区域被定义为紧随转录结束位点的300个碱基对。C6 - 1结合位点在基因转录起始位点周围的分布,在MB和MT中。D使用MEME进行从头母题发现的结果。去除冗余图案和MEME得分较低的图案。对于每个新主题,显示了来自JASPAR数据库的最相似的主题。在指定的结合位点序列中,计算每个基序的富集程度。%TP和%FP分别表示真阳性和假阳性百分比。的Bonferroni-adjustedpValue在“adj_p-value”下给出。E由Six1结合的基因之间GO项富集的生物学过程(所有在距离一个位点50 kb内的基因以MB或MT结合)。所选术语显示。N,具有给定注释的six1结合基因的数量;FDR,错误发现率。分配给Six1峰的基因总数显示在各自列的顶部
我们在基因表达谱数据中标注了基因是否有邻近位点的信息Six1-结合位点(图;1A、红条中的行注释)。在Six1-cKO肌肉中,近一半的差异表达基因(204个中的100个)具有一个不同的表达Six1-结合位点在MT的附近。有趣的是,Six1-cKO上调的基因很可能与Six1在MT中(118个基因中有57个存在six1结合位点),而Six1-cKO基因下调(86个基因中有43个)。这一分析揭示了基因可能被直接激活Six1在腓肠肌中与快抽搐表型密切相关。
Six1直接调控MCT10转运体在骨骼肌中的表达
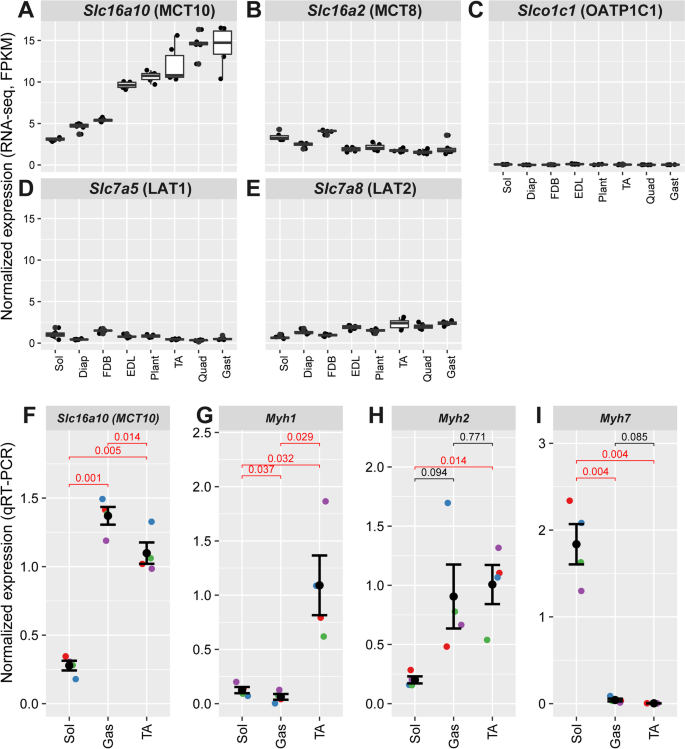
我们的注意力集中在识别快速抽动程序的可能直接控制的调节器上Six1.我们的注意力被吸引到Slc16a10基因(图中红色箭头所示)。1B和C),这成为了本研究的重点。Slc16a10编码TH的MCT10跨膜转运蛋白,TH与快速收缩骨骼肌形成有关[34].我们的分析发现MCT10在Six1-cKO腓肠肌中表达下调(图2)。1).在编码TH内流转运蛋白的5个主要基因中,MCT10在骨骼肌中的表达水平明显高于其他4个被测基因[54].此外,对muscleDB RNA-seq数据的分析表明,MCT10在快收缩肌组中的表达明显高于慢收缩肌组(图2)。1而且3.A)。其他TH转运蛋白(MCT8, Slco1c1, Slc7a5和Slc7a8)的表达水平明显较低,并没有显示出与纤维类型组成一致的表达谱(图。3.抵扣)。MCT10纤维型特异性表达谱通过定量反转录PCR (qRT-PCR)对从小鼠腓肠肌、比目鱼和TA中分离的RNA进行验证(图。3.F,以及图中Myh1, Myh2, Myh7的剖面比较。3.G-I分别为快型IIX、快型IIA和慢型I的标记)。这些结果,连同先前关于TH在肌肉代谢中的作用的知识,表明MCT10可能是Six1在建立快抽搐表型中的作用的中介。
甲状腺激素转运蛋白编码基因在小鼠骨骼肌群中的表达。来自muscleDB的RNA-seq表达数据以每千碱基转录本每百万映射reads (FPKM)的片段数进行定量和归一化。五个转运蛋白的表达如下:一个Slc16a10 (MCT10),BSlc16a2 (MCT8),CSlco1c1 (Oatp1c1),DSlc7a5 (Lat1),和ESlc7a8 (Lat2)。6个重复中的每一个都用一个点表示,FPKM值的统计分布用箱线图表示。F的qRT-PCR验证Slc16a10比目鱼肌(Sol)、腓肠肌(Gas)和胫骨前肌(TA)中的表达。在对照基因的几何平均值上进行归一化表达Actnb和18S rRNA。比目鱼和胫前肌的表达低于腓肠肌,成对,双尾t测试(p数值< 0.05以红色表示)。胃肠道的表达式配置文件Myh1,Myh2,Myh7是为了进行比较
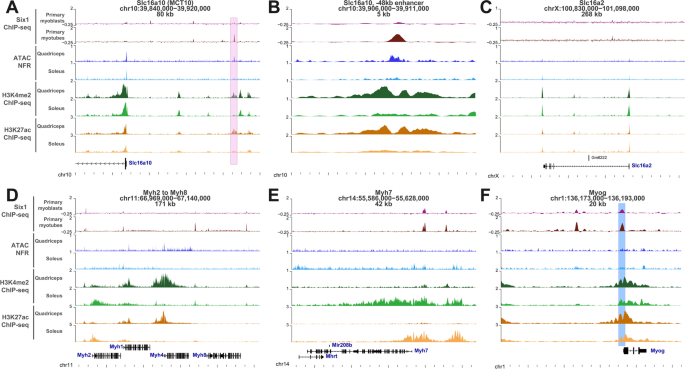
通过检查我们的ChIP-seq数据,我们注意到一个Six1-结合位点位于MCT10基因转录起始位点上游48个碱基处(图2)。4a - b)。以获得更多的证据证明这一点Six1我们分析了在快抽搐股四头肌和慢抽搐比比鱼中获得的组蛋白标记ChIP-seq和DNA可及性(转座酶可及染色质测定(ATAC-seq))数据[80].的Six1-结合位点位于一个可能的基因增强子内,其特征是高DNA可及性,存在H3K3me2和H3K27ac,这三个标记在股四头肌样本中都比比目鱼样本更丰富(图。4a - b)。Slc16a2/MCT8位点未显示任何six1结合位点。4相比之下,Myh1(快速,IIX型)和Myh4(快速,IIB型)在股四头肌中显示出更高丰度的组蛋白标记,而Myh2(快速,IIA型)和Myh7(慢I型)在比比鱼中表现出更高丰度(图2)。4Six1在Myog位点的结合也被检测到,与比目鱼相比,这两种组蛋白标记在股四头肌的该位点更丰富。4F)。
在编码两种主要甲状腺激素转运体的基因上有six1结合谱和表观遗传标记。在每个位点上,给出了基因名称、基因组位置(mm9坐标)和显示的间隔长度。Six1 ChIP-seq信号表示来自原代增殖肌母细胞或分化肌管的数据,在基因组的滑动窗口中以每百万测序reads进行量化,并从输入染色质对照样本中的信号中减去。在股四头肌和比目鱼中的ATAC-seq数据显示了推断的无核小体区域(插入位点在10到130个碱基对之间),并以每百万次测序计数(CPM)为单位以10个碱基对为单位进行量化。H3K4me2(表示增强子和启动子)和H3K27ac(表示活性启动子和增强子)在10个和CPM的箱中定量。一个在Slc16a10(MCT10)轨迹。上游的粉色盒子Slc16a10起始点显示了假定的six1结合增强子的位置,与慢抽搐比目鱼肌相比,主要活跃于快速抽搐的股四头肌。B−48 kb增强子在Slc16a10位点的放大。CSlc16a2位点的信号。D组成基因座的基因组信号Myh2来Myh8基因。E基因组信号Myh7轨迹。F肌原蛋白基因上的信号。图中蓝色方框为PCR扩增的区域。5
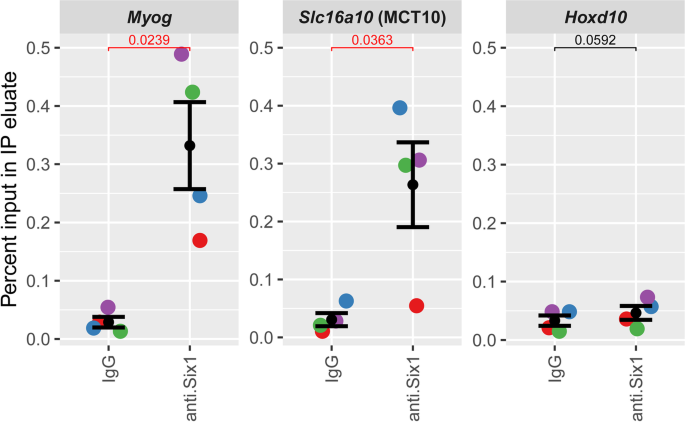
验证Six1通过ChIP-seq识别的-结合位点,我们使用抗Six1对照兔IgG检测小鼠后肢骨骼肌组织染色质。然后对ChIP洗脱物(qChIP)进行定量PCR,使用−48 kb增强子特异性引物,Myog近端启动子作为阳性对照(图中蓝框)。4F (17])和阴性对照位点(Hoxd10位点,骨骼肌异色[81,82])。这表明显着富集Six1绑定(图。5).我们的结果证实了MCT10位点上的−48kb假定增强子是a善意的Six1-binding网站。
确认Six1在Slc16a10增强子上结合。采集4只小鼠后肢肌肉染色质,固定,用抗six1抗体或正常兔IgG进行ChIP。结果显示在DNA上游48 kb结合位点上IP富集的qPCR定量(以输入DNA的百分比表示)Slc16a10/MCT10位点(图中粉色框对应区域)。4A).浓缩Myog阳性对照为近端启动子(图中蓝框对应区域)。4F)而缺乏浓缩在Hoxd10近端启动子显示为特异性对照。每个生物复制的结果用不同的颜色表示。双尾配对T分别与IgG和anti-Six1进行富集比较。单侧配对T测试还表明,抗six1的富集程度明显更高(p与Hoxd10位点相比,Myog和Slc16a10位点表达均< 0.05)
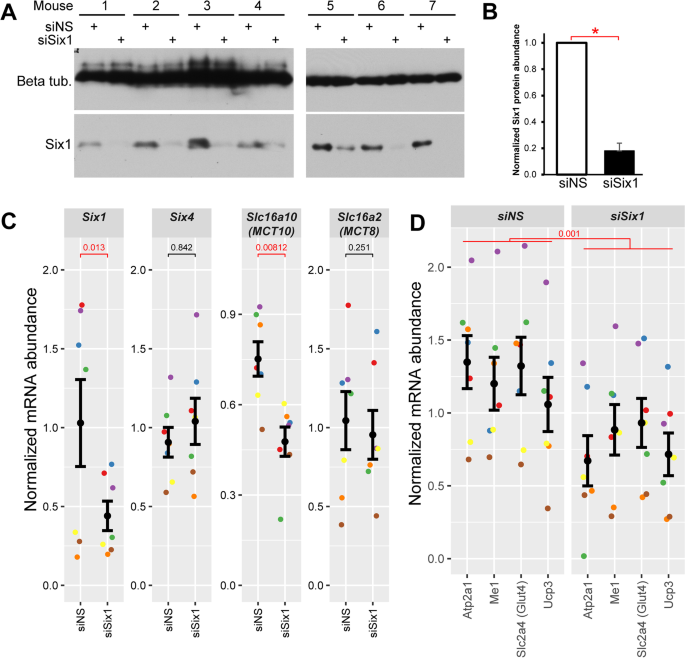
Sakakibara等人的微阵列转录组分析(图。1A)在小鼠中获得Six1在胚胎第9天左右切除,此时HSA-Cre转基因首次在肌分裂中检测到[28,83].为了探索Six1功能丧失对成人肌肉的影响,我们使用肌内短干扰RNA (siRNA)双电穿孔来降低TA肌肉(肌肉db簇1中的另一个主要快速收缩肌肉)中的Six1表达。选择TA是因为其体积较小,与腓肠肌相比,使电穿孔更有效。从电穿孔组织中收集总蛋白和RNA。对sirna处理过的肌肉提取物进行western blot,结果显示Six1蛋白水平相应降低了88%。6采用qRT-PCR方法评价其对靶基因表达的影响。Six1在sisx1敲除条件下,mRNA表达量下降约57%;未见代偿作用,有亲属关系的家庭成员(图;6C). MCT10的表达显著降低Six1-敲除样本,验证了该TH转运蛋白的表达依赖于Six1(无花果。6C).这种效应是MCT10特有的,因为MCT8的表达与Six1可拆卸的。综上所述,这些结果表明TH转运蛋白MCT10是一种直接的靶基因Six1并依赖于该TF在快收缩骨骼肌中达到正常表达水平。
Six1是MCT10表达和TH通路活性所必需的。一个Western blot检测siRNA敲除条件下Six1蛋白表达水平。siNS代表对照,非沉默RNA双工。注意,动物1 ~ 4和动物5 ~ 7在不同的时间加工,在不同的凝胶和膜上进行western blot。B6 - 1丰度的密度定量显示在面板a中,误差条表示扫描电镜。单尾配对的Six1蛋白丰度差异具有统计学意义T测试相对于siNS (*p值< 0.05)。实验是在七只相同的老鼠身上进行的。CmRNA表达水平Six1用qRT-PCR检测电穿孔小鼠TA肌中Six1敲除后MCT10的表达。本实验显示MCT8和MCT8属于同一基因家族,表达不变。mRNA水平归一化至18S rRNA和的几何平均值Actnb.数据代表平均7个生物重复(动物)。给出了规范化的表达式数据,每个单独的复制(鼠标)用不同的颜色显示。误差柱表示重复的平均值±SEM。P红色的值表示由单尾配对学生确定的表达水平在统计上显著下降T相对于siNS的测试(p值< 0.05)。D对照组和c组Six1敲除样本中四个TH通路靶基因组的mRNA表达水平。双向方差分析(检测mRNA水平作为检测基因和接收siRNA的函数)表明,Six1敲除后TH信号基因组显著降低(p值= 0.001)
甲状腺通路调节在Six1功能丧失条件下受到负面影响
确定…的影响程度Six1在此基础上,我们选取了4个TH受体靶基因进行qRT-PCR分析:Atp2a1,Slc2a4(Glut4),组织,Ucp3之所以选择它们,是因为它们是骨骼肌中TH信号和TH受体的最佳表征直接靶点之一[40,84,85,86,87,88,89].MCT10表达下调与Six14个TH通路基因的敲除与此平行(图2)。6D);基因组作为一个整体显著减少表达Six1功能丧失的双向方差分析。该小组的表达降低表明,甲状腺基因组调控通路活性降低Six1可拆卸的。
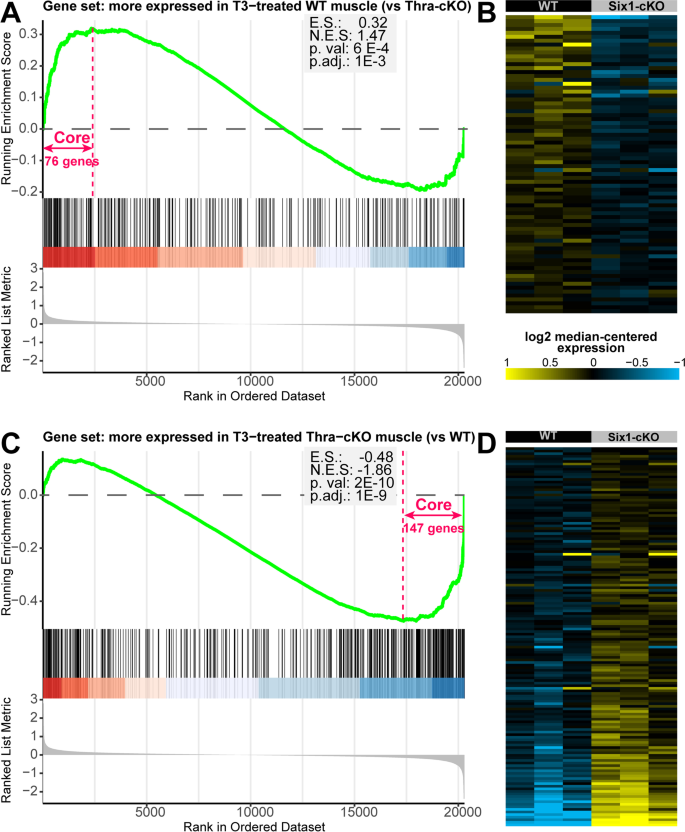
我们进一步研究了两者之间的联系Six1通过对Sakakibara等人的Six1-cKO基因表达谱数据进行基因集富集分析(GSEA),研究骨骼肌的TH信号通路和功能。为此,为了研究骨骼肌中与TH作用最相关的基因集,我们从Nicolaisen等人的研究中生成了两个基因集。[41],通过RNA-seq检测T3治疗和肌肉特异性敲除甲状腺激素受体α基因(Thra-cKO)的影响。具体来说,我们生成了第一组基因,与野生型相比,在t3处理的Thra-cKO肌肉中表达显著降低,而第二组基因表现出相反的行为,在Thra-cKO组织中表达更高。我们发现Six1-cKO中表达较低的基因在Thra-cKO中表达较低的基因中富集(图2)。7在这组基因中,我们注意到Sox6,是慢肌基因转录的抑制因子[90),而Myoz1(Calsarcin 2),一种阻断NFAT TF慢抽搐程序促进功能的蛋白质[29,91,92].参与细胞呼吸的四个基因也在这一组中:Idh3a,Ndufs6,Ndufa5,Uqcrq.相反,我们观察到Six1-cKO上调的基因倾向于与条件基因上调的基因重叠Thra肌肉损失(图;7其中,我们注意到钙稳态蛋白Atp2a2,Ryr3,Casq2,葡萄糖稳态的调节因子的基因而且Pdk3慢速肌钙蛋白Tnnc1,Tnnt1,Tnni1以及与脂肪酸代谢有关的基因Abhd1,Acot1,Acsf2,Tecrl.分析结果表明Six1活动与的活动直接相关Thra.总之,这些观察表明Six1在骨骼肌中与TH通路活性有功能性正相关。
Six1功能与TH受体相关。对野生型或Six1-cKO骨骼肌的基因表达分析进行了基因富集分析(Sakakibara等人),使用两个自定义的基因集,表示与T3处理的野生型肌肉相比,T3处理的Thra剔除骨骼肌中表达显著减少或增加的基因(来自Nicolaisen等人)。一个富集评分图显示,当基因从Six1-cKO中最下调的排列到上调的排列时,列表的开头是在t3处理的野生型肌肉中比Thra-cKO肌肉中表达更多的基因。B图A中显示的对富集贡献最大的基因热图(“核心富集”基因)。热图中基因从上到下的顺序与面板A从左到右的顺序相同。C而且D与A和B中相似的分析,但用于表示Thra-cKO中比WT表达更多的基因的集合。面板B和D中显示的基因符号在补充文件Code_S中列出3.和Code_S4
MCT10是骨骼肌TH信号通路活性所必需的
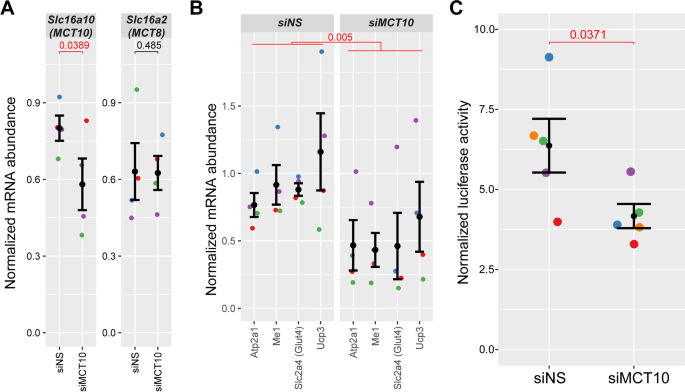
研究MCT10下调对TH信号表型的影响Six1当功能缺失时,我们使用siRNA直接敲除MCT10转运体。类似于采用的方法Six1敲低后,将靶向MCT10转录本(siMCT10)的siRNA双联体电穿孔到成人TA肌肉中,并使用qRT-PCR评估mRNA表达水平。siMCT10电穿孔可显著降低MCT10 mRNA的表达水平,而对相关MCT8基因无明显影响(图5)。8A).尽管siRNA敲低后MCT10的表达较低(降低29%)Six1击倒(无花果。6C), MCT10的下调伴随着TH信号通路基因面板表达的降低(图。8B),其趋势与Six1击倒条件下观察到的趋势相似(通过双向方差分析(ANOVA),以组为单位有统计学意义,图。6D)。最后,为了进一步证实MCT10敲低与TH转录应答的降低有关,我们检测了与siRNA双核苷酸同时电穿孔的TH应答荧光素酶报告基因的活性。MCT10敲低导致th依赖报告基因的活性显著降低(图。8C).这些结果表明MCT10是骨骼肌正常TH信号传递所必需的。
MCT10敲除TH通路效应的综述。一个用siRNA电穿孔对抗MCT10或非沉默RNA双工的TA肌肉中的基因表达。如图所示为siRNA靶向的MCT10以及相关基因MCT8和Six1的表达水平。mRNA水平归一化至18S和Actnb的几何平均值。数据来自4个生物重复(动物)。误差柱表示重复的平均值±SEM。P红色的值表示由单尾配对学生确定的表达水平在统计学上有显著变化T与siNS相关的测试(p值< 0.05)。B对照组和组a中MCT10敲低样本中四个TH通路靶基因组的mRNA表达水平。双向方差分析(检测mRNA水平作为测试基因和接收siRNA的函数)表明,MCT10敲低显著降低TH信号基因组(pValue = 0.005)。CMCT10的敲除导致th依赖基因转录的减少。用靶向MCT10的siRNA电穿孔TA肌肉中相对tre依赖的荧光素酶活性。N= 5个生物重复。报告基因表达的减少是显著的,由配对单尾确定T测试,与非静音对照(siNS)相比
结论
结合三个基因组研究分析骨骼肌基因调控(Six1ChIP-seq, Six1-cKO中的表达式分析和muscleDB数据库),我们强调了两者之间的强关联Six1功能和快速抽搐表型。分析结果不仅证实了这一点Six1与建立腓肠肌中若干基因的正确基因表达谱有关[28,但也重申Six1基因表达的激活因子和抑制因子。之前的报告已经证明了这一点Six1和其他6个家族tf可能与共同调控因子合作抑制转录Sobp[93]以及Dach或Groucho/TLE家族的成员[15,94],并与Eya家族的辅助因子或SWI/SNF复合物激活转录[15,79,95,96,97].这种联系Six1以前在培养的成肌细胞和肌管中观察到结合和功能丧失后的基因上调和下调[17但Six1在骨骼肌中转录抑制的确切机制,以及它们如何影响慢或快抽搐表达程序,仍有待发现。我们研究的一个局限是我们的Six1ChIP-seq分析在体外培养的分化的原代细胞中进行,代表来自不同肌肉群的肌肉前体的异质混合物。这是可能的Six1基因组结合数据不仅反映了分化肌纤维表型的维持,如快速收缩程序,而且还暗示Six1在肌源性分化过程中上调这些基因。这可以部分解释为什么Six1的结合位点在慢抽搐特异性Myh7基因附近被发现。4E).全基因组研究Six1在从特定肌群分离的肌纤维中进行的结合,将需要进一步评估该TF在建立和维持慢抽动与快抽动基因表达程序中的功能和作用模式。
我们的基因组学分析显示,在快收缩骨骼肌中,Six1直接调控TH转运蛋白MCT10的表达。确定其他组织类型是否也依赖Six1来表达MCT10将是有趣的。在这种情况下,值得注意的是,Eya1敲除小鼠的甲状腺发育存在缺陷[98]而Six1和MCT10 mrna均在成人甲状腺中检测到[99].我们注意到Atp2a1是已知的直接目标吗Six1[17,63],以及图中ChIP-seq和基因表达谱数据的分析。1表明,组织这是这个TF的另一个直接目标。这些基因是否下调后Six1功能的丧失是严格由于减少Six1活动或直接和间接作用的组合(例如,通过解除TH信号的调控)仍有待正式确定,但这些观察结果提高了基因表达组合调控的可能性Six1和TH受体。我们的研究结果也表明,这种情况仍在持续Six1表达是维持成人肌肉中适当的基因表达程序所必需的。
我们在两者之间作了比较Six1缺乏症和甲状腺功能减退症Six1功能丧失和TH信号通路损伤(通过Thra基因消融)在对基因表达的影响方面有相似之处。我们的发现与Six1缺乏症通过降低骨骼肌中TH的进入而导致甲状腺功能减退。相反,甲亢和Six1功能的获得都与快速抽搐程序的获得有关[26,45,46].然而,由每种条件引起的转录组变化的重叠程度以及MCT10诱导是否是这种机制的一部分仍有待观察。TH信号和之间的串扰的可能性Six1调控的基因程序也值得未来的关注。
作为一个Six1靶基因MCT10被鉴定为影响的中介Six1对骨骼肌TH信号通路的影响不能排除骨骼肌纤维中其他转运蛋白对TH摄取的影响。然而,MCT10似乎在这一过程中发挥了重要作用,而其他转运蛋白无法完全弥补MCT10敲低的影响。成熟肌肉的情况与再生时的情况不同,再生时MCT8和OATP1C1发挥更重要的作用[57].先前的一篇报道表明MCT10在MCT8/Oatp1c1缺失的情况下可以起到代偿作用[57,在这种情况下,卫星细胞介导的肌肉再生会暂时延迟。MCT8/Oatp1c1敲除小鼠同样表现出神经发育受损,与分化谱系相比,这两种转运蛋白在神经干细胞中表达更高[One hundred.].在这种情况下,MCT10 mRNA在分化谱系中比其他任何一种转运蛋白都高表达。这得到了蛋白质水平数据的支持,这些数据显示,终分化神经元组织中MCT10表达增加[101].这些数据表明MCT10在成人组织中具有更大的作用,在发育和分化的早期阶段具有代偿作用的潜力。也有报道在小鼠衰老过程中,腓肠肌中MCT10的mRNA水平显著升高,而MCT8的mRNA水平没有明显升高[58].因此,现有的证据表明MCT10与TH基因调控程序的成人组织稳态调控密切相关。到目前为止,MCT10基因敲除仅在小鼠中以一种构成方式实现;动物在某些外周器官(包括骨骼肌)中显示出较高浓度的芳香族氨基酸[102]但正常循环TH轴值[103];mct10缺失骨骼肌的表型未被彻底检查。有条件的MCT10肌肉特异性缺失小鼠的表型特征将是重要的,以确定其在该组织发育中的作用,以及在成人代谢表型的建立和维持中的作用。
除了TH转运蛋白外,其他种类的蛋白质也参与TH信号传导。TH的转录作用是由它们的核受体tf介导的Thra而且Thrb.细胞内脱碘酶Dio2而且Dio3将T4转化为效力更强的T3,将T3分别转化为效力更低的T4、RT3或T2。mu - crystin,由Crym基因,是一种高亲和力的细胞内TH结合蛋白,可调节TH进入其核受体和Crym-null小鼠显示快速IIb型肌纤维肥大[104].在查询muscleDB mRNA表达数据集时,我们发现所有这些蛋白在不同的肌肉群中以不同的水平表达,在快肌群或慢肌群中没有明显的表达偏倚;事实上,Slc16a10/MCT10仍然是表达偏倚最明显的基因(图S2).在这些基因中,MCT10也是唯一一个受到显著影响的基因Six1条件敲除肌(图;1).
考虑到TH信号对肌肉功能和代谢的重要性,本文的研究结果表明,TH转运蛋白的表达必须严格控制,我们已经证明Six1通过上调MCT10的表达在调节机制中发挥重要作用。
方法
动物
所有实验使用6-8周龄的雌性C57BL/6J小鼠,购自Charles River。采用颈椎脱位法处死小鼠。
ChIP-sequencing
如前所述,对原代小鼠成肌细胞中的Six1进行ChIP-seq检测[23].测序数据已保存在NCBI基因表达Omnibus (GEO)上,编号为GSE175999。原代成肌细胞从8周龄雌性小鼠中分离,在合流处收获或生长至合流处,在分化培养基(DMEM中添加10%马血清)中培养48 h,生成原代肌管。制剂几乎是纯的,因为95-100%的细胞表达MyoD,在生长期通过免疫荧光检测(未显示)。分化48小时足以获得非常大的肌管,其中发现超过80%的核(与C2C12细胞分化120小时相当,数据未显示)。为了识别six1结合位点,MACS2 [105]在BED模式下使用默认参数,并使用SSP估计片段大小[106].使用PeakSplitter将大的复合峰分割成单独的峰来细化峰,截断值为70,谷值为0.8 [107].通过消除MACS2使用输入样本发现的重叠峰、使用IgG与输入对照发现的重叠峰以及mm9基因组黑名单区域,进一步细化了Six1的峰。表S中提供了具有峰值坐标的BED文件1(成肌细胞)和S2(肌管)。使用这些包将Six1 ChIP-seq峰注释到小鼠基因上TxDb.Mmusculus.UCSC.mm9.knownGene而且ChIPseeker[108],设置距离截断为50kb。表S中提供了基因注释3.和S4.股四头肌和比目鱼的组蛋白标记ChIP-seq和ATAC-seq来自Barish等人的研究[80]并从NCBI Short Reads Archive中获得(条目SRP199043和SRP173476)。C2C12细胞组蛋白标记来自Asp等。[81]和Blum等人。[69] (SRP006743和SRP012465)。TF在原代成肌细胞中的结合来自Umansky等人[73) (SRP040422)。为了简化分析,每种条件下所有可用的生物和技术复制都被合并到一个文件中。读取的适配器和低质量部分使用fastp [109],利用STAR将它们与小鼠mm9基因组对齐[110]在局部模式下,最大内含子大小设置为1个碱基对,并使用没有基因模型GTF文件构建的基因组索引。只保留了与单个基因组位置对齐的reads。重复的标记使用皮卡[111].使用deepTools bamCoverage计算全基因组测序覆盖率,不包括标记为重复的reads [112].在ATAC-seq的特定情况下,bamCoverage被限制在10到130个碱基对之间的成对末端片段,假设代表无核小体区域。对于组蛋白标记ChIP-seq,可作为单端数据,bamCoverage使用使用SSP作为各自库中最常见的染色质片段大小计算的读扩展长度来执行。利用R/Bioconductor制备基因组覆盖图[113]和karyoploteR包(114].ChIP-seq读密度(覆盖率)热图用deepTools computeMatrix和plotHeatmap制作。
在R/Bioconductor中使用“模因”包进行从头motif发现[115]和STREME计划[116].将MB-only组、MT-only组和MB- MT组的2500个最高峰下的序列(以ChIP-seq读取数为单位)进行组合。对照序列是相同的一组,使用“通用motif”包和“欧拉”方法进行洗牌以保留双核苷酸频率,k= 2和100的随机种子。新母题与JASPAR数据库中已知母题的相似性[117]使用Tomtom [118].利用Ame [119],以各组six1结合峰下的DNA序列为测试集。控制序列集是所有Six1-binding峰下序列的并集,用欧拉方法洗牌,k= 2和随机种子200,使motif发现和富集的控制集不同。
在R/Bioconductor中使用“topGO”包进行氧化石墨烯术语富集分析[120],以整个小鼠基因为背景。测试集是转录起始位点最接近每个峰值的基因,最大耐受距离为50 kb。只包含至少10个小鼠基因的GO项。P使用Benjamini-Hochberg算法将值修正为错误发现率[121].
基因表达谱数据分析
Sakakibara研究的基因表达数据[28]是从NCBI GEO检索到的(编号GSE46151)。分析中只包括腓肠肌样本。数据分析使用R/Bioconductor和益生元而且limma包(122,123],采用RMA归一化和基于基因型的差异表达检测设计。日志2计算折叠变化,和P使用Benjamini-Hochberg算法调整数值;对于显著性阈值,分别使用0.58和0.05的截断值。差异表达基因列表见补充表S5.基因表达数据来自Terry et al. muscleDB研究[65]是从NCBI GEO(入世GSE100505)和SRA入世SRP110541中检索到的。用fastp修剪Reads,并使用STAR在局部模式下与mm10小鼠基因组对齐,并使用基因模型GTF文件(mus_muscle . grcm38.102)构建基因组索引。从ENSEMBL获得的gtf)。只保留了与单个基因组位置对齐的reads。重复标记,但保留所有下游分析,使用Picard。使用Subread featurets对基因进行读摘要[124].R/Bioconductor和DESeq2包用于定量和归一化基因表达,并获得方差稳定表达估计[125].数据聚类和热图生成使用pheatmap包(126].用于分析数据和生成图形的R脚本(包括包版本和会话信息)作为补充文件Code_S提供1.使用Sakakibara数据和Nicolaisen等人研究中的两个基因集进行基因集富集分析[41].简单地说,RNA-seq数据(基因读取计数)从NCBI GEO接入GSE146336下载,并在R/Bioconductor中使用刨边机包(127].数据采用TMM归一化,批效应采用RUVseqRUVr算法和k= 2 [128].在t3处理的Thra-cKO肌肉中,与t3处理的野生型肌肉相比,基因显著上调或下调(glmQLFTest功能显示FDR < 0.05),并保存为两个独立的基因集。GSEA在R/Bioconductor中进行clusterProfiler包(129],除最大基因集大小限制调整为1000外,其余均采用默认参数的fgsea算法。这两个基因集(以Entrez gene ID作为标识符)在补充文件Code_S中提供2.
可以阻止电穿孔
对6 - 8周龄雌性C57BL/6小鼠胫骨前肌进行电穿孔实验。在敲除实验中,在实验第0天,通过踝关节肌腱上方的后肢皮肤肌内注射0.4单位/μL浓度的25 μL透明质酸酶(Worthington)消化TA的间结缔组织,以确保基因物质能够包围并成功转染大部分肌肉纤维[130].1 h后,将22.5 μL siRNA以20 μM的浓度经后肢皮肤肌注至TA腹部。核酸电穿孔用Tweezertrodes(2桨电极组件,BTX-Harvard Apparatus 45-0165)进行,电极之间有7mm的间隙。注射siRNA后,在皮肤上涂抹超声凝胶,浅涂两发电穿孔,第一个电穿孔中的桨向后肢横矢状方向,第二个电穿孔中桨向后肢横矢状方向。使用BTX ECM 630电穿孔系统进行电刺激,设定为50伏,6个脉冲,50 ms/脉冲,脉冲之间间隔200 ms。实验第3天重复镊子电极电穿孔。非静音控制和Six1——或者Mct10通过Invitrogen (Stealth siRNA技术)获得-靶向siRNA双链,在20 μM下进行重组。序列为sisx1: GCGAGGAGACCAGCUACUGCUUUAA;siMct10: GCGUCUUCACAAUCCUGCUCCCUUU。siNS阴性对照为Stealth RNAi siRNA阴性对照,Med GC序列1(目录号12935300)。为了减少生物变异的影响,在所有实验中,同一只动物的一条腿接受了siNS双链,而另一条腿接受了Six1-或mct10 -靶向siRNA。实验第7天处死所有小鼠。
体内荧光素酶测定
在包括转录报告质粒的体内电穿孔实验中,实验第0天,22.5 μL siRNA与7.5 μL pdV-L1质粒混合,以3 μg/μL的浓度在无菌半盐水(0.45% NaCl)中注射siRNA。该质粒包含两个T3响应元件和位于萤火虫荧光素酶基因上游的SERCA1基础启动子,以及前面有SERCA1启动子的对照组肾草荧光素酶基因(由W.S. Simonides博士(阿姆斯特丹VU医学中心,NL)提供)[131,132].实验第3天注射只含有如上所述的siRNA。7天后收集处理过的肌肉,用冷却的臼和杵(Plattner’s)在液氮中粉碎,每100 mg组织块重新悬浮在100 μL的被动裂解缓冲液(Promega)中。荧光素酶检测结果通过在Glomax Luminometer中使用50 μL荧光素酶检测试剂(Promega)读取5 μL裂解液获得。萤火虫荧光素酶信号读数归一化为Renilla荧光素酶读数,以控制电穿孔效率的可变性。
RNA提取
所有样品在1 mL TRIzol试剂(Invitrogen)中提取。解剖和粉碎的TA样品放置在Lysing Matrix D管(MP Biomedical)的TRIzol中,并在MagNa Lyser机器(Roche)中均质,程序为7000 RPM,共进行三次20秒的爆破,中间在冰上冷却10秒。然后将样品在4°C, 12000 g下旋转5分钟以去除脂肪含量。RNA提取按照TRIzol制造商的建议进行。RNA通过DNase I (RNase-free, New England Biolabs)处理和制造商推荐的酶热失活进一步纯化。
反转录
根据制造商的建议,使用SuperScript III第一链合成系统(赛默飞世尔),使用随机六聚体方法和反应后RNAse H处理,使用500 ng经过dnas处理的总RNA将RNA反转录为cDNA。PCR前将cDNA样品用10 mM Tris pH 8.0稀释至50 μL。
染色质免疫沉淀反应
对于ChIP实验,每次复制都使用两只小鼠的所有后肢肌肉进行。组织在低渗缓冲液(25 mM pH 7.8, 1.5 mM MgCl)中冰上解剖并均质2, 10mm KCl, 0.1% (v/v) NP-40和蛋白酶抑制剂),使用特氟龙波特- elvehjem均质器安装在台式钻头上。从11X溶液(11%甲醛,0.1 M NaCl, 1.0 mM EDTA, 0.5 M EGTA, 50 mM HEPES pH 8.0)中加入甲醛,室温下10分钟。用0.125 M甘氨酸在室温下淬火5 min。样品以1000 g在4℃下旋压5min,重悬于新鲜低渗缓冲液中,经70 μm细胞过滤器过滤,再以1000 g在4℃下旋压5min,再悬浮于650 μL超声缓冲液(10 mM EDTA, 50 mM Tris-HCl pH 8, 0.1% (w/v) SDS和蛋白酶抑制剂)中。通过离心收集核颗粒,并在核裂解缓冲液(200 mM NaCl, 1 mM EDTA, 0.5 mM EGTA, 10 mM Tris-HCl pH 8和蛋白酶抑制剂)中裂解。将核制成球团,在650 μL超声缓冲液(1 mM EDTA, 0.5 mM EGTA, 0.5% (w/v)萨科齐钠,10 mM Tris-HCl pH 8.0和蛋白酶抑制剂)中重悬。所有超声均使用振幅为40%的探头超声器进行,进行60个周期,1秒剪切DNA, 4秒冷却。其余的分析按照先前发表的方法进行[17],每个样品25 μg染色质,用Protein A sepharose珠进行预处理,每个样品2 μg抗体孵卵过夜,珠洗7次,SDS结合交联逆转洗脱,苯酚萃取,乙醇沉淀法清除DNA。ChIP所用的一抗为抗six1(兔多克隆HPA001893, Sigma)和正常兔IgG (Jackson ImmunoResearch)。最后的微球在50 μL 10 mM Tris-HCl pH 8.0中重悬,进行下游qPCR。
qPCR
在含有SYBR Green I HotStarTaq酶(Qiagen)的反应中对cDNA和ChIP样品进行qPCR。相对定量是使用标准曲线进行的池化的等分的每个cDNA样本被检查。由于库中每个基因的绝对mRNA丰度是不同的,因此可以在样品间比较给定基因的表达,但不能直接比较不同基因的表达水平。相反,qChIP的标准曲线是用输入的基因组DNA制作的;假设每个基因都存在于基因组中相同的等位基因数量中,可以直接比较不同基因的富集水平。所有样本均作为技术三次重复运行,并取其几何平均值。在qRT-PCR中,通过18S核糖体RNA和的几何平均值得到相对表达量Actnb,它们在实验条件下是不变的[133].对于每个实验,图表显示单个生物复制(实验小鼠)作为单独的点,以及它们的平均值和标准误差。寡核苷酸序列见表S6.
蛋白提取,定量,免疫检测
肌肉蛋白按照制造商推荐的程序从TRIzol有机相中提取。蛋白质颗粒在尿素-SDS样品缓冲液(6 M尿素,1% SDS, 20 mM Tris pH 6.8)中以每1 mg组织约3 μL缓冲液的比例溶解,并在4°C下轻轻摇晃过夜。使用BCA蛋白检测试剂盒(Thermo Scientific)测定样品蛋白质浓度。一抗是抗six1(兔多克隆HPA001893, Sigma)和抗- tubulin(小鼠单克隆杂交瘤克隆E7, DSHB)。二抗与HRP结合。在x射线胶片上获取信号,随后将其数字化并在FIJI软件中进行密度定量分析。
统计分析
所需要的重复数是根据经验确定的,以获得足够的统计力。没有样品被专门排除在分析之外。R和rstatix进行统计分析[134].qPCR、密度测定和荧光素酶测定的统计学意义由配对确定T测试,总是将用敲低siRNA电穿孔的实验肌肉与用siNS电穿孔的同一动物的对侧肌肉配对。在已有数据表明影响方向的情况下,采用单侧检验。P≤0.05的值被认为是有显著差异的均值。在适用的情况下,对p值的计算采用Benjamini-Hochberg方法[121].除非另有说明,每次实验获得不少于3个生物或技术重复。统计分析的控制样本组和实验样本组总是使用相同数量的技术和生物重复。在mRNA表达的情况下,TH信号基因面板(由Atp2a1,组织,Slc2a4,Ucp3后)Six1或MCT10敲低后,对独立分类变量“Gene tests”和“siRNA duplex used”对因变量“Normalized expression”的影响进行双向ANOVA检验。正态分布和方差齐性假设分别被Shapiro-Wilk和Levene检验证实。P“使用siRNA双工”的效果值是显著的,并有报道。
数据和材料的可用性
的ChIP-seq数据Six1基因组结合谱已沉积在NCBI基因表达Omnibus (GEO)上,编号为GSE175999。
缩写
- 方差分析:
-
方差分析
- ATAC-seq:
-
转座酶可及染色质测定
- 芯片:
-
染色质免疫沉淀反应
- ChIP-seq:
-
染色质免疫沉淀,高通量测序
- 联盟:
-
指长伸肌
- 身上:
-
指短屈肌
- 走:
-
基因本体论
- GSEA:
-
基因集富集分析
- H3K4me1:
-
赖氨酸4上组蛋白H3的单甲基化
- H3K4me2:
-
赖氨酸4上组蛋白H3的二甲基化
- H3K27ac:
-
赖氨酸27上组蛋白H3的乙酰化
- m:
-
成肌细胞
- 磁流变液:
-
肌源性调节因子
- MT:
-
肌管
- 聚合酶链反应:
-
聚合酶链反应
- qChIP:
-
染色质免疫沉淀,定量聚合酶链反应
- 存在:
-
逆转录,然后定量聚合酶链反应
- RNA-seq:
-
RNA序列
- rt - pcr:
-
逆转录之后是聚合酶链反应
- siMCT10:
-
短干扰RNA靶向MCT10
- 罪:
-
非沉默短干扰RNA
- 核:
-
Short-interfering RNA
- siSix1:
-
短干扰RNA靶向Six1
- Six1-cKO:
-
Six1条件敲除
- 助教:
-
胫前肌
- TF:
-
转录因子
- TH:
-
甲状腺激素
- Thra-cKO:
-
甲状腺激素受体α基因条件敲除
- 混乱关系:
-
甲状腺激素反应元件
参考文献
Kawakami K, Ohto H, Takizawa T, Saito T. 6个家族基因在小鼠视网膜中的鉴定与表达。中国农业科学,1996;29(3):339 - 344。
Kawakami K, Sato S, Ozaki H, Ikeda K. 6个家族基因作为转录因子的结构和功能及其在发育中的作用。生物学报,2000;22(7):616-26。
赛瑞库马,欧图萨杰。sin oculis是果蝇视觉系统发育所必需的同源盒基因。遗传学。1994;138(4):1137 - 50。
张志刚,张志刚,张志刚。涡虫眼球再生的遗传网络研究进展。自然科学进展,2000;29(3):344 - 344。
Bebenek IG, Gates RD, Morris J, Hartenstein V, Jacobs DK。基部后生动物的正眼。中国生物医学工程学报,2004;26(7):342 - 344。
Dozier C, Kagoshima H, Niklaus G, Cassata G, Bürglin TR.秀丽隐杆线虫6 /正眼类同源盒子基因ceh-32是头部形态发生所必需的。生物工程学报,2001;36(2):281 - 283。
张志刚,张志刚,张志刚,张志刚,等。神经源性基板的前脊椎动物起源。大自然。2015;524(7566):462 - 5。
Laclef C, Souil E, Demignon J, Maire P. Six1缺陷小鼠胸腺、肾和颅面异常。机械工程学报。2003;20(6):669-79。
徐p - x,郑伟,黄玲,Maire P, Laclef C, Silvius D. Six1是哺乳动物肾脏早期器官发生所必需的。发展。2003;130(14):3085 - 94。
Self M, Lagutin OV, Bowling B, Hendrix J, Cai Y, Dressler GR,等。Six2在发育中的肾脏中抑制肾发生和祖细胞更新是必需的。中国生物医学工程学报。2006;25(21):5214-28。
朱成林,李志强,李志强,等。Wnt信号在前神经外胚层的Six3抑制对脊椎动物前脑发育至关重要。基因工程学报,2003;17(3):368-79。
鲍彻CA, King SK, Carey N, Krahe R, Winchester CL, Rahman S,等。一种新的同源结构域编码基因与被肌强直性营养不良不稳定(CTG) n重复中断的大CpG岛有关。胡文忠。1995;4(10):1919-25。
Oliver G, Mailhos A, Wehr R, Copeland NG, Jenkins NA, Gruss P. Six3,一种正眼基因的小鼠同源物,在发育中的神经板的最前边界,并在眼睛发育过程中表达。发展。1995;121(12):4045 - 55。
Larder R, Clark DD, Miller NLG, Mellon PL.缺乏同源结构域蛋白Six6的小鼠下丘脑失调和不育。神经科学杂志,2011;31(2):426-38。
李霞,Oghi KA,张杰,Krones A, Bush KT, Glass CK,等。Eya蛋白磷酸酶活性调控Six1-Dach-Eya在哺乳动物器官发生中的转录效应。大自然。2003;426(6964):247 - 54。
Spitz F, Demignon J, Porteu A, Kahn A, Concordet J- p, Daegelen D,等。胚胎发生过程中肌原蛋白的表达由六/正弦眼同源蛋白通过一个保守的MEF3结合位点控制。自然科学进展,1998;26(3):344 - 344。
刘艳,朱a, Chakroun I, Islam U, Blais A.成肌细胞分化过程中肌原性调控因子与6家族转录因子的协同作用。中国生物医学工程学报,2010;38(20):6857-71。
郑志超,曾斌,梅丽平,王文华,王志强。小鼠胚胎发生过程中肌原蛋白启动子的激活。中国科学院学报(自然科学版),2001;26(2):366 - 366。
Molkentin JD, Olson EN。基本螺旋-环-螺旋和MADS-box转录因子对肌肉发育的组合控制。自然科学进展,1996;29(3):366 - 366。
brison - richardson RJ, Currie PD。脊椎动物肌肉发生的遗传学。植物学报。2008;9(8):632-46。
白金汉M,里格比PW。控制肌肉生成的基因调节网络和转录机制。生物技术学报。2014;28(3):225-38。
张晓东,杨晓东,张晓东,张晓东,等。Six4、MyoD和肌发生过程中组蛋白去甲基化酶Utx之间的全基因组关联。中国生物医学工程学报。2015;29(11):4738-55。
刘勇,杨东,梁杰,阿齐兹,等。Six1调节成年肌肉祖细胞MyoD的表达。公共科学学报,2013;8(6):e67762。
刘志刚,李志刚,李志刚,李志刚。六- 1基因缺陷小鼠肌生成的改变。中国农业科学,2003;29(3):344 - 344。
Le Grand F, Grifone R, Mourikis P, Houbron C, Gigaud C, Pujol J,等。Six1在骨骼肌再生过程中调节干细胞修复潜能和自我更新。中国生物医学工程学报,2012;29(5):344 - 344。
Grifone R, Laclef C, Spitz F, Lopez S, Demignon J, Guidotti J e,等。Six1和Eya1的表达可以将成人肌肉从慢抽搐表型重编程为快抽搐表型。分子生物学杂志,2004;24(14):6253-67。
Hetzler KL, Collins BC, Shanely RA, Sue H, Kostek MC.同源盒基因SIX1改变小鼠骨骼肌肌球蛋白重链亚型表达。物理学报(英文版);2014;21(2):415-28。
Sakakibara I, Santolini M, Ferry A, Hakim V, Maire P.在快速MYH位点上的6个同源蛋白和一个Iinc-RNA锁定了快速肌纤维末端表型。公共科学图书馆。2014;10(5):e1004386。
陈尔,enson, Richardson JA, Yang Q, Humphries C, Shelton JM,等。钙调神经磷酸酶依赖的转录途径控制骨骼肌纤维类型。基因工程学报,1998;12(16):2499-509。
Röckl KS, Hirshman MF, Brandauer J, Fujii N, Witters LA,固特异LJ。骨骼肌适应运动训练。糖尿病。2007;56(8):2062 - 9。
林杰,吴华,Tarr PT,张春英,吴震,O老板,等。转录共激活因子PGC-1α驱动慢肌纤维的形成。自然。2002;418(6899):797 - 801。
何杰克逊,小野Y,王X,艾尔沃西S,坎利夫VT,英厄姆PW。Sox6在斑马鱼肌纤维类型规范中的作用。骨骼肌。2015;5(1):2。
张东,王旭,李勇,赵玲,陆明,姚旭,等。甲状腺激素通过miR-133a1调节肌纤维类型转换。中国生物医学工程学报。2014;
张杰,马丽泽。甲状腺激素的作用机制。《物理学年鉴》2000;62:439-66。
郑世勇,李奥纳德,戴维斯。甲状腺激素作用的分子方面。科学通报,2010;31(2):139-70。
杨克斯MA, Ribera AB.胚胎斑马鱼神经元非基因组甲状腺激素信号的分子成分。神经发展。2009;4:20。
冯旭,蒋勇,Meltzer P,闫敏。互补DNA芯片检测体内甲状腺激素对肝脏基因的调控。分子内分泌杂志2000;14(7):947-55。
牙科M,马西利A,安布罗西奥R,瓜迪奥拉O,西比里奥A,白金华,等。FoxO3/type 2脱碘酶通路是正常小鼠肌肉发生和肌肉再生所必需的。中国科学(d辑),2010;
泰蒂斯M,安布罗西奥R,达米亚诺V,西比利奥A,卢昂戈C,瓜迪奥拉O,等。细胞内甲状腺激素失活是肌肉干细胞增殖和谱系进展的生存机制。中国生物医学工程学报。2014;20(6):1038-48。
甲状腺激素作为骨骼肌代谢和收缩表型的决定因素。甲状腺。2008;18(2):205 - 16。
Nicolaisen TS, Klein AB, Dmytriyeva O, Lund J, Ingerslev LR, Fritzen AM,等。骨骼肌中的甲状腺激素受体α对t3介导的能量消耗增加至关重要。中国科学,2020;34(11):15480-91。
Lombardi A, de Lange P, Silvestri E, Busiello RA, Lanni A, Goglia F,等。3,5-二碘- 1 -甲状腺氨酸快速增强大鼠骨骼肌线粒体脂肪酸氧化率和产热:amp激活蛋白激酶参与。中华内分泌杂志,2009;29(3):349 - 349。
葛洛祖夫斯基,瑞比希,罗思·ML,马尔卡希·马,黄莎,佩蒂·梅,等。骨骼肌细胞中过氧化物酶体增殖物激活受体- γ激动剂诱导2型脱碘酶表达。内分泌学。2009;150(4):1976 - 83。
周娟,郭捷,何俊平,林安,朱兴国,韩瑞荣,等。甲状腺激素受体α调节骨骼肌的自噬、线粒体生物发生和脂肪酸使用。内分泌学。2021;162 (8):bqab112。
郭志刚,张志刚,张志刚,张志刚。慢性低频刺激对大鼠快收缩肌肌凝蛋白表达的拮抗作用。中国生物医学工程学报。1990;26(3):339 - 344。
张建平,李斌。肌球蛋白表达的竞争性控制:肥厚与甲状腺功能亢进。中国生物医学工程学报,2001;30(5):529 - 529。
布洛伊斯FF, Cordeiro A, Ortiga-Carvalho TM。甲状腺激素在骨骼肌生理中的作用。中华内分泌杂志,2018;36(1):R57-68。
齐晓明,张晓明,张晓明,张晓明。TEAD-1在转基因小鼠横纹肌中表达的研究进展。中国生物医学工程学报,2008;29(4):344 - 344。
Carnac G, Albagli-Curiel O, Vandromme M, Pinset C, Montarras D, Laudet V等。3,5,3 ' -三碘甲状腺原氨酸正向调控C2成肌细胞MyoD1基因转录和终末分化。分子内分泌杂志,1992;6(8):1185-94。
Downes M, Griggs R, Atkins A, Olson E, Muscat G.小鼠肌生蛋白基因中甲状腺激素反应元件的鉴定:甲状腺激素和类视黄酮X受体异二聚体结合位点的特征。细胞生长差异。1993;4:901。
Anderson JE, McIntosh LM, Moor AN, Yablonka-Reuveni Z.甲状腺激素对mdx和正常肢体肌肉损伤后MyoD蛋白表达水平的影响。组织化学杂志,1998;46(1):59-67。
杨晓明,杨晓明,杨晓明,等。甲状腺功能减退对大鼠比目鱼肌卫星细胞和纤维发育的影响。中国生物医学工程学报,1996;26(1):344 - 344。
Hennemann G, Docter R, Friesema EC, de Jong M, Krenning EP, Visser TJ。甲状腺激素的质膜转运及其在甲状腺激素代谢和生物利用度中的作用。科学通报2001;22(4):451-76。
Groeneweg S, van Geest FS, peters RP, Heuer H, Visser WE。甲状腺激素转运体。Endocr Rev. 2020;41(2):bnz008。
迪科斯莫C,廖晓华,叶华,费ara AM, Weiss RE, Refetoff S,等。mct8缺陷小鼠的能量消耗增加,脂肪量减少,这种情况通过血清T3水平的正常化而消除。内分泌学。2013;154(12):4885 - 95。
神经支配和甲状腺激素改变对肌球蛋白重链表达和纤维类型转换的影响:一项小型综述。组织化学细胞生物学。2015;43(2):123-30。
梅耶尔,史密,多伊切娃,戴拉斯VM, Hüttner SS, Boelen A,等。甲状腺激素转运蛋白MCT8和OATP1C1控制骨骼肌再生。干细胞研究,2018;10(6):1959-74。
王玲,盛勇,徐伟,孙明,吕松,于俊,等。衰老小鼠骨骼肌中甲状腺激素信号通路的机制。内分泌。2021;72(1):132 - 9。
Friesema EC, Docter R, Moerings EP, Verrey F, Krenning EP, Hennemann G,等。甲状腺激素转运的异二聚体人体系统L氨基酸转运体。内分泌学。2001;142(10):4339 - 48。
Ritchie JW, Peter GJ, Shi YB, Taylor PM。爪蟾卵母细胞中4F2hc-IU12异二聚体对甲状腺激素的转运。中华内分泌杂志,1999;23 (2):R5-9。
Poncet N, Mitchell FE, Ibrahim AFM, McGuire VA, English G, Arthur JSC,等。L1氨基酸转运体(slc7a5)的催化亚基促进小鼠骨骼肌中的营养信号传递。PloS One. 2014;9(2):e89547。
Felmlee MA, Jones RS, Rodriguez-Cruz V, Follman KE, Morris ME。单羧酸转运蛋白(SLC16):功能、调节和在健康和疾病中的作用。中国医药科学,2020;32(2):466-85。
刘玉玲,刘志刚,刘志刚,刘志刚,等。Six1和Six4基因的表达是激活小鼠初级肌分裂中快速型肌肉基因程序所必需的。中国生物医学工程学报。2010;38(2):168-82。
Sakakibara I, Wurmser M, Dos Santos M, Santolini M, Ducommun S, Davaze R,等。Six1同源蛋白驱动比目鱼肌肌纤维IIA型专门化。骨骼肌。2016;6(1):30。
张鑫,张晓霞,李建平,李建平,等。转录谱分析揭示了骨骼肌组织之间的非凡多样性。eLife。2018; 7: e34613。
刘艳,刘志刚,刘志刚,刘志刚,刘志刚。Six1同源结构域转录因子dna结合序列的发现、优化和验证。中国生物医学工程学报,2012;40(17):8227-39。
Andreucci JJ, Grant D, Cox DM, Tomc LK, Prywes R, Goldhamer DJ,等。肌细胞分化过程中AP-1转录复合物的组成及功能。中国生物医学工程学报,2002;27(4):426 - 426。
吴晓东,杨晓东,杨晓东,杨晓东,杨晓东。MEF2和AP-1对Hspb7的调控:Hspb7在肌肉萎缩中的意义中国生物医学工程学报,2016;29(4):344 - 344。
张晓明,张晓明,张晓明,张晓明,等。骨骼肌中MyoD1增强子的研究进展。基因工程学报,2012;26(24):2763-79。
孟加,E, Ransone L, Scharfmann R, Dwarki VJ, Tapscott SJ, Weintraub H,等。c-Jun和MyoD蛋白之间的功能拮抗:一种直接的物理联系。细胞。1992;68(3):507 - 19所示。
张志刚,张志刚,张志刚,张志刚,张志刚。肌源性分化的初步研究。基因开发,2005;19(5):553-69。
曹勇,姚震,Sarkar D, Lawrence M, Sanchez GJ, Parker MH,等。骨骼肌细胞的全基因组MyoD结合:广泛细胞重编程的潜力。生物工程学报。2010;18(4):662-74。
Umansky KB, Feldmesser E, Groner Y.原代成肌细胞的全基因组转录谱揭示了runx1调控基因在肌肉再生中的作用。基因组学数据。2015;6:120-2。
王旭,Blagden C, Fan J, Nowak SJ, Taniuchi I, Littman DR,等。Runx1可以防止骨骼肌的消瘦、肌纤维紊乱和自噬。基因开发,2005;19(14):1715-22。
Umansky KB, Gruenbaum-Cohen Y, Tsoory M, Feldmesser E, Goldenberg D, Brenner O,等。在肌肉再生过程中,成肌细胞增殖需要Runx1转录因子。公共科学图书馆,2015;11(8):e1005457。
Molkentin JD, Black BL, Martin JF, Olson EN。MEF2和肌源性bHLH蛋白协同激活肌肉基因表达。细胞。1995;83(7):1125 - 36。
张晓东,李志强,张志强,等。一种普遍表达的转录因子的组织特异性剪接对于肌肉分化是必不可少的。基因开发,2013;27(11):1247-59。
Wales S, Hashemi S, Blais A, McDermott JC。心脏和骨骼肌中MEF2的全球靶基因分析揭示了p38MAPK-MEF2信号通路对DUSP6的新调控。中国生物医学工程学报,2014;42(18):11349-62。
许俊,许鹏旭。EYA1和SIX1在哺乳动物内耳中与SWI/SNF染色质重塑复合物和SOX2合作驱动神经元发育程序。自然科学进展。2012;29(4):344 - 344。
Ramachandran K, Senagolage MD, Sommars MA, Futtner CR, Omura Y, Allred AL,等。动态增强子控制骨骼肌的身份和重编程。公共科学图书馆。2019;17(10):e3000467。
张志刚,张志刚,张志刚,等。肌源性分化过程中表观遗传景观的全基因组重塑。中国科学(d辑),2011,26(3):344 - 344。
Blais A, van Oevelen CJC, on R, Acosta-Alvear D, dynacht BD.视网膜母细胞瘤肿瘤抑制蛋白依赖的组蛋白H3赖氨酸27甲基化与不可逆的细胞周期退出有关。中国生物医学工程学报,2007;29(4):339 - 339。
Miniou P, Tiziano D, Frugier T, Roblot N, Le Meur M, Melki J.基因靶向小鼠横纹肌谱系。核酸研究,1999;27(19):e27。
王晓明,王晓明,王晓明。甲状腺激素对骨骼肌SERCA基因表达的影响。生物科学通报2001;21(2):139-54。
邹泽诺,张志刚,张志刚。骨骼肌中GLUT4葡萄糖转运蛋白表达与葡萄糖转运的调控机制。物理学报,2005;183(1):43-58。
王志强,王志强,王志强。甲状腺激素对苹果酶合成的调节。双重组织特异性控制。中国生物化学杂志,1986;26(2):339 - 339。
李敏,何勇,龚德伟。甲状腺激素和其他解偶联蛋白的调节因子。中华临床医学杂志1999;23(增刊6):S56-9。
Desvergne B, Petty KJ, Nikodem VM。苹果酶甲状腺激素反应元件的功能表征及受体结合研究。中国生物化学杂志,2001;26(2):344 - 344。
Solanes G, Pedraza N, Calvo V, Vidal-Puig A, Lowell BB, Villarroya F.甲状腺激素通过近端启动子区甲状腺反应元件直接激活人和小鼠解偶联蛋白-3基因的表达。中国生物化学杂志,2005;36(3):344 - 344。
叶敏,刘安。Sox6在小鼠胚胎骨骼肌正常纤维类型分化中的作用。中国农业大学学报。2007;36(8):344 - 344。
李文杰,李志强,李志强,陈志强,Kögler李志强,等。钙调磷酸酶-2缺乏通过钙调神经磷酸酶/NFAT激活增加小鼠的运动能力。《临床投资杂志》,2008;29(11):359。
弗雷,理查森JA,奥尔森EN。肌钙调神经磷酸酶结合蛋白的一个新家族。自然科学进展,2000;29(3):344 - 344。
Tavares ALP, Jourdeuil K, Neilson KM, Majumdar HD, Moody SA。Sobp调节Six1靶基因的转录激活,在颅面发育过程中是必需的。生物工程学报,2011;29(3):374 - 374。
López-Ríos J, Tessmar K, Loosli F, Wittbrodt J, Bovolenta P. Six3和Six6活性由groucho家族成员调节。发展。2003;130(1):185 - 95。
徐娟,李娟,张涛,姜辉,Ramakrishnan A, Fritzsch B,等。染色质重塑因子和谱系特异性因子与目标增强子相互作用,在耳部外胚层内建立原神经感觉命运。中国科学院学报(自然科学版),2011;29(12):379 - 379。
Ohto H, Kamada S, Tago K,富永S- i,尾崎H,佐藤S,等。通过eya的核易位,six与eya合作激活其靶基因。分子生物学杂志,1999;19(10):6815-24。
池田K, Watanabe Y, Ohto H, Kawakami K.通过CREB结合蛋白介导Six, Eya和Dach蛋白的分子相互作用和启动子的协同激活。分子生物学杂志,2002;22(19):6759-66。
徐鹏霞,郑伟,Laclef C, Maire P, Maas RL, Peters H,等。Eya1是哺乳动物胸腺、甲状旁腺和甲状腺形态发生所必需的。发展。2002;129(13):3033 - 44。
GTEx财团。基因型组织表达(GTEx)项目。中国科学,2013;45(6):580-5。
Luongo C, Butruille L, Sébillot A, Le Blay K, Schwaninger M, Heuer H,等。甲状腺激素转运蛋白MCT8和OATP1C1的缺失损害了成年小鼠脑室下区神经干细胞的命运。干细胞报告2021;16(2):337-53。
Mayerl S, Heuer H, french- constant C.海马神经发生需要细胞自主甲状腺激素信号。干细胞研究2020;14(5):845-60。
Mariotta L, Ramadan T, Singer D, Guetg A, Herzog B, Stoeger C,等。t型氨基酸转运体TAT1 (Slc16a10)是控制细胞外芳香族氨基酸稳态所必需的。中国生物医学工程学报,2012;29(4):529 - 529。
Müller J, Mayerl S, Visser TJ, Darras VM, Boelen A, Frappart L,等。Mct10和Mct8缺乏症患者甲状腺激素稳态的组织特异性改变内分泌学。2014;155(1):315 - 25所示。
Seko D, Ogawa S, Li T-S, Taimura, Ono Y. μ- crystin通过甲状腺激素作用控制肌肉功能。中国生物医学工程学报。2016;30(5):1733-40。
张勇,刘涛,梅耶,Eeckhoute J, Johnson DS, Bernstein BE,等。基于模型的ChIP-Seq (MACS)分析。中国生物工程学报。2008;9(9):R137。
Nakato R, Shirahige K.使用链移剖面对ChIP-seq读分布进行敏感和可靠的评估。中国生物医学工程学报,2018;34(14):2356-63。
Salmon-Divon M, Dvinge H, Tammoja K, Bertone P. PeakAnalyzer:染色质结合和修饰位点的全基因组注释。BMC生物信息学。2010;11:415。
于刚,王立国,何启勇。ChIPseeker:用于ChIP峰值注释、比较和可视化的R/Bioconductor包。生物信息学学报。2015;31(14):2382-3。
陈松,周勇,陈勇,顾杰。fastp:一种超快一体化FASTQ预处理器。中国生物医学工程学报,2018;34(17):i884-90。
杜宾A, Davis CA, Schlesinger F, Drenkow J, Zaleski C, Jha S,等。STAR:超快通用RNA-seq对准器。生物信息学学报,2013;29(1):15-21。
皮卡德工具-由Broad研究所[互联网]。[引2020年2月24日]。可以从:http://broadinstitute.github.io/picard/index.html
Ramírez F, Ryan DP, Grüning B, Bhardwaj V, Kilpert F, Richter AS,等。deepTools2:用于深度测序数据分析的下一代web服务器。核酸研究,2016;44(W1): W160-5。
Huber W, Carey VJ, Gentleman R, Anders S, Carlson M, Carvalho BS,等。利用Bioconductor进行高通量基因组分析。光子学报。2015;12(2):115-21。
Gel B, Serra E. karyoploteR:一个R/Bioconductor包,用于绘制可定制的基因组,显示任意数据。中国生物医学工程学报,2017;33(19):3088-90。
Nystrom S.模因:母题匹配,比较,和从头发现使用模因套件[互联网]。Bioconductor版本:Release (3.13);2021年[引用于2021年10月10日]。可以从:https://bioconductor.org/packages/memes/
贝利TL. STREME:精确和通用序列母题发现。中国生物医学工程学报,2015;26(3):344 - 344。
Fornes O, Castro-Mondragon JA, Khan A, van der Lee R, Zhang X, Richmond PA,等。JASPAR 2020:更新转录因子结合谱开放获取数据库。Nucleic Acids res 2020;48(D1): D87-92。
李志强,李志强,李志强。量化主题之间的相似性。中国生物工程学报。2007;8(2):R24。
Motif富集分析:ChIP数据的统一框架和评价。BMC生物信息学。2010;11:165。
刘志强,李志强,李志强,等。基因本体富集分析方法研究进展[j]。Bioconductor版本:Release (3.13);2021年[引用于2021年10月10日]。可以从:https://bioconductor.org/packages/topGO/
Benjamini Y, Hochberg Y.控制错误发现率:一种实用而强大的多重测试方法。中国生物医学工程学报。2001;26(1):1 - 7。
Carvalho BS, Irizarry RA。寡核苷酸微阵列预处理框架。中国生物医学工程学报。2010;26(19):2363-7。
李丽娟,吴东,李志刚,等。rna测序和微阵列技术的研究进展。核酸工程学报,2015;43(7):e47。
廖勇,史伟。featurets:一种高效的通用程序,用于分配序列读取基因组特征。生物信息学学报,2014;30(7):923-30。
Love MI, Huber W, Anders S.用DESeq2调节RNA-seq数据的折叠变化和分散估计。中国生物医学工程学报。2014;15(12):550。
CRAN -包地图[互联网]。[引2021年8月19日]。可以从:https://cran.r-project.org/web/packages/pheatmap/index.html
Robinson MD, McCarthy DJ, Smyth GK。edgeR:用于数字基因表达数据差异表达分析的Bioconductor包。生物信息学学报,2010;26(1):139-40。
李志强,李志强,李志强,等。RNA-seq数据规范化的研究。中国生物工程学报。2014;32(9):896-902。
于刚,王立国,韩勇,何启勇。clusterProfiler:一个R包,用于比较基因集群之间的生物学主题。中国生物医学杂志,2012;16(5):284-7。
McMahon JM, Signori E, Wells KE, Fazio VM, Wells DJ。通过透明质酸酶预处理优化质粒电转移到骨骼肌-增加表达,减少肌肉损伤。《科学》2001;8(16):1264-70。
van Mullem AA, van Gucht ALM, Visser WE, Meima ME, peters RP, Visser TJ。甲状腺激素转运蛋白MCT8和MCT10对T3核活性的影响Mol Cell Endocrinol. 2016; 437:252-60。
鲍杰,穆勒A,朱德威克MJ,范迪尔ED, Kaptein E, Saba A,等。心肌梗死后左心室重构与心肌细胞特异性甲状腺功能减退相关。内分泌学。2011;152(2):669 - 79。
Vandesompele J, De Preter K, Pattyn F, Poppe B, Van Roy N, De Paepe A,等。多个内控基因几何平均实时定量RT-PCR数据的精确归一化。中国生物医学工程学报,2002;3(7):RESEARCH0034。
Kassambara A. rstatix:用于基本统计测试的管道友好框架[Internet]。2021年[引自2021年8月25日]。可以从:https://CRAN.R-project.org/package=rstatix
确认
作者要感谢以下个人或团体的贡献:Sarah Hemens和Jack Guthrie的实验协助;渥太华大学动物护理和兽医服务的工作人员提供技术援助;麦吉尔大学和Génome Québec创新中心的ChIP-seq文库制备和高通量测序;加拿大计算和技术人员的高性能计算访问和支持;Warner Simonides(阿姆斯特丹,荷兰)的TRE报告质粒。由M. Klymkowsky开发的E7抗β -微管蛋白杂交瘤从发育研究杂交瘤库获得,由NIH NICHD创建,并保存在爱荷华大学生物系,爱荷华市,IA 52242。作者感谢加拿大卫生研究所的财政支持。
资金
这项工作是由加拿大卫生研究所的运营拨款(MOP 119458)支持给a . B.资助者在研究的设计、数据收集、分析、数据解释或撰写手稿中没有任何作用。
作者信息
作者及隶属关系
贡献
AB设计了这项研究,获得了资金,进行了基因组学实验,分析了数据,并撰写了手稿。JG进行实验并分析数据,DY进行实验,YL和IC进行实验并分析数据。所有作者都阅读、编辑并批准了最终的手稿。
相应的作者
道德声明
伦理批准并同意参与
手术过程遵守渥太华大学动物护理和使用委员会、加拿大动物护理委员会指南和动物研究法案。
发表同意书
不适用。
相互竞争的利益
作者宣称他们之间没有利益冲突。
额外的信息
出版商的注意
伟德体育在线施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
补充信息
附加文件1:图S1
.Six1 ChIP-seq结果分析。A) Six1目标位点的例子,显示Six1 ChIP-seq读覆盖MB和MTMyod1核心增强子区(CER)为蓝色,远端调控区(DRR)为绿色。覆盖率显示归一化为每个库中的每百万计数,并表示为ChIP和输入样本之间的差异,以10个碱基对为单位计算。阴性对照兔IgG ChIP-seq样品的覆盖轨迹也显示出来。对于每个基因组位点,所有三个轨道显示在相同的规模。B) Six1结合位点的ChIP-seq覆盖,分为三组:仅由Six1结合的MB(绿色),MB和MT(米色)或仅由MT(橙色)结合。覆盖范围显示在以Six1绑定位点中心为中心的5 kb窗口中。对于同一组区域,也涵盖了来自指示研究的其他基因组学数据集:Umansky等。在原代成肌细胞中检测c-Jun、MyoD和Runx1的ChIP-seq (73), Asp等人和Blum等人在C2C12 MB和MT中标记ChIP-seq (69,81), Barish等人在骨骼肌组(腓骨肌和比目鱼)中标记组蛋白和ATAC-seq信号(80)。对于所使用的每个抗体(每个TF或标记),热图颜色和平均图规模都被保留,以便可以直接进行比较。
附加文件3:Table_S1
.Six1_1MB_peaks mm9轮回。
附加文件4:Table_S2
.Six1_1MT_peaks mm9轮回。
附加文件5:Table_S3
.Six1_1MB_peaks .annotated (mm9)。
附加文件6:Table_S4
.Six1_1MT_peaks .annotated (mm9)。
附加文件7:Table_S5
.Expression_profiling_cluster_genes。
附加文件8:Table_S6
.Primers。
附加文件9:Table_S7
.Expression_profiling_numeric_data。
附加文件10。
Code_S1。
附加文件11。
Code_S2。
附加文件12。
Code_S3。
附加文件13。
Code_S4。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条所提供的资料,除非在资料的信用额度中另有说明。
关于本文
引用本文
Girgis, J., Yang, D., Chakroun, I.。et al。Six1通过调控MCT10转运体促进骨骼肌甲状腺激素反应。骨骼肌11, 26(2021)。https://doi.org/10.1186/s13395-021-00281-6
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s13395-021-00281-6