- 研究gydF4y2Ba
- 开放获取gydF4y2Ba
- 发表:gydF4y2Ba
随着年龄的增长,卫星细胞数量和再生潜力的保存揭示了运动肌肉的偏倚gydF4y2Ba
骨骼肌gydF4y2Ba体积gydF4y2Ba11gydF4y2Ba,文章号:gydF4y2Ba22gydF4y2Ba(gydF4y2Ba2021gydF4y2Ba)gydF4y2Ba
摘要gydF4y2Ba
背景gydF4y2Ba
尽管肌肉再生能力随着年龄的增长而下降,但这在多大程度上是由于卫星细胞的内在变化和环境变化引起的一直存在争议。大多数关于衰老的研究都是在笼养的久坐小鼠身上研究后肢运动肌肉,主要是胫骨前肌,这些肌肉锻炼不足。gydF4y2Ba
方法gydF4y2Ba
我们分析了代表年轻和2岁小鼠运动和非运动肌肉的8个肌肉群的卫星细胞数量,并对来自年轻和老年小鼠的低数量后肢卫星细胞进行移植分析。gydF4y2Ba
结果gydF4y2Ba
我们发现,在大多数肌肉中,卫星细胞密度在2岁时并没有显著下降,其中一块肌肉,咬肌,随着年龄的增长,卫星细胞密度显示出适度但具有统计学意义的增加。胫骨前肌和指长伸肌明显例外,表现出明显的下降。我们使用移植试验来量化自我更新。剂量稀释显示在一个非常低的阈值之上的自我更新具有显著的非线性,这表明卫星细胞之间在池内争夺空间。在线性范围内进行分析,即移植少于1000个细胞,没有证据显示2岁小鼠卫星细胞的细胞自主自我更新或再生潜力下降。gydF4y2Ba
结论gydF4y2Ba
这些数据证明了对比肌肉分析的价值,而不是过度依赖运动肌肉,这在衰老的久坐小鼠中没有生理学上的使用,并表明随着年龄增长的自我更新损伤是在老年阶段突然获得的,而不是像以前认为的那样随着时间的推移逐渐发生。gydF4y2Ba
背景gydF4y2Ba
骨骼肌是一种高度再生的组织。终身的再生能力取决于一群卫星细胞,这些卫星细胞位于肌纤维的外围,但位于其基板之下。gydF4y2Ba1gydF4y2Ba].卫星细胞对损伤的反应是增殖,产生成肌细胞池,这些成肌细胞池将融合形成新的肌肉纤维,以及替代细胞以维持干细胞池[gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba4gydF4y2Ba],这一过程被称为自我更新[gydF4y2Ba5gydF4y2Ba].虽然卫星细胞的再生特性正在深入研究中,但关于卫星细胞室调节的基本问题仍然存在,例如,每块肌肉的卫星细胞数量是多少。gydF4y2Ba
骨骼肌质量和损伤后肌肉再生潜力都随着年龄的增长而下降;然而,卫星细胞内在变化在这些衰退中的作用一直存在争议。许多研究小组都记录了小鼠卫星细胞数量与年龄相关的下降[gydF4y2Ba6gydF4y2Ba,gydF4y2Ba7gydF4y2Ba,gydF4y2Ba8gydF4y2Ba,gydF4y2Ba9gydF4y2Ba,gydF4y2Ba10gydF4y2Ba,gydF4y2Ba11gydF4y2Ba,gydF4y2Ba12gydF4y2Ba].一些研究小组没有发现明显的减少[gydF4y2Ba13gydF4y2Ba]或没有变化[gydF4y2Ba14gydF4y2Ba].Pax7在卫星细胞中选择性表达,并被它们的维持所需要[gydF4y2Ba15gydF4y2Ba];因此,在这些研究中,卫星细胞数量(通常来自运动肌肉)通过计算代表性肌肉切片或代表性孤立单个肌纤维中的Pax7+细胞数量来量化,并根据每块肌肉的估计切片或纤维数量进行外推。我们认为,也许这种不一致的部分原因是通过从子集进行外推来量化的方法中固有的抽样偏差,以及外推的系统错误的可能性。因此,在目前的研究中,我们调查了年轻人各种运动肌肉和非运动肌肉的卫星细胞数量gydF4y2Bavs。gydF4y2Ba使用Pax7- zsgreen BAC转基因菌株的流式细胞术,使用整体方法计数特定肌肉中存在的所有Pax7+细胞,其中卫星细胞被标记为绿色荧光[gydF4y2Ba16gydF4y2Ba].gydF4y2Ba
关于衰老的影响主要是通过卫星细胞或其环境的改变介导的,文献也包含了显著的不一致。有报告表明,随着年龄的增长,卫星细胞池的固有再生潜力正在受损[gydF4y2Ba12gydF4y2Ba,gydF4y2Ba17gydF4y2Ba,gydF4y2Ba18gydF4y2Ba,gydF4y2Ba19gydF4y2Ba].另有研究认为,虽然衰老肌肉中的卫星细胞数量减少,但卫星细胞的内在成肌潜能和自我更新能力并未改变[gydF4y2Ba11gydF4y2Ba],年龄较大的供体卫星细胞与年轻供体的卫星细胞功能相同[gydF4y2Ba8gydF4y2Ba,gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba21gydF4y2Ba,gydF4y2Ba22gydF4y2Ba],以及环境因素而非细胞内在变化是导致衰老动物再生能力受损的原因[gydF4y2Ba7gydF4y2Ba,gydF4y2Ba14gydF4y2Ba,gydF4y2Ba23gydF4y2Ba,gydF4y2Ba24gydF4y2Ba,gydF4y2Ba25gydF4y2Ba,gydF4y2Ba26gydF4y2Ba,gydF4y2Ba27gydF4y2Ba,gydF4y2Ba28gydF4y2Ba].gydF4y2Ba
为了测量卫星细胞群的内在自我更新和分化潜力,我们采用了两臂移植试验,其中一定数量的卫星细胞同时移植到具有免疫缺陷、肌营养不良蛋白缺陷NSG-mdx的胫骨前肌(TA)gydF4y2Ba4的简历gydF4y2Ba[gydF4y2Ba29gydF4y2Ba受体小鼠。一个肢体用于FACS计算移植后1个月未分化(ZsGreen+)卫星细胞的数量,为自我更新或对卫星细胞池的贡献能力提供定量值,而另一个肢体用于组织学计算营养不良蛋白+纤维,为供体细胞生成纤维的能力(分化潜力)提供定量值。我们应用这些实验来评估衰老背景下的自我更新和分化潜力。gydF4y2Ba
方法gydF4y2Ba
老鼠gydF4y2Ba
从Pax7-ZsGreen雄性小鼠中分离卫星细胞[gydF4y2Ba16gydF4y2Ba]将>杂交15代到C57BL/6背景或C57BL/6小鼠。接受移植的人gydF4y2BaNSG-mdxgydF4y2Ba4的简历gydF4y2Ba老鼠(gydF4y2Ba29gydF4y2Ba].野生型C57BL/6小鼠来源于美国国家老龄研究所老龄鼠群。所有程序都按照明尼苏达大学动物护理和使用委员会批准的协议进行。gydF4y2Ba
小鼠卫星细胞收获gydF4y2Ba
卫星单元的批量分离如前所述[gydF4y2Ba29gydF4y2Ba,gydF4y2Ba30.gydF4y2Ba].肌肉被仔细解剖。用刀片平行于肌肉纤维,用镊子分离纤维。肌肉在0.2%胶原酶II型(Gibco, Grand Island, NY)的高葡萄糖Dulbecco 's modified Eagle 's medium (DMEM)中摇75分钟,DMEM中含有4.00 mM L-谷氨酰胺4500 mg/L葡萄糖,丙酮酸钠(HyClone, Logan, UT),添加1% Pen/Strep (Gibco), 37℃。样品用漂洗液(F-10+)、Ham’s/F-10培养基(HyClone)补充10%马血清(HyClone)、1% 1 M HEPES缓冲液(Gibco)和1% Pen/Strep洗涤两次,并将其拉入剪切的巴斯德移液器中。样品被离心并再次洗涤。抽吸后,样品在含II型胶原酶和散酶(Gibco)的F-10+中重悬,进行漩涡处理,并在37°C震动孵卵30分钟。再次进行漩涡处理,用16号针将样品抽出并释放到10ml注射器中4次,然后用18号针将样品释放4次,使细胞悬浮液通过40 μm细胞过滤器(Falcon, Hanover Park, IL)。用18号针抽取、释放样品到10ml注射器中4次,并通过新的40 μm细胞过滤器。离心后,样品重悬在荧光激活细胞分选(FACS)染色介质中:含2%胎牛血清(HyClone)和0.5 μg/mL碘化丙啶的磷酸盐缓冲盐水(PBS, Corning, Manassas, VA),用于FACSAriaII (BD Biosciences, San Diego, CA)上的FACS分析和分选。gydF4y2Ba
来自单个肌肉群的卫星细胞的定量也同样进行。消化后的肌肉样本被抽出并通过16号针喷射到3毫升注射器中4次,然后通过18号针喷射4次。细胞悬浮液通过40 μm细胞过滤器。为防止过度消化,每个样品中加入3毫升F10+,离心后重悬于FACS染色培养基中。对于移植的TAs,使用PE- cy7大鼠抗小鼠CD31(克隆390)、PE- cy7大鼠抗小鼠CD45(克隆30-F11)、生物素大鼠抗小鼠CD106(克隆429(MVCAM.A))、BD生物科学公司(圣地亚哥,CA)的PE Streptavidin和AbLab公司(加拿大温哥华,bc . c)的Itga7 647(克隆R2F2)的混合抗体对样本进行染色。供体(ZsGreen +)卫星细胞数和总卫星细胞数(谱系阴性;VCAM (Itga7双阳性细胞)通过FACS测定整个体积并记录所有事件。gydF4y2Ba
用于FACS分析的抗体gydF4y2Ba
为了进一步鉴定卫星细胞,我们对谱系阴性进行染色;CXCR4和Itgb1双阳性细胞。来自eBioscience (San Diego, CA)的PE-Cy7抗小鼠TER-119(克隆TER-119)、APC抗小鼠/大鼠CD29(克隆eBioHMb1-1)和PE-Cy7抗小鼠Ly6A/E (Sca-1)(克隆D7);来自BD Biosciences抗体的PE-Cy7大鼠抗小鼠CD11b(克隆M1/70)、PE-Cy7 CD45和Biotin大鼠抗小鼠CD184与样品在冰上孵育1小时。此外,我们对谱系阴性进行染色;CD34, Itga7双阳性细胞。PE- cy7大鼠抗小鼠CD11b(克隆M1/70)、PE- cy7抗小鼠Ly6A/E(克隆D7)、生物素抗小鼠CD34(克隆RAM34) (eBioscience (San Diego, CA)和Itga7 PE(克隆R2F2) (AbLab (Vancouver, B.C, Canada))抗体在冰上孵育1小时。孵育后,用FACS染色液清洗和重悬样品。PE或APC偶联链霉亲和素试剂分别在冰上孵育20分钟。清洗样品,用FACS染色液重悬进行FACS分析。gydF4y2Ba
流式细胞计数gydF4y2Ba
为了定量卫星细胞,除腓肠肌和膈肌细胞重悬于400 μL的FACS染色培养基中外,个别肌肉细胞重悬于200 μL的FACS染色培养基中,以保持总细胞浓度相似。样品在BD FACS Aria II上用红色(641 nm)、蓝色(488 nm)和黄绿色(561 nm)激光完全耗尽。将碘化丙啶阴性(活)细胞送入任一SSCgydF4y2Bavs。gydF4y2BaZsGreen用于未染色样品,或用于染色样品:APC (Itga7)gydF4y2Bavs。gydF4y2BaPE-Cy7 (Lin),门控Lin阴性细胞进入APC (Itga7)gydF4y2Bavs。gydF4y2BaPE (VCAM),门控双阳性细胞进入SSCgydF4y2Bavs。gydF4y2BaZsGreen,计数ZsGreen+细胞,如图所示。gydF4y2Ba2gydF4y2Bab。gydF4y2Ba
Pax7疣状gydF4y2Ba
将载玻片用4%多聚甲醛(PFA)在室温下固定5分钟,风干,用PBS再水化5分钟,然后用高压锅在柠檬酸缓冲液(1.8 mM柠檬酸和8.2 mM柠檬酸钠水溶液)中提取抗原。玻片在科普林瓶中煮沸30分钟,然后用冷自来水冲洗10分钟,用PBS冲洗两次,每次5分钟。抗原提取后,切片用指甲油圈出,晾干,然后用3% H孵育gydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba在PBS中浸泡5分钟,用PBS冲洗两次,每次5分钟。用0.5% PerkinElmer阻断试剂(Cat # FP1020)在PBS中阻断切片,RT下1小时,然后在4°C下用一抗、来自发育研究杂交瘤库的小鼠抗小鼠Pax7和阻断缓冲液中的多克隆兔抗小鼠层粘连蛋白(Sigma-Aldrich L9393)孵育过夜。次级鸡尾酒,山羊抗小鼠IgG1生物素(Jackson Immunoresearch Cat# 115-065-205),和山羊抗兔IgG H&L Alexa Fluor 488 (Sigma-Aldrich。Cat # A11034)在阻塞缓冲液中静置2小时。PBS洗涤2次后,载片用vecastain ABC试剂(Vectorlab Cat # PK-6100)孵育3小时,然后PBS洗涤。最后,将载玻片用Tyramide信号放大剂(TSA Cyanine 3 Cat # NEL744)在堵塞缓冲液中在黑暗中孵育10分钟,用PBS冲洗,用DAPI抗褪色延长金安装。gydF4y2Ba
肌肉损伤与移植gydF4y2Ba
如前所述[gydF4y2Ba29gydF4y2Ba],肌内细胞移植前48小时,约4个月gydF4y2BaNSG-mdxgydF4y2Ba4的简历gydF4y2Ba用氯胺酮和甲苯嗪麻醉小鼠,并用RS 2000生物研究辐照器(Rad Source Technologies, Inc., Suwanee, GA)对小鼠的双后肢进行1200 cGy剂量的照射。铅盾只暴露在后肢上。移植前24小时,用Hamilton注射器将15 μL心脏毒素(10 μL in PBS, Sigma, Saint Louis, MO)注射到每只小鼠的左右TAs中诱导损伤。24小时后,采用流式细胞仪收集规定数量的卫星细胞,并将其重悬在10 μL无菌生理盐水中,使每次注射的细胞数量达到指示数量。每只小鼠在每个TA中注射10 μL。移植后4周,每只小鼠收集一个移植TA,准备切片和染色,如前所述[gydF4y2Ba29gydF4y2Ba],而另一个移植TA制备如上所述的FACS分析。gydF4y2Ba
克隆形成试验gydF4y2Ba
通过FACS鉴定,将单个细胞分选到含有150 μL小鼠成肌细胞培养基的96孔板明胶包被孔中:DMEM/F-12培养基,不含l -谷氨酰胺(Cell Gro, Manassas, VA),含有20%胎牛血清(HyClone)、10%马血清(HyClone)、10 ng/mL人碱性成纤维细胞生长因子(R&D Systems, Minneapolis, MN)、1% Pen/Strep、1%谷氨酰胺(Gibco)和0.5%鸡胚胎提取物(US Biological, Swampscott, MA)。gydF4y2Ba
培养皿在5%氧生长条件下培养8天gydF4y2Ba2gydF4y2Ba, 5% cogydF4y2Ba2gydF4y2Ba, 90% ngydF4y2Ba2gydF4y2Ba)在组织培养箱中37°C。鉴定含有菌落的孔,用4%多聚甲醛在室温下固定20分钟。免疫染色时,用0.3% triton-X100在室温下渗透细胞20分钟,用PBS清洗一次,在室温下用3%牛血清白蛋白(BSA)在PBS中阻塞1小时。菌落用1:20稀释的MF 20抗体上清液(识别肌凝蛋白,来自爱荷华大学发育研究杂交瘤库)在3% BSA PBS中4℃过夜染色。用PBS冲洗三次,在室温下用1:500稀释的Alexa Fluor 555山羊抗小鼠二抗(Life Technologies)孵育45分钟。在室温下加入1:100稀释的4,6-二氨基-2-苯基吲哚(DAPI)在PBS中20分钟之前,用PBS额外清洗四次。在最后一次PBS清洗后,细胞被PBS覆盖。10倍放大的图像在蔡司观察者上拍摄。Z1倒置显微镜,配备AxioCam MRm摄像机(Thornwood, NY)。使用开源算法G-Tool [gydF4y2Ba31gydF4y2Ba].该软件用于确定卫星细胞集落中的核数和肌球蛋白重链(MHC)阳性细胞质中核的百分比。gydF4y2Ba
组织学和肌萎缩蛋白/层粘连蛋白免疫荧光gydF4y2Ba
TA被移除并放置在OCT化合物(Scigen Scientific, Gardena, CA)中,在液氮冷却的2-甲基丁烷(Sigma)中冷冻,并在−80°C保存。10微米的冷冻切片被切割在徕卡CM3050 S低温恒温器(徕卡微系统,布法罗格罗夫,IL)。冷冻切片用冰冷的丙酮固定,风干,用PBS再水化,用3%的BSA在PBS中堵塞1小时。在RT下用兔抗肌营养蛋白多克隆抗体(Abcam,剑桥,马萨诸塞州)和小鼠抗层粘连蛋白单克隆抗体(Sigma - clone LAM-89)孵育1小时后,切片在RT下用Alexa Fluor 555山羊抗兔抗体和Alexa Fluor 488山羊抗小鼠IgG抗体(Life Technologies, Grand Island, NY)孵育45分钟。封面安装了免疫mount (Thermo Scientific, Kalamazoo, MI)。玻片用蔡司Axio成像仪成像。M2带有AxioCam MRm相机(卡尔蔡司显微镜,LLC, Thornwood, NY)。使用Photoshop合并移植TAs的整个横截面平铺图像并手动计数纤维后,确定供体(抗肌萎缩蛋白+)和总(层粘连蛋白+)肌纤维的数量。gydF4y2Ba
TA肌的体外评价gydF4y2Ba
如前所述[gydF4y2Ba32gydF4y2Ba,gydF4y2Ba33gydF4y2Ba],小鼠腹腔注射Avertin (250 mg/kg)麻醉。用丝线将TA肌远端肌腱和膝关节连接到力传感器上。将TA肌肉转移到含有哺乳动物林格溶液(120.5 mM NaCl)的器官浴中;20.4 mM NaHCOgydF4y2Ba3.gydF4y2Ba;10 mM葡萄糖;4.8 mM KCl;1.6 mM aclgydF4y2Ba2gydF4y2Ba;1.2 mM MgSOgydF4y2Ba4gydF4y2Ba;1.2 mM NaH2POgydF4y2Ba4gydF4y2Ba;1.0 mM丙酮酸,调整到pH 7.4连续灌注95% OgydF4y2Ba2gydF4y2Ba/ 5% cogydF4y2Ba2gydF4y2Ba.孤立的TA肌肉通过在TA肌肉两侧纵向放置的两个铂电极之间产生的电场刺激(使用振幅为25 V,持续时间为0.2 ms, 150 Hz的方波脉冲)。肌肉保持在最佳长度(gydF4y2Ba罗gydF4y2Ba)测定等距抽搐力,两次刺激之间有5分钟的恢复期。最佳肌肉长度(gydF4y2Ba罗gydF4y2Ba)和刺激电压(25 V)是根据肌肉长度控制和一系列产生最大等距抽搐力的抽搐收缩来选择的。调整最佳肌肉长度后(gydF4y2Ba罗gydF4y2Ba),测量最大等距破伤风力,用肌肉质量(mg)除以肌肉长度(mm)与1.06 mg/mm的乘积计算总肌肉横截面积(CSA)gydF4y2Ba3.gydF4y2Ba,即哺乳动物骨骼肌密度。比力(gydF4y2Ba科幻小说gydF4y2Bao)然后通过归一化CSA的最大等距破伤风力计算。gydF4y2Ba
统计数据gydF4y2Ba
数据采用双尾分析gydF4y2BatgydF4y2Ba-测试并报告为带有标准误差的均值。差异被认为是显著的gydF4y2BaαgydF4y2Ba< 0.05的水平。gydF4y2Ba
结果gydF4y2Ba
8块肌肉的卫星细胞数量随年龄的变化gydF4y2Ba
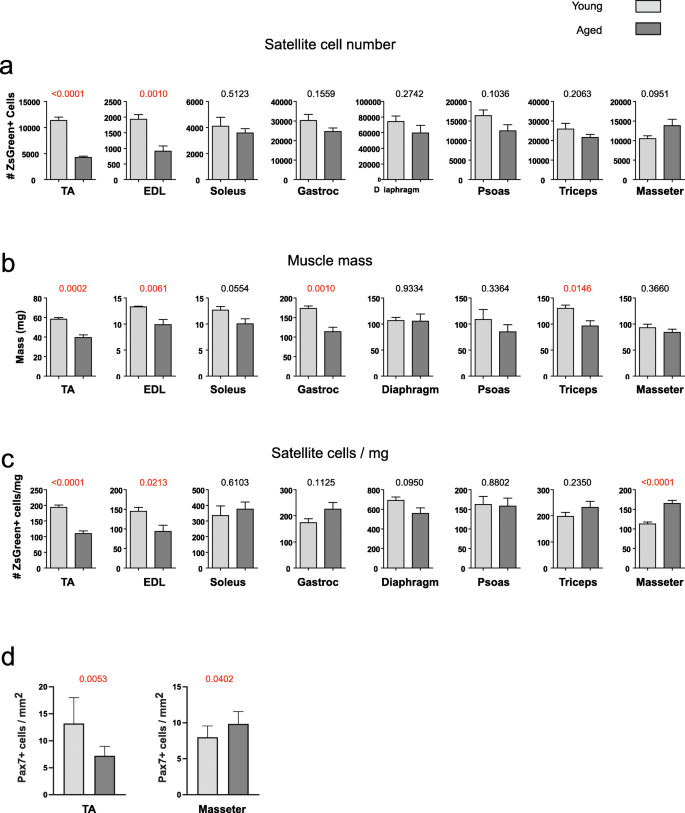
为了全面了解卫星细胞室的大小及其随年龄的变化,我们在年轻(4个月)和年老(2岁)雄性C57BL/6小鼠中研究了代表不同活动的8个肌肉群:运动、咀嚼和呼吸。gydF4y2Ba1gydF4y2Ba).重要的是,每一块肌肉经过处理后都没有残留组织,即每个细胞和纤维片段都被悬浮,样品被抽干,使整个肌肉消化通过流式细胞仪。用于4个月和2岁Pax7-ZsGreen小鼠不同肌肉群卫星细胞总数量化的代表性FACS配置文件显示在附加文件中gydF4y2Ba1gydF4y2Ba.在大多数肌肉中,两种卫星细胞数量(图。gydF4y2Ba1gydF4y2Baa)和肌肉量(图;gydF4y2Ba1gydF4y2BaB)在2岁时适度下降,并且一致。令人惊讶的是,咬肌的卫星细胞总数呈增加趋势(>增加25%,gydF4y2BapgydF4y2Ba< 0.0951,图;gydF4y2Ba1gydF4y2BaA)老年小鼠。只有两块肌肉,TA和EDL(指长伸肌)显示出卫星细胞数量的大幅下降,具有统计学意义,而其余肢体肌肉和膈肌显示出5%至20%的适度下降,但不具有统计学意义。我们研究了与年龄相关的肌肉质量损失、肌肉减少症,发现只有肢体肌肉的平均质量下降,TA、EDL、腓肠肌和三头肌明显减少(约35%),比目鱼和腰肌随年龄的增长呈下降趋势(图2)。gydF4y2Ba1gydF4y2Bab).值得注意的是,最过度的变化发生在运动肌肉中,考虑到笼内小鼠是久坐不动的,它们在实验室中的衰老可能不能反映正常条件下的衰老过程。当卫星细胞数归一化为肌肉质量以获得卫星细胞密度的测量时,在2岁的样本中,只有TA和EDL显示出显著下降,而膈肌呈下降趋势(gydF4y2BapgydF4y2Ba= 0.1)(图gydF4y2Ba1gydF4y2Bac).比目鱼和腰肌样本中未观察到卫星细胞密度的变化;腓肠肌和肱三头肌的密度随年龄增加而增加,值得注意的是,卫星细胞密度显著增加(gydF4y2BapgydF4y2Ba<0.0001)。gydF4y2Ba1gydF4y2Bac)。gydF4y2Ba
为了验证老龄小鼠咬肌卫星细胞数量增加这一意外发现,我们对来自另一个机构的3个月和22个月野生型小鼠的TA和咬肌进行了独立检测(Pax7和层粘胶蛋白免疫组化染色)(附加文件)gydF4y2Ba2gydF4y2Ba).该队列中Pax7免疫染色再次显示咬肌卫星细胞密度随年龄增长而增加,而TA肌卫星细胞密度下降(图2)。gydF4y2Ba1gydF4y2Bad)。gydF4y2Ba
衰老细胞与年轻细胞的体外克隆分析gydF4y2Ba
我们开始研究细胞自主功能差异,方法是评估两个年龄段每个肌群中单个细胞的集落形成潜力。克隆效率是细胞在体外存活、增殖和形成菌落能力的综合测量,在4个月到2岁之间,几乎每一块肌肉都显著下降,包括比目鱼、横隔膜和咬肌的强烈趋势(附加文件)gydF4y2Ba3.gydF4y2Baa).菌落大小在不同肌肉间的差异比年龄间的差异更显著,如前所述,隔膜卫星细胞的菌落最大[gydF4y2Ba31gydF4y2Ba].在腓肠肌、横膈膜、腰肌和肱三头肌中观察到随着年龄增长菌落大小显著下降,而在TA中观察到适度增加(附加文件)gydF4y2Ba3.gydF4y2Bab).大多数肌肉的分化率(MHC+细胞质中核的百分比)没有变化,但在TA、EDL和腰肌中随着年龄的增长显著降低(附加文件)gydF4y2Ba3.gydF4y2Bac)。gydF4y2Ba
检测体内的自我更新gydF4y2Ba
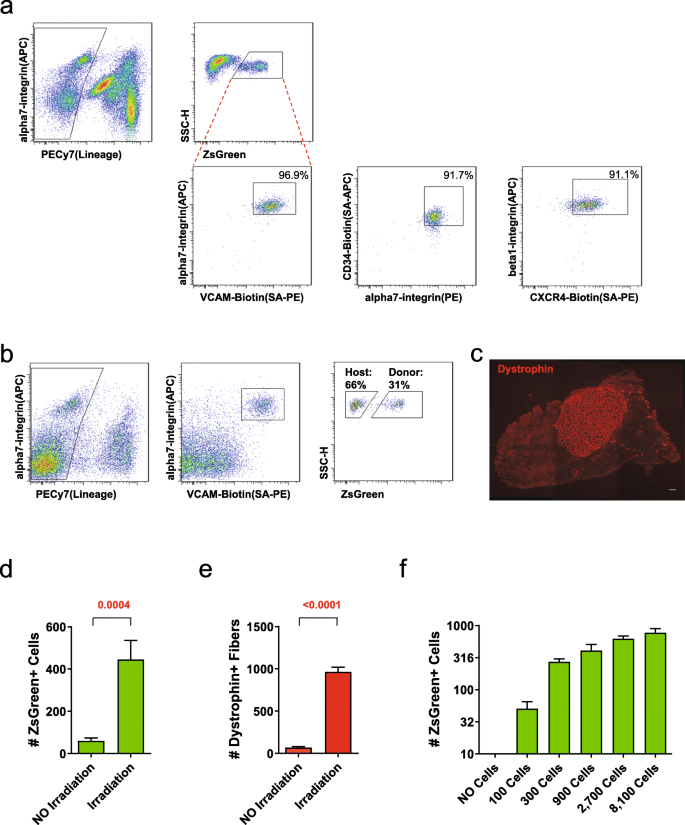
为了建立基于移植卫星细胞对植入肌肉干细胞室的贡献能力的自我更新的定量读数,我们首先评估了已被描述为定义该间隔的表面标记的年龄依赖性。对来自Pax7-ZsGreen/BL6小鼠的卫星细胞进行α 7-整合素(Itga7)和VCAM的评估[gydF4y2Ba34gydF4y2Ba,gydF4y2Ba35gydF4y2Ba];Itga7和CD34 [gydF4y2Ba4gydF4y2Ba];或beta1-integrin (Itgb1)和CXCR4 [gydF4y2Ba36gydF4y2Ba结合造血和内皮标志物的谱系阴性染色。我们观察到97%的ZsGreen+卫星细胞为Itga7/VCAM双阳性,91%的>为其他Itga7/CD34或Itgb1/CXCR4阳性。gydF4y2Ba2gydF4y2Baa).反向分析给出了相似的结果,>90%的双阳性(DP)细胞为ZsGreen+(附加文件gydF4y2Ba4gydF4y2Ba).接下来,我们研究了年老小鼠卫星细胞的表面标记是否发生了变化。ZsGreen+卫星细胞分离自2岁+ Pax7-ZsGreen小鼠(附加文件gydF4y2Ba5gydF4y2Ba)显示出与4个月大的小鼠相似的表面标记。对于下面涉及ZsGreen+细胞移植的研究,我们使用Itga7/VCAM来识别总的(宿主+供体)池。gydF4y2Ba
卫星细胞在体内的自我更新和分化。gydF4y2Ba一个gydF4y2Ba代表性的FACS档案显示ZsGreen+细胞系阴性的百分比,双阳性细胞的三种最常用的抗体识别卫星细胞(gydF4y2BangydF4y2Ba= 3)。gydF4y2BabgydF4y2Ba从移植肌肉中分离纯化卫星细胞的代表性FACS剖面。左边显示的是同源阴性门控(针对CD31和CD45,均为PE-Cy7偶联)。VCAM-1 (PE)、Itga7 (APC)的正门控显示在中间,Lin - VCAM+Itga7+群体中的ZsGreen显示在右侧。gydF4y2BacgydF4y2Ba代表性图像显示300个Pax7-ZsGreen细胞移植4周后Dystrophin(红色)的表达。比例尺为100 μm。gydF4y2BadgydF4y2Ba有或没有照射移植后ZsGreen+细胞数量的FACS定量。所示数据为平均值±SE (gydF4y2BangydF4y2Ba=12例移植TAs/组)。统计学比较采用双尾t检验。注意,辐照显著增强了对卫星细胞池的贡献。gydF4y2BaegydF4y2Ba在有/没有照射的情况下,移植后4周营养不良蛋白+纤维总数的定量。所示为平均值±SE (gydF4y2BangydF4y2Ba=12例移植TAs/组)。统计学比较采用双尾t检验。gydF4y2BafgydF4y2Ba不同数量ZsGreen+细胞移植4周后ZsGreen+细胞数量的定量。所示为平均值±SE (gydF4y2BangydF4y2Ba=6个移植的TAs)gydF4y2Ba
为了监测移植细胞群的自我更新和分化潜力,我们对免疫缺陷、营养不良蛋白缺陷NSG-mdx的TA肌肉进行了照射和损伤gydF4y2Ba4的简历gydF4y2Ba每只小鼠移植300个Pax7-ZsGreen细胞。15 μl心脏毒素注射可导致约40%的整个TA肌肉的破坏和再生(附加文件)gydF4y2Ba6gydF4y2Ba),为注入的卫星细胞提供足够的空间,促进细胞再生和自我更新。移植后1个月,双侧TA肌解剖;一组进行流式细胞仪检测,另一组进行组织学检测。FACS分析表明,Lin - VCAM+Itga7+卫星细胞池中存在供体ZsGreen+细胞亚群;因此,供体细胞的一部分后代有助于卫星细胞池的更新(图。gydF4y2Ba2gydF4y2Bab).组织学显示在另一个TA中有许多dystrophin+纤维,显示了移植细胞的分化潜力(图。gydF4y2Ba2gydF4y2Bac)。gydF4y2Ba
骨骼肌移植实验中经常加入辐照以钝化宿主卫星细胞的反应,导致纤维和相关卫星细胞的贡献更大[gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba21gydF4y2Ba].照射也导致供体干细胞及其子代细胞(成肌细胞)的广泛增殖[gydF4y2Ba37gydF4y2Ba].最近的研究表明,辐照肌肉内先天免疫系统的激活在增强供体卫星细胞植入中发挥作用[gydF4y2Ba38gydF4y2Ba].为了测量在我们的系统中照射的必要性,我们进行了300个细胞移植,有照射和没有照射,发现在没有照射的情况下,对卫星细胞池和新纤维的贡献都显著减少(分别为8倍和16倍,图。gydF4y2Ba2gydF4y2Bad, e)。gydF4y2Ba
辐射的影响暗示了卫星细胞之间为对再生后卫星细胞池的贡献而竞争的可能性,尽管这从未被正式证明过。要准确测定细胞群的内在自我更新潜力,需要对卫星细胞库的贡献不与供体细胞之间竞争的影响相混淆。为了确定这种测定方法是否以及如何用于读取内在的自我更新潜力,我们进行了一项剂量反应移植实验,从100个供体细胞开始,以3倍的步骤增加到8100个细胞(图2)。gydF4y2Ba2gydF4y2Baf).这揭示了细胞数在900及以上时的贡献存在严重的非线性,即300个细胞对100个细胞的贡献增幅接近300%,而900个细胞对300个细胞的贡献增幅仅为50%左右,2700个细胞的贡献增幅更小,以此类推。这表明了两个重要的点:首先,为了使贡献率的变化与自我更新率的变化线性相关,该分析需要在接近300个或更少的细胞数量上进行。在900个或更高的细胞中,自我更新的显著变化被解读为ZsGreen+细胞数量的微小变化。其次,供体细胞相互竞争,以争夺最容易到达的空间。为了避免内部竞争,移植细胞的数量需要小于可用的空间,因此我们在每块TA肌肉上使用300个细胞。gydF4y2Ba
老化至2年对C57BL/6卫星细胞的体内自我更新潜能无显著影响gydF4y2Ba
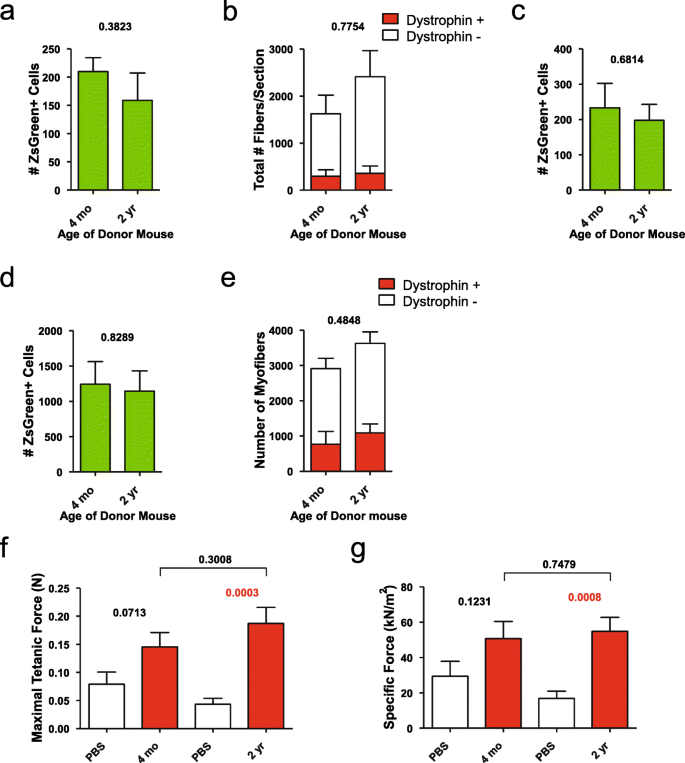
接下来,我们应用该方法来测量老年(2岁)卫星细胞的自我更新潜力。gydF4y2Bavs。gydF4y2Ba幼(4月龄)C57BL/6小鼠。我们首先测试了两种剂量,均在线性范围内:100和300个细胞进入辐照的、心脏毒素损伤的NSG-mdx4Cv小鼠(图2)。gydF4y2Ba3.gydF4y2Baa - c)。两种剂量在自我更新潜力和纤维分化潜力方面均未显示出统计学上的显著降低。这些少量的供体细胞并没有对移植肌肉的收缩功能产生可检测到的增加[gydF4y2Ba29gydF4y2Ba];因此,我们也进行了2700个细胞的移植。相似的自我更新和纤维分化潜力在这个细胞数量(图。gydF4y2Ba3.gydF4y2Bad, e),我们发现与旧细胞再生的TA肌的最大破伤风力或比力没有差异gydF4y2Bavs。gydF4y2Ba用年轻细胞再生TA肌肉(图。gydF4y2Ba3.gydF4y2Baf, g)。gydF4y2Ba
将4个月或2岁Pax7-ZsGreen小鼠的ZsGreen+细胞移植到辐照和心脏毒素损伤小鼠体内gydF4y2BaNSG-mdxgydF4y2Ba4的简历gydF4y2Ba老鼠。gydF4y2Ba一个gydF4y2Ba100个ZsGreen+细胞移植后4周采用流式细胞仪定量ZsGreen+细胞数量(gydF4y2BangydF4y2Ba= 4)。gydF4y2BabgydF4y2Ba肌萎缩蛋白+纤维数量的定量(gydF4y2BangydF4y2Ba=4), 100个ZsGreen+细胞移植后4周。gydF4y2BacgydF4y2BaZsGreen+细胞数量的定量(gydF4y2BangydF4y2Ba=6) 300个ZsGreen+细胞移植后。所示数据为平均值±标准差。统计比较采用双尾t检验。gydF4y2BadgydF4y2Ba2700个ZsGreen+细胞移植4周后ZsGreen+细胞数量的定量(gydF4y2BangydF4y2Ba= 4)。gydF4y2BaegydF4y2Ba2700个ZsGreen+细胞移植4周后肌萎缩蛋白+纤维数量(gydF4y2BangydF4y2Ba= 4)。gydF4y2BafgydF4y2Ba移植2700个ZsGreen+细胞4周后最大破伤风力(gydF4y2BangydF4y2Ba= 8)。gydF4y2BaggydF4y2Ba2700个ZsGreen+细胞移植后4周的比力测量(gydF4y2BangydF4y2Ba= 8)gydF4y2Ba
我们认为,因为我们的小鼠在生命周期中是久坐不动的,它们的肢体肌肉可能不能代表正在经历正常衰老的肌肉。因此,我们决定从一块经常使用的肌肉——隔膜中移植卫星细胞。900个从年轻或年老小鼠膈肌分离的ZsGreen+卫星细胞被移植到预处理的TAs中,这些TAs是在6周内收获的gydF4y2Ba7gydF4y2Baa, b)或15周(附加文件gydF4y2Ba7gydF4y2BaC, d,移植后。在两个时间点上都没有观察到自我更新或纤维贡献的显著差异,这与后肢肌肉卫星细胞的结果一致(上图)。gydF4y2Ba
讨论gydF4y2Ba
在本研究中,我们使用流式细胞术来量化单个肌肉中未分化的Pax7-ZsGreen+细胞的数量,这些细胞都是在老年人未经处理的肌肉中gydF4y2Bavs。gydF4y2Ba在移植的背景下,Pax7-ZsGreen报告基因既可以作为供体来源的指标,也可以作为未分化状态的指标。基于facs的方法非常有效;因此,我们能够量化衰老队列中研究的每只动物的8种不同肌肉的卫星细胞含量。与任何方法一样,基于facs的方法也有一些注意事项,主要是提取需要高效,并且可能受到ECM或纤维化程度的影响。由于老年肌肉中ECM含量较高,低效的提取可能会导致对老年标本细胞数量的低估。gydF4y2Ba
我们发现,少数肌肉群在2岁时卫星细胞的平均数量有统计学意义上的显著下降。例外的是TA和EDL,在2岁时经历了大幅(>50%)的统计学显著下降。使用其他方法,以前的研究已经量化了从EDL中新鲜分离的肌纤维中Pax7+细胞的数量[gydF4y2Ba8gydF4y2Ba,gydF4y2Ba9gydF4y2Ba,gydF4y2Ba11gydF4y2Ba,gydF4y2Ba22gydF4y2Ba,gydF4y2Ba39gydF4y2Ba],比目鱼[gydF4y2Ba39gydF4y2Ba],以及TA [gydF4y2Ba2gydF4y2Ba].与我们的结果一致,这些研究发现老年小鼠的TA和EDL肌肉中卫星细胞数量较低,这导致了该领域普遍接受的概念,即卫星细胞数量随着年龄的增长而显著下降。然而,考虑到更广泛的肌肉样本,现在很明显TA和EDL并不典型。这很不幸,因为这两块肌肉可能是老鼠系统中被研究最多的肌肉。此外,与年龄相关的肌肉质量损失在运动肌肉中更为极端,这是令人不安的,因为笼子里的老鼠不正常地久坐不动。它提出了一种可能性,即在笼鼠运动肌肉中,卫星细胞室的大小随着时间的推移而变化,可能由于长期缺乏正常使用而比衰老本身更极端。据报道,在老年大鼠进行耐力训练后,卫星细胞含量增加[gydF4y2Ba40gydF4y2Ba]和老鼠[gydF4y2Ba41gydF4y2Ba].经过8周的渐进式耐力训练后,运动组小鼠的TAs的卫星细胞明显多于久坐组[gydF4y2Ba42gydF4y2Ba].至少,这表明运动与笼中啮齿类动物运动肌肉中卫星细胞的损失有关。横膈肌和咬肌是在实验室条件下生理使用的肌肉,它们的质量不会随着年龄的增长而减少,只显示出非常温和的下降,或者在咬肌的情况下,卫星细胞数量有所增加。因此,我们的研究与卫星细胞数量随年龄逐渐下降的概念不一致,至少在2岁的雄性C57BL/6小鼠模型中不一致。gydF4y2Ba
在老年人中,观察到下肢肌肉质量损失更大,这可能是由于身体活动显著减少而造成的去训练效应[gydF4y2Ba43gydF4y2Ba].与年龄相关的肌肉质量损失在运动肌肉中更为极端。特别观察人类卫星细胞,它们在损伤性和非损伤性运动时的激活以及在废弃情况下的减少已被注意到(见[gydF4y2Ba44gydF4y2Ba]供审阅)。人类衰老导致II型肌肉纤维优先萎缩,II型纤维相关卫星细胞已被证明随着年龄的增长而衰退[gydF4y2Ba44gydF4y2Ba].最近一项对人类的纵向研究发现,女性在更年期时卫星细胞密度下降,这支持了一种观点,即老年人中与衰老相关的环境变化可能是某种程度上卫星细胞下降的原因[gydF4y2Ba26gydF4y2Ba].尽管不像笼中老鼠那样受到严重的限制,人类也相当久坐,看看正常使用的肌肉中卫星细胞相对稳定的稳态维持的概念是否适用于人类,将是很有趣的。gydF4y2Ba
比较年轻和年老的卫星细胞移植到受伤肌肉后对卫星细胞池的贡献能力,即测量自我更新潜力,我们发现4个月大和2岁大小鼠的后肢卫星细胞没有差异。虽然这一结果与原始卫星细胞老化文献一致[gydF4y2Ba8gydF4y2Ba,gydF4y2Ba11gydF4y2Ba,gydF4y2Ba14gydF4y2Ba,gydF4y2Ba23gydF4y2Ba],尽管如此,这还是有些令人惊讶,因为一些研究表明,内在的自我更新潜力会随着年龄的增长而下降[gydF4y2Ba12gydF4y2Ba,gydF4y2Ba17gydF4y2Ba,gydF4y2Ba18gydF4y2Ba,gydF4y2Ba19gydF4y2Ba].然而,对于上述一系列研究,有一些重要的区别需要指出。首先是其中一项研究[gydF4y2Ba12gydF4y2Ba]发现2.5岁的“老年”小鼠有显著下降,但大多数参数,包括移植后的再生,发现来自“老年”小鼠(2岁,典型的老年队列)的卫星细胞与来自年轻小鼠的细胞没有显著差异。这项研究表明,在2到2.5岁之间,许多卫星细胞开始衰老,这与非衰老细胞随着年龄增长而细胞内在自我更新潜力逐渐下降的模型截然不同。2年的差异不大,这项研究实际上与我们的结果一致,与早期文献的解释并不矛盾。在其他研究中,其中一项研究的结果来自于1万个细胞的移植[gydF4y2Ba19gydF4y2Ba],我们的剂量反应数据清楚地表明,这远远超出了线性范围;因此,这种差异可能更多地与空间竞争有关,而不是内在的自我更新。为了解决有多少空间可用于植入的问题,我们评估了注射15 μl心脏毒素的未辐照TA肌肉的再生,发现这个空间至少是TA的40%。肌纤维相关卫星细胞移植,再加上诱导的肌肉损伤,已被证明能植入整个TA [gydF4y2Ba45gydF4y2Ba].在Bernet和同事的研究中,进一步涉及竞争[gydF4y2Ba17gydF4y2Ba],受体小鼠不受辐射;因此,植入卫星细胞室的不同速率可能与竞争能力的内在差异有关,而不是自我更新本身。也有理由认为,衰老的速度可能与环境因素有关,因此,一些实验室的小鼠的卫星细胞比其他实验室的小鼠略早进入衰老、衰老倾向阶段。尽管如此,目前研究中提供的数据与这一概念是一致的,即直到最衰老的阶段,卫星细胞在自我更新或再生的内在能力方面几乎没有表现出与年龄相关的损失。gydF4y2Ba
结论gydF4y2Ba
这项工作提供了八个不同肌肉群的综合比较,并表明除了异常利用不足的运动肌肉外,在C57BL/6背景上老化到2岁并不涉及卫星细胞密度的逐渐下降。移植到免疫缺陷性营养不良小鼠的胫骨前肌后,移植的细胞有助于卫星细胞室和新生成的营养不良蛋白+肌纤维。随着年龄的增长,移植细胞产生新的卫星细胞或新的肌肉纤维的能力下降可以忽略不计。gydF4y2Ba
数据和材料的可用性gydF4y2Ba
本研究中使用和/或分析的数据集可根据合理要求从通讯作者处获得。gydF4y2Ba
缩写gydF4y2Ba
- BSA:gydF4y2Ba
-
牛血清白蛋白gydF4y2Ba
- cGy:gydF4y2Ba
-
cgy(厘戈瑞)gydF4y2Ba
- 客服人员:gydF4y2Ba
-
横截面积gydF4y2Ba
- DAPI:gydF4y2Ba
-
4, 6-Diamidino-2-phenylindolegydF4y2Ba
- DMEM:gydF4y2Ba
-
杜尔贝科改良的鹰牌中号gydF4y2Ba
- 联盟:gydF4y2Ba
-
指长伸肌gydF4y2Ba
- 流式细胞仪:gydF4y2Ba
-
荧光激活细胞分选gydF4y2Ba
- MHC:gydF4y2Ba
-
肌球蛋白重链gydF4y2Ba
- PBS:gydF4y2Ba
-
磷酸盐gydF4y2Ba
- 助教:gydF4y2Ba
-
胫骨前gydF4y2Ba
参考文献gydF4y2Ba
毛罗A.骨骼肌纤维卫星细胞。生物化学学报。1961;9(2):493-5。gydF4y2Bahttps://doi.org/10.1083/jcb.9.2.493gydF4y2Ba.gydF4y2Ba
Collins CA, Olsen I, Zammit PS, Heslop L, Petrie A, Partridge TA,等。干细胞功能、自我更新和成人肌肉卫星细胞生态位细胞的行为异质性。细胞。2005;122(2):289 - 301。gydF4y2Bahttps://doi.org/10.1016/j.cell.2005.05.010gydF4y2Ba.gydF4y2Ba
Montarras D, Morgan J, collins C, Relaix F, Zaffran S, Cumano A,等。骨骼肌再生卫星细胞的直接分离。科学(80-)。2005, 309(5743): 2064 - 7。gydF4y2Ba
萨科A,多约纳斯R,卡夫P,维特罗维奇S,布劳HM。单个移植肌肉干细胞的自我更新和扩增。大自然。2008;456(7221):502 - 6。gydF4y2Bahttps://doi.org/10.1038/nature07384gydF4y2Ba.gydF4y2Ba
克朗凯特EP,弗利德纳TM,邦德副总裁,罗伯逊JS。关于造血增殖系统的解剖学和生理学事实和假设。入:Stohlman F,编辑。细胞增殖的动力学。纽约:Grune & Stratton;1959.p .队。gydF4y2Ba
布拉克,H比尔索,休斯,SM。有证据表明,在小鼠年龄相关肌肉萎缩期间,卫星细胞减少有助于大纤维核数量的优先下降。中国生物医学工程学报,2005;29(4):529 - 529。gydF4y2Bahttps://doi.org/10.1242/jcs.02602gydF4y2Ba.gydF4y2Ba
查卡拉卡尔JV,琼斯KM,巴森MA,布拉克AS。老化的生态位破坏肌肉干细胞的静止。大自然。2012;490(7420):355 - 60。gydF4y2Bahttps://doi.org/10.1038/nature11438gydF4y2Ba.gydF4y2Ba
Collins CA, Zammit PS, Ruiz AP, Morgan JE, Partridge TA。骨骼肌干细胞:骨骼肌老化后仍能存活的肌源性干细胞群干细胞。2007;25(4):885-94。gydF4y2Bahttps://doi.org/10.1634/stemcells.2006-0372gydF4y2Ba.gydF4y2Ba
Day K, Shefer G, Shearer A, Yablonka-Reuveni Z.骨骼肌卫星细胞随着年龄的增长而耗竭,同时单个祖细胞产生储备子代的能力降低。中国生物医学工程学报。2010;40(2):330-43。gydF4y2Bahttps://doi.org/10.1016/j.ydbio.2010.01.006gydF4y2Ba.gydF4y2Ba
池本上泉M,上泉A,土田K,深田SI,山本H,山本N,等。胰岛素样生长因子- ii通过调节肌肉再生的自我强化机制改善与年龄相关的低效再生反应。中国生物医学工程学报。2015;33(8):2456-68。gydF4y2Bahttps://doi.org/10.1002/stem.2045gydF4y2Ba.gydF4y2Ba
Shefer G, Van de Mark DP, Richardson JB, Yablonka-Reuveni Z.卫星细胞池大小确实很重要:定义衰老骨骼肌的生肌能力。中国生物医学工程学报。2006;29(1):344 - 344。gydF4y2Bahttps://doi.org/10.1016/j.ydbio.2006.02.022gydF4y2Ba.gydF4y2Ba
Sousa-Victor P, Gutarra S, García-Prat L, Rodriguez-Ubreva J, Ortet L, Ruiz-Bonilla V,等。老年肌肉干细胞将可逆的静止转变为衰老。大自然。2014;506(7488):316 - 21所示。gydF4y2Bahttps://doi.org/10.1038/nature13013gydF4y2Ba.gydF4y2Ba
Schäfer R, Zweyer M, Knauf U, Mundegar RR, Wernig A. mdx和野生型小鼠比目鱼肌的个体发育。神经肌肉失调。2005;15(1):57-64。gydF4y2Bahttps://doi.org/10.1016/j.nmd.2004.09.011gydF4y2Ba.gydF4y2Ba
Conboy IH, Conboy MJ, Smythe GM, Rando TA。notch介导的衰老肌肉再生潜能的恢复。科学(80 -)。2003, 302(5650): 1575 - 7。gydF4y2Ba
Seale P, Sabourin LA, gir吉斯- gabardo A, Mansouri A, Gruss P, Rudnicki MA。Pax7是肌源性卫星细胞规范所必需的。细胞。2000;102(6):777 - 86。gydF4y2Bahttps://doi.org/10.1016/s0092 - 8674 (00) 00066 - 0gydF4y2Ba.gydF4y2Ba
波什纳科夫斯基D,徐震,李伟,Thet S, Cleaver O, Perlingeiro RCR,等。Pax7报告基因对骨骼肌干细胞的前瞻性分离干细胞。2008;26(12):3194-204。gydF4y2Bahttps://doi.org/10.1634/stemcells.2007-1017gydF4y2Ba.gydF4y2Ba
贝内特JD,多尔斯JD,霍尔JK,凯利田中K,卡特TA,奥尔温BB。P38 MAPK信号通路是老年小鼠骨骼肌干细胞自我更新的细胞自主丧失的基础。中华外科杂志,2014;20(3):265-71。gydF4y2Bahttps://doi.org/10.1038/nm.3465gydF4y2Ba.gydF4y2Ba
科斯格罗夫BD,吉尔伯特PM, Porpiglia E, Mourkioti F, Lee SP, Corbel SY,等。肌肉干细胞群的再生可以恢复受伤的老化肌肉的力量。中华外科杂志,2014;20(3):255-64。gydF4y2Bahttps://doi.org/10.1038/nm.3464gydF4y2Ba.gydF4y2Ba
Price FD, Von Maltzahn J, Bentzinger CF, Dumont NA, Yin H, Chang NC,等。抑制JAK-STAT信号通路刺激成人卫星细胞功能。中华外科杂志,2014;20(10):1174-81。gydF4y2Bahttps://doi.org/10.1038/nm.3655gydF4y2Ba.gydF4y2Ba
李志刚,李志刚,李志刚,李志刚。当宿主生态位保存而内源性卫星细胞失能时,供体卫星细胞的植入显著增加。中国生物医学工程杂志,2012;30(9):1971-84。gydF4y2Bahttps://doi.org/10.1002/stem.1158gydF4y2Ba.gydF4y2Ba
李志刚,李志刚,李志刚。成熟的成人营养不良小鼠肌肉环境不妨碍有效的植入卫星细胞再生和自我更新。干细胞。2009;27(10):2478-87。gydF4y2Bahttps://doi.org/10.1002/stem.162gydF4y2Ba.gydF4y2Ba
尼尔A,博尔德林L,摩根JE。雄性和雌性、发育中的和成年小鼠肌肉中的卫星细胞:用于生长和再生的不同干细胞。公共科学学报,2012;7(5):1-11。gydF4y2Ba
郭佳杰,郭志强,陈志强,等。衰老过程中Wnt信号的增加改变了肌肉干细胞的命运,增加了纤维化。科学(80 -)。317(5839): 807 - 2007; 10。gydF4y2Ba
Conboy IM, Conboy MJ, Wagers AJ, Girma ER, Weissman IL, Rando TA。通过暴露于年轻的系统环境使年老的祖细胞恢复活力。大自然。2005;433(2):760 - 4。gydF4y2Bahttps://doi.org/10.1038/nature03260gydF4y2Ba.gydF4y2Ba
卢克扬年科,郑俊杰,Hegde N, Perruisseau-Carrier C, Migliavacca E, Rozo M,等。衰老干细胞生态位中纤维连接蛋白的缺失影响小鼠骨骼肌的再生能力。中国医学杂志,2016;22(8):897-905。gydF4y2Bahttps://doi.org/10.1038/nm.4126gydF4y2Ba.gydF4y2Ba
Collins BC, Arpke RW, Larson AA, Baumann CW, Xie N, Cabelka CA,等。雌激素调节女性的卫星细胞室。2019;28(2): 368-81。gydF4y2Bahttps://doi.org/10.1016/j.celrep.2019.06.025gydF4y2Ba.gydF4y2Ba
卢克扬年科,卡拉兹,斯图尔萨茨,古里亚兰-罗德里格斯,米肖德,达蒙,等。衰老通过损害来自纤维脂肪形成祖细胞的基质细胞WISP1分泌来破坏肌肉干细胞功能。细胞干细胞,2019;24(3):433-446.e7。gydF4y2Bahttps://doi.org/10.1016/j.stem.2018.12.014gydF4y2Ba.gydF4y2Ba
尚敏,王志强,王志强,等。巨噬细胞来源的谷氨酰胺促进卫星细胞和肌肉再生。大自然。2020;587(7835):626 - 31所示。gydF4y2Bahttps://doi.org/10.1038/s41586-020-2857-9gydF4y2Ba.gydF4y2Ba
张勇,李志强,李志强,等。一种新的免疫,营养不良蛋白缺陷模型,NSG-mdx4Cv小鼠,为异基因卫星细胞移植后的功能改善提供了证据。干细胞,2013;31(8):1611-20。gydF4y2Bahttps://doi.org/10.1002/stem.1402gydF4y2Ba.gydF4y2Ba
Arpke RW, Kyba M.流式细胞术和基于移植的卫星细胞自我更新和分化定量分析。方法Mol生物学,2016;1460(1):163-79。gydF4y2Bahttps://doi.org/10.1007/978-1-4939-3810-0_12gydF4y2Ba.gydF4y2Ba
张军,张建军,张建军。G-Tool是一种通过集落形成实验量化肌肉生成的开放算法。骨骼肌。2012;2(13)。gydF4y2Bahttps://doi.org/10.1186/2044-5040-2-13gydF4y2Ba.gydF4y2Ba
Darabi R, Gehlbach K, Bachoo RM, Kamath S, Osawa M, Kamm KE,等。胚胎干细胞分化的功能性骨骼肌再生。中华外科杂志,2008;14(2):134-43。gydF4y2Bahttps://doi.org/10.1038/nm1705gydF4y2Ba.gydF4y2Ba
陈世凯,阿pke RW, Filareto A,谢宁,Pappas MP, Penaloza JS,等。骨骼肌干细胞具有功能性再生能力。细胞干细胞,2018;23(1):74-85.e6。gydF4y2Ba
布兰科博斯WE,姚CC,克莱默RH,布劳HM。基于α7整合素表达的小鼠原代成肌细胞的纯化中国农业科学,2001;26(2):344 - 344。gydF4y2Bahttps://doi.org/10.1006/excr.2001.5191gydF4y2Ba.gydF4y2Ba
深田S,上泉A,池本M,增田S, Segawa M,谷村N,等。成人骨骼肌静止卫星细胞的分子特征。干细胞。2007;25(10):2448-59。gydF4y2Bahttps://doi.org/10.1634/stemcells.2007-0019gydF4y2Ba.gydF4y2Ba
Sherwood RI, Christensen JL, Conboy IM, Conboy MJ, Rando TA, Weissman IL,等。成年小鼠肌源性祖细胞的分离:骨骼肌内和移植细胞的功能异质性。细胞。2004;119(4):543 - 54。gydF4y2Bahttps://doi.org/10.1016/j.cell.2004.10.021gydF4y2Ba.gydF4y2Ba
小波尚,摩根JE,佩格尔CN,帕特里奇TA。成肌细胞移植的动力学揭示了少数具有干细胞样特性的前体作为肌源。中国生物医学工程学报,1999;29(6):344 - 344。gydF4y2Bahttps://doi.org/10.1083/jcb.144.6.1113gydF4y2Ba.gydF4y2Ba
张志刚,张志刚,张志刚,等。辐射依赖性炎症反应可能促进卫星细胞植入。科学通报2020;10(1):1 - 12。gydF4y2Bahttps://doi.org/10.1038/s41598-020-68098-9gydF4y2Ba.gydF4y2Ba
Zammit PS, Heslop L, Hudon V, Rosenblatt JD, Tajbakhsh S, Buckingham ME,等。成肌细胞增殖动力学表明,常驻卫星细胞具有完全再生骨骼肌纤维的能力。科学通报,2002;26(1):39-49。gydF4y2Bahttps://doi.org/10.1006/excr.2002.5653gydF4y2Ba.gydF4y2Ba
Shefer G, Rauner G, Yablonka-Reuveni Z, Benayahu D.耐力运动可以缓解衰老过程中卫星细胞数量和肌生成能力的降低。公共科学学报,2010;5(10):e13307。gydF4y2Bahttps://doi.org/10.1371/journal.pone.0013307gydF4y2Ba.gydF4y2Ba
Shefer G, Rauner G, Stuelsatz P, Benayahu D, Yablonka-Reuveni Z.中等强度跑步机跑步促进年轻和老年小鼠卫星细胞池的扩张。中国生物医学工程学报,2013;29(4):344 - 344。gydF4y2Bahttps://doi.org/10.1111/febs.12228gydF4y2Ba.gydF4y2Ba
Joanisse S, Nederveen JP, Baker JM, Snijders T, Iacono C, Parise G.老年小鼠运动调节改善骨骼肌再生。中国科学院学报,2016;30(9):3256-68。gydF4y2Bahttps://doi.org/10.1096/fj.201600143RRgydF4y2Ba.gydF4y2Ba
肌肉减少症:特征、机制及功能意义。中华医学杂志。2010;95(1):139-59。gydF4y2Bahttps://doi.org/10.1093/bmb/ldq008gydF4y2Ba.gydF4y2Ba
Snijders T, Nederveen JP, McKay BR, Joanisse S, Verdijk LB, van Loon LJC,等。卫星细胞在人体骨骼肌中的可塑性。前沿物理。2015;6(10):1-21。gydF4y2Ba
霍尔JK,班克斯GB,张伯伦JS,奥尔温BB。肌纤维相关卫星细胞移植预防肌肉衰老。中国生物医学工程学报,2010;26(2):537 - 537。gydF4y2Bahttps://doi.org/10.1126/scitranslmed.3001081gydF4y2Ba.gydF4y2Ba
确认gydF4y2Ba
这项研究由美国肌肉萎缩协会(MDA351022)、美国国立卫生研究院/国家衰老研究所(R21 AG034370、R01 AG031743、R01 AG062899)和美国国家关节炎、肌肉骨骼和皮肤病研究所(R01 AR055685)资助。RWA和BCC得到了明尼苏达肌肉训练基金(NIH T32 AR007612)的支持。gydF4y2Ba
给予的支持gydF4y2Ba
NIH: R21 AG034370, R01 AG031743, R01 AG062899, R01 AR055685和T32 AR007612;MDA: MDA351022gydF4y2Ba
资金gydF4y2Ba
肌肉萎缩症协会(MDA351022)。gydF4y2Ba
NIH/国家衰老研究所(R21 AG034370, R01 AG031743, R01 AG062899)。gydF4y2Ba
美国国立卫生研究院/国家关节炎、肌肉骨骼和皮肤疾病研究所(R01 AR055685, T32 AR007612)。gydF4y2Ba
作者信息gydF4y2Ba
作者及隶属关系gydF4y2Ba
贡献gydF4y2Ba
RWA设计并执行了实验,分析了数据,解释了结果,并撰写了手稿。ASS进行了实验并对数据进行了分析。BCC进行实验并分析数据。AAL进行了实验并分析了数据。NL进行了实验并对数据进行了分析。DAL提供了资金支持,提供了研究材料,解释了结果,并编辑了手稿。MK构思了这个项目,设计了实验,提供了资金支持,解释了结果,并撰写了手稿。所有作者都阅读并批准了最终稿的出版。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
伦理批准并同意参与gydF4y2Ba
所有程序均由明尼苏达大学动物护理和使用委员会根据1408-31770A议定书批准。gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者声明他们没有相互竞争的经济或非经济利益。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Ba
伟德体育在线施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。gydF4y2Ba
补充信息gydF4y2Ba
附加文件1。gydF4y2Ba
对4个月大和2岁大的Pax7-ZsGreen小鼠不同肌肉群中卫星细胞总数进行定量的FACS绘图。ZsGreen+细胞门控的代表性FACS剖面来自八个不同的肌肉群——TA、EDL、比目鱼、腓肠肌、膈肌、腰肌、三头肌和咬肌(n=6,膈肌除外,n=4)。gydF4y2Ba
附加文件2。gydF4y2Ba
Pax7+细胞、层粘连蛋白和DAPI在年轻(3个月)和年老(22个月)TA肌切片(上图)和年轻与年老咬肌切片(下图)中的代表性免疫染色。比例尺:50 μm。gydF4y2Ba
附加文件3。gydF4y2Ba
4个月或2岁Pax7-ZsGreen小鼠8个不同肌肉群卫星细胞的增殖和分化。(a)克隆效率-在低氧条件下培养8天后,含有细胞的96孔板的孔数。(b)增殖和存活-一个菌落的平均核数。(c)自发分化-肌球蛋白重链阳性细胞质中核的百分比。所示为平均值±SE (n=6,膈肌除外,其中n=4)。p值比较(双尾t检验)的结果显示在每张图的上方。gydF4y2Ba
附加文件4。gydF4y2Ba
通过表面标记染色鉴定卫星细胞,分析ZsGreen的表达。谱系阴性百分比的代表性FACS资料表明,三种最常用的抗体用于识别ZsGreen+卫星细胞的标记双阳性细胞(n=3)。gydF4y2Ba
附加文件5。gydF4y2Ba
2岁Pax7-ZsGreen小鼠卫星细胞表面标记物染色无变化。(a) ZsGreen+细胞谱系阴性百分比的代表性FACS资料,表明三种最常用的抗体用于识别卫星细胞的标记双阳性细胞(n=3)。(b)三种最常用抗体用于识别ZsGreen+卫星细胞的系阴性、双阳性细胞百分比的代表性FACS资料(n=3)。gydF4y2Ba
附加文件6。gydF4y2Ba
心脏毒素注射液15 μL损伤程度分析。(a)未受伤(左)和15 μL心脏毒素损伤(右)3月龄雄性小鼠TA肌H+E染色切片,损伤后2周。核心区,代表损伤和再生区域,概述。(b)损伤后平均再生面积15 μL心脏毒素。gydF4y2Ba
附加文件7。gydF4y2Ba
从4个月或2岁Pax7-ZsGreen小鼠膈肌分离的卫星细胞移植后未观察到差异。(a)膈肌移植900个ZsGreen+细胞6周后,FACS定量测定的ZsGreen+细胞数量(n=5)。(b)膈肌移植900 ZsGreen+ 6周后Dystrophin+纤维数量(n=5)。(c)膈肌移植900个ZsGreen+细胞15周后,FACS定量ZsGreen+细胞数量(n=5)。(d)膈肌900个ZsGreen+细胞移植15周后Dystrophin+纤维的数量(n=5)。所示数据为平均值±标准差。统计学比较采用双尾t检验。gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba.创作共用公共领域奉献弃权书(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)适用于本条所提供的资料,除非在资料的信用额度中另有说明。gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
阿普克,r.w.,夏姆斯,a.s.,柯林斯,B.C.gydF4y2Baet al。gydF4y2Ba随着年龄的增长,卫星细胞数量和再生潜力的保存揭示了运动肌肉的偏倚。gydF4y2Ba骨骼肌gydF4y2Ba11gydF4y2Ba, 22(2021)。https://doi.org/10.1186/s13395-021-00277-2gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s13395-021-00277-2gydF4y2Ba
关键字gydF4y2Ba
- 卫星细胞gydF4y2Ba
- 再生gydF4y2Ba
- 移植gydF4y2Ba