肌肉突变体的选择和肌肉功能的预先评估
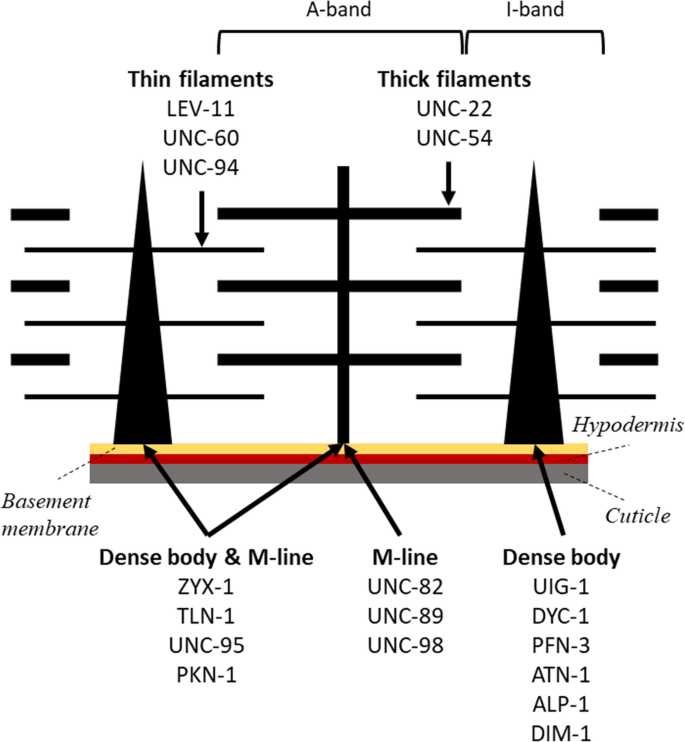
目的:探讨老年人肌肉结构与功能的关系C .线虫 ,我们选择了18个肌肉蛋白(图;1 ).这种选择是基于(i)位于肌节不同结构成分的蛋白质,(ii)先前在运动方面已被描述的突变体(表2)1 ), (iii)这些蛋白质是参与肌肉力量的产生还是传递。在参与力产生的蛋白方面,我们选择了2个与粗丝相关的蛋白(UNC-22和UNC-54);以及三种与细丝相关的蛋白质(LEV-11、UNC-60和UNC-94)。在力传递方面,我们选择了6个定位于密集体的蛋白(UIG-1、DYC-1、PFN-3、ATN-1、ALP-1和din -1)和3个定位于m系的蛋白(UNC-82、UNC-89、UNC-98)。我们还选择了4个同时定位于密体和m系的蛋白(ZYX-1, TLN-1, UNC-95, PKN-1)。尽管我们的选择是有限的,针对肌节的各种结构单位提供了这些蛋白质在肌肉功能中的作用的初步评估。
表1所研究突变体的摘要,及其人类同源物、蛋白质定位和报告的行为表型
表格1 显示了编码所选蛋白质的基因列表,所选的特定突变等位基因,蛋白质人类同源的指示,在肌节中的位置,以及文献中报道的运动测定的表型信息。对于两个基因,unc -54 ,编码体壁肌肉粗丝的主要肌球蛋白重链,以及unc -60 ,编码ADF/cofilin,我们选择研究轻度等位基因,因为任何一种的零状态都会导致严重的瘫痪。
所编译的表型包括来自弯曲试验的最大弯曲幅度[27 ],以及根据标准游泳和爬行测试评估的运动速率。通过分析数据,我们发现属于m -系和密体的突变体和m -系的突变体表现出缓慢的爬行或游泳运动(表1 ),除了unc -98 (sf19 )显示正常爬行,但游泳时动作较慢。相反,在粗体、粗丝和细丝突变体中观察到混合表型。一些突变体在爬行或游泳测试中没有表现出任何明显的缺陷,一些突变体甚至比野生型(WT)动物表现得更好。突变体uig -1 ,dyc -1 ,昏暗的 -1 ,列弗 -11 只在爬行和unc -22 (sf21 )在两种测试中都更快。另一方面,弯曲试验确定了6个突变体在弯曲方面有缺陷(zyx股票 -1 ,unc -95 ,pfn -3. ,atn -1 ,高山 -1 ,昏暗的 -1)和2个正常(unc -98 ,uig -1 ).有趣的是,这两个tln -1 而且dyc -1 表现出夸张的身体弯曲;然而,他们的运动速度是不同的tln -1 慢慢地爬行,dyc -1 爬得更快。
肌肉节的遗传缺陷可以减少C .线虫 肌肉力量和挖洞能力
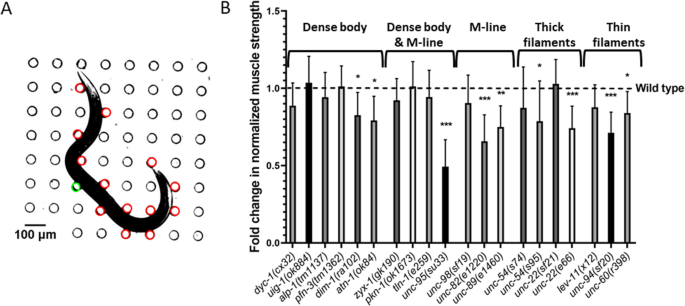
由于这些蛋白在肌节中的定位和已知功能,预计与WT相比,它们相应的功能丧失突变体将表现出肌肉无力。然而,表中所列的运动试验都没有1 适用于测量肌肉力量。在此之前,NemaFlex测试被用于显示肌肉无力unc -17 (e245 ),unc -52 (e669 ),unc -112 (r367ts 的多个等位基因unc -89 [31 ,49 ].在这里,我们利用NemaFlex平台来测量表中列出的更多肌肉突变体的强度1 .由于一些突变体的体径与WT相比有显著差异(见SI表)S1 ),我们用身体直径的立方归一化肌肉力量。这种归一化以前被证明可以很好地解释体直径的影响[31 ],它也适用于这里研究的肌肉突变体(见SI图)S1 ).
在无花果。2 B,我们显示测试突变体的归一化强度数据。我们发现,除了在细丝、粗丝和m系上有缺陷外,其余突变体均弱于WTlev-11 (x12 ),unc -22 (sf21 ),unc -54 (s74 ),unc -98 (sf19 ).在密体和m系均有遗传缺陷的动物与野生型相比均无显著差异unc - 95 (su33 ).最后,在密集体中存在遗传缺陷的6个突变体中,有4个突变体没有表现出差异,而另外2个突变体比WT弱。此外,我们发现在20个测试突变体中,unc -95 是最弱的。
图的结果。2 结果表明,20个肌肉基因中有9个与肌肉力量有关,9个基因中有6个属于m系(粗丝和细丝)的遗传缺陷。看来,这些肌节成分的遗传缺陷可能会导致更严重的肌肉力量损失,因此,该试验可以检测这些结构中每一种遗传缺陷的生理后果。有趣的是,稠密体的3个分量的零突变(uig -1 ,pfn -3. ,高山 -1)与其他结构的轻微突变相比,每一种都不会导致严重的缺陷。因此,就强度生产而言,致密体似乎更能抵御单个组件的损失。这一建议与过去的观察相一致,即正常肌节结构所需的高密度体蛋白比肌肉代谢稳态所需的更少[24 ].
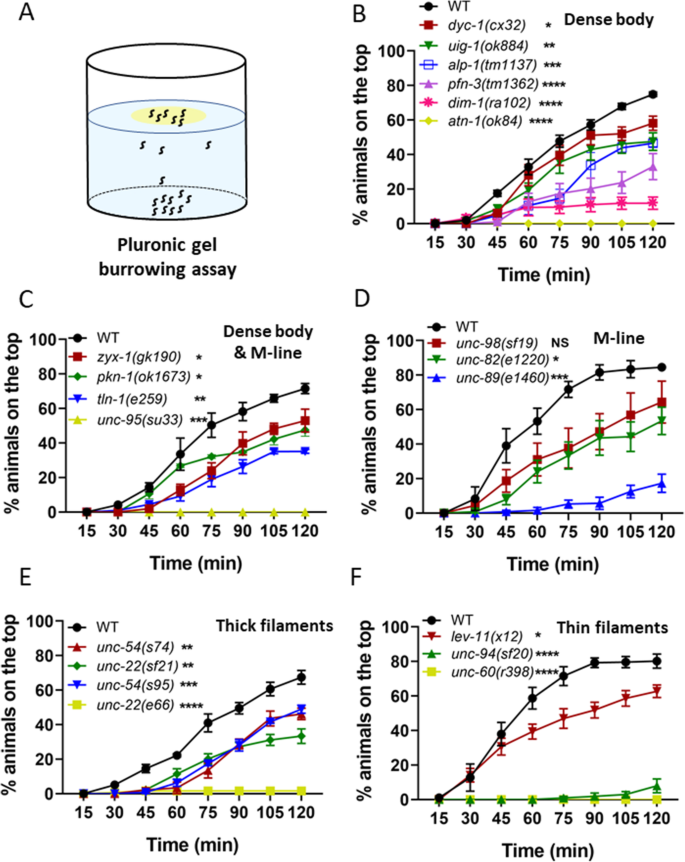
作为对NemaFlex实验的补充,我们还在穴居环境中测试了突变体C .线虫 可能会因为三维运动而受到不同的挑战[55 ,56 ].在挖洞实验中,突变体被装载在孔板的底部,然后刺激其通过Pluronic凝胶向顶部的引诱剂挖洞(图。3. a).每隔15分钟计算能到达顶部的动物的百分比,总持续时间为2小时[34 ].
以前使用的钻洞试验表明,4个密体和3个密体和m系蛋白突变体的钻洞效果不如WT [34 ],这使得我们用这种方法评估了其他的肌肉突变体。如图所示。3. B-f,我们发现大多数肌肉突变体都不能像野生型那样有效地挖洞,除了unc -98 (sf19 ).在存在缺陷的结构构件中,挖洞性能与缺陷之间没有明显的相关性。有趣的是,没有一个atn -1 (ok84 ),unc -95 (su33 ),unc -60 (r398 )动物可以到达最上面的引诱剂,使它们成为最差的钻洞者,其次是unc -22 (e66 ),unc -94 (sf20 ),其中只有2%和7%的动物达到引诱剂(图。3. b)。
我们之前已经证明,这种钻洞试验不仅仅是一种趋化性试验,事实上,由于钻洞性能随凝胶硬度和高度的变化而变化,因此它涉及肌肉的运动[34 ].此外,在二维趋化性方面没有缺陷的突变体(参考文献图6c [34 ])显示出挖洞不足,表明肌肉在3D运动过程中驱动不同,提供了比2D趋化性测定更多的肌肉功能信息。这也在这项研究中得到了证实,通过测试已知有不协调运动的Unc突变体;然而,在二维趋化性试验中,两者均无unc -22 而且unc -54 突变体有任何明显的损害,以控制他们的运动向细菌在2D(图S2 ),但它们在挖洞实验中都有缺陷。
总的来说,NemaFlex和挖穴试验都能反映肌肉功能C .线虫 并强调肌肉中的遗传缺陷会导致肌肉性能下降。
挖洞和NemaFlex强度测量的功能是不同的
为了开发一种结合NemaFlex读数和钻穴测定的肌肉功能的整体测量方法,我们首先考虑这两种测定的读数是否报告了肌肉功能的不同方面。所产生的火车头力C .线虫 在由可变形的微柱组成的机械环境中进行二维运动时,预计与在挖洞过程中进行三维机动时产生的不同,这表明这些分析可能报告了肌肉功能的独特方面。事实上,我们最近表明,从NemaFlex提取的测量值和WT动物的穴居测量值彼此并不相关[56 ].在这里,我们试图解决肌肉突变体是否存在这种相关性。此外,我们有兴趣检查是否存在基于受突变影响的肌节中蛋白质的已知位置的数据聚类。
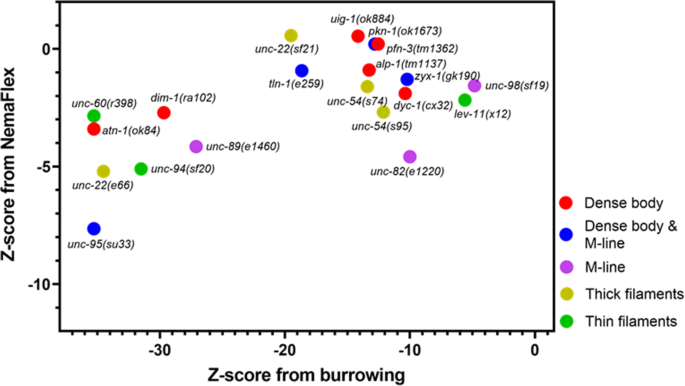
我们计算了z分数\({Z}_j=\frac{\mu_j-{\mu}_{WT}}{\sigma_{WT}} \) 对于从NemaFlex和穴居分析中提取的每一项功能测量的野生型种群。在这里μ 是测量的平均值,在我们的例子中是标准化肌肉力量(来自NemaFlex试验)或在2小时时间点到达地面的动物百分比(来自挖洞试验),下标j 表示一个给定的突变株。同样的,μ WT μ WT
在无花果。4 ,我们显示了所有测试突变体的挖洞和NemaFlex分析的z分数。在前一节中,我们展示了unc -95 ,atn -1 ,unc -60 ,unc -22 (e66 ),unc -94 是最差的挖洞者。因此,所有这些突变体都在图的最左边。4 ;然而,他们的NemaFlex强度测量值不同Z ≈−3unc -60 ,在NemaFlex和穴居实验中最弱的突变体,unc -95 ,Z ≈−8. 另一方面,dyc -1 ,uig -1 ,高山 -1 ,pfn -3. ,zyx股票 -1 ,波兰 -1 ,tln -1 ,unc -98 ,unc -54 (s74 ),unc -22 (sf21 ),列弗 -11 在强度测量上与WT无显著差异的区域位于图的右上方。4 z分数在−19之间的较大范围unc -22 (sf21 )到−4.8unc -98 .这表明,在挖洞实验中,肌肉功能受损更为明显。总的来说,这一数据表明这两个测试具有一定的相关性(Spearman相关系数为0.42),这是预期的,因为它们都涉及肌肉的驱动,但鉴于它们不完全相关,也表明它们可以告知肌肉生理学的不同方面。我们也没有发现任何基于受影响蛋白质位置的聚类证据。
结构混乱的评分系统C .线虫 肌肉
肌节的结构紊乱会对收缩-松弛周期产生不利影响,从而干扰肌肉功能。随着NemaFlex和挖洞试验的进行C .线虫 在驱动其肌肉时,我们推测在至少一项测定中z评分较低的突变体可能表现出一定程度的肌节结构紊乱。因此,我们进行免疫染色以可视化突变体肌肉收缩器官的结构紊乱,并开发了一个评分系统来对紊乱水平进行排名。
密体、m线、a带和i带是肌节的主要亚结构,肌节是肌肉收缩的基本单位。因此,我们通过对以下蛋白质的抗体免疫染色来评估这些部位的肌肉组织:MHCA(肌凝蛋白重链A),位于A带中间,代表组装和有组织的肌凝蛋白粗丝,UNC-95位于密集体和m线的底部,UNC-89位于m线的整个深度,ATN-1位于密集体的主要部分而不是基础部分。Phalloidin也用于肌动蛋白细丝所在的i带染色。我们还调查了文献,并收集了本研究中使用的相同等位基因的上述肌肉结构的图像。表格2 显示了20个突变体的肌肉结构数据,其中69个数据点来自本研究,36个数据点来自文献。本研究获得的突变体免疫染色图像见SI图S3 .
表2肌肉紊乱评分(MDS)。根据组织紊乱的严重程度,每个结构部位都被给予了0到3分的评分。突变体的MDS是每个位点上这些分数的总和。左图为肌肉结构正常的WT, MDS = 0,此值为14unc -60 (r398 ),因为它的肌肉组织紊乱严重。从文献中收集的肌肉结构数据(见引用文献)和未发表的(unpub)数据也包括在表格中
根据每个染色结构的结构紊乱水平对突变体进行评估,并将正常到最严重的紊乱分配为0到3分(表2)2 ).肌肉无序得分(MDS)定义为每个个体结构无序得分的总和。一个突变体可以获得一个从0(有组织的结构)到最大15(严重无序的肌肉结构)的值。表的左面板2 说明了如何计算MDS的两个例子:WT动物或对照组的MDS = 0,因为所研究的结构都没有紊乱unc -60 (r398 ),由于在i -带、a -带、m -线和密体深度处观察到较严重的结构无序,密体和m -线底部有中度无序,因此MDS = 14。
对于突变体,我们没有观察到任何无序zyx股票 -1 ,波兰 -1 ,unc -22 (sf21 )体壁肌肉结构(表2 ).有趣的是,在NemaFlex强度测量中,这些突变体都没有变弱,但它们都有挖洞能力受损。同样,在NemaFlex和挖洞中z值都较低的突变体如图左下角所示。4 肌肉结构紊乱;即MDS ofunc -95 而且unc -22 (e66 )分别为15例及10例。在下一节中,我们将使用这个评分系统来了解肌肉结构和肌肉功能之间的关系。
肌肉功能与肌肉结构紊乱的关系
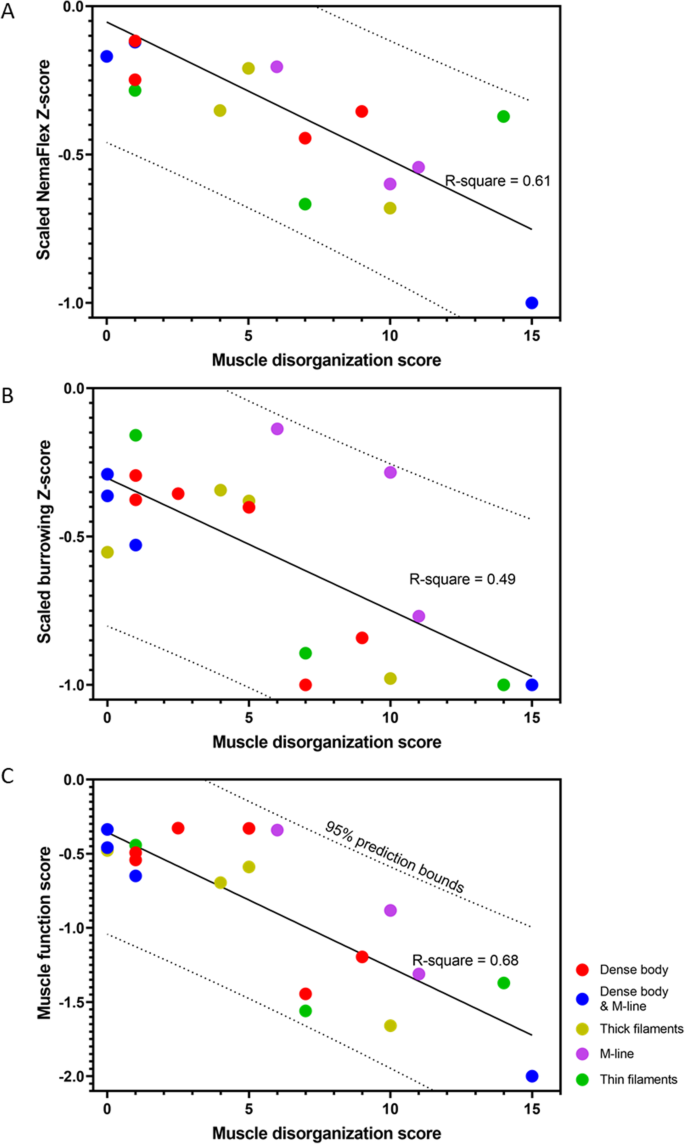
为了了解肌丝晶格的结构组织如何有助于肌肉功能,我们寻求一个功能读数表征肌肉生理学。由于NemaFlex和挖洞z分数值不在同一范围内,我们将它们归一化,使其相对于绝对最大值,从而归一化z分数\({\overline{Z}}_j \) 躺在射程内\(-1<{\overline{Z}}_j<0 \) .在无花果。5 a和b,我们将标准化的NemaFlex和挖洞得分作为肌肉紊乱得分的函数绘制。总体而言,NemaFlex和穴居评分均随肌肉结构紊乱评分的增加而降低。主成分分析(PCA)表明,将归一化NemaFlex和具有几乎相同权重的掘穴z分数相加,可以产生一个新的潜在变量,我们称之为肌肉功能分数,它可以解释80%的数据变化(见SI注)S1 ).数字5 c表明,与每个个体的生理z评分相比,使用这种新的肌肉功能的相关性得到了改善。有趣的是,所有数据点都落在拟合线的95%预测范围内。总的来说,这些结果表明,肌肉功能评分越低,肌肉组织紊乱的程度越大,这表明这两种肌肉生理学检测结合起来可以提高成功检测动物体壁肌肉结构紊乱的机会。
此外,无花果。5 c表明所有m系和粗丝突变体的肌肉结构轻度紊乱,生理功能混杂。密体突变体的肌肉结构从接近正常值到轻度紊乱,生理功能也从正常到轻度。大多数密体和m系突变体的肌肉结构几乎组织良好,生理性能正常,除了unc -95 在结构上和生理上都严重受损。对于有细丝缺陷的突变体,肌肉结构紊乱和肌肉功能从轻微到严重不等。