动物模型gydF4y2Ba
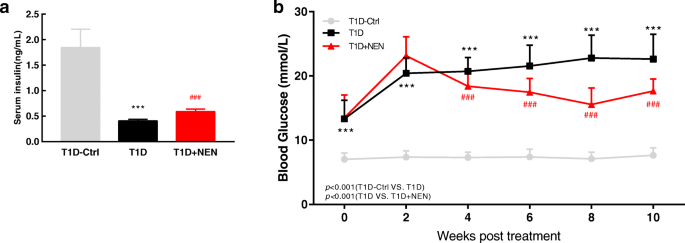
动物实验经广州中医药大学动物护理使用委员会批准,并按照相关指南和规定进行。雄性C57BL/6J小鼠购自广东省医学实验动物中心,北京大学深圳研究生院实验动物中心饲养。1型糖尿病(T1D)小鼠通过腹腔内注射溶解于柠檬酸缓冲液的多剂量STZ (Sigma-Aldrich, St. Louis, MO, USA) (55 mg/kg体重每天)连续5天诱导。正常对照组(T1D-ctrl)小鼠腹腔内注射等量的柠檬酸缓冲液。根据最后一次注射STZ后第9天的空腹血糖,将T1D小鼠随机分为T1D组和T1D + NEN组。T1D-ctrl组和T1D组小鼠正常饲粮,T1D + NEN组小鼠在正常饲粮中添加10 g/kg NEN。全组治疗8周。gydF4y2Ba
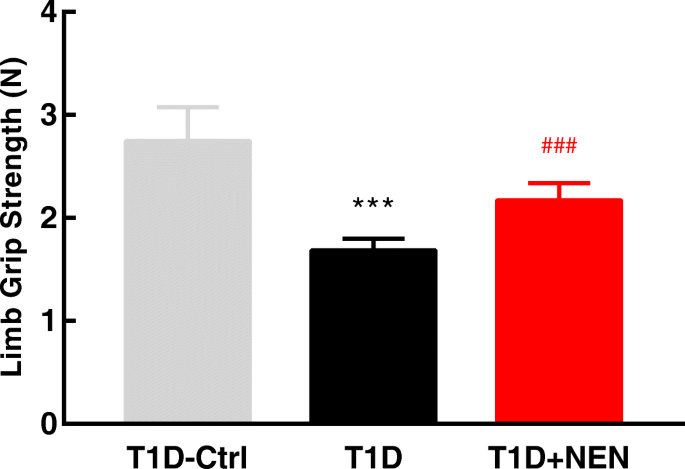
握力测试gydF4y2Ba
小鼠在被处死前一天,用测力仪(ZH-YLS-13A,安徽正华生物仪器设备有限公司,中国淮北)测量小鼠肢体握力。根据制造商的说明进行肢体握力测试。PC接口软件自动感知压缩或张力,并记录峰值(mV)。用标准重(1.98 N)测量校正因子,用峰值(mV) ×校正因子计算肢体强度(牛顿)。在本实验中,对每只小鼠进行了三次测量,并将结果的平均值用于分析。gydF4y2Ba
测量血糖和体重gydF4y2Ba
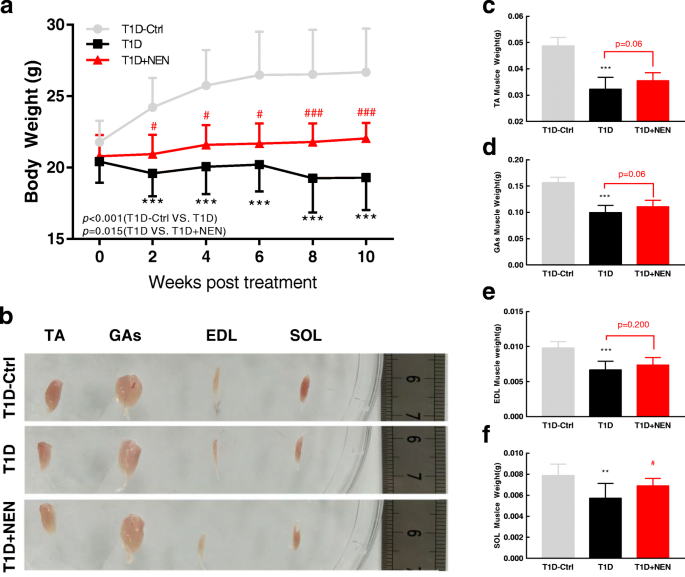
每2周称量每只小鼠的体重,使用血糖仪(Roche, Basel, Switzerland)通过尾静脉穿刺取血样测量血糖。gydF4y2Ba
组织准备gydF4y2Ba
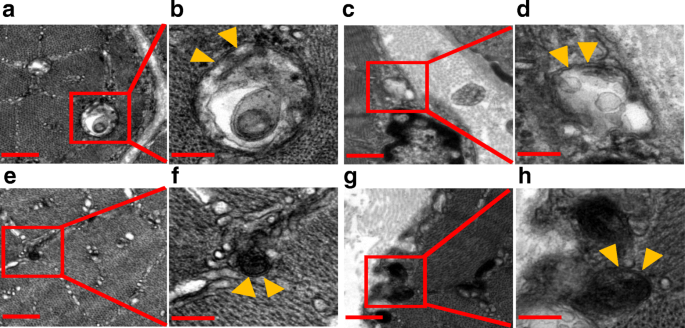
实验结束后处死小鼠,解剖胫前肌(TA)、比目鱼(SOL)、指长伸肌(EDL)、腓肠肌(GAs),并在纸上吸干,随即称量。用10%福尔马林固定TA肌肉组织,测定纤维截面积。EDL肌肉组织(大小1毫米gydF4y2Ba3.gydF4y2Ba)用2.5%戊二醛固定,1%渗透酸后固定,透射电镜(TEM)检查。GAs肌肉组织立即在液氮中快速冷冻,并储存在−80°C下,以供后续分析。SOL肌肉和EDL肌肉首先嵌入O.C.T.化合物(Tissue-Tek, Sakura Finetek, USA)中,然后在液氮冷却的异戊烷中冷冻,最后在- 80°C保存以确定纤维类型。gydF4y2Ba
纤维横截面积及纤维尺寸分布的确定gydF4y2Ba
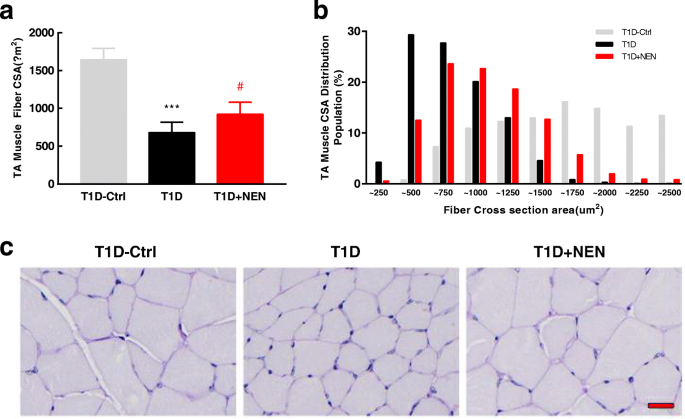
用数码相机拍摄肌肉。石蜡包埋TA肌切片用周期性酸-希夫(PAS)染色。使用ImageJ软件(美国国立卫生研究院,Bethesda, MD, USA)勾画出肌肉横截面内至少40%的纤维(约550-1500根纤维),以评估肌肉纤维横截面面积和纤维大小分布。gydF4y2Ba
纤维类型测定gydF4y2Ba
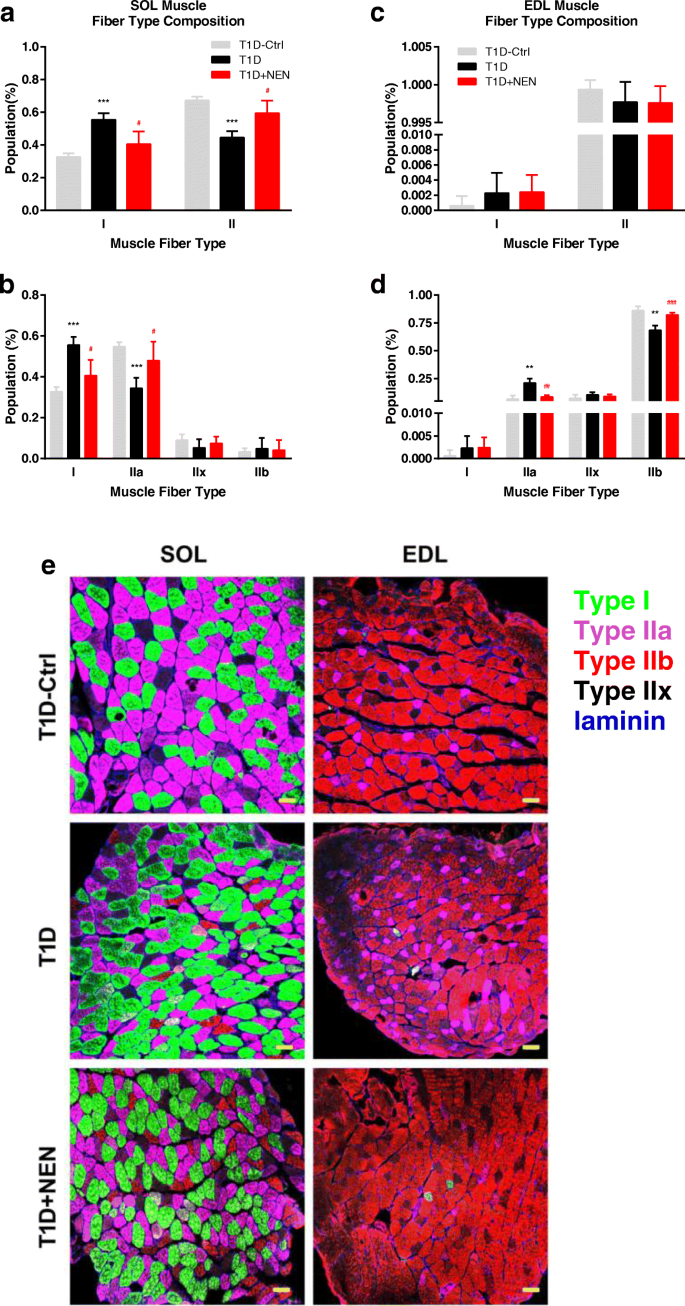
用- 20℃低温恒温器(CM1950, Leica, Germany)将制备好的SOL和EDL组织切成10 μm厚的冷冻切片,然后按照前面所述的程序进行MHC表达的免疫荧光分析[gydF4y2Ba10gydF4y2Ba].针对MHC-I (BA-F8)、MHC-IIa (SC-71)和MHC-IIb (BF-F3)的一抗购自发育研究杂交瘤库(美国爱荷华大学国立卫生研究院),而二抗购自Invitrogen(美国)。由此产生的图像被可视化,并在共聚焦显微镜上捕获(LSM710,卡尔蔡司,Oberkochen,德国)。在整个横截面上拍摄单个图像,然后用Photoshop 7.0 (Adobe, USA)组装成合成全景图像。对整个图像内的所有纤维进行表征,用于纤维类型分析。gydF4y2Ba
电子显微镜gydF4y2Ba
TEM图像由杰姆-1400(JEOL,东京,日本)拍摄。肌原纤维间区和肌层下区均有自噬液泡。gydF4y2Ba
酶联免疫吸附试验(ELISA)gydF4y2Ba
使用酶联免疫吸附测定试剂盒(Merck Millipore, Danvers, MA, USA)根据制造商说明书测量血清胰岛素。gydF4y2Ba
免疫印迹分析gydF4y2Ba
速冻的GAs肌肉组织在裂解缓冲液中均质,并在样品加载缓冲液中制备(Bio-Rad, Hercules, CA, USA)。裂解蛋白在10% SDS-PAGE凝胶上分离,然后转移到聚偏二氟乙烯(PVDF)膜(Merck Millipore, Danvers, MA, USA)。在含5%脱脂干牛奶的TBS缓冲液中在室温下阻塞1小时后,将膜孵育,并在4℃下用一抗轻轻摇动过夜。用TBS洗涤后,用二抗在室温震动下孵育1 h。清洗后,使用ChemiDoc™MP成像系统(Bio-Rad, Hercules, CA, USA)检测和分析蛋白带。以甘油醛-3-磷酸脱氢酶(GAPDH)为负载对照。结果表示为相对于GAPDH的集成光密度。以抗GAPDH一抗为加载对照。结果表示为相对于GAPDH的集成光密度。抗p-ULK1(ser555)、ULK1、p-AMPK (Thr172)、AMPK、LC3B、p-p38 MAPK(Thr180/Tyr182)、p38 MAPK和FoxO3a的一抗购自Cell Signaling Technology (Danvers, MA, USA)。 Primary antibody against GAPDH was from Proteintech Group, Inc. (Chicago, IL, USA).
统计分析gydF4y2Ba
数据以均数±标准差表示。两组间的统计学差异用未配对的Student 's进行分析gydF4y2BatgydF4y2Ba测试。对血糖和体重数据进行重复测量方差分析(ANOVA),影响分为组(T1D-ctrl vs T1D, T1D vs T1D + NEN)和周(第0、2、4、6、8、10周)。事后测试使用gydF4y2BaBonferronigydF4y2Ba.采用SPSS 16.0版统计软件进行统计分析gydF4y2BaPgydF4y2Ba< 0.05为有统计学意义。gydF4y2Ba