摘要
背景
在暴露于长期受控机械通气(CMV)的COVID-19患者中,老年与死亡率显著增加有关,这可能是由于与病毒感染相关的高炎症反应。然而,在没有病毒感染的情况下,我们对CMV反应的年龄相关差异的理解仍然不足。
方法
幼鼠(7-8个月)和老鼠(28-32个月)F344 BN杂交大鼠在ICU条件下暴露5天,即完全固定、机械通气和广泛监测。通过对膈肌的转录组学(RNA-Seq)和蛋白质组学(接近延伸分析)分析以及血浆的蛋白质组学分析来研究暴露于ICU条件下的年轻大鼠和老年大鼠之间的分子差异。
结果
根据多组学分析,年轻大鼠和老年大鼠对CMV和固定5天的反应有显著差异。在年轻的大鼠中,代谢通路主要下调以响应固定(神经肌肉传递的突触后阻断)。而老年大鼠则出现了明显的免疫和炎症反应,如“IL-17信号通路”等特异性相关通路上调,血浆中炎症因子和细胞因子/趋化因子水平升高。
结论
重症监护病房(ICU)老年covid -19相关性高炎症和细胞因子风暴患者死亡率的显著增加,不仅需要反映病毒感染,也可能与呼吸机诱导的膈功能障碍(VIDD)和长期CMV本身诱导的高炎症反应有关。虽然机械通气是COVID-19 ICU患者的救生干预措施,但应谨慎使用CMV,特别是老年患者,可考虑采用负压通气等其他呼吸支持手段。
背景
新型冠状病毒SARS-CoV-2可引起呼吸道疾病(COVID-19),老年患者病情更为严重,经常需要重症监护和长期机械通气[1].老年COVID-19患者的发病率/死亡率较高[2],而SARS-CoV-2引起的高炎症反应被认为是导致老年感染患者病情加重和死亡的主要病理过程[3.,4,5].“炎症”是用来描述伴随衰老的慢性低度全身炎症的术语,它预示着与年龄相关的疾病的易感性[5].然而,一个关键的未知因素是炎症和发生在患有严重疾病的老年COVID-19患者中的过度炎症与重症监护病房(ICU)病情本身的后果之间的关系。
MV是一种拯救急性呼吸衰竭患者生命的干预措施,经常在COVID-19患者中长期使用[1,6].然而,MV也与呼吸系统的负面后果有关,如呼吸机诱导的肺损伤(VILI) [7]和呼吸机诱导的膈肌功能障碍[8].VIDD导致膈肌耐力和力量迅速下降,导致拔管失败,呼吸机脱机时间延长,ICU住院时间延长,对ICU死亡率和医疗支出产生惊人的负面影响,老年患者风险更高。这是当前COVID-19大流行期间现代重症监护的一个主要问题[9].推测MV,特别是CMV诱导VILI,并释放影响膈肌等外周器官的因子,有助于VIDD的发病。在本研究使用的实验性ICU模型中,所有大鼠都因长期CMV而发生VILI和VIDD [10],而年老的老鼠比年轻的老鼠受影响更严重[11].值得注意的是,还有报道称,与基线时更年轻、更健康的患者相比,老年COVID-19患者从MV中获益更少[12].
因此,本研究采用独特的实验性ICU模型,比较暴露于CMV 5天的年轻大鼠和老年大鼠膈肌和血浆中CMV诱导的分子变化。该模型复制了VIDD患者临床观察到的骨骼肌结构和功能受损的基因型和表型特征[10,13,14,15,16].与年轻大鼠相比,我们观察到膈肌剧烈的炎症活动,导致更严重的VIDD,老年大鼠的全身炎症水平更高。我们的研究表明,除了病毒感染,年龄相关的CMV反应本身还有助于在老年COVID-19患者中报告的过度炎症和细胞因子风暴,导致老年死亡率增加。
材料与方法
动物和样本
10只7-8月龄(幼龄,n= 6)和28-32个月(年龄;n= 4)来自美国国家老龄化研究所(NIA, Bethesda, MD)。将3只幼龄大鼠和2只老年大鼠随机分为0天对照组和5天CMV组。大鼠被麻醉,神经肌肉传递的突触后阻断药物麻痹(神经肌肉阻滞剂(NMB);α-眼镜蛇毒素),机械通气和广泛监测24小时/天5天,并与0天对照。动物保持热量、蛋白质和液体平衡,包括动脉内和静脉内溶液。0 d对照动物麻醉,自主呼吸,给予动脉和静脉溶液,在初始麻醉和手术后1 h内处死。5 d实验动物采用同轴气管插管,吸气呼气比1:2,每分钟容积180 ~ 200 ml,气体浓度40% O,呼吸72次/min2, 57% n2,及3% CO2,由精密(体积漂移< 1%/周)容积式呼吸器提供。间歇性恶性通货膨胀(20厘米高时每小时6次)2O)和恒定的呼气末正压(PEEP;1.5 cm H2O)持续3 s,以预防肺减招募和肺不张。第1天诱导NMB (150 μg α-眼镜蛇毒素IA),持续注射IA (250 μg/d)维持。在NMB诱导后开始有创机械通气,在膈肌麻痹的第一个临床症状时,小心避免氧饱和度降低的发作。监测实验动物心率、心电图(ECG)、脑电图(EEG)、动脉和静脉血压、脉搏氧饱和度、体温、呼吸周期压、潮末CO2(等有限公司2),以及尿量(详情见以往刊物[17])。在CMV感染的5天内,没有任何动物出现感染和败血症的迹象。在安乐死后立即收集膈肌和血浆。
文库制备和转录组测序
根据制造商说明书,使用RNeasy®纤维组织迷你试剂盒(Qiagen, Inc., Valencia, CA, USA)提取RNA。经过质量控制后,每个样品的1 μg RNA作为文库制备的输入材料,并使用NEBNext®Ultra进行条形码编码TMRNA文库准备试剂盒Illumina®(NEB, USA)。文库制剂在Illumina平台(HiSeq Xten)上进行测序。
Olink蛋白质组学分析
每个样品的膜蛋白和血浆蛋白在T-PER裂解缓冲液(Thermo Fisher Scientific)中用完全蛋白酶抑制剂(Sigma-Aldrich)裂解,并稀释至1 ng/μl。蛋白质裂解物由Olink小鼠探索小组(Olink Proteomics AB,乌普萨拉,瑞典)根据制造商的说明进行检测。简而言之,对寡核苷酸标记的抗体探针与样品孵育。一旦结合到他们的目标蛋白寡核苷酸探针是接近的杂交成对的方式。DNA聚合酶的加入导致邻近依赖的DNA聚合,产生独特的PCR目标序列,随后使用微流体实时PCR仪器进行检测。从DNA延伸控制的量化周期(Cq)值从测量的Cq值中减去,并应用板间校正因子来产生归一化蛋白表达值(NPX),这是log2转换。所有化验验证数据可在制造商网站(www.olink.com).
微分表达式分析
质量控制后,使用HISAT2将配对的末端清洁reads映射到大鼠Ensemble参考基因组[18].HTSeq [19]用于计算映射到每个基因的读数。随后用DESeq2进行差异表达分析[20.].具有调节的基因p值< 0.05和绝对折叠变化> 2被认为是差异表达基因(DEGs)。
在分析之前,将Olink蛋白质组学平台的蛋白质水平转换为线性尺度(2NPX).用广义线性回归方法鉴定差异表达蛋白(DEPs)。蛋白质具有p值< 0.05,绝对折变> 2定义为差异表达。
富集分析
为了从deg和dep列表中提取生物学意义,它们受到ClusterProfiler的基因本体论(GO)和KEGG途径富集分析[21].经调整后,GO和KEGG富集分析的项被认为显著富集p值小于0.05。
每个DEGs的折叠变化信息添加到我们的富集分析中,并反映为az分数(22,23].Z-score是预测富集KEGG通路状态的计算。Z-score计算为
数赋给一个富集项的基因数量。而向上而且下来数据中指定基因的数量是上调还是下调?
结果
横膈膜和血浆中的基因和蛋白质特征对巨细胞病毒的反应
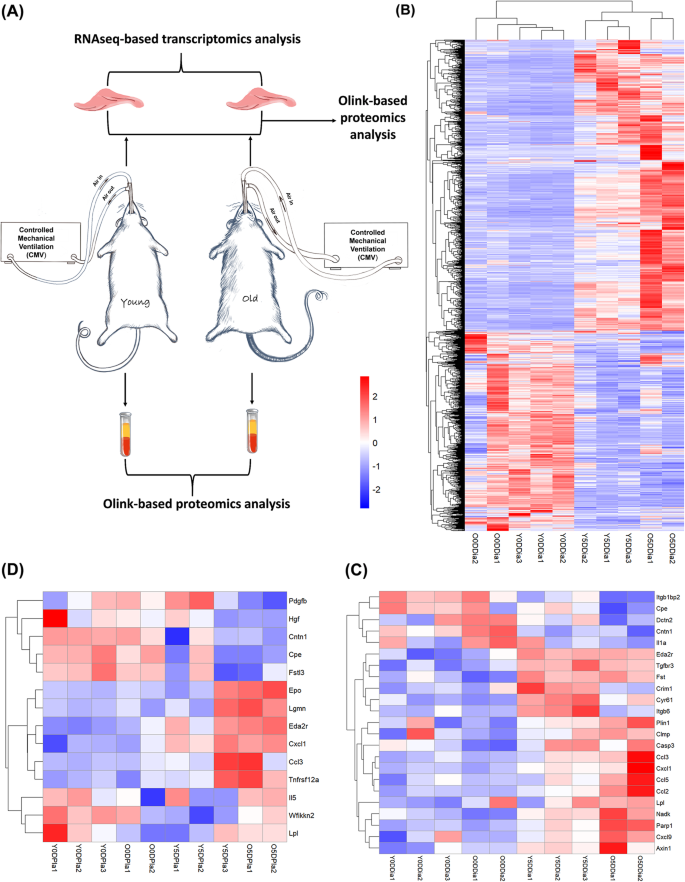
实验原理图如图所示。1a.对膈肌进行RNA-seq和蛋白质组学分析,并对血浆进行蛋白质组学分析。
根据RNA-seq分析,在0天对照组和5天CMV组的幼鼠和老年大鼠中共检测到12321个基因(默认阈值为Fragments Per Kilobase Million, FPKM值设为(1))1A).在年轻大鼠中,共有2163个差异表达基因(DEGs;p值< 0.05,绝对折叠变化> 2;详见《补充表》1A)被鉴定,大多数CMV在5天后下调(60%或1295个基因)。另一方面,在老年大鼠中,共鉴定出1752个deg,其中大多数上调(82%或1445个基因)(补充图)1B;详见《补充表》1B).这些cmv诱导的膈肌deg的层次聚类分析如图所示。1b. 5天CMV组间的聚类模式有明显差异。此外,聚类模式也显示了通气后与通气前大鼠之间的差异。这一结果表明,5天CMV和固定化对特定年龄相关的分子变化有响应。
经膜蛋白组学分析,共有8个和19个差异表达蛋白(DEPs;p值< 0.05,绝对折叠变化> 2;详见《补充表》1C和D)分别在年轻大鼠和老年大鼠中被鉴定为对5天CMV的反应。共检测到4个dep,包括Itgb1bp2、Fst、Cyr61和Eda2r。详细信息(折叠变化和p的数值)载于补充图1C和d。这些cmv诱导的隔膜dep的热图如图所示。1c.
根据血浆蛋白质组学分析,共10个DEPs, 9个DEPs(详见补充表)2A和B)分别在年轻和老年大鼠中被鉴定为对CMV的反应。共检测到5种dep,包括Eda2r、Cxcl1、Ccl3、Tnfrsf12a和Cpe。详细信息(折叠变化和p的数值)载于补充图1E和F.这些cmv诱导的血浆DEPs的热图如图所示。1d。
横膈膜中与年龄相关的分子差异对CMV的反应
GO在膜片中DEGs和DEPs的富集分析
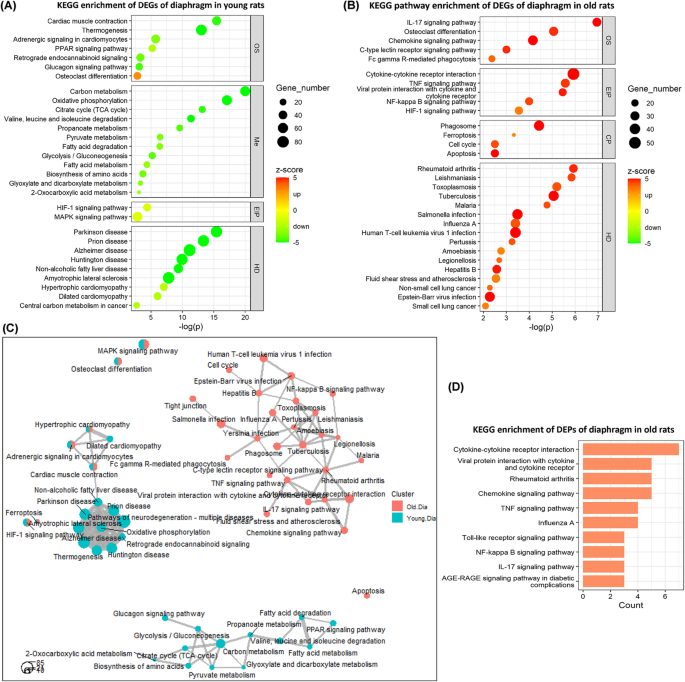
GO术语分为三个子本体:生物过程(BP)、分子功能(MF)和细胞成分(CC)。在年轻大鼠中,由17个BP、10个CC和3个MF组成的30个排名最高的GO术语如图所示。2a(更多GO术语见补充表3.A)消极的z-大多数GO术语的得分表明相应的涉及的deg主要下调。例如,在BP类别中排名前3位的GO术语占比非常低z-得分,包括“前体代谢产物和能量的产生”(z-得分−8.89),“通过有机化合物氧化获得能量”(z-score−8.05)和“ATP代谢过程”(z-评分−6.76),以大量下调的DEGs为主,这表明与横膈膜能量代谢和生产高度相关的生物过程减少。此外,CC类排名前3的GO术语,包括“线粒体内膜”(z-score−8.69),“氧化还原酶复合体”(z-得分- 6.38)和“肌节”(z-score−5.18),表明许多表达显著下调的基因不仅编码线粒体成分,还编码肌节成分。这些排名前几位的GO术语所包含的deg的详细折叠变化信息见补充图2.
在老年大鼠中,包含27个BP、2个CC和1个MF类别的30个排名最高的GO术语如图所示。2b(更多GO术语见补充表3.B)积极的z-多数GO项的得分表明相应的deg被上调。例如,排名前3位的GO术语在BP类别中占非常高z-评分包括“粒细胞迁移”(z-评分6.33),“粒细胞趋化性”(z-得分:6.00)和“髓系白细胞活化”(z-评分6.73),以大量上调的DEGs为主,这表明老年大鼠膈肌中与免疫细胞活性相关的生物过程显著增加。有趣的是,z- CC类“myofibril (z-score−3.54)为阴性,表明编码肌原纤维成分的基因表达显著下调。这些排名最高的GO术语所含的deg的详细折叠变化信息见补充图3..
幼鼠和老年大鼠对CMV的反应中膈肌主要涉及的生物学过程之间的关系如图所示。2c.年轻大鼠和老年大鼠之间的明显聚类支持了对5天CMV的强烈年龄相关差异。在年轻大鼠中,BP类相关GO术语形成两个聚类。一个聚类表明,这些受CMV影响的生物过程主要与“前体代谢物和能量的产生”有关。另一个类群表明,这些受CMV影响的生物过程主要与“肌肉系统过程”有关。在老年大鼠中,BP类中的许多相关GO术语也形成了两个聚类。两者均提示CMV影响的这些生物学过程主要与免疫和炎症反应有关。
此外,无花果。2d为老年大鼠横膈膜中由cmv诱导的DEPs富集的GO术语(更多GO术语见补充表)3.C和D)。在年轻大鼠中,GO项没有明显富集,这可能是由于年轻大鼠膈肌中检测到的DEPs数量较少。另一方面,在老年大鼠中,在BP类中发现了多个与趋化因子介导活性高度相关的GO术语,如排在前3位的GO术语“趋化因子介导的信号通路”、“趋化因子的反应”和“细胞对趋化因子的反应”,支持了上述对DEGs的GO富集分析,因为趋化因子在控制免疫系统迁移和免疫细胞在组织中的定位中起着重要作用。
膈肌中DEGs和DEPs的KEGG通路富集分析
KEGG途径被正式分为七类:“代谢(Me)”、“遗传信息处理(GIP)”、“环境信息处理(EIP)”、“细胞过程(CP)”、“有机体系统(OS)”、“人类疾病(HD)”、“药物开发(DD)”。在年轻大鼠中,30个排名最高的KEGG通路包含7个OS, 12个Me, 2个EIP和9个HD类别如图所示。3.a(更多KEGG途径见补充表4A).大多数KEGG通路与极低z-scores表明相应涉及的DEGs大多下调,如“碳代谢”(Me;z-score−6.76),“氧化磷酸化”(Me;z-评分−7.22),“柠檬酸循环(TCA循环)”(Me;z-score−4.80)和“钙信号通路”(EIP;z-得分−3.65)(不是前30名),表明这些途径受到抑制。如KEGG通路“氧化磷酸化”和“钙信号通路”的抑制状态见补充图4而且5.
在老年大鼠中,由5个OS、5个EIP、4个CP和16个HD类别组成的30个排名最高的KEGG通路如图所示。3.b(更多KEGG途径见补充表4B).大部分KEGG通路具有非常高的z-评分表明相应的deg大多上调,如“IL-17 signaling pathway”(OS;z-评分5.39),“趋化因子信号通路”(OS;z-评分5.24),“细胞因子-细胞因子受体相互作用”(EIP;z-score: 6.38),“TNF信号通路”(EIP;z-评分4.64),“NF-kappa B信号通路”(EIP;z-得分:4.49),“吞噬体”(CP;z-评分5.84)和“凋亡”(CP;z-评分5.00),提示激活了这些通路。
主要涉及年轻大鼠和老年大鼠膈肌的KEGG通路对CMV的反应关系如图所示。3.c.年轻大鼠和老年大鼠对5天巨细胞病毒反应的不同聚类显示出年龄特异性差异。具体而言,在年轻大鼠中,有许多相关的KEGG通路形成两个簇,这表明这些通路受CMV影响主要与“碳代谢”和“氧化磷酸化”有关。在老年大鼠中,有许多相关的KEGG通路形成一个主要与炎症和免疫反应相关的大簇。
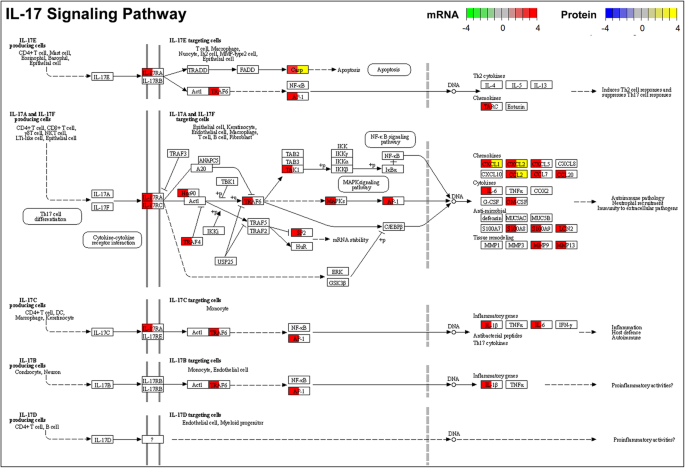
此外,无花果。3.d为老年大鼠由cmv诱导的膈肌DEPs增加的KEGG通路(更多KEGG通路见补充表)4C和D)。在年轻大鼠中,KEGG通路没有明显富集,这可能是由于年轻大鼠膈肌中检测到的DEPs数量较少。在老年大鼠中,DEPs及其富集的KEGG通路与deg及其富集的通路一致,如“细胞因子-细胞因子受体相互作用”(补充图)6),“TNF信号通路”(补充图7),“IL-17信号通路”(图;4)和“NF-kappa B信号通路”(补充图8).
CMV在老年时诱导较高水平的循环炎症因子
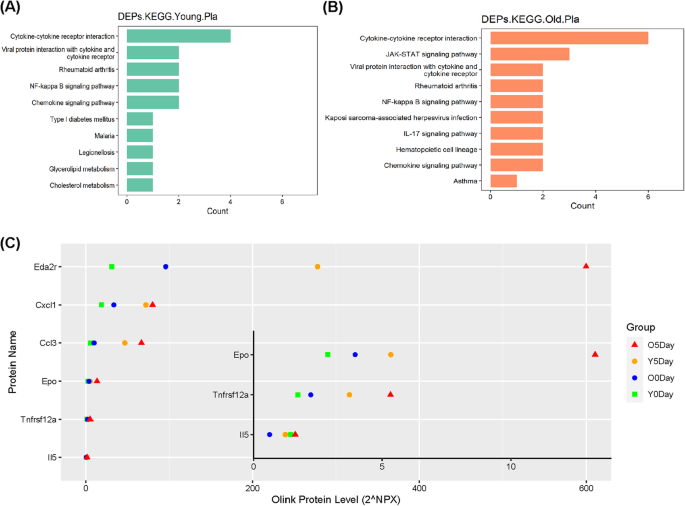
血浆DEPs富集的KEGG通路显示了CMV影响的主要生物学功能和通路。无花果。5a, b显示,在年轻大鼠和老年大鼠中,丰富的KEGG通路存在许多重叠,如“细胞因子-细胞因子受体相互作用”、“NF-kappa b信号通路”、“趋化因子信号通路”,提示CMV可能对主要与炎症和免疫活动相关的生物学功能具有相似的影响,与年龄无关(详见补充表)5A和B)。
数字5c显示上述炎症相关KEGG通路中涉及的DEPs,包括“NF-kappa B信号通路”、“IL-17信号通路”、“趋化因子信号通路”、“细胞因子-细胞因子受体相互作用”,CMV 5天后,幼鼠和老年大鼠均观察到Eda2r、Cxcl1、Ccl3、EPO和Tnfrsf12a蛋白水平显著升高。有趣的是,老龄大鼠中5种DEPs (Eda2r、Cxcl1、Ccl3、Epo和Tnfsf12a)的基础蛋白水平高于年轻大鼠。CMV感染5天后,幼鼠和老年大鼠血浆中这5个因子中的4个(Eda2r、Ccl3、Epo和Tnfrsf12a)蛋白水平的差异扩大。
讨论
目前的实验为长期CMV对膈肌中与年龄相关的分子变化的响应提供了新的见解,最终可能有助于开发针对患者年龄的个性化对策。VIDD进展背后的病理生理学和机制是复杂的,与年龄密切相关,对死亡率和发病率有负面影响。RNA-Seq转录组学和Olink蛋白质组学为暴露于CMV的年轻和年老大鼠膈肌差异的系统和相互验证的研究提供了有效的手段。根据功能富集分析,我们发现cmv诱导的分子改变和参与通路在年轻大鼠和老年大鼠之间存在明显差异。据我们所知,这项研究是第一个使用独特的不受早期死亡率限制的实验性ICU模型,报道了长期机械通气后膈肌mRNA转录谱和Olink蛋白质组的年龄相关变化。
在年轻大鼠的横膈膜中,5天CMV导致与能量代谢和生产相关的生物过程减少,如“碳代谢”、“柠檬酸循环(TCA循环)”、“丙酮酸代谢”、“糖酵解/糖异生”、“脂肪酸代谢”、“氨基酸生物合成”和“氧化磷酸化”等途径的下调所示。代谢通路和“钙信号通路”的下调反映了神经肌肉传递的突触后阻断对膈肌失活的生理适应。编码结构肌蛋白的基因表达减少(详见补充图)2B)可能导致我们之前在年轻大鼠中长期CMV反应中观察到的膈肌收缩调节受损[17].
在老年大鼠膈肌中,5天CMV导致与免疫和炎症反应相关的生物过程增加,如“IL-17信号通路”、“趋化因子信号通路”、“细胞因子-细胞因子受体相互作用”、“TNF信号通路”、“NF-kappa B信号通路”等通路上调。和“吞噬体”。如图所示。4、补充数字3.而且8、及补充表1,在CC趋化因子基因(CCL2、CCL3、CCL5、CCL7、CCL17、CCL20等)、CXC趋化因子基因(CXCL1、CXCL2、CXCL3、CXCL5、CXCL11等)、细胞因子基因(IL-6、IL-1β、CSF2等)和基质金属蛋白酶基因(MMP9、MMP13等)表达增加。一些细胞因子/趋化因子在基因水平上的变化反映在蛋白质水平上,表现为CCL2、CCL3、CCL5、CCL12、CXCL1、CXCL2、CXCL3的增加(图。4,补充图6而且7).因此,慢性CMV引起的膈肌功能的年龄相关性丧失、脱机过程的延迟、重症ICU患者死亡率的增加和医疗费用的大幅增加,提示与CMV引起的细胞因子风暴和过度炎症密切相关。
不能完全排除CMV以外的其他因素诱发炎症反应,如暴露于神经肌肉传递的突触后阻断5天。我们之前的研究表明,5天深度镇静和机械通气单独或联合神经肌肉阻滞、皮质类固醇激素治疗和败血症单独或全部联合对膈肌纤维功能有强烈的负面影响[24].然而,神经肌肉阻滞、皮质类固醇激素治疗或败血症与仅暴露于机械通气和深度镇静的动物相比,没有额外的负面影响[24].这与对肢体肌肉的影响形成鲜明对比,败血症和皮质类固醇治疗,而不是神经肌肉阻断,对肢体肌肉纤维功能有强烈的负面影响[25].因此,导致膈肌纤维功能严重受损的唯一共同点是机械通气本身支持CMV对膈肌功能受损的主导作用。
在一般以及特定的COVID-19 ICU人群中,老年是与死亡率最密切相关的因素之一。机械通气在危重病人中是一种救命的干预手段,但目前的研究结果提示,机械通气应尽量缩短时间,特别是有控制的机械通气。与icu中最常用的正压通气相比,负压通气等其他机械通气模式可能是一种较低呼吸机致肺损伤(VILI)的替代方法[26],因为VILI可能是年龄相关性肺损伤以及随后释放的因子对包括呼吸肌在内的外周器官造成负面影响的关键因素。血浆蛋白质组学分析证实了CMV的全身释放因子,表明一系列炎症因子和细胞因子/趋化因子的蛋白水平升高,如与“NF-kappa B信号通路”、“IL-17信号通路”、“趋化因子信号通路”、“细胞因子-细胞因子受体相互作用”高度相关的因子。值得注意的是,在CMV感染前,老年大鼠全身炎症的基础水平较高,而在CMV感染后,老年大鼠全身炎症的增加幅度更大。我们怀疑这种现象可能是由于炎症的作用。
炎症的特征是衰老过程中基础炎症水平的升高,与衰老细胞及其分泌的炎症分子如细胞因子和趋化因子的积累有关,这种情况被称为衰老相关分泌表型(SASP) [2,27].基线炎症不一定是有害的,但先前存在的带有SASP的炎症细胞可能参与炎症级联并放大触发的炎症事件[2].炎症升高的阴燃状态可能由于衰老T淋巴细胞的毒性而引起严重的组织损伤[28],被认为是导致老年COVID-19患者过度炎症和肺损伤的重要因素[2].这项研究的结果表明,CMV引发了老年炎症放大的炎症事件。
每组动物数量相对较少,这表明了该研究的局限性,涉及到老式F344 BN杂交大鼠的可用性以及技术上非常苛刻和劳动强度高的实验性ICU模型。然而,这一苛刻模型的复杂性被研究ICU条件长期影响的优势以及当前研究中显示的强烈的年龄特异性影响所抵消,尽管未来在更大人群中的研究将产生关于特定途径的更详细信息。
总之,我们的研究表明,在长期控制机械通气时,膈肌反应在基因和蛋白质水平上存在显著的年龄相关差异,这对年龄相关的断奶问题和死亡率具有临床重要性。通过比较幼鼠和老年大鼠之间的富集途径,结果表明,在CMV长期存在期间,老年大鼠的膈肌发生了剧烈的免疫和炎症反应,而年轻大鼠则没有。这提示应慎重考虑在老年COVID-19患者中使用机械通气,使用时间应尽可能短(特别是有控制的机械通气)。其他挽救生命的机械通气方式可能是重要的,造成较少的肺损伤,如负压通气。
数据和材料的可用性
在当前研究中使用的数据集可以通过合理的请求从通讯作者处获得。
缩写
- CCL2:
-
C-C基序趋化因子2
- CCL3:
-
C-C基序趋化因子
- CCL5:
-
C-C基序趋化因子
- CCL7:
-
C-C基序趋化因子
- CCL17:
-
C-C基序趋化因子17
- CCL20:
-
C-C基序趋化因子
- 处于:
-
生长调节蛋白
- CXCL2:
-
C-X-C基序趋化因子
- CXCL3:
-
C-X-C基序趋化因子
- CXCL5:
-
C-X-C基序趋化因子
- CXCL9:
-
C-X-C基序趋化因子
- Cpe:
-
羧肽酶E
- Eda2r:
-
肿瘤坏死因子受体超家族成员
- Tnfrsf12a:
-
肿瘤坏死因子受体超家族成员12a
- Itgb1bp2:
-
整合素-1结合蛋白2
- 置:
-
Follistatin
- Cyr61:
-
蛋白质CYR61
- 促红细胞生成素:
-
促红细胞生成素
- il - 6:
-
白细胞介素- 6
- IL-1B:
-
Interleukin-1β
- CSF2:
-
粒细胞巨噬细胞集落刺激因子2
- MMP9:
-
基质金属肽酶9
- MMP13:
-
基质金属肽酶13
- CIM:
-
危重症肌病
- VIDD:
-
呼吸机诱导的膈肌功能障碍
- 英国石油公司:
-
生物过程
- MF:
-
分子功能
- 答:
-
蜂窝组件
- 我:
-
新陈代谢
- 吉普赛人:
-
遗传信息处理
- EIP:
-
环境信息处理
- CP:
-
细胞过程
- 操作系统:
-
有机系统
- 高清:
-
人类疾病
- 弟弟:
-
药物开发
- SASP:
-
衰老相关的分泌表型
参考文献
Grasselli G, Zangrillo A, Zanella A, Antonelli M, Cabrini L, Castelli A,等对意大利伦巴第大区重症监护室收治的1591例感染SARS-CoV-2患者的COVID-19 ICU网络基线特征和结果进行了研究。Jama。2020;323(16):1574 - 81。https://doi.org/10.1001/jama.2020.5394.
安志伟,陈志伟。免疫老化可能会加剧COVID-19。科学(纽约,纽约州)。2020, 369(6501): 256 - 7。
Merad M, Martin JC。COVID-19患者的病理性炎症:单核细胞和巨噬细胞的关键作用。免疫免疫学杂志2020;20(6):355-62。https://doi.org/10.1038/s41577-020-0331-4.
老龄化人群研究中的炎症标志物。老龄问题研究,2011;10(3):319-29。https://doi.org/10.1016/j.arr.2010.11.002.
Franceschi C, Garagnani P, Vitale G, Capri M, Salvioli S.炎症和“服装老化”。中国内分泌杂志,2017;28(3):199-212。https://doi.org/10.1016/j.tem.2016.09.005.
卡明斯MJ,鲍德温MR,艾布拉姆斯D,雅各布森SD,迈耶BJ,巴洛EM,等。纽约市COVID-19危重成人的流行病学、临床病程和结局:一项前瞻性队列研究《柳叶刀》,2020;395(10239):1763-70。https://doi.org/10.1016/s0140 - 6736 (20) 31189 - 2.
斯卢茨基AS,拉涅利VM。呼吸机致肺损伤。新英格兰医学杂志,2013;369(22):2126-36。https://doi.org/10.1056/NEJMra1208707.
瓦西里科波洛斯T, Petrof BJ。呼吸机诱发的膈肌功能障碍。美国呼吸和重症监护医学杂志。2004年,169(3):336 - 41。https://doi.org/10.1164/rccm.200304-489CP.
Goligher EC, Ferguson ND, Brochard LJ。机械通气的临床挑战。柳叶刀(伦敦,英国)。2016, 387(10030): 1856 - 66。
Corpeno R, Dworkin B, Cacciani N, Salah H, Bergman HM, Ravara B,等。机械通气致大鼠膈肌收缩功能障碍的时间过程分析。中国生物医学工程杂志,2014;29(4):529 - 529。https://doi.org/10.1113/jphysiol.2014.277962.
Ogilvie H, Cacciani N, Akkad H, Larsson L.靶向热休克蛋白以年龄依赖的方式缓解呼吸机诱导的膈肌功能障碍。前沿物理。2016;7:417。
COVID-19的机械通气:解释当前的流行病学。美国呼吸与重症监护医学杂志2020;202(1):1 - 4。https://doi.org/10.1164/rccm.202004-1385ED.
重症监护病房病人肌肉萎缩的实验动物模型。重症监护医学。2007;35(9增刊):S484-7。https://doi.org/10.1097/01.CCM.0000278055.40121.54.
急性四肢瘫痪肌病:一种获得性“肌病”。Adv Exp医学生物学,2008;642:92-8。https://doi.org/10.1007/978-0-387-84847-1_8.
赵晓霞,李晓霞,李晓霞,等。在一种新的大鼠重症监护病房模型中机械沉默反应的优先骨骼肌肌球蛋白损失:潜在机制。中国生物医学工程杂志,2011;29(8):344 - 344。https://doi.org/10.1113/jphysiol.2010.202044.
张晓东,李志强,张志强,等。伴侣共诱导剂BGP-15可缓解通气诱导的膈肌功能障碍。中国生物医学工程学报,2016;26(3):366 - 366。
张志刚,张志刚,张志刚。中/长期控制机械通气对膈肌纤维响应的影响。Exp Gerontol. 2014; 59:28-33。https://doi.org/10.1016/j.exger.2014.06.017.
Kim D, Paggi JM, Park C, Bennett C, Salzberg SL.基于HISAT2和hisat基因型的基因组测序和基因分型。中国生物工程学报。2019;37(8):907-15。https://doi.org/10.1038/s41587-019-0201-4.
Anders S, Pyl PT, Huber W. HTSeq—用于处理高通量测序数据的Python框架。生物信息学(牛津,英国)。2015; 31(2): 166 - 9。
Love MI, Huber W, Anders S.用DESeq2调节RNA-seq数据的折叠变化和分散估计。中国生物医学工程学报。2014;15(12):550。https://doi.org/10.1186/s13059-014-0550-8.
于刚,王乐林,韩勇,何启勇。clusterProfiler:一个R包,用于比较基因集群之间的生物学主题。组学:综合生物学杂志。2012; 16(5): 284 - 7。https://doi.org/10.1089/omi.2011.0118.
Walter W, Sánchez-Cabo F, Ricote M. GOplot:一个将表达式数据与功能分析可视化结合的R包。生物信息学(牛津,英国)。2015; 31(17): 2912 - 4。
Krämer A, Green J, Pollard J Jr, Tugendreich S.匠心路径分析中的因果分析方法。生物信息学(牛津,英国)。2014; 30(4): 523 - 30。
Ochala J, Renaud G, Llano Diez M, Banduseela VC, Aare S, Ahlbeck K,等。实验性猪重症监护病房模型中的膈肌无力。公共科学图书馆,2011;6(6):e20558。https://doi.org/10.1371/journal.pone.0020558.
班迪西拉,陈永伟,陈永伟,郭兰松,等。猪ICU模型的基因表达和肌纤维功能。中国生物医学工程学报。2009;39(3):141-59。https://doi.org/10.1152/physiolgenomics.00026.2009.
阿伯勒纳扎尔,希玛特,哈塔米,怀特,布尔哈尼,卓姆帕利斯,等。负压通气可减少正常离体肺灌注时的炎症和肺水肿。中华心肺移植杂志,2018;37(4):520-30。https://doi.org/10.1016/j.healun.2017.09.007.
朱勇,陈志强,李志强,李志强。细胞衰老和衰老分泌表型:治疗机会。中华临床医学杂志,2013;23(3):366 - 366。https://doi.org/10.1172/JCI64098.
Pereira BI, De Maeyer RP, Covre LP, Nehar-Belaid D, Lanna A, Ward S,等。Sestrins诱导衰老样CD8+ T细胞的自然杀伤功能。中华免疫杂志2020;21(6):684-94。https://doi.org/10.1038/s41590-020-0643-3.
确认
我们非常感谢Ann-Marie Gustafsson和Yvette Hedström提供的优秀技术援助。
资金
本研究由瑞典研究委员会(8651,03610)、瑞典心肺基金会、斯德哥尔摩市议会(Alf 20150423,20170133)和卡罗林斯卡学院资助。由卡罗林斯卡学院提供的开放获取资金。
作者信息
作者及隶属关系
贡献
这项实验工作是在瑞典卡罗林斯卡学院生理学和药理学系Lars Larsson的研究实验室进行的。该研究由LL设计和监督。LL和NC采集样品。QL在RNA-seq和Olink蛋白质组学之前进行了RNA和蛋白质提取等准备工作。YW和XZ对RNA-seq和Olink蛋白质组学分析进行了数据处理和分析。ABA辅助RNA和蛋白质的提取。ABA和NC协助修改稿件。QL和YW在LL的协助下完成了手稿。所有作者都阅读并批准了最终的手稿。
相应的作者
道德声明
伦理批准并同意参与
这项研究得到了卡罗林斯卡学院和乌普萨拉大学伦理委员会的批准。
发表同意书
不适用
相互竞争的利益
作者宣称他们之间没有利益冲突。
额外的信息
出版商的注意
伟德体育在线施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
补充信息
附加文件1。
补充图1:膈膜对CMV反应的基因和蛋白质特征。补充图2:年轻大鼠对CMV的反应中横膈膜的顶级GO术语和涉及的DEGs。补充图3:老年大鼠对CMV的反应中膈肌的顶级GO术语和涉及的DEGs。补充图4:年轻大鼠“氧化磷酸化”KEGG通路和涉及膈肌的DEGs对CMV的反应。补充图5:年轻大鼠对CMV的反应中“钙信号通路”和涉及膈肌的DEGs。补充图6:“细胞因子-细胞因子受体相互作用”KEGG通路及涉及膈肌的DEGs和DEPs对CMV的反应。补充图7:“TNF信号通路”和涉及膈肌的DEGs和DEPs对CMV的反应。补充图8:“NF-kappa B信号通路”,涉及膈肌的DEGs和DEPs对CMV的反应。
附加文件2。
补充表1:cmv诱导的膈肌DEGs和DEPs。
附加文件3。
补充表2:cmv诱导的血浆DEPs。
附加文件4。
补充表3:隔膜中富集的氧化石墨烯。
附加文件5。
补充表4:膈肌KEGG通路富集。
附加文件6。
补充表5:血浆中KEGG通路富集。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条所提供的资料,除非在资料的信用额度中另有说明。
关于本文
引用本文
吕,Q,文,Y,张,X。et al。多组学揭示了机械通气对膈肌反应的年龄相关差异:一项试点研究。骨骼肌11, 11(2021)。https://doi.org/10.1186/s13395-021-00267-4
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s13395-021-00267-4
关键字
- 机械通风
- 年龄
- VIDD
- Hyperinflammation
- 新型冠状病毒肺炎