- 方法gydF4y2Ba
- 开放获取gydF4y2Ba
- 发表:gydF4y2Ba
一种基于冷冻处理的纯卫星细胞分离和长期扩增的新方法gydF4y2Ba
骨骼肌gydF4y2Ba体积gydF4y2Ba11gydF4y2Ba,文章号:gydF4y2Ba7gydF4y2Ba(gydF4y2Ba2021gydF4y2Ba)gydF4y2Ba
摘要gydF4y2Ba
卫星细胞(SCs)是一种能够再生受损肌肉的肌肉干细胞。其功能潜能的研究依赖于在体外连续传代后分离和扩增具有保存肌源性的纯SCs的方法的可用性。在这里,我们描述了冰冷处理(ICT)方法,这是一种简单、经济和有效的方法,用于分离和体外扩增高纯度的小鼠和人SCs。该方法将含有黏附肌肉单个核细胞的异质混合物的培养皿在冰上(0°C)进行短暂(15-30分钟)培养,只分离SCs,并产生比其他常用分离方法更高纯度的培养物。ICT方法可作为一种温和的传代技术,允许SC在较长时间内扩张,而不影响其增殖和分化潜力。此外,利用ICT方法分离和扩增的SCs能够在体内再生损伤肌肉。ICT方法涉及最少的细胞操作,不需要任何专业知识或昂贵的试剂,速度快,重复性高,并大大减少了为获得足够数量的SCs所需的动物或人类活检的数量。这种方法的成本效益、可获得性和技术简单性,以及其显著的效率,无疑将加速SC的基础和转化研究,使其治疗用途更接近临床。gydF4y2Ba
背景gydF4y2Ba
肌肉被赋予了一种特殊的再生能力,这主要是由于一种称为卫星细胞(SCs)的常住干细胞[gydF4y2Ba1gydF4y2Ba,gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3.gydF4y2Ba].位于肌纤维基板和质膜之间的SCs对损伤或各种应激刺激作出反应,并通过增殖、自我更新和分化形成新的肌纤维[gydF4y2Ba4gydF4y2Ba,gydF4y2Ba5gydF4y2Ba].当SCs被激活时,其中一部分被鉴定为Pax7gydF4y2Ba+gydF4y2BaMyoDgydF4y2Ba-gydF4y2Ba补充干细胞池,而其他细胞获得MyoD (Pax7gydF4y2Ba+gydF4y2BaMyoDgydF4y2Ba+gydF4y2Ba),分化为成肌细胞,进入成肌程序。经过几轮分裂后,成肌细胞产生肌原蛋白gydF4y2Ba+gydF4y2Ba肌细胞,融合在一起形成新的肌纤维[gydF4y2Ba1gydF4y2Ba,gydF4y2Ba4gydF4y2Ba,gydF4y2Ba6gydF4y2Ba,gydF4y2Ba7gydF4y2Ba,gydF4y2Ba8gydF4y2Ba,gydF4y2Ba9gydF4y2Ba].gydF4y2Ba
研究SCs功能潜能的一个主要障碍是缺乏涉及最小细胞操作的分离方法,并允许在体外连续传代后分离和扩增具有保留肌源性的高纯SCs [gydF4y2Ba10gydF4y2Ba,gydF4y2Ba11gydF4y2Ba,gydF4y2Ba12gydF4y2Ba].此外,SC移植治疗的成功取决于是否有一种有效的方法在体外分离和扩增这些未分化状态和足够数量的细胞[gydF4y2Ba13gydF4y2Ba].gydF4y2Ba
目前常用的SCs分离方法主要有三种:预镀法、荧光活化细胞分选法(FACS)和磁珠分离法。gydF4y2Ba
预镀方法基于肌肉细胞的不同粘附性能,其中SCs的粘附性最低。酶解后,骨骼肌细胞的异质混合物被镀到未涂层的培养皿上,在37℃下孵育1 - 24小时gydF4y2Ba○gydF4y2BaC,收集非粘附细胞,并将其镀在新的胶原蛋白涂层培养皿上[gydF4y2Ba10gydF4y2Ba,gydF4y2Ba11gydF4y2Ba,gydF4y2Ba12gydF4y2Ba,gydF4y2Ba14gydF4y2Ba].由此产生的细胞培养物以不同比例同时含有SCs和成纤维细胞。为提高SC纯度,可在6天内每24小时重复一次前镀步骤[gydF4y2Ba10gydF4y2Ba].虽然这种方法廉价且简单,但其主要缺点是耗时长,且培养物纯度不一,到培养第7天,成纤维细胞被污染和过度生长,导致肌管早期衰老和脱离[gydF4y2Ba10gydF4y2Ba].最近描述的一种预镀方法引入了重镀步骤,即在2天的膨胀后,将粘附的细胞与胰蛋白酶分离,并将其重涂到涂有Matrigel的培养皿中,从而产生纯度大大提高的SC培养物[gydF4y2Ba15gydF4y2Ba].gydF4y2Ba
FACS分选方法对预先标记有SC特异性抗体的肌肉单个核细胞进行分选。在用各种酶消化肌肉后,所产生的细胞混合物被标记为特定抗体,以方便识别SCs,然后使用FACS分选仪对其进行分选[gydF4y2Ba16gydF4y2Ba,gydF4y2Ba17gydF4y2Ba,gydF4y2Ba18gydF4y2Ba,gydF4y2Ba19gydF4y2Ba,gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba21gydF4y2Ba].目前,FACS分选方法是SCs分离和研究的金标准。然而,这种方法有一些缺点,包括高成本和对FACS分选仪器的要求。此外,这种方法耗时,需要专业知识来执行,细胞纯度可以是可变的。细胞标记步骤之后的分选程序可能会潜在地对细胞造成压力或损伤,降低其活力,或改变其体外功能特性[gydF4y2Ba12gydF4y2Ba].第三种方法是基于磁单元分离(MACS),使用磁柱和SC专用磁珠试剂盒[gydF4y2Ba22gydF4y2Ba].它是基于磁标记和去除其他细胞系的SCs的负选择。因为这种方法假定所有其他类型的细胞都成功地从肌肉细胞制剂中除去,所以它不如FACS分选方法精确。这种方法执行成本高,耗时长,对细胞有压力。至于其他两种方法,细胞纯度是可变的,通常到第7天,SC培养物就会被成纤维细胞过度生长[gydF4y2Ba10gydF4y2Ba,gydF4y2Ba12gydF4y2Ba].gydF4y2Ba
因此,需要新的和改进的方法来分离、扩增和培养SCs。在这里,我们描述了一种简单,廉价,高效的方法来分离高纯度的小鼠和人SCs,可以在体外连续扩增以获得足够数量的具有保留增殖潜力的SCs,能够在体内再生损伤肌肉。gydF4y2Ba
方法gydF4y2Ba
老鼠gydF4y2Ba
C57BL / 10 scsn -gydF4y2BaDmdgydF4y2BamdxgydF4y2Ba、C57BL/10ScSn和C57BL/6J小鼠购自Jackson实验室(Bar Harbor, ME, USA)。雄性和雌性小鼠都被使用。这些小鼠被安置在萨皮恩扎大学组织学部门认可的动物设施中。所有程序均经意大利卫生部批准,并根据欧盟法规和意大利动物研究法进行。gydF4y2Ba
人体肌肉来源gydF4y2Ba
肌肉活检(臀大肌)取自在意大利罗马Umberto I医院骨科和创伤科接受手术的患者(8男7女,年龄50-90岁)。根据意大利法律,作者不需要要求机构审查委员会或伦理委员会批准这类研究。在任何情况下,所有患者都同意进行术中肌肉活检,并发表所获得的临床和实验室数据。gydF4y2Ba
卫星细胞的冷冻分离方法gydF4y2Ba
SCs是从4 - 8周龄小鼠后肢肌肉或人体活检中分离出来的。肌肉用剪刀解剖,用手术刀在含有DMEM的培养皿中细切(Sigma-Aldrich, St. Louis, MO, USA, D5671)。然后用浓度为0.4 mg/ml的PBS (Sigma-Aldrich)中的10 ml/g胶原酶II型肌肉(Sigma-Aldrich, SCR103)在37°C的水浴中搅拌45分钟。用DMEM 10% FBS阻断消化,离心肌肉制剂并去除上清后,用10 ml/g胶原酶/ disase肌肉,浓度为1 mg/ml (Roche, Basel, CH, 11097113001),在无钙镁PBS (Sigma-Aldrich)中进行第二次消化,在37°C的水浴中搅拌30分钟。消化后的肌肉先经过70 μm细胞滤网,再经过40 μm细胞滤网,得到单细胞悬浮液。接下来,将细胞离心,在DMEM 10% FBS (Sigma-Aldrich, F2442)中重悬,计数并以2 × 10镀膜gydF4y2Ba6gydF4y2Ba细胞/100毫米培养皿(未涂布)(Corning, NY, USA, 430167), 37℃孵育1小时。收集非粘附细胞,离心,细胞颗粒在DMEM 10% FBS中重悬,再次镀,37℃再孵育1小时。第二次预镀后,收集非粘附细胞,离心,计数,在SC生长培养基(GM) DMEM, 20%马血清(赛默飞世尔科学公司,沃尔瑟姆,马萨诸塞州,美国,26050088),3%鸡胚提取物(Seralab, CE-650-J)中重新悬浮,并在10点时镀入100毫米培养皿中,涂有0.1%明胶(干细胞技术公司,温哥华,加拿大,07903)gydF4y2Ba6gydF4y2Ba细胞/菜。第二天,用PBS清洗含有不同黏附肌肉细胞混合的培养皿3次,并在每个培养皿中加入10毫升冰冷的PBS。然后将盘子放在冰上(0°C) 15-30分钟,偶尔手动轻轻摇晃(旋转运动)。收集分离的细胞,离心,在GM中重悬,并以10的密度镀入0.1%明胶涂层的35mm培养皿(Corning, 353001)gydF4y2Ba3.gydF4y2Ba细胞/菜。为了诱导分化,在添加GM后的第3天,将增殖细胞培养在含有DMEM 5%马血清、1%鸡胚提取物的DM培养基中。gydF4y2Ba
磁珠标记卫星细胞分离gydF4y2Ba
磁珠标记小鼠SC分离使用SC分离试剂盒(Miltenyi Biotech, Bergisch Gladbach, DE, REF: 130-104-268),如前所述[gydF4y2Ba23gydF4y2Ba].简单地说,切碎的肌肉如上所述被消化。将消化后的肌肉通过70 μm和40 μm细胞过滤器,分离得到的单细胞悬浮液离心,重悬于80 μl缓冲液(PBS pH 7.2, 0.5% FBS, 2 mM EDTA)中,每克肌肉加入20 μl卫星细胞分离试剂盒,4℃孵育15 min。接下来,将细胞悬液通过放置在MACS分离器(Miltenyi Biotech)磁场中的LS柱(Miltenyi Biotech, 130-042-401)。将未标记的SCs收集到flow-through中,计数、洗涤、重悬于生长培养基(GM)中,以10的密度镀至35mm培养皿中gydF4y2Ba3.gydF4y2Ba细胞/菜。gydF4y2Ba
小鼠和人SCs分别在含有DMEM、20%马血清(Sigma-Aldrich)、3%鸡胚提取物的GM中培养,或在含有DMEM、5%马血清、1%鸡胚提取物的DM中培养。gydF4y2Ba
胰蛋白酶脱离SCgydF4y2Ba
用PBS冲洗SCs一次,然后用胰蛋白酶- edta溶液(Sigma-Aldrich, T3924)在37℃下孵育5分钟。然后收集SCs,离心,重悬于GM中,并以10的密度镀金gydF4y2Ba3.gydF4y2Ba细胞/菜。gydF4y2Ba
SC移植gydF4y2Ba
移植前一天诱发急性肌肉损伤。为诱导胫骨肌肉损伤,用30 Gauge微注射器注射Naja Pallida Cardiotoxin (10 μM) (Latoxan ZA, Les Auréats, Fr) 0.01 ml [gydF4y2Ba23gydF4y2Ba,gydF4y2Ba24gydF4y2Ba,gydF4y2Ba25gydF4y2Ba,gydF4y2Ba26gydF4y2Ba].gydF4y2Ba
细胞移植时,用20 μl DMEM 2% FBS (Sigma-Aldrich)重悬15000个SCs,用30 Gauge微注射器单次注射入单腿TA肌。对侧TA肌只注射PBS作为对照。gydF4y2Ba
免疫荧光和显微技术gydF4y2Ba
免疫荧光分析培养SCs固定在PFA 4% 10分钟RT, permeabilized在冷甲醇- 20°C 6分钟,封锁在5%山羊血清在PBS 30分钟RT,和孵化一夜之间在4% BSA在PBS 4°C以下主要抗体:鼠标anti-Pax7-c(美国1:10 DSHB,爱荷华市,IA),兔子anti-MyoD(1:50圣克鲁斯甜:sc - 304,达拉斯,TX,美国),鼠标anti-myogenin (1:20, DSHB),鼠标anti-Myosin重链(1:20 DSHB),和鼠标anti-desmin (1:20, DSHB)。第二天,SCs在PBS中洗涤3次15分钟,然后用二抗山羊抗兔Alexa Fluor 488 (1:1000, Abcam)和山羊抗小鼠Alexa Fluor 555(1:1000,赛默飞世尔科学公司)在PBS中稀释1% BSA, rt 1小时。核用Hoechst反染色。gydF4y2Ba
为了对WT SCs移植的mdx TA肌肉进行免疫荧光分析,将8 μm厚的肌肉冷冻切片在4% PFA中室温(RT)固定10 min,然后在- 20℃冷甲醇中渗透6 min。然后,切片用5%山羊血清(Sigma-Aldrich)在PBS中rt封闭30分钟。接下来,切片用兔抗肌萎缩蛋白抗体(1:200,Abcam, Cambridge, UK)在4℃孵育过夜。第二天,切片清洗,用山羊抗兔Alexa Fluor 488 (1:1000 Abcam)二抗孵育。核用Hoechst反染色。gydF4y2Ba
样品在Zeiss Axioskop 2 Plus荧光显微镜下分析(Carl Zeiss, Oberkochen, DE)。gydF4y2Ba
用倒置相差显微镜(Nikon Eclipse, TS100)获取亮场图像。使用尼康DS-Fi2相机和NIS Elements 4.0版成像系统获取图像。gydF4y2Ba
CFSE染色gydF4y2Ba
分离的SCs在培养前用浓度为1 μM的CFSE (ThermoFisher Scientific)在37°C黑暗环境下染色10分钟。培养4天后,用Accutase溶液(Sigma-Aldrich)分离细胞。使用CyAn ADP (DAKO)流式细胞仪采集样品,使用FlowJo软件版本10 (FlowJo LLC, Ashland, OR, USA)分析采集的数据。gydF4y2Ba
RNA分离和实时定量PCRgydF4y2Ba
对于RNA制备,细胞用TRI试剂(Sigma-Aldrich)裂解,并按前面描述的方法处理[gydF4y2Ba23gydF4y2Ba].使用SensiFAST™cDNA Synthesis Kit (Bioline, Memphis, TN, USA)进行反转录。实时荧光定量PCR检测方法gydF4y2BaMIQEgydF4y2Ba标准,使用SensiFAST™SYBR No-ROX Kit (Bioline),遵循制造商的协议。所有反应都重复进行。使用ABI PRISM 7500序列检测系统(Life Technologies, Carlsbad, CA, USA)收集和分析数据。定量RT-PCR值归一化为GAPDH mRNA的表达。使用2−ΔΔCT方法计算相对基因表达量,并报告为基因表达的平均倍数变化。gydF4y2Ba
使用以下引物进行扩增:Pax7 (FW: 5 ' GTCCCAGTCTTACTGCCCAC 3 ', RV: 5 ' TGTGGACAGGCTCACGTTTT 3 '), Myogenin (FW: 5 ' GCATGGAGTTCGGTCCCAA 3 ', RV: 5 ' TATCCTCCACCGTGATGCTG 3 '), GAPDH (FW: 5 ' ACCCAGAAGACTGTGGATGG 3 ', RV: 5 ' CACATTGGGGGTAGGAACAC 3 ')。gydF4y2Ba
克隆性肌原性试验gydF4y2Ba
在克隆肌原性试验中,将SCs在生长培养基中以每孔1个细胞的速度镀入0.1%明胶涂层的96孔板中(不包括板的外孔)。在培养24、48和72 h时评估菌落形成和细胞数量。gydF4y2Ba
统计分析gydF4y2Ba
所有统计分析均使用GraphPad Prism软件版本8 (La Jolla, CA, USA)进行。数据以均数±标准差表示。使用未配对的2尾Student 's来确定统计学意义gydF4y2BatgydF4y2Ba用韦尔奇不平等方差校正法进行检验。一个gydF4y2BaPgydF4y2Ba≤0.05为有统计学意义。gydF4y2Ba
结果gydF4y2Ba
用冷冻处理方法分离和鉴定肌肉SCsgydF4y2Ba
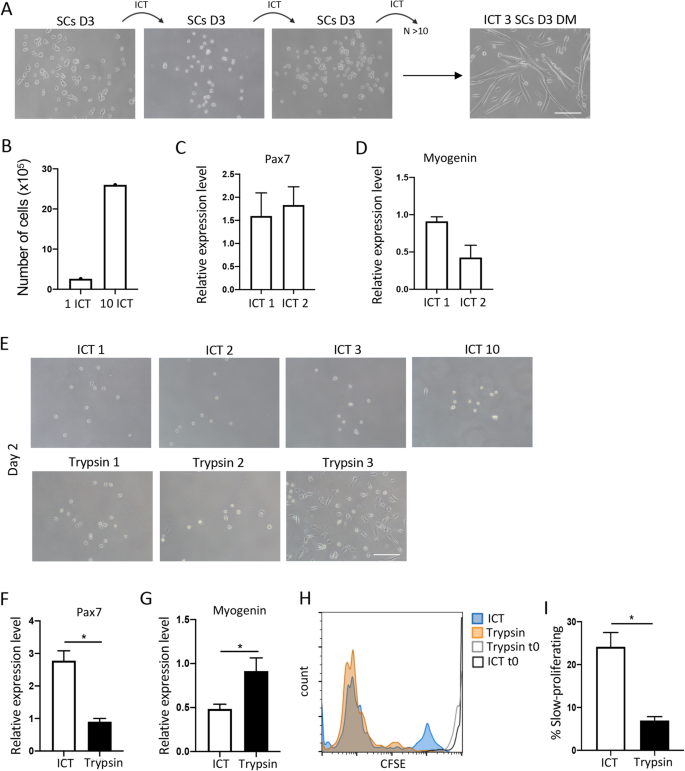
先前的研究表明,低温会导致细胞粘附降低,这可能是由于粘附受体的下调[gydF4y2Ba27gydF4y2Ba,gydF4y2Ba28gydF4y2Ba].与通常污染SC培养的其他细胞(如成纤维细胞)相比,SC被认为粘附性较差[gydF4y2Ba11gydF4y2Ba,gydF4y2Ba14gydF4y2Ba].考虑到这一点,以及像所有干细胞一样,SCs对应激信号敏感,并且是第一批对损伤做出反应的肌肉驻留细胞之一[gydF4y2Ba4gydF4y2Ba,gydF4y2Ba5gydF4y2Ba],我们假设将异质培养的肌肉细胞置于温和的应激刺激下,如低温,只会导致SCs分离。为了验证这一假设,我们获得了酶消化后的肌肉细胞混合物,并在未涂层的培养皿上预镀2小时后,在明胶涂层的培养皿上培养过夜。第二天,在清洗和去除未粘附的细胞和碎片后,我们将异质肌肉细胞放在冰上30 '(图2)。gydF4y2Ba1gydF4y2Baa, b).这个时间点是根据在冰上15、30、45和60 '后获得的SCs的纯度和数量选择的。虽然随着培养时间的延长,获得的SCs数量增加,但SCs纯度从15-30 '时的100%下降到45 '和60 '时的95%和90%(数据未显示)。冷冻处理(ICT)方法可以用于从含有异质肌肉细胞的原始培养皿中获得SCs,至少在培养的前3天。将异质肌肉培养皿置于冰上30 ',结果只有SCs分离,产生高度纯的SCs培养,在分化培养基中增殖并分化为肌管(图)。gydF4y2Ba1gydF4y2Ba罪犯)。通过SC标记Pax7和MyoD的表达,用ICT方法分离的卫星细胞纯度为100%(图2)。gydF4y2Ba1gydF4y2Bac).增殖第3天,100%的细胞卫星细胞标记Pax7阳性,其中97%被激活并表达MyoD (Pax7gydF4y2Ba+gydF4y2BaMyoDgydF4y2Ba+gydF4y2Ba)(图。gydF4y2Ba1gydF4y2Bac).为了检查ict分离的SCs的肌生能力,我们进行了克隆肌生实验,每孔电镀一个细胞并分析肌生菌落的形成。ICT法分离的卫星细胞显示出与磁珠法分离的SCs相似的40%的克隆肌原性和17小时的倍增时间(gydF4y2Ba图S1A和BgydF4y2Ba).肌球蛋白重链(MHC)的表达和肌管的形成进一步证实了培养细胞的肌源性。在分化培养基中培养3天后,SCs分化为成肌细胞,融合成表达MHC的肌管,融合指数为90%(图2)。gydF4y2Ba1gydF4y2Bad).培养开始时分离的SCs的纯度、融合指数和每个肌管的核素数量在ICT和磁细胞分离(MACS)分离的SCs之间相似(gydF4y2Ba图S1C-EgydF4y2Ba).然而,到第5-7天,用MACS法获得的培养物被PDGFRα等非肌源性细胞过度生长gydF4y2Ba+gydF4y2Ba成纤维细胞,导致过早的肌管脱离,而用ICT方法获得的培养几乎没有污染细胞(图。gydF4y2Ba1gydF4y2Bae、f)。gydF4y2Ba
利用ICT方法分离和鉴定肌肉SCs。gydF4y2Ba一个gydF4y2BaICT方法示意图。gydF4y2BabgydF4y2BaICT分离SCs的异质肌肉单个核细胞培养物的代表性亮场图像,以及ICT分离的SCs在生长培养基(GM)中D2、D4和在添加分化培养基(DM)后D3的代表性图像(gydF4y2BangydF4y2Ba= 15个独立实验)。gydF4y2BacgydF4y2Ba具有代表性的ict分离的SCs的Pax7(红色)、MyoD(绿色)和细胞核(蓝色)染色的免疫荧光图像,以及显示GM培养第3天Pax7和/或MyoD阳性细胞百分比的图表(gydF4y2BangydF4y2Ba= 3个独立实验)。gydF4y2BadgydF4y2Ba具有代表性的ict分离的SCs免疫荧光图像,显示肌球蛋白重链(MHC)(红色)和细胞核(蓝色),以及显示分化后融合百分比的图表(GM中4天,分化培养基中3天)(gydF4y2BangydF4y2Ba= 3个独立实验)。gydF4y2BaegydF4y2Baict分离的SCs和mb分离的SCs的代表性免疫荧光图像,显示肌原蛋白(红色)PDGFR⍺(绿色)和细胞核(蓝色),以及显示PDGFR百分比⍺的图表gydF4y2Ba+gydF4y2Ba细胞在转基因培养第5天。gydF4y2BafgydF4y2BaICT-和磁珠(MB)分离的SCs的代表性亮场图像,以及在培养第7天分化后ICT-和磁珠(MB)分离的SCs中肌源性细胞百分比的定量图(gydF4y2BangydF4y2Ba= 3个独立实验)。非肌源性细胞被鉴定为Pax7gydF4y2Ba-gydF4y2BaMyoDgydF4y2Ba-gydF4y2Ba肌管外的核。比例尺= 100 μm。误差柱表示平均值±sem。*gydF4y2BapgydF4y2Ba< 0.05的学生gydF4y2BatgydF4y2Ba测试。gydF4y2Ba
总的来说,这些结果证实了我们的假设,即ICT导致了SCs的优先分离,并且使用该方法可以分离出99-100%的纯SCs。gydF4y2Ba
ICT方法也可用于SCs的连续传代和长期扩展gydF4y2Ba
SC研究的一个主要障碍是培养的SCs在经过几次传代后失去了增殖潜力,开始分化为肌管,从而限制了体外连续扩增的SCs数量。分化潜能的丧失也随着传代数量的增加而被注意到[gydF4y2Ba10gydF4y2Ba,gydF4y2Ba11gydF4y2Ba,gydF4y2Ba12gydF4y2Ba,gydF4y2Ba13gydF4y2Ba,gydF4y2Ba29gydF4y2Ba].我们认为,由于ICT导致SC分离,它也可以用于增殖SC的培养。事实上,将增殖的SCs放在冰上30分钟,大约30%的增殖细胞脱离,我们能够连续传代和扩张增殖的SCs,而不影响它们的增殖和分化能力(图2)。gydF4y2Ba2gydF4y2Baa).我们使用ICT方法增殖SCs,然后依次对每个已建立的增殖SCs培养进行增殖(超过10个传代)。这种方法的平均产量为2.5 × 10gydF4y2Ba6gydF4y2Ba细胞/g肌肉(图;gydF4y2Ba2gydF4y2Bab).使用ICT方法传代的SCs没有失去增殖和分化潜力,Pax7和肌生成蛋白基因表达有最低限度的改变(图。gydF4y2Ba2gydF4y2Bac, d)。虽然ict传代的SCs即使在10次传代后仍保持其增殖和分化能力,但使用最常用的传代试剂胰蛋白酶传代的SCs在仅2次传代后就失去了形成新的肌源性菌落的能力,而是开始分化成肌管(图。gydF4y2Ba2gydF4y2Baeg)。与胰蛋白酶分离SCs类似,使用更温和的分离溶液(如Accutase)分离的SCs在超过3代后表现出加速分化(数据未显示)。gydF4y2Ba
利用ICT方法研究SCs的连续扩增和长期增殖潜力。gydF4y2Ba一个gydF4y2BaICT 1、ICT 2和ICT 3后GM培养第3天SCs的代表性亮场图像,ICT 3后DM培养第3天分化细胞的代表性亮场图像(gydF4y2BangydF4y2Ba= 10个独立实验)。gydF4y2BabgydF4y2BaGM培养第3天、ICTs 1次和ICTs 10次后的SCs总数(gydF4y2BangydF4y2Ba= 10个独立实验)。gydF4y2BacgydF4y2Ba实时荧光定量PCR分析ict1和ict2培养后第2天GM细胞中Pax7基因的表达(gydF4y2BangydF4y2Ba= 3个独立实验)。gydF4y2BadgydF4y2Ba应用实时荧光定量PCR技术分析ICT1和ict2培养后GM培养第5天SCs中肌原蛋白的表达(gydF4y2BangydF4y2Ba= 3个独立实验)。gydF4y2BaegydF4y2Ba在GM培养第2天,与ICT(顶部面板)和胰蛋白酶(底部面板)分离1-3天后,SCs的代表性图像。gydF4y2BafgydF4y2Ba在GM培养第2天,用实时荧光定量PCR分析与ICT或胰蛋白酶分离的SCs中Pax7基因的表达(gydF4y2BangydF4y2Ba= 3个独立实验)。gydF4y2BaggydF4y2Ba在转基因培养第5天,用实时荧光定量PCR分析与ICT或胰蛋白酶分离的SCs中肌原蛋白基因的表达(gydF4y2BangydF4y2Ba= 3个独立实验)。gydF4y2BahgydF4y2Ba在GM培养第0和第4天,CFSE标记ICT和胰蛋白酶分离的SCs的直方图有代表性的重叠。gydF4y2Ba我gydF4y2Ba图示GM培养第4天ICT或胰蛋白酶分离后cfse低增殖或缓慢增殖的SCs百分比(gydF4y2BangydF4y2Ba= 3个独立实验)。误差柱表示平均值±sem, *gydF4y2BapgydF4y2Ba< 0.05,以Student 's计算gydF4y2BatgydF4y2Ba测试。gydF4y2Ba
以往的研究表明,根据SCs的增殖速度,可以将其分为两个亚群:快速分裂和缓慢分裂[gydF4y2Ba30.gydF4y2Ba].慢分裂是SC的一个子集,已被证明具有茎干性和长期自我更新能力[gydF4y2Ba31gydF4y2Ba].快速分裂的SCs在传代后形成次生肌源性集落的能力有限,但与之不同的是,缓慢分裂的SCs在传代后形成次生肌源性集落[gydF4y2Ba30.gydF4y2Ba,gydF4y2Ba31gydF4y2Ba].为了检查快速和缓慢分裂的SCs在我们人群中的患病率,我们在电镀前用CFSE标记ict传代的SCs,并在3天后分析增殖率。我们比较了ict分离和传代的SCs与磁珠分离和胰蛋白酶传代的SCs的增殖率。与之前的观察结果一致,我们发现大多数使用商业试剂盒分离并经胰蛋白酶传代的活化SCs是快速分裂细胞(CFSE)gydF4y2Ba罗gydF4y2Ba),与缓慢分裂的细胞(CFSEgydF4y2Ba嗨gydF4y2Ba),少于总数的10%。有趣的是,虽然相似的异质性,但使用ICT方法分离和传代的SC在缓慢分裂的SC群体中富集(图2)。gydF4y2Ba2gydF4y2Bah, i)。gydF4y2Ba
接下来,我们研究了分化的ict分离SCs在培养中的寿命。使用ICT方法分离的高纯度SCs培养物产生的肌管可在培养物中维持1个月,而使用磁珠分离时仅维持7天(gydF4y2Ba图S2A-CgydF4y2Ba)或预镀方法(gydF4y2Ba图S2DgydF4y2Ba).gydF4y2Ba
总的来说,这些数据表明,与其他方法相比,ICT方法可以用于具有保存增殖和肌生潜能的SCs的连续扩增。gydF4y2Ba
为了研究ict分离和扩张的SCs再生损伤肌肉的潜力,我们将15,000个从野生型小鼠分离的SCs注射到24小时前损伤CTX的mdx小鼠(缺乏抗肌萎缩蛋白)的胫骨前肌。干细胞要么在ICT分离后立即注射,要么在ICT后体外扩张3天后注射。在ict分离后和体外扩张后立即移植两个SCs对再生过程的贡献程度相似,新形成的抗肌萎缩蛋白阳性纤维的出现证明了这一点(gydF4y2Ba图S3A和BgydF4y2Ba).移植的ict分离的SCs与磁珠分离的SCs再生损伤肌肉的能力无差异(gydF4y2Ba图S3C和DgydF4y2Ba).这些实验证实了用ICT方法分离出的SCs在移植后能够成功地移植物,并且在体外扩张后不会失去损伤肌肉再生的潜力。gydF4y2Ba
利用ICT方法高效分离、连续扩增和长期培养人类卫星细胞gydF4y2Ba
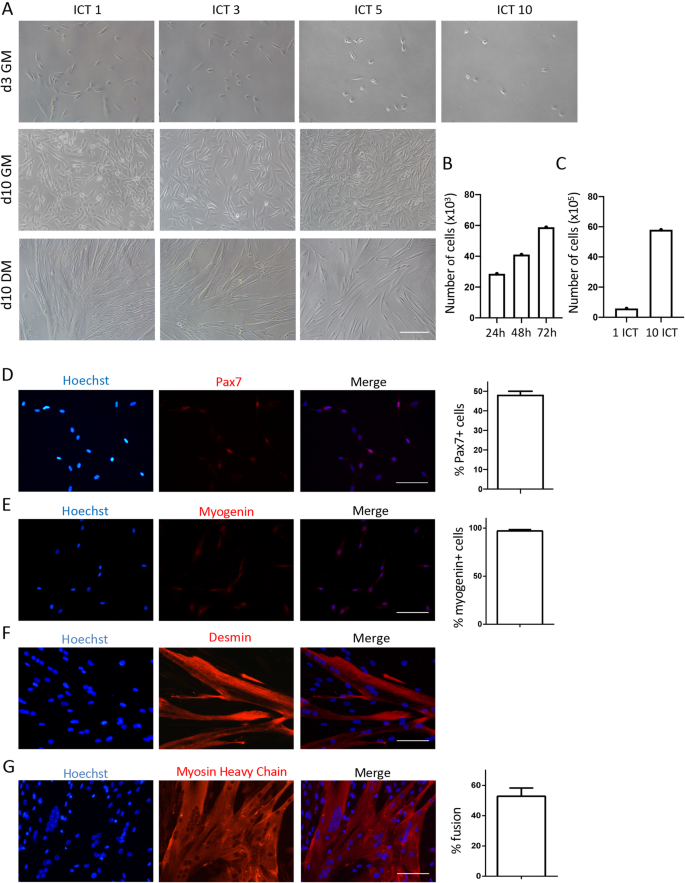
由于获得肌肉组织的困难,以及缺乏分离纯造血干细胞的方法,因此对人类造血干细胞的研究普遍落后于小鼠造血干细胞的研究,这些纯造血干细胞可以在体外扩增而不改变其生肌潜能[gydF4y2Ba13gydF4y2Ba].在证明了ICT方法在分离纯小鼠SCs方面的显著效率后,我们开始使用人类肌肉活检来重现这些发现。我们从50至90岁的手术患者中获得臀大肌标本。使用上述相同的方法,我们一致且可重复地获得了高纯度的造血干细胞培养(图2)。gydF4y2Ba3.gydF4y2BaA, d-g)来自人类肌肉细胞的异质群体(gydF4y2Ba图S4gydF4y2Ba),可以连续扩展10个以上的通道(图。gydF4y2Ba3.gydF4y2Baa).如先前报告[gydF4y2Ba32gydF4y2Ba],我们发现hsscs的增殖速度比小鼠SCs慢,倍增时间为46 h(图2)。gydF4y2Ba3.gydF4y2BaB),在隔离后第10天左右达到峰值,之后放缓。我们平均隔离了20 × 10左右gydF4y2Ba3.gydF4y2BaSCs/g肌肉。使用ICT方法,这些造血干细胞可以在2个月的时间内扩大300倍,最终达到6 × 10gydF4y2Ba6gydF4y2Ba/g肌肉(图;gydF4y2Ba3.gydF4y2Bac).前期研究表明,hsc在培养中迅速下调Pax7的表达[gydF4y2Ba33gydF4y2Ba].与他人一致[gydF4y2Ba33gydF4y2Ba],我们发现在培养第2天,Pax7在GM中的表达变化很大,在45 - 50%之间。gydF4y2Ba3.gydF4y2Bad).在转基因培养的第5天,几乎100%的造血干细胞的肌原蛋白呈阳性,这表明大多数造血干细胞已经激活了它们的肌原性程序(图5)。gydF4y2Ba3.gydF4y2Bae).第5天的desmin进一步证实了hSC培养的肌源性纯度(图。gydF4y2Ba3.gydF4y2Baf)和转入分化培养基后第10天的MHC表达(图。gydF4y2Ba3.gydF4y2Bag)。gydF4y2Ba
利用ICT方法分离和体外扩增人类卫星细胞。A.在GM培养的第3天和第10天,以及DM培养的第10天,ICT分离的人类SCs的代表性亮场图像(gydF4y2BangydF4y2Ba= 15个独立实验)。gydF4y2BabgydF4y2BaICT后24、48和72小时的人SCs数量gydF4y2BacgydF4y2Ba在1次和10次ict后,GM培养第3天的人类SCs总数。gydF4y2BadgydF4y2BaPax7(红色)和细胞核(蓝色)染色的人SCs代表性免疫荧光图像。图中显示了培养第2天Pax7阳性细胞的百分比。gydF4y2BaegydF4y2Ba具有代表性的人SCs免疫荧光染色的肌原蛋白(红色)和细胞核(蓝色)。图中显示转基因培养第5天肌原蛋白阳性细胞的百分比。gydF4y2BafgydF4y2Ba具有代表性的人SCs分化后的desmin(红色)和细胞核(蓝色)免疫荧光图像(GM 10天+ DM 5天)。gydF4y2BaggydF4y2Ba具有代表性的人SCs免疫荧光染色的肌球蛋白重链(MHC)(红色)和细胞核(蓝色)。图中显示分化后的融合百分比(10天GM + 10天DM)。(gydF4y2BangydF4y2Ba= 3个独立实验,每个实验分析10张图像)比例尺= 100 μm。误差柱表示平均值±semgydF4y2Ba
这些数据表明,ICT方法在用于人SCs分离时表现同样良好。gydF4y2Ba
讨论gydF4y2Ba
在过去十年中,在开发分离SCs的新方法方面取得了相当大的进展。然而,每一种可用的方法都至少有一个缺点,可能是纯度、成本、专业技术,或这些缺点的结合。gydF4y2Ba11gydF4y2Ba].在本研究中,我们描述了一种分离纯小鼠和人SCs的新方法,该方法成本低廉,操作简单,且可重复高效。ICT方法利用肌肉细胞不同的黏附特性,以及SCs对应激刺激快速反应的能力[gydF4y2Ba5gydF4y2Ba,gydF4y2Ba11gydF4y2Ba,gydF4y2Ba14gydF4y2Ba].因此,温和的冷应激刺激和冷诱导的粘连减少的结合,导致只有SCs脱离。将哺乳动物细胞暴露于冷应激可以减缓细胞周期的进程并抑制蛋白质合成。此外,根据冷应激的强度和持续时间,冷应激可激活凋亡程序,或导致坏死[gydF4y2Ba34gydF4y2Ba].因此,可以想象,长时间暴露在低温下可能会干扰SCs的生肌特性。然而,我们发现短暂的低温暴露并没有影响SCs在体外的增殖和分化能力,也没有影响其在体内的再生潜力,这表明ICT不会改变SC的功能。事实上,ICT分离的SCs与使用预镀方法或磁珠隔离试剂盒分离的SCs表现相似。值得注意的是,与我们的方法相比,磁珠和FACS分选分离方法在冰上的孵育时间要长得多,而且不会干扰SC在体内和体外的行为和功能[gydF4y2Ba16gydF4y2Ba,gydF4y2Ba17gydF4y2Ba,gydF4y2Ba21gydF4y2Ba,gydF4y2Ba22gydF4y2Ba].有趣的是,Marg A等人最近发现,在4°C、低血清培养基和无OgydF4y2Ba2gydF4y2Ba在37°C和21%的氧气下培养长达35天,导致SCs在纤维碎片外扩张。令人惊讶的是,生长出来的SCs菌落的纯度是100%的肌源性细胞,因为非肌源性细胞,如成纤维细胞,在低温条件下无法存活很长时间[gydF4y2Ba33gydF4y2Ba].因此,与其他类型的细胞相比,SCs对冷胁迫的耐受性可能更高,并且可以像我们的ICT方法一样利用这一特性来提高体外培养的SCs的纯度。gydF4y2Ba
最近,Yoshioka K等人描述了一种预镀方法的改进版本,通过引入重新镀步骤,将分离和纯化过程总共减少到2.5天,同时提高了细胞产量,并显著提高了所得SC培养物的纯度[gydF4y2Ba15gydF4y2Ba].在培养第2.5天进行的重镀步骤包括用胰蛋白酶分离所有粘附细胞,包括成纤维细胞和SCs,并在基质涂层培养皿上重新镀膜[gydF4y2Ba15gydF4y2Ba].虽然由此产生的SC培养的纯度与我们的相当,但我们的方法涉及的步骤总数更少,只有一个过夜的预镀。此外,ICT方法可以作为一种非常温和的传代技术,允许SCs在体外长期连续扩增,而不改变其增殖和分化特性。尽管FACS分选方法是并将继续是分离后立即研究SCs的金标准,但ICT方法可能会成为体外扩增SCs的首选方法。在每次ICT通过后,已经扩展的SCs可以冷冻保存,并存储到需要时。通过ICT方法,我们能够将增殖的小鼠和人类SCs传代至少10倍,将它们的数量分别扩大150倍和300倍。这与最常用的传代试剂胰蛋白酶相比具有明显的优势,我们和其他人已经证明,胰蛋白酶通常会在仅两次传代后加速传代sc的分化[gydF4y2Ba11gydF4y2Ba].胰蛋白酶除了是一种相对苛刻的酶传代试剂外,还会导致培养皿中所有细胞的分离,包括已经分化成肌管的SCs,以及任何污染细胞,这可能导致SC增殖潜力的丧失和加速分化。事实上,即使是像Accutase这样温和的分离溶液也会导致肌原性增殖特性的丧失并加速分化。相比之下,ICT方法只倾向于分离尚未分化的SCs,特别是先前已被证明保留茎干和长期自我更新能力的缓慢分裂种群[gydF4y2Ba31gydF4y2Ba].可以想象,作为“真正的”干细胞,对低温反应缓慢分裂的SCs是体内所谓的应激或损伤的第一反应者[gydF4y2Ba5gydF4y2Ba,这一假设将成为我们实验室未来研究的主题。gydF4y2Ba
在最近的一项研究中,Gregory WC等人证明,在体外维持在高丝裂原条件下,造血干细胞分化并失去其增殖潜力。他们通过抑制p38信号来阻止SCs的分化并促进其扩张[gydF4y2Ba35gydF4y2Ba].使用我们的方法,我们能够达到同样的效果,但只需最少的操作,就能在很长一段时间内维持体外造血干细胞的增殖能力,使用来自广泛年龄(50至90岁)的肌肉活检,达到类似的程度。这对于基础研究和临床研究都是一项重要的技术进步,因为它将允许研究人员获得足够数量的细胞用于移植或干预研究,同时减少所需的人体活检数量。事实上,基于干细胞的治疗的一个主要障碍是人类肌肉组织标本的稀缺和可用于移植的细胞数量有限。gydF4y2Ba
此外,成功的移植需要使用新鲜分离的SCs,因为在体外培养和扩大它们大大降低了它们的植入能力[gydF4y2Ba13gydF4y2Ba].在这里,我们展示了使用ICT方法分离和扩展的SCs不会失去它们的再生能力。gydF4y2Ba
ICT方法的另一个优点是提高了培养肌管的寿命。一般来说,SCs在培养第7天分化为肌管,不久之后开始分离[gydF4y2Ba11gydF4y2Ba,gydF4y2Ba12gydF4y2Ba].值得注意的是,用ICT方法分离和传代的SCs可以在培养中维持长达2个月,即使它们已经分化为肌管,这可能是由于缺乏污染细胞,如成纤维细胞。分离SCs的纯度对于体外研究至关重要,因为正如我们所证明的那样,即使97%的纯度也不足以防止非肌源性细胞的过度生长。虽然成纤维细胞产生的生长因子对细胞生长很重要,但在间充质干细胞的长期培养中与衰老诱导有关[gydF4y2Ba36gydF4y2Ba].gydF4y2Ba
结论gydF4y2Ba
在寻求新的和改进的SC分离方法的过程中,理想的技术将允许以最小的操作分离纯SCs,可以在不失去其茎性和再生能力的情况下在体外扩展。在分离细胞群纯度方面,ICT方法优于其他预镀方法或磁珠分离方法。与其他常用方法相比,该方法快速简便,除了酶解所需时间(1.5小时)外,对细胞的操作也最少。最后,使用ICT方法,可以在不失去其增殖和分化潜力的情况下延长SCs的扩增时间。这反过来又大大减少了获得足够数量细胞所需的小鼠或肌肉活检的数量。gydF4y2Ba
总的来说,这种方法的成本效益,可获得性和技术简单性,以及其显著的效率,代表了对现有方法的重大改进,毫无疑问将加速SC的基础和转化研究,使其治疗应用更接近临床。最后,这是一个概念验证研究,ICT方法可以进一步优化、适应和改进,以用于不同的实验设置。gydF4y2Ba
数据和材料的可用性gydF4y2Ba
在这项研究中产生或分析的所有数据都包含在这篇发表的文章[及其补充信息文件]中。gydF4y2Ba
本研究中使用和/或分析的数据集可根据合理要求从通讯作者处获得。gydF4y2Ba
参考文献gydF4y2Ba
张国昌,马鲁奇。卫星细胞:骨骼肌的建筑师。《生物工程学报》2014;107:161-81。gydF4y2Ba
王yx,杜蒙NA, Rudnicki MA。肌肉干细胞一览。中国生物医学工程学报(自然科学版)2014;gydF4y2Ba
毛罗A.骨骼肌纤维卫星细胞。中国生物化学杂志,2001;9:493-5。gydF4y2Ba
王yx, Rudnicki MA。卫星细胞,肌肉修复的引擎。中国生物医学工程学报。2012;13:127-33。gydF4y2Ba
张志刚,张志刚。骨骼肌干细胞的研究进展。npj再生医学。2018;3:24。gydF4y2Ba
Feige P, Rudnicki MA。肌肉干细胞。生物学报,2018;28:581-98。gydF4y2Ba
Sambasivan R, Yao R, Kissenpfennig A, van Wittenberghe L, Paldi A, Gayraud-Morel B,等。表达pax7的卫星细胞在成人骨骼肌再生中是不可或缺的。发展。2011;138:3647-56。gydF4y2Ba
卫星细胞对骨骼肌再生至关重要:边缘细胞返回中心舞台。开发(剑桥)。2012; 139:2845-56。gydF4y2Ba
陈建平,陈建平,陈建平,陈建平。骨骼肌干细胞修复骨骼肌的研究进展。中华临床医学杂志,2010;gydF4y2Ba
王志强,王志强,王志强,等。骨骼肌肌纤维的分离培养及其对卫星细胞的影响。方法Mol生物学,2013;446:431 - 68。gydF4y2Ba
骨骼肌卫星细胞:原代培养系统中分离和分析的背景和方法。方法Mol生物学,2012;798:21-52。gydF4y2Ba
Jonah D, Lee BCS, Lisa M, Larkin KWV。骨骼肌组织工程卫星细胞的分离纯化。《中华医学杂志》2015;3:117。gydF4y2Ba
Rinaldi F, Perlingeiro RCR。干细胞用于骨骼肌再生:治疗潜力和障碍。翻译2014年。gydF4y2Ba
贾瑞贝,吕安,郑波,李志强,等。用板前技术从小鼠骨骼肌中分离出含有干细胞的缓慢粘附细胞。Nat Protoc 2008; 163:409-17。gydF4y2Ba
吉冈K,北岛Y,冈崎N,千叶K, Yonekura A,小野Y.一种改进的从人/小鼠骨骼肌组织中分离高产量高纯度肌肉干细胞的预处理方法。前端细胞发育生物学2020;8:793。gydF4y2Ba
帕舒特A,奥莱尼克P,鲁德尼基MA。荧光激活细胞分选术分离肌肉干细胞。方法Mol biology, 2012; 798:53-64。gydF4y2Ba
刘l,张TH, Charville GW, Rando TA。荧光激活细胞分选分离骨骼肌干细胞。南京大学学报(自然科学版),2015;gydF4y2Ba
李俊,李俊杰,李文杰,黄华,等。从单个肌纤维中分选单个卫星细胞,揭示细胞表面标记和肌生成能力的异质性。Integr Biol(联合王国)。2013; 5:692 - 702。gydF4y2Ba
深田SI, Higuchi S, Segawa M, Koda KI,山本Y,辻川K,等。一种新型单克隆抗体纯化小鼠骨骼肌静止卫星细胞及细胞表面标记的研究。Exp Cell res 2004; 296:245-55。gydF4y2Ba
Sherwood RI, Christensen JL, Conboy IM, Conboy MJ, Rando TA, Weissman IL,等。成年小鼠肌源性祖细胞的分离:骨骼肌内和移植细胞的功能异质性。细胞。2004;119:543-54。gydF4y2Ba
孟德龙,李志强,李志强,等。骨骼肌再生卫星细胞的直接分离。中国生物医学工程学报,2005;gydF4y2Ba
布兰科博斯WE,姚CC,克莱默RH,布劳HM。基于α7整合素表达的小鼠原代成肌细胞的纯化Exp Cell res 2001; 265:212-20。gydF4y2Ba
Benedetti A, Fiore PF, Madaro L, Lozanoska-Ochser B, Bouché M.靶向pkcθ促进卫星细胞自我更新。中国生物化学杂志2020;21 (2)gydF4y2Ba
Fiore PF, Benedetti A, Sandonà M, Madaro L, de Bardi M, Saccone V,等。PKCθ缺失促进肌肉干细胞在慢性肌肉损伤中的再生能力中国生物化学杂志,2020;21:932。gydF4y2Ba
Rizzo G, di Maggio R, Benedetti A, Morroni J, Bouche M, Lozanoska-Ochser B.脾Ly6Chi单核细胞在肌营养不良损伤和修复中的重要作用。JCI Insight, 2020;5:e130807。gydF4y2Ba
Lozanoska-Ochser B, Benedetti A, Rizzo G, Marrocco V, di Maggio R, Fiore P,等。针对早期pkc θ依赖t细胞浸润的肌营养不良的小鼠模型减少疾病严重程度。中华病理学杂志。2018;44:323 - 333。gydF4y2Ba
张志刚,张志刚。中国仓鼠细胞黏附的研究。一、温度、代谢抑制剂和细胞表面大分子蛋白水解分离的影响。中国生物医学工程学报。2007;26(2):344 - 344。gydF4y2Ba
李志刚,朱春霞,陈志刚,陈志刚。整合素介导的细胞黏附的温度调节。中国生物工程学报,2010;gydF4y2Ba
町田S, Spangenburg EE, FW展位。原代大鼠肌肉祖细胞在传代过程中增殖和肌管形成减少。细胞增殖,2004;37:267-77。gydF4y2Ba
王志刚,王志刚。骨骼肌稳态的卫星细胞异质性研究。细胞生物学杂志,2016;26:434-444。gydF4y2Ba
小野Y, Masuda S, Nam HS, Benezra R, miyago - suzuki Y, Takeda S.成人肌肉中慢分裂卫星细胞具有长期自我更新能力。中国生物医学工程学报(自然科学版)2012;gydF4y2Ba
Charville GW,张TH, Yoo B, Santos PJ, Lee GK, shager JB,等。人肌肉干细胞的体外扩增和体内自我更新。干细胞报告。2015;5:21 - 32。gydF4y2Ba
马格,埃斯科巴,H, Gloy S, Kufeld M, Zacher J, Spuler A,等。人类卫星细胞具有再生能力,在基因上是可操作的。中华临床医学杂志。2014;124:4257-65。gydF4y2Ba
杨晓东,李志刚,李志刚,李志刚。热、冷胁迫对哺乳动物基因表达的影响。中国生物医学工程学报。2002;29(2):326 - 326。gydF4y2Ba
张志强,张志强,张志强,等。甲基转移酶Setd7的抑制使肌源性干细胞的体外扩增具有更好的治疗潜力。《细胞干细胞》2018;22:177-90。gydF4y2Ba
Ito T, Sawada R, Fujiwara Y, Seyama Y, Tsuchiya T. FGF-2通过下调TGF-β2抑制人间充质干细胞的细胞衰老生物化学与生物物理学报。2007;359:108-14。gydF4y2Ba
确认gydF4y2Ba
我们感谢Luca Madaro博士对手稿的批判性阅读和有益的讨论。gydF4y2Ba
资金gydF4y2Ba
这项工作得到了荷兰杜兴家长项目NL (DPP NL)对BLO的资助;意大利家长项目(PP, Italy)资助MB和罗马大学(# RP11715C7D238352, RM118164275C7EBE, RM11916B7E20311C资助MB;和# AR11715C7F9E158E, AR11816436905518和AR11916B7E2A7B64到AB)。gydF4y2Ba
作者信息gydF4y2Ba
作者及隶属关系gydF4y2Ba
贡献gydF4y2Ba
BLO构思、开发并标准化了该方法。BLO, AB和MB设计了实验。AB进行实验。AB和BLO分析数据并制作图表。BLO和MB监督了这项研究。CG、DMD和VC提供人体肌肉活检标本。布洛撰写了手稿。所有作者都认真阅读、编辑并批准最终的手稿。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
伦理批准并同意参与gydF4y2Ba
所有涉及小鼠的程序均经意大利卫生部批准,并根据欧盟法规和意大利动物研究法进行。gydF4y2Ba
根据意大利法律,作者在使用手术过程中摘取的人体组织时不需要获得机构审查委员会或伦理委员会的批准。所有患者均同意进行术中肌肉活检,并发表所获得的临床和实验室数据。gydF4y2Ba
发表同意书gydF4y2Ba
不适用。gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者宣称他们之间没有利益冲突。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Ba
伟德体育在线施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。gydF4y2Ba
补充信息gydF4y2Ba
附加文件1:图S1。gydF4y2Ba
ICT法分离SCs的生肌特性。A.在ICT和mb分离的SCs中,肌源性集落形成的百分比计算为每孔总种子单细胞中生长的克隆的百分比(每96孔板60个)(n=3个独立实验)。B.在转基因ICT SCs中培养48和72 h时,单克隆来源的ICT和mb分离SCs中每个克隆的细胞数量,每个实验分析n= 37个克隆。MB SCs,每个实验分析n= 37个克隆。C. GM培养第2天ICT-和mb -分离的SCs Pax7阳性百分比(n=3个独立实验)。D.分化后单克隆来源ICT和mb分离SCs的融合百分比(GM为4天,DM为3天)。融合指数:肌管内核数除以总核数。E.单克隆来源ICT和mb分离的SCs分化后每个肌管的核数(GM为4天,DM为3天)。(n=3个独立实验)。误差柱表示平均值±sem。gydF4y2Ba
附加文件2:图S2。gydF4y2Ba
ict分离的SCs培养寿命延长。A. DM培养第3天、第5天、第11天和第17天ICT分离SCs的代表性亮场图像B. DM培养第3天MB分离SCs的代表性亮场图像C. ICT和MB分离SCs的培养总天数D.具有代表性的亮场图像显示了在GM中培养3和5天后,预镀后异质的肌肉细胞培养。误差条表示平均值±sem。经学生t检验,P < 0.05。gydF4y2Ba
附加文件3:图S3。gydF4y2Ba
利用ICT和MB方法对分离的SCs进行体内功能验证。A.肌内注射15 x 10后30天,mdx胫骨肌中肌营养不良蛋白阳性纤维(绿色)和核(蓝色)的代表性免疫荧光图像gydF4y2Ba3.gydF4y2BaICT分离后立即培养或ICT分离后培养3天后培养的SCs。B. mdx小鼠每TA肌肉切片中肌营养不良蛋白阳性纤维数量的量化(ICT, n=5 mdx小鼠;ict扩展,n=4只mdx小鼠)。比例尺= 100μm。误差柱表示平均值±sem。C.肌内注射15 x 10后30天,mdx胫骨肌中肌营养不良蛋白阳性纤维(绿色)和核(蓝色)的代表性免疫荧光图像gydF4y2Ba3.gydF4y2Baict分离的SCs(左)或mb新分离的SCs(右)。B. mdx小鼠每个TA切片中肌萎缩蛋白阳性纤维数量的量化(ICT, n=5 mdx小鼠;MB, n=5只mdx小鼠)。比例尺= 100μm。误差柱表示平均值±sem。gydF4y2Ba
附加文件4:图S4。gydF4y2Ba
预处理后和ICT之前获得的人类肌肉来源细胞的特征。A.人肌源性细胞在GM培养的第3天和第10天以及DM培养的第10天的代表性亮场图像。B.人肌源性细胞异种培养的代表性免疫荧光图像,Pax7(红色)和细胞核(蓝色)染色。图示在培养后第2天Pax7阳性细胞的百分比。具有代表性的异质人肌肉细胞培养的免疫荧光图像染色为肌原蛋白(红色)和细胞核(蓝色)。图示为GM. d培养第5天肌原蛋白阳性细胞的百分比。具有代表性的人肌肉来源细胞异质培养的免疫荧光图像,MHC(红色)和细胞核(蓝色)染色。图表显示分化后细胞融合的百分比(GM为10天,DM为10天)。E.图表显示在GM培养第5天,预镀后或ICT后获得的人异质肌细胞中肌原细胞的百分比,由肌原蛋白IF染色计算(n= 3个独立实验,每个实验分析10张图像)。比例尺= 100μm。误差柱表示平均值±sem。****P < 0.0001经学生t检验。gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba.创作共用公共领域奉献弃权书(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)适用于本条所提供的资料,除非在资料的信用额度中另有说明。gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
Benedetti, A, Cera, G, De Meo, D。gydF4y2Baet al。gydF4y2Ba一种基于冷冻处理的纯卫星细胞分离和长期扩增的新方法。gydF4y2Ba骨骼肌gydF4y2Ba11gydF4y2Ba, 7(2021)。https://doi.org/10.1186/s13395-021-00261-wgydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s13395-021-00261-wgydF4y2Ba
关键字gydF4y2Ba
- 卫星蜂窝隔离gydF4y2Ba
- 卫星细胞体外扩增gydF4y2Ba
- 骨骼肌再生gydF4y2Ba