- 方法gydF4y2Ba
- 开放获取gydF4y2Ba
- 发表:gydF4y2Ba
使用新型肌原蛋白敲入报告小鼠的肌源性分化动力学gydF4y2Ba
骨骼肌gydF4y2Ba体积gydF4y2Ba11gydF4y2Ba、物品编号:gydF4y2Ba5gydF4y2Ba(gydF4y2Ba2021gydF4y2Ba)gydF4y2Ba
摘要gydF4y2Ba
背景gydF4y2Ba
MyogeningydF4y2Ba是一种转录因子,在胚胎发育和成人肌肉再生过程中末梢成肌细胞分化过程中表达。由于缺乏敏感的报告细胞动态跟踪分化过程,对这种细胞状态转变的研究一直受到阻碍。gydF4y2Ba
结果gydF4y2Ba
在这里,我们报道了一种表达内源性tdTOMATO荧光蛋白的敲入小鼠系gydF4y2BaMyogeningydF4y2Ba轨迹。tdTOMATO的表达gydF4y2BaMyoggydF4y2BantdTomgydF4y2Ba小鼠重现内源性gydF4y2BaMyogeningydF4y2Ba在胚胎肌肉形成和成体再生过程中表达,并使MYOGENIN的分离成为可能gydF4y2Ba+gydF4y2Ba细胞群。我们还表明,tdTOMATO荧光可以在体外和体内活体成像中跟踪分化的成肌细胞。最后,我们通过实时成像监测了体外分化成肌细胞的细胞分裂动力学,并表明MYOGENIN的一部分gydF4y2Ba+gydF4y2Ba种群可以经历一轮细胞分裂,尽管频率远低于MYOGENINgydF4y2Ba−gydF4y2Ba成肌细胞。gydF4y2Ba
结论gydF4y2Ba
我们希望这只报告鼠将成为研究人员在发育和成年环境下研究骨骼肌生物学的宝贵资源。gydF4y2Ba
背景gydF4y2Ba
胚胎和出生后的肌肉发生和成人肌肉再生是由一个基本的螺旋-环-螺旋肌生成调节因子(mrf)家族包括gydF4y2BaMyf5gydF4y2Ba,gydF4y2BaMrf4gydF4y2Ba,gydF4y2BaMyodgydF4y2Ba和gydF4y2BaMyogeningydF4y2Ba(gydF4y2BaMyoggydF4y2Ba).根据胚胎的肌原性规范,mrf以顺序的方式表达,以确保承诺,增殖,分化和融合,从而产生多核骨骼肌纤维。单个和组合小鼠mrf敲除模型已经建立了一个遗传层次结构gydF4y2BaMyf5gydF4y2Ba,gydF4y2BaMrf4gydF4y2Ba和gydF4y2BaMyodgydF4y2Ba控制谱系承诺和肌源性祖细胞的增殖gydF4y2BaMyodgydF4y2Ba,gydF4y2BaMrf4gydF4y2Ba和gydF4y2BaMyoggydF4y2Ba调节终末分化[gydF4y2Ba1gydF4y2Ba]。值得注意的是,在单个MRF敲除小鼠中,只有gydF4y2BaMyog -gydF4y2Ba由于严重的骨骼肌缺陷,零纯合子动物在出生时死亡[gydF4y2Ba1gydF4y2Ba,gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3.gydF4y2Ba]。因此,与其他肌源性bHLH因子不同,gydF4y2BaMyoggydF4y2Ba在发育过程中没有多余的或补偿机制来代替其功能。缺乏该基因的成肌细胞在全身的肌肉形成区积累,在体内不能形成正常的肌纤维,这表明它在成肌细胞的终末分化中起着关键作用[gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba4gydF4y2Ba]。而gydF4y2BaMyoggydF4y2Ba突变型和野生型胚胎之间的主要差异在继发性肌纤维形成的开始阶段变得明显[gydF4y2Ba2gydF4y2Ba,gydF4y2Ba4gydF4y2Ba]。没想到,条件消融了gydF4y2BaMyoggydF4y2Ba在围产期和产后期间不会导致肌肉形态或组织学上的明显缺陷,这表明gydF4y2BaMyoggydF4y2Ba−−/gydF4y2Ba成肌细胞仍可促进肌肉生长[gydF4y2Ba5gydF4y2Ba,gydF4y2Ba6gydF4y2Ba]。此外,条件消融gydF4y2BaMyoggydF4y2Ba杜氏肌营养不良小鼠模型(gydF4y2BamdxgydF4y2Ba(gydF4y2Ba7gydF4y2Ba])没有导致不良表型,证实gydF4y2BaMyoggydF4y2Ba对于这种疾病的成人肌肉再生是必不可少的[gydF4y2Ba8gydF4y2Ba]。然而,尽管gydF4y2BaMyoggydF4y2Ba-null肌肉干细胞(musc)在培养中与野生型细胞一样高效地增殖和分化,肌肉基因表达程序在缺乏gydF4y2BaMyoggydF4y2Ba(gydF4y2Ba6gydF4y2Ba]。gydF4y2Ba
成人肌肉再生依赖于musc,其特征是表达gydF4y2BaPax7gydF4y2Ba(gydF4y2Ba9gydF4y2Ba,gydF4y2Ba10gydF4y2Ba,gydF4y2Ba11gydF4y2Ba,gydF4y2Ba12gydF4y2Ba,gydF4y2Ba13gydF4y2Ba]。在肌肉损伤时,musc激活gydF4y2BaMyodgydF4y2Ba,增殖产生成肌细胞,这些细胞分化并融合形成肌纤维。已经产生了不同的报告小鼠系来荧光标记gydF4y2BaPax7gydF4y2Ba+gydF4y2Ba肌肉祖群,要么来自内源性位点[gydF4y2Ba14gydF4y2Ba,gydF4y2Ba15gydF4y2Ba,gydF4y2Ba16gydF4y2Ba]或作为转基因[gydF4y2Ba15gydF4y2Ba,gydF4y2Ba17gydF4y2Ba,gydF4y2Ba18gydF4y2Ba],从而可以成像和隔离gydF4y2BaPax7gydF4y2Ba表达的细胞。此外,诱导记者在其中的表达gydF4y2BaCregydF4y2Ba重组酶在gydF4y2BaPax7gydF4y2Ba启动子重组膜或细胞质荧光团[gydF4y2Ba13gydF4y2Ba,gydF4y2Ba19gydF4y2Ba,gydF4y2Ba20.gydF4y2Ba已被用于肌源性谱系的永久标记[gydF4y2Ba21gydF4y2Ba,gydF4y2Ba22gydF4y2Ba,gydF4y2Ba23gydF4y2Ba]和实时成像[gydF4y2Ba24gydF4y2Ba]。虽然已经产生了几种报告小鼠系来识别基于表达的分化成肌细胞gydF4y2Ba肌凝蛋白轻链gydF4y2Ba(gydF4y2Ba25gydF4y2Ba],gydF4y2BaMyoggydF4y2Ba(gydF4y2Ba26gydF4y2Ba,gydF4y2Ba27gydF4y2Ba,gydF4y2Ba28gydF4y2Ba),gydF4y2Ba肌酸激酶gydF4y2Ba(gydF4y2Ba29gydF4y2Ba的基础gydF4y2BalacZgydF4y2Ba(gydF4y2Baβ牛乳糖gydF4y2Ba活动,gydF4y2Ba30.gydF4y2Ba])或gydF4y2Ba猫gydF4y2Ba(gydF4y2Ba氯霉素乙酰转移酶gydF4y2Ba, (gydF4y2Ba31gydF4y2Ba])表达式,因此只允许对固定样本进行端点测量。gydF4y2Ba
末梢成肌细胞分化的特征是表达gydF4y2BaMyoggydF4y2Ba周期蛋白依赖性激酶抑制剂gydF4y2Bap21gydF4y2Ba细胞周期退出[gydF4y2Ba32gydF4y2Ba,gydF4y2Ba33gydF4y2Ba,gydF4y2Ba34gydF4y2Ba]。使用核苷酸类似物BrdU进行的实验表明,myog阳性细胞可以进行DNA复制[gydF4y2Ba32gydF4y2Ba],但目前尚不清楚它们在最终离开细胞周期之前能进行多少次分裂。gydF4y2Ba
在这里,我们利用了CRISPR/Cas9系统,它允许精确的基因组编辑[gydF4y2Ba35gydF4y2Ba],在内源性基因的控制下,产生表达核局部串联二聚体番茄(tdTOM)蛋白的敲入小鼠系gydF4y2BaMyoggydF4y2Ba同时保留MYOG蛋白的表达。我们证明这是杂合的gydF4y2BaMyoggydF4y2BantdTomgydF4y2Ba小鼠在固定和活的肌原细胞中表现出强大的报告基因表达,从而允许在体外和活体显微镜下研究肌肉分化和细胞周期退出的动力学。gydF4y2Ba
材料与方法gydF4y2Ba
鼠标的维护gydF4y2Ba
动物按照国家和欧洲共同体的指导方针和法国巴斯德研究所(CETEA, comit
Myog-ntdTomato构建体用于crispr - cas9介导的同源重组gydF4y2Ba
的最后一个外显子1000 bp的片段gydF4y2BaMyoggydF4y2Ba用PCR从小鼠gDNA中扩增出(引物1和2,补充表gydF4y2Ba1gydF4y2Ba),介绍SalI和NotI限制位点。该片段被亚克隆到编码tdTOM的供体质粒中(来自巴斯德研究所Festuccia博士的好意礼物)。3'UTR的760 bp片段gydF4y2BaMyoggydF4y2Ba通过PCR从小鼠gDNA中扩增出STOP密码子后的基因(引物3和4)。这种扩增还在CRISPR-Cas9基因组编辑所需的PAM序列中引入了突变。利用添加的PacI和SpeI酶切位点,将该片段亚克隆到PacI和XbaI酶切的tdTOM质粒中。含有T2A的寡核苷酸(引物5和6)[gydF4y2Ba36gydF4y2Ba肽和SV40大T的三重NLS序列[gydF4y2Ba37gydF4y2Ba]被退火并亚克隆到钝型pBluescript SK(+)质粒中。随后用NotI和KpnI对该质粒进行酶切,将T2A-NLS片段克隆到tdTOM质粒中。从初始质粒(引物7和8)中加入KpnI和FseI位点,通过PCR扩增tdTOM,并在3xNLS序列后亚克隆到供体载体中。在PGK启动子控制下,通过PCR扩增出含有两个FRT位点和NeoR/KanR基因的FNF盒(引物9和10),添加FseI和PacI位点。这个片段被亚克隆到供体载体中。gydF4y2Ba
得分最高的sgRNA序列靶向gydF4y2BaMyoggydF4y2Ba使用引导设计工具(crispr.mit.edu, Zhang Lab)确定STOP密码子区域。将含有该靶向序列的引物(引物11和12)退火并亚克隆到经BbsI酶切的pU6-(BbsI) CBh-Cas9-T2A-mCherry载体(Addgene #64324)上。gydF4y2Ba
小鼠胚胎干细胞的靶向gydF4y2Ba
Myog-ntdTOM供体构建物(通过PvuI消化线性化)和pU6载体电穿孔gydF4y2BaC57BL / 6 jgydF4y2Ba小鼠胚胎干细胞。选择G418 (300 μg/ml)后,用引物13、14和15进行PCR检测阳性克隆(补充表)gydF4y2Ba1gydF4y2Ba),产生1.7 kb的WT和1.2 kb的突变体条带。扩增两个阳性克隆,并注入8-10个胚胎干细胞gydF4y2BaBALB / cgydF4y2Ba在巴斯德研究所的小鼠遗传工程设施中,利用囊胚产生嵌合小鼠。通过PCR验证了种系传播,并将F1小鼠杂交到gydF4y2Ba9205 dym Tg (ACTFLPe)gydF4y2Ba(gydF4y2Ba38gydF4y2Ba]动物切除FNF磁带。切除FNF盒和存在gydF4y2BaMyoggydF4y2BantdTomgydF4y2Ba利用引物16、17和18对等位基因进行PCR验证(补充表)gydF4y2Ba1gydF4y2Ba) (Flp-recombinedgydF4y2BaMyoggydF4y2BantdTomgydF4y2Ba等位基因,236 bp; WT等位基因,600 bp,图gydF4y2BaS1gydF4y2Ba),这些引物随后用于基因分型。F2只动物回交gydF4y2BaC57BL / 6gydF4y2Ba消除动物gydF4y2BaTg (ACTFLPe)gydF4y2Ba等位基因,gydF4y2BaMyoggydF4y2BantdTom / +gydF4y2Ba选择动物进行进一步表征。gydF4y2Ba
musc的分离和培养gydF4y2Ba
胎儿和成人肌肉在[gydF4y2Ba39gydF4y2Ba]。样品在DMEM、0.08%胶原酶D (Sigma, 11088882001)、0.2%胰蛋白酶(ThermoFisher, 15090)和10 μg/ml DNAseI (Sigma, 11284932)中37℃温和搅拌25 min,消化5轮。每轮后,让样品沉淀5min,将上清收集在4 ml冰置胎牛血清(FBS)中,并将新鲜消化缓冲液添加到剩余的肌肉颗粒中。收集的上清液在550下离心15分钟gydF4y2BaggydF4y2Ba在4°C,重悬在DMEM 2% FBS中,在细胞分选前通过40 μm过滤器(康宁,352235)过滤。使用Aria III (BD Biosciences)流式细胞仪根据细胞大小、粒度和GFP或tdTOM荧光分离细胞。细胞直接在MuSC培养基中收集(38.5% DMEM (Fisher Scientific, 31966047), 38.5% F12 (Fisher Scientific, 31765035), 20% FBS (ThermoFisher, 10270), 2% Ultroser (Pall, 15950-017), 1%青霉素/链霉素(GIBCO, 15140-122))。gydF4y2Ba
使用Matrigel®(1mg /ml,康宁,354248)包膜培养皿(37°C, 30分钟)在3% O的培养基中培养muscgydF4y2Ba2gydF4y2Ba, 5% cogydF4y2Ba2gydF4y2Ba, 37°C的指示时间。gydF4y2Ba
免疫染色时,将细胞用4%多聚甲醛(PFA, Electron Microscopy Sciences, 15710)在PBS中室温固定15分钟,用0.5% Triton X-100 (Merck, T8787)在室温下渗透5分钟,用10%山羊血清(GIBCO)阻断。细胞与指定的一抗在PBS 2%山羊血清缓冲液中孵育过夜,然后与二抗和1 μg/ml Hoechst (ThermoFisher, H1399)孵育45分钟。gydF4y2Ba
胚胎免疫荧光gydF4y2Ba
对于组织免疫荧光,将胚胎收集在PBS中,并在4°C下固定在4%PFA 0.1% Triton X-100中的PBS中2小时。PBS洗涤3次后,胚胎在30%蔗糖PBS中冷冻保存,包埋于OCT组织冷冻培养基(Leica, 14020108926)中冷冻切片。冷冻切片在室温下干燥30分钟,用PBS洗涤一次。组织样品用3%牛血清蛋白、10%山羊血清、0.5% Triton X-100在室温下阻断1小时。一抗在阻断液中稀释,4°C孵育过夜。用PBST (PBS 0.1% Tween20 (Sigma Aldrich, P1379))洗涤三次后,用阻断液稀释二抗,室温孵育45分钟。最后,用1 μg/ml的Hoechst 33342在室温下孵育5分钟,观察细胞核,PBS洗涤3次,PBS中70%甘油载片成像。gydF4y2Ba
对于全载免疫荧光,胚胎在PBS中收集,在4% PFA 0.1% Triton X-100中固定2小时,4°C。PBS洗涤两次后,样品在50%甲醇的PBS中脱水,并在- 20°C下保存在100%甲醇中直至使用。将样品在PBS中再水化,并在阻断缓冲液(15%山羊血清,1.5%牛血清蛋白,0.5% TritonX-100在1X PBS中)中于2ml埃本多夫管中RT孵育1小时。然后将胚胎与一抗在阻断缓冲液中孵育5-7天,在4°C下摇晃。胚胎在PBST中广泛洗涤2 - 4小时,在Fab二抗中4°C摇床孵育2天。胚胎如上所述洗涤,在PBS中用50%甲醇脱水,在100%甲醇中脱水两次,然后用BABB清除并安装成像[gydF4y2Ba40gydF4y2Ba]。gydF4y2Ba
成人肌肉损伤的组织学和免疫荧光gydF4y2Ba
肌肉损伤的处理方法如前所述[gydF4y2Ba22gydF4y2Ba]。小鼠以0.5% Imalgene/2% Rompun麻醉,TA肌注射心毒素50 ml (10 mM;Latoxan, L8102)用0.9% NaCl稀释。gydF4y2Ba
收获后将受伤的TA肌肉固定在4% PFA中,在4°C下固定2小时,用PBS洗涤,并用30%蔗糖PBS平衡过夜。将样品置于OCT组织冷冻介质中,在8 ~ 12 μm范围内冷冻切片。内源性tdTOM评分后,冷冻切片在PBS中再水化,并用Hoechst 33342反染色。gydF4y2Ba
在MYOG + tdTOM检测的情况下,对组织切片进行组织学处理,如下所述[gydF4y2Ba41gydF4y2Ba]。简单地说,切片在4% PFA中固定10分钟,在RT下用PBS洗涤,然后进行免疫染色。热诱导表位检索在柠檬酸盐溶液pH 6.0中进行,在高压锅中进行6分钟。切片用30% H孵育gydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba然后用0.2% TritonX-100渗透,PBS洗涤,阻断缓冲液(15%山羊血清,1.5%牛血清蛋白,0.5% TritonX-100在1X PBS中)阻断。MYOG和DsRED(识别tdTOM)的一抗在4°C下孵育过夜。用PBST洗涤后,用合适的二抗和1 μg/ml的Hoechst 33342阻断缓冲液在RT下孵育45 min(表2)gydF4y2Ba1gydF4y2Ba).gydF4y2Ba
免疫印迹gydF4y2Ba
胚胎在冰冷的PBS中收集,随后在干冰中快速冷冻。胚胎组织在干冰上用研臼和杵研磨成细粉,用RIPA缓冲液(150 M NaCl, 50 mM Tris pH 8, 5 mM EDTA, 1% NP-40 (Sigma, I8896), 0.5%脱氧胆酸钠,0.1% SDS添加1X蛋白酶(Sigma, S8820)和磷酸酶抑制剂(Roche, 4906845001))裂解。15微克的蛋白质提取物在4-12%的bistris Gel NuPAGE (Invitrogen, NP0322)上运行,并转移到PVDF Amersham Hybond-P转移膜(GE Healthcare, RPN303F)上。在室温下,用5%牛奶(Dominique Dutscher, 711160)在Tris-Buffer Saline 0.2% Tween (Sigma, P9416) (TBS-T)中阻断膜1小时,并用特异性一抗在4℃下过夜。在TBS-T中洗涤三次后,用HRP或荧光基团偶联的二抗孵育膜,并通过化学发光(Pierce ECL2 western blotting substrate, Thermo Scientific, 80196)或荧光(Bio-Rad, Chemidoc MP)显示(表1)gydF4y2Ba2gydF4y2Ba).gydF4y2Ba
RNA提取gydF4y2Ba
用trizol -基试剂盒(Zymo Research, R2061)从FACS分离的细胞中提取RNA,用SuperScriptIII (Invitrogen, 18080093)进行逆转录。RT-qPCR评估mRNA相对表达,采用SYBR绿色主混合物(Roche, 04913914001)在Applied biosciences machine中进行。数据分析采用2gydF4y2Ba−ΔΔCTgydF4y2Ba方法(gydF4y2Ba42gydF4y2Ba], mRNA表达归一化gydF4y2BaRpl13gydF4y2Ba(引物23和24,补充表gydF4y2Ba1gydF4y2Ba).gydF4y2Ba
体外视频显微镜gydF4y2Ba
将MuSCs镀于显微镜培养箱(IBIDI, 80826)上,在添加上述培养基的培养基中培养。培养皿在37℃,5% CO下孵育gydF4y2Ba2gydF4y2Ba3% OgydF4y2Ba2gydF4y2Ba在Pecon孵化室里蔡司观察器。Z1连接到Plan-Apochromat 20倍/0.8 M27物镜和Hamamatsu Orca Flash 4相机,使用Zen软件(卡尔蔡司)。gydF4y2Ba
静态成像gydF4y2Ba
以下系统用于图像采集:蔡司SteREO Discovery V20用于整个胚胎的宏观观察,蔡司LSM800或LSM700激光扫描共聚焦显微镜用于组织切片和清除胚胎的全载免疫染色。终点离体培养样品用蔡司观察仪(Zeiss Observer.Z1)成像。gydF4y2Ba
活体的显微镜gydF4y2Ba
活体显像gydF4y2BaPax7gydF4y2BaCreERT2gydF4y2Ba;R26gydF4y2BaYFPgydF4y2Ba;MyoggydF4y2BantdTomgydF4y2Ba在尼康ni1r MP立式显微镜下,使用NIS软件(尼康)对再生过程中不同时间点的小鼠进行观察。显微镜配备了一个× 25 NA 1.1 PlanApo LambdaS物镜,GaAsP PMT探测器和一个光谱物理洞察Deepsee激光器。将激光频率调至960 nm,以允许同时激发YFP和tdTOM荧光团。gydF4y2Ba
为了获取图像,将上肢后肢的皮肤刮平并切开,露出约1厘米gydF4y2Ba2gydF4y2Ba并直接成像。在成像期间,小鼠被1.5%异氟烷麻醉,并保持在37℃的孵育室中。gydF4y2Ba
图像分析gydF4y2Ba
使用TrackMate插件的手动跟踪功能进行细胞跟踪[gydF4y2Ba43gydF4y2Ba在斐济[gydF4y2Ba44gydF4y2Ba]。ZEN软件(卡尔蔡司),斐济[gydF4y2Ba44gydF4y2Ba]和Imaris (Bitplane)进行图像分析。在Adobe Photoshop和Illustrator (Adobe Systems)中组装图形。gydF4y2Ba
数据分析与统计gydF4y2Ba
数据分析统计采用R [gydF4y2Ba45gydF4y2Ba],使用ggplot2 [gydF4y2Ba46gydF4y2Ba]。比较两组,双尾配对和未配对的学生gydF4y2BatgydF4y2Ba进行测试来计算gydF4y2BapgydF4y2Ba值并确定统计上显著的差异(见图图例)。gydF4y2Ba
结果gydF4y2Ba
a的产生和特征gydF4y2BaMyoggydF4y2BantdTomgydF4y2Ba鼠标gydF4y2Ba
利用CRISPR-Cas9系统,我们设计了一个sgRNA来靶向dna的STOP密码子区域gydF4y2BaMyoggydF4y2Ba同源重组基因。重组模板由对应于的两个同源臂组成gydF4y2BaMyoggydF4y2Ba停止密码子两侧的序列agydF4y2BatdTomgydF4y2Ba编码序列和一个新抵抗组织的卡带gydF4y2BafrtgydF4y2Ba网站(图。gydF4y2Ba1gydF4y2Baa). tdTOM蛋白前有一个T2A肽序列[gydF4y2Ba36gydF4y2Ba]以允许在翻译后从MYOG蛋白中切割,以及三重NLS序列[gydF4y2Ba37gydF4y2Ba以确保核本地化。gydF4y2Ba
一代gydF4y2BaMyoggydF4y2Ba敲入鼠标线。gydF4y2Ba一个gydF4y2Ba内源性的方案gydF4y2BaMyoggydF4y2Ba基因座、供体构建以及crispr - cas9介导的小鼠胚胎干细胞重组的结果。第一代gydF4y2BaMyoggydF4y2BantdTom-FNFgydF4y2Ba然后将小鼠与一种gydF4y2BaTg (ACTFLPe)gydF4y2Ba+/+gydF4y2Ba删除应变以去除FNF盒。gydF4y2BabgydF4y2Ba内源性荧光gydF4y2BaMyoggydF4y2BantdTom / +gydF4y2Ba不同阶段的胚胎。明光场和荧光图像之间的叠加显示。标尺,1000 μm。gydF4y2BacgydF4y2Ba图中显示了扩增野生型等位基因(2)的引物对gydF4y2BantdTomgydF4y2Ba等位基因(3)和两个等位基因(1)中的靶标gydF4y2BaMyoggydF4y2Ba轨迹。RT-qPCR分析总水平gydF4y2BaMyoggydF4y2BamRNA,野生型等位基因和gydF4y2BatdTomgydF4y2Ba尤其是E14.5的等位基因gydF4y2BaMyoggydF4y2Ba+/+gydF4y2Ba,gydF4y2BaMyoggydF4y2BantdTom / +gydF4y2Ba和gydF4y2BaMyoggydF4y2BantdTom / ntdTomgydF4y2Ba胚胎。gydF4y2BangydF4y2Ba每个基因型= 4个胚胎。数据代表均值±标准差。双尾未配对学生数据gydF4y2BatgydF4y2Ba测试;* * *gydF4y2BapgydF4y2Ba值< 0.005,**gydF4y2BapgydF4y2Ba值= 0.0005 ~ 0.01,*gydF4y2BapgydF4y2Ba值= 0.01 ~ 0.05。gydF4y2BadgydF4y2BaWestern blot检测E14.5的MYOG和tdTOM蛋白水平gydF4y2BaMyoggydF4y2Ba+/+gydF4y2Ba,gydF4y2BaMyoggydF4y2BantdTom / +gydF4y2Ba和gydF4y2BaMyoggydF4y2BantdTom / ntdTomgydF4y2Ba胚胎(gydF4y2BangydF4y2Ba=每个基因型4个胚胎)。条形图显示归一化为GAPDH的蛋白表达水平的定量。数据代表均值±标准差。双尾未配对学生数据gydF4y2BatgydF4y2Ba测试;* * *gydF4y2BapgydF4y2Ba值< 0.005,*gydF4y2BapgydF4y2Ba值= 0.01 ~ 0.05gydF4y2Ba
首先,我们对杂合子的内源性tdTOM荧光进行了评价gydF4y2BaMyoggydF4y2BantdTom / +gydF4y2Ba胚胎在E9.75和E11.5之间,即由近轴中胚层分裂产生的瞬态胚胎结构。内源性tdTOM荧光的模式与描述的相似gydF4y2BaMyoggydF4y2Ba成绩单(gydF4y2Ba47gydF4y2Ba(图。gydF4y2Ba1gydF4y2BaB),在尾状体(新近形成的)表达水平较低。gydF4y2Ba
然后我们收集了E14.5胎的组织样本,并进行了RT-qPCR和Western blot分析来证实这一点gydF4y2BaMyoggydF4y2Ba野生型、杂合子和纯合子的mRNA和蛋白水平相似。引物对被设计为特异扩增野生型等位基因或gydF4y2BatdTomgydF4y2Ba一个引物组同时扩增了这两个等位基因(图2)。gydF4y2Ba1gydF4y2Bac).该分析表明gydF4y2BaMyoggydF4y2Ba杂合子和纯合子敲入(KI)胚胎表达相似的总水平gydF4y2BaMyoggydF4y2BamRNA,并确认没有gydF4y2BaMyoggydF4y2Ba在纯合子胚中可以检测到野生型转录物。正如所料,水平gydF4y2BaMyoggydF4y2BantdTomgydF4y2BamRNA在纯合子样品中最高,在杂合子样品中下降到大约50%,并且在野生型胚胎中未检测到(图2)。gydF4y2Ba1gydF4y2Bac).在蛋白质水平上,我们注意到MYOG在所有三种基因型的胚胎中表达水平相似,而tdTOM蛋白在野生型样品中不存在(图2)。gydF4y2Ba1gydF4y2Bad).因此,我们得出结论,MYOG蛋白是由来自两个等位基因的转录本产生的。gydF4y2Ba
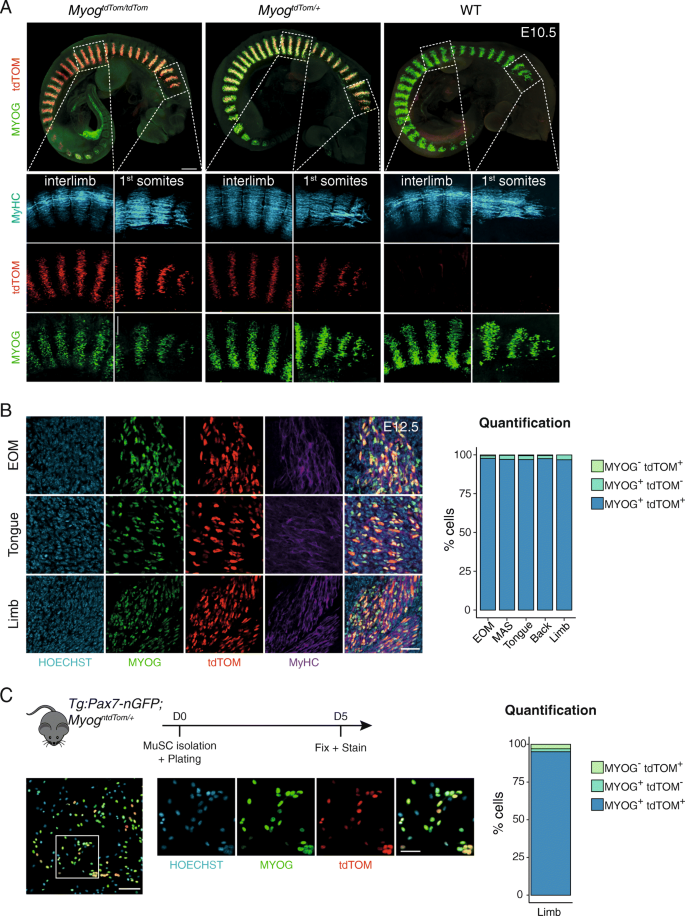
为了以更高的分辨率研究目标等位基因的表达,我们在E10.5时通过全挂免疫染色评估了MYOG和tdTOM蛋白的时间表达动态,并比较了MYOG和tdTOM在野生型、杂合子和纯合子胚胎中的表达(图5)。gydF4y2Ba2gydF4y2Baa,附加文件1,2,3)。我们证实tdTOM遵循MYOG在所有体体的外轴和下轴结构域的表达模式,表明这两种蛋白具有相似的时空表达动态。为了评估MYOG和tdTOM在杂合胚胎单细胞水平上的共同表达,在初级(E12.5)和次级(E14.5)肌发生期间,分别在眼外肌、舌肌和肢体肌肉水平上进行了冷冻切片,当产生小的寡核肌纤维和大的多核肌纤维时。不同肌肉中蛋白质表达的量化证实了E12.5时97%和95%的细胞中这两种蛋白质的平均共定位(图5)。gydF4y2Ba2gydF4y2Bab)和E14.5(图gydF4y2BaS2gydF4y2Ba),分别。gydF4y2Ba
tdTOM的表达是内源性的gydF4y2BaMyoggydF4y2Ba表达式。gydF4y2Ba一个gydF4y2Ba全挂载免疫荧光gydF4y2BaMyoggydF4y2Ba+/+gydF4y2Ba,gydF4y2BaMyoggydF4y2BantdTom / +gydF4y2Ba和gydF4y2BaMyoggydF4y2BantdTom / ntdTomgydF4y2BaE10.5时的胚胎染色tdTOM、MYOG和MyHC蛋白。比例尺,上面板300 μm,下面板100 μm。gydF4y2BabgydF4y2Ba眼外(EOM),舌和肢体肌肉冷冻切片的免疫荧光gydF4y2BaMyoggydF4y2BantdTom / +gydF4y2BaE12.5的胚胎。条形图显示tdTOM和myog阳性细胞的定量。gydF4y2BangydF4y2Ba= 3个胚胎,每块肌肉和每个胚胎计数100个细胞。标尺,40 μm。gydF4y2BacgydF4y2Ba从四肢肌肉中分离出肌肉细胞gydF4y2BaTg: Pax7-nGFP;MyoggydF4y2BantdTomgydF4y2Ba成体动物,体外培养5天。条形图显示tdTOM和myog阳性细胞的定量(gydF4y2BangydF4y2Ba= 3,每只动物计算200个细胞)。比例尺,左图100 μm,右图50 μmgydF4y2Ba
附加文件1gydF4y2Ba与图相关gydF4y2Ba2gydF4y2Baa.全免疫荧光gydF4y2BaMyoggydF4y2Ba+/+gydF4y2Ba胚胎在E10.5染色tdTOM, MYOG和MyHC蛋白。gydF4y2Ba
附加文件2gydF4y2Ba与图相关gydF4y2Ba2gydF4y2Baa.全载免疫荧光gydF4y2Ba一个MyoggydF4y2BantdTom / +gydF4y2Ba胚胎在E10.5染色检测tdTOM、MYOG和MyHC蛋白。gydF4y2Ba
附加文件3gydF4y2Ba与图相关gydF4y2Ba2gydF4y2Baa.全免疫荧光gydF4y2BaMyoggydF4y2BantdTom / ntdTomgydF4y2Ba胚胎在E10.5染色tdTOM, MYOG和MyHC蛋白。gydF4y2Ba
为了评估报告小鼠在成年成肌细胞中的保真度,gydF4y2BaMyoggydF4y2BantdTomgydF4y2Ba与动物杂交gydF4y2BaTg: Pax7-nGFPgydF4y2Ba小鼠,GFP标记所有的musc [gydF4y2Ba15gydF4y2Ba]。基于GFP表达的流式细胞法分离musc,体外分化5 d。与我们在胚胎中的结果一致,MYOG和tdTOM的表达在大约95%的细胞中共定位(图2)。gydF4y2Ba2gydF4y2Bac).此外,总体上无显著差异gydF4y2BaMyoggydF4y2Ba野生型、杂合子和纯合子动物之间的RNA水平(图2)gydF4y2BaS2gydF4y2BaB)。gydF4y2Ba
如上所述,KI策略被设计成非破坏性的,允许重组等位基因正常表达MYOG蛋白。考虑到gydF4y2BaMyoggydF4y2Ba-null小鼠出生时是致命的,而我们的gydF4y2BaMyoggydF4y2BantdTom / ntdTomgydF4y2Ba敲入小鼠是存活的,我们认为目标等位基因产生了足够水平的MYOG。然而,在纯合子中,免疫荧光检测到MYOG强度降低gydF4y2BaMyoggydF4y2BantdTom / ntdTomgydF4y2Ba胚胎和纯合子动物体外成肌细胞培养(图2)。gydF4y2Ba2gydF4y2Ba一个,图gydF4y2BaS2gydF4y2BaC).由于在杂合样本中没有观察到这种减少,因此我们决定在后续实验中使用杂合动物。gydF4y2Ba
综上所述,tdTOM忠实地再现了MYOG蛋白在胚胎和成人肌肉中的表达,以及它在肌肉中的插入gydF4y2BaMyoggydF4y2Ba位点在mRNA和蛋白水平上对该基因的表达没有显著影响。gydF4y2Ba
MyoggydF4y2BantdTomgydF4y2Ba小鼠允许在发育和再生过程中分离分化成肌细胞gydF4y2Ba
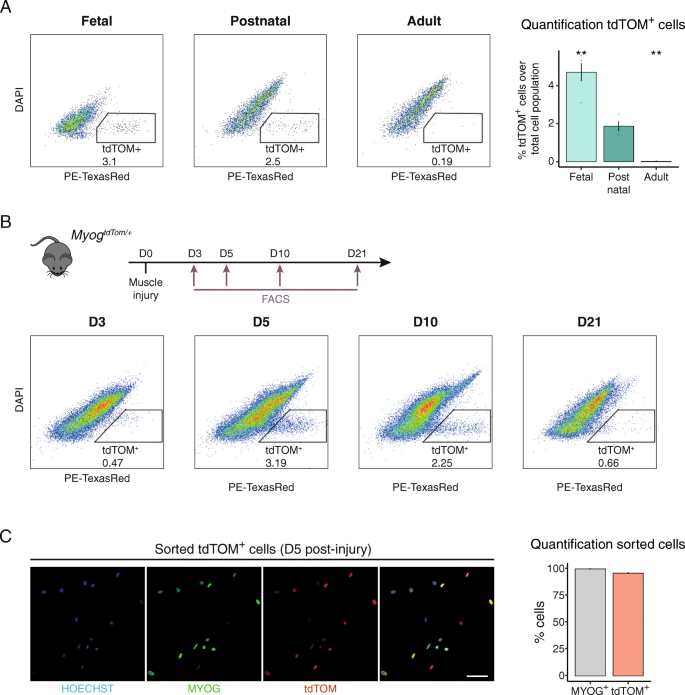
为了通过流式细胞术评估tdTOM在稳态条件下的表达,我们从小鼠肢体肌肉中分离了单个核群体gydF4y2BaMyoggydF4y2BantdTom / +gydF4y2Ba小鼠在胎期(胚胎日(E) 18.5)、产后期(p) 21)和成体期(10周)。tdTOM荧光细胞在胎儿和产后早期仍在发生肌发生的阶段被检测到。在体内平衡的成年肌肉中,大多数肌肉是静止的,因此没有肌电信号gydF4y2Ba+gydF4y2Ba可检测到单核细胞[gydF4y2Ba48gydF4y2Ba]。正如预期的那样,实际上没有tdTOMgydF4y2Ba+gydF4y2Ba在成人肌肉中检测到细胞gydF4y2BaMyoggydF4y2BantdTom / +gydF4y2Ba动物(图。gydF4y2Ba3.gydF4y2Ba一个)。gydF4y2Ba
MyoggydF4y2Ba+gydF4y2Ba基于tdTOM荧光可以分离细胞。gydF4y2Ba一个gydF4y2Ba胎儿(E18.5)、出生后(p21)和成人肢体肌肉分离的单个核细胞片段的FACS图谱gydF4y2BaMyoggydF4y2BantdTom / +gydF4y2Ba动物。条形图显示tdTOM的百分比gydF4y2Ba+gydF4y2Ba不同阶段的细胞。gydF4y2BangydF4y2Ba每种情况下4只动物。数据代表均值±标准差。双尾未配对学生数据gydF4y2BatgydF4y2Ba测试;**gydF4y2BapgydF4y2Ba值= 0.0005 ~ 0.01。gydF4y2BabgydF4y2Ba从心脏毒素损伤的TA肌分离的单个核细胞的FACS谱gydF4y2BaTg: Pax7-nGFP;MyoggydF4y2BantdTom / +gydF4y2Ba不同时间点(损伤后D3, D5, D10, D21)的小鼠。gydF4y2BacgydF4y2BatdTOM免疫染色gydF4y2Ba+gydF4y2Ba5 DPI时分离的细胞分数,如gydF4y2BabgydF4y2BaMYOG (3 h后)。条形图显示tdTOM和myog阳性细胞的定量(gydF4y2BangydF4y2Ba= 3,每只动物计算200个细胞)。数据为平均值±标准差,比例尺,50 μmgydF4y2Ba
为了确定tdTOM在成人肌肉再生过程中是否遵循MYOG的表达动态,我们对肌肉进行了损伤gydF4y2Ba胫骨前gydF4y2Ba(TA)肌肉gydF4y2BaTg: Pax7-nGFP;MyoggydF4y2BantdTom / +gydF4y2Ba小鼠肌内注射蛇毒心毒素[j]gydF4y2Ba49gydF4y2Ba]。我们接下来进行FACS分析,以确定tdTOM是否gydF4y2Ba+gydF4y2Ba组织损伤后可分离出单核部分。不出所料,只有几个人被淘汰gydF4y2Ba+gydF4y2Ba在损伤后3天检测细胞,此时已知肌原性细胞增殖最大[gydF4y2Ba23gydF4y2Ba,gydF4y2Ba24gydF4y2Ba,gydF4y2Ba50gydF4y2Ba(图。gydF4y2Ba3.gydF4y2Bab)。tdTOMgydF4y2Ba+gydF4y2Ba损伤后第5天和第10天细胞最丰富,这与此期间瞬时扩增的成肌细胞群体向分化的增加相对应。由于再生过程的主要特点是在3-4周内完成,tdTOM的比例gydF4y2Ba+gydF4y2Ba损伤后21天细胞数量减少,对应于肌原性群体逐渐恢复到静止状态(图2)。gydF4y2Ba3.gydF4y2Bab).最后,验证tdTOMgydF4y2Ba+gydF4y2BaFACS分离的细胞与表达MYOG的成肌细胞相对应,我们分离了tdTOMgydF4y2Ba+gydF4y2Ba损伤后5天再生TA肌群。细胞分选并进行MYOG和tdTOM染色后立即固定,结果显示95%的分离细胞MYOG阳性(图2)。gydF4y2Ba3.gydF4y2Bac),从而证实tdTOM在成人肌肉再生过程中也遵循MYOG的表达动态,并且其表达允许MYOG的分离gydF4y2Ba+gydF4y2Ba损伤后流式细胞仪检测细胞。gydF4y2Ba
综合来看,我们的结果表明gydF4y2BaMyoggydF4y2BantdTomgydF4y2BaKI鼠标可以有效地分离MYOGgydF4y2Ba+gydF4y2Ba种群在发育的不同阶段以及从再生肌肉。gydF4y2Ba
动态gydF4y2BaMyoggydF4y2Ba终末分化过程中的表达gydF4y2Ba
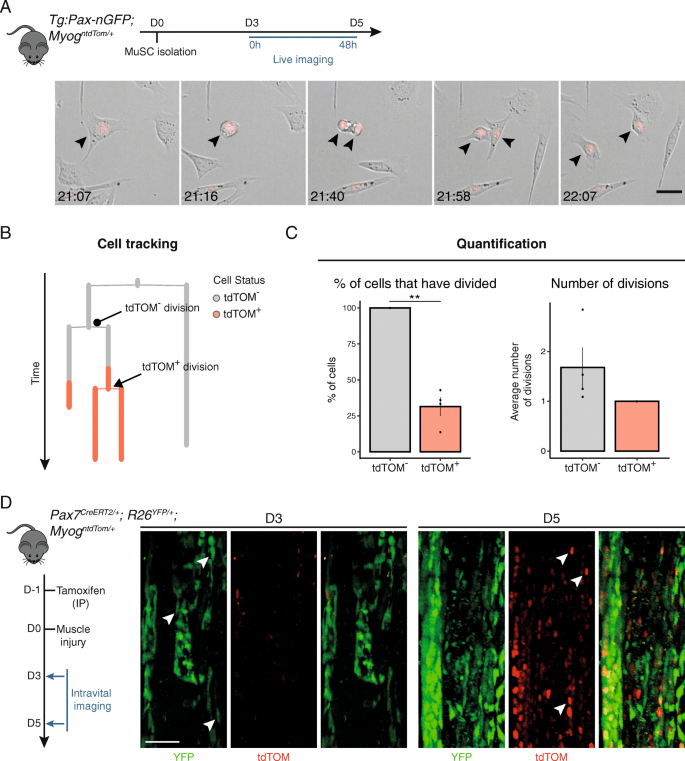
来评估gydF4y2BaMyoggydF4y2Ba表达成肌细胞可以进行细胞分裂,我们利用tdTOM报告基因进行监测gydF4y2BaMyoggydF4y2Ba体外原代成肌细胞的实时电镜表达。成人音乐gydF4y2BaTg: Pax7-nGFP;MyoggydF4y2BantdTom / +gydF4y2Ba采用基于GFP荧光的流式细胞术分离小鼠,并进行体外分化。培养3天后,开始实时成像,每9分钟采集图像,持续48小时(图2)。gydF4y2Ba4gydF4y2Baa、附加文件gydF4y2Ba4gydF4y2Ba).gydF4y2Ba
MyoggydF4y2Ba+gydF4y2Ba细胞可以进行细胞分裂。gydF4y2Ba一个gydF4y2Ba利用GFP荧光技术分离了gydF4y2BaTg: Pax7-nGFPgydF4y2BaTg / +gydF4y2Ba;MyoggydF4y2BantdTom / +gydF4y2Ba老鼠。细胞镀3天后开始实时成像。黑色箭头指向tdTOMgydF4y2Ba+gydF4y2Ba细胞分裂及其子细胞。每9分钟采集一次图像。比例尺,25 μm。gydF4y2BabgydF4y2Ba实验的代表性跟踪输出gydF4y2Ba一个gydF4y2Ba.gydF4y2BacgydF4y2Ba左边的条形图显示了tdTOM的百分比gydF4y2Ba−gydF4y2Ba和tdTOMgydF4y2Ba+gydF4y2Ba至少经历过一次细胞分裂的细胞。右边的条形图显示了被分割的平均分割数gydF4y2Ba−gydF4y2Ba和tdTOMgydF4y2Ba+gydF4y2Ba在追踪期间(gydF4y2BangydF4y2Ba=总共跟踪了4,100个细胞)。数据代表均值±标准差。双尾未配对学生数据gydF4y2BatgydF4y2Ba测试;**gydF4y2BapgydF4y2Ba值= 0.005 ~ 0.01。gydF4y2BadgydF4y2Ba复合的gydF4y2BaPax7gydF4y2Ba-表达细胞gydF4y2BaPax7gydF4y2BaCreERT2gydF4y2Ba;R26gydF4y2BaYFPgydF4y2Ba;MyoggydF4y2BantdTomgydF4y2Ba报告小鼠在上肢后肢肌肉损伤前1天进行诱导。在肌肉再生的2个时间点(1只小鼠/时间点)通过活体成像获得图像。白色箭头表示双阳性YFP和tdTOM细胞。标尺,100 μmgydF4y2Ba
通过人工跟踪单个细胞并基于tdTOM荧光监测其分化状态,我们观察到高达35%的MYOGgydF4y2Ba+gydF4y2Ba成像期间细胞发生细胞分裂(图2)。gydF4y2Ba4gydF4y2Bab、c).建立了MYOGgydF4y2Ba+gydF4y2Ba细胞仍然有能力进行细胞分裂,我们试图量化它们进行的分裂次数。在所有MYOG中gydF4y2Ba+gydF4y2Ba追踪到的细胞,没有分裂超过一次的。相比之下,所有的MYOGgydF4y2Ba−gydF4y2Ba细胞在成像期间分裂,在此期间平均进行1.5次分裂(图2)。gydF4y2Ba4gydF4y2Bac).因此,使用gydF4y2BaMyoggydF4y2BantdTomgydF4y2Ba记者老鼠,我们显示大约三分之一的MYOGgydF4y2Ba+gydF4y2Ba当追踪tdTOM表达时,细胞可以再进行一次细胞分裂。gydF4y2Ba
最后,我们评估了gydF4y2BaMyoggydF4y2BantdTomgydF4y2Ba小鼠活体成像监测组织再生。gydF4y2BaPax7gydF4y2BaCreERT2 / +gydF4y2Ba;R26gydF4y2BaYFP / +gydF4y2Ba;MyoggydF4y2BantdTom / +gydF4y2Ba小鼠被用于永久标记gydF4y2BaPax7gydF4y2Ba-表达的细胞及其后代,同时通过跟踪tdTOM的表达来追踪分化部分。我们在上肢后肢注射心脏毒素诱导肌肉损伤,并在不同时间点通过活体成像监测再生过程(图2)。gydF4y2Ba4gydF4y2Bad).不出所料,MYOG很少gydF4y2Ba+gydF4y2Ba损伤后3 d检测到细胞,YFP广泛增殖gydF4y2Ba+gydF4y2Ba肌原性祖细胞发生(图2)。gydF4y2Ba4gydF4y2BaD,左侧面板)。两天后,tdTOM的人口gydF4y2Ba+gydF4y2Ba成肌细胞明显扩大,tdTOM显著增加gydF4y2Ba+gydF4y2Ba在整个再生区均可观察到细胞(图2)。gydF4y2Ba4gydF4y2BaD,右侧面板,白色箭头),概括了我们流式细胞术分析的结果。gydF4y2Ba
综上所述,这些实验表明tdTOM是一个强大的报告器,可以监测MYOGgydF4y2Ba+gydF4y2Ba细胞的体外和活体成像。gydF4y2Ba
讨论gydF4y2Ba
MyoggydF4y2Ba是成肌细胞分化和融合的关键调节因子,是胚胎肌肉发育的重要因素。在本研究中,我们产生并表征了一种新的小鼠系来荧光标记MYOGgydF4y2Ba+gydF4y2Ba通过表达来自内源性的健壮的核定位tdTOM蛋白gydF4y2BaMyoggydF4y2Ba轨迹。gydF4y2Ba
表征tdTOM的特性gydF4y2Ba+gydF4y2Ba我们评估了它在胚胎和胎儿发育、体外成人原代成肌细胞和体内成人肌肉再生过程中与MYOG的共定位。考虑到在所有条件下,几乎所有细胞都对这两种标记物呈阳性(约95%的细胞),我们得出结论,tdTOM可靠地标记了MYOGgydF4y2Ba+gydF4y2Ba细胞从发育到成年。此外,总gydF4y2BaMyoggydF4y2Ba水平gydF4y2BaMyoggydF4y2BantdTom / +gydF4y2Ba动物与野生型相当,纯合子gydF4y2BaMyoggydF4y2BantdTom / ntdTomgydF4y2Ba老鼠是可以存活的。此外,tdTOM的表达使我们能够分离MYOGgydF4y2Ba+gydF4y2Ba来自发育胚胎和成年再生肌肉的群体表明该报告小鼠在分离活的分化成肌细胞方面的效用,这些细胞以前无法进行直接研究。gydF4y2Ba
此外,对细胞周期动力学的研究gydF4y2BaMyoggydF4y2Ba+gydF4y2Ba细胞由于缺乏荧光报告基因而受到阻碍。在这里,通过活体显微镜和单细胞跟踪分化的原代成肌细胞,我们证明了大约三分之一的MYOGgydF4y2Ba+gydF4y2Ba细胞可以在体外分裂,并在跟踪期间最多经历一次额外的细胞分裂。因此,大多数表达可检测水平MYOG的细胞退出细胞周期。gydF4y2Ba
一些研究已经对肌肉组织进行了活体成像[gydF4y2Ba24gydF4y2Ba,gydF4y2Ba51gydF4y2Ba,gydF4y2Ba52gydF4y2Ba,gydF4y2Ba53gydF4y2Ba];然而,其中只有两个动态监测肌肉再生过程[gydF4y2Ba24gydF4y2Ba,gydF4y2Ba51gydF4y2Ba]。这两项研究通过标记PAX7来关注祖细胞群体gydF4y2Ba+gydF4y2Ba细胞,但他们没有报道分化的动态。在这里,我们通过成人再生肌肉的活体成像进行了概念验证实验,并表明tdTOM荧光足以跟踪MYOGgydF4y2Ba+gydF4y2Ba细胞的整个再生过程。gydF4y2Ba
结论gydF4y2Ba
在这项研究中,我们描述了一种新的小鼠系的创建,其中tdTOM是从内源性表达的gydF4y2BaMyoggydF4y2Ba轨迹。tdTOM忠实地再现了MYOG在胚胎发育和成人肌肉再生过程中的表达,可以用流式细胞术分离这一群体。此外,tdTOM的杂合表达足以用于监测gydF4y2BaMyoggydF4y2Ba动态通过体内活体成像。因此,gydF4y2BaMyoggydF4y2BantdTomgydF4y2Ba这对研究肌肉祖细胞在胚胎期和成体期的谱系进展动力学具有重要意义。gydF4y2Ba
数据和材料的可用性gydF4y2Ba
研究过程中产生和分析的所有数据均可根据通讯作者的合理要求提供。gydF4y2Ba
缩写gydF4y2Ba
- Myog:gydF4y2Ba
-
MyogeningydF4y2Ba
- 磁流变液:gydF4y2Ba
-
肌生成调节因子gydF4y2Ba
- 音乐:gydF4y2Ba
-
肌肉干细胞gydF4y2Ba
- BrdU:gydF4y2Ba
-
5-Bromo-2的脱氧尿苷gydF4y2Ba
- sgRNA:gydF4y2Ba
-
单导RNAgydF4y2Ba
- CRISPR:gydF4y2Ba
-
有规则间隔的短回文重复gydF4y2Ba
- NLS:gydF4y2Ba
-
核定位序列gydF4y2Ba
- 绿色荧光蛋白:gydF4y2Ba
-
绿色荧光蛋白gydF4y2Ba
- RT-qPCR:gydF4y2Ba
-
实时定量聚合酶链反应gydF4y2Ba
- 凯蒂:gydF4y2Ba
-
敲入gydF4y2Ba
- 流式细胞仪:gydF4y2Ba
-
荧光辅助细胞分选gydF4y2Ba
- 助教:gydF4y2Ba
-
胫骨前gydF4y2Ba
- YFP:gydF4y2Ba
-
黄色荧光蛋白gydF4y2Ba
参考文献gydF4y2Ba
王晓明,王晓明,王晓明,等。骨骼肌发生的分子和细胞调控。中国生物医学工程学报,2014;11 (1):1 - 3gydF4y2Bahttps://doi.org/10.1016/b978-0-12-405943-6.00001-4gydF4y2Ba.gydF4y2Ba
李国强,李国强,李国强,等。由于严重的肌肉缺陷,肌原蛋白基因破坏可导致围产期死亡。大自然。1993;364:532-5gydF4y2Bahttps://doi.org/10.1038/364532a0gydF4y2Ba.gydF4y2Ba
Hasty P, Bradley A, Morris JH, Edmondson DG, Venuti JM, Olson EN,等。肌肉原基因靶向突变小鼠的肌肉缺乏和新生儿死亡大自然。1993;364:501-6gydF4y2Bahttps://doi.org/10.1038/364501a0gydF4y2Ba.gydF4y2Ba
Venuti JM, Morris JH, Vivian JL, Olson EN, Klein WH。在小鼠发育过程中,肌原素是晚期而非早期肌形成所必需的。[J]中国生物医学工程学报。1995;28 (3):563 - 567gydF4y2Bahttps://doi.org/10.1083/jcb.128.4.563gydF4y2Ba.gydF4y2Ba
Knapp JR, david JK, Myer A, Meadows E, Olson EN, Klein WH。产后失去肌原素导致骨骼肌正常,但体型减小。发展。2006;133:601-10gydF4y2Bahttps://doi.org/10.1242/dev.02249gydF4y2Ba.gydF4y2Ba
赵建辉,张建辉,张建辉。肌原素调节成体肌肉干细胞中一个独特的遗传程序。生物工程学报。2008;22 (2):444 - 444gydF4y2Bahttps://doi.org/10.1016/j.ydbio.2008.07.024gydF4y2Ba.gydF4y2Ba
张建军,张建军,张建军。小鼠X染色体连锁性肌营养不良(mdx)。国家科学进展。1984;81:1189-92gydF4y2Bahttps://doi.org/10.1073/pnas.81.4.1189gydF4y2Ba.gydF4y2Ba
梅多斯E,弗林JM,克莱因WH。肌原素调节运动能力,但对成年mdx小鼠骨骼肌再生是必不可少的。科学通报,2011;6:e16184gydF4y2Bahttps://doi.org/10.1371/journal.pone.0016184gydF4y2Ba.gydF4y2Ba
Seale P, Sabourin L a, Girgis-Gabardo a, Mansouri a, Gruss P, Rudnicki Ma . Pax7是肌源性卫星细胞规范所必需的。细胞。2000;102:777 - 86gydF4y2Bahttps://doi.org/10.1016/s0092 - 8674 (00) 00066 - 0gydF4y2Ba.gydF4y2Ba
Pax7对肌源性卫星细胞的再生和繁殖有指导作用,但对其特异性没有指导作用。[j] .中华医学会学报(自然科学版);2004;23 (3):344 - 344gydF4y2Bahttps://doi.org/10.1038/sj.emboj.7600346gydF4y2Ba.gydF4y2Ba
李建军,李建军,李建军,等。pax7阳性卫星细胞在急性损伤诱导的骨骼肌再生中的作用。发展。2011;138:3639-46gydF4y2Bahttps://doi.org/10.1242/dev.067595gydF4y2Ba.gydF4y2Ba
Sambasivan R, Yao R, kissenpfeneni A, Wittenberghe LV, Paldi A, Gayraud-Morel B,等。表达pax7的卫星细胞是成人骨骼肌再生不可或缺的细胞。发展。2011;138:3647-56gydF4y2Bahttps://doi.org/10.1242/dev.067587gydF4y2Ba.gydF4y2Ba
Murphy MM, Lawson JA, Mathew SJ, Hutcheson DA, Kardon G.卫星细胞、结缔组织成纤维细胞及其相互作用对肌肉再生至关重要。发展。2011;138:3625-37gydF4y2Bahttps://doi.org/10.1242/dev.064162gydF4y2Ba.gydF4y2Ba
北岛洋,小野洋。YFP敲入小鼠肌肉卫星细胞中PAX7蛋白动力学的可视化。骨骼肌。2018;8:26gydF4y2Bahttps://doi.org/10.1186/s13395-018-0174-xgydF4y2Ba.gydF4y2Ba
李建军,李建军,李建军,等。不同的调节级联控制眼外和咽弓肌祖细胞的命运。开发单元。2009;16:810-21gydF4y2Bahttps://doi.org/10.1016/j.devcel.2009.05.008gydF4y2Ba.gydF4y2Ba
李建军,刘建军,李建军,等。成体肌肉干细胞的胚胎建立者是由决定基因Mrf4启动的。中国生物医学工程学报,2013;31 (1):391 - 391gydF4y2Bahttps://doi.org/10.1016/j.ydbio.2013.04.018gydF4y2Ba.gydF4y2Ba
Bosnakovski D,徐忠,李伟,Thet S, Cleaver O, Perlingeiro RCR等。利用Pax7报告基因对骨骼肌干细胞进行前瞻性分离。中国生物医学工程学报。2008;26 (3):394 - 394gydF4y2Bahttps://doi.org/10.1634/stemcells.2007-1017gydF4y2Ba.gydF4y2Ba
Tichy ED, Sidibe DK, Greer CD, Oyster NM, Rompolas P, Rosenthal NA,等。一个健壮的Pax7EGFP小鼠,使肌肉干细胞的动态行为可视化。骨骼肌。2018;8:27gydF4y2Bahttps://doi.org/10.1186/s13395-018-0169-7gydF4y2Ba.gydF4y2Ba
李建军,李建军,李建军,等。成体卫星细胞和胚胎肌祖细胞具有不同的遗传要求。大自然。2009;460:627-31gydF4y2Bahttps://doi.org/10.1038/nature08209gydF4y2Ba.gydF4y2Ba
morrikis P, Sambasivan R, Castel D, Rocheteau P, Bizzarro V, Tajbakhsh S. Notch信号在静止骨骼肌干细胞状态维持中的关键要求。干细胞。2012;30:243-52gydF4y2Bahttps://doi.org/10.1002/stem.775gydF4y2Ba.gydF4y2Ba
adaddicks GC, brown CE, Sincennes M-C, Saber J, Porter CJ, Stewart AF,等。MLL1是小鼠PAX7表达和卫星细胞自我更新所必需的。学报。2019;10:4256gydF4y2Bahttps://doi.org/10.1038/s41467-019-12086-9gydF4y2Ba.gydF4y2Ba
Baghdadi MB, Firmino J, Soni K, Evano B, Girolamo DD, Mourikis P,等。缺口诱导的miR-708可拮抗卫星细胞迁移并维持静止。生物医学工程学报,2018;23:859-868.e5gydF4y2Bahttps://doi.org/10.1016/j.stem.2018.09.017gydF4y2Ba.gydF4y2Ba
李建军,李建军,李建军,等。肌肉干细胞非对称和对称分裂动力学的研究进展。[j] .计算机科学与技术,2010gydF4y2Bahttps://doi.org/10.1016/j.celrep.2020.01.097gydF4y2Ba.gydF4y2Ba
韦伯斯特MT, Manor U, Lippincott-Schwartz J, Fan CM。活体成像显示,在再生过程中,鬼纤维作为建筑单位引导肌源性祖细胞。细胞干细胞,2016;18:243-52gydF4y2Bahttps://doi.org/10.1016/j.stem.2015.11.005gydF4y2Ba.gydF4y2Ba
Kelly R, Alonso S, Tajbakhsh S, Cossu G, Buckingham M. Myosin轻链3F调控序列对转基因小鼠心肌和骨骼肌表达的影响。[J]中国生物医学工程学报。1995;29 (3):393 - 396gydF4y2Bahttps://doi.org/10.1083/jcb.129.2.383gydF4y2Ba.gydF4y2Ba
Edmondson DG, Cheng TC, Cserjesi P, Chakraborty T, Olson EN。对肌生成素启动子的分析揭示了由肌肉特异性增强因子MEF-2介导的正向自我调节的间接途径。中华生物医学杂志。1992;12:3665-77gydF4y2Bahttps://doi.org/10.1128/mcb.12.9.3665gydF4y2Ba.gydF4y2Ba
Yee SP, Rigby PW。小鼠胚胎发育过程中肌原素基因表达的调控。基因发展。1993;7:1277-89gydF4y2Bahttps://doi.org/10.1101/gad.7.7a.1277gydF4y2Ba.gydF4y2Ba
李建军,李建军,李建军,等。cre介导的基因重组对小鼠脊髓和颅脑运动神经元损伤的影响。发展生物学。1998;197:234-47gydF4y2Bahttps://doi.org/10.1006/dbio.1997.8859gydF4y2Ba.gydF4y2Ba
Johnson JE, Wold BJ, Hauschka SD。肌酸激酶序列元件调控转基因小鼠骨骼肌和心肌表达。中国生物医学工程学报。1989;9 (3):393 - 393gydF4y2Bahttps://doi.org/10.1128/mcb.9.8.3393gydF4y2Ba.gydF4y2Ba
李建军,李建军,李建军,等。蛋白质合成的基因调控机制。中华生物医学杂志,2006;3:391 - 391gydF4y2Bahttps://doi.org/10.1016/s0022 - 2836 (61) 80072 - 7gydF4y2Ba.gydF4y2Ba
高曼CM,莫法特LF,霍华德BH。在哺乳动物细胞中表达氯霉素乙酰转移酶的重组基因组。中华生物医学杂志。1982;2:10 - 10gydF4y2Bahttps://doi.org/10.1128/mcb.2.9.1044gydF4y2Ba.gydF4y2Ba
肌原蛋白表达、细胞周期退出和表型分化是暂时可分离的事件,发生在肌发生时细胞融合之前。[J] .生物医学工程学报。1996;32 (2):557 - 561gydF4y2Bahttps://doi.org/10.1083/jcb.132.4.657gydF4y2Ba.gydF4y2Ba
郭凯,王杰,王娟,王志刚,王志刚。myod诱导的p21对细胞周期蛋白依赖性激酶活性的抑制作用。中国生物医学工程学报。1995;15 (3):391 - 391gydF4y2Bahttps://doi.org/10.1128/mcb.15.7.3823gydF4y2Ba.gydF4y2Ba
张鹏,王超,刘东,Finegold M, Harper JW, Elledge SJ。p21CIP1和p57KIP2在肌生成素阶段控制肌肉分化。遗传学报。1999;13:213-24gydF4y2Bahttps://doi.org/10.1101/gad.13.2.213gydF4y2Ba.gydF4y2Ba
Ran FA, Hsu PD, Wright J, Agarwala V, Scott DA, Zhang F. CRISPR-Cas9系统的基因组工程。自然科学学报,2013;8 (2):591 - 598gydF4y2Bahttps://doi.org/10.1038/nprot.2013.143gydF4y2Ba.gydF4y2Ba
Ryan MD, King AMQ, Thomas GP。口蹄疫病毒多蛋白的切割是由位于19个氨基酸序列中的残基介导的。中国生物医学工程学报,2001;32 (2):379 - 379gydF4y2Bahttps://doi.org/10.1099/0022-1317-72-11-2727gydF4y2Ba.gydF4y2Ba
Kalderon D, Roberts BL, Richardson WD。史密斯AE。能确定核位置的短氨基酸序列。细胞。1984;39:499 - 509gydF4y2Bahttps://doi.org/10.1016/0092 - 8674 (84) 90457 - 4gydF4y2Ba.gydF4y2Ba
Rodríguez CI, Buchholz F, Galloway J, Sequerra R, Kasper J, Ayala R,等。高效缺失小鼠实验表明,FLPe是Cre-loxP的替代品。中华医学杂志。2000;25:139-40gydF4y2Bahttps://doi.org/10.1038/75973gydF4y2Ba.gydF4y2Ba
ggayraud - morel B, Pala F, Sakai H, Tajbakhsh S.肌肉干细胞的研究进展。[j] .生物医学工程学报。2017;35 (6):523 - 539gydF4y2Bahttps://doi.org/10.1007/978-1-4939-6771-1_2gydF4y2Ba.gydF4y2Ba
Yokomizo T, Yamada-Inagawa T, Yzaguirre AD, Chen MJ, Speck NA, Dzierzak E.小鼠胚胎内定位免疫染色细胞的全载三维成像。Nat protocol . 2012; 7:421-31gydF4y2Bahttps://doi.org/10.1038/nprot.2011.441gydF4y2Ba.gydF4y2Ba
鲍利科夫斯基B,波利姆C,贝塔N, Kardon G, Olwin BB。普遍的卫星细胞对未受伤的成年肌纤维的贡献。骨骼肌。2015;5:42gydF4y2Bahttps://doi.org/10.1186/s13395-015-0067-1gydF4y2Ba.gydF4y2Ba
Livak KJ, Schmittgen TD。采用实时定量PCR和2 - ΔΔCT方法分析相关基因表达数据。方法。2001;25:402-8gydF4y2Bahttps://doi.org/10.1006/meth.2001.1262gydF4y2Ba.gydF4y2Ba
Tinevez J- y, Perry N, Schindelin J, Hoopes GM, Reynolds GD, Laplantine E,等。TrackMate:一个开放和可扩展的单粒子跟踪平台。方法。2017;115:80 - 90gydF4y2Bahttps://doi.org/10.1016/j.ymeth.2016.09.016gydF4y2Ba.gydF4y2Ba
Schindelin J, Arganda-Carreras I, Frise E, Kaynig V, Longair M, Pietzsch T,等。斐济:生物图像分析的开源平台。Nat Methods. 2012; 9:676-82gydF4y2Bahttps://doi.org/10.1038/nmeth.2019gydF4y2Ba.gydF4y2Ba
团队RC。R:用于统计计算的语言和环境。R Foundation for Statistical. 2014。gydF4y2Bahttp://www.R-project.org/gydF4y2Ba.gydF4y2Ba
Wickham H. ggplot2,用于数据分析的优雅图形。2009.gydF4y2Bahttps://doi.org/10.1007/978-0-387-98141-3gydF4y2Ba.gydF4y2Ba
Cheng TC, Hanley TA, Mudd J, Merlie JP, Olson EN。利用与肌生成素控制区相关的转基因绘制胚胎发生过程中肌生成素的转录图谱。中国生物医学工程学报(英文版);2009;19(1):349 - 356。gydF4y2Bahttps://doi.org/10.1083/jcb.119.6.1649gydF4y2Ba.gydF4y2Ba
王晓明,王晓明,王晓明,等。骨骼肌发育的不同阶段对肌肉干细胞休眠的影响。干细胞代表2020。gydF4y2Bahttps://doi.org/10.1016/j.stemcr.2020.07.011gydF4y2Ba.gydF4y2Ba
李建军,陈建军,李建军,等。骨骼肌再生生物学的研究进展。中华医学杂志。2009;4:293-319gydF4y2Bahttps://doi.org/10.2217/17460751.4.2.293gydF4y2Ba.gydF4y2Ba
刘建军,刘建军,刘建军,等。小鼠肌肉再生损伤模型的比较研究。科学通报,2016;11:e0147198gydF4y2Bahttps://doi.org/10.1371/journal.pone.0147198gydF4y2Ba.gydF4y2Ba
Konagaya Y, Takakura K, Sogabe M, Bisaria A, Liu C, Meyer T, Sehara-Fujisawa A, Matsuda M, Terai K.生命成像显示肌肉再生过程中细胞周期依赖性的肌原细胞迁移。中国生物医学工程学报,2016,31(2):357 - 357。gydF4y2Bahttps://doi.org/10.1080/15384101.2020.1838779gydF4y2Ba.gydF4y2Ba
刘建军,吴志强,李建军,李建军,等。小鼠胫骨前肌的活体多光子成像。活体的。2016;5:e1156272gydF4y2Bahttps://doi.org/10.1080/21659087.2016.1156272gydF4y2Ba.gydF4y2Ba
Petkova MV, Stantzou A, Morin A, Petrova O, Morales-Gonzalez S, Seifert F,等。DmdEGFP-mdx Duchenne肌营养不良小鼠模型中可逆和治疗性恢复的肌营养不良蛋白的实时成像。Neuropath apple neuroo . 2020;gydF4y2Bahttps://doi.org/10.1111/nan.12639gydF4y2Ba.gydF4y2Ba
致谢gydF4y2Ba
我们感谢S. Paisant在维持小鼠胚胎干细胞系、巴斯德研究所小鼠遗传工程平台、法国国家研究机构(France BioImaging;ANR-10-INSB-04;巴斯德研究所转化科学中心(CRT)-细胞术和生物标志物技术与服务部门(CB UTechS)以及居里-法国国家科学研究中心的尼康成像中心支持开展这项研究。gydF4y2Ba
资金gydF4y2Ba
我们感谢巴斯德研究所、法国国家研究局(卓越复兴实验室)、avenir投资、ANR-10-LABX-73),法国肌病防治协会(批准号#20510)和国家科学研究中心。M.B.D.得到了复兴卓越实验室和法国癌症防治联盟的资助。gydF4y2Ba
作者信息gydF4y2Ba
作者及单位gydF4y2Ba
贡献gydF4y2Ba
MBD设计、进行了实验并对数据进行了分析。GC, DDG和FL进行了一些实验。ST设计并监督了该项目。MBD和ST解释数据并撰写手稿。所有作者都编辑了这份手稿。所有作者都阅读并批准了最终的手稿。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
伦理批准并同意参与gydF4y2Ba
根据国家和欧洲共同体的指导方针和法国巴斯德研究所(CETEA)的伦理委员会批准的协议(协议# 2015-0008)处理动物。gydF4y2Ba
发表同意书gydF4y2Ba
所有作者都阅读了手稿的最终版本,并同意将其提交给gydF4y2Ba骨骼肌gydF4y2Ba.gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者声明没有利益冲突。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Ba
伟德体育在线b施普林格《自然》杂志对已出版的地图和机构的管辖权要求保持中立。gydF4y2Ba
补充信息gydF4y2Ba
附加文件4gydF4y2Ba
与图相关gydF4y2Ba4gydF4y2Ba一个。gydF4y2Ba在体外gydF4y2BatdTOM的划分gydF4y2Ba+gydF4y2Ba细胞。gydF4y2Ba
附加文件5:图S1。gydF4y2Ba
基因分型gydF4y2BantdTomgydF4y2Ba等位基因。A.耳夹样本的基因分型gydF4y2BaMyoggydF4y2BantdTom / ntdTomgydF4y2Ba,gydF4y2BaMyoggydF4y2BantdTom / +gydF4y2Ba和gydF4y2BaMyoggydF4y2Ba+/+gydF4y2Ba动物。gydF4y2BaMyog-ntdTomgydF4y2Ba用引物16、17和18 (flp重组)对等位基因进行PCR验证gydF4y2BaMyog-ntdTomgydF4y2Ba等位基因为236 bp, WT等位基因为600 bp)。gydF4y2Ba
附加文件6:图S2。gydF4y2Ba
tdTOM的表达是内源性的gydF4y2BaMyoggydF4y2Ba表达式。A.眼外(EOM)、舌肌和肢体肌肉的免疫荧光gydF4y2BaMyoggydF4y2BantdTom / +gydF4y2Ba胚胎在E14.5。条形图显示tdTOM和MYOG阳性细胞的定量。N = 3个胚胎,每块肌肉和每个胚胎计数100个细胞。标尺,40 μm。B. RT-qPCR检测总蛋白水平gydF4y2BaMyoggydF4y2BamRNA,野生型等位基因和gydF4y2BatdTomgydF4y2Ba特异的来自gydF4y2BaMyoggydF4y2Ba+/+gydF4y2Ba, MyoggydF4y2BantdTom / +gydF4y2Ba和gydF4y2BaMyoggydF4y2BantdTom / ntdTomgydF4y2Ba成体成肌细胞使用图3所示的引物。gydF4y2Ba1gydF4y2Bac。gydF4y2BangydF4y2Ba每个基因型= 3只动物。数据为均数±标准差。双尾非配对Student 's t检验;*gydF4y2BapgydF4y2Ba-value = 0.01 ~ 0.05。C.分离肢体肌肉的肌肉细胞gydF4y2BaTg: Pax7-nGFP;MyoggydF4y2Ba+/+gydF4y2Ba,gydF4y2BaTg: Pax7-nGFP;MyoggydF4y2BantdTom / +gydF4y2Ba和gydF4y2BaTg: Pax7-nGFP;MyoggydF4y2BantdTom / ntdTomgydF4y2Ba动物和电镀gydF4y2Ba在体外gydF4y2Ba分化5天。对细胞进行MYOG和tdTOM蛋白染色。标尺,100 μm。gydF4y2Ba
附加文件7:补充表1。gydF4y2Ba
引物序列gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循知识共享署名4.0国际许可协议,该协议允许以任何媒介或格式使用、共享、改编、分发和复制,只要您适当地注明原作者和来源,提供知识共享许可协议的链接,并注明是否进行了更改。本文中的图像或其他第三方材料包含在文章的知识共享许可协议中,除非在材料的署名中另有说明。如果材料未包含在文章的知识共享许可中,并且您的预期用途不被法律法规允许或超过允许的用途,您将需要直接获得版权所有者的许可。如欲查阅本许可证副本,请浏览gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba.创作共用公共领域免责声明(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)适用于本文中提供的数据,除非在数据的信用额度中另有说明。gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
Benavente-Diaz, M., Comai, G., Di Girolamo, D.。gydF4y2Baet al。gydF4y2Ba使用新型肌原蛋白敲入报告小鼠的肌源性分化动力学。gydF4y2Ba骨骼肌gydF4y2Ba11gydF4y2Ba, 5(2021)。https://doi.org/10.1186/s13395-021-00260-xgydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s13395-021-00260-xgydF4y2Ba
关键字gydF4y2Ba
- MyogeningydF4y2Ba
- 敲入小鼠gydF4y2Ba
- tdTOMATOgydF4y2Ba
- 活体成像gydF4y2Ba
- 骨骼肌gydF4y2Ba