摘要
在肌肉损伤的反应中,肌肉干细胞整合受损组织中的环境线索来介导再生。这些环境信号受到严格调控,以确保肌肉干细胞群体的扩张,以修复受损的肌纤维,同时允许干细胞生态位的再生。肌肉干细胞命运的这些变化源于基因表达的变化,这些变化是对来自肌肉环境的细胞信号的响应。
来自肌肉环境的信号整合通过表观遗传机制导致基因表达的变化。这些机制,包括染色质的翻译后修饰和核小体重新定位,使特定的基因位点更多或更少地可被转录机制访问。在年轻时,肌肉环境的理想结构允许协调信号,从而调节有效的再生。年龄和疾病都会改变肌肉环境,从而改变塑造健康肌肉干细胞表观基因组的信号通路。改变的表观基因组降低了肌肉修复所需的细胞命运转变的效率,并有助于肌肉病理。然而,表观遗传变化的可逆性为恢复细胞命运潜力提供了可能,以改善肌病中的肌肉修复。
在这篇综述中,我们将描述目前允许肌肉干细胞在再生过程中命运转变的机制的知识,以及它是如何在肌肉疾病中改变的。此外,我们还提供了一些例子,说明表观遗传学如何在治疗上利用来改善各种肌肉病理的再生。
背景
骨骼肌的发育和再生是由肌肉干细胞(MuSCs)介导的,也被称为卫星细胞,其协调作用以确保肌纤维的有效形成,同时重新填充利基以允许在未来损伤后修复。为了介导肌纤维的形成,musc在达到完全分化状态之前必须经过多个细胞命运。这些中间细胞命运中的每一个都有一个相同的基因组,这被用作确定它们身份的蓝图。然而,每个细胞命运的特征是通过对基因组蓝图的交替解释来确定的,其中表观遗传机制被用来确定将被表达的基因子集。这些表观遗传机制通过控制转录机制对特定位点的可及性来实现差异基因表达。事实上,并不是核内的所有基因都可以被基因表达,因为由人类二倍体基因组编码的60亿碱基对的遗传信息必须高度压缩才能在核膜的范围内。DNA压缩通过连接147 bp的核小体的形成发生,并以200 bp的间隔在基因组中重复,连接子组蛋白H1蛋白允许核小体间DNA的保护。然后,这些10纳米纤维通过无序的自聚集冷凝形成染色单体[1].虽然每个细胞内的DNA组织都被认为是唯一的[2,一般规则就会出现。例如,未表达的基因往往与核外周有关,而转录的基因往往聚集在核腔内。这种细胞间独特的核组织是建立和维持细胞特异性基因表达程序的基础。染色质状态是流动的,以允许所需基因以时空方式表达。允许染色质结构流动性的一种机制是核小体与DNA联系的动态性质,其中核小体的位移允许未标记的组蛋白在新形成的核小体中合并。这种组蛋白交换不仅仅是一种简单的翻转机制,因为核小体中的典型组蛋白可以被不同的组蛋白变体所取代。组蛋白变体改变核小体的化学性质并改变它们的稳定性。
改变染色质组织的能力对于调节细胞命运和分化的决定至关重要。在对环境信号的响应中,染色质组织被修改,并改变了转录机制对基因序列的可及性,这是由几个水平的调控所调节的。第一个层次在于DNA本身,基因周围的特定序列元件可以作为启动子或增强子,作为转录因子(tf)的结合位点,可以将转录机制招募到位点。通过染色质环调节基因表达,启动子-增强子相互作用可能会增加招募转录机制的能力。第二级调控是通过转录因子或转录机制对DNA元件的差异可达性建立的。这可以通过调节染色质构象来实现,由DNA或组蛋白的可逆修饰通过表观遗传过程引起。
DNA甲基化是一种广泛应用的调节染色质可及性的表观遗传机制。哺乳动物中主要的DNA修饰是CpG甲基化,其中在脱氧核糖核苷酸胞嘧啶的碳5上添加一个甲基改变了TF对其DNA元素的亲和力。CpG甲基化通过两种潜在模式稳定基因沉默:(I)通过削弱DNA结合元件的能力来阻止转录所需的DNA结合蛋白的进入或(II)吸引含有甲基-CpG结合结构域的tf,这些结构域能够抑制转录。有人提出,DNA甲基化不会触发基因抑制,而是稳定已经沉默的基因的抑制[3.].
与有限数量的特征DNA修饰相比,组蛋白经历了各种各样的翻译后修饰(PTMs),包括乙酰化、甲基化、磷酸化、泛素化、adp -核糖基化和瓜氨酸化。其中,已知一些组蛋白pms允许染色质压实,而另一些组蛋白pms直接染色质分解。例如,组蛋白3赖氨酸9和赖氨酸27的三甲基化(H3K9me3和H3K27me3)或组蛋白4赖氨酸20的三甲基化(H4K20me3)与局部染色质压实有关。这种压缩调节TF或RNA聚合酶II对目标序列的访问,并导致基因表达的抑制。相反,组蛋白3赖氨酸9的乙酰化(H3K9Ac)和组蛋白4赖氨酸20的乙酰化(H4K20Ac)以及组蛋白3赖氨酸4的三甲基化(H3K4me3)导致染色质状态松弛,提高转录机制的可及性并增加局部基因表达[4,5,6].组蛋白3赖氨酸20的单甲基化(H3K20me1)和组蛋白3赖氨酸27的乙酰化(H3K27Ac)引起的基因增强子染色质松弛也可调节基因表达[7,8].因此,组蛋白修饰和转录输出之间的关系揭示了表观遗传密码如何调节基因表达。
在本综述中,我们将讨论表观遗传调控因子在成人musc再生功能中的作用。病变和老化的肌肉环境在修饰musc表观遗传景观中的作用也将进行研究。
MuSCs介导骨骼肌的再生
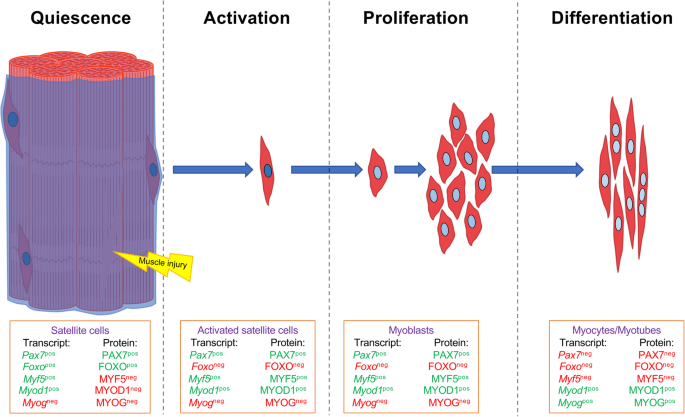
位于肌纤维的外围,在肌膜和基底膜之间[9], musc处于静止状态,随时准备对肌肉损伤做出反应。MuSCs的命运由一系列tf调控,包括Pax7和肌源性基本螺旋-环-螺旋蛋白家族,称为肌源性调节因子(mrf),包括MYOD, MYF5, MRF4和肌源性蛋白(MYOG) [10,11,12].这些肌肉tf与其他更普遍的tf一起工作,以建立调节肌肉再生的表观遗传状态。
MuSC静止状态的特征是PAX7和FOXO转录因子的表达[13].Myf5而且Myod1也在静止的musc中转录,但转录后调控阻止了它们的翻译(PAX7+FOXO+MYF5-MYOD1-)(图。1) [13,14].更具体地说,Myf5mRNA被隔离在信使核糖核蛋白颗粒(mRNPs)中,以避免其翻译[15),而Myod1mRNA保留一个内含子,防止其转位出核[16].肌肉损伤后,MuSC激活导致对称和/或不对称分裂。不对称分裂产生PAX7+MYF5+细胞,注定是肌源性程序和PAX7+MYF5-这种细胞可以重新填充静止的musc池。对称分裂产生两个相同的子细胞:Pax7的分裂+Myf5-细胞扩大MuSC池和更多的PAX7分裂+MYF5+扩大musc的[17].激活的musc表现为PAX7+FOXO-MYF5+MYOD+蛋白质表达谱。为了达到这个状态,Myf5而且Myod1mrna开始转译,PAX7表达减少,FOXO停止表达。激活的musc现在准备通过持续的细胞周期进程来响应受损肌肉中的环境信号信号来迅速扩大其种群。当musc开始积累时,PAX7和MYF5的表达被抑制,而MYOG开始表达,以驱动细胞周期退出并形成肌细胞(PAX7-FOXO-MYF5-MYOD1+MYOG+)(图。1) [13,18].最后,多核肌纤维的形成导致MYOD1表达降低,而MYF6/MRF4在功能性肌纤维中高表达[19,20.,21].
MRFs在控制MuSC命运中的作用已得到很好的确认。然而,肌源性tf需要与广泛的转录调控因子协调,这些调控因子有助于调节控制特定基因表达程序的表观遗传景观。下面,我们将讨论与肌源性tf协调工作以促进细胞命运转变的不同表观遗传因素。我们将讨论体外和体内观察,请记住,在体内进行的研究本质上更难以解释,因为信号信号可能来自再生肌肉环境中的其他细胞类型。除非另有说明,以下讨论的研究均在体外进行。
成人肌肉发生的表观遗传调控
静止和早期激活
静止是一种细胞进入可逆循环的状态0细胞周期:细胞周期的一个阶段染色质和表观遗传调控在维持MuSC静止中的作用的研究主要是在未受伤肌肉分离的MuSC上进行的,假设细胞在分选过程中保持静止细胞的特征。然而,最近的工作表明了隔离方案在研究真静止musc中的重要性[22].事实上,原位固定技术的发展将细胞在分离前锁定在静止状态,揭示了基因表达和组蛋白转录后修饰的重要差异。在分离MuSCs所需的3小时内,组蛋白H3上的表观遗传标记发生了广泛的变化,但在这段时间内未观察到DNA甲基化的差异[16,22,23].基于这些发现,人们可以假设,使用分离的MuSC分析收集的大多数表观遗传信息并不代表静止状态,而是在静止和激活之间的过渡,即早期激活[24,25].
维持静止状态需要抑制编码细胞周期蛋白和永久细胞周期退出的基因。p53被证明在静止的musc中维持可逆的细胞周期阻滞,而肿瘤抑制因子ARF的激活(p16INK4a)会导致明确的细胞周期阻滞和衰老[24,26].为了维持这种平衡,不同的途径有助于静止的MuSC转录网络。特别是,据报道,叉头盒(FOXO)转录因子FOXO1、FOXO3A和FOXO4的表达是维持MuSC静止所必需的[13].FOXO3维持Notch通路组分的表达[27].Active Notch通路导致MDM2的表达降低,从而允许p53的积累以维持细胞周期停滞和静止直到损伤[26,27,28].另一方面,p16INK4A需要保持在抑制状态,以防止musc进入最终的衰老细胞周期阻滞[26].
在静止状态下,由于染色质的浓缩状态,转录水平相对较低[29].然而,许多基因表达,包括MRFs,显示mRNA的积累,而不是其编码的蛋白质。这表明,musc使用转录调控之外的其他机制来调节它们的命运Myf5而且Myod1mRNA核保留。话虽如此,Myod1表达水平必须降到最低。这种减少必须通过表观遗传机制来控制。事实上,H4K20me2甲基转移酶Suv4-20 h1的表达是染色质凝结和抑制的必要条件Myod1静止musc的表达[29,30.].
组蛋白翻译后对MuSC静止和激活的调控
虽然PAX7和FOXO转录因子的表达是静止musc的关键特征,但尚不清楚它们的表达在静止期间是如何被控制的。
在激活的musc中,Pax7其表达受Polycomb (PcG)和Trithorax (TrxG)组蛋白拮抗作用,分别沉默或激活其表达。确实,赖氨酸甲基转移酶MLL1(三胸组亚单位)KO小鼠看到了损失Pax7在激活和增殖的musc中表达(通过在其启动子上添加H3K4me3标记),而对其没有影响Pax7静止musc的表达[31].
为了保持静止,MuSCs通过表达特定的细胞周期抑制剂来阻止细胞周期的进入。如前所述,细胞周期抑制剂的选择是必不可少的,如p16的表达INK4a细胞周期抑制剂导致衰老和永久细胞周期退出。p16的压抑INK4a在Polycomb PRC1复合体中,Ring1B E3泛素连接酶介导H2A的赖氨酸119 (H2AUb)单泛素化INK4a轨迹(26,32,33].此外,含有EZH2亚基的Polycomb PRC2配合物被证明在INK4a在小鼠胚胎成纤维细胞的体外培养中,通过沉积抑制性H3K27me3标记来控制其转录[34].监管INK4aPRC2位点也可能发生在musc中,因为EZH2的musc特异性KO阻止了干细胞种群的扩张[35].
MYOD1在MuSC承诺中具有重要功能,其表达是MuSC激活和增殖所必需的。当基因在低水平表达时,抑制染色质环境维持在Myod1基因座阻止高水平表达直到激活。组蛋白甲基转移酶(HMT) Suv4-20 h1在Myod1在其远端调控区(DRR)上游5kb处MyoD1转录起始位点。在这些位点添加H4K20me2可诱导异染色质形成并减少Myod1早期激活的MuSCs的表达[29].因为这种机制是必要的压制Myod1静止时的表情[29,30.],我们可以假设这些组蛋白ptm已经处于静止状态,并在早期激活期间维持。的DRR和推广者Myod1也以抑制性H3K9me2修饰为标志。虽然负责H3K9me2标记的酶尚不清楚,但一些维持这一标记的机制已经被发现。E3泛素连接酶Deltex2通过抑制含1C赖氨酸去甲基化酶朱孟吉结构域(JMJD1c)酶来维持H3K9me2标记是必不可少的[36].抑制JMJD1c功能可阻止去甲基化,以维持H3K9me2标记在Myod1启动子和DRR。值得注意的是,在这些调控区域去除H3K9me2对于蛋白表达的增加是必要的Myod1驱动MuSC激活[36].
最后,肌肉特异性基因的表达在静止和激活的musc中也受到抑制。在本例中,PRC2复合物介导肌球蛋白重链2b上H3K27me3标记的添加(Myh4)而且Myogenin(Myog)启动子与肌酸激酶基因(MCK)增强剂,导致他们的表达受到抑制[37].虽然这种水平的调控是从早期激活的musc中推断出来的,但在真正静止的musc中,确认PRC2是否也存在于这些肌肉特异性基因中是很重要的。
MuSC静止和早期激活期间的DNA甲基化格局
技术限制阻碍了我们对DNA甲基化在维持MuSC静止状态中的作用的理解。根据成纤维细胞系的原始谱系转换研究,可以推断DNA在MyoD位点甲基化以防止转录[38].然而,原代成纤维细胞的研究表明,MyoD位点在正常情况下没有甲基化,只有在危机反应中,全基因组CpG岛甲基化增加时,MyoD位点才会甲基化[39].因此,MyoD和其他基因的DNA甲基化在调节卫星细胞静止和激活之间的转变中的作用仍然是一个需要探索的领域,随着新技术的出现,允许分析少量细胞上的DNA甲基化,以及分离和研究静止musc的技术的改进,这一领域将得到促进。
表观遗传组蛋白修饰有助于musc的增殖状态
MYF5是促进musc增殖的关键转录因子。的Myf5该基因已经在静止的musc中表达,但激活后,其启动子H3K4 (H3K4me3)的三甲基化导致其表达增加。标记Myf5H3K4me3介导的启动子由HMT复合物WDR5/ASH2L/MLL1介导[40].该HMT复合物通过相互作用被PAX7招募,该相互作用需要CARM1蛋白对PAX7进行甲基化[41,42].HMT招聘地址:Myf5揭示了PAX7表达对musc激活和增殖的重要性。在相同的背景下,MLL1 KO也表现为Myf5原代成肌细胞和C2C12细胞中基因和蛋白的表达[31,43].在增殖的成肌细胞中观察到的这些作用与这一事实一致Pax7在从静止到增殖以及增殖过程中都需要保持表达。保持染色质的开放状态Pax7基因被认为是开关/蔗糖非发酵染色质重塑复合物(SWI/SNF)染色质重塑复合物的直接作用。事实上,Brg1 SWI/SNF亚基被酪蛋白激酶2磷酸化,并有助于SWI/SNF复合物的形成Pax7基因,促进其表达,导致MuSC增殖[44,45].
在增殖的musc中,PAX7被招募到开放染色质区域,其存在与活跃的组蛋白标记H3K4me1和H3K27Ac相关。特别是,PAX7通过激活转录增强子促进染色质在编码MRFs的基因位点的可及性[46].在这些mrf中,MYOD1在调节增殖和分化方面发挥着关键作用。在增殖细胞中,Msh同源异构体1 (MSX1) TF被证明与组蛋白H1, H1b的小鼠特异性亚型结合,在的核心增强子区(CER)Myod1以诱导染色质压实和减少Myod1表达式[47].此外,已知组蛋白去乙酰化酶(HDACs)是维持增殖所必需的,IIA类HDACs, HDAC4和HDAC5,由H3K9me3甲基转移酶SUV39H1招募以特异性靶向Myod1启动子。通过这种方式,它们进行了调节Myod1表达,这就强调了染色质形状的重要性Myod1基因维持增殖或进入分化(图;2) [48].抑制性的表观遗传因素的积累Myod1Notch1信号通路可以抑制细胞分化Myod1由于notch调控转录抑制剂HES1的瞬时表达而振荡[49,50].Lahmann等研究表明,HES1表达的降低导致MYOD表达和分化的维持[50].这些机制可能协同工作,协调从增殖到分化过渡的时间控制。
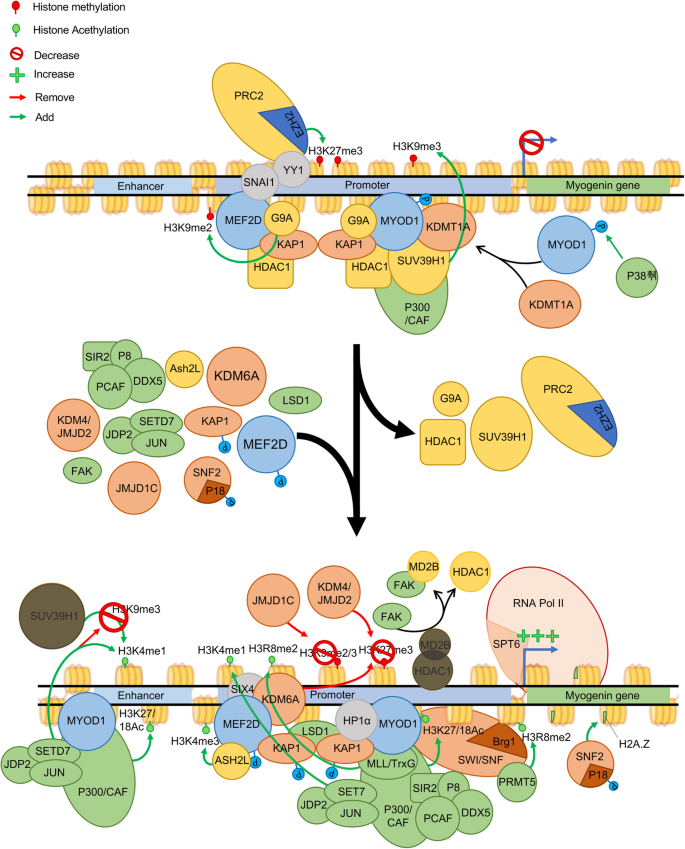
监管myogenin基因控制着增生性肌细胞向分化肌细胞的转变。为了阻断MyoG的表达并防止早期分化,需要MYOD1的抑制功能。在这种抑制作用中,MYOD1在启动子上被招募,并由于P38γ在其Ser199和200位点磷酸化而与KDMT1A结合。MYOD1与MEF2D、KAP1、G9a和HDAC形成平衡复合体。组蛋白乙酰转移酶P300/CAF蛋白也可与MYOD1/MEF2D复合物结合,但其功能有限。在分化诱导过程中,MYOD1的功能发生变化Myog基因的表达。这种转变是由于KAP1的磷酸化,导致MYOD1/MEF2D复合物中HDAC1和G9a蛋白的去除。在这种状态下,P38α磷酸化MEF2D的苏氨酸308和305,导致ASH2L的募集和H3K4的三甲基化。与此同时,JDP2、JUN和SETD7在p300/CAF蛋白上被招募,允许在的增强子上建立允许标记H3K4me1和H3K27/18AcMyogH3K4me1标记可以作为SuV39h1添加H3K9me3的拮抗剂。在启动子处,MLL/TrxG复合物被MyoD招募,使H3R8二甲基化。此外,JMJD1c和JMJD2 (KDM6A)分别去除H3K9me2/3和H3K27me3抑制标记,而MLL2、SETD2、PRMT5和p300在启动子上添加H3K4me3、H3K36me3、H3R8me2和H3K27/18Ac允许标记。这些允许标记的存在允许RNA聚合酶II的招募和转录的开始。在Myog基因中,P38α负责MEFD2和P18哈姆雷特(SNF2的一个亚基)的磷酸化;这种磷酸化导致不稳定H2A的掺入。Z变体位于核心基因,以促进转录
尽管MYOD1在增殖细胞中表达水平较低,但它对增殖和分化都有贡献。MYOD1确保肌肉分化基因在增殖过程中受到抑制,然后根据分化线索激活相同的基因[12].MYOD1在增殖和分化中的作用似乎是矛盾的,但当考虑到这个TF可以根据上下文同时是特定基因的抑制因子和激活因子时,就很容易理解了。在该模型中,MYOD1和MEF2D与支架蛋白KAP1相互作用[51].在增殖条件下,MYOD1、MEF2D和KAP1共同作用以稳定这两种辅抑制因子(G9A, HDAC1)的结合[48,52]和辅激活剂(P300和LSD1) [53,54肌肉分化基因。这种增强体型复合物的组装在启动子处建立了一种稳定的染色质状态,其中抑制酶主导以限制基因表达。在分化过程中,丝裂原激活蛋白激酶(MAPK) P38α (P38α)表达的增加导致MSK1激酶的激活,该激酶在丝氨酸473处磷酸化KAP1 [51].磷酸化的KAP1蛋白不再与辅抑制因子相互作用,但继续与辅激活因子保持相互作用,导致开放染色质状态的建立和肌肉靶基因的表达(图。2) [51].换句话说,当协同抑制因子和协同激活因子都与MYOD1相关时,协同抑制因子占主导地位。来自环境的信号诱导MSK1磷酸化,进而取代位点上的辅抑制因子[51].MYOD1对MuSC增殖的贡献直接提示了其调控的可能性Myod1增殖时的表达水平。
额外的辅抑制因子与增殖细胞中的MYOD1-MEF2D-KAP1复合物相关。异染色质蛋白HP1α和β与MYOD1-MEF2D-KAP1相互作用,抑制其在靶基因启动子上的活性以维持增殖[55].类似地,HDAC1/MYOD1- kap1复合物的形成允许MYOD1靶基因去乙酰化。他们的目标之一,Myog由于HDAC1/MYOD1复合物的存在,SUV39h1的乙酰化程度降低并被招募,这是分化所必需的。在C2C12细胞系中,另一种含有MYOD1/P300/ cbp相关因子(PCAF)和HDAC SIRT2的复合物的形成对于维持增殖和抑制分化是必要的[56].与其他SIRT酶一样,SIRT2依赖于NAD+的水平,揭示了代谢对维持增殖的影响。组蛋白乙酰化的去除和Suv39h1的招募导致H3K9me3标记的富集和染色质在封闭状态下的维持,导致抑制Myog表达和阻碍分化的开始(图;2) [57,58].另一项研究揭示了P38γ MAPK参与MYOD1 Ser199和200位点磷酸化的功能,从而使SUV39h1/KMT1a招募到MYOD1Myog启动子,减少增殖过程中的表达[59].此外,与HDAC1/2相关的SNAIl家族转录抑制因子1 SNAI1可以在分化相关基因上结合E-box,阻止MYOD1与靶基因表达结合[60].这一机制提示SNAI1/HDAC1/2复合物通过阻断MYOD1启动分化而促进细胞增殖的重要性。
要维持成肌细胞的增殖,抑制分化是不够的。细胞还必须维持参与细胞周期进程的基因的表达。与大多数细胞类型一样,E2F蛋白家族通过将组蛋白乙酰转移酶P300/CBP和PCAF/GCN5组蛋白乙酰化酶招募到细胞周期蛋白基因中,在调节细胞周期中发挥关键作用[61,62].在原代小鼠成肌细胞中,E2F1/PCAF复合物介导E2F1靶基因组蛋白乙酰化,允许通过G1/S细胞周期检查点[63].除了乙酰转移酶的募集外,许多不同细胞类型的研究表明,E2F蛋白介导KMT2家族H3K4组蛋白甲基转移酶的募集[64].在肌肉系统中,增殖的C2C12细胞利用MLL5在细胞周期蛋白A2基因上沉积H3K4me3标记,这是通过G1/S细胞周期检查点的必要因素[65].最后,C2C12细胞中的H3K36me甲基转移酶SET2 KO通过降低cyclin D1、CDK4、CDK6和cyclin E2的水平来破坏G1/S和G2/M相变。这一结果表明H3K36甲基转移酶SET2在维持成肌细胞增殖中具有重要功能[66].因此,很明显,组蛋白的表观遗传修饰有助于维持细胞周期进程,尽管我们仍然缺乏对所有参与成肌细胞扩张的参与者的深入了解。
基因被组蛋白翻译后修饰标记的程度不仅取决于表观遗传酶的存在,还取决于有助于其酶活性的关键辅因子的可用性。事实上,细胞可用的能量来源会影响这些辅助因素的可用性。增殖MuSCs的糖酵解环境确保了丰富的三羧酸循环(TCA)中间产物,这些中间产物是建立表观遗传修饰所必需的。特别是丙酮酸的氧化脱羧为HAT蛋白提供乙酰辅酶a供体[67].类似地,代谢产物α-酮戊二酸是DNA或组蛋白分别通过10 - 11易位(TET)和JMJD蛋白去甲基化的必要辅助因子。组蛋白去甲基化酶LSD1和HDACs的功能也取决于FAD+和NAD+在细胞中的可用性[68].独立于TCA,细胞内蛋氨酸转化为s -腺苷蛋氨酸,这是DNA甲基转移酶(DNMT)蛋白作用所必需的[68].理解这些观点突出了代谢在MuSC表观遗传调控中的重要性。事实上,在分离小鼠musc后,在从静止到增殖的过渡过程中,发生了脂肪酸氧化和糖酵解之间的转变[69].这种转变导致NAD+水平的降低,从而降低了NAD+依赖的HDAC酶的SIRT1家族的活性。SIRT1的活性与肌肉基因表达相关的H4K16Ac标记的调控有关[69].虽然对促进MuSC增殖的表观遗传调控的代谢途径的表征仍处于起步阶段,但代谢组学领域的新技术使其成为当前研究的一个令人兴奋的领域。
增殖musc的DNA甲基化
在MuSC增殖过程中,DNA甲基化在阻止细胞周期抑制剂的表达中起着关键作用。其中,抑制周期蛋白依赖性激酶抑制剂1C (CDN1C或P57kip2)是防止分化所必需的。有趣的是,在MuSCs中删除DNA甲基转移酶DNMT3A会导致增殖减少,这与DNA甲基转移酶DNMT3A的表达增加有关Cdkn1c基因,降低其启动子序列的DNA甲基化。DNMT3A KO成肌细胞的增殖损失可以通过Cdkn1cKD,表明从头甲基化在维持MuSC增殖中的重要功能[70].控制Cdkn1cDNA甲基化可以通过MYOD1的功能间接发生。事实上,MYOD1已被证明在C2C12细胞中控制转录抑制因子锌指蛋白238 (ZFP238)的表达[71].这很重要,因为ZFP238蛋白能够在肌源性基因启动子处招募DNMT3A和HDAC1,以抑制它们的表达[72].可能在musc中,ZFP238也出现在Cdkn1c启动子并招募DNMT3A。目前,还没有工作来支持这些假设和分析,ZFP238和DNMT3A的存在Cdkn1c发起人必须被调查。
成肌细胞的持续增殖也依赖于抑制Myog基因表达防止分化。这种抑制被证明是可能的,由于甲基化在Myog启动子(73,74].的Myog启动子只有1.4%的CpG二核苷酸。然而,即使该区域不富含CpG岛,亚硫酸氢盐和甲基化敏感限制性内切酶分析显示,C2C12细胞增殖过程中存在高甲基化状态,这是C2C12细胞增殖所必需的Myog镇压(73].此外,分散的CpG位点的甲基化对于甲基-CpG结合蛋白ZBT38 (CIBZ)的结合是必要的。ZBT38在CpG岛屿的存在Myog启动子抑制其表达和维持增殖,敲除ZBT38导致C2C12细胞分化[75].
综上所述,这些发现表明,当musc开始增殖时,tf将表观遗传机制定位于确保细胞周期进展和防止分化所必需的基因。
分化过程的表观遗传调控
在扩张阶段之后,musc经历细胞周期阻滞并向分化过渡[76].细胞周期阻滞是通过细胞周期抑制剂CDKN1C或CDKN1A的表达启动的(p21) [77].此外,MYOD1蛋白表达的渐进式增加导致早期分化标志物的表达增加,如Myog同时与MYF5和PAX7表达的缺失相一致[78].与分化开始一致,MuSCs以组蛋白H3和H4的高乙酰化为标志,同时观察到H3K9和K27的甲基化降低[79,80].MuSCs的表观遗传重编程允许在分化所需的特定肌肉位点上打开染色质。
转录后组蛋白对MuSC分化的控制
人类成肌细胞的分化已被证明导致组蛋白PTM景观的巨大变化,H3K9me3和H4K20me3抑制标记的整体减少。特别是H3K9me3被擦除Myod1而且Myog位点(79].这些结果表明了组蛋白修饰调节对成肌细胞分化的重要性。
向分化过渡的第一步之一是通过细胞周期阻滞来停止MuSC增殖。在这样的背景下,下调Pax7表达必须发生。事实上,PRC2通过p38α磷酸化EZH2的苏氨酸372与阴阳1 TF (YY1)相互作用,EZH2是PRC2复合体的亚基。这种相互作用允许H3K4me3标记被H3K27me3取代,并导致在处形成抑制性染色质状态Pax7推动者和对其表达的抑制[81].在参与分化的转录因子中,E2F是一个由8种蛋白质组成的家族,其中包括视网膜母细胞瘤相关蛋白(RB)、视网膜母细胞瘤样蛋白1 (RBL1)和2 (RBL2)口袋蛋白。它们的功能是控制调节细胞周期和促进各种组织分化的蛋白质的基因表达[82,83].RB被证明可以结合HDAC1维持增殖,也可以通过与E2F4的相互作用调节细胞周期退出。RB招募HMT促进H3K9me3和H3K27me3标记在促进细胞周期蛋白的基因启动子上,使其表达减少,细胞周期停止,开始分化。这种抑制依赖于PRC1和PRC2,其中H2AK119Ub1和H3K27me3标记的加入建立了沉默状态[84].这种沉默状态可以通过L3MBTL1亚基、E2F4和HP1γ异染色质蛋白之间的相互作用,将二聚体伙伴、rb样、E2F和MuvB (dREAM)染色质压实复合体招募到靶基因来维持[85].
分化的诱导与MYOD1表达的增加相一致。增加Myod1通过jmjd1c驱动启动子中H3K9me3标记的去甲基化建立表达[36].一旦MYOD1高水平表达,肌肉靶基因E-box中SNAI1/HDAC1/2复合物与MYOD1之间的转换就会发生,从而促进分化[60].
Myog表达对于musc的分化也是必不可少的(图2)。2),并受转录起始位点上游的超级增强子调控[86].MYOD1、MEF2D、SIX4和FOXO3等转录因子在肌原蛋白启动子上形成转录活性状态的能力取决于多种表观遗传酶的联合活性。激活的初始事件之一Myog基因是通过赖氨酸去甲基化酶JMJD2/KDM4A的作用,从启动子上去除H3K9me2和H3K9me3的抑制标记。87].此外,焦点粘附激酶(FAK)通过促进HDAC酶从启动子分离来帮助实现开放染色质状态。在这种情况下,FAK结合甲基- cpg结合蛋白MBD2,在那里它诱导HDAC1的磷酸化,破坏HDAC1/MBD2的相互作用,并将其与启动子分离[88].一旦抑制标记被清除,启动子就可以被修改以积累转录允许标记。首先出现的标志之一是启动子内组蛋白3 (H3R8me2)中精氨酸8的二甲基化。这是通过PRMT5蛋白实现的,这是一种II型精氨酸甲基转移酶。一旦H3R8me2标记就位,表观遗传标记通过复合物的Brg1亚基识别修饰的组蛋白尾,允许染色质重塑复合物SWI/SNF的稳定关联。SWI/SNF与启动子的结合允许RNA聚合酶II的染色质分解以访问该基因[89].此外,组蛋白甲基转移酶SETD7靶向于MyogMYOD1启动子引入H3K4me1标记。SETD7是分化所必需的,因为SETD7的沉默导致肌管数量的减少和蛋白表达的丧失Myog[90,91,92].通过SETD7添加H3K4me1,通过阻断Suv39h1功能防止H3K9me3抑制标记的重新引入[90,91,92].没有HDAC1的存在Myog组蛋白乙酰转移酶P300/CAF的启动子,导致其富集H3K9和H3K14的乙酰化和表达Myog[58].组蛋白乙酰转移酶P300与Myog启动子由染色质结合蛋白NUPR1 (P8)促进,NUPR1也将RNA解旋酶DDX5募集到位点以启动高水平的基因表达[93].H3K36me3标记的引入对于高水平表达也是必不可少的Myog因为SETD2的沉默阻断了其表达,并在分化过程中阻止了肌管的形成[66].最后,核小体内的组蛋白交换可以改变蛋白的表达Myog基因。在分化过程中,SNF2复合体的亚基ZNHI1 (p18Hamlet)被P38α磷酸化,这使得它可以招募到Myog启动子,并允许H2A组蛋白被其不稳定的变体H2A取代。Z(图。2) [94].
为了进行分化,细胞也必须开始表达定义肌肉谱系的功能基因。这些MYOD1靶基因的激活需要招募SWI/SNF复合体,这是由转录激活物BRG1 (SMCA4)的溴域识别的组蛋白4高乙酰化促进的,导致染色质分解和基因表达[95].通过将myod1相关的SMRD3 (BAF60C)亚基合并到染色质重塑复合体中,可以促进SWI/SNF的募集[96].此外,MyoD招募组蛋白乙酰转移酶P300、JDP2、AP1 (JUN)和RUNX1 tf以及SETD7 HMT,导致活跃的组蛋白修饰标记H3K27Ac、H3K18ac和H3K4me1,这些标记将RNA聚合酶II靶向到肌肉分化基因的启动子区域(图2)。2) [97].有趣的是,SETD7甲基化非组蛋白,如TF SRF。SRF乙酰化促进其与肌肉特异性基因的血清反应元件的结合Acta1促进它的表达。这一规定是差异化所必需的,受到KDM2B的推崇[98].这些数据表明SETD7在调节分化中具有间接功能。然而,除了Acta1,到目前为止,在musc中还没有发现其他SRF目标。
虽然在分化过程中许多抑制酶从MYOD1靶基因中去除,但一些复合物仍然允许抑制基因表达以响应不断变化的环境。一个例子就是Myh4,Myog,Ckm这些基因被Polycomb PRC2介导的H3K27me3修饰标记在增殖的musc中,以抑制它们的表达并阻止分化。随着分化开始,PRC2复合体中的亚基之间发生转换,其中增殖中的EZH2亚基(PRC2-EZH2)被功能不活跃的含有ezh1的PRC2复合体所取代,该复合体缺乏EED亚基(PRC2- ezh1) [37,99].为了在分化过程中允许基因表达,H3K27me3修饰的去除是由H3K27去甲基酶KDM6A(也称为UTX)介导的,这是一种H3K27去甲基酶,打开染色质,允许蛋白的表达Myog还有差异化的入口[One hundred.,101].缺乏甲基转移酶活性的PRC2-EZH1复合物的稳定结合有助于维持转录允许状态[37,99].在应对肌肉萎缩等细胞应激时,PRC2-EZH1复合物结合EED亚基形成功能性HMT复合物,可在这些肌肉基因上重新引入H3K27me3标记,以阻止其表达[37,99].
随着MYOG开始推进分化程序,额外的表观遗传事件将导致末端分化相关基因的表达和分化后的肌细胞融合成肌管。含有H3K4me3甲基转移酶ASH2L的TrxG复合物被MEF2D招募到肌肉特异性基因,如肌肉细胞质酶,肌酸激酶,在那里它们介导H3K4me3标记的添加,促进基因表达[102].这种募集是通过P38α MAPK在MEF2D的苏氨酸308和315位点磷酸化来调节的。有趣的是,组蛋白精氨酸甲基转移酶Prmt5的功能对于早期分化至关重要,但对于晚期分化是可有可无的,而I型精氨酸甲基转移酶CARM1/PRMT4对于晚期分化是必要的,因为它在组蛋白3上沉积精氨酸17的二甲基化,以允许基因激活[89,103].这揭示了不同的表观遗传酶在确保肌肉分化过程中基因的短暂表达中的精细作用。
最后,当完全分化时,肌细胞在Myomaker和Myomerger蛋白的作用下融合形成多核肌纤维。虽然Myomaker和Myomerger蛋白的表观遗传调控尚未阐明,但正调控融合的膜蛋白CDON被Trithorax HMT ASH1L调节,该蛋白在转录起始位点沉积组蛋白3赖氨酸36的二甲基化(H3K36me2),以防止polycomb介导的抑制[104].有趣的是,ASH1L的缺失引起小鼠和人肌细胞体外融合能力的减弱,而不损害肌球蛋白重链(MHC)蛋白表达。这表明了三胸复合体对融合的直接控制,可以想象,对表观遗传学对融合调控的理解很快就会出现。
分化过程中的DNA甲基化修饰
一些研究已经揭示了DNA甲基化在调节肌肉分化中的重要作用。事实上,在分化过程中,据报道整个DNA甲基化格局减少了[105].几年前,据报道,砷钠处理C2C12可降低细胞的分化能力。这与CpG位点的DNA甲基化增加有关Myog的启动子和减量Myog表达式[106].甲基化的MyogC2C12细胞的启动子在诱导分化后迅速降低[73].已知DNA甲基化抑制TF结合。然而,使用表达荧光素酶报告结构和不同tf的293 T细胞模型,Sine oculis homeobox homolog 1 (SIX1)与MEF2A的结合被证实是有效的Myog启动器被确认。沉默C2C12中的SIX1导致甲基化增加Myog提示SIX1可能在甲基化抑制中起作用[74,107].在过去的几年中,TET蛋白已被证明催化DNA 5-甲基胞嘧啶转化为不同的氧化形式,5-羟甲基胞嘧啶,5-甲酰胞嘧啶,最终转化为5-羧基胞嘧啶,显示出积极的去甲基化能力[108,109].TET1和TET2在成肌细胞分化诱导后表达显著增加,支持分化过程中DNA甲基化减少的观点。有趣的是,在C2C12中,siRNA抑制TET2而不抑制TET1会导致DNA甲基化增加Myog,Myf6/Mrf4,Mymk(Myomaker)基因启动子。这些基因启动子上DNA甲基化的增加与C2C12分化的降低和废除相关[110].CpG甲基化的存在Myog启动子是ZBT38蛋白结合和Myog表达降低所必需的。甲基化的减少Myog启动子可能导致ZBT38的移除和其抑制的废除[75].除了Myog启动子去甲基化,在CpG位点DNA甲基化的普遍减少Myod1启动子在C2C12细胞分化3天后出现[111].分化过程中的DNA甲基化变化不仅归因于肌源性分化所需基因启动子的去甲基化。在特定基因的启动子CpG位点上添加DNA甲基化也是允许成肌细胞分化所必需的。在C2C12细胞中,分化3天后,CpG位点DNA甲基化增加Pax7而且Myf5展示了启动子。有趣的是,分化5天后,DNA甲基化仍高于增殖状态,但与分化第3天相比略有降低[111].小鼠DNMT3A基因缺失导致急性损伤再生后肌肉纤维化和横截面面积减少。DNMT3A的减少与启动子DNA甲基化的减少相关Gdf5这是一种重要的肌肉基因。有趣的是,Gdf5表达的增加不会改变增殖或分化能力。然而,据报道,肌纤维大小、长度和细胞核数量减少,分化相关基因表达减少,提示DNA甲基化Gdf5促进子是避免意外肌肉萎缩所必需的[112].
分化过程中DNA甲基化修饰也与组蛋白修饰相关。特别是异染色质蛋白HP1γ在基因组上识别并结合H3K9me3,与DNMT1相互作用,并招募hmt [55,113].在这一现象中,HP1γ的蛋白水平没有改变,但其空间定位发生了变化,并与甲基- cpg结合蛋白MECP2的存在相关。这些功能允许在分化过程中通过添加DNA甲基化来维持特定基因的沉默,并提示DNA甲基化与组蛋白PTMs变化之间的相互作用[114].
肌肉疾病中肌肉表观基因组的变化
与健康的成人肌肉相比,年老和患病的肌肉呈现出改变的细胞环境。因此,不同的线索触发表观基因组的变化,这将反过来改变musc维持其功能的能力。
在杜氏肌营养不良(DMD)的背景下,表观基因组的变化得到了很好的研究。在这种疾病中,肌萎缩蛋白基因的缺失在体内诱导重要的肌肉退行性表型。持续的肌纤维损伤与一个重要的炎症环境有关,引起TNF水平升高,从而导致Notch1表达,是musc激活和增殖的重要中介因子[115,116].Notch1蛋白的抑制是由于DNA甲基化的增加Notch1由ezh2依赖的DNMT3b招募引导[117].Notch信号的减弱可能通过改变DNA甲基化格局而损害MuSC在静止状态下的维持。功能性肌萎缩蛋白复合物的缺失也导致其相关一氧化氮(NO)通路的改变。组蛋白乙酰转移酶CBP/P300在斑马鱼DMD模型中被下调,而其在胚胎发育中的过表达挽救了表型[118].这表明表观遗传因素在肌肉抵抗营养不良损伤能力中的重要性。此外,在人类DMD的增生性成肌细胞中存在组蛋白修饰的异常模式mdxDMD小鼠模型。组蛋白PTMs的这种整体变化的特征是H3K14和H3K9乙酰化水平的增加,H3K79me2标记的增加,以及H3丝氨酸磷酸化10的增加[119].与健康成肌细胞相比,人类DMD成肌细胞中PRC1复合物亚单位BMI1的表达降低。有趣的是,BMI1过表达可减少DMD成肌细胞的氧化应激和DNA损伤,并增加ATP的产生[120].有趣的是,BMI1表达的缺失导致p16的调控异常INK4a以及musc的早期衰老[26].因此,来自DMD患者的musc的表观遗传变化导致干细胞池的功能衰竭。
另一个表观基因组被改变的肌病的例子是埃默里-德雷弗斯肌营养不良症。在这种疾病中,突变核纤层蛋白A / C编码核膜蛋白Lamin A/C的基因改变了MuSCs中的染色质凝结。此外,染色质和核层之间相互作用的改变导致MuSCs中h3k27me3介导的Polycomb复合物的失调[121].这种Polycomb复合物位置的变化导致自我更新的减少和musc的衰竭[121].
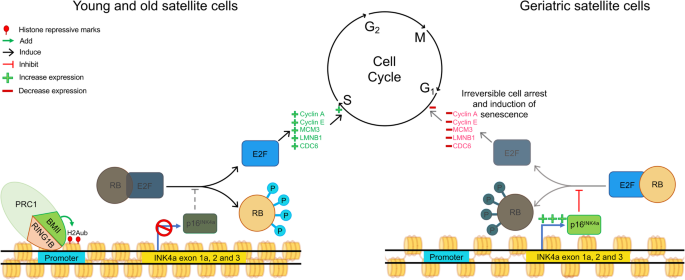
与年龄相关的炎症也会改变肌肉环境,从而改变MuSC表观基因组。在这些变化中,众所周知,DNA甲基化标记会随着年龄和环境暴露而变化,这表明随着时间的推移,MuSC表观基因组可能会发生改变[122].在人类中,DNA甲基化的比较显示,老年人(68-89岁)与年轻人(18-27岁)的骨骼肌基因的5 '区附近低甲基化,中间和3 '基因区高甲基化[123].此外,参与运动神经元连接和肌纤维形成的基因的基因内区域也显示了高甲基化[123].基因低表达与基因内、5′和转录起始区高甲基化之间存在相关性。相反,基因的上调与基因内、5’和转录起始区域的低甲基化相关[123].这种基因失调可能与肌肉减少症中观察到的运动单元丧失和肌肉去神经相关。在老年受试者的肌肉中观察到与衰老过程中DNA甲基化修饰相关的基因失调控[123,124].在人类中,在编码线粒体呼吸链组成部分COX7A1和NDUFB6的基因启动子上观察到DNA甲基化的增加,这与老年人基因表达的减少有关。这些改变显示了DNA甲基化随年龄变化的直接影响[125,126].一项从年轻和年老小鼠分离的musc中进行的研究表明,衰老过程中DNA甲基化的变化是一个随机事件。这些事件发生在基因启动子上,并驱动成肌细胞间变异基因的表达[127].肌肉再生功能也明显下降。对年轻(2-6个月)、老年(18-24个月)和老年(26-36个月)小鼠进行的研究显示,即使细胞移植到年轻肌肉中,随着年龄的增长,MuSC功能也会丧失,这表明MuSC存在内在改变。这些变化是由p16的放松管制引起的INK4a通过PRC1亚基BMI1,导致老年musc在衰老前状态切换(图1)。3.) [26,128].这种musc到衰老状态的转换具有不必要的后果,减少了可用于修复肌肉萎缩的功能干细胞的数量。因此,无论是衰老还是疾病,肌肉环境的改变都会导致musc的功能衰竭。
肌肉疾病和衰老中细胞命运的改变
如上所述,细胞的身份是由通过表观遗传机制确定的组织特异性基因表达程序定义的。因此,改变的细胞环境可能通过表观遗传机制改变MuSC的命运。由于表观基因组的改变,细胞可塑性在实验中得到证实,用DNA甲基化抑制剂5-氮杂胞苷处理成纤维细胞系可触发MYOD1的激活和多核肌管的形成[38,129,130].细胞对特定刺激的可塑性在多能性方面得到了更广泛的研究,其中成纤维细胞通过诱导多能干细胞的形成被重新编程到胚胎状态[131,132,133].虽然诱导多能干细胞最初是使用多能性tf的组合获得的,但后来的研究表明,谱系转换机制可以类似地通过暴露于各种小分子抑制剂来驱动[134,135].因此,肌病和衰老中肌肉环境的改变可能导致交替的MuSC命运也就不足为奇了。
近年来,越来越多的证据表明,MuSCs可以在DMD和衰老过程中产生成纤维细胞。研究表明,衰老肌肉的细胞外成分可诱导musc向成纤维细胞谱系的谱系转换[136].利用PAX7进行谱系追踪实验,证实了谱系转换对环境线索的响应克里尔; R26RYFP培育与mdx小鼠,其中7 - 20%的musc获得成纤维细胞表型[137].此外,mdx小鼠肌肉中TGFβ和Wnt信号通路升高,诱导肌源性向纤维源性转化。的确,Wnt信号通路控制TGFβ2的表达以诱导纤维化转化[137,138].因此,抑制WNT-TGFβ2信号通路可以阻止谱系转换,并降低纤维化基因的表达[137,138,139].由于环境的改变,MuSC命运的这种改变的维持机制仍然未知,需要进行研究,以及在人类中的证据,因为在小鼠中已经证明了命运的转变。
最后,与Emery-Dreifuss肌营养不良症中讨论的问题类似,由于p16导致功能性musc的丧失INK4a在肌肉减少症中也有表达。在这种情况下,BMI1的下调导致PRC1复合物从p16的启动子中移位INK4a在老年musc中。在缺乏PRC1的情况下,不适当的去除PRC1复合物会降低其抑制标记H2Aub的存在,增加p16INK4a表达,导致musc衰老[26].而类似的死Cas9 (dCas9)-Cbx4抑制p16的方法ink4a基因也是有效的,使用基因疗法来防止衰老突破了伦理界限。相反,通过小分子处理来维持老年musc中Bmi1的表达似乎是确保PRC1介导的p16抑制的更合适的手段INK4a延缓衰老musc的启动子。
结论
几十年前,关于musc使肌肉完全再生的机制的研究就已经开始了。在MRFs发现后,表观遗传机制的理解为肌肉发生的每一步的转变提供了新的见解。另外,DNA甲基化和组蛋白转录后调控在肌肉中已经得到了很好的研究,尽管仍有许多未解之谜。最近的研究强调了考虑这些法规正在以空间/时间方式变化的重要性。由于其复杂性,任何这些机制的严重失调都可能导致异常的肌生成程序和无法正确再生肌肉。在衰老或肌肉病理过程中遇到的MuSC表观基因组的改变导致基因失调和MuSC再生能力的降低。最近,据报道,这些法规的修改改变了小鼠模型中健康MuSC命运的维持[137,139].这些改变还没有被很好地理解。少数细胞表观基因组分析技术的重要进展,可能有助于发现导致musc异常细胞命运决定的机制。
数据和材料的可用性
不适用。
缩写
- AAV:
-
腺相关病毒
- CER:
-
核心增强子区
- dCas9:
-
死Cas9
- 模式:
-
杜氏肌营养不良症
- DNMT:
-
DNA甲基转移酶
- 梦想:
-
二聚体伙伴,rb样,E2F和MuvB
- DRR:
-
远端调节区
- FAK:
-
局灶粘附激酶
- H2AUb:
-
组蛋白2A赖氨酸119单泛素化
- H3K20me1:
-
组蛋白3赖氨酸20的单甲基化
- H3K27Ac:
-
组蛋白3赖氨酸27的乙酰化
- H3K27me3:
-
组蛋白3赖氨酸9的三甲基化
- H3K36me2:
-
组蛋白3赖氨酸36二甲基化
- H3K4me3:
-
组蛋白3赖氨酸4的三甲基化
- H3K9Ac:
-
组蛋白3赖氨酸9的乙酰化
- H3K9me3:
-
组蛋白3赖氨酸9的三甲基化
- H3R8me2:
-
组蛋白3中精氨酸8的二甲基化
- H4K20Ac:
-
组蛋白4赖氨酸20乙酰化
- H4K20me3:
-
组蛋白4赖氨酸20的三甲基化
- HDAC:
-
组蛋白脱乙酰酶
- HMT:
-
组蛋白甲基转移酶
- MAPK:
-
丝裂原活化蛋白激酶
- MCK:
-
肌酸激酶
- MeCP2:
-
甲基- cpg结合蛋白2
- MHC:
-
肌球蛋白重链
- 磁流变液:
-
肌源性调节因子
- 音乐:
-
肌肉干细胞
- MYOG:
-
Myogenin
- 没有:
-
一氧化氮
- PCAF:
-
P300 / CBP-associated因素
- PcG:
-
Polycomb集团
- 中华人民共和国:
-
多梳抑制复合体
- 铝:
-
翻译修饰
- 瑞士/ SNF:
-
开关/蔗糖非发酵染色质重塑复合物
- 春节:
-
一千零一十一年易位
- TF:
-
转录因子
- TrxG:
-
Trithorax集团
参考文献
Ou HD, Phan S, Deerinck TJ, Thor A, Ellisman MH, O 'Shea CC. ChromEMT:在间期和有丝分裂细胞中可视化三维染色质结构和压实。科学。2017;357:eaag0025。
张志刚,刘志刚,张志刚,张志刚,等。超分辨率染色质示踪揭示单细胞结构域和协同作用。科学。2018;362:eaau1783。
Mohandas T, Sparkes R, Shapiro L.失活的人类X染色体的再激活:DNA甲基化X失活的证据。科学。1981;211:393-6。
组蛋白甲基化与组蛋白乙酰化:表观遗传调控的新见解。中国生物医学工程杂志,2001;13:263-73。
许腾格鲁伯B,马丁内斯A-M, Iovino N, Cavalli G.三胸组蛋白:开关基因和保持它们的活性。中国生物医学工程学报,2011;
张春林,麦肯锡TA, Olson EN。II类组蛋白去乙酰化酶与异染色质蛋白1的关联:组蛋白甲基化在控制肌肉分化中的潜在作用。细胞生物学杂志,2002;22:7302-12。
Heintzman ND, Stuart RK, Hon G, Fu yy, Ching CW, Hawkins RD,等。人类基因组中转录启动子和增强子的独特和预测染色质特征。Nat Genet. 2007; 39:311-8。
赫泽华,马涵,刘志强,高桥勇,等。增强子相关的H3K4单甲基化由trithorax相关,哺乳动物Mll3/Mll4的果蝇同源物。基因开发2012;26:26 4 - 20。
毛罗A.骨骼肌纤维卫星细胞。中国生物化学杂志,2001;9:493-5。
阿齐兹,刘庆昌,戴尔华。调节一个主调控因子:在骨骼肌中建立组织特异性基因表达。表观遗传学。2010;5:691-5。
Segalés J,裴志勇,Muñoz-Cánoves P.成人骨骼肌干细胞功能的表观遗传控制。中国科学院学报,2015;
辛格K,迪尔沃斯FJ。细胞周期进程的差异调节区分了肌源性调控因子家族转录因子的成员。中国科学院学报,2013;
García-Prat L, Perdiguero E, Alonso-Martín S, Dell 'Orso S, Ravichandran S, Brooks SR,等。FoxO维持真正的肌肉干细胞静止状态直到老年。Nat Cell Biol, 2020。可以从:http://www.nature.com/articles/s41556-020-00593-7.
波champ JR, Heslop L, Yu DS, Tajbakhsh S, Kelly RG, Wernig A,等。CD34和Myf5的表达决定了大多数静止的成人骨骼肌卫星细胞。中国生物医学工程学报,2000;
Crist CG, Montarras D, Buckingham M.肌肉卫星细胞被启动为肌肉生成,但在mRNP颗粒中microRNA-31靶向Myf5 mRNA的隔离下保持静止。细胞干细胞。2012;11:118-26。
岳林,万荣,栾松,曾伟,张TH。在肌肉干细胞静止退出过程中,Dek调节整体内含子保留。开发细胞。2020;53:661-76。
匡邵,K黑田,F乐大,MA鲁德尼克。肌肉中卫星干细胞的不对称自我更新和承诺。细胞。2007;129:999 - 1010。
杨晓燕,王晓燕,王晓燕,王晓燕,王晓燕。MyoD缺失对小鼠卫星细胞增殖向分化的影响。发展生物学1999;210:440-55。
Hinterberger TJ, Sassoon DA, Rhodes SJ, Konieczny SF。肌纤维发育过程中肌肉调节因子MRF4的表达。Dev Biol, 1991; 147:144-56。
拉ure F, Blackburn DM, Corchado AH, Sahinyan K, Karam N, Sharanek A,等。Myf6/MRF4是维持肌肉干细胞库所需的肌源性生态位调节因子。EMBO 2020年代表。可以从:https://onlinelibrary.wiley.com/doi/10.15252/embr.201949499.
朱震,Boone MJ。MRF4可在肌生成早期替代肌原蛋白。Dev Dyn. 1997; 209:233-41。
Machado L, Esteves de Lima J, Fabre O, Proux C, Legendre R, Szegedi A,等。原位固定重新定义了骨骼肌干细胞的静止和早期激活。Cell rep 2017; 21:82 - 93。
范·维尔托芬CTJ,德·莫瑞A,埃格纳IM,布雷特·乔,兰多TA。体内静止肌肉干细胞的转录谱分析。Cell代表2017;21:1994-2004。
刘玲,张TH, Charville GW, Hurgo BMC, Leavitt T, Shih J,等。染色质修饰作为肌肉干细胞静止和年龄老化的决定因素。Cell rep 2013; 4:19 9 - 204。
刘l,张TH, Charville GW, Rando TA。荧光激活细胞分选分离骨骼肌干细胞。南京大学学报(自然科学版),2015;
Sousa-Victor P, Gutarra S, García-Prat L, Rodriguez-Ubreva J, Ortet L, Ruiz-Bonilla V,等。老年肌肉干细胞将可逆的静止转变为衰老。大自然。2014;506:316-21。
Gopinath SD, Webb AE, Brunet A, Rando TA。FOXO3促进成人肌肉干细胞在自我更新过程中的静止。干细胞代表2014;2:414-26。
Bjornson CRR,张TH,刘l, Tripathi PV,陡坡KM,兰多TA。Notch信号在成体肌肉干细胞中维持静止是必要的。干细胞。2012; 30:232-42。
张涛,张晓霞,袁晓霞,张晓霞,等。suv4 - 20h1依赖的兼性异染色质形成对骨骼肌干细胞静止的调控。《细胞干细胞》2016;18:229-42。
李勇,迪尔沃斯。压缩染色质以确保肌肉卫星细胞的静止。《细胞干细胞》2016;18:162-4。
Addicks GC, Brun CE, Sincennes M-C, Saber J, Porter CJ, Francis Stewart A等。MLL1是PAX7表达和小鼠卫星细胞自我更新所必需的。《公共学报》2019;10:4256。
曹睿,张艳,张艳。Bmi-1和Ring1A在H2A泛素化和Hox基因沉默中的作用。化学学报,2005;20:845-54。
王华,王玲,王丽娟,王志强,等。组蛋白H2A泛素化在Polycomb沉默中的作用。大自然。2004;431:873-8。
Agherbi H, Gaussmann-Wenger A, Verthuy C, Chasson L, Serrano M, Djabali M. Polycomb介导衰老过程中INK4a/ARF位点的表观遗传沉默和复制时间。Blagosklonny MV,编辑。PLoS ONE。2009; 4: e5622。
胡娟,Derfoul A,冯x, Ryall JG, Dell 'Orso S, Pasut A,等。Polycomb EZH2控制自我更新和保护骨骼肌干细胞的转录身份。基因开发,2011;25:7 9 - 94。
罗D, de Morree A, Boutet S, Quach N, Natu V, Rustagi A,等。Deltex2通过作为Jmjd1c负调控因子抑制MyoD表达,抑制肌源性分化。中国科学院学报(自然科学版),2017;
Polycomb Ezh2甲基转移酶调控肌肉基因表达和骨骼肌分化。基因开发2004;18:2627-38。
Jones PA, Wolkowicz MJ, Rideout WM, Gonzales FA, Marziasz CM, Coetzee GA,等。在不朽细胞系建立过程中MyoD1 CpG岛的从头甲基化。自然科学进展,1990;26(3):344 - 344。
张志刚,姚志刚,张志刚,张志刚,等。人类癌症和基因工程小鼠癌症模型启动子CpG岛DNA高甲基化的根本差异。表观遗传学。2013;8:1254-60。
McKinnell IW, Ishibashi J, Le Grand F, Punch VGJ, Addicks GC, Greenblatt JF,等。Pax7通过组蛋白甲基转移酶复合物激活肌源性基因。细胞生物学杂志,2008;10:77-84。
刁艳,郭霞,李艳,孙凯,卢玲,姜玲,等。Pax3/7BP是一种Pax7和pax3结合蛋白,通过表观遗传机制调节肌肉前体细胞的增殖。细胞干细胞。2012;11:31 - 41。
川边Y,王彦彦,麦金宁IW,贝德福德MT,鲁德尼克MA。在不对称卫星干细胞分裂过程中,Carm1通过MLL1/2招募调节Pax7的转录活性。细胞干细胞。2012;11:33 - 45。
蔡松,朱强,郭超,袁锐,张旭,聂勇,等。MLL1通过表观遗传调节促进肌肉生成Myf5.细胞增殖。2020;53可从:https://onlinelibrary.wiley.com/doi/abs/10.1111/cpr.12744.[引2020年3月10日]。
帕迪拉-贝纳维德斯T, Nasipak BT, Imbalzano AN。Brg1控制的表达Pax7促进小鼠原代成肌细胞的活力和增殖:原代成肌细胞需要Brg1。中国生物医学工程学报,2015;
Padilla-Benavides T, Nasipak BT, Paskavitz AL, Haokip DT, Schnabl JM, Nickerson JA,等。酪蛋白激酶2介导的brahma相关基因1的磷酸化控制成肌细胞增殖,并有助于SWI/SNF复合物的组成。中国生物医学工程学报。2017;
李丽佳,张宁,马丽丽,王志强,等。Pax7重塑骨骼肌干细胞中的染色质景观。PloS One, 2017;12:e0176190。
Lee H. Msx1与组蛋白H1b合作抑制转录和肌生成。科学。2004;304:1675-8。
李志强,李志强,李志强,等。I类组蛋白脱乙酰酶在骨骼肌发生过程中依次与MyoD和pRb相互作用。Mol Cell, 2001; 8:885-97。
Bröhl D, Vasyutina E, Czajkowski MT, Griger J, Rassek C, Rahn H-P,等。骨骼肌祖细胞对卫星细胞生态位的定植依赖于Notch信号。开发细胞。2012;23:469-81。
Lahmann I, Bröhl D, Zyrianova T, Isomura A, Czajkowski MT, Kapoor V,等。MyoD和Hes1蛋白的振荡调节激活肌肉干细胞的维持。基因开发2019;33:524-35。
Singh K, Cassano M, Planet E, Sebastian S, Jang SM, Sohi G,等。KAP1磷酸化开关控制骨骼肌分化过程中的MyoD功能。基因工程学报2015;29:513-25。
凌宝敏,巴拉蒂·N,钟廷坤,郭伟强,李松,谭玉华,等。赖氨酸甲基转移酶G9a甲基化转录因子MyoD并调节骨骼肌分化。中国科学:自然科学,2012;
迪尔沃斯FJ,西维尔KJ,菲什伯恩AL,赫特SL,泰普斯科特SJ。体外转录系统描述了辅激活子pCAF和p300在MyoD/ e47依赖的转激活中的不同作用。自然科学进展(英文版),2004;
崔俊,张浩,金浩,金世涛,赵艳杰,尹海东。组蛋白去甲基化酶LSD1通过调节生肌因子诱导骨骼肌分化。生物化学学报。2010;401:327-32。
Ait-Si-Ali S, Guasconi V, Fritsch L, Yahi H, Sekhri R, Naguibneva I,等。一种在分化细胞中沉默s期基因的suv39h依赖机制,而不是在周期细胞中。中华医学杂志,2004;23:605-15。
赵鹏,李志强,李志强,等。Sir2作为氧化还原状态的潜在传感器调节骨骼肌分化。化学学报。2003;12:51-62。
Mal正义与发展党。组蛋白甲基转移酶Suv39h1抑制肌源性分化。Embo j . 2006; 25:3323-34。
Mal A, Harter ML. MyoD在功能上与骨骼肌生成前肌肉特异性调节基因的沉默有关。自然科学进展,2003;21(3):357 - 357。
Gillespie MA, Le Grand F, Scimè A, Kuang S, von Maltzahn J, Seale V,等。p38-γ依赖基因沉默限制进入肌源性分化程序。中国生物医学工程学报(英文版);2009;
苏莱马尼VD,尹H,贾哈尼- asl A,明H, Kockx CEM, van Ijcken WFJ,等。蜗牛调节MyoD结合位点的占用,以指导增强子开关和分化特异性转录在肌发生。中国生物医学工程学报,2012;
高桥Y, Rayman JB, Dynlacht BD.体内E2F和pRB家族结合启动子的分析:不同的E2F蛋白介导激活和抑制。基因工程,2000;14:804-16。
Taubert S, Gorrini C, Frank SR, Parisi T, Fuchs M, Chan H-M,等。在G1晚期,e2f依赖的组蛋白乙酰化和Tip60乙酰转移酶复合物招募到染色质。分子生物学杂志,2004;24:4546-56。
饶文凯,欧JR,尚卡尔SR,巴拉提N,曼尼坎丹J,王勇,等。G9a在肌源性分化过程中促进细胞增殖并抑制细胞周期退出。核酸决议2016;44:8129-43。
南丁格尔KP, Gendreizig S, White DA, Bradbury C, holfelder F, Turner BM组蛋白修饰与组蛋白去乙酰化酶抑制剂之间的交叉对话:MLL4连接组蛋白H3乙酰化和组蛋白h3k4甲基化。中国生物化学杂志,2007;
Sebastian S, Sreenivas P, Sambasivan R, Cheedipudi S, Kandalla P, Pavlath GK,等。MLL5是三胸同源基因,间接调控H3K4甲基化,抑制cyclin A2表达,促进肌源性分化。自然科学进展(英文版);2009;
易鑫,陶勇,林X,戴勇,杨涛,岳X,等。组蛋白甲基转移酶Setd2对成肌细胞的增殖和分化至关重要。生物化学学报(英文版);2017:697-707。
Pietrocola F, Galluzzi L, bravoo - san Pedro JM, Madeo F, Kroemer G.乙酰辅酶A:中心代谢产物和第二信使。Cell Metab. 2015;21:8 5 - 21。
王玉玉,王玉霞,麦涛,李丽娟,王丽娟,等。葡萄糖代谢驱动组蛋白乙酰化景观转变,决定肌肉干细胞的功能。细胞代表2019;27:39 - 3955.e6。
Ryall JG, Dell 'Orso S, Derfoul A, Juan A, Zare H, Feng X,等。NAD(+)依赖的SIRT1脱乙酰酶在骨骼肌干细胞中将代谢开关转化为调控表观遗传学。细胞干细胞。2015;16:171-83。
内藤M,森M,稻川M,宫田K,桥本N,田中S,等。Dnmt3a通过p57Kip2调控肌肉卫星细胞增殖。PLoS Genet, 2016;12:e1006167。
横山S,伊藤Y,上野久道H,清水H,内部K, Albini S,等。系统方法揭示了肌生成基因组网络是由转录抑制因子RP58调节的。开发细胞,2009;17:836-48。
Fuks F. Dnmt3a结合去乙酰酶,并被序列特异性抑制因子招募以沉默转录。中国科学,2001;
Fuso A, Ferraguti G, Grandoni F, Ruggeri R, Scarpa S, Strom R,等。肌生蛋白5 '侧区非cpg、富含cpc的元素的早期去甲基化:主动去甲基化扩散的启动效应?细胞周期。2010;9:3965-76。
帕拉西奥斯D, Summerbell D, Rigby PWJ, Boyes J. DNA甲基化和转录因子可用性之间的相互作用:小鼠肌生成蛋白基因发育激活的意义。中国生物医学工程学报。2010;30:3805-15。
Oikawa Y, Omori R, Nishii T, Ishida Y, Kawaichi M, Matsuda E.甲基- cpg结合蛋白CIBZ通过直接抑制肌原蛋白表达来抑制肌原分化。Cell Res. 2011; 21:1578-90。
李晓霞,李丽娟,李晓霞,李晓霞,等。细胞周期蛋白介导的肌肉基因表达抑制机制研究。细胞生物学杂志1996;16:7043-53。
张鹏,王超,刘东,Finegold M, Harper JW, Elledge SJ。p21(CIP1)和p57(KIP2)在肌原蛋白阶段控制肌肉分化。基因开发1999;13:213-24。
Berkes CA, Tapscott SJ。MyoD与肌生成的转录控制。中国生物医学工程学报,2005;16:585-95。
Bhanu NV, Sidoli S,袁志峰,Molden RC, Garcia BA。脯氨酸定向激酶和反式组蛋白编码H3K9me3/H4K20me3在人类肌生成过程中的调控。中国生物化学杂志,2019;
张志刚,张志刚,张志刚,等。肌源性分化过程中表观遗传景观的全基因组重塑。自然科学进展,2011;29(3):344 - 344。
Palacios D, Mozzetta C, Consalvi S, Caretti G, Saccone V, Proserpio V,等。卫星细胞Pax7位点TNF/p38α/polycomb信号通路将炎症与肌肉再生的表观遗传控制联系起来。细胞干细胞。2010;7:455-69。
Balciunaite E, Spektor A, Lents NH, Cam H, te Riele H, Scime A,等。口袋蛋白复合物被招募到静止和增殖细胞的不同目标。中国生物医学工程学报,2005;25:8166-78。
Dimova DK。果蝇E2F/RB通路对转录的细胞周期依赖和细胞周期独立控制。基因工程学报2003;17:2308-20。
Schwartz YB, Pirrotta V. Polycomb沉默机制和基因组计划管理。Nat Rev Genet. 2007; 8:9-22。
李国强,李国强,李国强,李国强,等。L3MBTL1,组蛋白甲基化依赖的染色质锁。细胞。2007;129:915-28。
彭小林,苏kk,何玲,赵颖,周娟,李勇,等。MyoD-和foxo3介导的热点相互作用在肌源性分化过程中协调超级增强子的活性。核酸决议2017;45:8785-805。
Verrier L, Escaffit F, Chailleux C, Trouche D, Vandromme M.骨骼肌分化需要一种新的组蛋白去甲基化酶JMJD2A/KDM4A亚型。编辑Cox GA。PLoS Genet, 2011;7:e1001390。
罗世伟,张超,张波,金春华,邱永忠,杜庆生,等。FAK与MBD2相互作用对肌肉分化过程中异染色质重塑和肌原蛋白表达的调控。杨晓明,2009;
达瓦格CS,大川Y,帕尔S,西夫S,因巴尔扎诺AN。精氨酸甲基转移酶Prmt5蛋白是肌肉生成所必需的,因为它促进atp依赖性染色质重塑。中国生物医学工程学报,2007;27:384-94。
Nishioka K. Set9,一种新的组蛋白H3甲基转移酶,通过排除异染色质形成所需的组蛋白尾部修饰来促进转录。基因工程学报2002;16:479-89。
王华,曹睿,夏玲,Erdjument-Bromage H, Borchers C, Tempst P,等。组蛋白h3 -赖氨酸4特异性甲基转移酶的纯化及功能鉴定。Mol Cell, 2001; 8:1207-17。
陶勇,Neppl RL,黄志平,陈杰,唐仁华,曹锐,等。组蛋白甲基转移酶Set7/9促进成肌细胞分化和肌原纤维组装。中国生物医学工程学报,2011;
Sambasivan R, Cheedipudi S, Pasupuleti N, Saleh A, Pavlath GK, Dhawan J.小染色质结合蛋白p8协调抗增殖蛋白和肌原蛋白在肌原蛋白启动子上的关联。中国生物医学工程学报(英文版);2009;
Cuadrado A, Corrado N, Perdiguero E, Lafarga V, Muñoz-Canoves P, Nebreda AR. p18Hamlet/ srcap介导的组蛋白H2A的重要作用。Z染色质掺入肌肉分化。中华医学会学报,2010;29(2):344 - 344。
de la Serna IL, Ohkawa Y, Berkes CA, Bergstrom DA, Dacwag CS, Tapscott SJ,等。MyoD在形成稳定的dna结合复合物之前,将染色质重塑复合物定位于肌原蛋白位点。中国生物医学工程学报,2005;
Forcales SV, Albini S, Giordani L, Malecova B, Cignolo L, Chernov A,等。信号依赖地将MyoD-BAF60c合并到基于brg1的SWI/SNF染色质重塑复合物中:BAF60c-MyoD标记染色质用于SWI/SNF募集。中华人民共和国学报。2012;31:31 - 16。
Blum R, Dynlacht BD. MyoD1和组蛋白修饰在肌肉增强子激活中的作用。表观遗传学。2013;8:778 - 84。
郑浩,姜建勇,金建勇,权德华,郑安,闵海奎,等。SRF是KDM2B和SET7在肌生成调控中的非组蛋白甲基化靶点。bioRxiv。2020;2020(04):17.046342冷泉港实验室。
Stojic L, Jasencakova Z, Prezioso C, Stützer A, Bodega B, Pasini D,等。染色质调控的多梳抑制复合体2 (PRC2)-Ezh2和PRC2- ezh1复合体之间的互换控制骨骼肌细胞肌原蛋白的激活。表观遗传学染色质。2011;4:16。
王春华,王春华,王志强,王志强,等。UTX去甲基酶活性是卫星细胞介导的肌肉再生所必需的。J clinin Invest, 2016; 126:1555-65。
刘庆昌,刘志刚,刘志刚,刘志刚,等。UTX在肌肉发生过程中介导肌肉特异性基因H3K27me3的去甲基化。中华医学会学报,2010;29(2):344 - 344。
Rampalli S, Li L, Mak E, Ge K, Brand M, Tapscott SJ,等。p38 MAPK信号通路调控含ash2l的甲基转移酶复合物在分化过程中向特定基因的招募。分子生物学学报。2007;14:1150-6。
Dacwag CS, Bedford MT, Sif S, Imbalzano AN。不同的蛋白精氨酸甲基转移酶在骨骼肌分化的不同阶段促进atp依赖的染色质重塑功能。细胞生物学杂志2009;29:1909-21。
张志刚,张志刚,张志刚,等。三胸蛋白Ash1L通过激活Cdon表达促进成肌细胞融合。Nat Commun. 2018;9:5026。
张志刚,张志刚,张志刚,张志刚,等。肌肉谱系中早期从头DNA甲基化和延长去甲基化。表观遗传学。2013;8:317-32。
史帝芬AA,洪gm m,贝恩LJ。亚砷酸钠延缓C2C12小鼠成肌细胞分化,改变转录因子肌原蛋白的甲基化模式。中国药理学杂志。2011;250:154-61。
刘艳,朱a, Chakroun I, Islam U, Blais A.成肌细胞分化过程中肌原性调控因子与6家族转录因子的协同作用。核酸研究,2010;38:6857-71。
Pfaffeneder T, Hackner B, true ß M, Münzel M, Müller M, Deiml CA,等。胚胎干细胞DNA中5-甲酰胞嘧啶的发现。Angew Chem Int Ed. 2011; 50:7008-12。
陈志强,陈志强,陈志强,陈志强,等。MLL Partner TET1将哺乳动物DNA中的5-甲基胞嘧啶转化为5-羟甲基胞嘧啶。科学。2009;324:930-5。
钟欣,王琼琼,李建文,张玉梅,安兴荣,侯娟。Ten-eleven易位-2 (Tet2)参与体外骨骼肌成肌细胞的成肌分化。科学代表2017;7:43539。
晁志,郑晓林,孙仁平,刘海林,黄丽玲,曹志祥,等。细胞肌源性分化中Pax7和肌源性调节因子甲基化状态的研究。中国动物科学(英文版),2016;
畑泽Y,小野Y,广濑Y,金井S,藤井NL,町田S,等。减少Dnmt3a会增加Gdf5的表达,抑制卫星细胞分化和骨骼肌再生。FASEB J Off Publ Fed Am Soc Exp biology, 2018; 32:1452-67。
Smallwood A, Esteve P-O, Pradhan S, Carey M. HP1和DNMT1之间的功能合作介导基因沉默。基因开发,2007;21:1169-78。
阿加瓦尔,哈特T,布雷罗A,诺瓦克D,罗斯鲍尔U,贝克尔A,等。在肌源性分化过程中,MeCP2与HP1相互作用并调节其异染色质关联。核酸研究,2007;35:5402-8。
Tidball詹。肌肉损伤和修复中的炎症过程。中华医学会物理学报。2005;38(2):344 - 344。
波特JD。慢性炎症反应在营养不良蛋白缺失mdx小鼠的骨骼肌分子特征中占主导地位。Hum Mol Genet, 2002; 11:263-72。
张志刚,张志刚,张志刚,张志刚,等。TNF通过Ezh2和DNA甲基化介导的抑制骨骼肌细胞中的Notch-1:在杜氏肌营养不良中的意义Bryk M,编辑。PLoS ONE。2010; 5: e12479。
杜氏肌营养不良模型肌肉损伤的表观遗传调控因子。PLoS Curr, 2017。可以从:http://currents.plos.org/md/article/epigenetic-regulators-modulate-muscle-damage-in-duchenne-muscular-dystrophy-model/.
Colussi C, Gurtner A, Rosati J, Illi B, Ragone G, Piaggio G,等。一氧化氮缺乏决定杜氏肌营养不良的整体染色质变化。王志强,2009;23:2131-41。
李志强,李志强,李志强,等。过表达BMI1的人成肌细胞能量状态增强和氧化应激保护。干细胞代表2017;9:528-42。
Bianchi A, Mozzetta C, Pegoli G, Lucini F, Valsoni S, Rosti V,等。功能失调的多梳转录抑制有助于层蛋白A/ c依赖性肌营养不良。J clinin Invest, 2020; 130:2408-21。
张丽娟,赵玲,张丽娟,张丽娟,张丽娟,等。全基因组甲基化谱揭示了人类衰老速度的定量观点。化学学报。2013;49:359-67。
Zykovich A, Hubbard A, Flynn JM, Tarnopolsky M, Fraga MF, Kerksick C,等。在无疾病的人类骨骼肌中,全基因组DNA甲基化随年龄而变化。《衰老细胞》2014;13:360-6。
老化卫星细胞命运的改变是由信号和表观遗传变化决定的。5 . Front Genet. 2015;可以从:http://journal.frontiersin.org/Article/10.3389/fgene.2015.00059/abstract.
凌晨,Poulsen P, Simonsson S, Rönn T, Holmkvist J, Almgren P,等。遗传和表观遗传因素与呼吸链成分NDUFB6在人骨骼肌中的表达有关。中华临床医学杂志。2007;117:3427-35。
Rönn T, Poulsen P, Hansson O, Holmkvist J, Almgren P, Nilsson P,等。年龄影响人类骨骼肌中COX7A1的DNA甲基化和基因表达。Diabetologia。2008;51:1159 - 68。
Hernando-Herraez I, Evano B, Stubbs T, Commere P-H, Jan Bonder M, Clark S,等。衰老影响小鼠肌肉干细胞中DNA甲基化漂移和转录细胞间变异。Nat Commun. 2019;10:4361。
Conboy IM, Conboy MJ, Wagers AJ, Girma ER, Weissman IL, Rando TA。通过暴露于年轻的系统环境使年老的祖细胞恢复活力。大自然。2005;433:760-4。
陈建平,李建平,李建平,等。成纤维细胞转化成肌细胞的cDNA表达。细胞。1987;51:987 - 1000。
Taylor SM, Jones PA。5-氮胞苷诱导10个T1/2和3个T3细胞产生多种新的表型。细胞。1979;17:771-9。
高桥,山中。多能干细胞的诱导从小鼠胚胎和成人成纤维细胞培养的定义因素。细胞。2006;126:663 - 76。
高桥K,田边K,大树M,成田M,一坂T,友田K,等。确定因子诱导成人成纤维细胞多能干细胞。细胞。2007;131:861 - 72。
于杰,Vodyanik MA, Smuga-Otto K, Antosiewicz-Bourget J, Frane JL, Tian S,等。人体细胞诱导多能干细胞系。科学。2007;318:1917-20。
平野K,永田S,山口S,中川M,冲田K, Kotera H,等。人类和小鼠诱导的多能干细胞对激酶抑制剂的反应进行了差异重编程。干细胞发展2012;21:1287-98。
应Q-L, Wray J, Nichols J, battle - morera L, Doble B, Woodgett J,等。胚胎干细胞自我更新的基态。大自然。2008;453:519-23。
斯特恩斯-里德KM, D 'Amore A, Beezhold K, Rothrauff B, Cavalli L, Wagner WR,等。骨骼肌细胞外基质的老化驱动干细胞成纤维转化。衰老细胞。2017;16:518-28。
Biressi S, Miyabara EH, Gopinath SD, Carlig PM, Rando TA。Wnt-TGF 2轴诱导营养不良小鼠肌肉干细胞的纤维化程序。科学翻译,2014;6:267ra176。
裴晓燕,杨晓燕,Jardí M纤维细胞的可塑性使组织再生变钝,并加重肌肉营养不良。干细胞代表2015;4:1046-60。
郭佳杰,郭志强,陈志强,等。衰老过程中Wnt信号的增加改变了肌肉干细胞的命运,增加了纤维化。科学。2007;317:807-10。
确认
JM是MITACS全球链接奖学金的获得者。
资金
迪尔沃斯实验室的工作得到了加拿大健康研究所的支持。
作者信息
作者及隶属关系
贡献
JM、EG、BC和FJD构思、讨论并撰写了手稿。作者们阅读并批准了最终的手稿。
相应的作者
道德声明
伦理批准并同意参与
不适用。
发表同意书
所有作者都同意发表这篇文章。
相互竞争的利益
作者宣称他们之间没有利益冲突。
额外的信息
出版商的注意
伟德体育在线施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条所提供的资料,除非在资料的信用额度中另有说明。
关于本文
引用本文
马斯内,J.,加德纳,E.,查佐,B.。et al。骨骼肌再生过程中卫星细胞命运的表观遗传调控。骨骼肌11, 4(2021)。https://doi.org/10.1186/s13395-020-00259-w
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s13395-020-00259-w
关键字
- 肌肉干细胞
- 再生
- 表观遗传学
- 细胞的命运
- 杜氏肌营养不良症