摘要
背景
雌激素信号在肌肉再生中是必不可少的,然而雌激素在肌肉炎症发展中的作用,特别是在肌内T细胞反应中,以及对肌纤维固有免疫行为的影响仍在很大程度上尚不清楚。我们使用心脏毒素(CTX)诱导的心肌损伤小鼠模型来研究这个问题,有或没有雌激素水平的调整。
方法
采用CTX注射法(胫骨前肌,TA)制备小鼠肌损伤模型。17β-雌二醇注射液(E2)或雌激素受体拮抗剂4-OHT或卵巢切除术(OVX)用于改变动物模型体内雌激素水平。血清E2酶联免疫吸附法检测。采用qPCR检测炎症肌肉中雌激素受体(er)和细胞因子/趋化因子的基因水平。免疫荧光观察炎症浸润。采用流式细胞仪分析巨噬细胞和T细胞表型。免疫印迹法检测C细胞中ERs和免疫分子的蛋白水平2C12肌管用E2或4-OHT,在IFN-γ的存在下。
结果
监测血清E含量的增加2肌损伤后再生肌纤维ERβ水平及上调。体内雌激素的缺乏导致更严重的肌肉炎症浸润,包括单核/巨噬细胞和CD4的募集+T细胞和增强的促炎(M1)巨噬细胞。此外,雌激素信号通路的缺失导致炎症肌肉中Treg细胞浸润减少,Th1反应升高,IFN-γ-刺激的C中免疫分子表达明显上调2C12体外肌管。
结论
我们的数据表明,雌激素是肌肉炎症反应的积极干预因素,通过其控制肌内浸润和单核/巨噬细胞表型,影响Treg细胞的积累和功能,抑制炎症肌肉中的Th1反应。我们的研究结果还表明雌激素对肌肉细胞的固有免疫行为有抑制作用。
背景
雌激素在调节免疫反应中发挥重要作用,通过与免疫细胞上的受体相互作用,影响免疫细胞的产生、成熟、分化,并最终发挥功能[1,2,3.].一般来说,雌激素会刺激浆细胞产生免疫球蛋白[4],直接上调CD22、SHP-1、Bcl-2等B细胞存活介质的表达,并损害PD-1等B细胞凋亡介质的表达[5,6,7,8].另一方面,雌激素通过增加调节性T细胞(treg)的频率和数量,对先天免疫系统产生抑制作用[9],控制T细胞中某些趋化因子受体的表达[10],抑制单核细胞和中性粒细胞分泌促炎细胞因子以响应激活刺激[11,12,13],或损害NK细胞的细胞毒性[14].综上所述,这些发现表明雌激素信号在建立免疫和耐受性的平衡中很重要。
一项重要而持久的发现是,男性和女性在创伤性损伤后的反应不同,女性得到了相对的保护[15,16].据报道,急性创伤后雌激素水平早期升高[17,18,19].我们之前的工作证明,血清雌二醇(E2)的水平与创伤和颅脑损伤的严重程度相关,可能可作为评估创伤严重程度和预后的指标[20.].来自动物模型的证据还表明,雌激素可能通过直接改变局部炎症和免疫反应,在损伤愈合中发挥重要作用。例如,据报道,雌激素可以(i)减少伤口中性粒细胞的数量,并减少炎症部位中性粒细胞的定位[21],以及(ii)增强免疫细胞中的雌激素受体活性,并抑制外周树突状细胞和巨噬细胞中的先天免疫信号通路[22,23,24].但无论如何,雌激素环境对损伤后损伤外周组织免疫反应轨迹的影响仍不完全。
急性创伤常涉及骨骼肌损伤,引起严重的肌肉炎症、肿胀和肌纤维变性[25,26].理想的肌肉再生与修复有利于创伤患者运动功能的恢复和生活质量的提高。骨骼肌是雌激素的靶组织,同时表达ERα和ERβ [27,28],在小鼠中ERβ是主要的亚型[28].E2提示促进表达功能性雌激素受体的骨骼肌成肌细胞的增殖和分化[29].雌激素信号在肌肉再生过程中是不可缺少的,因为这种激素介导蛋白质合成和卫星细胞激活,并调节骨骼肌的代谢稳态和胰岛素敏感性[30.,31].然而,急性肌肉损伤后体内雌激素的改变是否与肌肉炎症过程直接相关,特别是与肌内T细胞反应有关,甚至与肌纤维的内在免疫行为有关,目前尚不清楚。
本研究探讨了雌激素信号通路在心脏毒素(CTX)诱导小鼠急性肌肉炎症反应中的作用。监测血清E含量的增加2损伤小鼠胫骨前肌再生肌纤维ERβ水平上调。通过体内注射重组17β-雌二醇、雌激素受体拮抗剂4-OHT,或使用卵巢切除术(OVX)雌性小鼠模型,我们人为地提高或阻断血清E2体内水平。我们发现雌激素信号通路有助于控制单核/巨噬细胞的肌内浸润,以及促炎M1向抗炎M2巨噬细胞的转变。此外,我们发现雌激素信号通路影响Treg细胞的积累和功能,抑制受损肌肉的Th1反应,并调节肌肉细胞的固有免疫能力。综上所述,我们的数据表明雌激素信号在抑制急性损伤引发的肌肉炎症和免疫反应中具有重要作用。
方法
鼠标菌株
C57BL/6 (B6)小鼠来源于南方医科大学动物实验中心。小鼠被安置在特定的无病原体屏障设施中,并在8至16周龄之间进行分析。动物实验由当地机构动物实验伦理委员会批准。
动物实验
为了制备CTX致肌损伤,将30 μl CTX (30 μg/ml, Sigma-Aldrich, USA)注入小鼠TA肌。为了干扰体内雌激素水平,我们使用了重组β-雌二醇(E2, E2758, Sigma-Aldrich, USA),或雌激素受体拮抗剂,4-羟他莫西芬(4-OHT, T176, Sigma-Aldrich, USA)。注射CTX后1天,动物注射E2(50 μl/小鼠/天,50 μg/ml)或4-OHT (50 μl/小鼠/天,2 mg/ml)每日皮下注射(s.c.d) [32,33].在制备卵巢切除术(OVX)小鼠时,雌性小鼠(8w)腹腔注射氯胺酮(90 mg/kg)和xylazine (4.5 mg/kg)麻醉。在两侧的两到三个乳头之间做一个腹侧切口,然后慢慢切除卵巢。缝合伤口后,注射22,000 IU/kg青霉素。假手术组接受了同样的手术,但没有切除卵巢。等离子体电子2采用酶联免疫吸附试验(ELISA)检测各组小鼠血清中抗氧化活性。卵巢切除术后第14天,OVX小鼠TA肌内注射CTX。在肌损伤后第0、1、3、7、10、15、20天处死小鼠。收集TA肌肉标本并快速冷冻用于基因和蛋白质分析,或均质用于细胞分选。对于组织学,肌肉样本直接冷冻在液氮冷却的异戊烷中。为了评估巨噬细胞的吞噬能力,雌性OVX小鼠或未处理的对照组小鼠在CTX注射1天后,在TA肌肉中注射50 μl Lumispheres (Lum, 1:200, 5 mg/ml, BeiSiLe, China)。第3天处死小鼠,流式细胞术分析。
RNA制备和qRT-PCR
颈椎脱位后,迅速剥离双侧TA肌,立即浸入RNAlater (RNeasy Protect Mini Kit, Qiagen)中保护RNA不被降解。将肌肉称重,在4°C下孵育过夜,然后转移到TRIzol中,在−80°C下深度冷冻,然后进行进一步分析。
从肌肉组织或C2C12肌管使用市售试剂盒(RevertAid First Strand cDNA Synthesis kit, Fermentas)进行逆转录(RT)。实时聚合酶链式反应(PCR)采用ABI StepOne Plus系统(Applied Biosystems, USA)和荧光标记SYBR Green/ROX qPCRMaster Mix试剂盒(Fermentas)进行,检测IL-1、IL-6、IL-10、TGF-β、MCP-1、MIP-1α、SLPI、TNF-α、TGF-β2、PPARγ、IL-1β、IFN-γ、IL-4、IL-17、T-bet、IRF4、STAT3、ERα和ERβ,并以甘油醛-3-磷酸脱氢酶(GAPDH)为内源性对照(引物序列和扩增子大小见表)1).用SOS2.1软件(Applied Biosystems)对结果进行分析。根据精确的阈值周期(Ct)计算基因的表达。将GAPDH的Ct值与IL-1、IL-6、IL-10、TGF-β、MCP-1、MIP-1α、SLPI、TNF-α、TGF-β2、PPARγ、IL-1β、IFN-γ、IL-4、IL-17、T-bet、IRF4、STAT3、ERα、ERβ和每孔的Ct值进行比较,计算ΔCt。处理条件的数据相对于通过ΔΔCt计算获得的未处理对照的平均值的信号表示。对每个样本的三个ΔΔCt值取平均值。
组织学和免疫荧光检测
将冰冻后的TA肌肉横切,厚度为8 μm,用苏木精和伊红染色或制备免疫染色。用于免疫荧光,肌肉用冷丙酮固定,并与大鼠抗小鼠单克隆抗体CD11b (1:200, eBioscience,美国加州)、F4/80 (1:200, eBioscience,美国加州)、CD4 (1:200, BD或eBioscience,美国)或兔抗er α多克隆抗体(1:400,Abcam,美国)孵育;小鼠单克隆抗er β (1:200, Abcam,美国),兔抗小鼠CD3ɛ(1:200,Abcam,英国剑桥),兔多克隆抗肌营养蛋白(1:400,加州圣克鲁斯,美国),Alexa Fluor 488共轭山羊抗大鼠IgG(1:400,加州圣克鲁斯,美国),Alexa Fluor 488共轭山羊抗兔IgG(1:40,加州圣克鲁斯,美国),cy3 -共轭山羊抗兔IgG(1:40,加州圣克鲁斯,美国),cy3 -共轭山羊抗大鼠IgG(1:40,加州圣克鲁斯,美国),使用Alexa Fluor 555偶联驴抗小鼠IgG (1:500, Beyotime,中国)、Alexa Fluor 555偶联驴抗兔IgG (1:500, Beyotime,中国)、fitc偶联山羊抗小鼠IgG (1:40, eBioscience,美国)或fitc偶联山羊抗兔IgG (1:40, Santa Cruz,美国)作为二抗。核用DAPI反染色。用Olympus BX51荧光显微镜(Olympus, Japan)观察载玻片。强度分析采用Image-Pro Plus软件量化染色强度。分别测定所有阳性染色的集成光密度(IOD)和感兴趣面积(AOI)。然后计算平均密度(IOD/AOI)。
细胞分选和流式细胞仪分析
收集损伤的TA肌,切碎,用0.2% IIcollagenase在37°C下轻轻消化45 min,两次。从肌肉匀浆中分离的全部细胞重新悬浮在荧光激活的细胞分选缓冲液(磷酸盐缓冲液,0.5%牛血清白蛋白,2 mM EDTA)中,以获得单细胞悬液。与anti-CD16 / Fc受体阻断后CD32(美国Biolegend),细胞被孵化与anti-CD45-Pacific蓝色,anti-F4/80-PE, anti-Ly-6C-FITC, anti-CD11b-PE, anti-CD3εapc, anti-CD4-FITC, anti-IFN -γpe, anti-IL-4-APC, anti-IL-17α-PE-Cy7, anti-CD25-PE, anti-Foxp3-APC(美国ThermoFisher 1:10 0), anti-T-bet-BV421(美国BD生物科学1:10 0),anti-CTLA-4-APC (1:10 0, eBioscience,加州,美国),anti-MHC-II-eFluor 450 (1:10 0, eBioscience,加州,美国),和anti-CX3CR1-APC (1:10 0, bios,中国)。使用FACSAria II细胞分选仪(BD Biosciences, USA)和FlowJo软件分析标记细胞。在ctx -肌损伤后第3天和第6天处死小鼠进行细胞分选。采集肌肉标本,切碎,第3天用抗cd45 - pacific Blue和抗f4 /80- pe孵育,第6天用抗cd3 ε- apc和抗cd4 - fitc孵育。CD45+F4/80+细胞或CD3ε+CD4+用MoFlo XDP对细胞进行分类,进行进一步的RNA制备和qRT-PCR分析。
C2C12细胞培养、促炎刺激、E2或4-OHT
C2C12细胞(ATCC, USA)在Dulbecco改良的Eagle培养基营养液F-12 (DMEM/F12, Hyclone)中培养,含有10%胎牛血清(FBS, Gbico)、100单位/ml青霉素和100 μg/ml硫酸链霉素,浓度为5% CO2- 37°C的加湿室(Heraeus, Germany)。对于分化研究,C2C12细胞在加入2%马血清(Gibco, USA)的DMEM中培养72小时。对于促炎刺激,细胞用IFN-γ (0.6 μg/ml, R&D, USA)处理。对于体外雌激素干扰分析,E2(1.0 nM)或4-OHT (0.1 μM) [34]分别添加到添加IFN-γ的相应培养基中。IFN-γ培养48 h后对细胞进行分析。
Western blot分析
细胞或组织蛋白提取按照制造商的方案进行(KeyGEN,中国)。使用BCA检测试剂盒(KeyGEN,中国)评估蛋白质浓度。等量的蛋白质在6-12% sds -聚丙烯酰胺凝胶上电泳,并转移到Immobilon P膜(Millipore, USA)。在5%脱脂牛奶中,用Tris缓冲的生理盐水/Tween-20 (TBS-T: 20 mM Tris, pH 7.5, 150 mM NaCl, 0.05% Tween-20)将细胞膜阻断1小时。使用以下抗体进行检测:小鼠单克隆抗tlr3 (1:1000, NOVUS,美国);兔多克隆抗h - 2kb(1:1000, Abcam,剑桥,英国);小鼠抗h2 - ea单克隆抗体(1:400,Santa Cruz, USA);兔多克隆抗er α (1:1000, Abcam,美国);小鼠er β单克隆抗体(1:1000,Abcam, USA);或小鼠单克隆抗gapdh(1:400,中国康辰)。一抗在TBS-T中,4°C, 5%脱脂奶粉中孵育12 h。膜在TBS-T中洗涤三次,并与山根过氧化物酶偶联的山羊抗兔IgG (1:5000, Fudebio,中国)或山羊抗小鼠IgG (1:2000, CST,美国)在RT中孵育1小时,在5%脱脂奶粉中孵育。在TBS-T中洗涤三次后,用增强化学发光(ECL)检测试剂(Applygen technology Inc., China)显示蛋白带。用ECL检测系统(Protein Simple, USA)检测免疫反应条带,用ImageJ v1.42软件(National Institutes of Health, USA)分析密度值。通过与GAPDH比较计算各免疫反应条带的相对表达量。
ELISA分析
在乙二胺四乙酸存在下,采用球后静脉穿刺法采集小鼠血液。样品在冰上冷冻,然后在48°C下离心20分钟分离血浆。根据制造商的程序(ER EIA试剂盒,R&D,美国),采集样品用于ELISA检测总雌二醇浓度。首先,用雌二醇一抗孵育。然后分别取100 μl标准品、对照品或样品分别加入板上相应孔中。在所有孔中加入50 μl雌二醇共轭物,用胶条覆盖,在室温下摇床上孵育2 h。之后,每个孔均加入200 μl底物溶液,避光在室温下放置30min左右。最后在每孔中加入100 μl停止液。每口井的光密度在30分钟内确定,使用设置为450 nm的微孔板读取器。信号量与测定缓冲液中雌二醇的标准水平成正比。
统计分析
所有数据均以均数±标准差(SD)表示。采用单因素方差分析(One-way ANOVA),采用SPSS server .13.0软件进行多重比较(Duncan’s多量程检验)。P值< 0.05为有统计学意义。
结果
急性肌损伤可引起损伤肌肉和再生肌纤维中血清雌激素水平和雌激素受体Erβ表达的升高
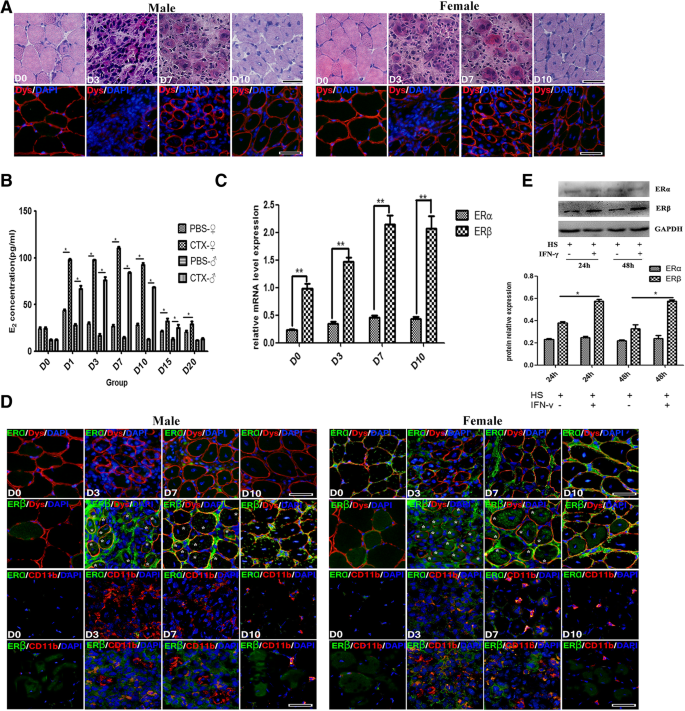
通过H&E和Dystrophin荧光染色,我们观察到CTX注射于B6小鼠胫骨前肌(TA)后3 d引起肌纤维坏死和退变。损伤逐渐被更小的再生肌纤维所取代,中心有核的肌纤维在第7天和第10天变得突出。1a).第3天和第7天均检测到明显的单个核细胞浸润(图。1一个)。
ctx损伤肌肉中血清雌激素水平及雌激素受体表达的变化。一个雄性和雌性小鼠炎症TA肌的组织学特征。上图为标准H&E染色,下图为Dystrophin免疫荧光染色(红色)。bElisa试验显示血清E2的水平。cqRT-PCR检测受损TA肌中雌激素受体(er)基因mRNA水平。d损伤TA肌中ERα/ERβ与Dystrophin或ERα/ERβ与CD11b的代表性免疫荧光双染色结果ERβ在肌纤维中的聚集以星号(*)表示。eWestern blot显示马血清分化C细胞ERα和ERβ蛋白水平2C12有或没有IFN-γ处理的细胞。将western blots实验的相对带强归一化到GAPDH水平,并用ImageJ软件进行分析。所有数据均以均数±标准差(n= 3)。多重比较采用单因素方差分析。(*p< 0.05和**p< 0.01)。海关马血清。Bar = 100 μm
研究表明,血清雌二醇(E2)成年男性和女性患者创伤早期雌激素水平升高,提示雌激素可能在创伤患者重要器官的保护中发挥重要作用[17,18,19].ELISA法检测血清E2在损伤后第1、3、7和10天,雄性和雌性小鼠的钙含量显著升高(E2在第7天出现峰值),但在第15天和第20天与健康小鼠相比迅速下降(图。1B),这反映了急性损伤诱导的肌肉炎症过程中雌激素信号的早期演变。为了进一步证实这一点,我们采用qRT-PCR方法分析损伤TA肌肉中雌激素受体(er)基因的表达,结果表明,损伤后雌激素受体ERα的mRNA表达水平始终较低,而ERβ基因在对照组和3d损伤肌肉中表达水平较低,但逐渐升高,并在第7和第10天达到峰值(图2)。1c),表明er β相关的雌激素信号通路在肌肉损伤时被招募。
接下来,我们通过免疫荧光分析研究了ERα和ERβ在损伤肌肉中的表达,并观察到ERα和ERβ在健康小鼠成熟肌纤维中低表达(图2)。1d).然而,CTX处理在浸润的单个核细胞(CD11b)中诱导ERβ蛋白表达增加,而ERα蛋白表达不增加+)和再生中心核肌纤维(Dystrophin+),与健康的TA肌相比(图。1d).为了明确确定肌肉细胞在炎症环境中是否上调雌激素信号,我们培养了C2C12IFN-γ-诱导成肌细胞构建促炎环境,并证明IFN-γ-诱导ERβ蛋白水平升高C2C12肌管(2%马血清给药)1e)。
体内雌激素信号通路干扰肌肉损伤后促炎巨噬细胞的招募和功能
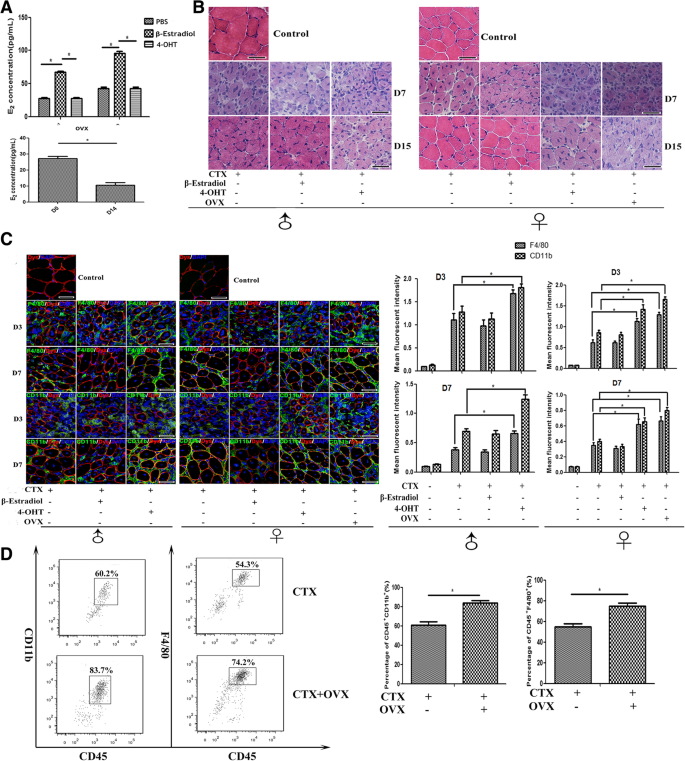
先前的研究表明雌激素信号控制着免疫和炎症反应的关键过程[2,4,12,14].为了研究雌激素在体内对肌肉炎症的影响,我们接下来人为地提高或降低E2通过分别注射重组β-雌二醇或其拮抗剂4-OHT在CTX治疗后,在体内的水平。此外,对雌性小鼠进行卵巢切除术(OVX),以获得恒定血清E2肌肉损伤前体内水平下降.不出所料,通过ELISA试验,我们证实β-雌二醇诱导血清E2雄性和雌性小鼠的浓度分别增加(图;2a).如Wang Y等报道。[35,我们发现血清E2ovx后第14天,雌性小鼠血清中卵泡蛋白水平明显下降(图;2a).我们没有发现β-雌二醇给药小鼠与单独使用CTX的对照组小鼠之间的肌肉炎症反应有显著差异(图2)。2b);相反,我们的数据表明,在缺乏雌激素信号的情况下,肌肉炎症加剧。组织学分析显示,注射4-OHT延迟了肌肉修复:在第15天,中心有核肌纤维仍然突出,此时肌肉结构尚未完全修复。事实上,4-OHT治疗在TA肌肉中引发了更持久和更严重的炎症反应,并且在损伤后第15天仍然观察到炎症细胞(图。2b).与4-OHT治疗的雌性小鼠相似,接受OVX治疗的雌性小鼠受损肌肉也观察到肌肉修复延迟和炎症加重(图。2b)。
由于肌肉损伤和愈合涉及炎症细胞的募集,而急性肌肉损伤的炎症反应是一种先天免疫反应[36,37],我们接下来研究了雌激素信号通路是否干扰CTX注射后单核/巨噬细胞的肌内浸润。我们通过免疫染色来评估CD11b的浸润+和F4/80+B6小鼠ctx损伤肌肉中β-雌二醇和4-OHT处理的细胞,或损伤后第3天和第7天的OVX小鼠。用荧光染色强度分析评价浸润程度。尽管β-雌二醇处理小鼠和对照组小鼠损伤肌肉中的炎症细胞数量和荧光强度相似,但我们观察到CD11b显著增加+和F4/80+4-OHT给药小鼠和OVX小鼠炎症肌肉中的细胞(图2)。2c).根据免疫染色结果,使用FACS分析,我们还监测了CD11b的增加+和F4/80+与对照小鼠相比,去卵巢雌性小鼠受损肌肉中的细胞数量增加。2d)。
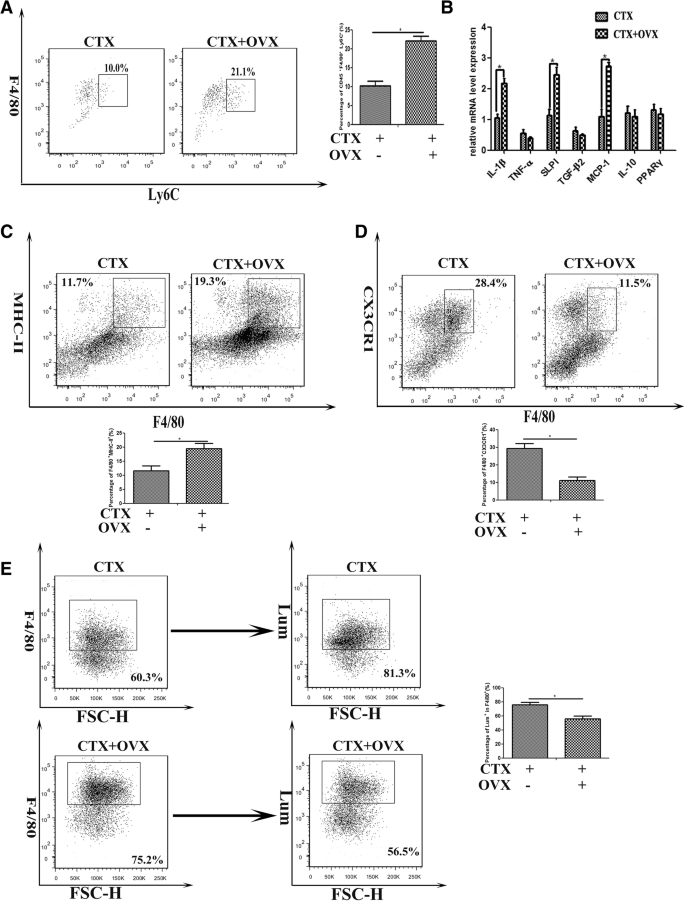
为了进一步确定雌激素信号通路对浸润型巨噬细胞CD45的影响+从接受或未接受卵巢切除术的雌性小鼠的3d损伤TA肌中分离细胞,用FITC或pe偶联抗体标记Ly-6C或F4/80,并用FACS分析。毫不奇怪,我们的结果显示F4/80的比例更高+Ly-6C+去卵巢小鼠受损肌肉中的细胞数量明显高于未治疗小鼠(图2)。3.a).当我们转向雌激素信号通路对巨噬细胞功能的影响时,我们发现在缺乏雌激素信号通路的情况下,分离的CD45中经典m1型因子的基因水平下降+F4/80+包括IL-1β, SLPI和MCP-1,但不包括m2型因子(TNF-α, TGF-β2, IL-10, PPARγ),显著升高(图。3.b).从MHC-II开始+巨噬细胞主要是炎症肌肉中的促炎细胞,在肌肉损伤后再生早期数量达到高峰[38],我们接下来监测MHC-II在分离细胞中的表达。如图所示。3.c, F4/80的比例越高+mhc ii+细胞由CD45启动+从去卵巢小鼠的炎症肌肉中分离出的细胞比未治疗小鼠的细胞多。F4/80也是如此+我们观察到CX3CR1的表达低于未处理的小鼠(图2)。3.d).这些数据表明雌激素信号通路有助于肌损伤诱导的炎症浸润,并可能有利于受损肌肉中浸润的巨噬细胞从促炎M1表型向抗炎M2表型的转变。
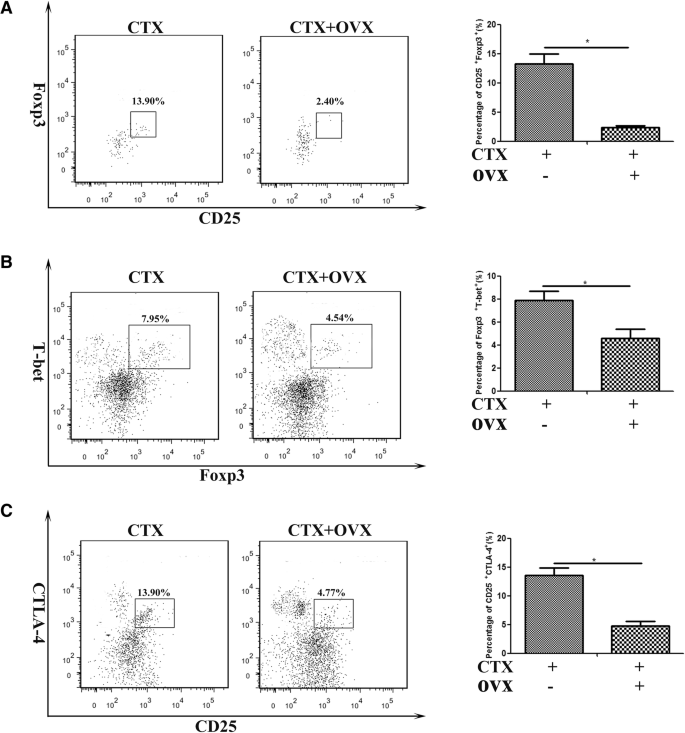
雌激素信号通路对炎症肌肉浸润巨噬细胞表型和功能的影响。一个Ly-6C比例的FACS分析+F4/80+在OVX或完整小鼠中,损伤后第3天从TA肌肉中分离出cd45门控细胞。b采用qRT-PCR检测CD45细胞中IL-1β、SLPI、MCP-1、TNF-α、TGF-β2、IL-10和PPARγ mRNA水平+F4/80+OVX或完整雌性小鼠损伤后第3天从炎症肌肉中分离的细胞。cCD45比例的FACS分析+F4/80+mhc ii+从OVX或完整雌性小鼠炎症肌肉中分离出的细胞。dCD45比例的FACS分析+F4/80+CX3CR1+从OVX或完整雌性小鼠炎症肌肉中分离出的细胞。eCD45对注射的Lumispheres摄取的流式细胞仪分析+F4/80+从OVX或完整雌性小鼠炎症肌肉中分离出的细胞。数据代表两个独立的实验,每组3只老鼠。多重比较采用单因素方差分析(*p< 0.05)
既往研究表明创伤后巨噬细胞的吞噬能力下降,而雌激素可提高巨噬细胞的吞噬能力[39].接下来,我们讨论了雌激素信号是否需要炎症肌肉中浸润的巨噬细胞的吞噬功能。为此,对OVX小鼠或未处理的对照组小鼠进行CTX肌损伤,然后在肌损伤1d后向炎症的TA肌注射绿色荧光Lum。我们发现注射的Lum通过肌注F4/80摄取+OVX小鼠的细胞含量比对照组低50%(图2)。3.e).该数据表明雌激素信号通路可能在损伤/再生骨骼肌中巨噬细胞吞噬和清除死亡细胞中起作用。
雌激素信号通路对损伤肌肉中CD4 T细胞积累和功能的影响
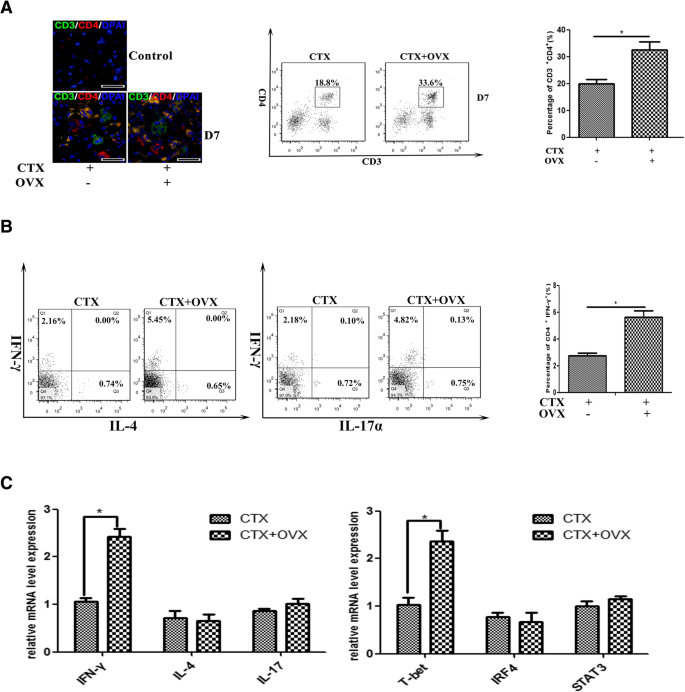
肌肉抗原已被证明可诱导T淋巴细胞在肌损伤后向肌内膜或肌周迁移[40,41].为了探究雌激素信号是否参与肌内T细胞浸润,我们进行了双重免疫染色来评估CD8的存在+T细胞(CD3ε+CD8α+)和CD4+T细胞(CD3ε+CD4+)在去卵巢雌性小鼠ctx损伤肌肉中的表达。意想不到的是,我们没有发现CD8有显著的数字差异+OVX和对照小鼠损伤肌肉中的T细胞(数据未显示)。相反,在卵巢切除术后,CD4比例增加+在受损肌肉中发现T细胞(图。4a).进一步确定雌激素信号通路是否影响肌内CD4+T细胞表型,我们检测了肌肉浸润CD4细胞中T辅助细胞-1 (Th1)、T辅助细胞-2 (Th2)和T辅助细胞-17 (Th17)的频率+通过流式细胞仪分析IFN-γ、IL-4和IL-17在T细胞中的表达。我们的结果表明,IFN-γ的频率+CD4+与对照组相比,去卵巢小鼠炎症肌肉中的细胞明显增加(图2)。4b),提示雌激素信号通路是抑制受损肌肉中Th1反应所必需的。为了明确证实这一点,我们分离出CD3+CD4+通过qRT-PCR检测细胞因子IFN-γ、IL-4和IL-17的基因水平,以及th1特异转录因子T-bet、Th2因子IRF4和Th17因子STAT3的水平。与FACS结果一致,CD4细胞中IFN-γ和T-bet mRNA表达增加+从OVX小鼠炎症肌肉中分离的T细胞,与对照组小鼠相比(图2)。4c)。
雌激素信号通路影响CD4细胞的积累和功能+受损肌肉中的细胞。一个CD4的免疫荧光双染色(左)和流式细胞仪分析(右)+发炎肌肉中的T细胞。bTh1(IFN-γ)频率的FACS分析+), Th2 (il - 4+)和Th17(IL-17)+) CD4细胞+从7d损伤TA肌中分离的细胞,在OVX或完整的雌性小鼠中。cCD3中细胞因子IFN-γ、IL-4、IL-17和转录因子T-bet、IRF4、STAT3的mRNA水平+CD4+从OVX或完整雌性小鼠的6d损伤TA肌中分离T细胞,用qRT-PCR定量。数据代表两个独立的实验,每组3只老鼠。多重比较采用单因素方差分析(*p< 0.05)。Bar = 50 μm
急性肌损伤引起一种特殊CD4细胞群的局部聚集+Foxp3+调节性T细胞(Tregs),它发挥免疫抑制作用,并促进肌肉修复[42,43].一些研究结果揭示了foxp3依赖的E2外周血T细胞耐受性的控制[44].为了确定雌激素信号是否影响Tregs的浸润和功能,我们在肌损伤后第6天,从接受或未接受卵巢切除术的雌性小鼠中研究了ctx损伤的TA肌中Tregs的积累。有趣的是,尽管CD4增加了+去卵巢小鼠损伤肌肉中的T细胞数量(图2)。4a),我们监测到CD4的百分比显著下降+CD25+Foxp3+炎症肌肉中的T细胞(图。5a).鉴于已有报道Tregs在骨骼肌修复中的作用[42,43],我们认为在给予4-OHT或去卵巢小鼠中,肌纤维再生延迟可能部分原因是雌激素信号的丧失抑制了受损肌肉中treg的积累。
先前的研究表明T-bet促进Treg细胞趋化因子受体CXCR3的表达,T-bet促进Treg细胞趋化因子受体CXCR3的表达+Treg细胞聚集在th1介导的炎症部位[45].由于我们监测了去卵巢小鼠受损肌肉中Th1反应的升高,我们接下来研究了肌肉浸润的Treg细胞中T-bet的表达。我们发现在没有雌激素信号的情况下,T-bet+Foxp3−炎症肌肉细胞显著增加,但T-bet+Foxp3+细胞明显减少(图;5b).为了评估雌激素信号通路对Treg细胞功能的影响,我们检测了Treg抑制功能所必需的CTLA-4的表达[46],在CD4上+CD25+细胞来自发炎的肌肉。毫不奇怪,我们观察到CD25的频率显著降低+CTLA-4+OVX小鼠炎症肌肉中的细胞,与对照组小鼠相比(图2)。5c).因此,我们的数据概述了在急性损伤后,上调的雌激素信号通路促使Treg细胞在受损肌肉中聚集,这有利于抑制Th1反应,促进肌肉再生。
雌激素信号通路对肌肉细胞固有免疫行为的影响
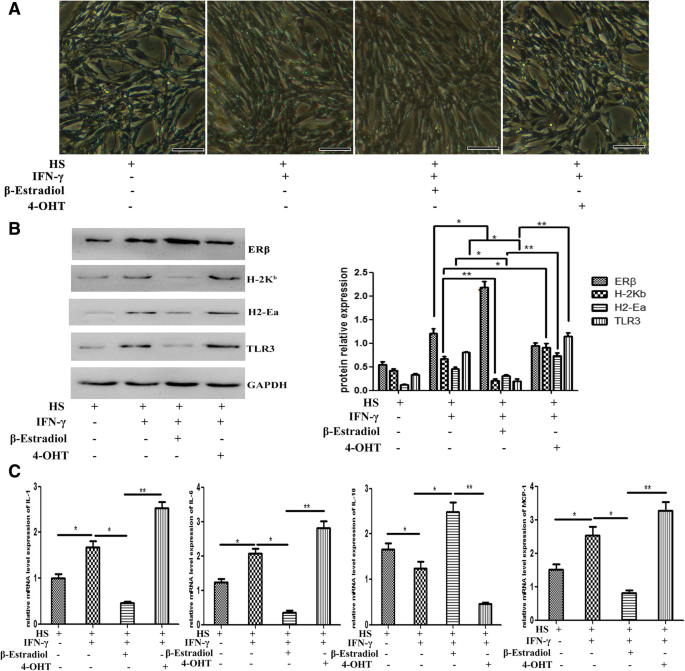
成肌细胞和肌管可以表达多种免疫重要分子,包括I/II类主要组织相容性复合体(MHC-I/II)和在IFN-γ或其他促炎细胞因子存在下的共刺激分子[47,48];这说明,在促炎环境下,肌肉细胞可以积极参与局部免疫反应。我们已经证明雌激素信号通路有助于肌肉炎症反应,这可能反映了雌激素信号通路可能影响肌肉细胞的内在免疫能力,就像它影响免疫细胞一样。为了阐明这一点,我们接下来评估了雌激素信号对IFN-γ诱导的肌肉细胞免疫行为的影响。为此,培养和马血清分化C2C12分别用β-雌二醇或4-OHT处理细胞。我们发现C2C12细胞在添加β-雌二醇或4- oht的培养基中存活良好,并在马血清中成功诱导形成多核肌管(图2)。6a).在本实验环境中,分化肌管上调了MHC-I分子H-2K的蛋白水平bIFN-γ刺激下,MHC-II分子H2-Ea和TLR3(图;6B),这意味着肌肉细胞在炎症环境下获得与驱动免疫反应相关的特性。我们一致地发现C2C12经IFN-γ刺激后,肌管ERβ蛋白水平升高,添加β-雌二醇后,ERβ蛋白水平进一步升高(图2)。6b).在β-雌二醇处理的肌管中,我们检测到H-2K蛋白水平显著下调b, H2-Ea和TLR3。相反,4-OHT诱导这些分子显著上调(图。6b)。
雌激素信号通路对肌肉细胞固有免疫行为的影响。一个相对比显微观察显示C2C12在IFN-γ-、E2-或添加4- oht的介质。bWestern blots分析显示H-2K蛋白水平变化b, H2-Ea, TLR3和ERβ2C12肌管,存在IFN-γ, E2或4-OHT。将western blots实验的相对带强归一化到GAPDH水平,并用ImageJ软件进行分析。c采用qRT-PCR方法检测C细胞中IL-1、IL-6、MCP-1和IL-10的mRNA表达水平2C12肌管,存在IFN-γ, E2或4-OHT。所有数据均以均数±标准差(n= 3)。多重比较采用单因素方差分析。(*p< 0.05和**p< 0.01)。海关马血清。Bar = 50 μm
炎症反应对肌肉修复的最终有害或有益影响受到炎症介质之间特定相互作用的影响,这些介质作为积极和/或消极调节因子,协调局部和全身炎症相关事件并调节肌肉修复过程[49,50].为了更直接地评估肌肉细胞的免疫能力如何受到雌激素信号的影响,我们接下来分析了包括IL-1和IL-6在内的促炎细胞因子的表达,包括TGF-β和IL-10在内的抗炎细胞因子的表达,以及包括MCP1和MIP-1α在内的巨噬细胞来源的趋化因子的表达,这些趋化因子在肌肉损伤诱导的炎症反应中具有优先的生物学作用[51辨析:选C2C12分别用β-雌二醇或4-OHT处理的细胞。我们的qPCR分析表明,在IFN-γ存在的情况下,4-OHT显著抑制了IL-10的表达,但β-雌二醇促进了IL-10的表达(图2)。6c). β-雌二醇治疗导致促炎IL-1和IL-6 mRNA水平显著下调(图。6c).相反,4-OHT刺激肌管中这两种细胞因子显著增加(图。6c).与上面观察到的相似,我们注意到在体外人工改变雌激素水平后,肌肉细胞中巨噬细胞来源的趋化因子的表达发生了改变:β-雌二醇治疗有效地降低了MCP-1水平,但MIP-1α却没有。相反,4-OHT诱导MCP-1的产生显著增加(图2)。6c).综上所述,这些结果共同表明雌激素信号对调节肌肉细胞的内在免疫行为至关重要。
讨论
在临床中注意到,急性创伤后,女性对损伤相对不敏感,功能恢复优于男性。这种损伤组织或器官保护效果的性别差异与血液循环中的性激素水平及其对创伤性侮辱的可能影响有关[15,16,17,18,19].有证据表明血清E2在急性创伤患者中,男性和女性的早期水平均显著升高[15,20.].然而,最近的研究表明雌激素影响动物对创伤性侮辱的免疫反应。Claudia H. Tambeli等人证明,在去卵巢的雌性小鼠中使用雌二醇可显著减少甲醛诱导的血浆外渗和颞下颌关节区中性粒细胞迁移,这一效应被雌激素受体拮抗剂ICI 182780阻断[52].Mukai K.报道雌激素治疗可减少伤口中性粒细胞数量,并降低中性粒细胞粘附分子l-选择素,导致炎症部位中性粒细胞定位减少[53].使用ctx诱导的肌肉损伤模型,我们监测血清E显著升高2雄性和雌性小鼠的雌激素水平在损伤早期呈下降趋势,但在损伤后期迅速下降,反映了急性肌肉损伤过程中雌激素信号的早期演变。通过免疫染色和蛋白水平分析,我们观察到浸润的炎症细胞和再生肌纤维中ERβ的表达增加。先前的报道表明,雌激素在介导骨骼肌葡萄糖摄取和肌原性前体细胞活化以应对肌外伤方面是必需的[30.,31];在此,我们进一步丰富了其在肌外伤后肌肉炎症反应中的作用。
骨骼肌是雌激素的靶组织。一些肌肉病变部分是由雌激素水平下降引起的。29].在炎症肌肉中,卵巢切除术(OVX)会加剧中性粒细胞的侵袭,雌激素治疗会减弱中性粒细胞的侵袭,而ER拮抗剂会减弱雌激素对受损肌肉中白细胞浸润的影响[54,55].E2进一步提示通过抑制活化B细胞核因子κ -轻链增强子(NF-κB)细胞内转运来降低巨噬细胞炎症基因表达[56].我们的数据表明,4-OHT注射和OVX治疗延迟了肌肉修复,并在受损的TA肌肉中引发了更严重的单核/巨噬细胞浸润。因此,我们的数据强调了雌激素通过调节损伤后骨骼肌的炎症动力学来预防继发性肌肉损伤的能力。在伤口愈合的炎症阶段,雌激素已被证明促进替代巨噬细胞极化(促进从M1亚型到M2亚型的转变),从而减少促炎细胞因子的表达[53,56].在OVX小鼠损伤肌肉分离的巨噬细胞中,我们持续监测M1巨噬细胞的频率增加和炎症分子IL-1β、SLPI和MCP-1水平的升高,支持雌激素介导的信号转导在抑制肌肉炎症过程中的重要作用。此外,我们观察到在受损肌肉中,OVX处理后巨噬细胞吞噬被抑制。这与先前的研究一致,表明雌激素可在创伤出血后恢复肝脏巨噬细胞的吞噬能力[39],并提出雌激素信号在介导肌肉炎症反应和修复中的作用。
雌激素影响T细胞生物学的机制尚未完全阐明,整体情况因T细胞对雌激素的双相反应而变得复杂。事实上,低雌激素状态会使t辅助性(Th)反应向Th1极化倾斜,与之相关的细胞介导免疫增加,而高剂量的雌激素则会使Th细胞向Th2表型分化失衡,并导致相关的体液反应[57].我们在受损肌肉中探讨了这个问题,并概述了雌激素信号通路是抑制CD4细胞肌内积聚的关键+T细胞。此外,我们注意到,在缺乏雌激素信号的情况下,受损肌肉中的Th细胞向Th1表型分化。在女性中,Treg细胞的频率和数量在卵泡期由于雌激素水平的增加而增加,而在黄体期由于雌激素水平低而减少[9].T细胞中ER缺失有助于T细胞活化和增殖的降低,并增加T细胞的表达Foxp3它编码调节性T细胞分化和功能的关键转录因子。在iTreg条件下,E2增强了Foxp3的频率+细胞(58].我们的研究表明,在炎症肌肉中,Treg细胞的积累和功能取决于雌激素水平,至少在一定程度上,这有利于抑制Th1反应。据报道,在急性肌损伤后,Treg细胞通过控制局部IFN-γ反应来抑制促炎巨噬细胞[38].因此,根据我们的结果,我们可以推测,在炎症肌肉中,雌激素信号通路通过增加Treg细胞诱导的th1反应抑制来抑制促炎巨噬细胞。
雌激素已被证明可以调节抗原呈递细胞(apc)的终末分化和存活。Seillet等报道了17β-雌二醇对稳态和激活dc功能反应的影响。具体地说,E2通过IFN调节因子(IRF)-4的上调,促进由gm - csf刺激的髓样前体衍生的炎症dc的分化和效应功能[59].这一发现与之前的研究一致2在体外和体内增强和维持GM-CSF对IRF4的诱导[60].雌激素也影响成熟dc的行为。Siracusa等人的研究报告了体外暴露于雌激素的dc显示IFN增加γ+杀伤DCs (CD11c+MHC II类+CD49b+Nk1.1高表型)[61].骨骼肌细胞被认为是兼性APCs。培养的人成肌细胞组成性地表达经典人类白细胞(HLA) I类抗原TLR3和TLR7,并通过促炎细胞因子(如IFN-γ、TNF-α、IL-1α等)提高其表达水平,提示肌肉细胞可积极参与局部免疫反应[47,48].在小鼠中,ERβ是ER的主要亚型[28].与此一致,我们检测到炎症肌肉组织和再生肌纤维中ERβ表达增加。在体外,我们观察到H-2K的表达明显上调b, TLR3和H2-Ea在分化C2C12在促炎IFN-γ存在的肌管中此外,我们还为雌激素信号在肌肉细胞固有免疫行为中的抑制作用提供了证据,因为我们检测到H-2K的显著下调bβ-雌二醇处理C2C12但在IFN-γ刺激下,4- oht处理的肌管显著上调。
结论
总的来说,我们的数据表明雌激素是肌肉炎症反应的积极干预因素。在体内,雌激素通过控制肌内单核/巨噬细胞的浸润和促炎M1向抗炎M2巨噬细胞的转变,影响Treg细胞的积累和功能,抑制受损肌肉中的Th1反应,致力于减轻骨骼肌的炎症损伤。我们的研究结果还表明雌激素对肌肉细胞的固有免疫行为有抑制作用。
改变历史
2022年6月24日
缩写
- 4-OHT:
-
4-Hydroxytamoxifen
- APC:
-
抗原呈递细胞
- CTX:
-
心脏毒素
- DC:
-
树突细胞
- DMEM:
-
杜尔贝科改良的鹰牌中号
- E2:
-
雌二醇
- 人:
-
雌激素受体
- 的边后卫:
-
胎牛血清
- GAPDH:
-
Glyceraldehyde-3-phosphate脱氢酶
- gm - csf:
-
粒细胞-巨噬细胞集落刺激因子
- HLA:
-
人类白细胞
- 海关:
-
马血清
- 干扰素-γ:
-
干扰素-γ
- IRF:
-
干扰素调节因子
- 亮度:
-
Lumispheres
- mhc i / II:
-
I/II类主要组织相容性复合体
- NF -κB:
-
核因子kappa-活化B细胞的轻链增强剂
- NK:
-
自然杀伤细胞
- OVX:
-
卵巢切除术
- 助教:
-
胫骨前
- TGF -β:
-
转化生长因子-β
- TLR:
-
toll样受体
参考文献
Mirandola L, Wade R, Verma R, Pena C, Hosiriluck N, Figueroa JA,等。性别驱动的免疫反应差异:第三个千年免疫疗法的挑战和机遇。国际免疫杂志2015;34:134-42。
雌激素受体调节先天免疫细胞和信号通路。中国生物医学工程杂志,2015;
王晓燕,王晓燕,王晓燕。先天性免疫的性别二态性研究。中国过敏免疫杂志,2017;56(3):308-21。
Kanda N, Tamaki K.雌激素增强人pbmcs免疫球蛋白的产生。中华过敏临床免疫杂志,1999;23(3):342 - 344。
Cyster JG, Goodnow CC.蛋白酪氨酸磷酸酶1c负向调控b淋巴细胞抗原受体信号通路并确定负选择阈值。免疫力。1995;2:13-24。
Dinesh RK, Hahn BH, Singh RP。Pd-1,性别和自身免疫Autoimmun Rev. 2010; 9:583-7。
王晓明,王晓明,王晓明,王晓明,等。b淋巴细胞bcl-2蛋白的发育调控及其对细胞死亡的敏感性。张志强,1994;13:683-91。
佐藤S,托斯卡诺JM,稻木M,特德TF。Cd22通过b淋巴细胞抗原受体负向和正向调节信号转导。中华免疫杂志,1998;10:497 - 497。
Arruvito L, Sanz M, Banham AH, Fainboim L.月经周期卵泡期cd4+cd25+和foxp3+调节性t细胞的扩张:对人类生殖的影响。中华免疫杂志2007;178:2572-8。
莫荣,陈杰,杨瑞林,陈建平,陈建平。雌激素调节t淋巴细胞ccr基因的表达和功能。中华免疫杂志,2005;
张志刚,张志刚。性激素与人体免疫反应的关系。嗡嗡声更新。2005;11:411-23。
Garcia-Duran M, de Frutos T, Diaz-Recasens J, Garcia-Galvez G, Jimenez A, Monton M,等。雌激素刺激中性粒细胞神经元一氧化氮合酶蛋白表达。第1999;85:1020-6号决议。
宫城M,青山H,森下M,岩本Y.性激素对人外周血多形核白细胞和单核细胞趋化性的影响。牙周病杂志。1992;63:28-32。
郝珊珊,赵娟,周娟,赵珊珊,胡艳,侯艳。雌二醇对体内nk细胞数量和细胞毒性的调控与mcm和激活受体相关。《免疫药物学杂志》2007;7:1765-75。
乔杜里MA, Bland KI, Chaudry IH。创伤后败血症的性别和易感性。Endocr Metab免疫失调药物靶点。2006;6:127-35。
Sperry JL, Minei JP。损伤后的性别二态:从长凳到床边的连接。中华生物医学杂志,2008;
性别与创伤性脑损伤。中华神经外科杂志2001;94:862-4。
Ponsford JL, Myles PS, Cooper DJ, McDermott FT, Murray LJ, Laidlaw J等。低血压和严重创伤性脑损伤患者结局的性别差异受伤。2008;39:67 - 76。
Brown CM,铃木S, Jelks KA, Wise PM。雌二醇是脑损伤后一种有效的保护、恢复和营养因子。谢明再医学。2009;27:240-9。
刚W,李敏X,杨W,占志W,李军X。颅脑及颅外创伤对早期血清睾酮、雌二醇变化的影响及其临床意义。中华创伤急救杂志,2013;
洪兴辉,张文华,叶长昌,黄保生,张正大,陈玉军,等。雌激素对伤口愈合的影响。国际分子化学杂志,2017;18(11):2325。https://doi.org/10.3390/ijms18112325
马志强,王志强,王志强,等。人单核细胞中雌激素受体与fas配体启动子的相互作用。中华免疫杂志2003;17:114 - 22。
Komi J, Lassila O.非甾体抗雌激素抑制人单核细胞来源的树突状细胞的功能分化。血。2000;95:2875 - 82。
拉方特,谢利特,郭瑞杰。雌激素受体对树突细胞发育和功能的依赖性调节。前沿免疫,2017;8:108。
控告SB, MA Rudnicki。肌肉再生的细胞和分子调节。物理学Rev. 2004; 84:209-38。
Tidball詹。肌肉损伤和修复中的炎症过程。美国物理学报。2005;38:R345-53。
Ekenros L, Papoutsi Z, Friden C, Dahlman Wright K, Linden HA。性类固醇激素受体在人骨骼肌月经周期的表达。物理学报(Oxf)。2017; 219:486 - 93。
Milanesi L, Vasconsuelo A, de Boland AR, Boland R.天然雌激素受体β在小鼠c2c12细胞和骨骼肌组织中的表达和亚细胞分布。类固醇。2009;74:489 - 97。
李志刚,李志刚,李志刚。雌激素对骨成肌细胞生长的影响。生物化学生物物理研究,1997;232:373-8。
性激素如何促进骨骼肌再生。体育医学。2013;43:1089-100。
周志强,周志强,李志强,等。骨骼肌雌激素受体在代谢稳态和胰岛素敏感性中的作用。Adv Exp医学生物学,2017;1043:257-84。
Johnson ML, Ho CC, Day AE, Walker QD, Francis R, Kuhn CM。雌激素受体促进大鼠中脑多巴胺神经元存活。神经内分泌杂志,2010;22:226-37。
Van Sinderen ML, Steinberg GR, Jorgensen SB, Honeyman J, Chow JD, Herridge KA,等。雌激素对雌性芳香化酶敲除小鼠脂肪因子和葡萄糖稳态的影响。科学通报。2015;10:e0136143。
范P,阿格博克FA,坎利夫HE,拉莫斯P,乔丹VC。乳腺癌获得性他莫西芬耐药机制的分子模型。中华癌症杂志,2014;
Wang Y, Shoemaker R, Thatcher SE, Batifoulier-Yiannikouris F, English VL, Cassis LA。给去卵巢的肥胖雌性小鼠注射雌二醇可通过乙酰2依赖机制逆转肥胖-高血压。中国生物医学杂志,2015;29(2):344 - 344。
免疫系统与骨骼肌修复。Pharmacol res 2008; 58:117-21。
Tidball JG, Villalta SA。肌肉再生过程中肌肉与免疫系统之间的调节相互作用。中国物理学报。2010;29:R1173-87。
Panduro M, Benoist C, Mathis D.在骨骼肌再生过程中,Treg细胞限制ifn - γ的产生以控制巨噬细胞的产生和表型。中国科学院学报(自然科学版),2018;
谢春华,陈杰,陈志强,马建平,等。创伤出血后雌激素对枯ffer细胞吞噬能力的有益作用机制:akt活化的关键作用。中华免疫杂志,2009;
肌炎中的Malmstrom V, Venalis P, Albrecht I. T细胞。关节炎研究。2012;14:230。
刘志强,刘志强,王晓明,等。肌肉损伤瞬时激活肌肉抗原特异性CD8+小鼠模型中淋巴结中的T细胞。风湿性关节炎。2012;64:3441-51。
张勇,张志刚,张志刚,张志刚,等。一种特殊的调节性t细胞增强了肌肉修复的能力。细胞。2013;155:1282 - 95。
Schiaffino S, Pereira MG, Ciciliot S, Rovere-Querini P.调节t细胞与骨骼肌再生。Febs j . 2017; 284:517-24。
范晓玲,段小波,陈志华,李敏,徐建军,丁gm .雌激素缺乏下调卵黄小鼠骨髓中treg细胞cxcr4表达,减少treg细胞数量。细胞摩尔生物学(嘈杂-大)。2015; 61:13-7。
Koch MA, Tucker-Heard G, Perdue NR, Killebrew JR, Urdahl KB, Campbell DJ。转录因子t-bet在1型炎症中控制调节t细胞稳态和功能。中华免疫杂志2009;10:595-602。
沃克LS。Treg和ctla-4:两条相互交织的免疫耐受途径。《科学》,2013;45:49-57。
温德尔H,霍尔菲尔德R,基塞尔BC。肌肉免疫生物学:理解免疫微环境的进展。免疫学杂志2005;26:373-80。
丁敏,黄涛,朱睿,顾睿,史东,肖杰,等。肌细胞在ifn- γ刺激下的体内外免疫行为分析。阿纳特Rec(霍博肯)。2018; 301:1551 - 63。
王志强,王志强。细胞因子对肌肉干细胞功能的调控作用。Adv Exp医学生物学。2016;900:27-44。
Philippou A, Maridaki M, Theos A, Koutsilieris M.肌肉损伤中的细胞因子。Adv clinalchem . 2012; 58:49-87。
巨噬细胞因子:参与免疫和感染性疾病。前沿免疫。2014;5:491。
Torres-Chavez KE, Sanfins JM, Clemente-Napimoga JT, Pelegrini-Da-Silva A, Parada CA, Fischer L,等。性腺类固醇激素对福尔马林诱导的颞下颌关节炎症的影响。中国科学院学报(自然科学版),2012;
向井K,井井T,浅野K,中岛Y,中谷T。评价外用苯甲酸雌二醇对去卵巢雌性小鼠皮肤伤口愈合的影响。公共科学图书馆,2016;11:e0163560。
麦克朗JM,戴维斯JM,卡森JA。卵巢激素状态和骨骼肌炎症在大鼠从废弃恢复。实验物理。2007;92:219-32。
麦克朗JM,戴维斯JM,威尔逊MA,戈德史密斯EC,卡森JA。雌激素水平与废用性萎缩的骨骼肌恢复。应用物理学报(1985)。2006; 100:2012-23。
Ghisletti S, Meda C, Maggi A, Vegeto E. 17 β -雌二醇通过控制nf-kappab细胞内定位抑制炎症基因表达。中国生物医学工程学报,2005;
雌激素和cd4+ t细胞。《风湿病杂志》2007;19:414-20。
郭杰,郭金勇,王志强,等。雌激素受体通过促进t细胞的活化和增殖参与t细胞介导的自身免疫性炎症。科学通报。2018;11(526):eaap9415。https://doi.org/10.1126/scisignal.aap9415
Seillet C, Rouquie N, Foulon E, Douin-Echinard V, Krust A, Chambon P,等。雌二醇通过雌激素受体α激活功能-1的差异需求促进炎性和稳态树突状细胞的功能反应。中华免疫杂志,2013;
卡雷拉斯E, Turner S, Frank MB, Knowlton N, Osban J, Centola M,等。雌激素受体信号通路通过增加转录因子irf4的表达促进树突状细胞分化。血。2010;115:238-46。
Siracusa MC, Overstreet MG, Housseau F, Scott AL, Klein SL. 17 β -雌二醇改变传统和产生干扰素的杀手树突细胞的活性。中华免疫杂志2008;180:1423-31。
确认
不适用。
资金
本研究得到国家自然科学基金(81572102)、国家重点研发计划(2017YFC1105003)、南方医科大学南方医院主任基金(2018B017)资助。
数据和材料的可用性
在这项研究中产生或分析的所有数据都包含在这篇发表的文章中。
作者信息
作者及隶属关系
贡献
所有作者都参与了文章的起草或对重要的知识内容进行了批判性的修改,所有作者都批准了最终版本的出版。HL可以完全访问研究中的所有数据,并对数据的完整性和数据分析的准确性负责。研究构想与设计:HL、GW;数据采集:ZHL, TH;数据分析与解释:ZHL, TH, JWX, RCG,乔, gw, hl。
相应的作者
道德声明
伦理批准并同意参与
所有动物实验方案均经南方医科大学动物保护与使用委员会批准。
发表同意书
不适用。
相互竞争的利益
作者宣称他们之间没有利益冲突。
出版商的注意
伟德体育在线施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
权利和权限
开放获取本文根据创作共用属性4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),允许在任何媒介上不受限制地使用、分发和复制,前提是您对原作者和来源给予适当的赞扬,提供到创作共用许可证的链接,并注明是否进行了更改。创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)除另有说明外,适用于本条所提供的资料。
关于本文
引用本文
廖志华,黄涛,肖建伟,肖建伟et al。雌激素信号通过控制巨噬细胞和T细胞的招募和功能对肌肉特异性免疫反应的影响。骨骼肌9, 20(2019)。https://doi.org/10.1186/s13395-019-0205-2
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s13395-019-0205-2
关键字
- 雌激素
- Myoinjury
- 炎症
- 雌二醇(E2)
- C2C12细胞