摘要
背景
骨骼肌是全身代谢的主要贡献者,因为它是葡萄糖和氨基酸的仓库,是一种高度代谢活跃的组织。骨骼肌内部存在一种内在的分子钟机制,调节生理过程的时间。生物钟的一个关键功能是调节代谢过程的时间,以预测环境条件下每天的时间变化。本研究的目的是鉴定以昼夜节律方式表达的代谢基因,并通过分析诱导骨骼肌特异性的基因表达来确定这些基因是否在内在分子钟的下游被调节Bmal1敲除小鼠模型(iMS-Bmal1−/−).
方法
我们使用昼夜节律统计来分析公开可用的高分辨率骨骼肌表达数据集。利用基因本体分析来识别骨骼肌昼夜转录组中丰富的生物学过程。我们产生了一种他莫昔芬诱导的骨骼肌特异性Bmal1敲除小鼠模型,并进行了时间过程微阵列实验,以确定分子钟下游的基因表达变化。车轮活动监测用于评估im的昼夜行为节律Bmal1−−/控制即时消息Bmal1+/+老鼠。
结果
骨骼肌昼夜转录组在代谢过程中高度富集。对昼夜代谢基因的肢端相分析显示,24小时内涉及底物利用和存储的基因存在时间分离。一些昼夜节律代谢基因在im -骨骼肌中有差异表达Bmal1−−/老鼠。iMS -Bmal1−−/小鼠表现出与即时消息无法区分的昼夜节律行为节律Bmal1+/+老鼠。我们还观察到一种基因特征,表明在im -中纤维类型的快速到缓慢的转变和更氧化的骨骼肌Bmal1−−/模型。
结论
这些数据提供了证据,骨骼肌内固有的分子钟在时间上调节与底物的利用和储存无关的基因。由相移(即社交时差)或夜间进食引起的这一机制的破坏,最终可能会降低骨骼肌在24小时内有效维持代谢稳态的能力。
背景
骨骼肌在全身代谢中起着重要作用,因为它约占身体质量的40%,是一种高度代谢活跃的组织[1,2].基础代谢率取决于骨骼肌的大小和活动,因为与收缩相关的过桥循环和钙处理是能量消耗很大的过程[2-5].骨骼肌是全身葡萄糖处理的主要贡献者,因为它负责约80%的餐后葡萄糖摄取[6,7].据广泛报道,骨骼肌具有调节底物利用和储存的机制,以响应不同的代谢需求和环境条件(例如,营养状况)[3.,8-12].例如,骨骼肌在收缩和/或胰岛素刺激时迅速调节葡萄糖摄取和利用的速率[13-15].而波动的作用则是为肌肉储存vs.使用通常与进食/禁食和活动/不活动行为联系在一起,这些储存和使用的变化也与24小时(昼夜节律)的光/暗周期相一致,归因于太阳的升起和落下以及进食/活动行为[16].
昼夜节律的核心是一种被称为分子钟的机制。在过去的15年里,许多研究人员已经证明,生物钟机制存在于人体几乎所有类型的细胞中,包括骨骼肌。17,18].内在分子钟最为人所知的作用是调节细胞代谢,即使是在恒定的光照或进食条件下[19-26].这些研究表明,分子钟在时间上调节限速代谢基因的节律性激活或抑制,以帮助细胞预测环境条件和代谢需求的变化[27].分子钟包括由PAS-bHLH家族转录因子BMAL1: clock的节律性表达驱动的转录-翻译反馈机制,该转录因子BMAL1: clock在非活性期(即小鼠的光期)达到最大活性[28-31].BMAL1:CLOCK的直接靶点通常在一天的活动期(即小鼠的暗期)开始之前达到峰值表达(acrophase)。在遗传核心时钟突变模型中观察到的代谢表型强调了分子钟调节代谢的能力[32-38].正在进行的研究旨在利用器官特异性分子钟突变模型来确定时钟在每个组织中的功能,以及评估外围时钟在调节全身代谢中的作用[39-43].
利用高分辨率的时间转录组数据与昼夜节律统计数据相结合,已被证明是识别以昼夜节律方式表达的基因的有效方法[44,45].在本研究中,我们采用生物信息学方法,利用在持续黑暗条件下收集的公开可获得的高分辨率昼夜节律数据集,分析骨骼肌昼夜节律转录组(腓肠肌),重点关注基因表达的时间阶段。我们揭示了骨骼肌昼夜节律基因在代谢过程中高度富集,此外,我们确定了分离分解代谢的不同关键代谢基因峰值表达的时间模式vs.为了确定哪些昼夜代谢基因在内在分子钟的下游受到调控,我们生成了一种可诱导的肌肉特异性基因Bmal1击倒(iMS -Bmal1−−/)小鼠进行时间序列转录组分析。老鼠缺乏Bmal1在骨骼肌中没有表现出明显的昼夜节律行为变化,但我们观察到参与葡萄糖利用和肾上腺素能信号的昼夜节律基因的表达显著降低,同时观察到脂肪生成基因的显著增加。与底物从碳水化合物到脂类利用的转变相一致,我们观察到伴随的纤维型基因表达谱从快到慢的转变,表明在im -中肌肉更氧化Bmal1−−/.这些发现表明,骨骼肌内的内源性分子钟对碳水化合物/脂质代谢的日转换时间有显著贡献。
方法
高分辨率昼夜节律芯片
高分辨率昼夜节律时间过程的微阵列数据来自雄性C57Bl6小鼠的腓肠肌,在恒定的黑暗条件下,每2小时收集一次,持续48小时随意食物供应[46].数据从NCBI GEO数据集(GSE54652)下载,由24个单独的阵列组成,每个阵列对应昼夜节律时间18至64 [45,46].将序列矩阵文件中所有探针集在所有时间点上的表达强度作为JTK_CYCLE分析的输入,周期长度设置为24 h [47].我们将昼夜节律基因定义为调节了JTK_CYCLEP值小于0.05。我们利用Bioconductor包在Affymetrix小鼠基因1.0 ST芯片上识别代表唯一基因的映射探针,从而消除了进一步分析的对照探针。中位表达强度至少为100的基因被认为在骨骼肌中表达。我们将昼夜节律基因列表输入到基因本体联盟在线工具中,以识别丰富的生物过程[48,49].浓缩P使用Bonferroni校正对数值进行多次测试调整。
可诱导骨骼肌特异性Bmal1失活小鼠模型
所有的动物程序都是根据肯塔基大学机构动物护理和使用委员会批准的实验动物护理和使用机构指南进行的。的液氧Bmal1鼠标(B6.129S4 (Cg)Arntltm1Weit/J]购自杰克逊实验室,没有育种、生理或行为异常的报告[50].骨骼肌特异性Cre重组酶的鼠标,[人体骨骼肌动蛋白(保险公司) - - -MerCreMer]已被预先鉴定[51].的液氧Bmal1鼠标loxP位点位于外显子8的侧翼,与野生型窝仔难以区分。与骨骼肌特异育种Cre-重组酶小鼠产生的后代中,bHLH结构域的选择性缺失Bmal1在骨骼肌中可以诱导他莫西芬给药。可诱导骨骼肌特异性Bmal1敲除小鼠生成如下Bmal1液氧/液氧女性与骨骼肌特异杂交Cre重组酶男性。这产生了F1代骨骼肌特异性Cre+ /−;Bmal1+ /液氧老鼠。繁殖F1代雄性到Bmal1液氧/液氧女性导致骨骼肌特异性Cre+ /−;Bmal1液氧/液氧小鼠(简称iMS-)Bmal1液氧/液氧)。利用从尾剪中分离的基因组DNA,用PCR方法测定小鼠基因型。激活Cre-重组是通过腹腔注射他莫西芬完成的(Sigma-Aldrich, St. Louis, MO, USA;猫。不。T5648)(2毫克/天),连续5天,当小鼠达到12周龄时。选择这个年龄是为了消除任何缺乏的影响Bmal1可能对骨骼肌发育和产后成熟有影响。对照组为载体(15%乙醇葵花籽油)处理的iMS-Bmal1液氧/液氧老鼠。
复合特异性
iMS -Bmal1小鼠腹腔内注射任一载体(iMS-Bmal1+/+)或他莫西芬(iMS-Bmal1−−/)在12至16周之间。注射后5周,用异氟醚麻醉小鼠,收集心脏、膈肌、肝脏、肺、腹主动脉、大脑、胫骨前肌、比目鱼、腓肠肌、棕色脂肪、白色脂肪和软骨,并立即冷冻在液氮中进行DNA分析。使用DNeasy血液和组织试剂盒(Qiagen, Venlo, Netherlands)从组织中提取基因组DNA。为了评估重组特异性,用组织DNA和引物对重组和非重组等位基因进行PCR,如Storch所述等.[50].未重组等位基因的正向和反向引物与基因分型引物相同,得到431 bp的产物。采用第二个正向引物5 ' -CTCCTAACTTGGTTTTTGTCTGT-3 '检测重组等位基因,在572 bp [50].PCR反应在1.5%琼脂糖凝胶(0.0005%溴化乙锭)上进行,以显示DNA产物。
RNA分离和实时PCR
根据制造商的说明,使用TRIzol (Invitrogen)从冷冻腓肠肌组织样本中制备总RNA。RNA样本用TURBO DNase (Ambion, Austin, TX, USA)处理以去除基因组DNA污染。分离的RNA用分光光度法定量(λ= 260 nm)。使用SuperScript III First-strand synthesis SuperMix (Invitrogen, Waltham, MA, USA),将寡核苷酸(dT)引物和随机六聚体混合,从总RNA中合成第一链cDNA。所有分离的RNA和cDNA样本保存在−80°C,直到进一步分析。采用TaqMan (Applied Biosystems, Waltham, MA, USA)实时定量PCR检测基因表达Bmal1(Mm00500226_m1),Rev-erbα(Mm00520708_m1),菲律宾(Mm00497539_m1),Hk2(Mm00443385_m1),Pdp1(Mm01217532_m1),Fabp3(Mm02342495),Pnpla3(Mm00504420_m1)。使用ΔΔCT方法对昼夜节律收集的实时PCR数据进行量化。
车轮活动监测
一组小鼠被用于分析昼夜节律行为(该队列中未分析基因表达)。共对20只小鼠(男女混合)进行了分析,其中11只接受他莫西芬治疗,其余9只接受对照治疗。在12L:12D (LD)条件下,小鼠在带跑轮的单独笼子中饲养4周。车辆的车轮运行(iMS-Bmal1+/+)或他莫西芬(iMS-Bmal1−−/)在整个实验过程中使用ClockLab软件对小鼠进行持续记录和监测[52].为了确定小鼠的自由奔跑期,我们将它们置于完全黑暗(DD)中3周。活动评估采用自愿跑步轮旋转绘制1分钟的箱。自由运行期(τ),采用ClockLab软件中的周期图分析方法进行计算。
昼夜集合
48 iMS -Bmal1液氧/液氧小鼠被安置在灯箱中的单独笼子中,以12小时LD周期进行14天随意获得食物和水。在2周的夹带期后,24只小鼠连续5天注射了本品,24只小鼠注射了他莫西芬,产生了24只im -Bmal1+/+24个即时通讯Bmal1−−/老鼠,分别。在注射期间和随后的5周内保持相同的轻时间表。注射最后一天五周后,小鼠按照昼夜节律领域建立的协议被释放到持续黑暗中30小时[46,53].在黑暗中(昏暗的红光)处死小鼠,每4小时收集一次骨骼肌,持续20小时(6个时间点),并冷冻用于RNA和蛋白质分析。
免疫印迹
从iMS-的肝脏和腓肠肌制备全细胞裂解物Bmal1+/+和iMS -Bmal1−−/老鼠(n= 3 /应变)。SDS-PAGE(4-15%分离凝胶,Bio-Rad, Hercules, CA, USA)和免疫印迹均按常规方案进行。Affinity-purifiedBmal1多克隆抗体(Sigma-Aldrich, SAB4300614)用irdye偶联的二抗使用Odyssey系统(Li-Cor, Lincoln, NE, USA)进行检测。每个巷含总蛋白50 μg。
微阵列分析即时消息-Bmal1+/+iMS -Bmal1−−/和MKO (Dyar等.)
我们为每个时间点(昼夜节律时间18,22,26,30,34,38)和治疗(载体或他莫西芬)收集了4只小鼠的等量总RNA。聚合RNA样本用于构建cDNA文库,并与Affymetrix Mouse Gene 1.0 ST微阵列(Affymetrix, Santa Clara, CA, USA)杂交(1个样本/时间点)。即时消息强度数据-Bmal1+/+和iMS -Bmal1−−/腓肠肌分位数归一化,对两个iMS-应用大于或等于100的低通中值强度滤波器Bmal1+/+和iMS -Bmal1−−/单独的数据集。九千一百八十四个非冗余的映射基因(9988个探针集)被认为在一个或两个数据集中表达。im -基因表达改变Bmal1−−/通过平均每个基因在昼夜节律时间过程中的表达变化来计算肌肉组织(CT18-38,n= 6)。来自Dyar的对照和肌肉特异性敲除模型(MKO)的胫骨前肌和比目鱼基因表达值等.[43]是从NCBI GEO数据集(GSE43071)下载的,由18个单独的阵列组成,从昼夜节律时间0到20,每个时间点3个。为了比较TA和SOL的暂时性基因表达变化,我们在昼夜节律时间0、4、8、12、16和20时平均了每个基因的Affymetrix ST 1.0表达值。学生的t测试被用来识别差异表达的探针在显著性P≤0.05。
结果与讨论
细胞代谢过程在骨骼肌的昼夜转录组中高度丰富
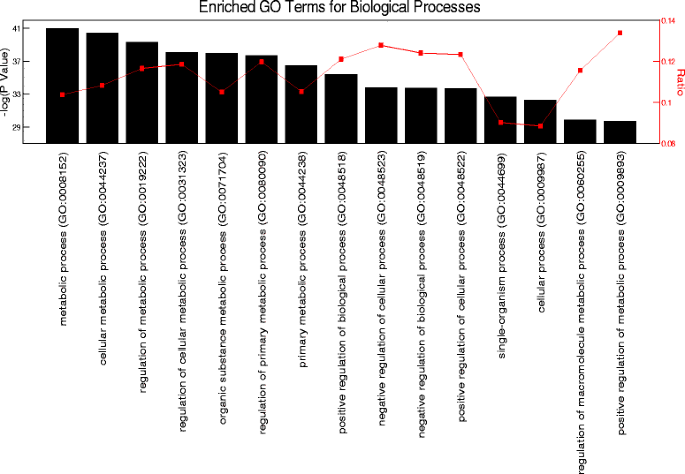
为了确定骨骼肌中的昼夜节律基因表达,我们使用了一个公开的、高分辨率的昼夜节律时间过程微阵列数据集,这些数据来自雄性C57BL/6小鼠的腓肠肌[45,46].这些老鼠被关在持续黑暗的环境中,并提供食物随意消除外部环境线索的影响。我们之所以选择这个数据集,是因为它的采样频率是之前发表的昼夜节律肌肉转录组的两倍,这使得昼夜节律分析具有更高的精度[46,54].使用JTK_CYCLE统计算法[47为了可靠地检测以24小时为周期的振荡转录本,我们鉴定了1628个昼夜节律mrna(经调整后)P< 0.05)。对这些昼夜节律基因的无偏倚基因本体论富集分析揭示了细胞代谢过程的显著过度代表,大约有1004个(62%)基因直接参与骨骼肌代谢过程以及代谢调节(图1).
使用JTK_CYCLE算法的另一个好处是它能够确定每个昼夜节律探针的最顶端阶段或峰值表达时间。识别具有共同本体的基因的顶端期可能有助于预测细胞和生理过程的潜在时间。在这里,我们根据它们各自的昼夜节律时间(CT)来报告末端相,CT是标准化的,以小鼠在恒定条件下的自由奔跑时间为标准。对于阵列研究,小鼠处于DD中30小时,因此CT 0表示非活动期的开始,而CT 12表示活动期的开始。为了确定骨骼肌中基因表达的时间及其与代谢过程的关系,我们通过已知功能、峰值表达的时间和参与关键代谢途径注释了一组昼夜节律基因。我们重点分析了涉及底物(碳水化合物和脂质)利用以及储存和生物合成过程的代谢功能。
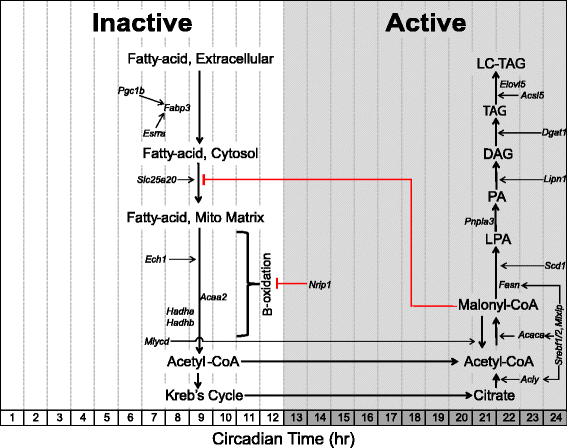
脂质代谢:参与脂肪酸摄取和β-氧化的基因在中度不活跃/轻度阶段达到峰值
骨骼肌表达特殊的膜转运蛋白,以促进脂质进入细胞[55-57].编码脂肪酸结合蛋白的两种脂质转运基因,Fabp4(CT 24.0)和Fabp3(心脏/肌肉亚型,CT 6.0),以昼夜节律的方式表达,分别在无活动的早期和中期mRNA表达最高。参与脂质代谢的昼夜节律基因的肢端相如图所示2.每个基因的规范化表达轨迹位于附加文件中1,2,3..先前的研究表明,小鼠血浆脂肪酸浓度的波动出现在不运动/轻度运动期间[58-60].需要进一步的功能分析来验证骨骼肌中脂肪酸摄取率在非活动中后期达到峰值的预测。脂肪酸进入细胞后,可储存为甘油三酯或通过β-氧化转化为乙酰辅酶a [61].Slc25a20编码酰基肉碱转位酶,将脂肪酸转移到线粒体内部基质,并在非活跃期中期达到峰值表达(CT 7.5) [62].我们发现了多个编码β-氧化酶的基因,它们具有昼夜节律性,并且在失活期中期达到峰值表达。这些包括烯酰辅酶a水合酶Ech1(CT 7.0),三功能酶亚基Hadha(CT 8.0)和Hadhb(CT 8.0)和乙酰辅酶a酰基转移酶Acaa29.0 (CT)。过程中形成的一种中间体,丙二醇辅酶a新创脂肪酸合成,是一种有效的β-氧化抑制剂。横纹肌富集基因Mlycd(CT 7.5)编码丙二酰辅酶a脱羧酶,该酶通过降低丙二酰辅酶a的细胞质浓度来促进β-氧化,并在无活性期中期达到峰值表达,与昼夜β-氧化基因的表达相似。这些观察结果表明,β-氧化速率随时间变化而变化,并可能通过骨骼肌中的内源性分子钟进行调节[10,63,64].
核受体被认为是有效的代谢转录调节因子,因为它们感知环境条件的变化,并诱导代谢基因表达的适当变化[65-69].核受体雌激素相关受体α (Esrra, CT 7.5)和核共激活剂PPARγ共激活剂-1 β (Ppargc1b, CT 7.0)均为骨骼肌中的昼夜节律基因,峰值表达出现在失活期中期。这些因素已被证明促进线粒体生物发生,脂肪酸摄取(目标Fabp3)和β-氧化[70,71].核辅抑制剂Nrip1,也被称为Rip140是骨骼肌氧化代谢的一种有效的负调节因子,已被证明可以抑制脂肪酸转运蛋白的表达,Fabp3,在骨骼肌[72-74].NRIP1通过结合核受体(包括ppar和雌激素相关受体)和招募组蛋白去乙酰酶来抑制基因表达[75].有趣的是,峰值表达Nrip1发生在活动期的开始(CT 13.0),因此可能作为分子制动氧化代谢,因为肌肉在活动期早期从脂质转化为碳水化合物。
脂质代谢:脂肪生成基因在活性/暗期结束时达到峰值表达
脂肪生成基因中国国际皮革展(CT23.0),Acaca(CT 23.0),和Fasn(CT 22.5)参与新创脂肪酸合成,或将多余的碳水化合物转化为脂肪酸,在活性期结束时达到峰值表达(图2) [61,76].Scd1(CT 24.0)编码催化单不饱和脂肪酸形成的限速反应以促进脂质双分子层流动性和脂肪生成的酶[77,78].的基因Srebf124.5 (CT),Srebf2(CT 24.0),和Mlxip(CT 23.5)编码脂肪生成基因启动子区域内针对碳水化合物反应元件的转录因子(中国国际皮革展,Acaca,Fasn),也具有昼夜节律性,活跃期结束时的峰值表达[79,80].与我们的结果一致,Srebf1在肝脏中有振荡的报道,全基因组结合研究表明,SREBF1在活跃(喂养)阶段对脂肪生成基因启动子的结合具有最大的昼夜节律模式[81-84].
的基因Pnpla3(CT 21.0),也称为脂素,通过将LPA转化为磷脂酸(PA)来促进脂肪生成[85].的基因Lpin1(CT 24.0)编码脂素-1酶,负责将磷脂酸(PA)转化为磷脂生物合成所需的上游代谢物二酰基甘油(DAG) [86,87].在三酰基甘油(TG)合成中,将脂肪酰基辅酶a添加到DAG中是高度调控的,由编码的产物执行Dgat1(CT 24.5),也以昼夜节律的方式表达[88].一旦TG分子形成,它可以被编码的酶延长Acsl5(CT 23.0)或Elovl5(ct 22.5) [89,90].观察到昼夜脂肪生成基因在活动阶段结束时达到峰值表达水平,这表明骨骼肌在活动/吸收阶段结束时促进了多余能量的存储。
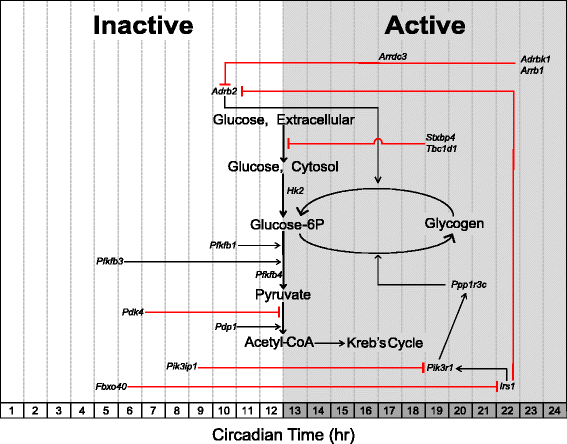
碳水化合物代谢:参与碳水化合物分解代谢的基因在早期活跃/暗期达到峰值
糖酵解是葡萄糖分解形成丙酮酸的过程,主要受己糖激酶和磷酸果糖激酶催化的两种酶促反应的调控[91].我们观察到己糖激酶-2 (Hk2)基因具有昼夜节律性,活跃期开始时出现峰值表达(CT 12.0)。参与碳水化合物代谢的昼夜节律基因的肢端相如图所示3..每个基因的规范化表达轨迹位于附加文件中1,2,3..Hk2负责糖酵解的第一步,通过磷酸化葡萄糖生成葡萄糖-6-磷酸,从而将葡萄糖困在细胞内[92].糖酵解的限速步骤是由磷酸果糖激酶-1 (PFKM)催化果糖-6-磷酸生成高度不稳定的果糖-1,6-二磷酸[93,94].PFKM的一种有效变构激活物是果糖-2,6-二磷酸,它是另一种磷酸果糖激酶同工酶磷酸果糖激酶-2 (PFK2)的产物[95].三个基因(Pfkfb-1、3、4)编码磷酸果糖激酶-2亚基的基因是昼夜节律的,峰值表达出现在失活中期和晚期(分别为CT 10.0、CT 4.5和CT 12.0)。
通过Kreb循环的糖酵解通量受丙酮酸脱氢酶复合物(PDH)控制[96,97].PDH脱羧丙酮酸形成乙酰辅酶a,这是Kreb循环的底物。PDH的活性在翻译后水平被调节。激酶磷酸化(PDKs)抑制PDH活性,而磷酸酶去磷酸化(pdp)激活复合物[98,99].的Pdk4该基因编码抑制PDH的PDH激酶,在非活性期中期达到最大表达(CT 6.0)。这种表达模式与β-氧化基因的表达模式相似,表明骨骼肌基质偏好在无活性中后期被推动利用脂质而不是碳水化合物。相反,PDH磷酸酶基因,Pdp1,与上述糖酵解酶相比,在活性期的开始(CT 10.0)以类似的时间方式达到峰值。这种暂时的调节Pdp1因此可能有助于增加活性期糖酵解通量。Dyar等.观察到相似的表达模式Pdk4而且Pdp1在骨骼肌中,并首次报告在活动期开始时向碳水化合物利用的转变[43].
Adrb2编码β2-肾上腺素能受体(β2AR)参与外周组织的战斗或逃跑反应[One hundred.,101].激动剂(即儿茶酚胺)结合已被充分证实,可激发细胞信号级联,促进葡萄糖摄取、糖原分解和脂肪分解,为骨骼肌提供现成的能量来源[102-104].Adrb2表达模式与糖酵解激活基因相似,因为它在活性阶段的开始达到峰值。有趣的是,的表达Adrb2与哺乳动物中振荡的肾上腺素浓度相吻合,先前已确定在小鼠模型中活跃期开始时达到峰值[105].g蛋白受体激酶,由Adrbk1,使β磷酸化2AR,从而使其易受受体介导的内吞作用通过β-抑制蛋白编码Arrdc3而且Arrb1[106-108].Adrbk1,Arrdc3,Arrb1都以昼夜节律的方式表达并且与?的表达相反Adrb2.这些观察结果表明,肾上腺素能信号在一天中存在时间差异,骨骼肌对肾上腺素的敏感性可能在活动期最高,而在非活动期之前脱敏。
碳水化合物代谢:参与碳水化合物储存的基因在活动中期/黑暗期达到峰值
过量的碳水化合物以糖原的形式储存在骨骼肌中,约占全身储存量的70 - 80% [109].与肝脏不同,骨骼肌糖原含量不负责维持血糖浓度,而是作为主动收缩的快速能量仓库[110].糖原发生受葡萄糖- 6p浓度和糖原合酶活性的调节[111,112].的基因Ppp1r3c(CT 20.0)在非活性期中期左右达到峰值表达,并编码蛋白磷酸酶-1 (PP-1)的调节亚基,负责激活糖原合成酶,同时抑制糖原分解(图3.) [113].PP-1的酶活性以及随后糖原合成酶的激活在胰岛素信号通路下游受到调控[114].
胰岛素促进合成代谢信号级联,与肾上腺素能信号相反,驱动糖原和脂质储存。先前的报道已经确定了胰岛素受体选择性抑制β的“反调节”作用2AR信号通过磷酸化和随后的受体内化[101,115].有趣的是,编码胰岛素受体底物-1的基因,Irs1(CT 22.0),及其下游的pi3激酶靶点,Pik3r1(CT 19.0),都是昼夜节律的,峰值表达出现在活动后期,而抑制pi3激酶的基因,Pik3ip1(CT 8.0),胰岛素受体底物-1,Fbxo40(CT 5.0),在无活性期达到峰值表达[116,117].这些数据表明,分子钟可能会在活动中期至晚期激活骨骼肌来储存多余的葡萄糖。这一预测得到了先前研究的进一步支持,这些研究报告骨骼肌糖原含量具有昼夜节律,最高水平出现在活动中期[118-120].骨骼肌葡萄糖摄取主要通过质膜(肌膜)和横小管中葡萄糖转运体GLUT4/Slc2a4的存在/不存在来控制。t-SNARE syntaxin-4相互作用蛋白,由Stxbp4,先前已被证明在缺乏胰岛素信号的情况下抑制GLUT4插入质膜[121-123].的基因Tbc1d1编码rabb - gtpase,在缺乏胰岛素或收缩诱导的信号级联时抑制GLUT4易位[124-126].有趣的是,Tbc1d1而且Stxbp4均以昼夜节律的方式表达,并在活动期中期达到峰值表达(CT 19.0)。之前的报告指出Tbc1d1作为骨骼肌和其他组织中的昼夜节律基因[43,127].总之,这些基因产物可能通过抑制GLUT4易位和/或插入质膜在活性期结束时减少葡萄糖摄取中发挥作用。骨骼肌中合成代谢和分解代谢信号过程的短暂分离可能对维持血糖水平的严格调节至关重要,而破坏这一过程可能有助于在时钟突变小鼠模型中经常报道的代谢表型。
诱导骨骼肌特异性小鼠模型的生成Bmal1失活
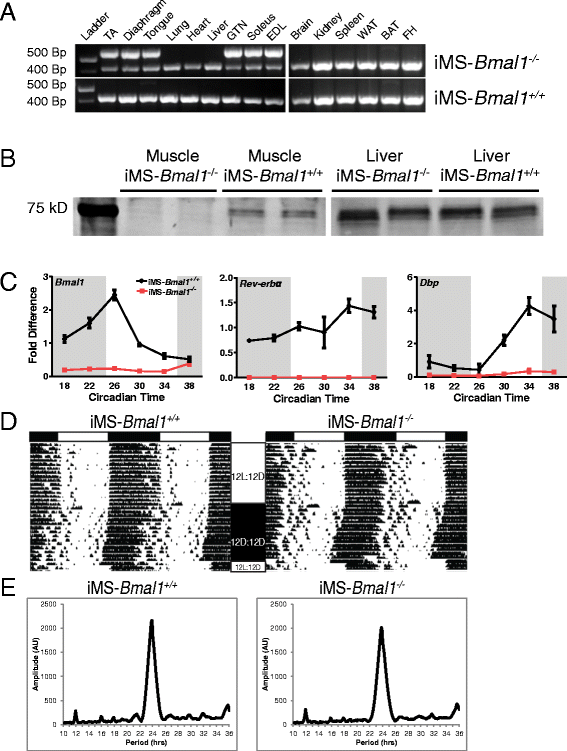
使用高分辨率微阵列数据集可以识别以昼夜节律模式表达的mrna,但这可能是由于内在分子钟,也可能是对外部行为(进食/活动)或神经/体液线索的反应[24,128,129].为了确定内在骨骼肌分子钟在代谢基因表达的时间调节中的作用,我们生成了一个可诱导的小鼠失活模型Bmal1特别是在成人骨骼肌中。在用他莫西芬治疗12周大的成年小鼠后,我们检测到细胞外显子-8(即DNA结合区域)的重组Bmal1基因在骨骼肌中的特异性表达(图4A),确认小鼠模型的组织特异性。我们等到12周龄才限制可能的发育影响,因为BMAL1已被证明能促进肌肉生成[20.,130].如图所示4A,在载体处理小鼠的骨骼肌或非肌肉组织中未检测到重组(iMS-Bmal1+/+).Western blot分析证实了骨骼肌中BMAL1蛋白的缺失Bmal1−−/对肝脏没有影响的小鼠(图4B).他莫西芬引起的损失Bmal1在成人骨骼肌导致显著和预期的基因表达变化涉及核心时钟机制的基因。特别是直接被BMAL1/CLOCK异源二聚体激活的基因,如Rev-erbα,菲律宾,在即时消息中明显下调Bmal1−−/但在即时通讯系统中没有Bmal1+/+样品(图4C).总的来说,这些结果证明了在im -中BMAL1蛋白的有效损失和核心时钟基因表达的破坏Bmal1−−/肌肉组织。
即时通讯的特征Bmal1−−/老鼠。复合试验(一)从他莫昔芬处理的肌肉和非肌肉组织中分离出的基因组DNA (iMS-Bmal1−−/)和车辆处理(iMS-Bmal1+/+) 17 - 18周龄小鼠(注射后5周)。重组Bmal1基因(外显子8)产生572 bp的PCR产物。在431 bp处检测到未重组的等位基因。免疫印迹(B)BMAL1在im中的表达分析Bmal1−−/和iMS -Bmal1+/+肝脏和腓肠肌样本。注意,原始的包含肌肉和肝脏样本的印迹被切割,亮度/对比度被改变,以增强Bmal1在肌肉样本中的可见性。(C)的实时PCR结果Bmal1,Rev-erbα,菲律宾在即时通讯中Bmal1+/+(黑色)和即时消息-Bmal1−−/(红色)。代表性车轮运行节奏(D)iMS -Bmal1−−/和iMS -Bmal1+/+老鼠。白色和黑色条(顶部)表示明暗相位。12 L/12D表示12小时亮/12小时暗的循环。12D/12D表示恒定黑暗条件。标记表示车轮运行活动。代表性卡方周期图(E)iMS -Bmal1−−/和iMS -Bmal1+/+两种小鼠的周期均为24小时左右。
iMS -/ Bmal1−−显示正常的昼夜活动节律
我们使用自愿轮跑来评估im的昼夜节律行为Bmal1小鼠治疗后22 ~ 29周。在12小时光照/12小时黑暗条件下,我们没有检测到im -之间对光的夹带有任何显著差异Bmal1+/+和iMS -Bmal1−−/,在持续黑暗下的活动节律分析没有揭示任何昼夜节律行为的变化(图4D, E)。时钟实验室分析表明,两个im -Bmal1+/+和iMS -Bmal1−−/表现出大约24小时的周期长度(分别为23.85±0.083和23.77±0.138小时),振幅和节律的相对强度没有差异。这些数据与其他研究一致,并证实骨骼肌中BMAL1的失活不会直接改变昼夜节律活动模式[43,131].因此,在该模型中观察到的基因表达变化更可能是骨骼肌内源性分子钟机制的下游。
关键昼夜代谢基因的表达在im -中显著改变Bmal1−−/骨骼肌
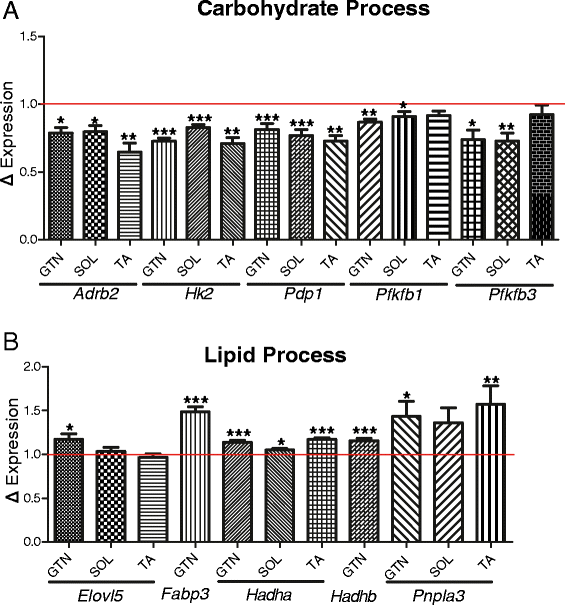
im基因表达分析Bmal1+/+和iMS -Bmal1−−/肌肉组织表明,即使在恒定的条件下,内在的分子钟也在调节碳水化合物和脂质代谢方面发挥作用。我们在联合后5周进行了转录组分析,以确定骨骼肌中由时钟机制缺失引起的早期基因表达变化。在这个时间点分析基因表达也限制了他莫西芬治疗的潜在脱靶效应,允许足够的冲洗期。我们发现参与碳水化合物代谢的昼夜节律基因最容易受到损失的影响Bmal1.糖酵解酶的表达,Pfkfb1,Pfkfb3,Hk2以及PDH磷酸酶,Pdp1都在腓肠肌中显著下调(图5A).此外,肾上腺素能受体的表达,Adrb2,也显著下降。这些基因在骨骼肌中具有令人信服的时钟控制候选者,因为它们具有与已知的时钟控制基因相似的昼夜节律表达模式(在非活性到活性相变期间达到峰值表达),然后它们的表达丢失Bmal1失活表明了时钟对转录的直接调控。通过靶向这些基因,分子钟机制可以精确地调节活跃期碳水化合物利用的时间。在我们的模型中,参与葡萄糖利用的昼夜节律基因减少的观察结果与肌肉特异性一致Bmal1Dyar生成的敲除模型等.他们报告说,他们的肌肉组织中葡萄糖氧化和胰岛素刺激的葡萄糖摄取显著降低[43].
脂质代谢过程似乎作为核辅抑制因子而升高,Nrip1,参与抑制β-氧化的活性随着β-氧化的损失而显著降低Bmal1(大约减少21%,学生的t测验Pvalue = 0.019)。之前的研究表明敲除Nrip1结果腓肠肌琥珀酸脱氢酶染色增加,与向慢氧化纤维类型的转变一致[72].有趣的是,脂肪酸转运体,Fabp3, β-氧化基因,Hadha而且Hadhb,在im -中显著升高Bmal1−−/腓肠肌组织(图5B).参与三酰甘油伸长的两个昼夜节律基因;Pnpla3而且Elovl5,在im -中也有所增加Bmal1−−/.总的来说,我们报告了在骨骼肌代谢的关键调节昼夜节律基因的显著表达变化。我们认为在im -中观察到的基因变化Bmal1−−/骨骼肌中BMAL1/分子钟的下游直接或间接受到调控,而不是由于im中的昼夜节律活动模式等外部线索的变化-Bmal1−−/与车辆处理的对照组难以区分。在im -中,参与碳水化合物和脂质代谢的昼夜节律基因被破坏Bmal1−−/强调在缺乏外部信号的情况下,内在分子钟在骨骼肌基质利用和存储的时间调节中的根本重要性。
iMS -/ Bmal1−−基因表达的变化揭示了纤维类型的快速到缓慢的转变
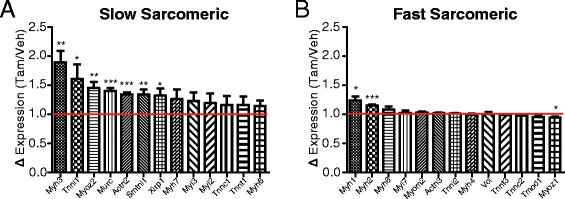
骨骼肌由不同类型的纤维组成,根据收缩功能和主要底物利用来区分[132-135].例如,快速型骨骼肌(IIX/IIB型)主要依赖于无氧代谢(糖酵解/乳酸发酵)产生的ATP来提供短时间爆发活动所需的快速能量来源,而缓慢型骨骼肌和快速型IIA肌则依赖于氧化代谢来促进更持久和更不容易疲劳的收缩。我们分析了与纤维类型相关的基因表达变化Bmal1成人骨骼肌消融,包括昼夜节律和非昼夜节律转录本。我们发现腓肠肌中慢型肌群基因选择性增加,而对快型肌群基因影响有限(图6A、B)。我们选择了“慢”和“快”肌纤维基因的列表,因为这些基因已被证明在慢比目鱼和快edl肌纤维制剂中显著富集[136].此外,钙处理基因和核受体在慢纤维肌肉(例如,Casq2,Atp2a2,Ankrd2,Csrp3。)在im -中显著增加Bmal1−−/(表1).与昼夜节律代谢基因观察到的变化相似,我们发现参与碳水化合物代谢的非昼夜节律代谢基因显著减少,而参与脂质代谢的基因则增加(表2)2而且3.).这种从快纤维型到慢纤维型mRNA谱的转换与观察到的代谢变化是一致的,因为与快纤维型骨骼肌相比,慢纤维型肌肉更依赖氧化代谢。
结论
在这里,我们报道了内在分子钟调节参与骨骼肌底物分解代谢和合成代谢过程的基因的时间。我们已经确定了不活动中期是脂肪酸分解相关基因的峰值表达时间,可能是一夜禁食期间骨骼肌的主要能量来源。调节糖酵解和进入克雷伯循环的糖酵解通量的基因的时间表达模式表明,在早期活性期,底物利用从脂类转移到碳水化合物,这在其他肌肉特异性中已被记录Bmal1敲除模型[43].我们观察到参与葡萄糖和脂质储存的基因在活性期结束时达到峰值表达,我们预测在吸收后阶段储存多余的能量以供使用。即时通讯时间过程数据的表达式分析Bmal1−−/骨骼肌显示,在缺乏BMAL1的情况下,一些关键的昼夜代谢基因表达差异。这些发现表明,这些基因的时间调节和昼夜节律性是内在骨骼肌分子钟机制的直接下游。最后,我们观察到一个基因表达谱,表明糖酵解到氧化纤维类型的转变与损失Bmal1在成人肌肉组织中。这些发现表明一种潜在的未知作用Bmal1维持快速型肌纤维,可能通过葡萄糖处理的直接转录调节。据广泛报道,衰老与快速型骨骼肌纤维的选择性丧失有关[137,138].此外,衰老还与分子钟的稳健性下降有关[139,140].这些观察结果提出了一种可能性,即由快到慢的纤维型转变可能是随着年龄增长而使分子钟受到阻尼的结果。
缩写
- Acaa2:
-
乙酰辅酶A酰转移酶2
- Acaca:
-
乙酰辅酶A羧化酶
- Acadm:
-
酰基辅酶A脱氢酶,中链
- 交流:
-
ATP柠檬酸裂解酶
- Acot7:
-
酰基辅酶a硫酯酶7
- Acot9:
-
酰基辅酶a硫酯酶9
- Acsl1:
-
酰基辅酶a合成酶长链家族成员1
- Acsl5:
-
酰基辅酶a合成酶长链家族成员5
- Actn2:
-
肌动蛋白2
- Actn3的基因:
-
肌动蛋白3
- Adrb2:
-
β2-adrenergic受体
- Adrbk1:
-
肾上腺素能受体激酶,β 1
- 榴弹炮:
-
amylo-1、6-glucosidase 4-alpha-glucanotransferase
- Agpat3:
-
1-酰基甘油-3-磷酸o -酰基转移酶
- Akt1:
-
胸腺瘤病毒原癌基因1
- Ankrd2:
-
锚蛋白重复结构域2(拉伸反应性肌肉)
- Arrb1:
-
抑制素,β 1
- Arrdc3:
-
止动域包含3
- Atp2a1:
-
atp酶,ca2 +转运,心肌,快速抽搐
- Atp2a2:
-
atp酶,ca2 +转运,心肌,慢抽搐2
- 蝙蝠:
-
棕色脂肪组织
- bHLH:
-
基本helix-loop-helix
- Bhlhe40:
-
基本的螺旋-环-螺旋族,成员为e40
- Bmal1:
-
大脑和肌肉arnt样1
- Calm3:
-
钙调蛋白3
- Casq1:
-
隐钙素1
- Casq2:
-
隐钙素2
- Cd36:
-
脂肪酸转位酶
- 互补脱氧核糖核酸:
-
互补脱氧核糖核酸
- 钟:
-
昼夜运动输出周期中断
- 辅酶a:
-
辅酶A
- Cox5a:
-
细胞色素c氧化酶亚单位Va
- Cox6a1:
-
细胞色素c氧化酶亚基VIa多肽1
- Cpt2:
-
肉碱棕榈酰转移酶2
- Csrp3:
-
富含半胱氨酸和甘氨酸的蛋白3
- CT:
-
昼夜时间
- DAG:
-
甘油二酯
- 菲律宾:
-
D位点白蛋白启动子结合蛋白
- 弟弟:
-
黑/黑
- Dgat1:
-
二酰基甘油o -酰基转移酶
- Ech1:
-
烯酰辅酶A水合酶1
- 联盟:
-
指长伸肌
- Elovl5:
-
ELOVL家族成员5,长链脂肪酸伸长
- Esrra:
-
雌激素相关受体
- Fabp1:
-
脂肪酸结合蛋白1
- Fabp3:
-
脂肪酸结合蛋白3
- Fabp4:
-
脂肪酸结合蛋白4
- Fabp5:
-
脂肪酸结合蛋白5
- Fads2:
-
脂肪酸去饱和酶2
- Fasn:
-
脂肪酸合成酶
- Fbxo40:
-
F-box蛋白40
- FH:
-
股骨头
- GTN:
-
腓肠肌
- Fhl1:
-
4个半LIM结构域
- Hadha:
-
烯酰辅酶A水合酶(三功能蛋白),α亚基
- Hadhb:
-
烯酰辅酶A水合酶(三功能蛋白),β亚基
- HDAC3:
-
组蛋白去乙酰化酶3
- Hk2:
-
hexokinase-2
- Il15:
-
白介素15
- iMS-Bmal1:
-
诱导骨骼肌特异性Bmal1
- Irs1:
-
胰岛素受体底物-1
- Itpr1:
-
肌醇1,4,5-三磷酸受体1
- JTK_CYCLE:
-
Jonckheer-Terpstra-Kendall循环算法
- LD:
-
光明/黑暗
- Ldhb:
-
乳酸脱氢酶B
- Ndufa8:
-
NADH脱氢酶(泛醌)1 α亚复合物,8
- 摘要:
-
lysophosphatidic酸
- Lpin1:
-
油脂1
- Mlxip:
-
MLX相互作用蛋白
- Mlycd:
-
malonyl-CoA脱羧酶
- Murc:
-
肌肉相关的盘绕蛋白
- Myh1:
-
肌球蛋白,重多肽1,骨骼肌,成人
- Myh2:
-
肌球蛋白,重多肽2,骨骼肌,成人
- Myh3:
-
肌球蛋白,重多肽3,骨骼肌,胚胎
- Myh4:
-
肌球蛋白,重多肽4,骨骼肌
- Myh6:
-
肌球蛋白,重多肽6,心肌,α
- Myh7:
-
肌球蛋白,重多肽7,心肌,β
- Myh8:
-
肌球蛋白,重多肽8,骨骼肌
- Myl2:
-
肌球蛋白,轻多肽2,调节,心脏,缓慢
- Myl3:
-
肌球蛋白,轻多肽3
- Myl7:
-
肌球蛋白,轻多肽7,调节
- Myom2:
-
myomesin 2
- Myoz1:
-
myozenin 1
- Myoz2:
-
myozenin 2
- NCBI地理:
-
国家生物技术信息基因表达综合中心
- Ndufb8:
-
NADH脱氢酶(泛醌)1 β亚复合物8
- Nfatc2:
-
活化T细胞的核因子,细胞质,钙调神经磷酸酶依赖2
- Nrip1:
-
核受体相互作用蛋白1
- PA:
-
磷脂酸
- Pak1:
-
p21蛋白(Cdc42/Rac)活化激酶1
- 聚合酶链反应:
-
聚合酶链反应
- PDH:
-
丙酮酸脱氢酶复合物
- 此后:
-
丙酮酸脱氢酶激酶
- Pdk4:
-
丙酮酸脱氢酶激酶同工酶4
- Pdlim1:
-
PDZ和LIM域1
- PDP:
-
丙酮酸脱氢酶磷酸酶
- Pdp1:
-
丙酮酸脱氢酶磷酸酶催化亚基1
- PFK2:
-
phosphofructokinase-2
- Pfkfb1:
-
6-phosphofructo-2-kinase / fructose-2 6-biphosphatase 1
- Pfkfb3:
-
6-phosphofructo-2-kinase / fructose-2 6-biphosphatase 3
- Pfkfb4:
-
6-phosphofructo-2-kinase / fructose-2 6-biphosphatase 4
- Pfkm:
-
phosphofructokinase-1
- Pgm2:
-
phosphoglucomutase 2
- Phka1:
-
磷酸化酶激酶1
- Pik3ip1:
-
磷酸肌醇-3-激酶相互作用蛋白1
- Pik3r1:
-
磷脂酰肌醇3-激酶,调节亚基,多肽1 (p85 α)
- Plin5:
-
perilipin 5
- Pnpla3:
-
Patatin-like磷脂酶结构域含有3
- PP-1:
-
蛋白质phosphatase-1
- Ppargc1b:
-
过氧化物酶体增殖激活受体,γ,辅激活因子1 β
- Ppara:
-
过氧化物酶体增殖物激活受体
- Pparδ:
-
过氧化物酶体增殖激活物受体
- Ppargc1a:
-
过氧化物酶体增殖激活受体,共激活因子1 α
- Ppp1r3c:
-
蛋白磷酸酶1,调节(抑制剂)亚基3C
- Prkab2:
-
蛋白激酶,amp激活,β 2非催化亚基
- Prkag2:
-
蛋白激酶,amp活化,γ 2非催化亚基
- Prkag3:
-
蛋白激酶,amp激活,γ 3非催化亚基
- Pvalb:
-
小清蛋白
- Rab10:
-
RAB10, RAS癌基因家族成员
- Rev-erbα:
-
核受体亚家族1,D组,成员1
- RORE:
-
REV-ERB响应元件
- Scd1:
-
硬脂酰辅酶A去饱和酶
- Sdhc:
-
琥珀酸脱氢酶复合物,亚基C,整体膜蛋白
- Sdhd:
-
琥珀酸脱氢酶复合物,亚基D,整体膜蛋白
- sds - page:
-
十二烷基硫酸钠-聚丙烯酰胺凝胶电泳
- Slc25a20:
-
溶质载体家族25(线粒体肉碱/酰基肉碱转位酶)
- Slc2a3:
-
溶质载体家族2(葡萄糖转运体),成员3
- Smtnl1:
-
smoothelin-like 1
- Sos2:
-
7 -同系物2的子
- Srebf1:
-
固醇调节元件结合转录因子1
- Srebf2:
-
固醇调节元件结合因子2
- Stxbp4:
-
Syntaxin结合蛋白4
- 助教:
-
胫骨前
- 标签:
-
三酰甘油
- Tbc1d1:
-
TBC1域族,成员1
- Tmod1:
-
tropomodulin 1
- Tnnc1:
-
肌钙蛋白C,心脏/慢骨骼
- Tnnc2:
-
肌钙蛋白C2,快
- Tnni1:
-
肌钙蛋白I,骨骼,慢1
- Tnni2:
-
肌钙蛋白I,骨骼,快2
- Tnnt1:
-
肌钙蛋白T1,骨骼,缓慢
- Tnnt3:
-
肌钙蛋白T3,骨骼,快
- Uqcr10:
-
泛醇-细胞色素c还原酶,复合体III亚基X
- Vcl:
-
vinculin
- 窟:
-
白色脂肪组织
- Xirp1:
-
Xin肌动蛋白结合重复包含1
参考文献
正常哺乳动物骨骼肌及其表型可塑性。中国生物医学工程学报(英文版);2002;
Zurlo F, Larson K, Bogardus C, Ravussin E.骨骼肌代谢是静息能量消耗的主要决定因素。《投资管理》,1990;86:1423-7。
王志刚,王志刚。运动代谢与骨骼肌适应的分子调控。《生物医学杂志》,2013;17:162-84。
张志刚,张志刚,张志刚,等。骨骼肌的结构与功能综述:钙化组织杂志。2014。
拉尔农协。骨骼肌收缩的能量方面:纤维类型的影响。运动科学,1985;13:33-74。
Defronzo RA, Simonson D, Ferrannini E, Barrett E.胰岛素抵抗:糖尿病状态下的普遍发现。Bull Schweiz Akad Med Wiss, 1981-1982:223- - - - - -238.
Ferrannini E, Simonson DC, Katz LD, Reichard Jr G, Bevilacqua S, Barrett EJ,等。非胰岛素依赖型糖尿病患者口服葡萄糖负荷的处理。新陈代谢。1988;37:79 - 85。
Green HJ, Helyar R, Ball-Burnett M, Kowalchuk N, Symon S, Farrance B.对训练的代谢适应先于肌肉线粒体容量的变化。中国生物医学工程学报。1992;42(2):344 - 344。
Benziane B, Burton TJ, Scanlan B, Galuska D, Canny BJ, Chibalin AV,等。短期强化耐力训练后人体骨骼肌细胞信号的分化。中华内分泌杂志。2008;29(2):344 - 344。
Jeukendrup AE。骨骼肌脂肪代谢的调节。南京大学学报(自然科学版)2002;
McCarthy JJ, Esser KA。调节骨骼肌质量的合成代谢和分解代谢途径。临床健康护理杂志,2010;13:230-5。
Pilegaard H, Saltin B, Neufer PD。短断食与复食对人骨骼肌代谢基因转录调控的影响。糖尿病。2003;52:657 - 62。
罗明杰,李志强,李志强,等。内源性脂肪和碳水化合物代谢的调节与运动强度和持续时间的关系。中华医学杂志,1993;29(2):329 - 329。
van Loon LJ, Greenhaff PL, Constantin-Teodosiu D, Saris WH, Wagenmakers AJ。增加运动强度对人体肌肉燃料利用的影响。中国生物医学工程学报,2001;
张志刚,张志刚,张志刚。胰岛素与肠促胰岛素在骨骼肌代谢调控中的作用机制。Curr Diabetes rev 2014; 10:327-35。
Gaitanos GC, Williams C, Boobis LH, Brooks S.间歇性最大运动时人体肌肉代谢。中国生物医学工程学报(英文版),1993;
高CH,高桥JS。哺乳动物生物钟的分子成分。Hum Mol Genet. 2006;15规格2:R271-7。
傅原,李志刚。外周昼夜节律振荡及其节律调节。生物科学进展。2003;8:d642-51。
阿玛拉尔·叶,约翰斯顿IA。斑马鱼骨骼肌中时钟和假定的时钟控制基因的昼夜节律表达。中国生物医学工程学报。2012;32:R193-206。
andrew JL, Zhang X, McCarthy JJ, McDearmon EL, Hornberger TA, Russell B,等。CLOCK和BMAL1调节MyoD,是维持骨骼肌表型和功能所必需的。中国科学院学报(自然科学版)2010;
杜德克M,孟QJ。准时运行:生物钟在肌肉骨骼系统中的作用。生物化学学报。2014;43:1 - 8。
Lazado CC, Kumaratunga HP,长泽K, Babiak I, Giannetto A, Fernandes JM。大西洋鳕鱼快速骨骼肌中时钟基因转录本的每日节律性。科学通报,2014;9,e99172。
Murphy BA, Wagner AL, McGlynn OF, Kharazyan F, Browne JA, Elliott JA。运动影响马骨骼肌昼夜节律基因表达。兽医学报。2014;201:39-45。
施罗德EA,艾塞尔KA。昼夜节律,骨骼肌分子钟,还有运动。运动运动科学,2013;41:24 24 - 9。
Squarcini CF, Pires ML, Lopes C, beneditto - silva AA, Esteves AM, cornelisen - guillaume G,等。完全失明的人肌肉力量、反应时间和体温的自由昼夜节律。中国生物医学工程学报。2013;13(2):326 - 326。
沃尔夫G,邓肯MJ,艾塞尔KA。慢性相位提前改变昼夜生理节律和外周分子钟。中国生物医学工程学报,2013;
代谢的昼夜拓扑。大自然。2012;491:348-56。
柯伦奇,李志刚,李志刚,李志刚。哺乳动物组织中昼夜节律基因的研究进展。科学通报2014;4:5782。
何建平,顾永泽,陈志明,等。甲基-螺旋-环-螺旋- pas孤儿蛋白MOP3与昼夜节律和缺氧因子形成转录活性复合物。中国科学院学报(自然科学版)1998;
Lee C, Etchegaray JP, Cagampang FR, Loudon AS, Reppert SM。翻译后机制调节哺乳动物的生物钟。细胞。2001;107:855 - 67。
Lowrey PL,高桥JS。哺乳动物昼夜生物学:阐明时间组织的全基因组水平。中国生物医学杂志,2004;5:407-41。
Rudic RD, McNamara P, Curtis AM, Boston RC, Panda S, Hogenesch JB,等。BMAL1和CLOCK是生物钟的两个重要组成部分,参与葡萄糖稳态。《公共科学图书馆·生物学》2004;2,e377。
Shimba S, Ishii N, Ohta Y, Ohno T, Watabe Y, Hayashi M,等。脑和肌肉的arnt样蛋白-1 (BMAL1)是分子钟的组成部分,调节脂肪的形成。中国科学院学报(自然科学版),2005;
杜瑞克,乔舒C, Kohsaka A,林E, Ivanova G, McDearmon E,等。生物钟突变小鼠的肥胖和代谢综合征。科学。2005;308:1043-5。
潘旭,张勇,王玲,Hussain MM. SHP介导CLOCK对MTP和血浆甘油三酯的日调节作用。细胞医学杂志,2010;12:174-86。
Shimba S, Ogawa T, Hitosugi S, Ichihashi Y, Nakadaira Y, Kobayashi M,等。缺乏时钟基因,大脑和肌肉arnt样蛋白-1 (BMAL1),诱导血脂异常和异位脂肪形成。《公共科学杂志》2011;6,e25231。
冯东,王峰,李志强,王峰,等。Rev-erbalpha和Rev-erbbeta协同保护生物钟和正常代谢功能。基因工程学报2012;26:657-67。
赵浩,赵旭,M Hatori,于涛,Barish GD, Lam MT,等。rev - erb - α和rev - erb - β调节昼夜节律行为和代谢。大自然。2012;485:123-7。
Lamia KA, Storch KF, Weitz CJ。外周组织生物钟的生理意义。中国科学院学报(自然科学版),2008;
Bray MS,年轻的我。细胞特异性生物钟在代谢和疾病中的作用。Obes Rev. 2009;10 Suppl 2:6-13。
马彻瓦,马志强,张志强,张志强,等。时钟成分clock和BMAL1的破坏会导致低啡肽血症和糖尿病。大自然。2010;466:627-31。
潘卓,宋伟强,郭田,葛兰,等。脂肪细胞特异性时钟成分Arntl缺失小鼠的肥胖。2012; 18:1768-77。
Dyar KA, Ciciliot S, Wright LE, Bienso RS, Tagliazucchi GM, Patel VR,等。肌肉的胰岛素敏感性和葡萄糖代谢是由内在的肌肉时钟控制的。Mol Metab. 2014; 3:29-41。
吴刚,朱军,于军,周玲,黄建忠,张忠。全基因组昼夜节律基因鉴定的五种方法评价。中国生物医学杂志,2014;29:231-42。
皮萨罗A,海耶K,拉亨斯NF,霍根施杰JB。CircaDB:哺乳动物昼夜基因表达谱数据库。核酸研究,2013;41:D1009-13。
张r, Lahens NF, balance HI, Hughes ME, Hogenesch JB。哺乳动物的昼夜基因表达图谱:生物学和医学意义。中国科学院学报(自然科学版),2014;
Hughes ME, Hogenesch JB, Kornacker K. JTK_CYCLE:一种高效的非参数算法,用于检测基因组尺度数据集中的节奏成分。中国生物医学杂志,2010;25:32 - 80。
Ashburner M, Ball CA, Blake JA, Botstein D, Butler H, Cherry JM,等。基因本体论:生物学统一的工具。基因本体论联盟。2000;25:25-9。
米H,董q, Muruganujan A, Gaudet P, Lewis S, Thomas PD。PANTHER版本7:改进的系统发育树、直方图和与基因本体联盟的合作。核酸研究,2010;38:D204-10。
张晓东,张晓东,李晓东,等。哺乳动物视网膜的内在生物钟:视网膜处理视觉信息的重要性。细胞。2007;130:730-41。
McCarthy JJ, Srikuea R, Kirby TJ, Peterson CA, Esser KA。可诱导的Cre转基因小鼠骨骼肌特异性基因靶向。《骨骼肌》2012;2:8。
Pfeiffenberger C, Lear BC, Keegan KP, Allada R.处理从果蝇活动监测(DAM)系统收集的昼夜节律数据。冷泉港协议。2010;2010:pdb.prot5519。
McCarthy JJ, Andrews JL, McDearmon EL, Campbell KS, Barber BK, Miller BH,等。成年小鼠骨骼肌昼夜转录组的鉴定。物理基因组学,2007;31:86-95。
张建平,李志强,张志强,等。垂体基因表达的高分辨率时间过程分析。中国生物医学工程学报,2007;
王玲,李玲,蒋娟,王勇,钟涛,陈勇,等。山羊骨骼肌发育过程中FABP基因家族的分子特征和不同表达模式:Mol Biol Rep. 2014。
Malik ZA, Cobley JN, Morton JP, Close GL, Edwards BJ, Koch LG,等。骨骼肌的无标签LC-MS分析显示心脏型脂肪酸结合蛋白是有氧能力的候选生物标志物。中国科学院学报(自然科学版),2013;
李志刚,李志刚,李志刚,李志刚,等。脂肪酸结合蛋白4和5 (FABP4/5)在禁食的全身反应中的关键作用。科学通报,2013;8,e79386。
李志刚,李志刚,李志刚。脂肪功能的昼夜节律调节。脂肪细胞。2013;2:201-6。
Gooley JJ, Chua EC。脂质代谢的日调节及昼夜脂质组学的应用。中国基因工程学报,2014;
Minami Y, Kasukawa T, Kakazu Y, Iigo M,杉本M,池田S,等。用血液代谢组学测量体内时间。中国科学院学报(自然科学版)2009;
阿米尔F,斯坎迪兹L, Hasnain S, Kalbacher H, Zaidi N.新生脂肪生成的健康与疾病。新陈代谢。2014;63:895 - 902。
Indiveri C, Iacobazzi V, Tonazzi A, Giangregorio N, Infantino V, Convertini P,等。线粒体肉碱/酰基肉碱载体:功能、结构和生理病理。《医学杂志》2011;32:23 - 33。
在新生猪骨骼肌线粒体中,肉碱棕榈酰转移酶I (CPT I)活性及其丙二酰coa的调控受年龄和冷暴露的调节。张志军。1998;28(3):366 - 366。
Saggerson D. Malonyl-CoA,哺乳动物细胞中的关键信号分子。《营养学》,2008;28:253-72。
李志刚,李志刚,李志刚。核受体与代谢的关系。物理学报。2003;65:261-311。
范伟,李文杰,李文杰,等。线粒体代谢的分子介质。中国生物医学工程杂志。2014;33C: 49-54。
杨旭,Downes M, Yu RT, Bookout AL, He W, Straume M,等。核受体表达将生物钟与新陈代谢联系在一起。细胞。2006;126:801-10。
Sonoda MT, Martinez L, Webb P, Skaf MS, Polikarpov I.配体与雌激素受体的分离是由受体二聚体介导的:来自分子动力学模拟的证据。《Mol Endocrinol》2008;22:1565-78。
杨x, Lamia KA, Evans RM。核受体,新陈代谢和生物钟。《生物工程学报》,2007;42(2):387 - 94。
Kressler D, Schreiber SN, Knutti D, Kralli a. pgc -1相关蛋白PERC是雌激素受体α的选择性共激活剂。中国生物化学杂志,2002;
芬克BN,凯利DP。PGC-1共激活因子:健康和疾病中能量代谢的诱导调节因子。《临床投资杂志》2006;116:615-22
Seth A, Steel JH, Nichol D, Pocock V, Kumaran MK, Fritah A,等。转录辅抑制因子RIP140调节骨骼肌氧化代谢。Cell Metab, 2007; 6:236-45。
Constantinescu S, Turcotte LP。受体相互作用蛋白140的基因下调揭示了Akt信号在骨骼肌细胞脂肪酸氧化调控中的核心作用。中国生物医学工程学报,2013;
Fritah A, Christian M, Parker MG。代谢协调节因子RIP140:最新进展中华内分泌杂志。2010;29(2):366 - 366。
核受体辅抑制因子RIP140对骨骼肌代谢特性的控制。中国生物医学工程学报。2009;34(4):366 - 366。
Funai K, Semenkovich CF.骨骼肌脂质通量:自来水无毒。中国生物医学杂志,2011;31(2):344 - 344。
硬脂酰辅酶A去饱和酶在骨骼肌代谢调节中的新参与者。《物理药物学杂志》2006;57增刊10:31-42。
Ntambi JM, Miyazaki M.硬脂酰辅酶a去饱和酶-1的最新见解。柯尔。欧平。利比多。2003;14:255-61。
肝脏能量代谢。Compr Physiol. 2014; 4:177-97。
Dentin R, Girard J, Postic C.碳水化合物反应元件结合蛋白(ChREBP)和固醇调节元件结合蛋白-1c (SREBP-1c):肝脏中糖代谢和脂质合成的两个关键调节因子。Biochimie。2005;87:81-6。
Brewer M, Lange D, Baler R, Anzulovich a . SREBP-1作为肝脏昼夜节律和营养线索的转录整合器。中华生物医学杂志2005;20:195-205。
松本E,石原A,田井S, Nemoto A,岩濑K, Hiwasa T,等。每天喂食的时间和营养素控制着小鼠肝脏中固醇调节元件结合蛋白(SREBP)-1基因的日常表达节律。中国生物医学工程学报。2010;
松本K,横山。消胆胺治疗的2型糖尿病模型小鼠肝脏的基因表达分析。生物医学,2010;64:373-8。
Gilardi F, Migliavacca E, Naldi A, Baruchet M, Canella D, Le Martelot G,等。对SREBP1昼夜活动的全基因组分析揭示了它对营养和昼夜节律信号的综合依赖。公共科学图书馆,2014;10,e1004155。
库玛丽,肖iswohl G, Chitraju C, Paar M, Cornaciu I, Rangrez AY,等。脂素是一种营养调节溶血磷脂酸酰基转移酶。《生物医学杂志》2012;15:691-702。
脂质代谢与Lipin 1的关系。日本,2011;131:1189-94。
甘油三酯合成中GPAT、AGPAT和脂素酶的生物化学、生理和遗传学。中华内分泌杂志,2009;29(2):366 - 366。
Yen CL, Stone SJ, kooliwad S, Harris C, Farese Jr RV。专题回顾系列:甘油脂类。DGAT酶与三酰甘油生物合成。《油脂杂志》2008;49:2283-301。
Jakobsson A, Westerberg R, Jacobsson A.脂肪酸延长酶在哺乳动物:他们的调节和代谢的作用。Prog血脂Res. 2006; 45:37 - 49。
Bu SY, Mashek DG。肝脏长链酰基辅酶a合成酶5介导脂肪酸在合成代谢和分解代谢途径之间的通道。中华医学会杂志,2010;
快速浏览一下生物化学:碳水化合物代谢。中国生物化学杂志。2013;46:1339-52。
Vogt C, Ardehali H, Iozzo P, Yki-Jarvinen H, Koval J, Maezono K,等。己糖激酶II在人骨骼肌体内表达的调控。新陈代谢。2000;49:814-8。
在脊椎动物肌肉中糖酵解的关键调节酶磷酸果糖激酶的不同激活模式。生物化学学报,2002;30:264-70。
王志刚,王志刚,王志刚。水蛙骨骼肌中果糖2,6-二磷酸和糖酵解通量。FEBS Lett, 1990; 267:257-60。
骨骼肌提取物中的果糖2,6-二磷酸和糖酵解振荡。《生物化学杂志》1988;
Spriet LL, Heigenhauser GJ。运动时人体骨骼肌丙酮酸脱氢酶(PDH)活性的调节。运动科学,2002;30:91-5。
Harris RA, Bowker-Kinley MM,黄波,吴平。丙酮酸脱氢酶复合物活性的调控。中国农业大学学报(自然科学版),2002;
霍妮斯。MJ。可逆磷酸化对丙酮酸脱氢酶复合物活性的调控。生物化学学报,2003;31:1143-51。
范杰,康海波,单春,Elf S,林荣,谢杰,等。tir -301磷酸化通过阻断底物结合抑制丙酮酸脱氢酶,促进Warburg效应。中国生物医学工程学报。2014;29(2):344 - 344。
Emrick MA Sadilek M Konoki K, Catterall WA。β -肾上腺素能调节磷酸化骨骼肌Ca(V)1.1通道的战斗或逃跑反应。中国科学院学报(自然科学版)2010;107:18712-7。
Mandic M, Drinovec L, Glisic S, Veljkovic N, Nohr J, Vrecl M.通过BRET和生物信息学证明β - 2肾上腺素能受体和胰岛素受体之间的直接相互作用。科学通报。2014;9,e112664。
赖永春。胰岛素、运动、肾上腺素对肌糖原合成酶磷酸化和运动特性的调节及其在胰岛素抵抗中的作用。生物化学学报。2009;115:13-21。
张丽娟,张丽娟,张丽娟,等。β(2)-肾上腺素能受体通过GPCR激酶位点增加GLUT4易位。中国药理学杂志,2012;
Boyda HN, Procyshyn RM, Pang CC, Barr AM。外周肾上腺素受体:葡萄糖失调和胰岛素抵抗背后的推动力。神经内分泌杂志。2013;25:17 - 28。
李,唐豪尔,傅丽玲,刘志刚,刘志刚,刘志刚。小鼠交感神经信号的昼夜稳态紊乱促进肿瘤的发生。科学通报,2010;5,e10995。
臼井I,今村T,佐藤H,黄娟,Babendure JL,于斐CJ,等。GRK2是葡萄糖转运刺激胰岛素信号通路的内源性蛋白抑制剂。中国农业科学,2004;23:2821-9。
Patwari P, Lee RT.一个扩大的抑制因子家族调节代谢。内分泌代谢杂志2012;23:216-22。
韩秀珍,韩秀珍。β-抑制素2和含有抑制素结构域的蛋白在β2肾上腺素能受体转运中的不同作用。EMBO代表2013;14:164-71。
王sc,马斯喀特GE。核受体和表观遗传信号:骨骼肌糖原代谢的新调控因子。IUBMB Life. 2013; 65:657-64。
杨永强,李国强,李国强。骨骼肌糖原分解对运动调节胰岛素敏感性的作用。《前沿物理》2011;2:12 2。
Villar-Palasi C, Guinovart JJ。葡萄糖6-磷酸在糖原合成酶控制中的作用。王晓明,王晓明,1997;11:544-58。
Halse R, Bonavaud SM, Armstrong JL, McCormack JG, Yeaman SJ。糖原合成的控制葡萄糖,糖原和胰岛素在培养的人肌肉细胞。糖尿病。2001;50:720-6。
蒙托利-格劳M,吉塔特M,加西亚-马丁内斯C,奥罗斯科A,戈麦斯-福瓦AM。与PPP1R3C和PPP1R3A相比,骨骼肌细胞中蛋白磷酸酶1糖原靶向亚基PPP1R6过表达后糖原积累的差异模式。BMC生物化学,2011;12:57。
布雷迪,MJ, Saltiel AR.蛋白磷酸酶-1在胰岛素作用中的作用。最近Prog Horm Res. 2001; 56:157-73。
Baltensperger K, Karoor V, Paul H, Ruoho A, Czech MP, Malbon CC. β -肾上腺素能受体是胰岛素受体酪氨酸激酶的底物。《生物化学杂志》1996;271:1064 - 4。
潘志伟,王志强,王志强,等。肌肉萎缩的基础研究进展。国际心血管杂志。2014;176:640-4。
史俊,罗林,艾希杰,Ibebunjo C, Glass DJ。SCF-Fbxo40复合物在骨骼肌中诱导IRS1泛素化,限制IGF1信号通路。开发单元。2011;21:835-47。
Leighton B, Cooper GJ。胰胰淀素和降钙素基因相关肽引起骨骼肌胰岛素抵抗。大自然。1988;335:632-5。
李志强,李志强,李志强,等。大鼠比目鱼肌葡萄糖代谢对胰岛素敏感性的昼夜节律。中华医学杂志。1988;25:E41-5。
李志刚,李志刚,李志刚,李志刚。腺苷脱氨酶对大鼠肌肉葡萄糖转运、糖酵解和糖原合成敏感性的影响。《生物化学》1988;20:23-7。
李文杰,李文杰,李文杰,等。Synip:一种新的胰岛素调节合成素4结合蛋白,介导脂肪细胞中的GLUT4易位。化学学报,1999;3:751-60。
冈田S,大岛K,上原Y,清水H,桥本K,山田M,等。胰岛素刺激的Glut4易位需要Synip磷酸化。生物化学生物物理研究,2007;36:102 - 6。
斋藤T,冈田S,野原A,大谷Y,大崎A, Oh IS,等。Syntaxin4相互作用蛋白(Synip)结合磷脂酰肌醇(3,4,5)三磷酸。《公共科学杂志》2012;7,e42782。
安D,丰田T,泰勒EB,于H,藤井N,赫什曼MF,等。TBC1D1在小鼠骨骼肌中调节胰岛素和收缩诱导的葡萄糖运输。糖尿病。2010;59:1358 - 65。
Cartee GD。TBC1D1和TBC1D4在胰岛素和运动刺激下骨骼肌葡萄糖转运中的作用Diabetologia。2015;58:19-30。
Szekeres F, Chadt A, Tom RZ, Deshmukh AS, Chibalin AV, Bjornholm M,等。rabb - gtpase激活蛋白TBC1D1调节骨骼肌葡萄糖代谢。中华内分泌杂志。2012;03:E524-33。
闫娟,王辉,刘勇,邵晨。哺乳动物昼夜节律基因调控网络分析。科学通报。2008;4,e1000193。
哈夫曼BD,施罗德EA,艾瑟KA。昼夜节律,分子钟和骨骼肌。生物节律杂志,2014。
Cermakian N, Sassone-Corsi P.生物钟的多层调节。细胞生物学,2000;1:59-67。
郭波,郭志明,郭志明,李俊,等。Arnt-like 1是肌肉形成的关键调节因子。中国生物医学工程学报,2013;
McDearmon EL, Patel KN, Ko CH, Walisser JA, Schook AC, Chong JL,等。哺乳动物时钟蛋白BMAL1在小鼠组织特异性救援中的功能分析。科学。2006;314:1304-8。
哺乳动物骨骼肌中的纤维类型。物理学Rev. 2011; 91:1447-531。
张晓明,李志强,张晓明。骨骼肌表型调控机制的研究进展。《Compr Physiol》2013;3:1645-87。
Pette D.骨骼肌纤维的适应潜力。应用物理学报。2002;27:423-48。
杰拉斯JR,霍利JA。骨骼肌纤维类型:对收缩和代谢特性的影响。《公共科学图书馆·生物学》2004;2,e348。
Chemello F, Bean C, Cancellara P, Laveder P, Reggiani C, Lanfranchi G.骨骼肌中的微基因组分析:个体快、慢肌纤维的表达特征。科学通报,2011;6,e16807。
陈晓明,陈晓明,陈晓明,陈晓明。衰老对II型肌纤维的影响:文献综述。老年物理法案。2007;15:336-48。
Purves-Smith FM, Sgarioto N, Hepple RT.老化肌肉中的纤维分型。运动科学,2014;42:45-52。
Wyse CA, Coogan AN。衰老对小鼠大脑中CLOCK和BMAL1日表达模式的影响。Brain res 2010; 1337:21-31。
康德拉托夫RV,康德拉托娃AA,戈尔巴乔夫VY,维霍瓦涅茨OV,安托赫MP。缺乏BMAL1(生物钟的核心组成部分)的小鼠的早期衰老和与年龄相关的病理。基因开发,2006;20:1868-73。
确认
作者要感谢John Hogenesch提供的骨骼肌昼夜转录组数据。我们要感谢约翰·麦卡锡在数据分析方面的智力支持。我们要感谢谭雅·苏厄德对老鼠群落的培育和维护。我们要感谢Trusha Mehta为收集和分析小鼠活动数据所做的贡献。我们要感谢唐娜·沃尔和肯塔基大学的微阵列核心设施进行了微阵列实验。这项工作得到了美国国立卫生研究院(NIH) AR066082的资助。
作者信息
作者及隶属关系
相应的作者
额外的信息
相互竞争的利益
作者宣称他们之间没有利益冲突。
作者的贡献
BAH参与了iMS-的时间过程收集和RNA提取Bmal1肌肉组织,参与重组试验,进行生物信息学分析,并撰写稿件。YW参与了生物信息学的分析,对数据的解释做出了贡献,并帮助撰写了手稿。LAR帮助生物信息学分析和图形制作。JHE参与了用于微阵列分析的RNA的时间过程收集和制备。BDH和EAS参与时间过程采集,完成小鼠活动数据采集和分析。EAS也进行了real-time PCR分析,并参与了重组实验。XZ参与时间-病程采集,进行Western blot分析。KAE参与了研究的设计和协调,并帮助起草了手稿。最终的手稿由所有作者阅读并通过。
附加文件
附加文件1:
昼夜代谢基因的归一化表达痕迹。来自高分辨率骨骼肌时间过程转录组的昼夜代谢基因的标准化表达痕迹(数据从NCBI GEO数据集- gse54652下载)。灰色条表示活跃期,白色条表示不活跃期。注意,在收集时间过程中,老鼠一直处于黑暗中。红线为JTK_CYCLE算法计算出的峰值表达时间(acrophase)。用6°多项式拟合数据以突出时间表达模式(黑线)。这些基因按功能分类,并按以下顺序列出:脂质分解、脂质储存、碳水化合物分解和碳水化合物储存。
附加文件2:
时间基因表达痕迹的昼夜代谢基因。来自小鼠ST 1.0 Affymetrix基因阵列的腓肠肌组织的昼夜节律代谢基因表达痕迹,收集于昼夜节律时间18至38。iMS -Bmal1+/+控制值用黑色菱形和im -表示Bmal1−−/用红色方块表示。灰色条表示活跃期,白色条表示不活跃期。注意,在收集时间过程中,老鼠一直处于黑暗中。
附加文件3:
昼夜代谢基因的实时PCR结果。Real-time -course PCR结果(C)Fabp3,Pnpla3,Hk2,Pdp1在即时通讯中Bmal1+/+(黑色)和即时消息-Bmal1−−/(红色)。配对t测试的Fabp3(Pvalue = 0.02),Pnpla3(Pvalue = 0.4),Hk2(PValue = 0.001),和Pdp1(Pvalue = 0.15)。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。
本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。
如欲查看本牌照的副本,请浏览https://creativecommons.org/licenses/by/4.0/.
创作共用公共领域奉献弃权书(https://creativecommons.org/publicdomain/zero/1.0/)适用于本条所提供的资料,除非在资料的信用额度中另有说明。
关于本文
引用本文
霍奇,文学学士,温,Y,莱利,洛杉矶人et al。内源性分子钟在骨骼肌中调控底物代谢的时间分离。骨骼肌5, 17(2015)。https://doi.org/10.1186/s13395-015-0039-5
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s13395-015-0039-5
关键字
- 昼夜
- 分子钟
- 骨骼肌
- 新陈代谢
- 暂时的分离
- 合成代谢
- 分解代谢的
- Bmal1
- Rev-erbα