摘要
一种高度保守的信号通路,包括胰岛素样生长因子1 (IGF1),以及介导其作用的细胞内成分级联,在骨骼肌生长的调节中起着重要作用。这一级联的核心成分是激酶Akt,也称为蛋白激酶B (PKB),它通过哺乳动物雷帕霉素激酶靶蛋白(mTOR)和糖原合成酶激酶3β (GSK3β)控制蛋白质合成,并通过FoxO家族的转录因子控制蛋白质降解。在这篇文章中,我们回顾了这一途径在骨骼肌纤维中的组成和功能,重点是所获得的证据在活的有机体内通过转基因和敲除模型和肌肉瞬时转染实验。尽管这一途径在肌肉发育和再生过程中是必不可少的,但它在成人肌肉对机械负荷反应中的作用尚不清楚。充分了解这一途径的运作有助于设计分子靶向疗法,以防止肌肉萎缩,这发生在各种病理背景和衰老过程中。
简介
肌肉萎缩发生在各种情况下,如癌症恶病质,糖尿病,肾功能衰竭和心力衰竭,以及衰老本身。这些患者和老年人的生存和生活质量可以通过抵消肌肉质量和力量的损失来改善,已经探索了不同的方法,包括营养补充、抗阻力训练和合成代谢药物。最近在理解肌肉萎缩的机制方面取得的进展可能会为新的和更有效的治疗方法铺平道路。
在过去的几年里,基于严格的遗传学方法的实验研究已经开始解剖肌肉质量调节中涉及的信号通路。虽然对培养肌细胞的研究有助于确定这些途径,但其生理相关性的确切证据只能通过使用在活的有机体内当肌纤维具有成熟的结构时,神经肌肉和肌肉骨骼系统的完整性得以保存。
两个在活的有机体内遗传学方法已被用于了解肌肉质量是如何被调节的。一种是基于转基因和敲除小鼠的生成,其中肌肉调节基因的表达被选择性地修饰。随着Cre/loxP技术的引入和诱导转基因的使用,传统基因过表达或缺失方法的潜力已被充分利用,这允许在肌肉组织和不同发育阶段特异性地调节基因表达。因此,有可能在发育过程中对肌肉生长调节的影响与对成年期肌肉质量维持的影响之间进行区分。解决成人肌肉质量调节的另一种方法是基于在活的有机体内通过电穿孔转染骨骼肌,质粒编码信号通路的特定成分,或突变体具有组成性活性或显性负性特性。用质粒转染能够在肌肉纤维中产生特定的小干扰rna,也越来越多地被用作功能丧失模型。通过转染失神经肌肉,可以探索各种因素在预防肌肉萎缩中的能力。
在这篇综述中,我们讨论如何在活的有机体内基于这些遗传模型的研究有助于确定特定信号通路的作用,即胰岛素样生长因子1-Akt/蛋白激酶B (IGF1-Akt/PKB)通路在肌肉质量调节中的作用。该通路在骨骼肌中所起作用的各个方面之前已经讨论过[1- - - - - -3.].IGF1-Akt1通路与胰岛素- akt2通路共享其大部分成分,并且这两条通路在不同水平上相交。例如,胰岛素也可以结合IGF1受体IGF1可以结合胰岛素受体;此外,IGF1和胰岛素受体之间的杂交存在于骨骼肌中。然而,胰岛素在葡萄糖稳态中尤其重要,而IGF1主要在肌肉生长中活跃。在这篇综述中,我们只考虑这一途径在生长中的作用,而不是在代谢中的作用。
IGF1-Akt/PKB通路概述
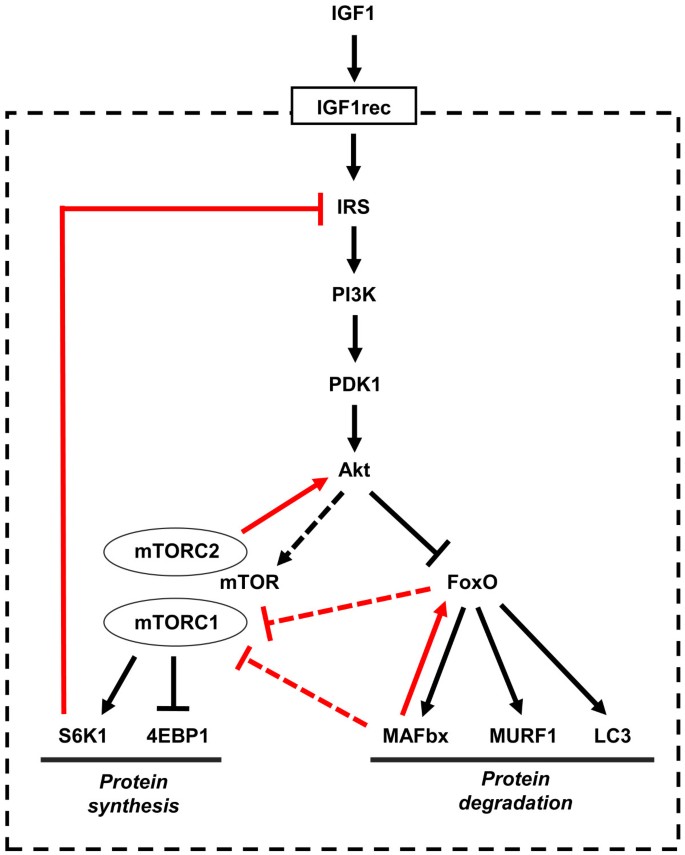
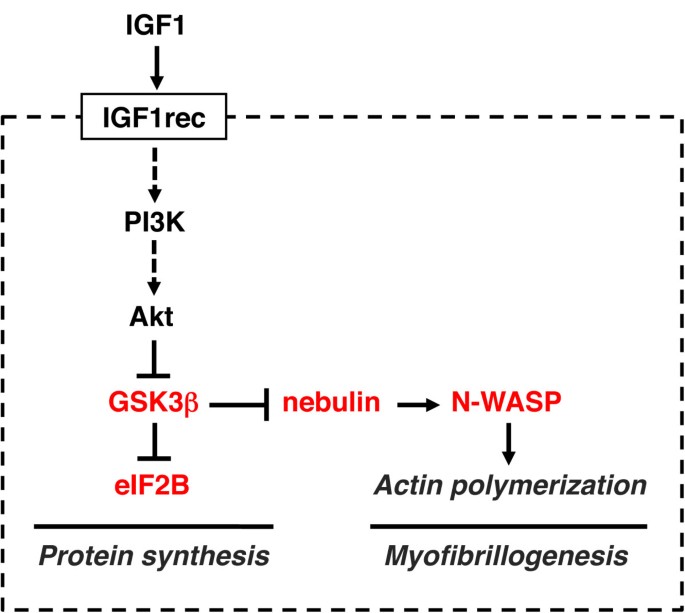
IGF1-Akt通路的简化方案如图所示1.IGF1与其受体的结合导致其固有酪氨酸激酶的激活和自磷酸化,从而产生胰岛素受体底物(IRS)的对接位点,IRS也被IGF1受体磷酸化。磷酸化的IRS然后作为对接位点招募和激活磷脂酰肌醇-3-激酶(PI3K), PI3K使膜磷脂磷酸化,从4,5-二磷酸肌醇-4,5-三磷酸肌醇-3,4,5-三磷酸肌醇(PIP3)生成。PIP3依次充当两种激酶——磷酸肌醇依赖激酶1 (PDK1)和Akt的停靠位点,随后PDK1在丝氨酸308位点磷酸化Akt,导致Akt激活。所有这些步骤都发生在质膜的内表面。Akt通过磷酸化FoxO家族转录因子抑制蛋白质降解,并通过哺乳动物雷帕霉素靶蛋白(mTOR)和糖原合成酶激酶3β (GSK3β)刺激蛋白质合成[4].FoxO因子是泛素连接酶atrogin1(也称为肌肉萎缩F-box (MAFbx)和肌肉无名指1 (MuRF1)的转录调节所必需的,导致肌球蛋白和其他肌肉蛋白质的泛素化(见下文),并通过蛋白酶体降解它们。FoxO因子也是微管相关蛋白1轻链3 (LC3)的转录调控所必需的,它与BCL2/腺病毒E1B相互作用蛋白3 (BNIP3)一起对自噬-溶酶体途径的激活至关重要。Akt对mTOR的影响是间接的:Akt抑制结节性硬化症复合体(TSC)蛋白1和2,它们作为GTPase激活蛋白(GAP)抑制大脑中富集的小G蛋白Ras同源物(Rheb)激活mTOR信号。mTOR形成两种不同的蛋白质复合物,当与Raptor结合时,雷帕霉素敏感的mTORC1和与Rictor结合时,雷帕霉素不敏感的mTORC2 [5].TORC2是Akt磷酸化激活所必需的[6].mTORC1磷酸化S6激酶(S6K), S6K反过来磷酸化核糖体蛋白S6和其他参与翻译起始和延伸的因子,从而刺激蛋白质合成。TORC1还通过磷酸化抑制性eIF4E结合蛋白(4ebp)激活真核翻译起始因子4E (eIF4E)。Akt还通过磷酸化和失活GSK3β促进蛋白质合成,从而释放GSK3β依赖的真核翻译启动因子2B (eIF2B)抑制(图)2).
IGF1-Akt通路的活性受几个反馈回路的控制(图1).负反馈涉及S6K,它通过多个位点的磷酸化抑制IRS,从而诱导其降解和改变细胞定位[7].正反馈包括mTORC2,它在丝氨酸473位点磷酸化Akt,除了PDK1在苏氨酸308位点磷酸化外,Akt还需要最大限度地激活这种磷酸化[8].Akt依赖于rictor的丝氨酸473位点磷酸化是Akt介导的FoxO磷酸化所必需的,而TSC2则不需要,因此它不会影响S6K的激活[5].在另一种前馈机制中,由FoxO激活的MAFbx依次充当FoxO的共激活剂[9].MAFbx似乎也通过泛素化来控制蛋白质合成,从而促进真核翻译起始因子3亚基F (eIF3F)的降解,从而抑制mTOR对S6K1的激活[10,11].FoxO因子已被证明在培养的哺乳动物细胞中通过诱导sestrin3和Rictor的表达来抑制mTORC1并激活Akt [12],但这一途径在骨骼肌中尚未被发现在活的有机体内.
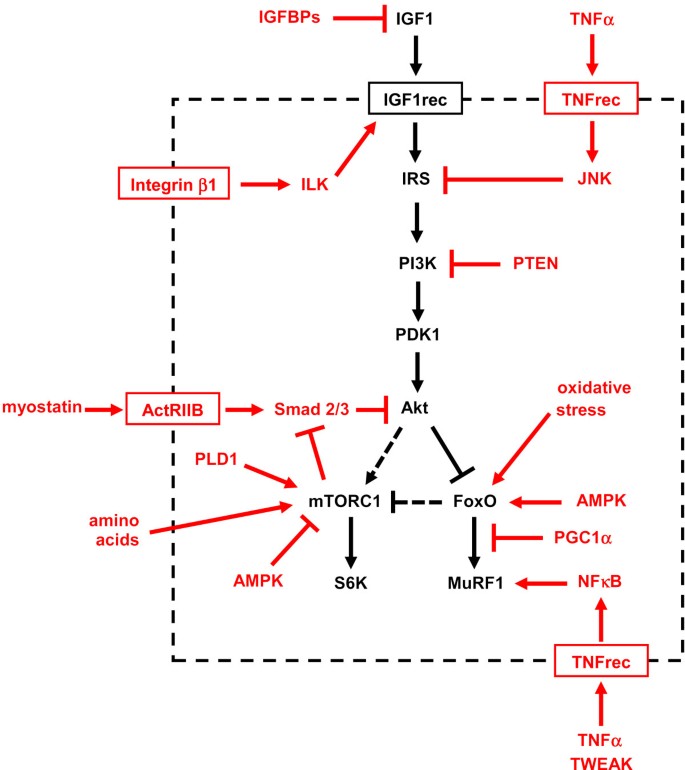
IGF1-Akt通路的活性可以通过多种其他因素和通路在不同步骤上的作用进行调节(图3.).IGF结合蛋白(IGFBPs),最重要的可能是IGFBP5,可以通过抑制其与IGF1受体的结合来阻断IGF1的作用。通过整合素β1和整合素链接激酶(ILK)的机械信号导致肌肉细胞中IGF1受体的磷酸化和PI3K-Akt通路的激活[13].另一个下游整合素效应子,整合素依赖的局灶性粘附激酶(FAK)是否影响骨骼肌中的IGF1-Akt通路仍有待确定。FAK缺失小鼠胚胎致死,骨骼肌特异性条件突变未见报道。通过电转移法过表达FAK可诱导成年大鼠肌肉轻度肥大,但未研究其对IGF1-Akt通路的影响[14].IRS类型的激活被肿瘤坏死因子α (TNFα)等炎症因子通过Jun n端激酶(JNK)诱导的丝氨酸残基磷酸化所抑制[15].PTEN(从10号染色体上删除的磷酸酶和紧张素同源物)是一种脂质磷酸酶,可将PIP3转化为PIP2,从而反对PI3K的作用,并干扰Akt与质膜的对接。肌肉生长抑制素,也称为生长与分化因子8 (GDF8),作为肌肉生长的负调节因子,由肌肉生长抑制素基因失活诱导的肥厚表型显示[16].肌生长抑制素与激活素A (TGFβ家族的另一个成员)一起通过其受体激活素受体IIB (ActRIIB)作用于Akt的抑制剂Smad2和Smad3;相反,mTOR抑制Smads [17,18].在培养肌细胞中,添加IGF1主要阻断肌生长抑制素的作用[17].在成人骨骼肌中,可以通过发育后肌肉生长抑制素基因敲除或使用卵泡抑素(一种肌肉生长抑制素拮抗剂)或抗肌肉生长抑制素抗体或可溶性ActRIIB诱饵受体(见[19,20.]及其中的参考资料)。
mTORC1将生长因子信号与来自营养物质和细胞能量状态的各种信号整合在一起。氨基酸直接激活mTORC1是由Rag家族的GTPases介导的,该家族与Raptor相互作用[21,22].相比之下,ATP激活激酶(AMPK),一种由ATP消耗激活的能量状态传感器,通过磷酸化和灭活Raptor来抑制mTORC1 [23],并通过磷酸化和激活TSC2 [24].AMPK通过抑制mTOR控制肌肉纤维大小的作用被AMPKα1敲除小鼠和AMPKα1/α2双敲除小鼠的表型证实,这些小鼠产生肌肉肥大[25,26].mTOR也可以独立于PI3K/Akt信号,被磷脂酶D (PLD)产生的磷脂酸直接激活,以响应偏心肌收缩诱导的机械信号[27- - - - - -29].
AMPK还可以影响foxo依赖的蛋白质降解途径。AMPK可以通过磷酸化不同于Akt磷酸化位点的几个调控位点激活FoxO因子[30.].foxo依赖的atrogin1和肌肉萎缩的激活被过氧化物酶体增殖物激活的受体γ共激活因子1α (PGC1α)抑制,这是一种转录共激活因子。PGC1α转染可保护成人肌肉免受foxo依赖性萎缩的影响,氧化肌纤维中PGC1α的高水平可以解释它们对肌肉萎缩的更强抵抗力[31].循环细胞因子如TNFα和tnf相关的细胞凋亡弱诱导因子(TWEAK)可通过转录因子核因子κB (NFκB)激活MuRF1 [32,33].最后,糖皮质激素通过在多个水平上抑制IGF1- akt通路,例如诱导IGF1的产生减少和肌肉生长抑制素的产生增加[34].此外,糖皮质激素受体和FoxO1协同激活MuRF1基因[35].
上述因素很可能只是IGF1-Akt通路与其他因素和通路相互作用的一小部分。事实上,最近基于酵母双杂交筛选PI3K-mTOR通路33个组分的相互作用组图已经确定了802种相互作用,其中包括67种新的已验证的相互作用[36].另一个复杂因素是IGF1-Akt通路的各种组分以多种亚型存在,其中许多在骨骼肌中共表达(表2)1).这些包括IGF1的不同剪接变体,两种IRS (IRS1和IRS2), PI3K的调节和催化亚基的不同亚型,两种Akt (Akt1和Akt2)和S6K (S6K1和S6K2),以及几种FoxO因子(FoxO1, FoxO3和FoxO4)。下面将讨论其中一些异构体的不同作用。
已经产生了大量涉及IGF1-Akt通路组分的转基因和敲除小鼠模型,并在表中列出2而且3.,分别。在活的有机体内导致骨骼肌中IGF1-Akt通路成分扰动的转染实验如表所示4.
IGF1和IGF1受体
IGF1最初被认为纯粹是由肝脏产生的循环生长因子,并介导生长激素对身体生长的影响。然而,随后的研究表明,IGF1也在包括骨骼肌在内的许多组织中局部表达,这表明局部IGF1的自分泌/旁分泌作用可能是控制组织生长的主要机制。Igf1无效小鼠表现出严重的生长迟缓,大多数在出生后不久死亡[37- - - - - -39],而靶向消融术实验表明,尽管肝脏来源的IGF1是血清中IGF1的主要来源,但它并不是出生后身体生长所必需的[40,41].然而,这一解释受到了证明IGF1在肝脏中的条件表达的挑战Igf1无背景占成人体型的30% [42].这种差异可以解释为在肝脏特异性敲除中检测到循环IGF1的残余部分[40,41因为不完整的Igf1基因切除[43].在一项类似的研究中,过度表达大鼠导致血清IGF1浓度升高Igf1转基因在肝脏中Igf1无效小鼠,能够挽救严重的生长迟缓表型观察se老鼠(44].为了确定肌肉细胞产生IGF1的影响,产生了一个转基因结构,其中人类IGF1 cDNA的表达由鸟类骨骼α-肌动蛋白基因驱动[45].野生型小鼠和转基因小鼠血清中IGF1浓度相似,但转基因小鼠出现骨骼肌肥大[45- - - - - -47].在这些小鼠中,IGF1过表达不足以防止后肢卸载引起的肌肉质量下降[46].然而,在成年大鼠中,通过电穿孔过表达IGF1可防止糖皮质激素诱导的肌肉萎缩[48].
的Igf1该基因可以通过选择性RNA处理产生多个转录本,从而在羧基端产生不同的肽,称为E肽。IGF1A和IGF1B两种亚型存在于大多数哺乳动物体内,另外一种亚型IGF1C存在于灵长类动物和人类体内[49].E肽似乎对肌肉生长调节至关重要,因为病毒传递IGF1A或IGF1B促进小鼠肌肉的功能性肥大,而传递缺乏E肽的成熟IGF1不能引起肌肉质量的增加[50].在转基因小鼠模型中研究了IGF1亚型(IGF1A)的作用,该亚型的表达由肌球蛋白轻链1快速启动子驱动[51].转基因小鼠显示出出生后肌肉质量和力量的增加,并且免受与年龄相关的肌肉萎缩和无力的影响。此外,老化的转基因肌肉保留了与年轻动物相当的再生能力。令人惊讶的是,在这些小鼠中没有检测到Akt激活[52],表明IGF1可能通过其他途径发出信号。一种潜在的替代途径可能是血清和糖皮质激素反应激酶1 (SGK1),这是一种与Akt结构同源的pi3k依赖性激酶,在许多组织中强烈表达,包括骨骼肌和心脏[53].SGK1被IGF1、PI3K和PDK1激活,可诱导心肌细胞S6K和GSK3β磷酸化[54]和FoxO3在不同细胞类型中的磷酸化[55].然而,这种替代途径尚未在骨骼肌中探索。igf1依赖信号通路通过丝裂原激活蛋白激酶/细胞外信号调节受体激酶(MAPK/ERK)途径也涉及igf1依赖的肌肉生长调节[56,57],然而,选择性激活ERK通路的组成型活性Ras双突变体并未诱导再生肌纤维肥大[58].
直到最近,唯一可用的IGF1和IGF1受体功能丧失模型是由肌肉特异性启动子驱动的IGF1受体β亚基的显性阴性、激酶失活性形式(MKR小鼠)[59].突变的IGF1受体与内源性IGF1和胰岛素受体的杂交形成导致胰岛素和IGF1受体信号通路受损,特别是在骨骼肌中。这些小鼠的主要表型是发生外周胰岛素抵抗和2型糖尿病[59].从出生到3周龄,肌肉生长有短暂延迟,但成年后的肌肉质量和力量是正常的[60].在这些小鼠中,协同腓肠肌消融后的跖肌代偿性肥厚以及相关的Akt和S6K激活均未受影响[61],但肌肉再生功能受损[62].最近,已经产生了特定的功能丧失小鼠模型。肌肉特异性敲除Igf1受体基因导致骨骼肌发育受损,肌纤维数量和面积减少,腓肠肌1型纤维数量减少[63].相比之下,老鼠缺乏Igf1没有明显的表型,在出生后的所有时间里,它们的体重与对照仔没有明显的区别(报告为“数据未显示”,在[63])。
IRS, PI3K和PDK1
IRS1无效小鼠的生长大大降低(30-60%的对照组)[39,64),而IRS2无效小鼠的生长几乎正常(约为对照组的90%),但会患上2型糖尿病[65],因此IRS1被认为在IGF1受体下游,而IRS2在胰岛素受体下游(表2)3.).然而,肌肉特异性失活国税局基因尚未被报道。PI3K p85α无效小鼠围产期死亡,显然是由于肝坏死[66),而PI3K p85β无效小鼠可存活,生长正常[67].有条件删除p85α骨骼肌和心脏基因生长正常[68],但当这些老鼠与p85β无效小鼠,由此产生的双突变动物显示心脏减少,但骨骼肌大小没有减少[68].相比之下,研究发现,在转染到再生骨骼肌时,组成型活性PI3K可诱导肌肉肥大[69].有条件删除PTEN骨骼肌和心脏的基因导致心脏肥厚,而骨骼肌没有肥厚。过度负荷引起的骨骼肌肥大也不受影响PTEN击倒(70],但再生肌肉纤维的成熟会加速[71].骨骼肌和心脏富集的microRNA miR-486已被证明靶向并抑制PI3K抑制剂PTEN,从而激活Akt通路[72].miR-486的表达受心肌相关转录因子A (MRTF-A)和血清反应因子(SRF)的调控。然而,miR-486在肌肉生长调节中的作用尚未被证实在活的有机体内基因的方法。有条件删除的基因心脏和肌肉会导致扩张型心肌病,但肌肉没有明显变化[73].因此,基于功能丧失的方法,支持PI3K和PDK1在骨骼肌生长中的作用的遗传证据仍然缺失。
一种蛋白激酶/ PKB
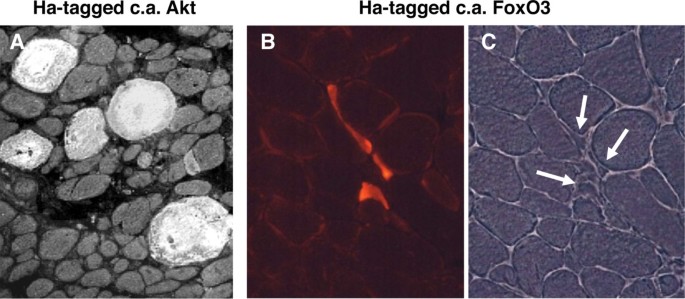
中断Akt1基因导致生长迟缓和细胞凋亡[74,75],而删除Akt2导致葡萄糖代谢缺陷,但不会改变生长[76].当两个Akt1而且Akt2基因被删除,在胚胎18.5天观察到骨骼肌萎缩,伴有侏儒症,皮肤和骨骼发育受损,脂肪生成减少[77].Akt1对肌肉大小的显著影响由在活的有机体内组成型活性Akt1的瞬时转染[69,78)(图4),以及在骨骼肌中过度表达组成型活性诱导转基因Akt1基因的转基因小鼠[79- - - - - -82].在成年动物中诱导Akt1表达1至3周后,所有病例都迅速实现肌肉肥大。下游蛋白质合成介质(S6K, S6)被激活,但未观察到卫星细胞的掺入[82].Akt1肥厚肌表现出增强的力量,表明功能性肥厚被诱导[80,82].此外,去神经的转基因Akt小鼠的肌肉质量完全保留[18].Akt激活引起肌肉基因表达的多种变化,通过微阵列分析记录[80,82,83].Akt在肌肉质量调节中的作用可能由几种不同的下游效应因子介导,包括GSK3β, mTOR和FoxO。
GSK3β
一种显性阴性形式的GSK3β已被证明可诱导骨骼肌管肥大[84],心脏中野生型GSK3β的过表达导致心脏大小减小30% [85].然而,在活的有机体内骨骼肌中GSK3β突变体的研究尚未见报道。最近报道了一种介导GSK3β对肌肉生长影响的新机制[86].GSK3β能够磷酸化位于位于z盘的星云蛋白c端区域的两个Ser位点,从而阻止星云蛋白与神经元威斯科-奥尔德奇综合征蛋白(N-WASP)相互作用,N-WASP是WASP家族中普遍表达的成员,参与肌动蛋白组装(图2).IGF1-Akt信号通路通过抑制GSK3β,允许N-WASP与未磷酸化的云状蛋白相互作用;随之而来的N-WASP招募到z盘促进肌动蛋白成核和肌动蛋白丝的伸长。这个过程似乎与肌肉生长有关在活的有机体内,因为在成年小鼠肌肉中长期敲除N-WASP会导致转染的肌纤维萎缩[86].因此,我们认为IGF1-Akt信号通路通过GSK3β-nebulin-N-WASP途径控制肌原纤维的生长和维持。
mTOR
mTOR是含有Raptor的TORC1和含有Rictor的TORC2两种多蛋白复合物的一部分。为了明确mTOR复合物在骨骼肌中的作用,采用小鼠肌肉特异性消融猛禽而且Rictor产生[87].肌肉的Rictor基因敲除小鼠与野生型对照小鼠没有区别。相比之下,缺乏raptor的肌肉逐渐营养不良,氧化能力受损[87].这些变化伴随着肌肉力量的下降和参与线粒体生物发生的基因的下调,包括PGC-1α。在肌肉特异性mtor缺陷小鼠中观察到类似但不完全相同的表型[88].就像猛禽敲除基因后,缺乏mtor的肌肉会出现类似肌肉营养不良的肌病,同时氧化代谢受损。各组肌病较对照组严重mTOR淘汰赛比猛禽敲除小鼠,可能是由于营养不良蛋白和营养不良蛋白-糖蛋白复合物的其他成分的含量减少。研究表明mTOR以不依赖雷帕霉素和激酶的方式直接控制抗肌萎缩蛋白的转录[88].
Raptor和Rictor对雷帕霉素治疗有不同的敏感性,Raptor活性被雷帕霉素阻断,而Rictor活性则没有。然而,Raptor抑制和雷帕霉素治疗不会对肌肉产生相同的效果。雷帕霉素阻断再生肌肉或Akt转染肌肉的肌肉生长[69,78]但不会导致成年小鼠在治疗15天后出现萎缩或营养不良[18].mTOR通过不同的靶点控制蛋白质合成,包括S6K,存在于两种亚型,S6K1和S6K2。S6K1而且S6K2双敲除小鼠的肌纤维尺寸减小,而肌核数量不变[89].删除S6K1足以重现这种萎缩的表型。
FoxO
FoxO家族的转录因子已成为肌肉萎缩计划的主要调节因子。在肌肉特异性启动子下过度表达FoxO1的小鼠出现肌肉萎缩和溶酶体蛋白酶组织蛋白酶L水平升高[90].FoxO3在肌肉萎缩时被诱导,过表达可以减少肌肉量在活的有机体内: FoxO3组成型活性突变体转染骨骼肌时的显著效果如图所示4(B, C)。相反,显性阴性FoxO3的表达可抑制地塞米松诱导的肌肉萎缩[91].FoxO3作用于肌肉蛋白质降解的两条主要途径:蛋白酶体途径和自噬-溶酶体途径。
通过证明肌肉特异性泛素连接酶atrogin1 /MAFbx和MuRF1在各种肌肉萎缩模型中被诱导,获得了foxo依赖的泛素-蛋白酶体途径激活的直接证据[92,93],是FoxO因子的转录靶点,在成人肌肉中通过转染FoxO3上调[91,94].它们在肌肉质量调节中的作用得到了支持,这一发现部分地阻止了两者由去神经支配引起的肌肉萎缩MuRF1零和atrogin1 / MAFbx无效小鼠[92].MuRF1参与肌凝蛋白重链和其他粗丝蛋白的降解,如肌凝蛋白轻链和肌凝蛋白结合蛋白C [95,96].MuRF1属于肌肉特异性的无名指蛋白家族,该家族还包括MuRF2和MuRF3。不同的MuRF具有冗余功能,这一发现表明,缺乏单个MuRF基因的小鼠没有显著的骨骼肌表型[92,97,98].相比之下,MuRF1而且3.双敲除小鼠出现骨骼肌和心肌肌病,肌凝蛋白积聚[99),而MuRF1而且2双敲除小鼠有轻度骨骼肌肥大,并在衰老过程中减少肌肉损失[One hundred.].
FoxO3作为自噬诱导物的作用得到以下发现的支持:转染具有组成性活性FoxO3的成人肌纤维会导致自噬空泡的积累,而禁食诱导的自噬被显性阴性FoxO3和RNA干扰介导的FoxO3敲低所阻断[81,101].FoxO3是自噬相关基因上调所必需的,如aLC3而且Bnip3[81].通过肌肉特异性敲除自噬基因抑制自噬Atg7被发现会导致肌肉萎缩,伴随着肌肉力量的下降,并伴有改变的线粒体和异常的同心膜结构的积累[102].此外,抑制自噬加剧了去神经和禁食期间的肌肉损失,这表明功能失调的细胞器的持续存在影响肌肉萎缩的进展[102].因此,自噬机制的正常运作是处理改变的细胞器和维持肌纤维完整性所必需的。一个意想不到的结果是发现mTOR被认为是不同细胞系统中自噬的主要调节因子,但在肌肉自噬中似乎并没有发挥主要作用,因为用mTOR抑制剂雷帕霉素治疗对骨骼肌的自噬都有有限的影响在体外而且在活的有机体内[81,101].
开放式的问题
有关IGF1- akt通路在骨骼肌中的作用的几个悬而未决的问题仍有待回答,包括不同亚型的作用,如IGF1和FoxO亚型。这里将简要地讨论未来研究中需要解决的两个一般性问题。
IGF1-Akt通路在成人骨骼肌中的作用
毫无疑问,IGF1是发育过程中肌肉质量的主要调节因子,这得益于它对肌原细胞增殖和分化的影响[103].关于IGF1在成人骨骼肌中的作用,多项研究表明IGF1可诱导骨骼肌肥大并阻断骨骼肌萎缩。在成年大鼠中,局部输注重组IGF1可导致肌肉肥大[104,105]和质粒介导的IGF1基因转移可预防皮质类固醇诱导的肌肉萎缩[48].在成年小鼠中,病毒介导的IGF1基因转移导致肌肉肥大,并防止肌肉质量和力量的老化依赖性损失[50,106].然而,目前尚不清楚IGF1是否参与调节负荷对成人肌肉质量的影响。IGF1在转基因小鼠骨骼肌中过表达并不能预防卸载诱导的肌肉萎缩[46],尽管在这些实验中卸载IGF1转基因表达降低。在过度表达IGF1受体显性阴性形式的转基因小鼠中,过度肥大也没有变化[61],尽管该模型的解释因转基因对胰岛素和IGF1信号的双重作用而变得复杂。介导卸载和过载对肌肉大小影响的途径尚未被确定,如上所述,Akt-mTOR途径可能通过整合素- ilk或通过对mTOR的直接影响参与。
IGF1及其下游效应子在成人骨骼肌中的作用不能用传统的转基因和敲除方法来确定,因为发育中的肌肉比成人肌肉具有更大的可塑性,因此可能会发生代偿性适应,以应对基因过表达或消融,这在成年动物中诱导遗传扰动时是看不到的。这可能解释了在某些敲除模型中肌肉表型的缺乏,例如,在PI3K而且的基因淘汰赛。其他基因敲除模型引起的不适应变化导致肌肉营养不良而不是萎缩,如所见mTOR而且猛禽基因敲除模型。了解遗传扰动对成人而不是发育中的肌肉的影响对于确定治疗靶点和设计预防肌肉萎缩的对策特别重要。为了获得这方面的有用信息,使用可诱导的转基因方法是必不可少的,在成年动物中诱导转基因过表达或基因敲除。然而,据我们所知,Akt诱导模型是迄今为止用于研究IGF1-Akt通路的唯一诱导模型。另外,在活的有机体内转染程序可用于探索转基因过表达或RNAi基因敲低在成人肌肉中的影响。
IGF1-Akt通路激活对卫星细胞的影响
肌肉生长和肌肉再生需要卫星细胞和其他细胞类型的参与,包括血管细胞,在再生的情况下,炎症细胞。这方面必须在涉及IGF1过度生产的遗传模型中考虑,因为这种生长因子已知作用于不同的细胞类型,因为在卫星细胞和非肌肉细胞中存在IGF1受体。对卫星细胞的影响对于肌肉肥大尤为重要。据报道,卫星细胞在成年小鼠肌肉中病毒介导的IGF1基因转移诱导的肥厚反应中起着至关重要的作用,事实证明,用于阻止卫星细胞增殖的γ照射被发现可以减少IGF1过表达的肥厚效应[107].然而,由于肥厚反应的降低可能是由于照射对肌纤维蛋白合成的影响,对该实验的解释变得复杂。108],也许对蛋白质降解也有影响。在另一项关于IGF1转基因小鼠的研究中,发现IGF1过表达首先导致DNA的增加,出生后仅几周就导致蛋白质质量的增加,这被解释为反映了出生后早期卫星细胞增殖和融合的主要影响,当时卫星细胞进行活跃增殖[47].这种解释与IGF1诱导肌肉肥大需要生长刺激的观点是一致的在活的有机体内[109].然而,卫星细胞增殖在这些研究中没有直接检查。在出生后肌肉生长过程中,卫星细胞增殖和融合导致肌核增加[110]以及协同肌消融引起的代偿性肥厚[111],后经电子显微镜放射自显影证实3.H-thymidine标签。然而,使用可诱导的肌肉肥大转基因模型,在成人骨骼肌中短期Akt激活后,在卫星细胞中未检测到显著的BrdU掺入,然而肌肉肥大伴随着力量产生的增加[82].因此,卫星细胞增殖和融合并不是Akt激活在成人骨骼肌中诱导的功能性肥大的先决条件。
参考文献
玻璃DJ:PI3激酶对骨骼肌肥大和萎缩的调节。Curr顶级微生物免疫2010年,346:267 - 278。full_text
宫崎骏M, Esser KA:动物中调节蛋白质合成和骨骼肌肥大的细胞机制。J应用物理2009年,106:1367 - 1373。10.1152 / japplphysiol.91355.2008
Sandri M:肌肉萎缩和肥大的信号。生理学(贝塞斯达)2008年,23:160 - 170。
曼宁BD,坎特利LC:AKT/PKB信号:下游导航。细胞2007年,129:1261 - 1274。10.1016 / j.cell.2007.06.009
Zoncu R, Efeyan A, Sabatini DM:mTOR:从生长信号整合到癌症、糖尿病和衰老。Nat Rev Mol细胞生物学2011年,12:21-35。10.1038 / nrm3025
Guertin DA, Stevens DM, Thoreen CC, Burds AA, Kalaany NY, Moffat J, Brown M, Fitzgerald KJ, Sabatini DM:小鼠mTORC组件raptor, rictor或mLST8的消融显示,mTORC2是向Akt-FOXO和PKCalpha发送信号所必需的,而不是S6K1。Dev细胞2006年,11:859 - 871。10.1016 / j.devcel.2006.10.007
Harrington LS, Findlay GM, Gray A, Tolkacheva T, Wigfield S, Rebholz H, Barnett J, Leslie NR, Cheng S, Shepherd PR,等.:TSC1-2肿瘤抑制因子通过调控IRS蛋白控制胰岛素- pi3k信号。细胞生物学2004年,166:213 - 223。10.1083 / jcb.200403069
萨巴索夫DD,格尔丁DA,阿里SM,萨巴蒂尼DM:rictor-mTOR复合物对Akt/PKB的磷酸化和调控。科学2005年,307:1098 - 1101。10.1126 / science.1106148
Li HH, Willis MS, Lockyer P, Miller N, McDonough H, Glass DJ, Patterson C:atrogin1通过泛素依赖的Forkhead蛋白共激活抑制小鼠akt依赖的心肌肥厚。J临床投资2007年,117:3211 - 3223。10.1172 / JCI31757
Lagirand-Cantaloube J, Offner N, Csibi A, Leibovitch MP, Batonnet-Pichon S, Tintignac LA, Segura CT, Leibovitch SA:起始因子eIF3-f是骨骼肌萎缩中atrogin1/MAFbx功能的主要靶点。EMBO J2008年,27日:1266 - 1276。10.1038 / emboj.2008.52
Csibi A, Cornille K,莱博维奇MP, Poupon A, Tintignac LA, Sanchez AM,莱博维奇SA:翻译调节亚基eIF3f控制小鼠肌肉分化和肥大所需的激酶依赖性mTOR信号。《公共科学图书馆•综合》2010年,5:e8994。10.1371 / journal.pone.0008994
Chen CC, Jeon SM, Bhaskar PT, Nogueira V, Sundararajan D, Tonic I, Park Y, Hay N:FoxOs通过诱导Sestrin3和Rictor的表达抑制mTORC1,激活Akt。Dev细胞2010年,18:592 - 604。10.1016 / j.devcel.2010.03.008
王hv, Chang LW, Brixius K, Wickstrom SA, Montanez E, stealessen I, Schwander M, Muller U, Bloch W, Mayer U, Fassler R:整合素链接激酶稳定肌腱连接和保护肌肉免受应激性损伤。细胞生物学2008年,180:1037 - 1049。10.1083 / jcb.200707175
Durieux AC, D'Antona G, Desplanches D, Freyssenet D, Klossner S, Bottinelli R, Fluck M:黏附激酶是负荷依赖性的调控慢收缩和氧化肌肉表型。杂志2009年,587:3703 - 3717。10.1113 / jphysiol.2009.171355
Draznin B:胰岛素抵抗的分子机制:胰岛素受体底物-1的丝氨酸磷酸化和p85 α表达的增加:硬币的两面。糖尿病2006年,55岁:2392 - 2397。10.2337 / db06 - 0391
McPherron AC, Lawler AM, Lee SJ:一种新的tgf - β超家族成员对小鼠骨骼肌质量的调节。自然1997年,387:83 - 90。10.1038 / 387083 a0
Trendelenburg AU, Meyer A, Rohner D, Boyle J, Hatakeyama S, Glass DJ:肌生长抑制素降低Akt/TORC1/p70S6K信号通路,抑制成肌细胞分化和肌管大小。Am J Physiol Cell Physiol2009年,296:c1258 - 1270。10.1152 / ajpcell.00105.2009
Sartori R, Milan G, Patron M, Mammucari C, Blaauw B, Abraham R, Sandri M:Smad2和3转录因子控制成年肌肉质量。Am J Physiol Cell Physiol2009年,296:c1248 - 1257。10.1152 / ajpcell.00104.2009
Lee SJ, Lee YS, Zimmers TA, Soleimani A, Matzuk MM, Tsuchida K, Cohn RD, Barton ER:卵泡抑素和激活素对肌肉质量的调节。摩尔性2010年,24:1998 - 2008。10.1210 / me.2010 - 0127
周欣,王建林,陆杰,宋勇,郭克胜,焦强,Rosenfeld R,陈强,Boone T, Simonet WS,等.:ActRIIB拮抗剂逆转癌症恶病质和肌肉萎缩导致延长生存期。细胞2010年,142:531 - 543。10.1016 / j.cell.2010.07.011
Kim E, Goraksha-Hicks P, Li L, Neufeld TP,管kl:Rag GTPases对TORC1在营养反应中的调控。Nat细胞生物学2008年,10:935 - 945。10.1038 / ncb1753
桑萨克Y,彼得森TR,绍尔YD,林德奎斯特RA,索林CC,巴佩莱德L,萨巴蒂尼DM:Rag GTPases结合raptor并介导氨基酸信号到mTORC1。科学2008年,320:1496 - 1501。10.1126 / science.1157535
Gwinn DM, Shackelford DB, Egan DF, Mihaylova MM, Mery A, Vasquez DS, Turk BE, Shaw RJ:raptor的AMPK磷酸化介导代谢检查点。摩尔细胞2008年,30:214 - 226。10.1016 / j.molcel.2008.03.003
Inoki K,李勇,朱涛,吴娟,管kl:TSC2被Akt磷酸化和抑制,并抑制mTOR信号。Nat细胞生物学2002年,4:648 - 657。10.1038 / ncb839
穆尼埃R,兰蒂尔L,勒克莱尔J,索蒂罗普洛斯A,潘德M,达格伦D,坂本K,弗雷茨M,紫罗兰B:AMPKalpha1在限制骨骼肌细胞肥大中的重要作用。美国实验生物学学会联合会J2009年,23:2264 - 2273。10.1096 / fj.08 - 119057
兰蒂尔L,穆尼尔R,勒克莱尔J,潘德M,福尔茨M,维奥莱特B:amp活化蛋白激酶对肌肉细胞大小控制的协调维持。美国实验生物学学会联合会J2010年,24:3555 - 3561。10.1096 / fj.10 - 155994
Hornberger TA, Stuppard R, Conley KE, Fedele MJ, Fiorotto ML, Chin ER, Esser KA:机械刺激通过磷酸肌醇3-激酶、蛋白激酶B-和生长因子独立机制调节雷帕霉素敏感信号。物化学J2004年,380:795 - 804。10.1042 / BJ20040274
Hornberger TA,朱伟坤,麦耀文,熊景文,黄莎,钱生:磷脂酶D和磷脂酸在骨骼肌mTOR信号机械激活中的作用。美国国家科学研究院2006年,103:4741 - 4746。10.1073 / pnas.0600678103
奥尼尔TK,达菲LR,弗雷JW,霍恩伯格TA:磷酸肌醇3-激酶和磷脂酸在哺乳动物雷帕霉素偏心收缩后靶细胞调节中的作用。杂志2009年,587:3691 - 3701。
Greer EL, Oskoui PR, Banko MR, Maniar JM, Gygi MP, Gygi SP, Brunet A:能量传感器amp激活蛋白激酶直接调节哺乳动物FOXO3转录因子。生物化学2007年,282:30107 - 30119。10.1074 / jbc.M705325200
Sandri M, Lin J, Handschin C, Yang W, Arany ZP, Lecker SH, Goldberg AL, Spiegelman BM:PGC-1alpha通过抑制FoxO3作用和萎缩特异性基因转录来保护骨骼肌免受萎缩。美国国家科学研究院2006年,103:16260 - 16265。10.1073 / pnas.0607795103
Cai D, Frantz JD, Tawa NE Jr, Melendez PA, Oh BC, Lidov HG, Hasselgren PO, Frontera WR, Lee J, Glass DJ, Shoelson SE:IKKbeta/NF-kappaB激活导致小鼠严重的肌肉萎缩。细胞2004年,119:285 - 298。10.1016 / j.cell.2004.09.027
Dogra C, Changotra H, Wedhas N, Qin X, Wergedal JE, Kumar A:肿瘤坏死因子相关的细胞凋亡弱诱导因子(TWEAK)是一种强效的骨骼肌损耗细胞因子。美国实验生物学学会联合会J2007年,21:1857 - 1869。10.1096 / fj.06 - 7537 com
Schakman O, Kalista S, Bertrand L, Lause P, Verniers J, Ketelslegers JM, Thissen JP:Akt/GSK-3beta/ β -连环蛋白转导通路在糖皮质激素处理大鼠胰岛素样生长因子- i抗肌肉萎缩作用中的作用内分泌学2008年,149:3900 - 3908。10.1210 / en.2008 - 0439
Waddell DS, Baehr LM, van den Brandt J, Johnsen SA, Reichardt HM, Furlow JD, Bodine SC:糖皮质激素受体和FOXO1协同激活骨骼肌萎缩相关的MuRF1基因。Am J Physiol Endocrinol Metab2008年,295:e785 - 797。10.1152 / ajpendo.00646.2007
派勒-斯托克F,肖邦E,鲁阿尔JF,博多A,多布罗霍托夫P,罗宾逊-雷查维M,布伦C,库西克ME,希尔DE,谢弗L,等.:雷帕霉素通路的磷脂酰肌醇3激酶-哺乳动物靶点的相互作用组定位确定了变形的表皮自调节因子-1作为新的糖原合成酶激酶-3相互作用体。Mol细胞蛋白质组学2010年,9:1578 - 1593。10.1074 / mcp.M900568-MCP200
刘jp, Baker J, Perkins AS, Robertson EJ, Efstratiadis A携带编码胰岛素样生长因子I (IGF -1)和1型IGF受体(Igf1r)基因零突变的小鼠。细胞1993年,75:59 - 72。
Powell-Braxton L, Hollingshead P, Warburton C, Dowd M, Pitts-Meek S, Dalton D, Gillett N, Stewart TA:IGF-I是小鼠胚胎正常生长所必需的。基因开发1993年,7:2609 - 2617。10.1101 / gad.7.12b.2609
刘建平,刘建平,刘建平,叶海松A:胰岛素样生长因子在胚胎和出生后生长中的作用。细胞1993年,75:73 - 82。
雅卡尔S,刘建林,斯坦纳德B,巴特勒A,阿齐利D,绍尔B,勒罗伊斯D:缺乏肝脏胰岛素样生长因子I时的正常生长发育。美国国家科学研究院1999年,96:7324 - 7329。10.1073 / pnas.96.13.7324
Sjogren K, Liu JL, Blad K, Skrtic S, Vidal O, Wallenius V, LeRoith D, Tornell J, Isaksson OG, Jansson JO, Ohlsson C:肝源性胰岛素样生长因子I (IGF-I)是血液中IGF-I的主要来源,但不是小鼠出生后身体生长所必需的。美国国家科学研究院1999年,96:7088 - 7092。10.1073 / pnas.96.12.7088
Stratikopoulos E, Szabolcs M, Dragatsis I, Klinakis A, Efstratiadis A:IGF1在小鼠出生后生长中的激素作用。美国国家科学研究院2008年,105:19378 - 19383。10.1073 / pnas.0809223105
唐智,余睿,陆勇,Parlow AF,刘建林:年龄依赖的肝脏特异性IGF-I基因缺陷及其在老年中的持久性:对LID小鼠出生后生长和胰岛素抵抗的影响Am J Physiol Endocrinol Metab2005年,289:e288 - 295。10.1152 / ajpendo.00494.2004
吴勇,孙华,Yakar S, LeRoith D:血清中胰岛素样生长因子(IGF)-I水平升高可挽救IGF-I缺失小鼠的严重生长迟缓。内分泌学2009年,150:4395 - 4403。10.1210 / en.2009 - 0272
Coleman ME, DeMayo F, Yin KC, Lee HM, Geske R, Montgomery C, Schwartz RJ:胰岛素样生长因子I的肌源性载体表达刺激转基因小鼠肌细胞分化和肌纤维肥大。生物化学1995年,270:12109 - 12116。10.1074 / jbc.270.20.12109
Criswell DS, Booth FW, DeMayo F, Schwartz RJ, Gordon SE, Fiorotto ML:IGF-I在转基因小鼠骨骼肌中过表达并不能预防卸载诱导的萎缩。Am J Physiol1998年,275:e373 - 379。
Fiorotto ML, Schwartz RJ, del欢笑MC:骨骼肌中持续的IGF-I过表达短暂地增强了DNA的增生和生长。美国实验生物学学会联合会J2003年,17:59-60。10.1096 / fj.02 - 0289 fje
Schakman O, Gilson H, de Coninck V, Lause P, Verniers J, Havaux X, Ketelslegers JM, Thissen JP:胰岛素样生长因子- i基因电穿孔转移可预防糖皮质激素治疗大鼠骨骼肌萎缩。内分泌学2005年,146:1789 - 1797。10.1210 / en.2004 - 1594
巴顿ER:IGF-I亚型的abc:对肌肉肥大的影响和修复的意义。应用Physiol Nutr Metab2006年,31日:791 - 797。10.1139 /下半年- 054
Barton ER, DeMeo J, Lei H:胰岛素样生长因子(IGF)-I e肽在局部IGF-I产生后,对于异构体特异性基因表达和肌肉肥大是必需的。J应用物理2010年,108:1069 - 1076。10.1152 / japplphysiol.01308.2009
Musaro A, McCullagh K, Paul A, Houghton L, Dobrowolny G, Molinaro M, Barton ER, Sweeney HL, Rosenthal N:局部Igf-1转基因表达维持衰老骨骼肌肥大和再生。Nat麝猫2001年,27日:195 - 200。10.1038/84839
Barton ER, Morris L, Musaro A, Rosenthal N, Sweeney HL:胰岛素样生长因子I的肌肉特异性表达在mdx小鼠中对抗肌肉衰退。细胞生物学2002年,157:137 - 148。10.1083 / jcb.200108071
小林T, Deak M, Morrice N, Cohen P:血清和糖皮质激素诱导蛋白激酶两种新异构体的结构和调控特征。物化学J1999年,344(Pt(1): 189 - 197。10.1042 / 0264 - 6021:3440189
青山T,松井T,诺维科夫M,朴J,海明斯B,罗森茨威格A:血清和糖皮质激素反应激酶-1调节心肌细胞存活和肥厚反应。循环2005年,111:1652 - 1659。10.1161/01. cir.0000160352.58142.06
Brunet A, Park J, Tran H, Hu LS, Hemmings BA, Greenberg ME:蛋白激酶SGK通过磷酸化叉头转录因子FKHRL1 (FOXO3a)介导生存信号。Mol细胞生物学2001年,21:952 - 965。10.1128 / mcb.21.3.952 - 965.2001
Haddad F, Adams GR:抑制MAP/ERK激酶可防止igf -i诱导的大鼠肌肉肥大。J应用物理2004年,96:203 - 210。10.1152 / japplphysiol.00856.2003
Shi H, Scheffler JM, Zeng C, Pleitner JM, Hannon KM, Grant AL, gerard DE:丝裂原活化蛋白激酶信号是维持骨骼肌质量所必需的。Am J Physiol Cell Physiol2009年,296:c1040 - 1048。10.1152 / ajpcell.00475.2008
Murgia M, Serrano AL, Calabria E, Pallafacchina G, Lomo T, Schiaffino S:Ras参与肌肉基因的神经活动依赖调节。Nat细胞生物学2000年,2:142 - 147。10.1038 / 35004013
Fernandez AM, Kim JK, Yakar S, Dupont J, Hernandez-Sanchez C, Castle AL, Filmore J, Shulman GI, Le Roith D:骨骼肌中IGF-I和胰岛素受体的功能失活导致2型糖尿病。基因开发2001年,15:1926 - 1934。10.1101 / gad.908001
Fernandez AM, Dupont J, Farrar RP, Lee S, Stannard B, Le Roith D:肌肉特异性失活IGF-I受体诱导骨骼肌代偿性增生。J临床投资2002年,109:347 - 355。
Spangenburg EE, Le Roith D, Ward CW, Bodine SC:功能性胰岛素样生长因子受体对于负荷诱导的骨骼肌肥大并不是必需的。杂志2008年,586:283 - 291。10.1113 / jphysiol.2007.141507
Heron-Milhavet L, Mamaeva D, LeRoith D, Lamb NJ, Fernandez A:IGF-IR肌肉特异性KO小鼠的肌肉再生和成肌细胞分化受损。细胞物理2010年,225:1 - 6。10.1002 / jcp.22218
马瓦利MD, DiGirolamo DJ,范Y,里德尔RC,坎贝尔KS,范格林T,弗兰克SJ,斯珀林MA,埃塞尔KA,班曼MM,克莱门斯TL:不同的生长激素受体信号模式调节小鼠骨骼肌发育和胰岛素敏感性。J临床投资2010年,120:4007 - 4020。10.1172 / JCI42447
Araki E, Lipes MA, Patti ME, Bruning JC, Haag B, Johnson RS, Kahn CR:靶向破坏IRS-1基因的小鼠胰岛素信号的替代途径。自然1994年,372:186 - 190。10.1038 / 372186 a0
Withers DJ, Gutierrez JS, Towery H, Burks DJ, Ren JM, Previs S, Zhang Y, Bernal D, Pons S, Shulman GI,等.:IRS-2的破坏会导致小鼠的2型糖尿病。自然1998年,391:900 - 904。10.1038/36116
弗鲁曼DA,莫维斯-贾维斯F,波拉德DA,伊巴尔CM,巴西D,布朗森RT,卡恩CR,坎特利LC:缺乏磷酸肌醇3-激酶p85 α所有亚型的小鼠的低血糖、肝坏死和围产期死亡Nat麝猫2000年,26日:379 - 382。10.1038/81715
Ueki K, Yballe CM, Brachmann SM, Vicent D, Watt JM, Kahn CR, Cantley LC:缺乏磷酸肌醇3-激酶p85 β亚基的小鼠胰岛素敏感性增加。美国国家科学研究院2002年,99:419 - 424。10.1073 / pnas.012581799
罗j, McMullen JR, Sobkiw CL, Zhang L, Dorfman AL, Sherwood MC, Logsdon MN, Horner JW, DePinho RA, Izumo S, Cantley LC:IA类磷酸肌醇3-激酶调节心脏大小和生理性心肌肥厚。Mol细胞生物学2005年,25:9491 - 9502。10.1128 / mcb.25.21.9491 - 9502.2005
Pallafacchina G, Calabria E, Serrano AL, Kalhovde JM, Schiaffino S:蛋白激酶b依赖和雷帕霉素敏感途径控制骨骼肌生长,但不纤维类型规范。美国国家科学研究院2002年,99:9213 - 9218。10.1073 / pnas.142166599
Hamilton DL, Philp A, MacKenzie MG, Baar K:PI(3,4,5)P3调节在抵抗运动中控制骨骼肌质量的作用有限。《公共科学图书馆•综合》2010年,5:e11624。10.1371 / journal.pone.0011624
胡震,王辉,李ih, Modi S,王旭,杜杰,Mitch WE:PTEN抑制促进高脂饮食小鼠的肌肉再生。糖尿病2010年,59:1312 - 1320。10.2337 / db09 - 1155
小EM, O'Rourke JR, Moresi V, Sutherland LB, McAnally J, Gerard RD, Richardson JA, Olson EN:肌肉富集microRNA-486对PI3-kinase/Akt信号的调控。美国国家科学研究院2010年,107:4218 - 4223。10.1073 / pnas.1000300107
莫拉A,戴维斯AM,伯特兰L,沙里夫I,布达斯GR,约万诺维奇S,木顿V,卡恩CR,卢科克JM,格雷GA,等.:心肌中缺乏PDK1会导致心力衰竭和对缺氧的敏感性增加。EMBO J2003年,22:4666 - 4676。10.1093 / emboj / cdg469
赵h, Thorvaldsen JL, Chu Q, Feng F, Birnbaum MJ:Akt1/PKBalpha是正常生长所必需的,但对于维持小鼠葡萄糖稳态是可有可无的。生物化学2001年,276:38349 - 38352。10.1074 / jbc.C100462200
陈文伟,徐佩泽,Gottlob K,陈明明,Sokol K, Shiyanova T, Roninson I,翁w,铃木R, Tobe K,等.:Akt1基因纯合破坏小鼠生长迟缓和凋亡增加。基因开发2001年,15:2203 - 2208。10.1101 / gad.913901
Cho H, Mu J, Kim JK, Thorvaldsen JL, Chu Q, Crenshaw EB, Kaestner KH, Bartolomei MS, Shulman GI, Birnbaum MJ:缺乏蛋白激酶Akt2 (PKB β)的小鼠的胰岛素抵抗和糖尿病样综合征。科学2001年,292:1728 - 1731。10.1126 / science.292.5522.1728
彭晓东,徐佩珍,陈明明,Hahn-Windgassen A, Skeen J, Jacobs J, Sundararajan D, Chen WS, Crawford SE, Coleman KG, Hay N:在缺乏Akt1和Akt2的小鼠中,侏儒症,皮肤发育受损,骨骼肌萎缩,骨骼发育迟缓,脂肪生成受阻。基因开发2003年,17:1352 - 1365。10.1101 / gad.1089403
博丁SC,斯蒂特TN,冈萨雷斯M,克莱恩WO,斯托弗GL,鲍尔莱因R,兹洛琴科E,斯克林杰A,劳伦斯JC,格拉斯DJ, Yancopoulos GD:Akt/mTOR通路是骨骼肌肥大的重要调节因子,在体内可预防肌肉萎缩。Nat细胞生物学2001年,3:1014 - 1019。10.1038 / ncb1101 - 1014
Lai KM, Gonzalez M, Poueymirou WT, Kline WO, Na E, Zlotchenko E, Stitt TN, Economides AN, Yancopoulos GD, Glass DJ:akt在成人骨骼肌中的条件激活诱导快速肥大。Mol细胞生物学2004年,24:9295 - 9304。10.1128 / mcb.24.21.9295 - 9304.2004
Izumiya Y, Hopkins T, Morris C, Sato K, Zeng L, Viereck J, Hamilton JA, Ouchi N, LeBrasseur NK, Walsh K:快速/糖酵解肌纤维生长减少肥胖小鼠的脂肪量,改善代谢参数。细胞金属底座2008年,7:159 - 172。10.1016 / j.cmet.2007.11.003
Mammucari C, Milan G, Romanello V, Masiero E, Rudolf R, Del Piccolo P, Burden SJ, Di Lisi R, Sandri C, Zhao J,等.:FoxO3在体内控制骨骼肌的自噬。细胞金属底座2007年,6:458 - 471。10.1016 / j.cmet.2007.11.001
Blaauw B, Canato M, Agatea L, Toniolo L, Mammucari C, Masiero E, Abraham R, Sandri M, Schiaffino S, Reggiani C:Akt的诱导激活增加骨骼肌的质量和力量,而不需要卫星细胞的激活。美国实验生物学学会联合会J2009年,23:3896 - 3905。10.1096 / fj.09 - 131870
Blaauw B, Mammucari C, Toniolo L, Agatea L, Abraham R, Sandri M, Reggiani C, Schiaffino S:Akt激活可防止肌营养不良蛋白缺乏的骨骼肌偏心收缩引起的力下降。哼Mol Genet2008年,17:3686 - 3696。10.1093 /物流/ ddn264
隆美尔C,博丹SC,克拉克BA,罗斯曼R,努涅斯L,斯蒂特TN,扬科波洛斯GD,格拉斯DJ:PI(3)K/Akt/mTOR和PI(3)K/Akt/GSK3通路介导igf -1诱导的骨骼肌管肥大。Nat细胞生物学2001年,3:1009 - 1013。10.1038 / ncb1101 - 1009
Michael A, Haq S, Chen X, hich E,崔l, Walters B,邵z, Bhattacharya K, Kilter H, Huggins G,等.:糖原合成酶激酶3 β调节生长,钙稳态和心脏舒张功能。生物化学2004年,279:21383 - 21393。10.1074 / jbc.M401413200
高野K,渡边高野H, Suetsugu S,栗田S,土田K,木村S, Karatsu T,竹和T,远藤T:星云蛋白和N-WASP共同作用引起igf -1诱导肌动蛋白丝的形成。科学2010年,330:1536 - 1540。10.1126 / science.1197767
Bentzinger CF, Romanino K, Cloetta D, Lin S, Mascarenhas JB, Oliveri F, Xia J, Casanova E, Costa CF, Brink M,等.:猛禽骨骼肌特异性消融引起代谢改变,导致肌肉营养不良。细胞金属底座2008年,8:411 - 424。10.1016 / j.cmet.2008.10.002
Risson V, Mazelin L, Roceri M, Sanchez H, Moncollin V, Corneloup C, Richard-Bulteau H, Vignaud A, Baas D, Defour A,等.:mTOR的肌肉失活会引起代谢和肌萎缩蛋白缺陷,导致严重的肌病。细胞生物学2009年,187:859 - 874。10.1083 / jcb.200903131
Ohanna M, Sobering AK, Lapointe T, Lorenzo L, Praud C, Petroulakis E, Sonenberg N, Kelly PA, Sotiropoulos A, Pende M:S6K1(-/-)骨骼肌细胞的萎缩揭示了不同的mTOR效应对细胞周期和大小的控制。Nat细胞生物学2005年,7:286 - 294。10.1038 / ncb1231
龟井Y,三浦S,铃木M,启Y,水神J,谷口T,望田K,畑T,松田J, Aburatani H,等.:骨骼肌FOXO1 (FKHR)转基因小鼠骨骼肌质量减少,I型(慢肌/红肌)纤维基因下调,血糖控制受损。生物化学2004年,279:41114 - 41123。10.1074 / jbc.M400674200
Sandri M, Sandri C, Gilbert A, Skurk C, Calabria E, Picard A, Walsh K, Schiaffino S, Lecker SH, Goldberg AL:Foxo转录因子诱导萎缩相关泛素连接酶atrogin1,引起骨骼肌萎缩。细胞2004年,117:399 - 412。10.1016 / s0092 - 8674 (04) 00400 - 3
博丹SC,拉特尔E,鲍姆胡特S,赖VK,努涅斯L,克拉克BA,普伊米鲁WT,帕纳罗FJ,娜E,达玛拉扬K,等.:骨骼肌萎缩所需的泛素连接酶的鉴定。科学2001年,294:1704 - 1708。10.1126 / science.1065874
Gomes MD, Lecker SH, Jagoe RT, Navon A, Goldberg AL:atrogin1,一种肌肉特异性F-box蛋白,在肌肉萎缩时高度表达。美国国家科学研究院2001年,98:14440 - 14445。10.1073 / pnas.251541198
Stitt TN, Drujan D, Clarke BA, Panaro F, Timofeyva Y, Kline WO, Gonzalez M, Yancopoulos GD, Glass DJ:IGF-1/PI3K/Akt通路通过抑制FOXO转录因子防止肌肉萎缩诱导的泛素连接酶的表达。摩尔细胞2004年,14:395 - 403。10.1016 / s1097 - 2765 (04) 00211 - 4
Clarke BA, Drujan D, Willis MS, Murphy LO, Corpina RA, burrova E, Rakhilin SV, Stitt TN, Patterson C, Latres E, Glass DJ:E3连接酶MuRF1在地塞米松处理的骨骼肌中降解肌球蛋白重链蛋白。细胞金属底座2007年,6:376 - 385。10.1016 / j.cmet.2007.09.009
Cohen S, Brault JJ, Gygi SP, Glass DJ, Valenzuela DM, Gartner C, Latres E, Goldberg AL:在肌肉萎缩过程中,粗的而不是细的纤维成分被依赖于murf1的泛素化降解。细胞生物学2009年,185:1083 - 1095。10.1083 / jcb.200901052
Willis MS, Ike C, Li L, Wang DZ, Glass DJ, Patterson C:肌肉无名指1在体内对心肌肥厚有调节作用,而无名指2在体内对心肌肥厚无调节作用。中国保监会Res2007年,100:456 - 459。10.1161/01. res.0000259559.48597.32
Fielitz J, van Rooij E, Spencer JA, Shelton JM, Latif S, van der Nagel R, Bezprozvannaya S, de Windt L, Richardson JA, Bassel-Duby R, Olson EN:心肌梗死后,肌肉特异性无名指3的缺失易导致心脏破裂。美国国家科学研究院2007年,104:4377 - 4382。10.1073 / pnas.0611726104
Fielitz J, Kim MS, Shelton JM, Latif S, Spencer JA, Glass DJ, Richardson JA, basil - duby R, Olson EN:肌球蛋白积累和横纹肌肌病是由无名指1和无名指3的肌肉缺失引起的。J临床投资2007年,117:2486 - 2495。10.1172 / JCI32827
Witt CC, Witt SH, Lerche S, Labeit D, Back W, Labeit S:MuRF1和MuRF2对横纹肌质量和代谢的协同控制。Embo J2008年,27日:350 - 360。10.1038 / sj.emboj.7601952
赵娟,Brault JJ, Schild A,曹p, Sandri M, Schiaffino S, Lecker SH, Goldberg AL:在萎缩的肌肉细胞中,FoxO3通过自噬/溶酶体和蛋白酶体途径协调地激活蛋白质降解。细胞金属底座2007年,6:472 - 483。10.1016 / j.cmet.2007.11.004
Masiero E, Agatea L, Mammucari C, Blaauw B, Loro E, Komatsu M, Metzger D, Reggiani C, Schiaffino S, Sandri M:自噬是维持肌肉质量所必需的。细胞金属底座2009年,10:507 - 515。10.1016 / j.cmet.2009.10.008
Florini JR, Ewton DZ, Coolican SA:生长激素和胰岛素样生长因子系统在肌肉生成中的作用。Endocr牧师1996年,17:481 - 517。
Adams GR, McCue SA:局部输注IGF-I可导致大鼠骨骼肌肥大。J应用物理1998年,84:1716 - 1722。
Chakravarthy MV, Davis BS, Booth FW:IGF-I在固定的老骨骼肌中恢复卫星细胞增殖潜能。J应用物理2000年,89:1365 - 1379。
Barton-Davis ER, Shoturma DI, Musaro A, Rosenthal N, Sweeney HL:病毒介导的胰岛素样生长因子I的表达阻断与衰老相关的骨骼肌功能丧失。美国国家科学研究院1998年,95:15603 - 15607。10.1073 / pnas.95.26.15603
Barton-Davis ER, Shoturma DI, Sweeney HL:卫星细胞对IGF-I诱导骨骼肌肥大的贡献。物理学报1999年,167:301 - 305。10.1046 / j.1365 - 201 x.1999.00618.x
Adams GR, Caiozzo VJ, Haddad F, Baldwin KM:照射后骨骼肌负荷增加的细胞和分子反应。Am J Physiol Cell Physiol2002年,283:c1182 - 1195。
Shavlakadze T, Chai J, Maley K, Cozens G, Grounds G, Winn N, Rosenthal N, Grounds MD:IGF-1在体内诱导骨骼肌肥大需要生长刺激。细胞科学2010年,123:960 - 971。10.1242 / jcs.061119
Moss FP, Leblond CP:卫星细胞作为生长大鼠肌肉细胞核的来源。阿娜特列克1971年,170:421 - 435。10.1002 / ar.1091700405
Schiaffino S, Bormioli SP, Aloisi M:代偿性肌肉肥大期间新形成的卫星细胞的命运。Virchows Arch B细胞Pathol1976年,21:113 - 118。
Bailyes EM, Nave BT, Soos MA, Orr SR, Hayward AC, Siddle K:胰岛素受体/IGF-I受体杂交体广泛分布在哺乳动物组织中:通过选择性免疫沉淀和免疫印迹法定量单个受体物种。物化学J1997年,327(Pt(1): 209 - 215。
Bailey JL, Zheng B, Hu Z, Price SR, Mitch WE:慢性肾脏疾病导致胰岛素受体底物/磷脂酰肌醇3-激酶/Akt通路信号传递缺陷:肌肉萎缩的意义J Am Soc Nephrol2006年,17:1388 - 1394。10.1681 / ASN.2004100842
莫拉A,科曼德D,范阿尔滕DM,阿莱西DR:PDK1, AGC激酶信号转导的主要调节因子。Semin细胞发育生物学2004年,15:161 - 170。10.1016 / j.semcdb.2003.12.022
Fruman DA, Meyers RE, Cantley LC:磷酸肌醇激酶。Annu Rev生物化学1998年,67:481 - 507。10.1146 / annurev.biochem.67.1.481
杨ZZ, Tschopp O, Hemmings- mieszczak M, Feng J, Brodbeck D, Perentes E, Hemmings BA:蛋白激酶B α /Akt1调节胎盘发育和胎儿生长。生物化学2003年,278:32124 - 32131。10.1074 / jbc.M302847200
Shima H, Pende M, Chen Y, Fumagalli S, Thomas G, Kozma SC:p70(s6k)/p85(s6k)基因的破坏揭示了一个小的小鼠表型和一个新的功能性S6激酶。EMBO J1998年,17:6649 - 6659。10.1093 / emboj / 17.22.6649
Gout I, Minami T, Hara K, Tsujishita Y, Filonenko V, Waterfield MD, Yonezawa K:一种新的p70 S6激酶的分子克隆和特征,p70 S6激酶β含有富含脯氨酸的区域。生物化学1998年,273:30061 - 30064。10.1074 / jbc.273.46.30061
斋藤M,十代克P,宫野K,一条H:p70(S6K beta)的克隆和表征定义了一个新的p70 S6激酶家族。生物化学生物物理Res公社1998年,253:470 - 476。10.1006 / bbrc.1998.9784
Tsukiyama-Kohara K, Poulin F, Kohara M, DeMaria CT, Cheng A, Wu Z, Gingras AC, Katsume A, Elchebly M, Spiegelman BM,等.:缺乏翻译抑制剂4E-BP1的小鼠脂肪组织减少。Nat地中海2001年,7:1128 - 1132。10.1038 / nm1001 - 1128
Obsilova T, Obsilova V:FOXO转录因子调控的结构/功能关系。致癌基因2008年,27日:2263 - 2275。10.1038 / onc.2008.20
Tamemoto H, Kadowaki T, Tobe K, Yagi T, Sakura H,早川T, Terauchi Y, Ueki K, Kaburagi Y,佐藤S,等.:胰岛素受体底物-1缺失小鼠的胰岛素抵抗和生长迟缓。自然1994年,372:182 - 186。10.1038 / 372182 a0
Crackower MA, Oudit GY, Kozieradzki I, Sarao R, Sun H, Sasaki T, Hirsch E, Suzuki A, Shioi T, Irie-Sasaki J,等.:不同PI3K-PTEN信号通路对心肌收缩力和细胞大小的调节细胞2002年,110:737 - 749。10.1016 / s0092 - 8674 (02) 00969 - 8
Lawlor MA, Mora A, Ashby PR, Williams MR, Murray-Tait V, Malone L, Prescott AR, Lucocq JM, Alessi DR:PDK1在调节小鼠细胞大小和发育中的重要作用。EMBO J2002年,21:3728 - 3738。10.1093 / emboj / cdf387
Bayascas JR, Wullschleger S, Sakamoto K, Garcia-Martinez JM, Clacher C, Komander D, van Aalten DM, Boini KM, Lang F, Lipina C,等.:PDK1 PH结构域突变抑制蛋白激酶B/Akt,导致体积变小和胰岛素抵抗。Mol细胞生物学2008年,28日:3258 - 3272。10.1128 / MCB.02032-07
Kwiatkowski DJ, Zhang H, Bandura JL, Heiberger KM, Glogauer M, el-Hashemite N, Onda H:一个TSC1小鼠模型揭示了肝血管瘤的性别依赖性致死,以及TSC1缺失细胞中p70S6激酶活性的上调。哼Mol Genet2002年,11:525 - 534。10.1093 /物流/ 11.5.525
Onda H, Lueck A, Marks PW, Warren HB, Kwiatkowski DJ:Tsc2(+/-)小鼠在多个表达gelsolin的位点发生肿瘤,并受遗传背景的影响。J临床投资1999年,104:687 - 695。10.1172 / JCI7319
Gangloff YG, Mueller M, Dann SG, Svoboda P, Sticker M, Spetz JF, Um SH, Brown EJ, Cereghini S, Thomas G, Kozma SC:小鼠mTOR基因的破坏导致早期移植后的致命性,并阻止胚胎干细胞的发育。Mol细胞生物学2004年,24:9508 - 9516。10.1128 / mcb.24.21.9508 - 9516.2004
村上M,一坂T,前田M,大四郎N,原K,艾登霍夫F,清山H,米泽K,山中S:mTOR对早期小鼠胚胎和胚胎干细胞的生长和增殖至关重要。Mol细胞生物学2004年,24:6710 - 6718。10.1128 / mcb.24.15.6710 - 6718.2004
潘德M,恩SH,米耶莱特V,斯蒂格M,戈斯VL,梅斯坦J,穆勒M,福马加利S,科兹马SC,托马斯G:S6K1(-/-)/S6K2(-/-)小鼠表现出围产期致命性和雷帕霉素敏感的5'-端寡嘧啶mRNA翻译,并揭示了丝裂原激活蛋白激酶依赖的S6激酶途径。Mol细胞生物学2004年,24:3112 - 3124。10.1128 / mcb.24.8.3112 - 3124.2004
Le Bacquer O, Petroulakis E, Paglialunga S, Poulin F, Richard D, Cianflone K, Sonenberg N:缺乏4E-BP1和4E-BP2的小鼠对饮食诱导的肥胖和胰岛素抵抗的敏感性升高。J临床投资2007年,117:387 - 396。10.1172 / JCI29528
古山T,北山K,下田Y,小川M,松根K,吉田荒木K,久津H,西川S,中山K,池田K,等.:Foxo1 (Fkhr)缺陷小鼠血管生成异常。生物化学2004年,279:34741 - 34749。10.1074 / jbc.M314214200
保坂T,比格斯WH,蒂欧D,博耶AD,瓦尔基NM,卡文尼WK,阿登KC:叉头转录因子(FOXO)家族成员在小鼠体内的破坏揭示了其功能的多样化。美国国家科学研究院2004年,101:2975 - 2980。10.1073 / pnas.0400093101
Kitamura T, Kitamura YI, Funahashi Y, Shawber CJ, Castrillon DH, Kollipara R, DePinho RA, Kitajewski J, Accili D:Foxo/Notch通路控制肌源性分化和纤维类型规范。J临床投资2007年,117:2477 - 2485。10.1172 / JCI32054
山崎Y,龟美Y,杉田S,赤池F,金井S,三浦S,平田Y,特伦BR,北村T,西野I,等.:组织蛋白酶L基因是骨骼肌中FOXO1的直接靶基因。物化学J2010年,427:171 - 178。10.1042 / BJ20091346
卡斯特里隆DH,苗L,科利帕拉R,霍纳JW,德皮尼奥RA:转录因子Foxo3a对小鼠卵泡激活的抑制。科学2003年,301:215 - 218。10.1126 / science.1086336
白俊华,Kollipara R,褚刚,纪华,肖勇,丁智,苗林,Tothova Z, Horner JW, Carrasco DR,等.:foxo是受世系限制的冗余肿瘤抑制因子,调节内皮细胞稳态。细胞2007年,128:309 - 323。10.1016 / j.cell.2006.12.029
Alzghoul MB, Gerrard D, Watkins BA, Hannon K:IGF-I和Shh在骨骼肌中异位表达抑制废用介导的骨骼肌萎缩和骨质减少美国实验生物学学会联合会J2004年,18:221 - 223。
高桥A,库瑞希Y,杨杰,罗震,郭k, Mukhopadhyay D, Ivashchenko Y, Branellec D, Walsh K:肌源性Akt信号通路调节肌纤维生长过程中的血管招募。Mol细胞生物学2002年,22:4803 - 4814。10.1128 / mcb.22.13.4803 - 4814.2002
Goodman CA, Miu MH, Frey JW, Mabrey DM, Lincoln HC, Ge Y, Chen J, Hornberger TA:磷脂酰肌醇3-激酶/蛋白激酶b对哺乳动物雷帕霉素信号靶点的独立激活足以诱导骨骼肌肥大。Mol生物细胞2010年,21:3258 - 3268。10.1091 / mbc.e10 - 05 - 0454
确认
这项工作得到了欧盟委员会(给S.S.的综合项目MYOAGE)、意大利航天局(ASI,给S.S.的项目OSMA)和帕多瓦大学(2009年给C.M.的Progetto di Ateneo)的资助。我们感谢Marco Sandri对手稿的批判性阅读。
作者信息
作者及隶属关系
相应的作者
额外的信息
相互竞争的利益
作者宣称他们之间没有利益冲突。
作者的贡献
SS构思并设计了该研究。SS和CM起草了手稿。
权利和权限
本文由BioMed Central Ltd授权发布。这是一篇开放获取文章,根据创作共用属性许可协议(http://creativecommons.org/licenses/by/2.0),允许在任何媒介上不受限制地使用、传播和复制,前提是正确地引用原始作品。
关于本文
引用本文
Schiaffino, S, Mammucari, C. IGF1-Akt/PKB通路对骨骼肌生长的调控:来自遗传模型的见解。骨骼肌1, 4(2011)。https://doi.org/10.1186/2044-5040-1-4
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/2044-5040-1-4
关键字
- 局灶粘附激酶
- 卫星细胞
- 肌肉萎缩
- 胰岛素受体底物
- 肌肉肥大