摘要
在骨骼肌中,兴奋-收缩耦合机制介导神经传递的动作电位转化为细胞内钙释放和肌肉收缩。EC偶联需要一个高度特化的膜结构,即三联体,由一个中央t小管和两个来自肌浆网的末端池包围组成。虽然已经确定了位于这些结构上的几种蛋白质,但控制t小管生物发生和三联体形成的机制仍然很大程度上未知。在这里,我们提供了三联体结构和可塑性的描述,并回顾了与骨骼肌中t小管生物发生和三联体形成和/或维持有关的蛋白质的作用:caveolin 3, amphiphysin 2, dysferlin, mitsugumins, junctophilins, myotubularin, ryanodine受体和二氢吡啶受体。这些蛋白质在三联体生物发生和随后的肌肉收缩中的重要性得到了动物模型研究的支持,并通过大多数这些蛋白质在人类肌病中的直接含义得到了证实。
介绍
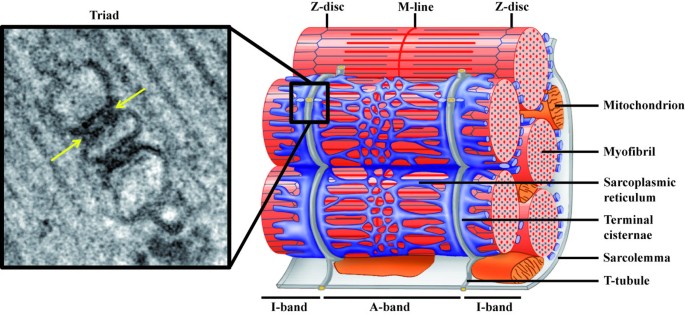
为了触发骨骼肌收缩,运动神经元产生的动作电位通过运动神经传递到肌肉细胞。激发-收缩(EC)耦合,即.信号从肌膜传递到肌动蛋白/肌球蛋白装置,是由第二个信使钙离子介导的。的确,肌肉纤维含有大量的内部钙储存,具有快速释放和回收钙的能力(图2)1(右面板)。为了快速微调肌肉收缩,这些储存在动作电位的控制下维持,这确保了钙在整个肌纤维内部同时释放。由于肌纤维的直径为50 ~ 100 μm,长度为几毫米~厘米,因此需要一种高度专门化的结构,称为“三联体”,以克服利用钙作为次级信使的空间限制,并将肌膜与钙储存连接起来。肌膜在肌原纤维之间形成规则的内陷,称为横小管(t小管)。在骨骼肌中,t小管与肌浆网(SR)紧密相连,在一个称为末端池/连接池的区域。一个t小管与小管两侧的两个末端池紧密相连,形成了三联体(图2)1)。
骨骼肌中的黑社会组织.左:三联结的电子显微照片。中央t小管两侧是肌浆网的末端池元件。箭头表示电子密集的连接脚对应于ryanodine受体-二氢吡啶受体复合物。右图:哺乳动物肌肉肌节及其周围膜的示意图。灰色显示的t小管是肌膜的特化内陷。精细的肌浆网网络用蓝色表示。注意t小管和肌浆网末端池的距离很近(改编自[104];©2007年,皮尔森教育公司出版)。
大量的特化蛋白参与EC偶联,包括:i)二氢吡啶受体(DHPR),一种位于t小管膜上的电压门控钙通道[1,2ii) Ryanodine Receptor (RyR1),这是一种钙释放通道,定位于SR的交界面,在电子显微镜下呈“脚”状(图2)1,左面板)[3.], iii) SR管腔内的钙缓冲蛋白,如钙sequestrin [4], iv)钙通道调节剂,如钙调素,FKBP12和许多其他[5,6], v)肌内质网钙atp酶泵(SERCA),它通过纤维缩短后快速去除胞质钙来补充钙储存的作用间接参与EC偶联[7]。值得注意的是,RyR1和DHPR之间的物理耦合只发生在骨骼肌中,而不发生在心肌中,这使得骨骼肌中的信号在2 ms内传输,而心肌中的信号在100 ms内传输[8]。在心肌肌纤维中,ryr2介导的钙释放是由DHPR介导的细胞外钙进入诱导的,其机制称为钙诱导钙释放(calcium-induced calcium release, CICR) [8]。此外,在小直径的纤维中,如文文鱼的身体肌肉,SR与质膜之间的外周耦合具有类似于三联体的功能。此外,所有分化肌纤维都会经历一个t小管不存在的阶段,EC偶联是由这种外周偶联介导的。
在这篇综述中,我们将重点关注骨骼肌中t小管生物发生和三联体形成的分子机制。与人类单基因疾病有关的三联体缺陷也将被强调。
连接可塑性
t小管膜具有很高的可塑性,在肌肉收缩过程中提供了所需的稳定性,并有助于损伤后的修复。除了其在EC耦合中的主要功能外,t管的塑性还赋予该系统不相关的EC功能。
据报道,用甘油外排-内流或其他低分子量非电解质(如糖)处理分离肌纤维会对t小管形态产生物理影响。这种渗透冲击可以将t小管网络转化为许多膜结合的液泡,这些液泡可以通过正常的t小管保持相互连接,也可以分离(图2)2) [9,10]。令人惊讶的是,这种导致t管系统相对体积增加5-15倍的空泡化是自发逆转的[11,12]。此外,这一观察结果仅针对横小管膜,因为似乎没有涉及其他细胞内膜系统[12],可能是因为它们的管腔与细胞外空间相连。
由甘油外排产生的t小管空泡化动力学.用亲脂性荧光探针染色的单个青蛙骨骼肌纤维。所示为同一纤维的连续共聚焦显微图像(一)5分钟,(b)12分钟和(c)将纤维从含有110 mM甘油的溶液转移到不含甘油的溶液后30分钟(转载自[10];©2001年获得爱思唯尔许可)。
除了这种人为条件外,在肌肉疲劳或疾病时也会观察到这种空泡现象[10,13]。基于这种可塑性和t -管网络的大膜表面(相当于约80%的肌膜表面),提出了与EC耦合无关的t -管系统的几个功能[10,13]。这些包括:i)水分平衡和细胞体积的调节,ii)肌肉疲劳的恢复,iii)运输途径,包括内吞作用、胞吐作用和外源DNA的渗透。参与这些过程的分子机制仍有待研究。
三位一体生物发生的形态学方面
肌浆网
SR代表横纹肌中主要的钙储存。它是高度专业化的,以确保同时释放细胞内钙在整个肌细胞的细胞质。SR生物发生的第一步是在肌原纤维附近形成管状内质网(ER)(直径30-60 nm) [14]。随后,内质网的管状分支发育成围绕肌原纤维的网状结构[15]。最后,新形成的SR在A-I界面与源自肌膜的t小管接合。与SR的功能和结构组织有关的分子决定因素已在其他地方进行了综述[16]。
利用电镜(EM)对小鼠肌肉分化过程中SR生物发生的年表进行了很好的研究[17]。这些观察结果也得到了利用鸡胚胎的研究的支持[18]。在小鼠中,早在胚胎第14天(E14)就可以检测到SR,其点状RyR簇位于肌纤维的周围[17]。在此阶段,接合SR中足部(RyR)含量较差,观察到部分SR元素无足部。在E16,含有RyR的元素变得丰富,并开始与新形成的肌节的A带边缘(A- i连接)相关联。这种关联导致了在i波段具有薄的纵向连接SR元素的离散SR网络的明显带状模式[17]。在接下来的几天(E17和E18),接合SR获得了主要的横向分布,通过在z线的每一侧形成三联排(每个三联排中有两个SR囊连接一个t小管)占据了最终位置[17]。在SR膜的成熟过程中,足部频率增加,特别是在E16和E18之间,当所有结都被足部填充时。结隙宽度在9 ~ 12 nm之间。含RyR元素的成熟是在出生时完成的[17]。在分化肌管中使用标记SR蛋白的优雅实验表明,SR组织与纵向和连接SR蛋白的动态定位是平行的[19]。
横小管
t小管是质膜的内陷,只存在于横纹肌中。它们的作用是通过电压传感器通道DHPR在膜去极化的严格控制下维持SR钙的储存[2]。对鸡和小鼠胚胎的形态学研究表明,t小管在SR后开始形成。17,18]。在小鼠胚胎中,第一个明确的小管可以在E15观察到。在这一阶段,它们从肌管内的肌膜向内挤压短柱体[17]。在E16,新形成的t小管在肌纤维中延伸得更深,通过短的横段与表面保持连接,但它们主要是纵向的。在妊娠的最后几天(e17,18,19), t小管逐渐侵入整个纤维;它们大多数是纵向的,有一些横向连接元件[17,18]。t小管的横向定向是在产后实现的。小鼠出生后3周完成t小管的最终成熟[17,20.]。
参与t小管生物发生和三联体形成和维持的分子机制
虽然表征t小管生物发生和三联体形成的事件在形态学上是明确的,但分子机制仍然难以捉摸。在过去的20年里,有几种蛋白质被提出参与这些机制,并且大多数相应基因的突变与人类和/或啮齿动物的肌肉疾病有关。这些蛋白包括小窝蛋白3 (CAV3)、骨骼肌特异性的两栖素2 (BIN1)、异铁蛋白(DYSF)、线粒体蛋白(MG)、结膜亲蛋白(JPH1)和肌小管蛋白(MTM1)1)。在这种情况下,人们应该区分导致t小管生物发生的机制和那些参与适当组装的三组分(即一个t小管元件与两个连接的SR池)。根据以往的报道,我们将CAV3、BIN1、DYSF归类为t小管生物发生机制,将mitsugumins和junctophilin归类为三联体形成机制,而MTM1在这一分类中的位置尚不清楚。
3窖蛋白
小泡是质膜上的小室,呈50 ~ 100 nm的囊泡内陷,在信号转导和囊泡运输中起重要作用[j]。21]。与其他主要由磷脂组成的质膜区域不同,小泡被认为是富含胆固醇-鞘脂的筏结构域[22]。小窝的主要蛋白质成分是小窝蛋白(CAV),这是一种胆固醇结合蛋白[22]。在哺乳动物中,洞穴蛋白家族有三个成员;CAV1和CAV2在非肌肉细胞尤其是脂肪细胞中共表达[21,23]而CAV3主要存在于横纹肌中,其表达在肌肉分化过程中受到诱导[24]。在骨骼肌中,CAV3定位于肌膜,在那里它可以与肌营养不良蛋白及其相关糖蛋白形成复合物[25]。除了肌膜外,CAV3还定位于发育中的t小管[26]。
内的突变CAV3与几种肌肉疾病有关。特别是,导致CAV3蛋白缺失或CAV3表达减少90%以上的突变,会导致常染色体显性肢带肌营养不良症(LGMD1C),表现为轻度至中度近端肌无力[27]。此外,CAV3在波纹肌病中发现突变[28]、家族性肥厚性心肌病[29和长QT综合征[30.]。此外,其在mdx小鼠胫骨前肌中的表达增加,提示CAV3可能参与了DMD的发病机制[31]。
缺乏CAV3的小鼠表现出类似于人类病理的轻度肌病表型[32]。此外,小鼠体内CAV3的异位表达导致杜氏样肌营养不良表型[33]。根据其在t小管中的定位,CAV3的缺失导致t小管膜的紊乱,使其扩张并失去横向定向(图2)3和3 b) [32]。这证明CAV3对肌肉功能至关重要,并在t小管生物发生中发挥作用。一些证据表明,类似的机制控制着t小管系统和小泡的形成。事实上,成熟和发育中的t小管与CAV3有关,并且含有比质膜多约四倍的胆固醇[34,35]。此外,用两性霉素B(一种胆固醇结合药物)处理上皮细胞会导致细胞表面形态学上确定的小泡的丢失。与上皮细胞中的CAV1类似,两性霉素B处理C2C12肌管后,DHPR α和CAV3显著重新分布。有趣的是,其他富含胆固醇的隔室,如反式高尔基网络似乎没有受到影响。34]。
骨骼肌中与三联组织有关的蛋白质.(一)电镜图像显示了野生型小鼠经氰酸铁处理后的肌肉。(b)电子显微镜图像显示氰酸亚铁处理肌肉从Cav3(caveolin 3)-突变小鼠注意t小管的外观和方向的改变(源自[32];©美国生物化学与分子生物学学会(2001)。(c)电子显微镜图像果蝇正常的肌肉。请注意,二元体定位在z线附近(类似于脊椎动物)。(d至f)电子显微图像Bin1(amphiphysin)零果蝇显示t小管的改变导致(d)mislocalized,(e)纵向和(f)扩张的小管(源自[43];©2001 .冷泉港实验室出版社)。(g ~ j)电子显微镜图像的氰酸亚铁处理肌肉从(g和h)野生型和(i和j)MG29(mitsugumin)敲除小鼠显示t小管组织的改变。注意没有(我)连接或(j)纵向方向(源自[61];©1999洛克菲勒大学出版社。细胞生物学杂志,2002,59:695-705)。(k和l)电子显微图像(k)野生型和(左)JPH1(结膜亲蛋白)敲除的新生小鼠骨骼肌显示出三联体的改变和肿胀的SR(转载自[73];©2002年获得爱思唯尔许可)。(m和n)电子显微镜图像的氰酸亚铁处理肌肉从(m)野生型和(n)Dysf(dysferlin)基因敲除的小鼠显示t小管系统形状异常(源自[51];©2010 John Wiley and Sons)。(0和p)电子显微镜图像的氰酸亚铁处理肌肉从(o)野生型和(p)Mtm1(肌小管蛋白)敲除小鼠显示t小管组织的严重改变。注意缺少(箭头)或纵向方向(箭头)的t小管(从[82];©美国国家科学院,2009)。
Amphiphysin 2 (BIN1)
突变BIN1与常染色体隐性核心性肌病有关[36一种以肌肉无力、肌纤维萎缩和肌纤维内细胞核位置异常为特征的疾病。
Amphiphysin是膜弯曲和曲率传感蛋白,能够通过其BAR (Bin/Amphiphysin/Rvs)结构域管化脂质膜。无处不在的两性蛋白2,由BIN1该基因在骨骼肌中高度表达,并被认为参与了t小管的生物发生。它在这一过程中的作用是由外显子11编码的多碱性氨基酸延伸提供的,这对于它在t小管膜上的募集是重要的[37,38]。这个多碱基序列可以特异性结合磷酸肌苷PtdIns(4,5)。P2和PtdIns4体外P.有趣的是,pttin的水平(4,5)P2和BIN1在C2C12肌管分化过程中同时升高[37,39]。
此外,BIN1可以单独或与动力蛋白2 (DNM2)合作管化膜,动力蛋白2是另一种在核中心性肌病中突变的蛋白[40,41]。BIN1与DNM2的协同作用是通过BIN1 SH3结构域与DNM2富含脯氨酸结构域的相互作用介导的。然而,这种相互作用可能不会发生在BIN1与膜结合之前,因为多碱基序列在非膜结合时与SH3结构域结合[42]。事实上,PtdIns(4、5)P2结合是释放SH3结构域所必需的,进一步使SH3结构域与DNM2相互作用[42]。虽然这种分子内调节的存在已在培养细胞中被破译,但尚不确定是否有类似的机制调节t小管曲率。然而,表达缺乏多基序列的BIN1突变体的肌管不能形成正常的膜小管网络[42]。
缺少同源物的果蝇突变体BIN1(amphiphysin)表现出与t小管形态和EC偶联改变相关的骨骼肌缺陷(图2)三氟) [43]。有趣的是,对肌肉活检患者的EM分析BIN1突变显示t小管形态异常[44]。在培养的COS-1细胞中,与野生型构建相比,BAR结构域中与CNM相关的突变过表达未能形成膜小管,这表明缺乏bin1介导的膜重塑可能是肌肉疾病的基础[36]。
令人惊讶的是,没有骨骼肌缺损的报道Bin1-/-老鼠。然而,这些小鼠由于心肌病而在围产期死亡,因此无法对出生后的骨骼肌进行详细分析[45]。
Dysferlin
DYSF (DYSF)是一个230 kDa的蛋白,属于与秀丽隐杆线虫ferlin相似的基因家族。它包含一个c端跨膜结构域和多个参与钙结合和钙依赖膜融合和修复的C2结构域。基因内的突变DYSF基因与等位基因肌肉疾病有关,包括常染色体隐性肢体带状肌营养不良2B型[46],三吉肌病[47]和远前室肌病[48]。DYSF在分化骨骼肌中有肌层定位,这与其在膜修复中的作用有关[49]。然而,在C2C12细胞中进行的研究表明,在肌管分化过程中,DYSF除了与细胞融合位点外,还与t小管网络相关,并可在肌纤维损伤时转移到肌膜[50]。有趣的是,对皮下注射诺特辛诱导再生的成年大鼠肌肉进行的研究表明,在肌纤维再生的早期阶段(诺特辛治疗后的第一周内),DYSF主要定位于t小管,并在再生的后期向肌膜转移[51]。
已经产生了几种小鼠系来操纵DYSF的水平和功能,并且自发的SJL菌株被证明在其c -末端包含帧内缺失Dysf基因(49,52- - - - - -55]。与CAV3小鼠突变体类似,DYSF缺陷小鼠的t小管结构发生改变,小管更加扩张和纵向定向[51)(图3 m n)。这些缺陷被认为是原发性的,因为它们在疾病的早期阶段被观察到,当时肌原纤维结构和肌膜的异常很小。DYSF在t小管生物发生中的作用仍未确定,然而,有人认为DYSF有助于含有小泡蛋白3的囊泡与t小管的融合。这一建议是基于i)成熟骨骼肌中DYSF与DHPR的相互作用,ii)已知的DYSF与CAV3的相互作用,以及iii)早期肌形成过程中CAV3与DYSF的部分共定位[56,57]。这一假设也得到了异常铁蛋白病患者与t小管系统相邻的肌层下液泡积累的支持[58]。
Mitsugumins
除了上述涉及t小管生物发生的蛋白质外,其他蛋白质还涉及SR末端池的成熟以及t小管与SR之间的连接。这就是Synaptophysin家族成员的情况,例如mitsugumin 29 (MG29或Synaptophysin -like 2, SYPL2),这是一种在重SR囊泡制备中高度富集的跨膜蛋白[59]。MG29在肌发生早期,甚至在三联肌出现之前表达。它首先与新形成的SR囊泡相关,然后与三联体相关,三联体在肌肉形成过程中出现。59]。这些观察结果暗示MG29参与了连接SR的早期形成及其与t小管的连接[qh]59,60]。在MG29-KO小鼠,肌肉质量下降,发力能力略有下降[61]。在这些小鼠中也报道了储运性钙进入(SOCE)功能障碍导致细胞内钙稳态缺陷和肌肉疲劳增加[62,63]。突变肌肉的EM分析显示三联结构的形态学改变,包括肿胀的SR和纵向t小管(图2)3 g-j) [61]。然而,SR和t小管之间的实际联系似乎并没有改变。因此,尚不清楚三联体结构中的这种紊乱是否与观察到的SOCE缺陷有关。
另一种mitsugumin MG53(也称为TRIM72)已被确定为横纹肌细胞膜内运输和膜修复机制的关键参与者[64,65]。除了在横纹肌中特异性表达外,MG53还被证明与异铁蛋白和小窝蛋白3结合,这两种蛋白直接参与t小管的生物发生[64,66]。没有研究表明MG53在三联膜的生物发生中有直接的意义;然而,目前的证据支持其作为这一机制的潜在新伙伴的含义。
Junctophilins
JPH家族成员被认为是连接膜的组成部分,它们可以通过其c端跨膜结构域连接SR,通过其n端结构域连接t小管/质膜。更具体地说,n端结构域可以结合膜磷脂,包括鞘磷脂和磷脂酰胆碱[67]。在哺乳动物的四种结膜亲蛋白样蛋白(JPH1-4)中,JPH1主要在骨骼肌中表达,而JPH2也在心肌中表达,并与肥厚性心肌病有关[qh]67- - - - - -69]。然而,JPH3和4在大脑中共表达,其中JPH3被发现与亨廷顿样疾病有关[70,71]。
JPH1缺陷小鼠在出生后不久就会死亡,原因是颌骨肌肉缺陷导致哺乳不足[72]。胚胎和新生小鼠的骨骼肌电镜分析显示,三联体形态出现了一些异常,导致肌肉收缩缺陷[72,73]。这些异常包括三联体数量减少、交界处SR肿胀、部分空泡化的纵向SR和SR网络定向不规则(图2)3 k-l)。此外,对新生小鼠突变肌肉的功能分析显示,这些肌肉对细胞外钙刺激的反应增加,表明EC偶联存在缺陷[72]。当JPH1在两栖动物胚胎细胞中过度表达时,它能够诱导内质网和质膜之间的连接,这也支持了JPH1在膜连接的生物发生中的特殊作用[67]。此外,的表达JPH1在出生后增强,作为在三联体晚期生物发生和成熟中的作用的指标[72]。
Myotubularin
肌管蛋白(Myotubularin, MTM1)是磷酸肌苷磷酸酶家族的一员,在进化过程中一直保存到酵母,在人类中有14个成员。74]。虽然肌小管蛋白普遍表达,但其内部的突变MTM1导致骨骼肌疾病:核中心性肌病的x连锁形式,也称为肌管性肌病,将出生时严重的肌肉萎缩和虚弱与核的异常定位联系起来[75]。这表明MTM1具有肌肉特异性作用,这是同源蛋白无法弥补的。在体外在酵母和哺乳动物细胞中进行的过表达研究归因于MTM1在内体和膜运输途径中的功能,并表明MTM1特异性地使ptdin3去磷酸化P和PtdInsp(3、5)P2转化成磷脂酰肌醇和PtdIns5P分别为(76- - - - - -79]。最近,免疫组织学和电镜分析显示,AAV介导的MTM1在小鼠肌肉中的过表达导致异常膜结构的形成[80]。这些结构包括来源于肌膜和/或t小管的液泡,因为它们对小窝蛋白-3、肌营养不良蛋白和二氢吡啶受体(DHPR)呈阳性染色,对层粘连蛋白2呈阴性染色,并且还含有外源性MTM1蛋白[80]。这表明MTM1在骨骼肌膜结构的生成或维持中具有直接或间接的作用。
Mtm1KO小鼠表现为进行性核中心肌病[81]。的电子显微镜分析Mtm1KO肌肉显示t小管结构的改变,其特征是t小管的纵向取向和t小管成分缺失的三联体的存在(图2)3 o-p) [82]。随着疾病进展,这些改变变得更加明显[44,82]。同样的,mtm1斑马鱼的变种和mtm-枯竭的果蝇肌肉表现出三联肌的结构缺陷,这种缺陷也在肌小管肌病患者的肌肉中观察到[44,83,84]。由于MTM1在小鼠和小鼠出生后的生命中表达增加Mtm1与疾病晚期相比,KO肌肉在早期阶段表现出较少的t小管改变,可能MTM1在t小管的晚期成熟和/或维持中发挥关键作用,而不是在其早期生物发生中发挥关键作用。
RyR-DHPR复合体
RyR-DHPR相互作用将SR与骨骼肌中的t小管物理连接,从而介导动作电位转化为细胞内钙释放。RyR1,骨骼肌里诺定受体,与恶性高热的易感性有关[85,86],并在以可变组织学结果为中心核心的肌病中突变[87,88],多微核[89],先天性纤维型失调[90,91]和/或核集中[92,93]。人们认为RyR和DHPR之间的直接相互作用对于t小管和SR的组装是必要的[94]。在肌发生过程中,RyR和DHPR的同时表达与这一观点一致[94]。然而,在缺乏一种或两种蛋白质的小鼠模型中进行的免疫荧光和EM研究表明,情况不太可能是这样。更具体地说,缺乏RyR(发育不良)或DHPR(肌肉发育不良,mdg小鼠),甚至两种蛋白质的突变小鼠形成与野生型小鼠结构相似的三合一连接[95- - - - - -99]。此外,尽管细胞内储存的钙释放受到很大影响,但这些肌管对其他SR成分(如钙sequestrin和triadin)的配置正常[96,One hundred.]。这表明RyR和DHPR都不是三联体结构生物发生所必需的。
结论
关于t小管的起源是由细胞膜向内运动还是向外运动引起的,人们已经争论了几十年。一些同事认为,囊泡内陷与内膜小管融合,从而促进了它们与表面的连接[34]。然而,越来越多的证据支持t小管是由表面膜内陷形成的假设,从小泡开始[17,18,37]。在肌纤维成熟过程中,t小管网络生长并占据整个肌纤维。t小管增殖可能通过两种互补的机制发生:1)膜内陷和管化,2)膜添加(图2)4)。BIN1是调控t小管膜管化的一个有希望的候选分子。t小管内陷可在肌膜上形成小泡的部位触发。也有可能t小管的生长是由内体和/或小泡产生的新膜保证的。CAV3、DYSF和MTM1可能通过调节内部膜的结合和/或现有管膜的周转,在生长的t小管的形成和重塑中发挥重要作用。在SR侧,mitsugumin和junctophilin蛋白对于将连接SR定位到靠近横向小管的位置很重要。膜内陷和管化可能在t小管生物发生的早期阶段(即肌肉分化或肌肉损伤后)更为活跃,膜的增加可能是出生后肌肉生长或维持过程中t小管增殖的主要机制。
很可能其他蛋白质在这些过程中也起着重要的作用,比如triadin [19,101,102[a],一种位于SR或TCAP上的蛋白质],一种与肌节组装有关的大蛋白质,最近被认为在t小管生物发生中起作用[103],但它们对骨骼肌三联症生物发生的直接影响仍有待证实。关于参与三联体生物发生的其他潜在蛋白质,以及它们在肌肉发育中的生物学作用,还有很多需要了解的。
参考文献
Curtis BM, Catterall WA:骨骼肌横小管电压敏感钙通道钙拮抗剂受体的纯化。生物化学,1984,23:2113-2118。10.1021 / bi00305a001。
[3]王晓明,王晓明,王晓明,等。硝基地平受体在骨骼肌中的作用。生物化学学报,2003,28(4):559 - 564。
李建军,李建军,李建军,等。心脏肌浆网ryanodine受体的分离及与足部结构的关系。中国生物医学工程学报,2002,26(2):563 - 564。
MacLennan DH, Wong PT:肌浆网中钙隔离蛋白的分离。美国国家科学促进会。[j] .中国科学:地球科学。10.1073 / pnas.68.6.1231。
陈士林,张莉,MacLennan DH .: 12-kDa FK506结合蛋白对ryanodine受体Ca2+释放通道的不对称阻断。美国国家科学促进会。[j] .中国科学:地球科学。10.1073 / pnas.91.25.11953。
徐丽娟,陈建军,陈建军。骨骼肌Ca2+释放通道(ryanodine受体)的钙调素激活和抑制。中国生物医学工程学报,2009,29(2):444 - 444。10.1016 / s0006 - 3495(95) 79880 - 0。
MacLennan DH, Brandl CJ, Korczak B, Green NM:兔肌浆网Ca2+ + Mg2+依赖性atp酶的氨基酸序列,从其互补DNA序列推断。自然,1985,31(6):696-700。10.1038 / 316696 a0。
Fill M, Copello JA: Ryanodine受体钙释放通道。中国生物医学工程学报,2002,32(2):893-922。
陈建军,陈建军,陈建军,陈建军,陈建军。t小管液泡对细胞外葡聚糖和DNA的可及性:液泡化的机制和潜在应用。[J]中国生物医学工程学报,2009,31(2):693 - 693。10.1023 /: 1005320929284。
Krolenko SA, Lucy JA:骨骼肌中t小管的可逆空泡化:细胞生物学的机制和意义。中华医学杂志,2001,32(2):393 - 398。
Krolenko SA, Adamian S:[用共聚焦荧光显微镜检测青蛙肌肉纤维t系统空泡化的立体分析]。中华口腔医学杂志,2000,42(2):1125-1133。
Krolenko SA, Lucy JA:生物膜系统中t小管的液泡化模型。中国生物医学工程学报,2002,26(2):893-904。10.1006 / cbir.2002.0945。
兰纳格伦J,布鲁顿JD, Westerblad H:蛙和小鼠疲劳单一肌肉纤维的液泡形成。[J]中国生物医学工程学报,1999,32(2):559 - 561。10.1023 /: 1005412216794。
克拉斯基W, Jakubowska M:胚胎兔骨骼肌肌原纤维形成的电镜研究。[j] .中国科学院学报,1999,19(3):559 - 561。
Luff AR, Atwood HL:出生后发育过程中小鼠快、慢骨骼肌肌浆网和横管系统的变化。中国生物医学工程学报,2011,31(2):369-383。10.1083 / jcb.51.2.369。
Rossi D, Barone V, Giacomello E, Cusimano V, Sorrentino V:肌浆网:一个专门领域的有组织的补丁。交通,2008,9:1044-1049。10.1111 / j.1600-0854.2008.00717.x。
陈建军,陈建军,陈建军,等。小鼠骨骼肌t小管/SR连接的序列对接、分子分化和定位。生物医学工程学报,2001,29(3):204-214。10.1006 / dbio.2001.0437。
刘建军,陈建军,陈建军。骨骼肌肌浆网和横小管与肌原纤维的关系。中国生物医学工程学报,1993,32(1):391 - 391。10.1006 / dbio.1993.1292。
库西马诺,潘皮内拉F, Giacomello E, Sorrentino V:骨骼肌细胞纵向和连接肌浆网蛋白质的组装和动力学。美国国家科学促进会。[j] .中国科学:地球科学。10.1073 / pnas.0810243106。
Franzini-Armstrong C:小鼠肌肉分化过程中横小管和肌浆网同时成熟。中国生物医学工程学报,2001,32(4):353-363。10.1016 / 0012 - 1606 (91) 90237 - w。
李建军,李建军,李建军,张建军,张建军,张建军,张建军,张建军,张建军。中国生物医学工程学报,1994,4(4):391 - 391。10.1016 / 0962 - 8924(94) 90114 - 7。
Smart EJ, Graf GA, McNiven MA, Sessa WC, Engelman JA, Scherer PE, Okamoto T, Lisanti MP:小洞蛋白、液体有序结构域和信号转导。中国生物医学工程学报,1999,19(3):789 - 794。
Scherer PE, Okamoto T, Chun M, Nishimoto I, Lodish HF, Lisanti MP:小窝蛋白基因家族的鉴定、序列和表达。美国国家科学促进会。[j] .中国科学:地球科学。10.1073 / pnas.93.1.131。
唐志,Scherer PE, Okamoto T, Song K, Chu C, Kohtz DS, Nishimoto I, Lodish HF, Lisanti MP:肌肉小窝蛋白家族新成员caveolin-3的分子克隆。生物化学学报,1996,31(2):555 - 561。10.1074 / jbc.271.4.2255。
宋建军,李世生,Okamoto T, Quilliam LA, Sargiacomo M, Lisanti MP:小泡微域整体膜蛋白Ras的共纯化及直接作用。小泡微域的无洗涤剂纯化。生物化学学报,1996,31(1):990 - 997。10.1074 / jbc.271.16.9690。
王晓明,王晓明,王晓明,等。肌分化过程中t小管的形成与细胞凋亡的关系。中国生物医学工程学报,1997,26(3):344 - 344。10.1083 / jcb.136.1.137。
mintti C, Sotgia F, Bruno C, Scartezzini P, Broda P, Bado M, Masetti E, Mazzocco M, Egeo A, Donati MA,等:常染色体显性肢体肌营养不良基因突变的研究。生物医学工程学报,1998,18(3):368 -368。10.1038 / ng0498 - 365。
Betz RC, Schoser BG, Kasper D, Ricker K, Ramirez A, Stein V, Torbergsen T, Lee YA, Nothen MM, Wienker TF,等:CAV3基因突变引起波浪形肌病骨骼肌机械亢进。生物医学工程学报,2001,28(2):218-219。10.1038/90050。
林志刚,田志刚,田志刚,柴田,郝田,高桥,何志刚,古贺,奥冈,等:家族性肥厚性心肌病小泡蛋白-3基因突变的鉴定和功能分析。生物化学学报,2004,31(3):368 - 378。10.1016 / j.bbrc.2003.11.101。
Vatta M, Ackerman MJ, Ye B, Makielski JC, ughze EE, Taylor EW, Tester DJ, Balijepalli RC, Foell JD, Li Z,等:突变caveolin-3诱导持续晚钠电流与长qt综合征相关。流通。2006,114:2104-2112。10.1161 / CIRCULATIONAHA.106.635268。
方健,吴伟,王立军,王立军。小鼠肌肉中小窝蛋白-3水平的变化。科学通报,1998,31(4):125-127。10.1016 / s0014 - 5793(98) 00738 - 8。
Galbiati F, Engelman JA, Volonte D, Zhang XL, Minetti C, Li M, Hou H, Kneitz B, Edelmann W, Lisanti MP:小泡蛋白-3缺失小鼠出现小泡缺失、肌营养不良蛋白-糖蛋白复合物微结构域分布改变和t小管异常。生物化学学报,2001,26 (2):21425-2143310.1074 / jbc.M100828200。
Galbiati F, Volonte D, Chu JB, Li M M, Fine SW, Fu M, Bermudez J, Pedemonte M, Weidenheim KM, Pestell RG,等:骨骼肌纤维小泡蛋白-3的转基因过表达诱导duchenne样肌营养不良表型。美国国家科学促进会。[j] .中国科学:地球科学。
王晓明,王晓明,王晓明,等。胆固醇在t小管发育中的作用:t小管和小泡生物发生的类似机制。交通,2000,1:326-341。10.1034 / j.1600-0854.2000.010406.x。
M ., M ., M ., M .:兔骨骼肌横小管膜的免疫生化特性。中国生物医学工程学报,2011,32(2):444 - 444。
Nicot AS, Toussaint A, toschv, Kretz C, Wallgren-Pettersson C, Iwarsson E, Kingston H, Garnier JM, Biancalana V, Oldfors A,等:两性生理蛋白2 (amphiphysin 2, BIN1)突变破坏与动力蛋白2的相互作用并导致常染色体隐性核心性肌病。中国生物医学工程学报,2007,39(3):1134-1139。10.1038 / ng2086。
Lee E, Marcucci M, Daniell, Pypaert M, Weisz OA, Ochoa GC, Farsad K, Wenk MR, De Camilli P:肌肉中Amphiphysin 2 (Bin1)的生物发生。科学,2002,29(7):1193-1196。10.1126 / science.1071362。
Ramjaun AR, McPherson PS:多种两性蛋白II剪接变体显示不同的网格蛋白结合:两个不同的网格蛋白结合位点的鉴定。中华神经科杂志,1998,32(3):369- 376。
张建军,张建军,张建军,等。肿瘤抑制因子Bin1在肌肉细胞分化中的作用。中国生物医学工程学报,1998,18(5):566-575。
Bitoun M, Maugenre S, Jeannet PY, Lacene E, Ferrer X, Laforet P, Martin JJ, Laporte J, Lochmuller H, Beggs AH,等:动力蛋白2突变导致显性核中心肌病。中国生物医学工程学报,2005,37(3):1107 - 1109。10.1038 / ng1657。
李建军,李建军,李建军,等。两溶蛋白和动力蛋白在网格蛋白介导的内吞作用中的作用。中华生物医学工程学报,1999,19(1):393 - 393。10.1038/9004。
李晓明,李晓明,李晓明,李晓明,李晓明,李晓明,李晓明,李晓明,李晓明,李晓明。磷酸肌内酯对b_1 - SH3结构域的影响。中国生物医学工程学报,2004,23(3):413- 422。10.1038 / sj.emboj.7600442。
Razzaq A, Robinson IM, McMahon HT, Skepper JN, Su Y, Zelhof AC, Jackson AP, Gay NJ, O'Kane CJ:两栖素在果蝇肌肉兴奋-收缩耦合机制的组织中是必需的,但在突触囊泡内吞作用中不是必需的。中国生物医学工程学报,2001,25(5):667 - 679。10.1101 / gad.207801。
Toussaint A, coling BS, Hnia K, Mohr M, Oldfors A, Schwab Y, Yis U, Maisonobe T, Stojkovic T, Wallgren-Pettersson C,等:两角化蛋白2 (BIN1)在几种核中心性肌病中的缺陷。中华神经科杂志,2011,21(1):253-266。10.1007 / s00401 - 010 - 0754 - 2。
Muller AJ, Baker JF, DuHadaway JB, Ge K, Farmer G, Donover PS, Meade R, Reid C, Grzanna R, Roach AH,等:靶向破坏小鼠Bin1/Amphiphysin II基因不会使内吞噬功能丧失,但会导致胚胎心肌病的异常肌原纤维形成。中国生物医学工程学报,2003,23(3):495 - 496。10.1128 / mcb.23.12.4295 - 4306.2003。
Bashir R, Britton S, Strachan T, Keers S, Vafiadaki E, Lako M, Richard I, Marchand S, Bourg N, Argov Z,等:一种与秀丽隐杆线虫精子发生因子1 -1相关的基因在肢带肌营养不良2B型中的突变。生物医学工程学报,1998,20:37-42。10.1038/1689。
Liu J, Aoki M, Illa I, Wu C, Fardeau M, Angelini C, Serrano C, Urtizberea JA, Hentati F, Hamida MB,等:一个新的骨骼肌基因Dysferlin在三吉肌病和肢带肌营养不良症中发生突变。[j] .生物医学工程学报,1998,20:31-36。10.1038/1682。
Illa I, Serrano-Munuera C, Gallardo E, Lasa A, Rojas-Garcia R, Palmer J, Gallano P, Baiget M, Matsuda C, Brown RH:远前室肌病:异常蛋白突变导致新的肌营养不良表型。中国生物医学工程学报,2001,29(4):391 - 391。10.1002 / 1531 - 8249 (200101) 49:1 < 130:: AID-ANA22 > 3.0.CO; 2 - 0。
杨建军,陈建军,陈建军,陈建军,陈建军,陈建军,陈建军,陈建军。自然科学,2003,23(4):168-172。10.1038 / nature01573。
王晓东,王晓东,王晓东,王晓东,王晓东,王晓东,王晓东,王晓东,王晓东,等。t小管到肌膜损伤诱导的异铁蛋白易位。中国生物医学工程学报,2007,21(1):1 - 6。10.1096 / fj.06 - 7659 com。
Klinge L, Harris J, Sewry C, Charlton R, Anderson L, Laval S, Chiu YH, Hornsey M, Straub V, Barresi R,等:Dysferlin与鼠和人骨骼肌t小管系统发育的关系。肌肉神经学报,2010,41(1):166-173。10.1002 / mus.21166。
Bittner RE, Anderson LV, Burkhardt E, Bashir R, Vafiadaki E, Ivanova S, Raffelsberger T, Maerk I, Hoger H, Jung M,等:SJL小鼠(SJL- dysf) Dysferlin缺失定义了肢体带状肌营养不良2B的自然模型。生物医学进展,1999,23(3):141-142。10.1038/13770。
Glover LE, Newton K, Krishnan G, Bronson R, Boyle A, Krivickas LS, Brown RH:骨骼肌中Dysferlin过表达产生进行性肌病。中国生物医学工程学报,2010,32(4):387 -393。
韩瑞,杨建军,杨建军,杨建军,杨建军,杨建军,杨建军,张建军,张建军,张建军,张建军:应激性左心室损伤的研究进展。[J] .临床医学杂志,2007,17(1):1805-1813。10.1172 / JCI30848。
Ho M, Post CM, Donahue LR, Lidov HG, Bronson RT, Goolsby H, Watkins SC, Cox GA, Brown RH:两种新型dysferlin缺乏小鼠模型的肌膜破坏和表型分化。生物医学进展,2004,13(3):391 - 391。10.1093 /物流/ ddh212。
王晓明,王晓明,王晓明,等。异铁蛋白的细胞内定位及其与二氢吡啶受体的关系。医学学报,2005,24:134-144。
李建军,李建军,李建军,李建军,李建军,李建军,李建军,李建军,李建军,张建军,张建军,张建军,张建军。生物医学进展,2006,15(5):129-142。
selen D, Stilling G, Engel AG:异铁蛋白病的早期病理改变。神经病学杂志,2001,56:1472-1481。
王晓明,王晓明,王晓明,等。mitsugumin29蛋白在两栖动物胚胎细胞中表达的研究进展。开发应用,1999,15(2):87-95。10.1002 / (SICI) 1097 - 0177 (199906) 215:2 < 87:: AID-DVDY1 > 3.0.CO; 2 y。
Komazaki S, Nishi M, Takeshima H, Nakamura H: mitsugumin29缺陷小鼠骨骼肌细胞早期发育过程中肌浆网网络和三联体的异常形成。[j] .地理学报,2001,(4):717-723。10.1046 / j.1440 - 169 x.2001.00609.x。
Nishi M, Komazaki S, Kurebayashi N, Ogawa Y, Noda T, Iino M, Takeshima H: mitsugumin29缺失小鼠骨骼肌的异常特征。中国生物医学工程学报,2009,32(1):444 - 444。10.1083 / jcb.147.7.1473。
Brotto MA, Nagaraj RY, Brotto LS, Takeshima H, MA JJ, Nosek TM: MG29缺失小鼠细胞内Ca2+稳态维持缺陷与肌肉疲劳增加有关。生物医学工程学报,2004,14:373-378。10.1038 / sj.cr.7290237。
潘志,杨东,Nagaraj RY, Nosek TA, Nishi M, Takeshima H,程华,马军:缺乏mg29的肌肉细胞储存钙通道功能障碍。中国生物医学工程学报,2002,4(4):379-383。10.1038 / ncb788。
蔡超,Masumiya H, Weisleder N, Matsuda N, Nishi M, Hwang M, Ko JK,林平,Thornton A,赵霞,等:MG53细胞核组装的细胞膜修复机制。中国生物医学工程学报,2009,31(1):556 - 564。10.1038 / ncb1812。
王欣,谢伟,张勇,林鹏,韩磊,韩鹏,王勇,陈志,季刚,郑明,等:mg53介导的膜修复对缺血再灌注损伤的心脏保护作用。中国医学杂志,2010,107:76-83。10.1161 / CIRCRESAHA.109.215822。
蔡春华,魏志强,高建军,马军,张建军,张建军,张建军,张建军。肌营养不良患者的膜修复缺陷与MG53、小泡蛋白-3和异铁蛋白相互作用的关系。生物化学学报,2009,28(4):894- 892。10.1074 / jbc.M109.009589。
李建军,李建军,李建军,等。连接膜复合体蛋白的研究进展。分子细胞,2000,6:11-22。
Minamisawa S, Oshikawa J, Takeshima H, Hoshijima M, Wang Y, Chien KR, Ishikawa Y, Matsuoka R:结蛋白2型与小泡蛋白3在肥厚型和扩张型心肌病中的表达下调。生物化学学报,2004,25(2):556 - 556。10.1016 / j.bbrc.2004.10.107。
魏绍林,郭安,陈斌,Kutschke W,谢玉平,Zimmerman K, Weiss RM, Anderson ME,程华,宋立生:肥厚向心力衰竭过渡的t小管重构。中国生物医学工程学报,2010,27(7):531 -531。10.1161 / CIRCRESAHA.109.212324。
Holmes SE, O'Hearn E, Rosenblatt A, Callahan C, Hwang HS, Ingersoll-Ashworth RG, Fleisher A, Stevanin G, Brice A, Potter NT,等:连接蛋白-3编码基因重复扩增与亨廷顿病样2相关。生物医学工程学报,2001,29(3):377-378。10.1038 / ng760。
Nishi M, Sakagami H, Komazaki S, Kondo H, Takeshima H:结膜亲蛋白3型和4型在脑中的共表达。中国生物医学工程学报,2003,31(2):559 - 561。
Ito K, Komazaki S, Sasamoto K, Yoshida M, Nishi M, Kitamura K, Takeshima H:缺乏结膜亲蛋白1型突变骨骼肌的三联连接缺陷和收缩。中国生物医学工程学报,2001,32(4):559 - 567。10.1083 / jcb.200105040。
李春华,李春华,李春华,等。骨骼肌细胞中结膜亲蛋白1型缺失的研究进展。生物工程学报,2002,26(4):526 - 526。10.1016 / s0014 - 5793(02) 03042 - 9。
李建军,张建军,张建军,等。肌管蛋白家族的研究进展。生物化学学报,2003,12(规格2):R285-292。
Laporte J,胡丽娟,Kretz C, Mandel JL, Kioschis P, Coy JF, Klauck SM, Poustka A, Dahl N:酵母x连锁肌小管性肌病酪氨酸磷酸酶家族的基因突变。生物医学工程学报,1996,13(3):175-182。10.1038 / ng0696 - 175。
张建军,张建军,张建军,张建军。肌小管性肌病中肌小管性肌小管性肌小管性肌小管性肌小管性肌小管性肌小管性肌小管性肌小管性肌小管性肌小管性肌小管性肌小管性肌小管性肌小管性肌小管性肌小管性肌小管性肌小管性肌小管性肌小管性肌小管性肌小管性肌小管性肌小管性肌小管性肌小管性肌小管性肌小管性肌小管性肌小管性肌小管性肌小管性肌小管。生物医学进展,2002,9(9):2223-2229。
肖文杰,刘建军,张建军,张建军,张建军,张建军,张建军,张建军,张建军,张建军,张建军。中国生物医学工程学报,2003,13(3):544 - 544。10.1016 / s0960 - 9822(03) 00132 - 5。
Taylor GS, Maehama T, Dixon JE:肌管蛋白:一种酪氨酸蛋白磷酸酶在肌管病中突变,可使脂质第二信使磷脂酰肌醇3-磷酸去磷酸化。美国国家科学促进会。[j] .中国科学:地球科学。10.1073 / pnas.160255697。
陈建军,陈建军,陈建军,陈建军,陈建军,陈建军,陈建军,陈建军,陈建军,陈建军,陈建军。生物化学学报,2004,29(3):734 - 734。
Buj-Bello A, Fougerousse F, Schwab Y, Messaddeq N, Spehner D, Pierson CR, Durand M, Kretz C, Danos O, Douar AM,等:aav介导的肌小管蛋白肌内传递可纠正小鼠肌小管病表型并提示其在质膜稳态中的作用。生物医学进展,2008,17(7):2132-2143。10.1093 /物流/ ddn112。
Buj-Bello A, Laugel V, Messaddeq N, Zahreddine H, Laporte J, Pellissier JF, Mandel JL:脂质磷酸酶肌管蛋白对小鼠骨骼肌维持至关重要,但对肌肉形成无关。美国国家科学促进会。[j] .中国科学:地球科学。10.1073 / pnas.212498399。
李建军,张建军,张建军,张建军,张建军,张建军,张建军,等:肌小管蛋白脂质磷酸酶缺失对肌纤维兴奋-收缩偶联的影响。美国国家科学促进会。[j] .中国科学:地球科学,2009。10.1073 / pnas.0900705106。
Dowling JJ, Vreede AP, Low SE, Gibbs EM, Kuwada JY, Bonnemann CG, Feldman EL:斑马鱼和人肌小管肌病中t小管紊乱与肌小管蛋白功能的丧失。科学通报,2009,35 (5):11000372 - 11371 /journal.pgen.1000372。
李丽娟,李建军,李建军,李建军,李建军,等。磷酸肌苷对肌肉附着和维持的调控作用。科学通报,2011,27 (7):1001295-10.1371/journal.pgen.1001295。
Fujii J, Otsu K, Zorzato F, de Leon S, Khanna VK, Weiler JE, O'Brien PJ, MacLennan DH:恶性高热相关猪ryanodine受体突变的鉴定。科学,1991,25(3):448-451。10.1126 / science.1862346。
Otsu K, Khanna VK, Archibald AL, MacLennan DH:猪恶性高热的共分离和回交家族骨骼肌ryanodine受体基因的可能突变。基因组学,1991,11:744-750。10.1016 / 0888 - 7543 (91) 90083 - q。
王晓明,王晓明,王晓明,王晓明,等。ryanodine受体基因在中枢性疾病和恶性高热中的表达。生物医学工程学报,1993,5:51-55。10.1038 / ng0993-51。
张勇,陈洪生,Khanna VK, De Leon S, Phillips MS, Schappert K, Britt BA, Browell AK, MacLennan DH:与中枢核心疾病相关的人类ryanodine受体基因突变。生物医学进展,1993,5:46-50。10.1038 / ng0993-46。
Monnier N, Ferreiro A, Marty I, Labarre-Vila A, Mezin P, Lunardi J:引起骨骼肌RYR1缺失的纯合剪接突变与多小核病先天性肌病伴眼麻痹相关。中国生物医学工程学报,2003,12(2):1171-1178。10.1093 /物流/ ddg121。
Clarke NF, Waddell LB, Cooper ST, Perry M, Smith RL, Kornberg AJ, Muntoni F, lilis S, Straub V, Bushby K等:RYR1隐性突变是先天性纤维类型失调的常见原因。中国生物医学工程学报,2010,31(1):544- 550。10.1002 / humu.21278。
Sato I, Wu S, Ibarra MC, Hayashi YK, Fujita H, Tojo M, Oh SJ, Nonaka I, Noguchi S, Nishino I:均匀型1纤维和RYR1突变的先天性神经肌肉疾病。中华神经科学杂志,2008,32(2):391 - 391。
Bevilacqua JA, Monnier N, Bitoun M, Eymard B, Ferreiro A, Monges S, Lubieniecki F, Taratuto AL, Laquerriere A, Claeys KG等:RYR1隐性突变可导致少见的先天性肌病,核内化突出,肌纤维大面积破坏。中华神经科杂志,2011,37(3):271-284。10.1111 / j.1365-2990.2010.01149.x。
Wilmshurst JM, lilis S, Zhou H, Pillay K, Henderson H, Kress W, Muller CR, Ndondo A, Cloke V, Cullup T,等:RYR1突变是具有中央核的先天性肌病的常见原因。中国生物医学工程学报,2010,32(6):717-726。10.1002 / ana.22119。
袁世华,王志刚,王志刚,王志刚。兔骨骼肌横小管和三联体的生物发生:1,4-二氢吡啶受体TS28和良嘌呤受体的原位免疫定位。中国生物医学工程学报,2001,31(2):389 - 391。10.1083 / jcb.112.2.289。
Chaudhari N:肌肉发育不良(mdg)小鼠骨骼肌特异性钙通道转录物中的单核苷酸缺失。中国生物医学工程学报,2002,26(3):563 - 563。
Felder E, Protasi F, Hirsch R, franzni - armstrong C, Allen PD:缺乏DHPR和RyR的小鼠骨骼肌肌浆网表面连接的形态和分子组成。中国生物医学工程学报,2002,32(2):344 - 349。10.1016 / s0006 - 3495(02) 75656 - 7。
Franzini-Armstrong C, Pincon-Raymond M, Rieger F:体内异常小鼠肌肉纤维缺乏外周偶联的表面成分。中国生物医学工程学报,2001,35(6):364-376。10.1016 / 0012 - 1606 (91) 90238 - x。
李春华,李春华,李春华,等。非二氢吡啶受体亚基在骨骼肌细胞中的形成。中国生物医学工程学报,1996,32(4):387 - 398。10.1083 / jcb.134.2.375。
陈建军,陈建军,陈建军,等。二氢吡啶受体和三羟吡啶在小鼠骨骼肌中的靶向作用。中国生物医学工程学报,1999,26(2):372-380。10.1002 / (SICI) 1097 - 0177 (199904) 214:4 < 372:: AID-AJA9 > 3.0.CO; 2 q。
Knudson CM, Chaudhari N, Sharp AH, Powell JA, Beam KG, Campbell KP:肌肉发育不良小鼠二氢吡啶受体α 1亚基特异性缺失。生物化学学报,2009,26(4):1345-1348。
马立文,傅立文,刘建军,刘建军。Triadin在20年后的应用前景。中国生物医学工程学报,2009,31(2):317 - 321。10.1113 / jphysiol.2009.171892。
沈新,franzinii - armstrong C, Lopez JR, Jones LR, Kobayashi YM,王勇,Kerrick WG, Caswell AH, Potter JD, Miller T,等:Triadins调节骨骼肌细胞内Ca(2+)稳态,但不是兴奋-收缩耦合所必需的。生物化学学报,2007,28(2):374 -378。10.1074 / jbc.M705702200。
张锐,杨军,朱军,徐翔:斑马鱼Tcap的缺失是通过破坏肌节-膜相互作用导致肌肉营养不良,而不是通过破坏肌节组装。中国生物医学工程学报,2009,18(4):413 -414。10.1093 /物流/ ddp362。
Marieb Elaine:《人体解剖学和生理学》,2007,Pearson Education, Inc.,第7页
致谢
这项工作得到了法国国家医学医学研究所(INSERM)、法国国家科学研究中心(CNRS)、斯特拉斯堡大学(UdS)、法兰西学院和法国肌病防治协会(AFM)的资助。库萨里得到了
作者信息
作者及单位
相应的作者
额外的信息
相互竞争的利益
作者宣称他们没有竞争利益。
作者的贡献
LAQ和JL构思并起草了手稿。
权利和权限
本文由BioMed Central Ltd.授权发表。这是一篇基于知识共享署名许可(http://creativecommons.org/licenses/by/2.0),允许在任何媒体上不受限制地使用、分发和复制,前提是正确引用原创作品。
关于本文
引用本文
Al-Qusairi, L, Laporte, J.骨骼肌t小管生物发生和三联体形成及其在人类疾病中的意义。骨骼肌1, 26(2011)。https://doi.org/10.1186/2044-5040-1-26
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/2044-5040-1-26
关键字
- 肌浆网
- 家族性肥厚性心肌病
- 终端池
- Centronuclear肌病
- Myotubular肌病