摘要
受损组织的修复过程涉及多种细胞类型对局部和系统信号的响应协调活动。急性组织损伤后,浸润性炎症细胞和常驻干细胞协调其活动以恢复组织内稳态。然而,在慢性组织损伤中,如肌肉营养不良,炎症细胞浸润和成纤维细胞激活持续存在,而干细胞(卫星细胞)的修复能力减弱。异常的肌营养不良修复及其终末阶段,纤维化,代表了几乎所有慢性神经退行性肌肉疾病的最终共同途径。随着我们对肌肉纤维化发病机制的了解不断深入,很明显,肌肉为局部微环境调节组织修复提供了一个有用的模型,显示了肌肉特异性干细胞、炎症细胞、成纤维细胞和哺乳动物伤口愈合反应的细胞外基质成分之间的相互作用。这篇文章回顾了在正常和异常肌肉组织修复的机制下的新兴发现。
简介
病理生理性纤维化,本质上是细胞外基质(ECM)成分,特别是胶原蛋白的过度积累,是炎症引起的组织损伤引发的一系列事件的最终结果,并导致永久性瘢痕形成。纤维化可损害组织功能,并在包括骨髓在内的各种重要器官和组织中引起慢性疾病。尽管易受纤维化影响的组织范围各不相同,但所有的纤维化反应都有共同的细胞和分子机制,如细胞和组织变性、白细胞浸润、组织持续炎症以及具有成纤维细胞样表型的细胞增殖。不同细胞类型的相互作用和不平衡维持了大量生长因子、蛋白水解酶、血管生成因子和纤维细胞因子的产生,这些因子共同扰乱了受损组织的微环境,并刺激结缔组织元素的沉积,从而逐步重塑、破坏和取代正常的组织结构。然而,尽管有许多共同的因素,在不同的组织系统之间也有重要的差异,一些启动和促进纤维形成途径的细胞和可溶性因素的身份仍然未知。因此,提高我们对这一过程中涉及的机制、细胞类型和因素的理解,对于制定这些疾病的治疗策略至关重要。
肌肉组织微环境控制着正常修复与纤维化的发展
肌营养不良
在骨骼肌中,纤维化通常与肌肉营养不良症相关,这是一种临床和分子异质性的疾病。表型上,这些疾病的特征是肌肉组织炎症和骨骼肌萎缩,这影响患者的活动能力,使患者只能坐在轮椅上。在最严重的情况下,如杜氏肌营养不良症(DMD,由缺乏肌营养不良蛋白引起),肌肉损失和纤维化也会因呼吸衰竭和心力衰竭而导致过早死亡[1].在许多营养不良症中,包括DMD,突变影响在细胞骨架和基底层之间形成链接的蛋白质,通常导致整个蛋白质复合物的分解。因此,肌膜变得脆弱,特别是在剧烈的收缩活动中。反过来,纤维会出现局灶性或弥漫性损伤,钙离子进入增加,尽管这些影响的潜在分子机制尚未详细阐明[2].肌肉营养不良症和特发性炎症性肌病(IIMs)之间也有一些相似之处,它们具有共同的表型特征,如炎症和肌肉无力,尽管潜在的原因不同。
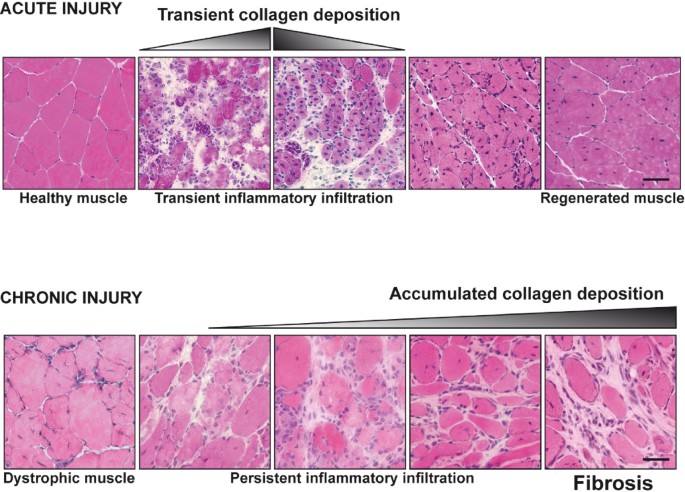
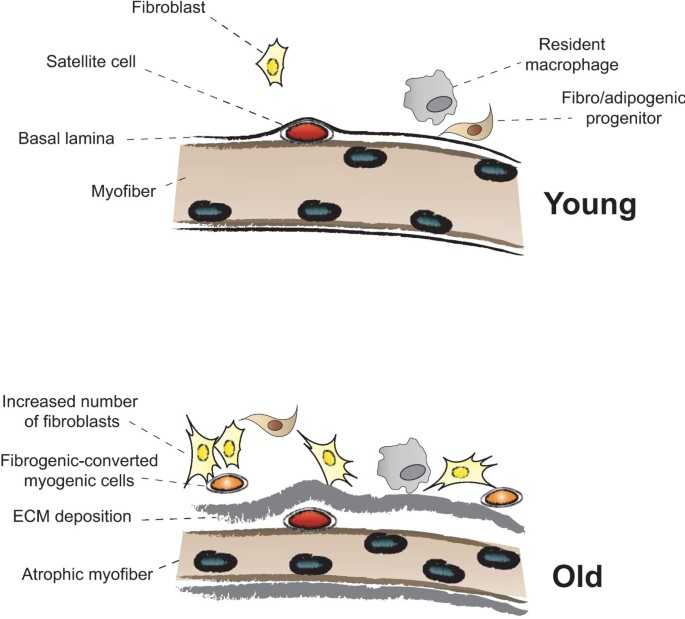
在急性损伤后的正常肌肉修复中,如实验动物和运动损伤后的人类,受损或死亡的纤维首先由炎症细胞去除,然后由被称为卫星细胞的组织驻留肌肉干细胞修复或取代[3.].然而,在慢性人类疾病中,如DMD和许多其他营养不良,新生成的纤维也容易变性,因为它们保留了潜在的分子缺陷,产生与慢性炎症相关的纤维变性的不断循环(图1) [4].直到几年前,卫星细胞是唯一已知的具有生肌潜能的产后再生细胞。在DMD中,这种卫星细胞群要么随着时间的推移而耗尽,要么失去了介导修复的能力,肌肉组织逐渐被脂肪和纤维化组织所取代。营养不良时肌肉组织的纤维化和丧失不仅会降低运动和收缩功能,还会减少可用于治疗干预的靶组织数量,或损害这些治疗的效率[5].尽管不断努力,但目前还没有有效的治疗DMD的方法。DMD唯一相对有效的药物治疗是使用皮质类固醇,在早期延长肌肉力量和行走能力,但最终会导致不良的次要影响[6].此外,也没有有效的临床治疗来对抗或减弱DMD患者的纤维化。由于这些原因,最近的研究使用mdxDMD的小鼠模型更多地关注与营养不良蛋白缺乏相关的纤维化的细胞和分子机制。重要的是,这些研究已经测试了几种针对肌肉纤维化的药物,结果强烈表明,对抗纤维化的发展可以改善DMD的进展,并增加新的基于细胞和基因的治疗的成功。
老化的肌肉
除了肌肉营养不良外,衰老还与骨骼肌质量和功能的丧失有关,并伴有纤维化和ECM沉积。年龄相关的肌肉减少(肌肉减少症)会导致和/或加剧与年龄相关的健康问题。因此,了解所涉及的过程不仅对阐明纤维化机制很重要,而且对改善老年人的生活质量和医疗保健也很重要。肌肉减少症的发生机制似乎部分是它独有的,部分是其他形式的萎缩所共有的。其中一些可能涉及可溶性效应物的变化,如激素状态的改变,炎症因子,热量和蛋白质摄入量的改变,可能是由中枢和外周神经系统的改变或下降引起的。这些改变的净后果首先包括进行性萎缩和单个肌肉纤维的丧失,并伴有运动单位的丧失[7].此外,脂肪和其他不可收缩物质的渗透,导致肌肉“质量”下降[8].在超微结构水平上,在营养不良的动物模型中,衰老也与肌原纤维紊乱有关,并且力的下降而不改变运动蛋白功能在体外运动性测定[9].与DMD和年龄相关纤维化相关的其他因素将在下面进一步详细讨论。
骨骼肌正常修复
在自然界中,生物体的生存往往取决于其快速修复机械创伤、接触毒素或感染造成的肌肉损伤的能力。组织损伤的快速修复需要一系列有序的事件。任何这些阶段的干扰都可能导致肌肉再生不成功,其典型特征是肌纤维持续退化、炎症和纤维化[10- - - - - -12].导致正常和有缺陷/纤维化肌肉修复的关键事件如图所示2而且3.,详情如下。
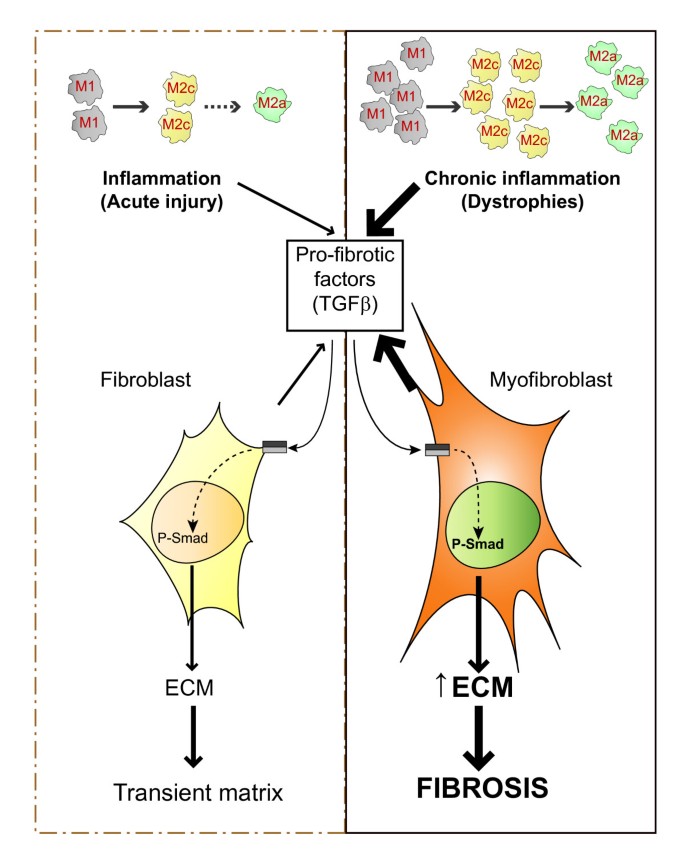
慢性炎症导致骨骼肌修复纤维化.在急性损伤后肌肉修复的早期阶段,滞留和外渗的外周巨噬细胞起着重要的作用,促炎(M1)巨噬细胞首先起清除损伤的作用,抗炎(M2c)巨噬细胞和交替激活的巨噬细胞(M2a)参与随后的炎症恢复、细胞外基质(ECM)沉积和组织修复。M2c和M2a巨噬细胞释放抗炎细胞因子和促纤维化分子,如转化生长因子(TGF)-β,它们反过来以调节的方式激活成纤维细胞,产生ECM成分和ECM重塑因子,包括TGFβ、胶原蛋白、纤维连接蛋白、丝氨酸蛋白酶(如uPA/纤溶酶)和金属蛋白酶(MMPs)及其抑制剂(TIMPs)的自分泌。然而,在慢性组织损伤中,如在肌肉营养不良症中,巨噬细胞的增加和持续存在改变了这些释放因子的强度、持续时间和相互作用,导致过度ECM积累和肌肉被纤维化组织取代。
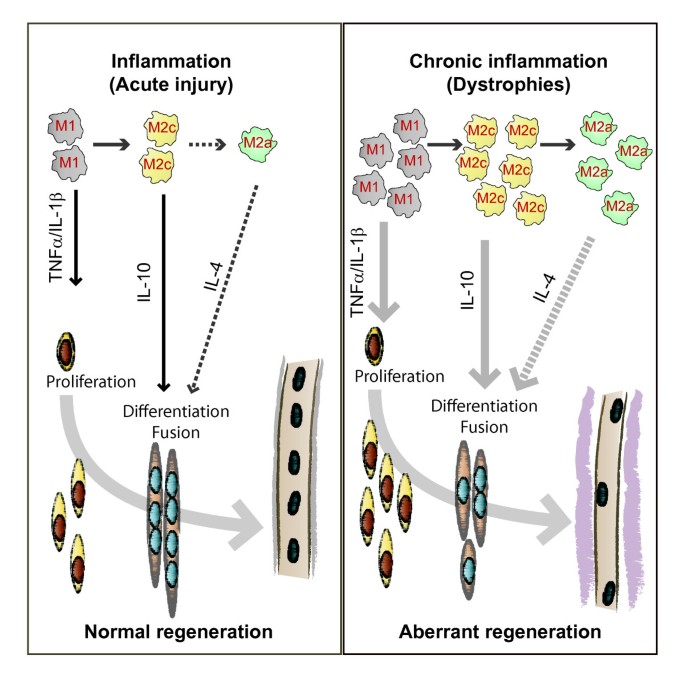
骨骼肌再生的炎症控制.受损肌肉纤维的替换依赖于卫星细胞,即通常处于静止状态的常驻干细胞,它们位于肌肉纤维的基底层之下。组织损伤导致其激活、增殖、分化和融合形成新的肌纤维。然而,它们介导修复的能力受到损伤的程度和类型的影响,并因此受到它们与各种细胞和可溶性介质(最重要的是与浸润的巨噬细胞)的相互作用的影响。巨噬细胞和卫星细胞之间的旁分泌相互作用如下。在急性损伤后及时调控的再生过程中(左),m1 -巨噬细胞释放的促炎细胞因子可能促进卫星细胞的增殖,而抗炎(M2c)和交替激活(M2a)巨噬细胞释放的细胞因子则分别有利于卫星细胞的分化和融合。特别是,白介素(IL)-4被证明可以调节成肌细胞的融合在体外而且在活的有机体内[129].可以预期,在慢性损伤期间,如肌肉营养不良症,不同巨噬细胞类型的增加和持续存在可以改变这些细胞因子的相对水平和动力学,导致卫星细胞功能的改变和异常再生,纤维化和脂肪积累的逐步发展,最终导致无功能的肌肉组织。
骨骼肌损伤后,细胞因子和生长因子立即从损伤的血管和浸润的炎症细胞中释放出来[13,14].这些因子刺激炎症细胞迁移到损伤部位,并介导增殖和细胞存活。入侵的炎症细胞也负责吞噬任何细胞碎片。许多损伤信号、生长因子和炎症分子对卫星细胞的具体影响尚不清楚[14,但下一个关键的修复阶段是由这些细胞形成新的肌肉纤维。这一过程始于卫星细胞的激活,因为卫星细胞通常处于肌肉纤维基底层下的静止状态,随后是它们的广泛增殖。一些细胞进行自我更新,以补充卫星细胞库,但大多数细胞被投入并随后分化。这些后期的成肌细胞要么与自身融合,要么与受损的肌纤维融合,以取代失去的肌肉。
除了炎症细胞和卫星细胞,有效的肌肉修复还需要成纤维细胞的迁移和增殖,以产生新的临时ECM成分,如I型和III型胶原蛋白、纤维连接蛋白、弹性蛋白、蛋白多糖和层粘连蛋白。这些元素起到稳定组织的作用,并充当新纤维的支架。此外,卫星细胞还利用预先存在的坏死纤维的基底膜来确保肌纤维保持相似的位置。基底膜和临时ECM成分对于引导神经肌肉连接(NMJs)的形成也至关重要[15].ECM的形成和降解是由组织修复过程中蛋白酶及其特异性抑制剂的表达介导的。ECM降解还导致产生蛋白质片段,这些蛋白质片段介导了促进正常组织修复所需的重要生物活动[16].最后,除了ECM重塑外,血管生成还促进损伤部位新血管网络的发展,而新形成的肌纤维则经历生长和成熟。
有效的肌肉修复和纤维化的炎症
肌肉损伤后的第一个事件是炎症细胞侵入损伤部位。现在有大量证据表明,肌肉损伤和再生后炎症反应的性质、持续时间和强度可对肌肉修复或纤维化的结果产生关键影响[12,14,17,18].例如,干扰急性损伤后的短暂炎症反应可能会对死亡和受损纤维的吞噬产生负面影响,从而阻碍新组织的形成。相比之下,调节营养不良肌中长期高水平的炎症可有利于减少肌肉变性和纤维化,同时促进再生[19].
这些结果强调了两个关键概念:首先,某种形式的炎症反应是有效修复受损组织所必需的;其次,慢性炎症反应会导致无节制的伤口愈合和纤维化。
炎症反应:不同巨噬细胞群的作用
组织修复的早期阶段通常以先天免疫系统的局部激活为特征,尽管最初的免疫原性刺激并不总是已知的(见下文)[20.].巨噬细胞在对感染和/或组织损伤的先天免疫反应中具有突出作用,因为它们能够吞噬细菌或细胞碎片等颗粒,并分泌促炎细胞因子[13].最近的研究表明,肌肉肌外膜/肌外膜中的驻留巨噬细胞协调了对损伤的先天免疫反应,该反应通过炎症树突状细胞与适应性免疫有关[21].除了巨噬细胞外,损伤部位的侵袭还包括多形核白细胞(如中性粒细胞)和血源性单核细胞,这些单核细胞也分化为巨噬细胞[17].在一些组织中,其他炎症细胞类型,如肥大细胞和T细胞,也在修复和纤维形成中发挥关键作用,尽管迄今为止,对这些细胞在肌肉修复和DMD中的作用的研究有限[22].
损伤肌肉中主要的炎症细胞是单核细胞和巨噬细胞[17].在再生肌和营养不良肌中,它们用于清除肌纤维碎片,在某种程度上,它们通过分泌细胞因子调节再生。我们对肌肉修复和纤维化理解的一个重要进展是,损伤后再生肌肉中存在着异质巨噬细胞群,表现出相反的活性(促炎或抗炎)和不同的动力学[23].极化巨噬细胞的命名法已被提出[24,25],它们现在分别被称为经典和交替激活的巨噬细胞,或M1和M2巨噬细胞(图2,图3.)。
经典激活(M1)或促炎巨噬细胞,产生于t辅助(Th)1细胞因子干扰素-(IFN)γ和肿瘤坏死因子(TNF)-α,以及脂多糖(LPS)或内毒素[24- - - - - -26].M1巨噬细胞在急性炎症过程中起关键作用,因此被认为是原型巨噬细胞。它们在肌肉损伤后的早期阶段与招募的单核细胞一起被发现,并参与抗原的处理和呈递,以及坏死物质的吞噬清除。M1巨噬细胞也产生高水平的促炎细胞因子,如TNFα和白细胞介素(IL)-1β和IL-12。此外,它们还能被诱导表达一氧化氮合酶(iNOS;也称为NOS2),它是高效代谢l -精氨酸以产生大量NO参与杀死细胞内病原体所必需的。
M2巨噬细胞的种群比M1巨噬细胞更复杂,目前被分为不同的亚型,反映了不同的功能特化。M2a巨噬细胞或严格地说,交替激活的巨噬细胞,由Th2细胞因子IL-4和IL-13激活,最常与组织修复、伤口愈合和纤维化有关。M2c巨噬细胞被认为具有抗炎作用,因为它们在M1表型失活中起着关键作用,并促进非髓系细胞的增殖。M2c巨噬细胞释放抗炎细胞因子,由IL-10启动。因此,经典激活的M1巨噬细胞通常出现在肌肉损伤后的早期,紧随其后的是M2c巨噬细胞[23].M2a巨噬细胞在组织修复过程的晚期阶段大量存在[12的纤维化肌肉中也发现了mdx老鼠(27,28)(图4摄氏度)。
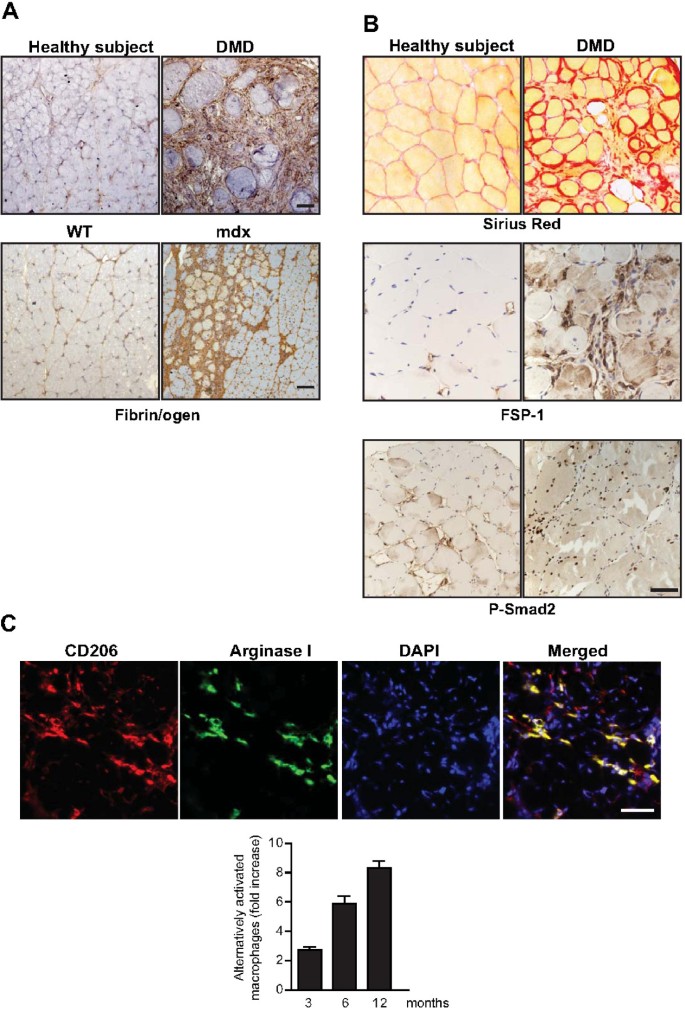
DMD患者营养不良肌的炎症和纤维化特征mdx老鼠.(一)纤维蛋白(原)在DMD患者和老年人肌肉中积累mdx老鼠。(上)DMD患者和健康受试者以及(下)野生型(WT)和肌肉活检中纤维蛋白(原)(棕色)的免疫组化mdx横隔膜。(B)营养不良肌肉中纤维化、成纤维细胞数量和TGFβ信号通路增加。对DMD患者和健康受试者的肌肉活检进行胶原沉积(天狼星红)染色和成纤维细胞特异性蛋白(FSP)-1和P-Smad2免疫组化。(C)横膈膜肌中存在交替激活的巨噬细胞mdx老鼠。CD206(红色)和精氨酸酶I(绿色)双阳性细胞mdx特异性抗体免疫荧光显示膈膜。这些细胞数量的相对增加mdx横膈膜随时间的变化。Bars = 50 μm。
从肌肉损伤到慢性炎症反应和病理性肌肉纤维化
巨噬细胞反应强度或持续时间的改变可以对肌肉再生和纤维化产生深远的影响。其中一个例子是白细胞介素-10在mdx小鼠,由于M1和M2巨噬细胞之间的不平衡,增加了肌肉损伤,降低了肌肉力量[29].同样,M1巨噬细胞的持续存在也被认为在慢性炎症性肌病中具有病理后果(见下文)。在组织纤维化方面,M2a巨噬细胞通常被认为是最重要的[12].它们表达特定的细胞表面标志物,如甘露糖受体CD206和II型IL-1诱饵受体,此外还释放一系列调节细胞因子,如IL-10和可溶性IL-1受体拮抗剂(IL-1Ra),以及许多促纤维化分子,如转化生长因子(TGF)-β,纤维连接蛋白,脯氨酸,几种类型的基质金属蛋白酶组织抑制剂(TIMP)和趋化因子(C-C motif)配体(CCL)17。特别是CCL17已被证明可以通过与CC趋化因子受体(CCR)4结合来增强几个肺部疾病小鼠模型的纤维化[30.].M2巨噬细胞能够中和M1促炎反应的另一个原因是它们精氨酸酶(ARG)1的高水平表达,它直接与M1相关的诱导型一氧化氮合酶(iNOS)竞争l -精氨酸[31](见下文及图4摄氏度)。
几个小组使用了不同的在体外而且在薇芙o动物模型,试图揭示巨噬细胞在肌肉发生、肌肉修复、纤维化以及DMD的发展和治疗中的作用。在体外促炎巨噬细胞在抑制成肌细胞分化的同时对成肌细胞增殖有积极影响,而抗炎巨噬细胞则同时刺激成肌细胞分化和融合。重要的是,在活的有机体内M1和M2巨噬细胞可能来源于血液单核细胞,其耗竭已被证明对损伤后的肌肉修复过程有负面影响[23].相反,BM移植实验揭示了CC趋化因子受体2/单核细胞趋化蛋白-1 (CCR2/MCP-1)配体的重要作用,以及尿激酶纤溶酶原激活物(uPA)/纤溶蛋白的蛋白水解活性,通过调节BM来源的巨噬细胞招募到损伤肌肉中,从而在骨骼肌修复中发挥重要作用[32- - - - - -37].
一些关于巨噬细胞衰竭或受损巨噬细胞募集的研究揭示了巨噬细胞在营养不良肌肉中调节成纤维的关键功能,以及治疗干预的潜力[19,35,37,38].在营养不良表型上也有类似的好处mdx使用多种抗炎药作用于细胞因子,如TNFα及其细胞受体,或作用于其他主要促炎介质,如核因子-κB [39- - - - - -41].此外,在纤维化膈肌中,交替激活的M2a巨噬细胞的存在随着年龄的增长而逐渐增加mdx老鼠(27)(图4摄氏度)。类似的,纤维蛋白原损耗mdx小鼠纤维化减轻,同时横膈膜中M2a巨噬细胞数量显著减少。在DMD患者中,纤维化也与交替激活的巨噬细胞数量增加有关[42].总的来说,这些研究表明适当调节巨噬细胞活性可能改善营养不良的进展。
M2a巨噬细胞精氨酸代谢与异常修复或纤维化发展之间的潜在重要联系最近已被几个研究小组证实。在一项研究中,从C/EBP-β启动子中删除两个C - amp反应元件(CREB)结合位点可特异性损伤M2基因表达,但不影响M1基因表达,干扰损伤诱导的肌肉再生的后期阶段。突变小鼠能够从受伤的肌肉中移除坏死组织,但它们在肌纤维再生方面表现出严重缺陷[43].C/EBP-β启动子的突变也降低了巨噬细胞中ARG1的表达,这被假设为将精氨酸代谢从精氨酸酶介导的多胺合成转向inos介导的NO生成,先前已证明这可以促进关键肌源性转录因子MyoD的降解[44].事实上,巨噬细胞极化和巨噬细胞精氨酸代谢竞争的类似变化被认为影响肌肉病理的严重程度mdx营养不良小鼠[28].在另一项研究中[14], Th2细胞因子增加了M2巨噬细胞精氨酸酶的表达和活性mdx精氨酸酶-2缺失对不同肌肉的影响存在有趣的差异。的确,尽管股四头肌和横膈膜的纤维化有所减少mdx缺乏精氨酸酶-2的小鼠,比目鱼肌、心肌和背最长肌似乎没有这种情况。更重要的是,从临床角度来看,长期膳食补充精氨酸增加了营养不良小鼠的骨骼和心肌纤维化,与报道的短期补充精氨酸的益处相反,因此,提示DMD患者在膳食补充精氨酸时需要谨慎[45].综上所述,这些研究表明巨噬细胞极化在肌肉修复和纤维形成中起着至关重要的作用,特别是在营养不良肌肉中。
iim的异常修复和纤维化
除了肌肉营养不良症外,还有另一类慢性肌肉疾病,统称为肌炎[46].表型上,iim的特点是肌肉无力,耐力差,肌肉组织的持续再生。在肌肉内,炎症浸润的存在主要由巨噬细胞,T细胞和树突状细胞组成,与免疫介导的肌纤维损失和无法有效解决再生过程相关。这些疾病的一个重要特征是促炎M1巨噬细胞和相关细胞因子如IL-1、IL-15和TNFα在组织中持续存在,并且明显无法切换到抗炎M2巨噬细胞。因此,迄今为止最有效的治疗方法是糖皮质激素和其他非甾体抗炎药(NSAIDs),如布洛芬和阿司匹林。然而,这些药物的一个问题是它们能够促进纤维萎缩。47],除此之外,它们还通过干扰环加氧酶(COX)基因功能对前列腺素(PG)合成产生负面影响。pg已被证明在肌肉生成的许多阶段发挥不同的作用,并从再生肌肉中分泌[48,49].有趣的是,巨噬细胞来源的TGFβ1已被证明可诱导PGE2成肌细胞通过cox -2依赖机制表达TGFβ1,从而减少TGFβ1的表达,形成一个重要的反馈回路,可以控制炎症和纤维化的发展[49].用于治疗IIMs的药物的另一个局限性是它们不能完全恢复,也不能解决潜在的缺陷,在大多数情况下,这些缺陷是多因素的,并且没有完全定义[50].尽管如此,IIMs代表了一组重要的疾病,帮助我们理解促炎细胞和细胞因子在协调正常与异常肌肉修复中的复杂作用。
其他免疫细胞类型在肌肉修复和纤维化中的作用
巨噬细胞并不是免疫系统中已知在肌肉修复和营养不良中起作用的唯一细胞。组织修复和纤维化也受到Th细胞反应的严格调控。与巨噬细胞一样,T淋巴细胞可以分化为不同的功能类型,被称为Th1和Th2细胞,它们通过产生不同的细胞因子谱来协调宿主反应[26].CD4+ Th1细胞产生促进细胞介导免疫的细胞因子,包括IFN-γ, TNFα, IL-12和IL-2,所有这些都被发现是抗纤维化细胞因子。CD4+ Th2细胞促进体液免疫,产生促纤维化细胞因子IL-4、IL-5、IL-6和IL-13。Th1细胞因子抑制Th2细胞的发育,反之,Th2细胞因子抑制Th1细胞的发育。显然,这些通路的改变或失衡有可能使修复向抗或促纤维化通路倾斜,正如Th2细胞因子在肝纤维化发生发展中的重要性所见证的那样[12].t细胞产生的细胞因子也调节肌肉退化和修复。例如,在转基因敲除小鼠中,uPA蛋白水解活性的丧失减少了损伤肌肉的巨噬细胞和t淋巴细胞浸润,与更持久的肌纤维变性有关[33].此外,scid / mdx与正常小鼠相比,缺乏功能性T和B淋巴细胞的小鼠在1岁时发生的膈纤维化要少得多,同时骨骼肌中活化的TGFβ也减少mdx老鼠(51].在ν/ν/ mdx小鼠(免疫缺陷裸鼠mdx背景)仅缺乏功能性T细胞与3个月时较少的膈纤维化相关,支持T细胞的致病作用mdx肌肉,揭示了这种淋巴细胞亚类是TGFβ1的重要来源[52].
最近发现了一种表达Vβ8.1/8.2 T细胞受体(TCR)的特定T细胞亚群mdx肌肉。这些T细胞产生高水平的骨桥蛋白,这是一种促进免疫细胞迁移和存活的细胞因子[53],且骨桥蛋白水平在DMD患者中升高mdx发病后的小鼠。重要的是,骨桥蛋白的丢失mdx双突变小鼠减少了自然杀伤T细胞(NKT)样细胞的浸润,这种细胞既表达T和NK细胞标记物,也表达中性粒细胞,此外还降低了TGFβ的水平。这些结果与肌肉力量的改善以及膈和心脏纤维化的减少密切相关[53].并不是所有的研究都得出了这样明确的结果,淋巴细胞及其亚型在肌肉修复和纤维化中的意义显然需要进一步研究。例如,在1个月大时进行胸腺切除术可诱导胎儿体内循环T细胞在出生后几乎完全耗尽mdx老鼠和。在随后的抗cd4和/或抗cd8抗体治疗中,未能改善6月龄的膈纤维化mdx老鼠(51,54,55].在另一项研究中,M2巨噬细胞被证明影响CD4+ Th细胞,因为表达arg1的巨噬细胞抑制了由Th2细胞因子诱导的肝脏炎症和纤维化曼氏裂体吸虫感染(26].由于这些数据显示了调节炎症和纤维化发展的机制的复杂性,显然有必要进一步研究以确定在营养不良肌中是否存在不同类型的Th反应和巨噬细胞亚型。以及它们如何调节相互作用。
成纤维细胞,骨骼肌中产生胶原的细胞
当组织受损时,成纤维细胞迁移到伤口,开始产生和重塑ECM,以响应促纤维化细胞因子,如TGFβ。基质成纤维细胞产生细胞因子、生长因子和蛋白酶,引发和维持急性和慢性炎症/促纤维化条件。事实上,尽管成纤维细胞对组织稳态和正常伤口修复是必要的和基本的,但它也是慢性纤维化疾病的关键中间物,在慢性纤维化疾病中,持续的炎症被广泛认为是引起成纤维细胞活性失调的原因。值得注意的是,阻碍纤维化疾病研究的一个限制是缺乏良好的遗传标记来标记成纤维细胞。在非肌肉系统中。活化的成纤维细胞可通过其增殖能力增强、迁移能力增强和收缩能力增强来鉴定。波形蛋白的表达增加,特别是α-平滑肌肌动蛋白(αSMA)的表达增加,α-平滑肌肌动蛋白是应激纤维的一种收缩蛋白。这些纤维通过称为“成熟”和“超成熟”灶性粘连的特殊结构以及细胞间隙和粘附连接连接到ECM。因此,当αSMA应力纤维收缩时,它们对ECM施加机械张力,从而提供机械抗性支持,因此称为“肌成纤维细胞”。这些细胞与许多组织和器官的组织修复和纤维化有关,包括肌肉、皮肤、肝脏、肺、骨骼和软骨[56].然而,尽管肌成纤维细胞与这些疾病相关,但仍不清楚肌成纤维细胞是否真的存在于纤维性骨骼肌中,或者它们是否是活跃地产生ECM成分的成熟成纤维细胞。引起这一争议的一个原因是经典的标记物如波形蛋白或αSMA也在成肌细胞中表达,尽管表达水平低于成纤维细胞。然而,最近的一项研究已经确定转录因子Tcf4是肌肉中成纤维细胞的潜在重要标记,尽管仍需要后续研究来验证其效用[57].尽管如此,为了与文献保持一致,我们在肌肉环境中使用术语“肌成纤维细胞”。
肌成纤维细胞有许多可能的来源。在大多数组织中,响应特定效应物而分化的常驻成纤维细胞被认为是主要的肌成纤维细胞祖细胞。或者,肌成纤维细胞可能通过表达CD34、CD45和I型胶原蛋白的循环脑转移细胞(称为纤维细胞)的流入而到达,这些细胞在受损区域进行进一步的重编程。最后,在肺、肾、肝等器官中,通过上皮细胞向间充质转化(epithelial - to - mesenchymal transition, EMT)机制,有大量的肌成纤维细胞来源于实质上皮细胞。因此,不同类型的细胞转分化为肌成纤维细胞可以潜在地解释慢性损伤组织中持续的ECM沉积。因此,了解肌成纤维细胞的起源对于开发新的方法来对抗不同疾病中的纤维化过程是非常重要的。
虽然成纤维细胞是主要的胶原生成细胞,但肌纤维相关卫星细胞和C2C12成肌细胞也被证明表达显著水平的间质胶原I和III,在分化过程中减少[58].而I型胶原蛋白可显著抑制C2C12细胞的分化,III型胶原蛋白的表达在衰老时保持不变mdx肌原性的细胞。这表明,随着年龄的增长,成肌细胞转变为成纤维细胞可能是通过正反馈发生的[58].胶原蛋白修饰,如非酶调节交联产生晚期糖基化末端(AGE)产物,也会增加肌肉结缔组织的硬度,从而导致老年人肌肉功能受损[59].最近在其他模型中的几项研究也研究了肌源性细胞中成纤维细胞表型的诱导。在一个病例中,TGFβ能够诱导C2C12成肌细胞中smad依赖性的鞘氨醇激酶SK)1上调,而药理学或小干扰(si) rna介导的SK1抑制阻止了TGFβ诱导纤维化标志物。Rho/Rho激酶信号通路似乎也与tgf β介导的SK1激活下游成肌细胞向肌成纤维细胞的转变有关[60].同样,Notch2表达下调也与C2C12成肌细胞中非肌肉纤维组织和tgf β依赖的肌成纤维细胞标志物诱导有关。在C2C12细胞中过表达活跃的Notch2会阻止TGFβ诱导αSMA和I型胶原蛋白的表达,然而更令人惊讶的是,在培养的成肌细胞中,siRNA短暂敲除Notch2会导致C2C12成肌细胞分化为肌成纤维细胞,即使在缺乏TGFβ的情况下也能表达αSMA和I型胶原蛋白等纤维标志物。最后,Notch2可以通过直接反调节Notch3并限制其表达来抑制成肌细胞向肌成纤维细胞分化[61].
老化肌肉中的纤维生成
Notch通路也与衰老相关的纤维化密切相关。例如,对老年小鼠肌肉干细胞微池的分析发现,在分化的肌肉纤维和卫星细胞中,TGFβ及其激活效应子Smad3的水平都很高,这与活跃的Notch水平相互作用,后者在年轻的微池中更丰富[62].衰老肌肉中被激活的Smad3水平的增加通过与启动子结合并刺激几种周期蛋白依赖性激酶(CDK)抑制剂(例如,p15, p16, p21和p27)的表达来减弱其再生能力,这些抑制剂是细胞周期进程的负调节因子。重要的是,这种TGFβ/pSmad3-Notch的不平衡可以通过强制激活Notch来恢复。类似的Notch激活降低和TGFβ/pSmad3信号通路增加的情况最近在老年人类肌肉中也有报道[63].
在对衰老肌肉的其他研究中,据报道,肌肉干细胞后代的命运由Wnt和Notch通路之间的相互作用控制,其中糖原合成酶激酶(GSK)3β起着重要作用[64].哺乳动物的同源物果蝇转录辅激活子Legless, BCL9/9-2,在本研究中也被证明是成人肌源性祖细胞中典型Wnt通路激活以及Wnt介导的分化和有效肌肉再生所必需的[64].然而,GSK3β和/或BCL9是否介导wnt诱导的静止卫星细胞从肌源性到纤维源性的细胞命运变化有待进一步验证。同一小组的一项早期研究已经强调了典型Wnt通路在年龄相关纤维化中的作用,该研究将老化再生肌肉中胶原沉积的增加与肌原性细胞向非肌原性细胞转化时产生的更大比例的纤维原性细胞联系起来[65].这种纤维转化可以通过实验用Wnt抑制剂治疗小鼠来消除。Wnt3A刺激负向调节年轻再生肌肉中的细胞增殖,增加纤维化。因此,衰老与系统环境的改变有关,因为这些影响是可逆的,这项工作为旨在改善组织修复和减少病理条件下纤维化的干预措施提供了战略基础。
肌肉修复中的纤维生成与脂肪生成
众所周知,当再生失败时,除成纤维细胞外,纤维瘢痕还会浸润脂肪细胞(脂肪变性)[66].然而,脂肪浸润的细胞来源仍然存在争议。最近发表了两篇关于这一争论的独立文章,它们确定了一种新型的常驻肌肉细胞,称为纤维/成脂祖细胞(FAP),可对骨骼肌损伤作出反应[67,68].这些细胞表达间充质标记血小板衍生生长因子受体(PDGFR) α,也不是肌源性的在体外或在活的有机体内根据它们不同的胚胎起源。FAPs被认为是肌肉再生过程中成肌细胞促分化信号的来源,更重要的是,它们表现出强烈的生成肌成纤维细胞和脂肪细胞的倾向[67,68].因此,尽管FAPs显示出有限的生肌能力在体外而且在活的有机体内,如果再生过程失败,FAP种群将持续存在于组织中,并且它们可能会分化为脂肪细胞。这支持了来自局部环境的信号有助于控制FAP命运的观点,并可能在健康肌肉的成功再生中发挥重要作用(图5)。FAP转换是否也发生在衰老过程中,以及Wnt配体等系统性因素是否也有助于这一过程,仍有待确定。有趣的是,有迹象表明,急性模型中的损伤类型可能会促使修复反应朝着更纤维化或更成脂性的修复方向发展,例如分别在甘油损伤和急性缺血后[68,69],尽管其机制尚未被广泛研究。
损伤后肌纤维生长和细胞外基质(ECM)积累在年轻肌肉和老年肌肉中存在差异.(上)在年轻肌肉对损伤的反应中,基底层下的卫星细胞可以被邻近细胞(由成纤维细胞、间质细胞、巨噬细胞、纤维/成脂肪祖细胞(FAPs)和微血管相关细胞组成的局部环境)释放的环境线索激活,最终形成几乎与先前存在的纤维难以区分的新纤维。(下)在老化的肌肉中,修复过程将通过增强ECM成分的沉积导致新形成的肌纤维尺寸减小和基底层增厚,这可能归因于驻留成纤维细胞(和/或FAPs)的存在和活性的增加,以及卫星细胞成肌潜能的降低。肌源性细胞转化为纤维源性细胞也有助于ECM的积累。卫星细胞生态位内的这些新的微环境条件将阻碍卫星细胞的有效功能和肌肉修复。
TGFβ在肌肉修复和纤维化中的作用
大多数促纤维化多肽是通过浸润免疫细胞、炎症细胞、间充质细胞和组织特异性细胞产生的,从而促进旁分泌促纤维化作用,使炎症驱动的纤维化持久(见下图)2,图3.) [12].最有效的促纤维化细胞因子之一在活的有机体内TGFβ。迄今为止已经描述了三种TGFβ异构体(TGFβ1、TGFβ2和TGFβ3),它们最初都是作为潜在前体产生的[70].当活性TGFβ被释放时,它结合到一个异二聚体受体复合体,由一个TGFβ I型受体分子,称为激活素链接激酶(ALK)5和一个TGFβ II型受体组成。在正常成纤维细胞的典型TGFβ通路中,配体结合导致ALK5磷酸化Smad2和3,它们反过来与Smad4结合形成一个复合物,该复合物被转移到细胞核,激活转录[71].然而,TGFβ也被证明通过其他几种途径发出信号,包括p38丝裂原活化蛋白激酶(MAPK),这需要含硫酸肝素蛋白聚糖(HSPG)倍聚糖;Ras/MAPK激酶(MEK)/细胞外信号调节激酶(ERK)通路,该通路需要HSPG syndecan 4;c-abl途径;Jun激酶(JNK),需要黏附激酶(FAK)和tgf β活化激酶(TAK)1 [72].这些信号通路似乎最终以启动子选择性的方式修改基因表达。例如,FAK、JNK和TAK1是肌成纤维细胞分化和α-SMA表达所必需的,而ERK是I型胶原表达所必需的。然而,p38 MAPK似乎不参与TGFβ的成纤维活性。因此,在肌肉成纤维细胞中,额外的信号通路可能以独立于典型TGFβ通路的方式被异常激活。
TGFβ在损伤后正常肌肉和DMD患者的营养不良肌肉中表达mdx老鼠(70],可能是通过刺激成纤维细胞产生ECM蛋白,如胶原蛋白和纤维连接蛋白,它有可能诱导肌纤维周围的纤维化。同样重要的是TGFβ能够减少降解ECM的酶的产生,如胶原酶,同时增加抑制ECM降解酶的蛋白质的产生,如TIMPs和纤溶酶原激活物抑制剂(PAI)-1(见下文)。重组TGFβ直接注射骨骼肌在活的有机体内以自分泌方式刺激肌原细胞中TGFβ的表达,并诱导注射区结缔组织的形成[73,74].此外,转染表达TGFβ的载体的成肌细胞在肌内移植后可分化为肌成纤维细胞,这一过程被decorin抑制,decorin是一种富含亮氨酸的小蛋白聚糖,可以结合并抑制TGFβ(另见下文)[75,76].最后,潜在的TGFβ结合蛋白(LTBP)4调节TGFβ从ECM的释放和生物利用度,在小鼠肌肉营养不良的情况下,它已被证明可以调节纤维化[77综上所述,这些研究强调了TGFβ在纤维化过程启动中的关键作用,以及在损伤肌肉中诱导肌原性细胞分化为肌成纤维细胞。
TGFβ似乎在衰老相关纤维化和肌肉损伤中也起着重要作用。据报道,在衰老过程中TGFβ水平升高,可能激活SK1信号通路以触发纤维化[60].对老年动物肌源性细胞的微阵列分析也揭示了依赖于TGFβ信号激活的许多基因表达的重大变化[78].特别是,PAI-1、纤维连接蛋白和结缔组织生长因子(CTGF)在衰老肌源性细胞中均被TGFβ直接上调,同时磷酸化的Smad2/3基础水平升高。总的来说,这些数据表明TGFβ信号在老年肌源性祖细胞中具有组成性活性,这可能解释了老年肌肉中纤维化的增加。
在一些实验和动物模型中,许多治疗药物对TGFβ信号的拮抗已被证明可以抑制纤维化和改善肌肉再生。然而,还没有一种药物能够令人信服地证明一旦形成就可以减少纤维化。例如,直接免疫调节TGFβ抑制结缔组织积累和膈纤维化的进展mdx小鼠,虽然炎症增加[79].在使用装饰蛋白和血管紧张素受体拮抗剂治疗的小鼠中,也检测到损伤后组织纤维化的减少,装饰蛋白还可以阻止tgf β诱导的肌源性细胞向纤维化细胞的分化[80].同样,扩展的处理mdx氯沙坦可显著减少小鼠膈纤维化,且无明显不良反应[81].在接受苏拉明治疗的动物中也报告了类似的结果,苏拉明通过与TGFβ竞争受体结合而起作用[82].最后,对老年人使用卤代黄酮类药物mdx通过大幅降低胶原蛋白的表达和显著降低磷酸化的Smad3水平,小鼠的心脏和呼吸功能得到了改善[83].事实上,卤代黄酮治疗也被证明可以增强肌肉生成,这一特征可能与改善肌肉营养不良的肌肉再生和功能有关[84].
参与纤维化发展的其他生长因子
CTGF
TGFβ对纤维化的作用至少可以被CTGF部分模拟和放大。CTGF在DMD患者骨骼肌中水平升高,营养不良的狗和mdx老鼠(85,86].CTGF最显著的特性之一是其诱导大鼠肾成纤维细胞中1型胶原蛋白、α5整合素和纤维连接蛋白的能力,比TGFβ强得多[87].皮下注射TGFβ也可调节新生瑞士小鼠CTGF的产生,而注射CTGF可引起与TGFβ相当的纤维化反应。这种纤维化反应是TGFβ和CTGF所特有的,EGF、PDGF或FGF2不能模仿[87].虽然CTGF似乎与decorin相互作用,可能调节其作用,但CTGF在骨骼肌中的确切作用尚不清楚。这些结果表明TGFβ和CTGF通过诱导纤维化、抑制肌生成和促进成肌细胞去分化为肌成纤维细胞样细胞而在骨骼肌重塑中发挥作用[86].
参与纤维化发展的其他生长因子
PDGF家族
另一个能够诱导肌肉成纤维细胞变化的生长因子家族是PDGF家族,包括PDGF- aa, PDGF- ab, PDGF- bb, PDGF- cc和PDGF- dd。这些分子结合两种不同的PDGF受体,α和β,和在活的有机体内它们可以诱导中性粒细胞、巨噬细胞、成纤维细胞和平滑肌细胞迁移到伤口部位并增殖。在体外, TGFβ可诱导PDGF的产生,TGFβ也可刺激成纤维细胞收缩胶原基质并分化为肌成纤维细胞[88].此外,PDGF可以以非典型的方式诱导c-abl激酶活性,类似于TGFβ [89].因此,阻断c-abl活性具有抗纤维化作用就不足为奇了。例如,抗肿瘤药物伊马替尼选择性和竞争性地阻断c-abl和其他几种酪氨酸激酶的ATP结合位点,包括PDGF受体和c-kit,并在许多纤维化疾病的实验小鼠模型中减少组织纤维化[90].PDGF及其受体在DMD患者的炎症细胞和再生纤维中也上调mdx老鼠。因此,给予伊马替尼mdx小鼠膈肌纤维化减轻,骨骼肌坏死和炎症减轻,肌肉功能随之改善[91].补充研究表明,伊马替尼改善营养不良mdx运动后的小鼠,尽管经过治疗的小鼠也表现出明显的体重减轻[92].
肌肉生长抑制素
肌生长抑制素,也被称为生长分化因子(GDF)8,是TGFβ家族成员,在骨骼肌谱系中特异性表达,其最典型的作用是肌肉生长的负调控。缺乏肌肉生长抑制素可增加骨骼肌量、肌纤维直径及强度[93,94].正常的肌肉生长抑制素信号可被细胞外蛋白卵泡抑素反调节[95].然而,肌肉生长抑制素不仅调节肌肉细胞的生长,还调节肌肉成纤维细胞的激活,从而调节纤维化的进展[96].事实上,一些研究小组已经报道了在没有肌肉生长抑制素的情况下,再生改善和纤维化减少[74].同样的,mdx缺乏肌肉生长抑制素的小鼠膈肌纤维化程度较低,而且比正常小鼠更强壮、肌肉更发达mdx同行(97].肌肉生长抑制素免疫中和是一种潜在的治疗方法mdx通过改善肌肉再生和减少ECM积累来减轻小鼠营养不良[98].肌肉生长抑制素的作用可能反映了它对肌肉成纤维细胞增殖的直接刺激,或当肌肉生长抑制素与激活素受体IIB结合时诱导其分化为肌成纤维细胞在体外而且在活的有机体内.在成纤维细胞中,肌肉生长抑制素诱导Smad、p38 MAPK和AKT通路的激活以促进ECM的合成[99].不出意外,注射重组肌肉生成抑制蛋白在活的有机体内刺激肌纤维表达TGFβ,可产生上述自分泌促纤维化作用。此外,TGFβ诱导肌肉生长抑制素的产生,揭示了两种促纤维化细胞因子对肌肉细胞的协同作用。一个重要的考虑是,肌肉生成抑制素在心肌中的生理作用似乎与它在骨骼肌中的作用有显著不同。因此,肌肉生长抑制素的损失既不诱导心肌肥大,也不调节心肌纤维化mdx老鼠(81].
其他一些因素也可能通过调节肌肉生长抑制素的功能起作用。例如,装饰蛋白的抗纤维化、促再生作用可能不仅源于其中和TGFβ作用的能力[73],还因为它能够拮抗肌肉生长抑制素对成纤维细胞和成肌细胞的作用。装饰蛋白是成人肌肉外基质中的主要蛋白聚糖。Biglycan的表达较弱,尽管两种蛋白都有扩增mdx肌肉(One hundred.,101].事实上,转基因小鼠中biglycan的缺失并不影响再生能力,尽管会导致新的肌纤维生长延迟[One hundred.],通过腺相关病毒(AAV)载体向再生肌肉传递装饰蛋白可防止TGFβ激活和纤维化[76].Decorin还可上调肌生长抑制素抑制剂follistatin的表达[74].胰岛素样生长因子(IGF)-1的过度表达和肌肉生长抑制素的同时丢失在活的有机体内已发现对肌纤维生长和受损纤维化有有趣的协同作用。肌肉受限IGF-1转基因基因的局部表达加速损伤骨骼肌的再生过程,调节炎症反应和限制纤维化[39].然而,这两个基因结合调节纤维化和肌肉再生的机制仍不清楚,仍在研究中。总的来说,肌肉生长抑制素具有独特的成纤维特性,当与其他信号系统结合考虑时,表明TGFβ、CTGF、肌肉生长抑制素和装饰蛋白之间存在共同调节关系。
ECM重塑在肌肉修复中的作用
纤维化可能是伤口愈合反应失调和/或ECM过度沉积的结果,阻碍了组织损伤后的正常再生。然而,适当的ECM沉积是有效修复的关键,因为骨骼肌周围的ECM在维持肌肉结构和加强肌肉收缩功能方面起着重要作用。此外,ECM隔离并向纤维呈现肝素结合生长因子,如肝细胞生长因子(HGF)和成纤维细胞生长因子(FGF),并通过反糖聚糖和肌聚糖复合物向分化的纤维发出信号[102,103].在肌肉损伤或药物干预后的转基因敲除模型中分析了ECM的单个成分,为ECM在正常条件下和肌肉再生过程中的功能提供了重要的见解。在正常肌肉中,外板由IV型胶原、层粘连蛋白和硫酸肝素蛋白聚糖组成,而环绕基板的间质基质则含有I、III、V型胶原、纤维连接蛋白和perlecan [10,11,102].系统和及时的分解和更换这些层是至关重要的,以确保完全和快速修复,同时避免纤维化。
纤维蛋白(原)在肌肉修复和纤维化中的作用
损伤骨骼肌临时原发性ECM的一个关键成分是纤维蛋白原及其终产物纤维蛋白,在这里统称为纤维蛋白(原)。过量和持续的纤维蛋白(原)沉积对肌纤维修复有害。失去纤溶蛋白酶uPA和纤溶酶的转基因小鼠(见下文)由于纤溶缺陷而表现出肌肉再生受损,并且在肌肉损伤后也有纤维蛋白积累[33,35].纤维蛋白(原)也积累在人类DMD患者的肌肉和横膈膜mdx老鼠(图4) [27,37].重要的是,纤维蛋白(原)的积累也与年龄的增加和纤维化的进展相关,而纤维蛋白(原)的消耗在mdx动物可显著拯救肌肉纤维化和疾病严重程度[27].纤维蛋白(原)沉积可能是炎症反应的重要触发因素,因为它们能够与经典激活的M1巨噬细胞上的整合素受体Mac-1结合[27)(见上文)。例如,纤维蛋白(原)与Mac-1接触后,巨噬细胞mdx肌肉可诱导促炎趋化因子和细胞因子的表达,这些因子可促进肌肉退变,包括IL-1β、TNFα、IL-6和MIP-2 [27].持久的纤维蛋白(原)沉积在营养不良的肌肉维持慢性炎症,其特征是交替激活的巨噬细胞的存在增加mdx随着年龄的增长,肌肉营养不良[27].如上所述,M2a巨噬细胞已被证明在几种不同的致病条件下促进纤维化[12],从而支持了纤维蛋白(原)可能通过维持营养不良肌肉中交替激活的巨噬细胞来促进纤维化的观点。此外,纤维蛋白(原)通过与成纤维细胞上的αVβ3整合素受体结合,还能直接刺激胶原蛋白的表达[27].这些发现强调了纤维蛋白(原)不仅是损伤后形成的短暂基质的结构成分,而且在持续的慢性疾病中,如肌肉萎缩症,它可以进一步促进组织炎症和纤维化。最后,损伤后立即产生的ECM成分的持久性显然对肌肉修复有害,至少部分是通过促进纤维化。
基质金属蛋白酶在骨骼肌修复中的重要性
除了直接合成ECM成分外,有效的肌肉修复还需要调节ECM蛋白水解降解的因子。这些分子包括一个大家族的基质金属蛋白酶(MMPs),钙依赖酶,特异性降解胶原蛋白和非胶原底物,以及它们的抑制剂,TIMPs。蛋白水解也受纤溶酶原激活系统分子的调节[[16,104].事实上,MMPs单独或与纤溶酶原/纤溶酶系统联合,可以降解ECM成分,这对细胞迁移和组织重塑至关重要。
基质金属蛋白酶的大家族包括各种胶原酶(MMP-1、MMP-8和MMP-13)、明胶酶(MMP-2和MMP-9)、基质溶质酶(MMP-3、MMP-7、MMP-10和MMP-11)、膜型金属蛋白酶(MMP-14、MMP-15、MMP-16、MMP-17、MMP-24和MMP-25)和金属弹性酶MMP-12 [16].基质金属蛋白酶从受损的肌肉和浸润细胞中释放出来,以破坏纤维的基底膜,从而促进肌源性、炎症性、血管性和成纤维细胞向受损组织募集。然而,基质金属蛋白酶的功能不仅由它们在受损肌肉和炎症细胞中的表达和释放所控制。MMP净活性也反映了活化酶的相对数量。激活需要膜型(MT)1-MMP对非活性前体的蛋白水解裂解[105]或纤溶酶,以及其相应抑制剂的裂解[106].例如,TIMP-1和TIMP-2水平的增加介导蛋白酶活性的净降低,从而导致基质积累。至少丝氨酸蛋白酶纤溶酶可以直接激活在体外其中,proMMP-1、proMMP-3、proMMP-9、proMMP-10和proMMP-11是一组MMP亲结构域,而proMMP-2的激活也涉及到在纤溶酶刺激过程中MT1-MMP的水解。在某些情况下,主动的MMPs还可以进一步激活其他MMPs的promp,从而形成正反馈循环。
基质金属蛋白酶在纤维化的发展中起着明显的作用,因为当胶原蛋白的合成速率大于基质金属蛋白酶/胶原酶分解速率时,胶原蛋白就会积累;也就是说,当TIMP和MMP活性之间的平衡有利于TIMP时。除了在纤维化中的作用外,基质金属蛋白酶和丝氨酸蛋白酶还在骨骼肌修复和卫星细胞活性中发挥许多其他作用。例如,MT1-MMP被认为有助于维持肌纤维的完整性,因为缺乏MT1-MMP的转基因小鼠发育出比正常小鼠更小的中心有核肌纤维[105].MMP-13和MMP-1在肌肉修复过程中也参与ECM重塑[16,107,108],而明胶酶MMP-2在成肌细胞增殖、迁移和融合过程中通过促进基膜中IV型胶原的降解来影响新纤维的形成。此外,在损伤过程中,局部细胞和入侵细胞释放的NO可以作为促炎分子,并能激活MMP-2,进而释放HGF。重要的是,NOS功能的阻滞剂,如硝基- l -精氨酸甲酯(L-NAME),已被证明可以减少急性炎症反应并增强纤维化在活的有机体内,部分通过降低iNOS、MMP-2和HGF [109,110].
另一种明胶酶,MMP-9,除了在炎症中起作用外,还被认为在肌肉再生的初始阶段卫星细胞激活中起关键作用。也许更重要的是成年人的骨骼肌mdx小鼠表达高水平的潜在和活性MMP-2和MMP-9,抑制MMP-9活性被证明可以通过减少肌肉的结构恶化、坏死、炎症和纤维化来显著改善再生和收缩功能[16,111- - - - - -113].在老年人中也得到了类似的结果mdx表达MMP-9和胎盘生长因子(PlGF)的改良肌腱成纤维细胞移植后的小鼠。这些细胞恢复了血管网络,减少了胶原蛋白沉积,提高了使用类似的细胞或基因疗法改善目前无法治疗的晚期营养不良患者肌肉功能的令人兴奋的可能性[114].ADAM12蛋白(一种分解素和金属蛋白酶12)已被证明在肌肉营养不良和衰老的情况下通过上调营养素和稳定质膜而产生益处[115].然而,长期高水平的ADAM12抑制卫星细胞反应和延迟成肌细胞分化,随后导致骨骼肌损失,加速纤维化和脂肪形成mdx老鼠。
纤溶酶原激活系统在受损肌肉修复过程中ECM重塑中的作用
在组织修复过程中,基质金属蛋白酶的活性可以与纤溶酶原激活系统的蛋白酶在ECM重塑中放大或协同作用,特别是由于它们具有降解多种ECM蛋白的能力。纤溶酶原激活系统以非活性的细胞外丝氨酸蛋白酶——纤溶酶原为中心,通过两种纤溶酶原激活剂(PAs):组织型纤溶酶原激活剂(tPA)和尿激酶型纤溶酶原激活剂(uPA)转化为活性酶——纤溶酶。PA抑制剂(PAI)-1在PAs水平上抑制纤溶酶原激活系统,α2-抗纤溶酶在纤溶酶水平上抑制纤溶酶原激活系统[104].纤溶酶原激活系统的主要功能是降解纤维蛋白[104],但它也通过切割ECM相关分子,释放和/或激活潜在形式的生物活性分子,如生长因子,血管生成因子和细胞因子(特别是bFGF, TGFβ, VEGF, HGF/SF和某些MMPs),在肌肉ECM重塑中发挥重要作用。这些分子中的许多也可能有助于激活静止的卫星细胞,并调节随后的肌生成程序。
纤溶酶原激活系统的组成部分在损伤后肌肉再生中起着重要而独特的作用,这并不奇怪。虽然已有研究表明uPA和纤溶酶活性对骨骼肌再生都是必要的,但tPA活性是可有可无的,这表明肌肉中不存在冗余[33,35].相比之下,PAI-1在肌肉再生中的负面作用是由PAI-1缺陷动物损伤后肌肉修复的改善所提示的[36].纤溶酶原激活系统在肌肉萎缩症中也起着重要作用。例如,uPA表达增加mdx而uPA的基因缺失会加剧营养不良和肌肉功能受损mdx老鼠(37].最近的数据也表明PAI-1可能影响人类和小鼠的营养不良肌肉,并且uPA/PAI-1平衡可能影响肌肉纤维化(我们未发表的结果)。与正常卫星细胞相比,来自人类DMD患者的卫星细胞产生更多的uPA受体和PAI-1,而uPA较少[116].表达uPA的脑转移源性细胞似乎也发挥了关键作用mdx肌肉修复与移植实验,表明它可能以许多不同的方式起作用。首先,bm衍生的upa表达细胞通过uPAs在纤维蛋白降解中的正常作用来防止纤维蛋白的过度沉积。其次,脑转移源性uPA也促进成肌细胞迁移,可能是通过激活或增加生长因子的可用性。最后,它增加了脑转移瘤来源的炎症细胞,特别是巨噬细胞向受损组织的浸润。然而,uPA受体的遗传缺失mdx小鼠的肌肉营养不良没有加剧,这表明uPA独立于其受体发挥其蛋白水解作用[37].
基于所有新出现的数据,我们很容易推测,DMD患者中明显的纤维化与营养不良肌肉中净蛋白水解活性的改变有关,这是由于PA/MMP系统成分的表达和活性的失衡[101,116].反过来,这种不平衡可能引发潜在TGFβ的异常激活,从而导致严重的纤维化后果。尽管纤溶酶和MMP的蛋白水解过程很重要,整合素和血栓反应蛋白也很重要,但导致TGFβ激活的全部机制是复杂的,仍然知之甚少。
影响肌肉ECM重塑的其他因素
干细胞抗原(Sca)-1已被证明通过调节ECM重塑来影响肌肉再生。由于Sca-1是成肌细胞增殖和分化的负调节因子,缺乏Sca-1的小鼠在肌肉再生方面表现出缺陷在体外.这些小鼠在损伤后也表现出增强的纤维化,这是MMP活性降低的结果。目前尚不清楚Sca-1是否直接或间接上调MMP活性,从而增加基质分解和有效的肌肉再生,同时阻止纤维化[117].最近的一项后续研究[118研究表明,由于腹膜产生IgM的B-1a细胞的特异性减少,sca -1缺陷小鼠的纤维化增加与损伤肌肉中IgM和C3的募集减少有关。因为Sca-1也在祖细胞的维持中起作用[119],假设B-1a细胞的减少是由于自我更新的谱系特异性缺陷。无论如何,肌肉损伤后IgM和C3的募集对于吞噬性巨噬细胞识别和清除死亡细胞,从而实现高效再生至关重要。尽管需要对IgM和C3在肌肉再生和纤维化中的作用进行更详细的研究,但在其他动物模型中,C3已被证明影响肝纤维化的发展[120].
在老年小鼠中,Sca-1+、非肌源性(MyoD-)和非免疫造血(CD45-)细胞群被认为有利于纤维化[121].这些细胞存在于衰老的再生肌肉中,或者它们可以克隆来源于从老年动物或晚传代C2C12细胞中分离出来的成肌细胞,尽管它们在年轻动物中并不常见,在年轻动物中它们似乎保留了更大的成肌潜能并表达MyoD。重要的是,这些细胞过度表达纤维化相关基因,可能是由Wnt2调节的。另一项最近的研究发现,肌肉中的肌肉驻留基质细胞(mrSC)种群增加mdx老鼠(122].Wnt3a在培养中促进mrSCs的增殖和胶原蛋白的表达,而对培养的成肌细胞起相反的作用。此外,野生型成年小鼠胫骨前肌注射Wnt3a可显著增加mrSC数量和胶原沉积。相反,Wnt拮抗剂DKK1注射到骨骼肌mdx小鼠显著减少了纤维化。因此,如上所述,典型的Wnt通路似乎增加了mrSCs的数量,并刺激这些细胞产生胶原蛋白。因此,Wnt通路,以及潜在的mrSCs,被进一步证实为对抗衰老和各种肌病纤维化的治疗靶点。
最近的研究表明igf家族成员松弛蛋白在调控MMP表达和纤维化发展中起着重要作用。用松弛素治疗能够限制小鼠撕裂伤后纤维化的发展[123].从机制上看,松弛素促进成肌细胞增殖和肌生成在体外通过下调p21和上调Pax7表达,同时增加几种基质金属蛋白酶的表达和激活,这一效应被基质金属蛋白酶阻断剂GM6001废止[123,124].然而,松弛素的作用机制尚不清楚在活的有机体内由于其对肌肉生成和纤维生成的联合作用,以及直接注射时减少炎症和促进血管生成的明显能力而复杂化。在衰老的肌肉中也能看到类似的效果[124].需要进一步的研究来确定松弛蛋白的关键靶细胞,其活性的动力学,以及其限制胶原沉积的能力是否适用于急性损伤模型之外的慢性损伤和肌病。
肌肉减少症的肌肉功能障碍和纤维化
除了上述因素外,一些研究还强调了衰老骨骼肌影响再生和纤维化的其他特征。例如,有人提出,在老年性肌肉减少症期间,肌纤维本身在控制ECM的稳态方面起着重要作用[125].事实上,一些与人类衰老相关的肌肉特征在出生后血清反应因子(SRF)肌肉特异性缺失的小鼠模型中过早地重现,包括IIB型肌纤维萎缩、肌节紊乱和肌内膜纤维化。在心脏毒素诱导的损伤小鼠模型中,除了持续和增加的纤维化外,还可以看到功能和形态再生受损。因为在这些小鼠中,SRF在有丝分裂后的肌纤维中被选择性地消融,再生受损和纤维化增加归因于干细胞生态位的二次修饰,再加上有利于纤维化的出现和维持的修饰环境。值得注意的是,在小鼠和人类肌肉样本中,SRF蛋白的表达随着年龄的增长而降低,这表明该因子在肌肉减少症的发病机制中具有生理作用。
衰老对人类骨骼肌中microRNAs表达影响的研究发现,Let-7家族的几个成员在老年受试者中上调。由于Let-7家族成员与细胞周期控制有关,它们可能会下调与肌肉细胞增殖有关的其他基因,这反过来可能会对随着衰老而出现的肌肉再生能力下降产生负面影响[126].在受到类似程度的损伤后,老年人类肌肉的表现也与年轻肌肉不同,其中一组特定转录本失调,包括与纤维化和结缔组织功能相关的转录本[127].老年人对损伤的年龄特异性反应包括NF-κB、热休克蛋白70和STAT3信号通路的更高表达。在人类抗阻运动后,老年肌肉与年轻肌肉相比,stat3依赖的反应也有所增加,这被假设与肌肉修复和再生的效率有关[128].
结论
纤维化是组织损伤和炎症之后一系列复杂事件的最终结果。如果这一过程出现故障,就会发生过度且持续的ECM沉积,正常组织被胶原疤痕取代,导致组织功能障碍。伴有持续性纤维化而非高效再生的肌肉修复失调在严重肌肉营养不良相关的临床衰退和预期寿命缩短中起着重要作用,尤其是在DMD中。如果纤维化组织能够得到修复,营养不良肌至少在一定程度上可以重新定向再生,从而保持肌肉的完整性,这类患者的健康状况可以得到显著改善。持久性纤维化是DMD基因和细胞治疗成功的主要障碍,旨在恢复或替换营养不良基因。因此,旨在阻止和/或减少DMD纤维化的肌肉环境的改变对于减缓疾病进展,改善基因传递和无法治疗的患者的干细胞移植至关重要。炎症细胞,尤其是巨噬细胞,在调节组织稳态和促进异常愈合中起着至关重要的作用。它们正在成为肌肉损伤损伤控制和组织重塑不可或缺的参与者,并在IIMs和营养不良等疾病中作为病理性骨骼重塑的主要介质。尽管骨骼肌巨噬细胞有许多功能,但它们在分子方面的特征仍然很差。有证据表明,肌肉巨噬细胞是一个异质群体,可能源于不同的生理学和病理学起源。 Finally, although there have been many advances in deciphering the variety of pathways involved in normal muscle regeneration and muscular dystrophy-associated fibrosis, these have not yet been translated into effective anti-fibrotic therapies for patients with DMD. It seems likely that single-agent therapies, such as growth-factor administration or antagonism of a single signaling pathway, will have a very weak effect on fibrosis at advanced disease stages in a clinical setting. This is probably due to the redundancy of growth factors and of the cellular participants, ECM components and signaling pathways involved in muscle regeneration/fibrosis, and to the rapid neutralization or elimination of individual agents. Thus, combined strategies will be crucial to combat fibrosis and ameliorate the progression of muscular dystrophy, including systemic delivery of anti-fibrotic agents and gene-corrected cells that could integrate environmental inputs from the host and convert them into biological transmitters.
参考文献
金刚砂AE:肌肉萎缩症。《柳叶刀》2002年,359:687 - 695。10.1016 / s0140 - 6736 (02) 07815 - 7
Blake DJ, Weir A, Newey SE, Davies KE:肌营养不良蛋白及其相关蛋白在肌肉中的功能和遗传学研究。生理上的评论2002年,82:291 - 329。
毛罗。A:骨骼纤维的卫星细胞。生物物理生物化学细胞学1961年,9:493 - 495。10.1083 / jcb.9.2.493
Porter JD, Khanna S, Kaminski HJ, Rao JS, Merriam AP, Richmonds CR, Leahy P, Li J, Guo W, Andrade FH:慢性炎症反应在营养不良蛋白缺失mdx小鼠的骨骼肌分子特征中占主导地位。哼Mol Genet2002年,11:263 - 272。10.1093 /物流/ 11.3.263
Muir LA, Chamberlain JS:肌肉营养不良的细胞和基因治疗新策略。医学专家2009年,11:e18。
Angelini C:皮质类固醇在肌肉萎缩症中的作用:一个关键的评估。肌肉神经2007年,36:424 - 435。10.1002 / mus.20812
Snijders T, Verdijk LB, van Loon LJ:肌肉减少症和运动训练对骨骼肌卫星细胞的影响。老化决议2009年,8:328 - 338。10.1016 / j.arr.2009.05.003
赖尔JG,谢尔策JD,林奇GS:年龄相关骨骼肌萎缩和无力的细胞和分子机制。Biogerontology2008年,9:213 - 228。10.1007 / s10522 - 008 - 9131 - 0
弗里德里希O, Both M,韦伯C,舒尔曼S,泰希曼MD,冯韦格纳F,芬克RH,沃格尔M,张伯伦JS,加尔贝C:在营养不良的mdx骨骼肌中,微结构严重受损,但运动蛋白功能保留。Biophys J2010年,98:606 - 616。10.1016 / j.bpj.2009.11.005
Grounds MD, Sorokin L, White J:细胞外基质-肌肉界面的力量。医学科学运动2005年,15:381 - 391。10.1111 / j.1600-0838.2005.00467.x
Kaariainen M, Jarvinen T, Jarvinen M, Rantanen J, Kalimo H:肌肉损伤修复过程中肌纤维与结缔组织的关系。医学科学运动2000年,10:332 - 337。10.1034 / j.1600-0838.2000.010006332.x
永利助教:纤维化的细胞和分子机制。中草药2008年,214:199 - 210。10.1002 / path.2277
查佐B,布丽吉特M,雅库布-尤瑟夫H,阿诺德L,盖拉尔迪R,十四行诗C,拉福斯特P,克雷蒂安F:巨噬细胞在骨骼肌再生过程中的双重有益作用。运动科学2009年,37:在18到22岁的。10.1097 / JES.0b013e318190ebdb
Tidball JG, Villalta SA:肌肉再生过程中肌肉与免疫系统之间的调节相互作用。Am J Physiol Regul集成Comp Physiol2010年,298:r1173 - 1187。10.1152 / ajpregu.00735.2009
卢里G,朗格卢瓦GD,麦克莱伦B,索洛韦PD,贾沃斯基DM:金属蛋白酶组织抑制剂2 (TIMP-2)通过β - 1整合素介导的机制调节神经肌肉连接处的发育。J一般2006年,66:1365 - 1377。10.1002 / neu.20315
陈晓,李旸:基质金属蛋白酶在骨骼肌中的作用:迁移、分化、再生和纤维化。细胞Adh Migr2009年,3:337 - 341。10.4161 / cam.3.4.9338
Tidball詹:肌肉损伤和修复中的炎症过程。Am J Physiol Regul集成Comp Physiol2005年,288:r345 - 353。
Serrano AL, Munoz-Canoves P:骨骼肌纤维化的调节与失调。Exp Cell Res2010年,316:3050 - 3058。10.1016 / j.yexcr.2010.05.035
Segawa M, Fukada S, Yamamoto Y, Yahagi H, Kanematsu M, Sato M, Ito T, Uezumi A, Hayashi S, miyago - suzuki Y,等.:抑制巨噬细胞功能损害严重纤维化的骨骼肌再生。Exp Cell Res2008年,314:3232 - 3244。10.1016 / j.yexcr.2008.08.008
Green DR, Ferguson T, Zitvogel L, Kroemer G:免疫原性和耐受性细胞死亡。Nat Rev Immunol2009年,9:353 - 363。10.1038 / nri2545
Brigitte M, Schilte C, Plonquet A, Baba-Amer Y, Henri A, Charlier C, Tajbakhsh S, Albert M, Gherardi RK,克雷蒂安F:肌肉巨噬细胞控制诺特辛诱导的肌肉损伤小鼠模型中的免疫细胞反应。关节炎感冒2010年,62:268 - 279。10.1002 / art.27183
Nahirney PC, Dow PR, Ovalle WK:正常和遗传营养不良小鼠骨骼肌肥大细胞的定量形态。阿娜特列克1997年,247:341 - 349。10.1002 / (SICI) 1097 - 0185 (199703) 247:3 < 341:: AID-AR5 > 3.0.CO; 2 x
Arnold L, Henry A, Poron F, Baba-Amer Y, van Rooijen N, Plonquet A, Gherardi RK, Chazaud B:骨骼肌损伤后招募的炎性单核细胞转变为抗炎巨噬细胞以支持肌生成。J实验医学2007年,204:1057 - 1069。10.1084 / jem.20070075
Mantovani A, Sica A, Sozzani S, Allavena P, Vecchi A, Locati M:趋化因子系统在多种形式的巨噬细胞激活和极化。趋势Immunol2004年,25:677 - 686。10.1016 / j.it.2004.09.015
Wynn TA, Barron L:巨噬细胞:炎症和纤维化的主要调节因子。Semin肝病2010年,30:245 - 257。10.1055 / s - 0030 - 1255354
永利助教:纤维化疾病和T(H)1/T(H)2范式。Nat Rev Immunol2004年,4:583 - 594。10.1038 / nri1412
Vidal B, Serrano AL, Tjwa M, Suelves M, Ardite E, De Mori R, baza - raja B, Martinez De Lagran M, Lafuste P, Ruiz-Bonilla V,等.:纤维蛋白原通过tgf - β /替代巨噬细胞激活途径驱动肌营养不良纤维化。基因与发育2008年,22:1747 - 1752。10.1101 / gad.465908
Villalta SA, Nguyen HX, Deng B, Gotoh T, Tidball JG:巨噬细胞表型的改变和巨噬细胞对精氨酸代谢的竞争影响肌肉萎缩症肌肉病理的严重程度。哼Mol Genet2009年,18:482 - 496。
比利亚塔SA,雷那尔迪C,邓B,刘刚,费多尔B,缇波JG:白介素-10通过灭活M1巨噬细胞和调节巨噬细胞表型减少mdx肌营养不良的病理。哼Mol Genet2011年,20:790 - 805。10.1093 /物流/ ddq523
Yogo Y, Fujishima S, Inoue T, Saito F, Shiomi T, Yamaguchi K, Ishizaka A:特发性肺纤维化中的巨噬细胞来源的趋化因子(CCL22)、胸腺和活化调节趋化因子(CCL17)和CCR4。和物2009年,10:80.10.1186 / 1465-9921-10-80
佩斯塞JT,拉玛林加姆TR,芒廷克-凯恩MM,威尔逊MS,埃尔·卡斯米KC,史密斯AM,汤普森RW,契弗AW,穆雷PJ,韦恩TA:表达精氨酸酶-1的巨噬细胞抑制Th2细胞因子驱动的炎症和纤维化。公共科学图书馆Pathog2009年,5:e1000371。10.1371 / journal.ppat.1000371
Sun D, Martinez CO, Ochoa O, Ruiz-Willhite L, Bonilla JR, Centonze VE, Waite LL, Michalek JE, McManus LM, Shireman PK:骨髓源性细胞对骨骼肌再生的调节。美国实验生物学学会联合会J2009年,23:382 - 395。
Lluis F, Roma J, su小精灵M, Parra M, anorte G, Gallardo E, Illa I, Rodriguez L, Hughes SM, Carmeliet P,等.:尿激酶依赖性的纤溶酶原激活是体内骨骼肌高效再生所必需的。血2001年,97:1703 - 1711。10.1182 / blood.V97.6.1703
马丁内斯CO, McHale MJ, Wells JT, Ochoa O, Michalek JE, McManus LM, Shireman PK:激活ccr2的趋化因子对骨骼肌再生的调控与巨噬细胞招募直接相关。Am J Physiol Regul集成Comp Physiol2010年,299:r832 - 842。10.1152 / ajpregu.00797.2009
Suelves M, Lopez-Alemany R, Lluis F, Aniorte G, Serrano E, Parra M, Carmeliet P, Munoz-Canoves P:纤溶酶活性是体外肌肉生成和体内骨骼肌再生所必需的。血2002年,99:2835 - 2844。10.1182 / blood.V99.8.2835
Suelves M, Vidal B, Ruiz V, Baeza-Raja B, Diaz-Ramos A, Cuartas I, Lluis F, Parra M, Jardi M, lopez - almany R,等.:骨骼肌再生中的纤溶酶原激活系统:尿激酶型纤溶酶原激活物(uPA)及其抑制剂(PAI-1)的拮抗作用。前面Biosci2005年,10:2978 - 2985。10.2741/1754
Suelves M, Vidal B, Serrano AL, Tjwa M, Roma J, Lopez-Alemany R, Luttun A, de Lagran MM, Diaz-Ramos A, Jardi M,等.:uPA缺乏加重MDX小鼠的肌肉营养不良。细胞生物学2007年,178:1039 - 1051。10.1083 / jcb.200705127
Wehling M, Spencer MJ, Tidball JG:一氧化氮合酶转基因改善mdx小鼠肌肉营养不良。细胞生物学2001年,155:123 - 131。10.1083 / jcb.200105110
Pelosi L, Giacinti C, Nardis C, Borsellino G, Rizzuto E, Nicoletti C, Wannenes F, battistiini L, Rosenthal N, Molinaro M, Musaro A:IGF-1的局部表达通过快速调节炎症细胞因子和趋化因子来加速肌肉再生。美国实验生物学学会联合会J2007年,21:1393 - 1402。10.1096 / fj.06 - 7690 com
彼得森JM, Guttridge DC:骨骼肌疾病、炎症和NF-kappaB信号:治疗干预的见解和机会免疫2008年,27日:375 - 387。10.1080 / 08830180802302389
Radley HG, Davies MJ, Grounds MD:cV1q (TNF阻断)治疗后,营养不良mdx小鼠的肌肉坏死减少和长期益处。Neuromuscul Disord2008年,18:227 - 238。10.1016 / j.nmd.2007.11.002
Desguerre I, Christov C, Mayer M, Zeller R, Becane HM, Bastuji-Garin S, Leturcq F, Chiron C, Chelly J, Gherardi RK:杜氏肌营养不良(DMD)的临床异质性:亚表型的定义和长期随访的预测标准。《公共科学图书馆•综合》2009年,4:e4347。10.1371 / journal.pone.0004347
Ruffell D, Mourkioti F, Gambardella A, Kirstetter P, Lopez RG, Rosenthal N, Nerlov C:CREB-C/ ebp -级联诱导M2巨噬细胞特异性基因表达,促进肌肉损伤修复。美国国家科学研究院2009年,106:17475 - 17480。10.1073 / pnas.0908641106
Di Marco S, Mazroui R, Dallaire P, Chittur S, Tenenbaum SA, Radzioch D, Marette A, Gallouzi IE:在肌肉萎缩过程中,NF-kappa b介导的MyoD衰减需要一氧化氮合酶mRNA稳定、HuR蛋白和一氧化氮释放。Mol细胞生物学2005年,25:6533 - 6545。10.1128 / mcb.25.15.6533 - 6545.2005
Evangeliou A, Vasilaki K, Karagianni P, Nikolaidis N:肌酸补充剂在儿科的临床应用。Curr Pharm生物技术公司2009年,10:683 - 690。10.2174 / 138920109789542075
Loell I, Lundberg IE:肌肉再生会在慢性炎症中失败吗:炎症性肌病的弱点?国际医学杂志2011.
Schakman O, Gilson H, Kalista S, Thissen JP:糖皮质激素致肌萎缩的机制。霍恩Res2009年,7216(5): 36-41。
Bondesen BA, Mills ST, Kegley KM, Pavlath GK:COX-2通路在骨骼肌再生的早期阶段是必不可少的。Am J Physiol Cell Physiol2004年,287:c475 - 483。10.1152 / ajpcell.00088.2004
沈伟,李勇,朱娟,Schwendener R, Huard J:损伤后骨骼肌愈合炎症期巨噬细胞、TGFbeta1和COX-2通路之间的相互作用细胞物理2008年,214:405 - 412。10.1002 / jcp.21212
洛埃尔一世,赫尔默斯SB,达斯特马尔基M,亚历山大H,蒙特斯LA,内内斯莫一世,林德罗斯E,博格K,伦德伯格IE,埃斯比约森M:特发性炎症性肌病中高比例的快抽动(II型)肌纤维-在慢性患者中明显,但在未经治疗的新诊断患者中不明显。临床物理功能成像2011年,31日:年龄在18岁至25岁之间。10.1111 / j.1475 - 097 x.2010.00973.x
Farini A, Meregalli M, Belicchi M, Battistelli M, Parolini D, D'Antona G, Gavina M, Ottoboni L, Constantin G, Bottinelli R, Torrente Y:T、B淋巴细胞减少对scid/mdx小鼠营养不良骨骼肌纤维化有显著影响。中草药2007年,213:229 - 238。10.1002 / path.2213
Morrison J, Lu QL, Pastoret C, Partridge T, bu - gharios G:mdx营养不良小鼠t细胞依赖性纤维化。实验室投资2000年,80:881 - 891。
Vetrone SA, Montecino-Rodriguez E, Kudryashova E, Kramerova I, Hoffman EP, Liu SD, Miceli MC, Spencer MJ:骨桥蛋白通过调节免疫细胞亚群和肌内tgf - β促进营养不良小鼠肌肉纤维化。J临床投资2009年,119:1583 - 1594。10.1172 / JCI37662
Morrison J, Palmer DB, Cobbold S, Partridge T, bo - gharios G:t淋巴细胞减少对mdx小鼠肌肉纤维化的影响。Am J Pathol2005年,166:1701 - 1710。10.1016 / s0002 - 9440 (10) 62480 - 7
Spencer MJ, Montecino-Rodriguez E, Dorshkind K, Tidball JG:辅助(CD4(+))和细胞毒(CD8(+)) T细胞促进肌营养不良蛋白缺陷的病理。中国Immunol2001年,98:235 - 243。10.1006 / clim.2000.4966
Hinz B, Phan SH, Thannickal VJ, Galli A, Bochaton-Piallat ML, Gabbiani G:肌成纤维细胞:一个功能,多个来源。Am J Pathol2007年,170:1807 - 1816。10.2353 / ajpath.2007.070112
Mathew SJ, Hansen JM, Merrell AJ, Murphy MM, Lawson JA, Hutcheson DA, Hansen MS, Angus-Hill M, Kardon G:结缔组织成纤维细胞和Tcf4调节肌肉生成。发展2011年,138:371 - 384。10.1242 / dev.057463
Alexakis C, Partridge T, boui - gharios G:卫星细胞在肌营养不良纤维化中的意义:胶原蛋白过度生产的自我延续机制。Am J Physiol Cell Physiol2007年,293:c661 - 669。10.1152 / ajpcell.00061.2007
Haus JM, Carrithers JA, Carroll CC, Tesch PA, Trappe TA:人体骨骼肌的收缩和结缔组织蛋白含量:35天和90天模拟微重力的影响和运动对策。Am J Physiol Regul集成Comp Physiol2007年,293:r1722 - 1727。10.1152 / ajpregu.00292.2007
塞切蒂F,伯纳基奥尼C,尼切利P,多纳蒂C,布鲁尼P:转化生长因子-beta1通过上调鞘氨醇激酶-1/S1P3轴诱导成肌细胞转分化为肌成纤维细胞。细胞的分子生物学2010年,21:1111 - 1124。10.1091 / mbc.e09 - 09 - 0812
小野Y,仙井H,大津S,永富R:Notch2负向调节成肌细胞的成纤维细胞分化。细胞物理2007年,210:358 - 369。10.1002 / jcp.20838
Carlson ME, Hsu M, Conboy IM:pSmad3和Notch之间的不平衡诱导衰老肌肉干细胞中的CDK抑制剂。自然2008年,454:528 - 532。10.1038 / nature07034
卡尔森J,崔伟,张强,徐旭,Mercan F, Bennett AM, Vignery A:MKP-1在破骨细胞和骨稳态中的作用。Am J Pathol2009年,175:1564 - 1573。10.2353 / ajpath.2009.090035
Brack AS, Murphy-Seiler F, Hanifi J, Deka J, Eyckerman S, Keller C, Aguet M, Rando TA:BCL9是典型Wnt信号的重要组成部分,在肌肉再生过程中介导肌源性祖细胞的分化。开发生物2009年,335:93 - 105。10.1016 / j.ydbio.2009.08.014
Brack AS, Conboy MJ, Roy S, Lee M, Kuo CJ, Keller C, Rando TA:衰老过程中Wnt信号的增加改变了肌肉干细胞的命运,增加了纤维化。科学2007年,317:807 - 810。10.1126 / science.1144090
Natarajan A, Lemos DR, Rossi FM:纤维/成脂祖细胞:骨骼肌再生的双刃剑。细胞周期2010年,9:
Joe AW, Yi L, Natarajan A, Le Grand F, So L, Wang J, Rudnicki MA, Rossi FM:肌肉损伤激活常驻纤维/脂肪生成祖细胞,促进肌肉生成。Nat细胞生物学2010年,12:153 - 163。10.1038 / ncb2015
上泉A,深田S,山本N,武田S,土田K:不同于卫星细胞的间充质祖细胞有助于骨骼肌中异位脂肪细胞的形成。Nat细胞生物学2010年,12:143 - 152。10.1038 / ncb2014
阿尔西奇N,扎奇尼亚S,曾蒂林L,拉米雷斯-科雷亚G,帕塔里尼L,萨尔维A,辛纳格拉G,贾六甲M:血管内皮生长因子在体内刺激骨骼肌再生。摩尔其他2004年,10:844 - 854。10.1016 / j.ymthe.2004.08.007
周玲,Porter JD,程刚,龚波,Hatala DA, Merriam AP,周X, Rafael JA, Kaminski HJ:TGFbeta1, 2,3和TbetaRI, II, III在mdx小鼠骨骼肌中mRNA的时空表达模式。Neuromuscul Disord2006年,16:。10.1016 / j.nmd.2005.09.009
Bonniaud P, margets PJ, Ask K, Flanders K, Gauldie J, Kolb M:tgf β和Smad3信号通路将炎症与慢性纤维生成联系起来。J Immunol2005年,175:5390 - 5395。
石毅,马萨格J:tgf - β信号从细胞膜到细胞核的机制。细胞2003年,113:685 - 700。10.1016 / s0092 - 8674 (03) 00432 - x
Brandan E, Cabello-Verrugio C, Vial C:蛋白聚糖装饰蛋白和大聚糖在肌肉形成和肌肉营养不良过程中的新调控机制。矩阵杂志2008年,27日:700 - 708。10.1016 / j.matbio.2008.07.004
朱娟,李勇,沈伟,乔晨,Ambrosio F, Lavasani M, Nozaki M, Branca MF, Huard J:转化生长因子- β - 1、肌肉生长抑制素和装饰蛋白之间的关系:骨骼肌纤维化的意义。生物化学2007年,282:25852 - 25863。10.1074 / jbc.M704146200
Li Y, Foster W, Deasy BM, Chan Y, Prisk V, Tang Y, Cummins J, Huard J:转化生长因子- β - 1诱导损伤骨骼肌肌原细胞分化为纤维细胞:肌肉成纤维的关键事件。Am J Pathol2004年,164:1007 - 1019。10.1016 / s0002 - 9440 (10) 63188 - 4
李颖,李娟,朱娟,孙波,Branca M,唐勇,Foster W,肖x, Huard J:Decorin基因转移促进肌肉细胞分化和肌肉再生。摩尔其他2007年,15:1616 - 1622。10.1038 / sj.mt.6300250
Heydemann A, Ceco E, Lim JE, Hadhazy M, Ryder P, Moran JL, Beier DR, Palmer AA, McNally EM:潜伏的tgf -结合蛋白4修饰小鼠肌肉萎缩症。J临床投资2009年,119:3703 - 3712。10.1172 / JCI39845
Beggs ML, Nagarajan R, Taylor-Jones JM, Nolen G, Macnicol M, Peterson CA:肌源性祖细胞tgf -信号通路随年龄的变化衰老细胞2004年,3:353 - 361。10.1111 / j.1474-9728.2004.00135.x
Andreetta F, Bernasconi P, Baggi F, Ferro P, Oliva L, Arnoldi E, Cornelio F, Mantegazza R, Confalonieri P:在mdx小鼠中tgf β 1的免疫调节抑制膈内结缔组织增殖但增加炎症反应:抗纤维化治疗的意义。J Neuroimmunol2006年,175:77 - 86。10.1016 / j.jneuroim.2006.03.005
贝代尔,T Karthikeyan, Quintero A, Li Y, Huard J:损伤后使用血管紧张素受体阻断剂可以促进肌肉再生,减少正常骨骼肌的纤维化。Am J运动医学2008年,36:1548 - 1554。10.1177 / 0363546508315470
Cohn RD, van Erp C, Habashi JP, Soleimani AA, Klein EC, Lisi MT, Gamradt M, ap Rhys CM, Holm TM, Loeys BL,等.:在多种肌病状态下,血管紧张素II型1受体阻断可减弱tgf -诱导的肌肉再生失败。自然医学2007年,13:204 - 210。10.1038 / nm1536
陈玉生,李勇,Foster W, Horaguchi T, Somogyi G,付芳华,Huard J:苏拉明对裂伤后骨骼肌抗纤维化的作用。J应用物理2003年,95:771 - 780。
Roffe S, Hagai Y, Pines M, Halevy O:Halofuginone在肌肉细胞中通过PI3K/Akt和MAPK/ERK途径抑制Smad3磷酸化:对肌管融合的影响Exp Cell Res2010年,316:1061 - 1069。10.1016 / j.yexcr.2010.01.003
许伯纳KD,贾萨尔DS,哈勒维O,派恩斯M,安德森JE:halofuginone对mdx小鼠营养不良心脏和骨骼肌纤维化的功能性解决。是J Physiol心脏Circ Physiol2008年,294:h1550 - 1561。10.1152 / ajpheart.01253.2007
孙g,萩野谷K,吴Y,千叶Y, Nakanishi T,大沼A,佐藤Y,泷川M,井沼K,土屋S:结缔组织生长因子在人肌营养不良的肌肉中过表达。神经科学2008年,267:48-56。10.1016 / j.jns.2007.09.043
维尔C,祖尼加LM,卡贝洛-维鲁乔C,佳能P,法迪奇R,布兰登E:骨骼肌细胞表达促纤维化细胞因子结缔组织生长因子(CTGF/CCN2),诱导骨骼肌细胞去分化。细胞物理2008年,215:410 - 421。10.1002 / jcp.21324
Frazier K, Williams S, Kothapalli D, Klapper H, Grotendorst GR:结缔组织生长因子刺激成纤维细胞生长、基质生成和肉芽组织形成。J Invest Dermatol1996年,107:404 - 411。1523 - 1747. - 10.1111 / ep12363389
邦纳JC:PDGF及其受体在纤维化疾病中的调控。细胞因子生长因子Rev2004年,15:255 - 273。10.1016 / j.cytogfr.2004.03.006
Plattner R, Kadlec L, DeMali KA, Kazlauskas A, Pendergast AM:c-Abl被生长因子和Src家族激酶激活,并在细胞对PDGF的反应中发挥作用。基因与发育1999年,13:2400 - 2411。10.1101 / gad.13.18.2400
Gordon J, Spiera R:伊马替尼和纤维化的治疗:最近的试验和磨难。Curr Rheumatol Rep2011年,13:51-58。10.1007 / s11926 - 010 - 0146 - 6
黄鹏,赵晓星,Fields M, Ransohoff RM,周磊:伊马替尼可减轻mdx小鼠骨骼肌营养不良。美国实验生物学学会联合会J2009年,23:2539 - 2548。10.1096 / fj.09 - 129833
比扎里奥JC,塞里DG,罗德里格斯LC,奥利维拉GL,诺米佐A,德阿劳霍DD,福原爱PS,里贝罗JC,德卡斯特罗FA,科斯塔MC:甲磺酸伊马替尼改善运动mdx小鼠的营养不良表型。J Neuroimmunol2009年,212:93 - 101。10.1016 / j.jneuroim.2009.05.006
玻璃DJ:信号通路扰乱肌肉质量。Curr Opin Clin Nutr Metab护理2010年,13:225 - 229。10.1097 / MCO.0b013e32833862df
Kollias HD, McDermott JC:骨骼肌中的转化生长因子- β和肌肉生长抑制素信号。J应用物理2008年,104:579 - 587。
Rodino-Klapac LR, Haidet AM, Kota J, Handy C, Kaspar BK, Mendell JR:肌肉生长抑制素的抑制,强调卵泡抑素作为肌肉疾病的治疗方法。肌肉神经2009年,39:283 - 296。10.1002 / mus.21244
Li ZB, Kollias HD, Wagner KR:肌肉生长抑制素直接调节骨骼肌纤维化。生物化学2008年,283:19371 - 19378。10.1074 / jbc.M802585200
Wagner KR, McPherron AC, Winik N, Lee SJ:在mdx小鼠中,肌肉生长抑制素的缺失可减轻肌肉萎缩的严重程度。安神经2002年,52:832 - 836。10.1002 / ana.10385
mcroskery S, Thomas M, Platt L, Hennebry A,西村T, McLeay L, Sharma M, Kambadur R:肌肉生长抑制素缺失小鼠通过增强再生和减少纤维化来改善肌肉愈合。细胞科学杂志2005年,118:3531 - 3541。10.1242 / jcs.02482
Philip B, Lu Z, Gao Y:p38 MAPK对GDF-8信号的调控。手机信号2005年,17:365 - 375。10.1016 / j.cellsig.2004.08.003
Casar JC, McKechnie BA, Fallon JR, Young MF, Brandan E:骨骼肌再生过程中biglycan的短暂上调:在biglycan缺陷小鼠中纤维生长延迟和decorin增加。开发生物2004年,268:358 - 371。10.1016 / j.ydbio.2003.12.025
扎诺蒂S,内格里T,卡佩莱蒂C,贝纳斯科尼P,卡尼奥尼E,迪布拉西C,佩戈拉罗E,安杰利尼C,西卡托P,普雷勒A,等.:Decorin和biglycan在几种肌营养不良症中的表达有差异。大脑2005年,128:2546 - 2555。10.1093 /大脑/ awh635
Cornelison DD:背景问题:体内和体外对肌肉卫星细胞活性的影响。细胞生物化学2008年,105:663 - 669。10.1002 / jcb.21892
Durbeej M, Campbell KP:涉及肌营养不良蛋白-糖蛋白复合物的肌肉营养不良:当前小鼠模型的概述。Genet开发总监2002年,12:349 - 361。10.1016 / s0959 - 437 x (02) 00309 - x
Nagamine Y, Medcalf RL, Munoz-Canoves P:纤溶酶原激活物系统的转录和转录后调控。Thromb Haemost2005年,93:661 - 675。
大竹Y,东条H,精木M:MT1-MMP在骨骼肌肌纤维形成和形态维持中的多功能作用细胞科学杂志2006年,119:3822 - 3832。10.1242 / jcs.03158
Visse R, Nagase H:基质金属蛋白酶和金属蛋白酶的组织抑制剂:结构,功能和生物化学。中国保监会Res2003年,92:827 - 839。10.1161/01. res.0000070112.80711.3d
Kaar JL, Li Y, Blair HC, Asche G, Koepsel RR, Huard J, Russell AJ:基质金属蛋白酶-1治疗肌肉纤维化。Acta Biomater2008年,4:1411 - 1420。10.1016 / j.actbio.2008.03.010
吴娜,詹森ED,戴维森JM:小鼠基质金属蛋白酶13在自由电子激光和手术刀创面愈合过程中表达的比较。J Invest Dermatol2003年,121:926 - 932。10.1046 / j.1523-1747.2003.12497.x
Filippin LI, Cuevas MJ, Lima E, Marroni NP, Gonzalez-Gallego J, Xavier RM:一氧化氮在骨骼肌创伤愈合过程中的作用。Inflamm Res2011年,60(4): 347 - 56。Epub 2010 11月13日10.1007/s00011-010-0277-2
Filippin LI, Cuevas MJ, Lima E, Marroni NP, Gonzalez-Gallego J, Xavier RM:一氧化氮调节损伤骨骼肌的修复。一氧化氮2011年,24:43-49。10.1016 / j.niox.2010.11.003
福岛K,中村A,上田H,汤浅K,吉田K,武田S,池田S:基质金属蛋白酶-2和-9在肌营养不良犬(CXMDJ)骨骼肌中的活化和定位。BMC肌肉骨骼失调2007年,8:54.10.1186 / 1471-2474-8-54
khherif S, Lafuma C, Dehaupas M, Lachkar S, Fournier J-G, Verdiere-Sahuque M, Fardeau M, Alameddine HS:基质金属蛋白酶2和9在再生骨骼肌中的表达:实验性损伤肌肉和mdx肌肉的研究。DevBiol1999年,205:158 - 170。
Li H, Mittal A, Makonchuk DY, Bhatnagar S, Kumar A:基质金属蛋白酶9抑制可改善肌营养不良的发病机制并促进骨骼肌再生。哼Mol Genet2009年,18:2584 - 2598。10.1093 /物流/ ddp191
Gargioli C, Coletta M, De Grandis F, Cannata SM, Cossu G:plgf - mmp -9表达细胞恢复老年营养不良肌微循环及细胞治疗效果自然医学2008年,14:973 - 978。10.1038 / nm.1852
Jorgensen LH, Jensen CH, Wewer UM, Schroder HD:ADAM12转基因过表达抑制衰老mdx小鼠肌肉再生,加重营养不良。Am J Pathol2007年,171:1599 - 1607。10.2353 / ajpath.2007.070435
Kafadar KA, Yi L, Ahmad Y, So L, Rossi F, Pavlath GK:Sca-1的表达是骨骼肌再生过程中细胞外基质高效重塑所必需的。开发生物2009年,326:47-59。10.1016 / j.ydbio.2008.10.036
Long KK, Pavlath GK, Montano M:Sca-1影响骨骼肌再生过程中的先天免疫反应。Am J Physiol Cell Physiol2011年,300:公元前294年。10.1152 / ajpcell.00319.2010
伊藤春,李春,伯恩斯坦A,狄克JE,斯坦福Sca-1/ ly - 6a缺失小鼠的造血干细胞和祖细胞缺陷。血2003年,101:517 - 523。10.1182 / - 2002 - 06 - 1918血
Markiewski MM, Mastellos D, Tudoran R, DeAngelis RA, Strey CW, Franchini S, Wetsel RA, Erdei A, Lambris JD:补体第三组分(C3)的C3a和C3b激活产物对毒性损伤后肝脏的正常恢复至关重要。J Immunol2004年,173:747 - 754。
Hidestrand M, Richards-Malcolm S, Gurley CM, Nolen G, Grimes B, Waterstrat A, Zant GV, Peterson CA:表达sca -1的非肌源性细胞参与老年骨骼肌纤维化。J Gerontol生物科学医学科学2008年,63:566 - 579。
Trensz F, Haroun S, Cloutier A, Richter MV, Grenier G:肌肉常驻细胞群通过Wnt典型途径促进mdx小鼠后肢骨骼肌纤维化。Am J Physiol Cell Physiol2010年,299:c939 - 947。10.1152 / ajpcell.00253.2010
根岸S,李勇,Usas A,付芳华,Huard J:松弛素治疗骨骼肌损伤的效果。Am J运动医学2005年,33:1816 - 1824。10.1177 / 0363546505278701
Mu X, Urso ML, Murray K, Fu F, Li Y:在年轻和老年小鼠的肌肉愈合过程中,松弛素调节MMP的表达并促进卫星细胞的动员。Am J Pathol2010年,177:2399 - 2410。10.2353 / ajpath.2010.091121
Fibbi G, Barletta E, Dini G, Del Rosso A, Pucci M, Cerletti M, Del Rosso M:正常和营养不良患者肌肉卫星细胞中尿激酶纤溶酶原激活物/尿激酶纤溶酶原激活物受体系统表达差异影响细胞侵袭。实验室投资2001年,81:27-39。
Lahoute C, Sotiropoulos A, Favier M, Guillet-Deniau I, Charvet C, Ferry A, Butler-Browne G, Metzger D, Tuil D, Daegelen D:缺乏血清反应因子的骨骼肌过早衰老。《公共科学图书馆•综合》2008年,3:e3910。10.1371 / journal.pone.0003910
Drummond MJ, McCarthy JJ, Sinha M, Spratt HM, Volpi E, Esser KA, Rasmussen BB:衰老和人类骨骼肌中的MicroRNA表达:微阵列和生物信息学分析。杂志基因组学2010年出版。
Thalacker-Mercer AE, Dell'Italia LJ, Cui X, Cross JM, Bamman MM:尽管在阻力负荷后轻度肌肉损伤水平相似,但老年人与年轻人的差异基因组反应。杂志基因组学2010年,40岁:141 - 149。10.1152 / physiolgenomics.00151.2009
特里纳里MK,凯里KA,沃德AC,法恩菲尔德MM,卡梅隆-史密斯D:运动诱导的STAT3信号的激活随着年龄的增长而增加。复兴Res2008年,11:717 - 724。10.1089 / rej.2007.0643
Horsley V, Jansen KM, Mills ST, Pavlath GK:IL-4在哺乳动物肌肉生长过程中作为成肌细胞招募因子。细胞2003年,113:483 - 494。10.1016 / s0092 - 8674 (03) 00319 - 2
确认
我们感谢我们实验室所有成员的有益讨论,并感谢E. Ardite和B. Vidal分享未发表的结果。这项工作由MICINN (PLE2009-0124, SAF2009-09782, FIS-PS09/01267, SAF2010-21682, CIBERNED), Fundación Marató-TV3/R-Pascual, MDA, EU-FP7 (Myoage, Optistem和Endostem)和AFM资助。
作者信息
作者及隶属关系
相应的作者
额外的信息
相互竞争的利益
作者宣称他们之间没有利益冲突。
作者的贡献
所有作者都在一定程度上对手稿的写作和编辑以及人物设计做出了贡献。所有作者都阅读并批准了最终的手稿
Christopher J Mann, Eusebio Perdiguero, Antonio L Serrano对这项工作做出了同样的贡献。
权利和权限
开放获取本文由BioMed Central Ltd授权发布。这是一篇开放获取文章,根据创作共用归属许可协议(https://creativecommons.org/licenses/by/2.0),允许在任何媒介上不受限制地使用、传播和复制,前提是正确地引用原始作品。
关于本文
引用本文
曼恩,c.j.,佩迪戈罗,E.,哈拉兹,Y.。et al。骨骼肌异常修复与纤维化发展。骨骼肌1, 21(2011)。https://doi.org/10.1186/2044-5040-1-21
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/2044-5040-1-21
关键字
- 肌肉萎缩症
- 卫星细胞
- 肌肉再生
- 血清反应因子
- 肌原性的细胞