摘要
背景
日本常用的透析液由两种透析浓缩液和透析水配制而成。报道了自来水中的硅(Si)作为不溶性悬浮颗粒物存在于透析水中。我们的目的是检查在线制备的替代液中不溶性颗粒物质的来源,并检查二氧化硅(SiO)的影响2)的自来水2透析水。
方法
根据在线制备替代液的颗粒数和粒径分布,对在线制备替代液的颗粒直径和颗粒组成元素进行了评价。为了确定在线制备的替代液中不溶性颗粒物的来源,我们测量了粘附在最终内毒素保留过滤器(ETRF)中空纤维表面和最终内毒素保留过滤器外壳内表面的颗粒直径和组成元素,并测量了SiO2自来水、透析用水和商用无菌替代液。
结果
在最终ETRF(中空纤维和外壳)和从最终ETRF采样的在线制备的替代液中检测到的30个颗粒中,含硅颗粒占83%。SiO的巨大变异性2在自来水中,这取决于地理区域。SiO2含量为0.4 ~ 0.7 mg/L。商用无菌替代液中未检出Si颗粒,商用无菌替代液中含有SiO20.1 mg/L。
结论
我们假设在线制备的替代液中不溶性颗粒为透析液中析出的钙、镁和透析水中析出的Si。此外,SiO的变化2是影响SiO含量的一个因素2透析水的水平。如果考虑在线制备的取代液中硅酸盐的形成和目标SiO2在透析水中应设置≤0.1 mg/L, SiO2在确定透析液制备仪器的规格之前,应了解医院和透析中心提供的自来水。
背景
日本常用的透析液是由两种透析浓缩液(酸,A;碳酸氢盐,B)和透析水。稀释比例为透析浓缩液A/透析浓缩液B/透析水= 1:1.26:32.74。将粉状透析浓缩液溶于透析水,制备透析浓缩液A和B。因此,透析液的质量很大程度上取决于透析水的质量[1].而粉状透析浓缩液则是按照日本药典(JP)的规定制造的[2],透析用水主要由自来水制造;因此,日本透析治疗学会(JSDT)提出了两套透析用水标准,即生物污染标准和化学污染物水质标准[3.].然而,据报道,来自自来水的硅(Si)作为悬浮的不溶性颗粒物质存在于透析水中[4].此外,JSDT标准没有参考透析水或透析液中的不溶性颗粒物。
在在线血液透析滤过(HDF)治疗中,每次透析期间将10-100升在线制备的替代液注入接受体外循环的患者的血液中[5].在线制备的替代液是通过透析液的内毒素保留过滤器(ETRF)过滤而产生的[6].根据ETRF规范,不溶性颗粒物> 0.1 μ m不可能通过ETRF;然而,一项研究显示,在经ETRF过滤的透析液中存在不溶性微粒物质[4].考虑到在线制备的替代液的注射量比商业无菌替代液的用量大,即使是少量的不溶性颗粒物质也可能导致最终的健康危害。
在本研究中,我们首先测量了在中央透析液输送系统(CDDS)的床边透析控制台上使用ETRF在线制备的替代液的颗粒数量和粒径分布[7使用过氧乙酸、商业无菌替代液和5%葡萄糖注射液进行清洗。参考JP及美国肠外和肠内营养学会的特别报告[8],我们根据以下四类颗粒直径来评估每1ml样品的颗粒数量:< 5 μ m,≥5 μ m,≥10 μ m,≥25 μ m。根据颗粒数量和粒径分布,对在线制备的替代液中颗粒数量最多的、商用无菌替代液中的颗粒、5%葡萄糖注射液中的颗粒进行了扫描电子显微镜(SEM)和能量色散x射线能谱(EDS)相结合的SEM - EDS分析。为了确定在线制备的替代液中不溶性颗粒物质的来源,我们使用SEM-EDS测量了粘附在最终ETRF中空纤维表面和最终ETRF外壳内表面的颗粒的直径和组成元素,并测量了二氧化硅(SiO)2)在自来水、反渗透(RO)水、透析水、商业无菌酸性替代液、商业无菌碳酸氢盐替代液和5%葡萄糖注射液中使用电感耦合等离子体发射光谱(ICP-OES)。此外,由于Matsumoto等人报道了不同地理区域制备透析用水的自来水中Si的含量存在很大差异[9,我们确定了SiO2在日本各地采集的自来水样本中
通过这种方式,我们旨在检查在线制备的替代液中不溶性颗粒物质的来源,并检查SiO的影响2SiO上的自来水2透析水。这些数据有望建立医院和透析中心制备透析液的仪器规范,以提供在线制备的替代液,以提供与商业无菌替代液相同的水平。
方法
中央透析液输送系统
CDDS由一个水处理设备(VCR-81NF-RUHS;Daicen膜系统公司,东京,日本),一个多患者透析液供应单元(MDSU) (das - 20nx;NIKKISO,东京,日本),一种酸性粉末混合装置(AHI-502;DKK-TOA,东京,日本),碳酸氢盐粉末混合装置(BHI-502, DKK-TOA,东京,日本)和12个床边透析控制台(DCS-100NX;日基所,东京,日本)。反渗透单元的回收率约为75%,平均电导率为4.4µS/cm。床边透析控制台配有两个etrf串联。透析液管道有两个系统——22米和15米长——每个系统都有6个连接的床边透析控制台。透析液浓缩液粉末使用Kindaly®4E (Fuso Pharmaceutical Industries, Ltd, Osaka, Japan)。CDDS消毒方法为透析后冲洗30分钟,然后用含螯合剂的次氯酸钠(DIACLEAN; Kao, Tokyo, Japan; used after 140-fold dilution) for 40 min. After 40 min of disinfection, sodium hypochlorite including a chelating agent was retained overnight. Then, pre-dialysis rinsing was performed for 60 min. This disinfection process was performed three times a week. The method for acid cleaning of CDDS was post-dialysis rinsing for 30 min, followed by disinfection with sodium hypochlorite including a chelating agent (DIACLEAN; Kao, Tokyo, Japan; used after 140-fold dilution) for 40 min. After rinsing with dialysis water for 30 min, the system was cleaned with peracetic acid (SURGITECT; Kao, Tokyo, Japan; used after 100-fold dilution) for 40 min, and the peracetic acid solution was retained overnight. Then, pre-dialysis rinsing was performed for 60 min. This process was performed three times a week. Under these conditions, there were no CDDS issues because of carbonate.
材料
我们混合了商用无菌酸性替代液和商用无菌碳酸氢盐替代液,用于离线HDF (SUBPACK-Bi®;NIPRO,大阪,日本),在80°C的恒温水浴中加热混合物20分钟。商用无菌替代液加热至36°C和5%葡萄糖注射液(大冢葡萄糖注射液;大冢制药,东京,日本)是这项研究的目标。
测量粒子的数量
根据JP标准,在以下条件下测量粒子数[2].在计数颗粒前,确认测量环境符合JP标准。为了去除附着在烧杯上的异物,注射用水(大冢蒸馏水;大冢制药,东京,日本)用于清洁。使用光遮蔽粒子计数器(KL-04;RION,东京,日本)在通风时停止了。颗粒直径阈值分别为1.3、2.0、5.0、10.0、20.0、25.0、40.0、50.0、100.0 μ m。每次测量使用5毫升样品。经过四次测量后,剔除第一个结果,取第二个到第四个结果的平均值。我们评估了每1ml样品的颗粒数量,基于以下四类:颗粒直径< 5 μ m,≥5 μ m,≥10 μ m,≥25 μ m。
我们从12台配备最终ETRF (EF-02;日基索,东京,日本)使用1-6个月。我们将透析液通过所选床边透析控制台的最终ETRF,持续15分钟(透析液流速为500 mL/min)。用样品液洗涤烧杯3次后,分别取在线制备的替代液、商用无菌替代液和5%葡萄糖注射液各300 mL,放置30 min,以避免≥2 μ m的气泡对样品的影响,然后计数颗粒[10].
颗粒直径和颗粒组成元素的测量
在取样液体进行颗粒计数的同时,我们在50ml离心管(50ml超清离心管3191-335;Labcon北美,加利福尼亚州,美国)冲洗三次后。采用孔径为0.4 μm的膜过滤器FJ-VKF04;Koyo Sangyo,东京,日本)在相同的条件下计数粒子。为了防止成分沉淀到膜过滤器上,混合时将离心管中的每种液体各20ml,注射用水50ml放置在膜过滤器上,并将离心管中每种液体的颗粒捕获在膜过滤器上。我们的目标是在线制备的置换液中数量最大的粒子。抽吸后,我们在膜过滤器上涂上带有锇的颗粒。我们使用SEM - eds(加速电压8 kV)结合SEM (Supra40;卡尔蔡司显微镜公司,耶拿,德国)和EDS (XFlash 6|10;布鲁克,马萨诸塞州,美国)。
用SEM-EDS观察最终的ETRF
收集在线制备的替代液后,用透析水冲洗CDDS 90分钟,以防止透析液管路中残留的透析液成分沉淀。冲洗后,最后的ETRF从透析台取出。最后的ETRF在离透析液入口6厘米处被切断,然后风干,直到没有剩余水分。从用这种方法处理的6个最终ETRF中,我们选择了直接连接到采样点的最终ETRF,用于在线制备的具有最高粒子数的替代流体。我们将选定的最终ETRF的10根中心纤维和最靠近最终ETRF外壳的10根中空纤维涂上锇。我们用SEM-EDS(加速电压8 kV)对透析液进口侧2 cm的包锇中空纤维进行了分析。根据粒子数的结果,我们测量了粒子直径,并对每个粒子进行了10个元素分析。我们还收集了选定的最终ETRF的外壳,并涂上锇。我们使用SEM-EDS(加速电压8 kV)测量了粘附在锇涂层外壳内表面的共10个颗粒的粒径,并根据颗粒数的结果进行了元素分析。
SiO2测量
在用透析水冲洗CDDS至少90分钟后,从以下三个点用聚乙烯瓶收集水样:用于CDDS的自来水、水处理设备(RO渗透)和替代液体采样点(透析水)(每个100毫升)(收集地点,东京文京区;征集期,2017年4月- 9月)。比较SiO2在自来水中,RO渗透,并与SiO透析水样2在商业药品中,商业无菌酸性替代液、商业无菌碳酸氢盐替代液和5%葡萄糖溶液(各100 mL)收集在聚乙烯瓶中。此外,为了比较日本不同地理区域的自来水,在札幌北田区的聚乙烯瓶中收集自来水样品;仙台Aoba-ku;Bunkyo-ku,东京;Nakamura-ku名古屋;Yodogawa-ku大阪;Naka-ku,广岛;福冈博田(各100毫升)(收集期,2017年4月第一周)。用纯净水清洗过的聚乙烯瓶,用待收集的溶液提前清洗三次。SiO2用ICP-OES (730-ES;Agilent Technologies, CA, USA)根据日本水务协会的水检验标准方法[11].
结果
粒子数
表格1显示在线制备的替代液、商业无菌替代液和5%葡萄糖溶液样品中的颗粒计数。所有样品均检出直径≥5 μ m的颗粒。在商用灭菌替代液中检测到的颗粒数量最多。在在线制备的替代液样品中,使用3个月后,在最终ETRF测试的样品中报告了最大数量的颗粒。
粒子直径和元素分析
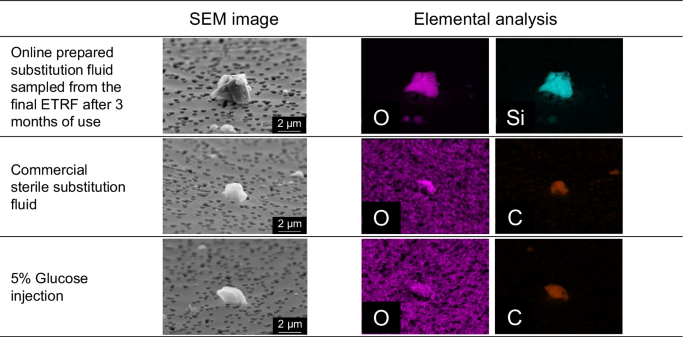
数字1显示了使用3个月后从最终ETRF中采集的在线制备替代液体样品、商业灭菌替代液体样品和5%葡萄糖溶液样品中的颗粒的SEM图像和EDS映射结果。在使用3个月后从最终ETRF中收集的在线制备的替代液中检测到氧(O)和硅(Si)。在商用灭菌替代液和5%葡萄糖溶液样品的颗粒中检测到碳(C)和O。表格2显示了使用3个月后从最终ETRF中取样的在线制备替代液、商业无菌替代液和5%葡萄糖溶液中10个颗粒的粒径测量和成分元素分析结果。从使用了3个月的最终ETRF中采集的在线制备的替代流体样品中,有3个颗粒由C、O和钙(Ca)组成,3个颗粒由O和Si组成,4个颗粒由O、镁(Mg)和Si组成。商用灭菌替代液样品或5%葡萄糖溶液样品中的10个颗粒均由C和O组成。
粘附在最终ETRF上的粒子的直径和组成元素
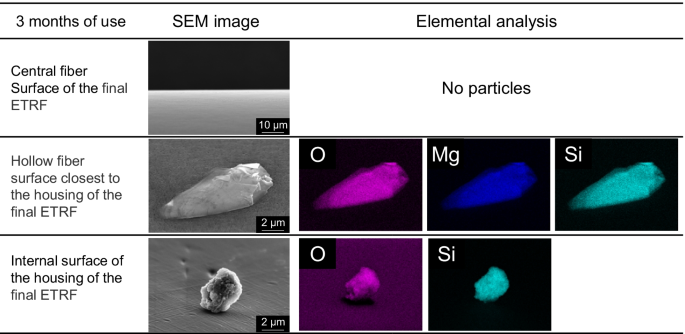
数字2显示了使用3个月的最终ETRF的中心纤维表面、最靠近最终ETRF外壳的中空纤维表面和最终ETRF外壳的内表面的SEM图像和EDS映射结果。在最终的ETRF中,中心纤维表面未发现颗粒。在离最终ETRF外壳最近的空心纤维表面的粒子中检测到O、Mg和Si。在最终的ETRF外壳内表面的粒子中检测到O和Si。表格3.显示了使用3个月后,在离最终ETRF外壳最近的中空纤维表面的10个颗粒和在最终ETRF外壳内表面的10个颗粒的粒径测量和成分元分析结果。在使用3个月的最后ETRF的外壳最近的中空纤维表面的10个颗粒全部由O、Mg和Si组成。在最终ETRF外壳内表面的10个粒子中,有5个粒子由O和Si组成,2个粒子由C、O和Ca组成,3个粒子由O、Mg和Si组成。
SiO2
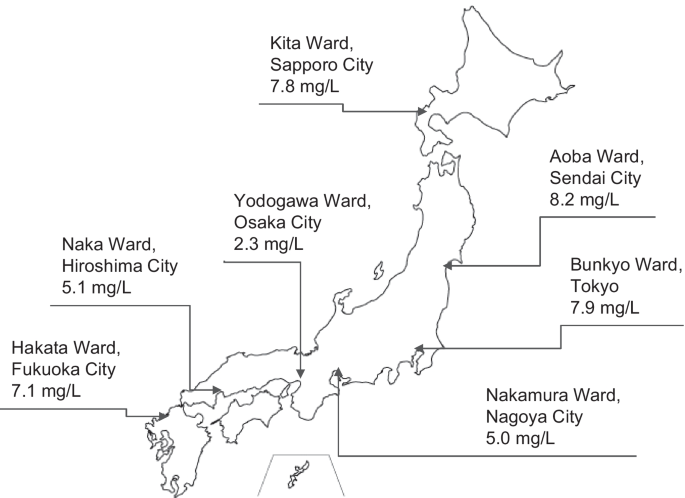
表格4显示SiO2用于CDDS的自来水、RO渗透液、透析水、商业无菌酸性和碳酸氢盐替代液以及5%葡萄糖溶液。SiO的定量下限2为0.1 mg/L。SiO2自来水中RO含量为5.8 ~ 7.7 mg/L, RO含量为0.4 ~ 0.7 mg/L。SiO2从替代液采样点收集透析水样,每月一次,直到使用最终ETRF 6个月后为止,为0.4-0.7 mg/L。商业无菌酸性替代液和碳酸氢盐替代液都含有SiO20.1 mg/L。SiO2在5%葡萄糖溶液中均低于定量下限。数字3.显示SiO2在日本各地采集的自来水样本中来自札幌、仙台、东京和福冈的自来水样品中SiO含量较高2而来自名古屋、大阪和广岛的自来水样本中SiO的含量往往较低2.
讨论
最终ETRF中不溶性颗粒物的形成机理
在在线制备的替代液样品中,从使用3个月后的最终ETRF中采集的在线制备的替代液样品检测到的颗粒数量最多。从使用3个月的最终ETRF中提取在线制备的替代液,每1ml检测到直径为5µm或更大的1.7个颗粒。用于危重病人输液治疗的一次性过滤器,可有效防止微粒进入体内,减少全身炎症反应综合征(SIRS)的发生率[12].然而,制备超纯透析液的etrf在许多国家被重复使用[13].
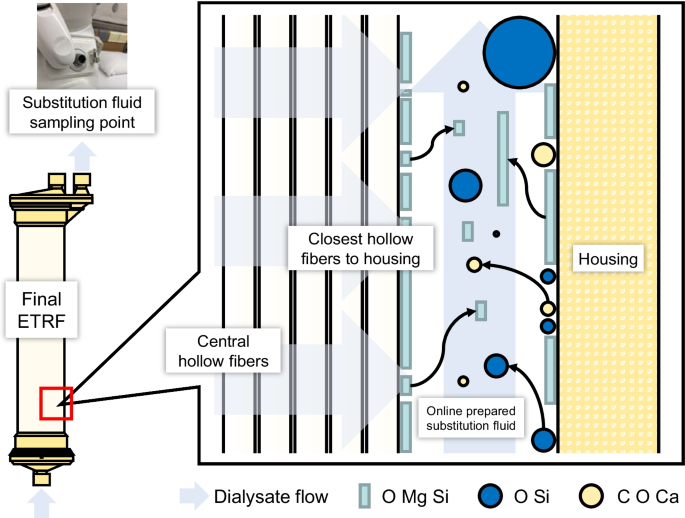
数字4显示了不溶性颗粒物质粘附在最终ETRF上并排放到在线制备的替代流体的示意图。在最终的ETRF中,从中空纤维内部向外部进行过滤。在最终的ETRF中,中心纤维表面未观察到颗粒。在冲洗、过氧乙酸清洗和消毒过程中,来自中央纤维的液体在最终ETRF冲洗、过氧乙酸清洗和消毒其他中央中空纤维的表面,并可能防止不溶性颗粒物质粘附在中央中空纤维的表面。此外,在最终ETRF的中心部分没有观察到颗粒,因为即使形成了不溶性颗粒物质,它们在每个过程中从中心流向外壳。
在离最终ETRF外壳最近的空心纤维表面检测到由O、Mg和Si组成的粒子。在离子Mg, SiO存在的情况下2即使在低SiO条件下也会以含镁硅酸盐(镁硅酸盐)的形式析出2浓度(14].表格4表明SiO2透析水中的SiO含量是市售无菌酸性或碳酸氢盐替代液的4-7倍,而SiO含量为89-93%2自来水由水处理设备除去。SiO2在5%葡萄糖溶液中均低于定量下限。这些结果表明,在线制备的替代液中容易形成硅酸镁。此外,只有不溶性硅酸镁[15]被连接到最接近最终ETRF外壳的中空纤维上,因为这些中空纤维从外壳一侧进行的有效冲洗、过氧乙酸清洗和消毒与最终ETRF的中心部分相比较低。
在最终ETRF外壳的内表面检测到由O和Si、C、O和Ca或O、Mg和Si组成的粒子。由O和Si组成的粒子可能是无定形的SiO2,是由SiO的独立沉淀形成的2在水中[15].由C、O和Ca组成的粒子可能是CaCO3.因为形成了含钙的碳酸盐(CaCO3.)取代了含钙硅酸盐的形成[16].在离最终ETRF外壳最近的中空纤维表面只检测到硅酸镁,这表明与最终ETRF的中心部分相比,外壳的内表面遭受的冲洗、过氧乙酸清洗和消毒效果较差,因此容易形成颗粒。此外,有可能在冲洗、过氧乙酸清洗和消毒过程中,在离最终ETRF外壳最近的中央纤维或中空纤维表面形成的不溶性颗粒物质被排出并附着在外壳的内表面。
在线制备的置换液采集处的置换液采样点与最终ETRF直接相连;因此,CaCO颗粒的进入3.,非晶态SiO2而硅酸镁进入在线HDF患者体内是不可避免的,只要在线制备的替代液是使用重复使用的ETRF制备的。
商用无菌替代液和5%葡萄糖注射液中的颗粒,在线制备的替代液中的含硅颗粒
在商用灭菌替代液中检测到的颗粒数量最多。考虑到商业消毒替代液中碳酸氢钠的电离度相对较低(36℃时为0.88),碳酸氢钠可能是一种不溶性盐[17].在商用无菌替代液和5%葡萄糖溶液中只检测到完全由C和O组成的颗粒。数据如图所示。1表明未完全溶解的葡萄糖通过膜过滤器收集,并用SEM-EDS测量。因此,商业无菌替代液和5%葡萄糖溶液中的颗粒被认为来自葡萄糖。因为人肺毛细血管的平均直径为5µm [18],直径大于5 μ m的颗粒可阻碍肺毛细血管的血液流动,并有引起肺栓塞等并发症的风险[8].然而,葡萄糖是可溶性的,不能阻碍肺毛细血管中的血液流动。
在使用了3个月的最终ETRF(中空纤维和外壳)和从使用了3个月的最终ETRF中取样的在线制备的替代液中检测到的30个颗粒中,含硅颗粒占83%。商用无菌替代液和5%葡萄糖溶液中未检出Si颗粒。商业无菌酸性替代液和碳酸氢盐替代液都含有SiO20.1 mg/L。SiO2在5%葡萄糖溶液中均低于定量下限。关于硅和硅的信息2没有包含在商业无菌替代液和5%葡萄糖溶液包装说明书或医学访谈表中。因此,我们推测在线制备的替代液中不溶性颗粒为透析液中析出的Ca和Mg和透析水中析出的Si。
SiO的协调波动2渗析水及自来水样本的含量4表明SiO的变化2是影响SiO含量的一个因素2透析水的水平。数字3.显示了SiO的巨大变异性2在自来水中,这取决于地理区域。在日本,自来水的来源包括河水和地下水[19].在火山多的地区,如北海道和关东地区,已知水中含有高浓度的SiO2[20.].此外,中部地区的河水中SiO含量较低2, Chugoku地区SiO含量较低2九州地区含有最高水平的SiO2[21].SiO2大阪市自来水样本中汞含量最低;这大概是由于沉淀物的清除和琵琶湖的春季硅藻繁盛,琵琶湖是流经大阪市的约都河的源头[19,22].如表所示4, etrf不能去除SiO2从透析水和水处理设备中去除89-93%的SiO2从自来水中去除,平均去除率为91%。表格5显示SiO2用假设的SiO来估计透析水中的含量2日本各地区自来水的去除率达91%。最低SiO2在日本不同地理区域的自来水中,假设去除率为91%的透析水的水平为0.2 mg/L,是SiO的两倍2在商业消毒替代液中有了网上的HDF,就需要与制药公司生产的注射剂具有相同(甚至更高)的质量[23因为在线注射HDF的注射量比正常注射要大得多。如果目标SiO2在透析用水设置为≤0.1 mg/L时,可采用水处理设备降低SiO2,以及额外的SiO有效去除2可通过将水处理设备与电去电离(EDI)纯水生产系统相结合而实现[24].
这一研究还不够,患者的健康与含si颗粒之间的关系还需要通过使用患者样本等体内研究来深入考虑。通过饮食摄入的硅会随尿液排出体外,但在肾衰竭患者中,硅不会随尿液排出体外,并被认为会积累[25,26].因此,血液透析患者血清Si浓度(64±12 μg/dl)高于健康人群(< 20 μg/dl) [27].特别是伴有骨病的血液透析患者的血清Si浓度(76±18 μg/dl)和伴有神经系统疾病的血液透析患者的血清Si浓度(86±15 μg/dl)明显高于无并发症的血液透析患者(64±12 μg/dl),提示血液透析患者血清Si浓度过高是引起骨病和神经系统疾病的原因之一[27].用于分析等离子体Si浓度的原子光谱法评价元素[28].这种分析方法可以评价Si的鉴定和浓度,但不能区分Si的形态。需要考虑水中Si的多种形式,包括可溶性二氧化硅、离子二氧化硅、可溶性硅酸盐、胶体二氧化硅、硅酸盐、含Si的无机和有机物质以及含Si的生物材料[29,30.,31].除去这些含硅物质还需要根据Si的形式考虑除去方法,例如,如果Si是离子形式,则用离子交换树脂除去;如果Si是胶体形式,则用反渗透膜等膜装置除去[32].此外,当二氧化硅不是通过食物或饮料摄入(例如通过吸入或静脉注射)进入人体时,它总是表现出某种毒性[33].基于这些文献发现,需要综合考虑Si对血液透析患者的影响,包括血清Si浓度、进入血液透析患者体内的Si的形式以及进入血液透析患者体内的二氧化硅的吸收途径。根据目前的研究结果,在线制备的替代液中存在硅酸盐镁(由镁和硅组成的颗粒),可能是血栓形成的触发器[34].SiO2市售无菌替代液和5%葡萄糖溶液中Ca、mg、Si含量≤0.1 mg/L,市售无菌替代液和5%葡萄糖溶液中Ca、mg、Si颗粒未检出。因此,即使两个etrf串联在一起,对于在线制备的替代液也应格外小心,因为它含有CaCO的不溶性颗粒物质3.,非晶态SiO2和硅酸镁。
结论
我们利用SEM/EDS对在线制备的从过氧乙酸清洗的CDDS中获得的替代液中的颗粒和附着在最终ETRF(空心纤维和外壳)上的颗粒进行了评估。我们还测量了SiO2从日本各地收集的自来水、商业消毒替代液和5%葡萄糖溶液中所含的维生素d。在线制备的替代液中颗粒和附着在最终ETRF上的颗粒的测量结果表明,在线制备的替代液和最终ETRF中检测到的30个颗粒中,含硅颗粒占83%。SiO2在生产透析水的自来水中,不同的地理区域收集的样本有所不同。商用无菌替代液中含有SiO20.1 mg/L。SiO2在5%葡萄糖溶液中均低于定量下限。
关于硅和硅的信息2在粉状透析浓缩液包装说明书或药物面谈表中不包括。因此,我们推测在线制备的替代液中不溶性颗粒物质为透析液中析出的Ca和Mg以及透析水中析出的Si。此外,SiO的变化2是影响SiO含量的一个因素2透析水的水平。如果考虑在线制备的取代液中硅酸盐的形成和目标SiO2在透析水中应设置≤0.1 mg/L, SiO2在确定透析液制备仪器的规格之前,应了解医院和透析中心提供的自来水。
数据和材料的可用性
本研究中使用和/或分析的数据集可根据合理要求从通讯作者处获得。
缩写
- 答:
-
酸
- B:
-
碳酸氢
- 摩根大通:
-
日本药典
- JSDT:
-
日本透析治疗学会
- 如果:
-
硅
- HDF:
-
过
- ETRF:
-
Endotoxin-retentive过滤器
- cdd:
-
中央透析液输送系统
- 扫描电镜:
-
扫描电子显微镜
- EDS:
-
能量色散x射线光谱法
- SiO2:
-
硅
- 罗依:
-
反渗透
- ICP-OES:
-
电感耦合等离子体发射光谱
- O:
-
氧气
- C:
-
碳
- Ca:
-
钙
- Mg:
-
镁
- 先生们:
-
全身炎症反应综合征
- 艾迪:
-
去电离子
参考文献
佐久间K,内umi N,佐藤S, Aida N,石松T, Igoshi T,等。热柠檬酸消毒法在中心透析液输送系统中的应用体会。中华器官杂志2010;3:145-50。
《日本药典》第17版。日本:厚生劳动省;2016.
Mineshima M, Kawanishi H, Ase T, Kawasaki T, Tomo T, Nakamoto H,等。2016年更新日本透析治疗学会血液透析及相关治疗用液体标准。Ren Replace Ther. 2018;4:15。
Wada S, Maruyama T, Wakikawa T, Yamada A, Sasaki S用于透析液的激光粒子监测器。jpj clinin Dial (Rinsho Toseki)2002; 18:1333-7 (在日本).
谷口M,中井S,土田K,和田A,绪方S,等。2016年度透析数据报告,JSDT肾脏数据登记。Ren Replace Ther. 2018;4:45。
定义透析液的微生物质量。Artif器官1999;23:37-43。
Kawanishi H, Moriishi M, Takahashi N, Tsuchiya S.中央透析液输送系统(CDDS):是日本的特色吗?Ren Replace Ther。2016;2:1。
美国肠外和肠内营养学会。安全实践家长Nutr JPEN。2004; 28: s39 - 70。
Matsumoto T, Okabayash K, Yamakawa T.粉状透析液和硅(Si)。jpj clinin Dial (Rinsho Toseki)2004; 20:1195-7 (在日本).
日本医药和医疗器械监管科学学会:2016年日本药典技术信息。东京:JIHO;2016:243 - 259 (在日本).
日本水工程协会:水检验标准方法II -3-28。东京:高久里印刷株式会社;2011:210 - 215 (在日本).
李文华,李文华,李文华,等。在儿科心脏重症监护患者中,在线滤过可减少全身炎症反应综合征、肾和血液学功能障碍。儿科心血管杂志2015;36:1270-8。
江西浩,江西浩,明岛明,武本勇,内野俊,星野俊,等。日本透析治疗学会:2011年JSDT透析及相关治疗内毒素保留过滤器管理标准。Ther Apher Dial. 2013; 17:229-40。
日本腐蚀工程学会:腐蚀手册。东京:Maruzen Publishing;2000: 159-160 (在日本).
伊藤,Sekido K, Kawade M.硅酸镁水垢在冷却水系统中的沉积特性。废水(Yosui到Haisui)。2016; 58:677 - 84 (在日本).
评价设施耐腐蚀性的水质指数。日本水污染决议1987;10:97-101 (在日本).
Guyton AC, Hall JE。医学生理学课本。费城:W.B. Sauders公司;2000.456 - 7页。
库诺T. AFBF。jpj clinin Dial (Rinsho Toseki)2017;33:540 - 541 (在日本).
王晓燕,王晓燕,王晓燕。天然水体的化学研究。Nogaku kenkyu。1982; 59:171 - 88 (在日本).
日本腐蚀工程学会:腐蚀手册。东京:Maruzen出版社;2000:648 (在日本).
日本河流水的平均水质和特征的化学研究。能乐健休。1961;48:63-103 (在日本).
西田S,稻大N,津田K,中谷y。育都河下游人工系统中溶解硅酸盐的运移。日本社会文明工程B1及水文工程。2015;71:1207-12 (在日本).
Minakuchi J.人工肾脏的研究进展。日本医学杂志2017;73:199-206 (在日本).
Ase T, Watabe T, Sato T。使用电去离子法提高血液透析用水的生产。科学通报2017;52:32 - 43。
Berlyne G, Dudek E, Adler AJ, Seidmon M.硅代谢;肾衰竭的基本事实。《肾脏杂志》1985;28(增刊17):175-7。
阿德勒AJ,伯林MG。硅代谢:慢性肾衰竭患者的肾脏处理。肾元。1986;44:36-9。
细川,谷口,吉田,等。微量元素异常与慢性血液透析的关系。J jpsoc Dial Ther. 1990; 23:371-5 (在日本).
分析化学的原理与实践。牛津大学:布莱克威尔科学学院;2000.p . 284 - 353。
广岛市公共卫生研究所:广岛市公共卫生研究所年度报告。广岛:广岛市;2000;28: 94-95 (在日本).
岩崎I,桂田T,檀谷T,所谓天然水中二氧化硅含量。布尔化学学报1951;24:27 - 30。
王晓燕,王晓燕,王晓燕。阴离子交换树脂去除水中胶体二氧化硅的研究。给水工程学会1994;4:176-82。
石井宁。仪器分析用超纯水优化净化技术。Bunseki Kagaku(日本分析师)2011; 60:103-13 (在日本).
二氧化硅的化学:溶解度,聚合,胶体和表面性质,以及生物化学。纽约:威利;1979.172 - 8页。
临床外植腔静脉滤器的检索分析。中国生物医学杂志,2006;27(3):347 - 347。
确认
在此,我们衷心感谢Eiichi Nishikawa博士在数据收集方面的合作。
资金
没有收到任何资金。
作者信息
作者和隶属关系
贡献
MI和KT设计了这项研究。MI和MY对数据收集做出了贡献。MI进行了分析。MI和AY撰写了初稿。所有作者审阅并批准了最终稿。
相应的作者
道德声明
伦理批准和同意参与
不适用。
发表同意书
不适用。
相互竞争的利益
作者声明他们没有竞争利益。
额外的信息
出版商的注意
伟德体育在线施普林格自然对出版的地图和机构附属的管辖权要求保持中立。
权利与权限
开放获取本文遵循创作共用署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),该协议允许在任何媒体或格式中使用、分享、改编、分发和复制,只要您给予原作者和来源适当的署名,提供创作共用许可协议的链接,并说明是否有更改。本文中的图片或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果材料不包含在文章的创作共用许可中,并且您的预期用途不被法律法规允许或超出了允许的用途,您将需要直接从版权所有者那里获得许可。欲查看此许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献放弃书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信用额度中另有说明。
关于本文
引用本文
今井,男,山本,男,多哥,K。et al。透析液中形成的微粒:自来水中二氧化硅的影响。Ren替换Ther8, 44(2022)。https://doi.org/10.1186/s41100-022-00433-4
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s41100-022-00433-4
关键字
- 透析液
- 粒子
- 硅
- 不溶性颗粒物质
- 在线配制替代液
- 在线过