摘要
背景
糖尿病透析患者的数量目前在日本和世界范围内都在增加。这提示大约20%的患者在透析后出现低血糖,这些低血糖大多数是无意识的。此外,有人认为血液透析引起的血糖变化可能与胰岛素和胰岛素对抗激素有关,如胰高血糖素、促肾上腺皮质激素(ACTH)、皮质醇和生长激素等,但尚未得到确凿的证据。
方法
我们详细调查了7例2型糖尿病患者血液透析时的血糖和激素情况(均为男性,HbA1c 6.8±2.1%,糖化白蛋白24.7±10.2%)。所有受试者均接受持续血糖监测(iPro2®)。采用透析日早餐前、早餐后(透析前)、透析开始后2 h、4 h、透析日午餐后、晚餐前后和非透析日餐前餐后6点血检,测定血糖水平、c肽免疫反应性、血浆胰高血糖素、ACTH、皮质醇、生长激素水平,并分析其与血糖动态的关系。膳食内容设置为指定的能量量,在研究期间的透析和非透析日,每天的早餐、午餐和晚餐都提供相同的菜单。另外,非透析日午餐开始时间与透析日午餐开始时间相同。
结果
血清c肽水平在血液透析日吃早餐和午餐后显著升高,在血液透析期间显著降低,血液透析日午餐前后显著低于非血液透析日。血液透析期间血浆胰高血糖素水平显著降低,血液透析日午餐前血浆胰高血糖素水平显著低于非血液透析日。ACTH、皮质醇和生长激素未表现出与血液透析相关的变化。
结论
提示c肽和胰高血糖素在2型糖尿病血液透析患者血液透析相关血糖变化中起重要作用。
试验注册UMIN临床试验注册中心(注册编号UMIN000018707).2015年8月18日注册https://center6.umin.ac.jp/cgi-open-bin/ctr/ctr.cgi?function=brows&action=brows&type=summary&language=J&recptno=R000021647.
背景
慢性肾病和2型糖尿病是长期的疾病,不仅在日本,而且在全世界都被认为是主要的公共卫生问题。此外,糖尿病目前是终末期肾病(ESKD)的主要原因,占日本新透析病例的40%以上,在世界范围内也有类似比例。另一方面,血液透析(HD)的医疗手段、干预手段和设备的进步延长了慢性HD患者的平均年龄,偶尔也会看到原发性肾病不是糖尿病肾病的HD患者在开始HD后也会出现新的糖代谢异常。伴有ESKD的糖尿病患者死亡率低于无并发症的糖尿病患者[1].尽管之前的研究表明严格的血糖控制可以提高伴有ESKD的糖尿病患者的生存时间[2,3.],然而,由于严格的血糖控制也有发生大血管病变和致死性心律失常的风险,因此有必要在了解ESKD患者的血糖和激素动态的基础上控制血糖谱[4].心血管疾病和脑动脉疾病不仅在高血糖情况下有报道,而且餐后高血糖、血糖波动和低血糖也有助于动脉硬化疾病的发生/发展和死亡率[5,6,7,8].HbA1c与死亡率呈u型关系,提示低血糖可能是HbA1c < 6.5%人群死亡率较高的原因之一[9,10,11,12].因此,在接受HD的糖尿病患者中,仅仅降低平均血糖是不够的,这表明必须根据个人的血糖动态来控制血糖,包括减少血糖波动和避免低血糖。我们报道了采用连续血糖监测(CGM)对日本糖尿病患者进行HD的血糖谱,作为血糖动力学的一个特征,HD后的低血糖约为20%,且所有低血糖均为无意识状态,他们的血糖水平由于HD后的饮食摄入而急剧上升。此外,我们报道了HbA1c和糖化白蛋白(GA)分别是2型糖尿病患者平均血糖水平和血糖变率的可靠指标[13].然而,利用这些血糖指标,很难检测HD后是否存在低血糖以及之后的血糖漂移。换句话说,影响HD糖尿病患者特定血糖谱的因素尚不清楚。既往研究认为HD后血糖升高可能与胰岛素分泌和胰高血糖素、皮质醇等抗胰岛素激素的减少有关,但仍未获得确凿证据[14,15].
基于这些原因,本研究的目的是准确地确定糖尿病患者在使用CGM时的血糖水平,并确定内分泌激素水平,如胰岛素、葡聚糖和其他胰岛素对抗激素,这有助于血糖水平。
方法
研究设计与患者
本研究在UMIN临床试验注册中心注册(注册号为UMIN000018707),该研究方案由北中大学医学院伦理委员会(B14-72)批准,并获得所有参与者的知情同意。所有的研究方法都是根据北中大学医院的相关指南和规定进行的日本人体医学和健康研究伦理准则并根据《赫尔辛基宣言》的道德准则。我们在糖尿病和正常糖耐量的参与者中,基于新方法测量的胰高血糖素的研究数据进行了功率分析[16].由于这种功率分析不适用于其他血糖调节激素,我们回顾了以往血糖调节肽或胃肠道激素的研究,粗略估计了样本量[16,17,18,19,并使用CGM [20.,21]。最后,在前期研究的基础上,确定最小样本量为7-10例。然而,由于HD住院患者数量较少,且本研究使用的CGM用品和服务终止,在招募8例病例,并因数据不足排除1例时,本研究终止。参与者是入住北中大学医院的2型糖尿病患者,每周接受3次4小时的HD治疗。2型糖尿病由美国糖尿病协会标准定义。参与者被证实没有以下任何排除标准:任何传染性疾病,任何影响血红蛋白和白蛋白代谢/周转的伴随疾病,如恶性肿瘤、肝硬化、血液病、甲状腺功能障碍和怀孕。所有HD患者入院后每周接受三次透析。所有参与者同意使用美敦力iPro2®CGM (Medtronic Minimed, Northridge, CA, USA)和ENLiTE传感器®(Medtronic Minimed, Northridge, CA, USA)进行至少72小时CGM。使用Medisafe FIT®(Terumo Corporation, Tokyo, Japan)自我监测毛细血管血糖,准确度要求满足ISO 15197,每天至少进行4次,并使用这些值校准CGM数据。在透析条件稳定后,通过间歇血糖测量临床判断血糖控制稳定后,贴附CGM,并于HD日前一天上午贴附CGM,约72 h后解吸。根据既往研究,低血糖定义为低于CGM传感器血糖水平(SGL) 63 mg/dL (3.5 mmol/L) [22,23]和一次有效的低血糖发作,即SGL低于阈值超过20分钟[24].膳食内容设定为指示的能量量(30-35千卡/理想体重(kg)/天)。因为我们避免了第二餐效应25],在研究期间的高清和非高清天,每天提供相同的早餐、午餐和晚餐菜单。另外,非高清日的午餐开始时间与高清日的午餐开始时间相同。家族史、病史、吸烟史、体质史、其他血检结果和临床结果通过访谈或病历提取。
生化测量
采用早餐前、早餐后(透析前)、开始HD后2 h、开始HD后4 h (HD结束和午餐前)、HD日午餐后和晚餐前后以及非HD日餐前餐后6点血检,测定血糖水平、c肽免疫反应性(CPR)、血浆胰高血糖素、促肾上腺皮质激素(ACTH)、皮质醇、生长激素(GH),并探讨其与血糖动态的关系。在血管通路的对侧上肢放置采血导管,提前进行血液检测。CPR测定采用化学发光酶免疫法(CLEIA) (Presto II, FUJIREBIO INC, Tokyo, Japan)。采用胰高血糖素酶联免疫吸附试验(ELISA)试剂盒(Mercodia AB, Uppsala,瑞典)检测血浆胰高血糖素。ACTH和皮质醇采用eclusys ACTH电化学发光免疫分析法(ECLIA)方法(Roche Diagnostics K.K, Tokyo, Japan)和eclusys皮质醇II ECLIA方法(Roche Diagnostics K.K, Tokyo, Japan)和Cobas8000 (Roche Diagnostics K.K, Tokyo, Japan)测定。GH采用ECLIA方法(Roche Diagnostics k.k., Tokyo, Japan)和Cobas8000 (Roche Diagnostics k.k., Tokyo, Japan)测定。采用自动化系统Lucica™糖化白蛋白- l检测试剂盒(日本朝日Kasei制药,检测内总分析误差[TAE] < 0.51)进行酶合成测定GA。
统计分析
使用GraphPad Prism 5.02软件(GraphPad software Inc., San Diego, CA, USA)和JMP ver进行统计分析。14 (SAS研究所,卡里,北卡罗来纳州,美国)。除非另有说明,数据以平均值±标准差(SD)或中位数(最小值-最大值)表示。用Wilcoxon符号秩检验评价两组间顺序资料的差异。p< 0.05为差异有统计学意义。
结果
参与者的人口统计学和临床数据
参与者的人口统计情况见表1.所有参与者都是男性。平均年龄62±13岁,干重69.6±17.8 kg,糖尿病病程23±10年,HD 1.0(0.5-30.0)个月,HbA1c 6.8±2.1%,GA 24.7±10.2%。5例患者接受胰岛素治疗,同时或不服用口服降糖药。3例患者使用二肽基肽酶-4 (DPP-4)抑制剂(2例利奈格列汀和1例teneligliptin), 1例患者使用胰高血糖素样肽-1 (GLP-1)类似物(杜拉格鲁肽)。所有参与者的透析模式均为HD。2名患者透析液葡萄糖浓度为150 mg/dL, 5名患者为125 mg/dL。血液流量5为200 mL/min, 1为230 mL/min, 1为250 mL/min,透析液流量6为400 mL/min, 1为500 mL/min,透析膜面积1.8 m22、1.9米21、2.1米2在4个参与者。
48 h CGM数据(包括HD日和非HD日)的平均传感器葡萄糖水平(SGL)和SGL的SD分别为156.1±28.6 mg/dL和41.9±11.2 mg/dL。高清日平均SGL和SD分别为153.8±27.1 mg/dL和35.5±13.4 mg/dL,非高清日平均SGL和SD分别为158.4±32.7 mg/dL和48.2±20.8 mg/dL。其中2例患者在48 h的CGM数据中出现低血糖发作,只有1例患者在HD结束至下一次饮食摄入期间出现低血糖发作(SGL < 40 mg/dL)。
高血糖日和非高血糖日的血糖和各种激素水平
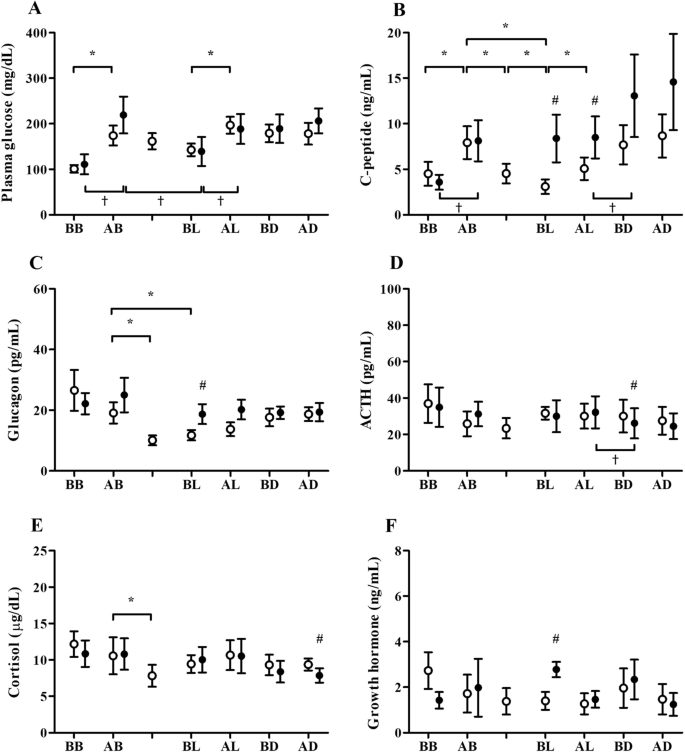
图中显示了每个高清日和非高清日的血糖剖面和各种激素剖面。1.在比较HD日的血糖时,我们观察到早餐时餐后血糖漂移(从100.9±8.5到173.9±21.8 mg/dL[平均±SE],p= 0.0223)和午餐(从142.4±13.7 mg / dL 196.7±18.5 mg / dL(均值±SE),p= 0.0156)而不是晚餐时(179.0±19.6 ~ 178.0±23.9 mg/dL[平均±SE])。在HD时间内血糖水平无明显变化,但有降低的趋势。非hd日,早餐后血糖水平显著高于早餐前(219.1±40.5 mg/dL, 110.9±22.0 mg/dL[平均值±SE],p= 0.0313),午餐前血糖水平显著低于早餐后和午餐后(p= 0.0313,p= 0.0313)。此外,在高清日与非高清日的比较中,各时间点的差异均不显著(图5)。1A).在比较CPR水平时,吃早餐后餐后CPR水平增加(从4.50±1.31 ng/mL增加到7.92±1.80 ng/dL[平均值±SE],p午饭= 0.0156)和(3.09±0.80,5.07±1.24 ng / mL(均值±SE),p= 0.0156)而不是通过吃晚餐(7.68±2.16 ~ 8.67±2.38 ng/dL[平均值±SE])。在HD期间,开始HD后2小时和4小时的CPR水平显著低于透析前(从7.92±1.80 ng/mL到4.53±1.09 ng/dL[平均±SE],p= 0.0156,至3.09±0.80 ng/dL[平均值±SE],p= 0.0156),心肺复苏水平在开始HD后4小时显著低于开始HD后2小时(p= 0.0156)。在非hd日,早餐前至早餐后血清CPR水平显著升高(从3.47±0.81到8.03±2.26 ng/dL[平均±SE],p= 0.0313),从午餐后到晚餐前(8.39±2.31 ~ 12.97±4.54 ng/dL[平均±SE],p= 0.0313)。高清日与非高清日比较,高清日午餐前后心肺复苏水平显著低于非高清日(p= 0.0156,p= 0.0156)(图1B).在血浆胰高血糖素图谱中,透析当天,开始透析后2小时和4小时的血浆胰高血糖素水平显著低于透析前(从19.09±3.53 pg/mL到10.06±1.61 pg/dL[平均±SE],p= 0.0313,至11.71±1.71 pg/dL[平均值±SE],p= 0.0469),但在开始HD后2 h和4 h之间无差异。此外,每顿饭前后没有差异。1C). HD日午餐前血浆胰高血糖素水平显著低于非HD日(11.71±1.71 pg/dL vs 18.33±3.27 pg/dL,p= 0.0223)(图1C).促肾上腺皮质激素、皮质醇和生长激素的分布如图所示。1D, E,分别。晚餐前ACTH水平低于午餐后(p= 0.0469)。高清日晚餐前ACTH水平高于非高清日(p= 0.0469)。透析开始后2小时的皮质醇水平明显低于透析前(p= 0.0469)。高清日晚餐后ACTH水平高于非高清日晚餐后(p= 0.0156)。高清日午餐前生长激素水平低于非高清日午餐前(p= 0.0469)。
讨论
这是第一个新构建的、目前最精确的血浆胰高血糖素测定系统被用于阐明影响HD患者血糖动力学的激素谱,并通过CGM详细的血糖监测阐明HD相关低血糖与激素动力学之间的关系。在这项研究中,我们评估了2型糖尿病患者中与血糖动态有关的内分泌激素特征。尽管世界范围内患有HD的糖尿病患者的数量有所增加,但他们中与HD相关的血糖变异性和激素状况仍未得到重视。目前的研究表明,hd相关的血糖紊乱不依赖于ACTH、皮质醇和GH,而是依赖于内源性胰岛素和胰高血糖素。
既往研究表明hd相关低血糖是由无糖透析液引起的[26,27].含有100 - 150mg /dL葡萄糖的透析液葡萄糖被认为可以预防透析内低血糖[28].理论上,HD期间的血糖水平是由血液侧和透析液侧的浓度梯度确定的,且绝不低于透析液中添加的葡萄糖浓度。但在临床情况下,空腹期间及空腹后血糖水平低于透析液血糖水平,部分患者主诉有低血糖症状。我们之前对糖尿病患者进行HD的研究显示,约20%的患者在HD后出现低血糖,且均无症状[29,30.].这种hd相关性低血糖的原因曾提示胰岛素分泌反应异常,胰高血糖素、ACTH、皮质醇等胰岛素对抗激素反应紊乱,但尚无充分证据。此外,直到最近,还很难构建一个准确的测量系统,特别是血浆胰高血糖素的测量,很难确定血浆胰高血糖素是如何真正影响HD糖尿病患者的血糖谱的。
在HD期间,CPR水平和精确测量的血浆胰高血糖素水平下降,但ACTH、皮质醇和生长激素水平没有变化。正如之前的一些研究所显示的[31,32,33],血浆胰高血糖素水平相对于血糖和内源性胰岛素浓度的变化没有相互升高,可能提示反馈系统失效,与血浆胰高血糖素等胰岛素对抗激素的慢性低责任有关。在这些患者的血糖谱中,在非hd日没有显著的每日血糖变化,但在早餐前后和午餐前后有显著的血糖漂移(图1)。1A).此外,正如之前的研究报告所述[29],从HD前到中期和HD后,HD期间的血糖水平逐渐下降,但本研究中无显著差异。HD日反映胰岛素动力学的血清CPR从早餐前到早餐后显著升高,从HD前期到中期和从HD中期到后期显著降低,在HD前后显著降低(图1)。1B).这种c肽动力学表明胰岛素和c肽被HD去除,内源性胰岛素分泌减少,负反馈,由于上述的HD期间的低血糖。可以通过胰高血糖素负荷测试和测量透析液中的CPR来区分[34].然而,胰高血糖素动力学从HD前期到中期呈下降趋势,在HD前后显著下降。这是因为,如前所述,在HD过程中血糖趋于下降的情况下,并不是内源性胰高血糖素分泌的抑制,而是透析膜对血浆胰高血糖素的去除。在HD日血浆胰高血糖素的日变化中(图。1C),在HD期间显著降低。此外,与非高清日相比,午餐前血浆胰高血糖素浓度,在高清日这个点在高清日之后,在高清日显著低于非高清日。然而,在HD和非HD日之间,ACTH、皮质醇和生长激素水平没有与HD相关的波动,也没有明显的差异。因此,提示胰岛素/CPR和胰高血糖素的动态变化诱导了hd相关性低血糖的发生。即HD时血糖水平有下降的趋势,HD时胰岛素和CPR被去除并降低,内源性胰岛素分泌也被抑制。另一方面,有人认为在HD期间血浆胰高血糖素也被去除并下降,但在HD结束后呈低值,血浆胰高血糖素对低血糖反应不佳,在某些情况下导致血糖进一步下降。虽然HD后通过饮食摄入分泌胰岛素,但也分泌胰高血糖素,这被认为是HD后饮食摄入导致葡萄糖漂移的原因。另一方面,有报道称,HD的糖尿病患者由于透析后的食物摄入,容易发生血糖漂移,即HD相关的高血糖,HD相关的高血糖可能与HD诱导的低血糖反应中胰高血糖素水平升高有关[35].在本研究中未发现hd相关的高血糖,但这可能是因为患者接受了肠促胰岛素调节剂治疗。病例数有所减少,但根据是否使用肠促胰岛素调节剂将两组患者分为两组(N= 4)或不(N= 3),肠泌素调节剂治疗组空腹前后血糖下降较小,为14.0±23.8 mg/dL[平均±SE],而未接受肠泌素调节剂治疗组为54.7±27.5 mg/dL[平均±SE],空腹后餐间血糖漂移较小(52.3±40.3 mg/dL[平均±SE] vs 57.0±15.1 mg/dL[平均±SE])。此外,心肺复苏术,餐后胰高血糖素高清的变化分别为8.84±2.53 ng / mL(均值±SE)和0.73±1.99 pg / mL(均值±SE),分别在肠促胰岛素治疗组调节器和6.69±2.92 ng / mL(均值±SE)和3.77±2.29 pg / mL(均值±SE),分别组中没有肠促胰岛素调节器,建议由高清后食物摄取可能会刺激胰岛素分泌,胰高血糖素分泌可能抑制肠促胰岛素治疗组调节器。
在本研究中,7例患者中有1例经CGM观察到HD后出现低血糖。本例在HD后出现低血糖,HD结束时血糖水平为68 mg/dL,同时CGM测得SGL为42 mg/dL (HD时血糖最低为40 mg/dL,为测量下限)(图1)。2A).心肺复苏水平在HD期间逐渐降低,在HD后随着午餐摄入量的增加而增加,但心肺复苏水平的增加与血糖的增加程度相比并不充分(图1)。2B).胰高血糖素水平在HD期间也有所下降,HD后午餐后略有升高,并持续升高(图1)。2C).提示胰岛素/C肽和胰高血糖素的这种波动有助于HD相关的低血糖和HD后因饮食摄入而导致的血糖漂移。之前的几项研究表明,肠泌素调节剂,如DPP-4抑制剂和GLP-1类似物,可以改善HD相关的低血糖和发生HD的糖尿病患者的血糖变率[36,37,38].我们的结果可以证明,使用肠泌素调节剂干预胰高血糖素分泌反应的疗效可能会改善糖尿病HD患者的特异性血流动力学。
本研究的局限性是样本量小,部分患者处于HD的引入期。正如之前的研究表明的那样[39],葡萄糖耐量和胰岛素敏感性在透析诱导组和慢性HD组之间可能存在差异。此外,这是一项观察性研究,使用单变量分析,没有调整混杂因素,可能会限制推广性。此外,由于本研究包括透析时间较短且有残余肾功能的参与者,且有报道称血浆CPR被HD清除[40],他们的血浆CPR水平(以胰岛素分泌能力衡量)可能低于无尿患者。此外,我们在本研究中检测了c肽、胰高血糖素、ACTH、皮质醇和生长激素,但其他参与葡萄糖血流动力学的激素,如葡萄糖依赖性胰岛素性多肽(GIP)和胰高血糖素样肽-1 (GLP-1),尚未被研究。进一步的调查包括更大的样本量,包括GIP和GLP-1,以确定肠促胰岛素调节剂对患有HD的2型糖尿病患者的总体有效性。
结论
在有HD的2型糖尿病患者中,提示ACTH、皮质醇和GH不参与HD相关的血糖波动,包括HD相关的低血糖,但c肽和胰高血糖素参与。
数据和材料的可用性
本研究中使用和/或分析的数据集可根据合理要求从通讯作者处获得。
参考文献
de Jager DJ, Grootendorst DC, Jager KJ, van Dijk PC, Tomas LM, Ansell D, Collart F, Finne P, Heaf JG, de Meester J, Wetzels JF, Rosendaal FR, Dekker FW。开始透析患者的心血管和非心血管死亡率。《美国医学协会杂志》上。2009; 302:1782-9。
Morioka T, Emoto M, Tabata T, Shoji T, Tahara H, Kishimoto H, Ishimura E, Nishizawa Y.血糖控制是糖尿病血液透析患者生存的预测因子。糖尿病护理。2001;24:909-13。
Villar E, Polkinghorne KR, Chang SH, Chadban SJ, McDonald SP. 2型糖尿病对终末期肾病相关死亡风险的影响。Diabetologia。2009;52:2536-41。
Desouza CV, Bolli GB, Fonseca v低血糖,糖尿病和心血管事件。糖尿病护理。2010;33:1389 - 94。
糖耐量和死亡率:WHO和美国糖尿病协会诊断标准的比较。DECODE研究小组。欧洲糖尿病流行病学小组。糖尿病流行病学:欧洲诊断标准的协作分析。《柳叶刀》杂志。1999;354:617-21。
Muggeo M, Zoppini G, Bonora E, Brun E, Bonadonna RC, Moghetti P, Verlato G.空腹血糖变化预测2型糖尿病患者10年生存率:维罗纳糖尿病研究。糖尿病护理。2000;23:45-50。
Zoungas S, Patel A, Chalmers J, de Galan BE, Li Q, Billot L, Woodward M, Ninomiya T, Neal B, MacMahon S, Grobbee de, Kengne AP, Marre M, Heller S严重低血糖与血管事件和死亡的风险。中华医学杂志2010;363:1410-8。
苏刚,米硕,李铮,陶浩,杨海霞,郑慧。老年急性心肌梗死患者院内早期血糖波动的预后价值。Cardiovasc Diabetol。2013;12:33。
糖化蛋白参数在晚期肾病中的关键评价:事关生死:糖化血红蛋白仍然是糖尿病透析患者预后的金标准预测指标。糖尿病护理。2012;35:1625-8。
Ramirez SP, McCullough KP, Thumma JR, Nelson RG, Morgenstern H, Gillespie BW, Inaba M, Jacobson SH, Vanholder R, Pisoni RL, Port FK, Robinson BM。糖尿病血液透析人群的血红蛋白A(1c)水平与死亡率:来自透析结果和实践模式研究(DOPPS)的发现糖尿病护理。2012;35:2527-32。
Ricks J, Molnar MZ, Kovesdy CP, Shah A, Nissenson AR, Williams M, Kalantar-Zadeh K.糖尿病血液透析患者血糖控制与心血管死亡率:一项6年队列研究。糖尿病。2012;61:708-15。
Shurraw S, Hemmelgarn B, Lin M, Majumdar SR, Klarenbach S, Manns B, Bello A, James M, Turin TC, Tonelli M.糖尿病和慢性肾脏疾病患者血糖控制与不良结局的相关性:一项基于人群的队列研究Arch实习医学2011;171:1920-7。
Hayashi A, Takano K, Masaki T, Yoshino S, Ogawa A, Shichiri M. HbA1c和糖化白蛋白在2型糖尿病血液透析患者中的独特生物标志物作用。《糖尿病并发症杂志》2016;30:1494-9。
安倍M,凯祖K,松本K。血液透析诱导糖尿病患者血糖和胰岛素浓度变化的评价:血液透析与非血液透析天数的比较。Ther Apher Dial. 2007;11:28 - 95。
血液透析去除血浆胰岛素:用含或不含葡萄糖的透析液评价血浆胰岛素与葡萄糖的关系。Ther Apher Dial. 2007; 11:280-7。
市川R,高野K,藤本K,元宫T,小林M,北村T,石尻M糖尿病前期和轻度2型糖尿病基础胰高血糖素高分泌及其对口服葡萄糖负荷的响应。Endocr j . 2019; 66:663 - 75。
Bailey T, Bode BW, Christiansen MP, Klaff LJ, Alva S.工厂校准闪光葡萄糖监测系统的性能和可用性。糖尿病科技杂志2015;17:787-94。
费尔南德斯-雷耶斯MJ,桑切斯R,加西亚L,格兰德C, Codoceo R, Heras M, Iglesias P, Velasco S, Molina A, Gutierrez C, Alvarez-Ude f胃肠道激素对口服和非肠内营养的急性反应。中华医学杂志。2010;32:272-8。
Jorgensen MB, Idorn T, Knop FK, Holst JJ, Hornum M, Feldt-Rasmussen B.非糖尿病终末期肾病患者血液透析和血液透析滤过过程中糖调节肽激素的清除Nephrol Dial Transpl. 2015; 30:513-20。
kazempour - ardemari S, Lecamwasam VL, Dassanyake T, Frankel AH, Tam FW, Dornhorst A, Frost G, Turner JJ。评估2型糖尿病维持性血液透析患者的血糖控制。糖尿病护理。2009;32:1137-42。
Riveline JP, Teynie J, Belmouaz S, Franc S, Dardari D, Bauwens M, Caudwell V, Ragot S, Bridoux F, Charpentier G, Marechaud R, Hadjadj S在2型糖尿病患者慢性血液透析中血糖控制:使用连续血糖监测系统。尼弗罗尔Dial Transpl. 2009; 24:2866-71。
吉尔GV,伍德沃德A,卡森IF,韦斯顿PJ。1型糖尿病患者的心律失常和夜间低血糖——“死在床上”综合征的回顾。Diabetologia。2009;52:42-5。
Chow E, Bernjak A, Williams S, Fawdry RA, Hibbert S, Freeman J, Sheridan PJ, Heller SR. 2型糖尿病患者低血糖时心律失常的风险和心血管风险。糖尿病。2014;63:1738-47。
英国低血糖研究小组。1型和2型糖尿病发生低血糖的风险:治疗方式的影响及其持续时间Diabetologia。2007;50:1140-7。
中村Y, Sanematsu K, Ohta R, Shirosaki S, Koyano K,野中K, Shigemura N, Ninomiya Y.人的甜味觉识别阈值的日变化与血浆瘦素水平相关。糖尿病。2008;57:2661-5。
MA Jackson, Holland MR, Nicholas J, Talbot M, Spencer H, Lodwick R, Fuhrmann C, Forster D, Macdonald IA。血液透析引起的隐性低血糖。Nephrol。1999;51:242-7。
MA Jackson, Holland MR, Nicholas J, Lodwick R, Forster D, Macdonald IA。糖尿病患者血液透析引起的低血糖。Nephrol。2000;54:30-4。
Burmeister JE, Scapini A, da Rosa MD, da Costa MG, Campos BM。添加葡萄糖的透析液可防止常规血液透析中无症状的低血糖。尼弗罗尔表盘Transpl. 2007; 22:1184-9。
Hayashi A, Moriya T, Ogawa A, Yoshino S, Kishihara E, Ogawa J, Yamagishi T, Shichiri M.通过持续血糖监测评估日本糖尿病患者血液透析的血糖谱。中华医学杂志,2012;55:681-7。
Hayashi A, Shimizu N, Suzuki A, Matoba K, Momozono A, Masaki T, Ogawa A, Moriguchi I, Takano K, Kobayashi N, Shichiri M.经持续血糖监测证实的血液透析相关血糖紊乱:血糖指标和低血糖。糖尿病护理。2021;44:1647-56。
终末期肾病:内分泌方面的治疗。生长激素IGF Res. 2003;13附录A: S94-101。
科科特F, Wiecek A, Grzeszczak W, Klepacka J, Klin M, Lao M。终末期肾衰竭患者内分泌异常。生物学杂志1989;260:61-7。
吕格,郎一,科瓦瑞克,史姆沃勒,邓波。慢性肾功能衰竭患者的下丘脑-垂体-肾上腺皮质轴异常。肾脏杂志1987;9:51-4。
Tuttle KR, Bakris GL, Bilous RW, Chiang JL, de Boer IH, Goldstein-Fuchs J, Hirsch IB, Kalantar-Zadeh K, Narva AS, Navaneethan SD, Neumiller JJ, Patel UD, Ratner RE, whley - connell AT, Molitch ME。糖尿病肾病:来自ADA共识会议的报告。糖尿病护理。2014;37:2864 - 83。
血液透析诱导的低血糖和血糖紊乱。2015; 11:302-13。
石川田中T,细岛M, Kabasawa H, Kaseda R,安川R,矢田Y, Kuwahara S,河野E,高田T,饭野N,田中T,北村N,铃木Y,斋藤A,成田I. DPP-4抑制剂对日本2型糖尿病维护性血液透析患者血糖变异性的影响:一项前瞻性观察性探索性研究。糖尿病其他。2020;11:2845。
索索伊T,斋藤M, Tamasawa A,石田H, Tsujino D,西村R,宇都宫K.血液透析对2型糖尿病终末期肾病患者血糖及利拉鲁肽水平影响的初步研究。PLoS ONE。2014; 9: e113468。
Yajima T, Yajima K, Hayashi M, Takahashi H, Yasuda K.通过持续的血糖监测评估2型糖尿病血液透析患者使用每周一次的杜拉鲁肽和胰岛素治疗改善血糖控制。中华糖尿病杂志2018;32:310-5。
Mak RH。终末期肾病和透析对血糖控制的影响。Semin拨号。2000;13:4-8。
糖尿病血液透析患者血浆胰岛素和c肽浓度:与五种高通量透析膜的比较。糖尿病临床杂志2008;82:e17-9。
确认
感谢北中大学附属医院营养科的注册营养师为我们提供特别餐食。
资金
本研究得到了日本透析医师协会(JADP grant No. 30014)和Terumo生命科学基金会(21-III5030)的部分资助。资助机构在研究设计、数据收集/分析、出版决定或稿件准备方面没有任何作用。
作者信息
作者和联系
贡献
AH和MS设计了这项研究。AH、KM、YO、NS、AS、SF、MS收集临床资料并采血。AH, KT和MS分析了数据并起草了手稿。所有作者都修改了论文,所有作者都批准了最终版本的手稿。
相应的作者
道德声明
伦理批准和同意参与
本研究在UMIN临床试验注册中心注册(注册号为UMIN000018707),该研究方案由北中大学医学院伦理委员会(B14-72)批准,并获得所有参与者的知情同意。所有的研究方法都是根据北中大学医院的相关指南和规定进行的日本人体医学和健康研究伦理准则并根据《赫尔辛基宣言》的道德准则。
同意出版
不适用。
相互竞争的利益
A.H.报告了来自美敦力、雅培、泰云、罗氏的发言人;从雅培和罗氏的研究资助以外提交的工作。国家安全局报道美敦力公司的霍诺丽亚发言人。作者没有报告与本文相关的其他潜在利益冲突。
额外的信息
出版商的注意
伟德体育在线施普林格自然对出版的地图和机构附属的管辖权要求保持中立。
权利和权限
开放获取本文遵循创作共用署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),该协议允许在任何媒体或格式中使用、分享、改编、分发和复制,只要您给予原作者和来源适当的署名,提供创作共用许可协议的链接,并说明是否有更改。本文中的图片或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果材料不包含在文章的创作共用许可中,并且您的预期用途不被法律法规允许或超出了允许的用途,您将需要直接从版权所有者那里获得许可。欲查看此许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献放弃书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信用额度中另有说明。
关于这篇文章
引用这篇文章
林(Hayashi, A.),马托巴(Matoba, K.),大田(Ohata, Y.)et al。2型糖尿病患者血液透析相关血糖变异性与激素变化关系的评估:一项初步研究任取代其他843(2022)。https://doi.org/10.1186/s41100-022-00429-0
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s41100-022-00429-0
关键字
- 低血糖症
- 血糖变异性
- Hemodialysis-related低血糖
- c -肽
- 胰高血糖素