摘要
背景
透析患者由于合并症和免疫功能低下,易患严重疾病,2019冠状病毒病(COVID-19)死亡率高。因此,透析患者应优先接种疫苗。这项研究旨在研究疫苗的效果能维持多久,以及哪些因素会影响抗体滴度。
方法
血液透析患者(HD组)和年龄和性别匹配的非透析患者(对照组),接受两剂BNT162b2疫苗,于2021年7月通过日本透析治疗学会(JSDT)网站招募。分别在疫苗接种前、第一次接种后3周、第二次接种后2周、第二次接种后3个月测定抗SARS-CoV-2免疫球蛋白(IgG)滴度,并与HD组进行比较。采用多变量回归分析和逐步回归分析(AIC最小)分析影响SARS-CoV-2 IgG滴度的因素。此外,我们还比较了对照组和HD组的不良反应,并研究了不良反应与SARS-CoV-2 IgG滴度的关系。
结果
我们的研究招募了123名对照组参与者(62.6%男性,中位年龄67.0岁)和206名HD组患者(64.1%男性,中位年龄66.4岁)。HD组首次接种疫苗3周后SARS-CoV-2 IgG滴度明显降低(p< 0.0001),第二次接种后2周(p= 0.0002),以及第二次接种疫苗后3个月(p= 0.045)高于对照组。但HD组第二次接种后2周至3个月SARS-CoV-2 IgG滴度降低率明显低于对照组(p= 0.048)。逐步回归分析显示,透析时间是HD组第二次接种后2周SARS-CoV-2 IgG滴度的显著独立因素(p= 0.002),透析时间越长,最大抗体滴度越高。HD组在第二次接种疫苗后发烧和恶心的发生率明显较高(p= 0.039和p= 0.020)。两组发热患者的抗体滴度均显著高于无发热患者(HD:p= 0.0383,对照:p= 0.0096)。
结论
在接种疫苗3个月后,HD患者的抗体滴度明显低于年龄和性别匹配的非透析患者。透析时间是影响HD组SARS-CoV-2 IgG滴度的一个因素,透析时间越长,最大SARS-CoV-2 IgG滴度越高。
背景
由严重急性呼吸综合征2型冠状病毒(SARS-CoV-2)引起的2019冠状病毒病(COVID-19)在全球范围内广泛传播,感染人数仍在增加[1].由于血液透析(HD)患者比正常人有更多的合并症和免疫功能紊乱,慢性肾脏疾病或HD已被报道为COVID-19严重程度的危险因素。事实上,HD患者的COVID-19死亡率大约是普通人群的10倍[2].截至2021年7月,疫苗未在日本广泛分发时的数据显示,1349名患者(仅已知结局)中有383人死亡,死亡率高达28.4% [3.].疫苗被认为对预防严重疾病非常重要,因此在全球范围内迅速分发疫苗。迄今为止,日本主要使用的疫苗是辉瑞- biontech疫苗(BNT162b2)和武田/Moderna疫苗(mRNA-1273)。BNT162b2和mRNA-1273在预防严重疾病的发病方面都非常有效。第二次接种疫苗后,前者预防疾病症状发作的有效率为95%,后者为94.1%,前者预防严重疾病的有效率为89%,后者为100% [1,4].此外,已知的疫苗不良反应包括接种部位疼痛、瘙痒、全身不适、头痛、寒战、肌痛、关节痛和发烧,尽管这些症状通常在2天内好转[1,4].BNT162b2和mRNA-1273的过敏反应率分别为1.95%和2.20%,BNT162b2和mRNA-1273的过敏反应率分别为4.7 / 100万和2.5 / 100万[5].该疫苗被广泛报道为安全有效,日本的疫苗接种率提高到约80%。在日本,透析患者优先接种疫苗。因此,自2021年8月以来,截至2022年3月24日的透析患者COVID-19死亡率已下降至1804例患者中的132例(7.3%)(仅结局已知)[3.].然而,由于HD患者在接种其他疫苗(如流感疫苗和乙型肝炎疫苗)后无法获得和维持足够的抗体,人们担心他们可能无法通过COVID-19疫苗获得和维持足够的抗体[6].
我们通过对SARS-CoV-2刺突蛋白免疫球蛋白G (IgG)抗体滴度的定量分析,研究这些患者在中和SARS-CoV-2时是否获得了有效的体液反应,这表明抗体滴度与中和有很强的相关性[7,8].此外,这项研究旨在研究疫苗的效果能维持多久,以及哪些因素会影响抗体滴度。
材料与方法
我们由日本透析治疗学会感染控制委员会(JSDT)开展了一项前瞻性多中心研究。在获得JSDT伦理委员会的批准(批准号1-10)后,可以招募患者参加研究的机构从7月6日到31日在JSDT网站上登记。
HD患者(HD组)的入组条件如下:受试者未接种疫苗或仅接种过一剂疫苗,未感染过COVID-19, 1年内未接受任何恶性肿瘤治疗,未接受类固醇、免疫抑制剂和免疫调节剂等药物治疗,计划接种两剂BNT162b2疫苗,并给予本研究书面同意。对照组在东京生会中心医院及其附属医院通过公开招募的方式进行注册,将入组透析患者的年龄(以10年为单位)和性别进行匹配。与HD组一样,对照组也包括满足HD患者设定的条件的患者,除了eGFR为45 mL/min/1.73 m外2,或更多。
在第一次疫苗接种前、第一次疫苗接种后3周、第二次疫苗接种后2周和第二次疫苗接种后3个月,使用Ortho-Clinical Diagnostics VITROS®Anti-SARS-CoV-2 IgG化学发光免疫法测定与中和抗体相关的SARS-CoV-2刺突蛋白S1亚基IgG抗体滴度(抗S1抗体滴度)。研究期间有症状的COVID-19患者被排除在外。第一次疫苗接种前基线值为17.8 BAU/mL(抗体滴度阳性标准)或更高的患者,第二次疫苗接种后3个月抗体滴度高于第二次疫苗接种后2周抗体滴度的患者也被排除在外。比较两组抗体滴度随时间的变化。患者也被分为两组:抗体滴度低于17.8的(无反应)和抗体滴度为17.8或更高的(有反应)在第一次疫苗接种后3周。评估非应答者的百分比、背景和特征。患者临床特征(年龄、性别、体重指数(BMI)、原发性肾脏疾病、合并症、HD年龄、透析时间、Kt/V)和临床资料(总蛋白(TP)、白蛋白(Alb)、天冬氨酸转氨酶(AST)、丙氨酸转氨酶(ALT)、碱性磷酸酶(ALP)、γ-谷氨酰转肽酶(γ-GTP)、血尿素氮(BUN)、肌酐(Cre)、尿酸(UA)、免疫球蛋白(IgG)、铁(Fe)、铁总结合能力(TIBC)、铁蛋白、c反应蛋白(CRP)、同时采集糖化血红蛋白(HbA1c)、白细胞(WBC)、淋巴细胞和血红蛋白(Hb)。评估影响第二次疫苗接种后2周抗体滴度和降低率的因素(降低率由第二次疫苗接种后2周至3个月抗s1抗体滴度的差异除以第二次疫苗接种后2周抗体滴度的差异计算)。
另外,采用iFlash-2019-nCoV NAb代物中和试验(Yhlo-NAb;深圳市永和乐生物科技有限公司,中国深圳)的研究结果证实,该基因与抗s1抗体滴度呈强正相关。
在第一次和第二次接种疫苗后进行问卷调查,以确定不良反应(疼痛、红肿、瘙痒、疲劳、头痛、肌肉痛、寒冷、发热(37.5°C <)、关节痛、恶心、腹泻、胃痛、过敏反应)是否存在,并在对照组和HD组之间进行比较。然后观察各组抗s1抗体滴度与不良反应的关系。
我们通过sinh-arcsinh (SHASH)变换将第二次疫苗接种后2周的抗s1抗体滴度和第二次疫苗接种后2周至3个月的降低率近似为正态分布,并使用背景、共病和实验室数据作为解释变量进行单变量分析。然后,仅提取与的因子进行多变量回归分析p在该单变量分析中值小于0.25,然后使用JMP软件程序进行逐步回归分析(AIC最小)。
使用Mann-Whitney法比较中位数U测试。使用Fisher精确检验或卡方检验比较各组之间的频率。统计显著性设为p< 0.05。
结果
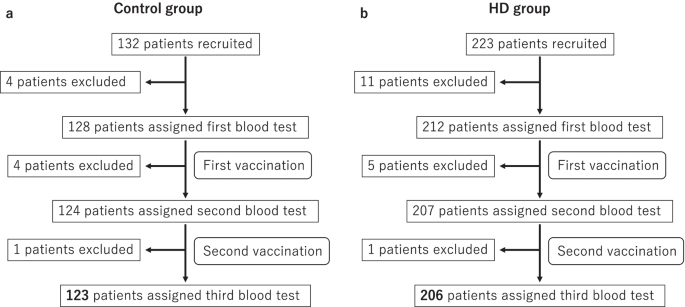
在本研究中,10家机构(东京生会中心医院、原田奈嘉诊所、小泽诊所、水野诊所、中村诊所、Konan-no-sato、shirogan -no-mori、Keifukuen、Oumori养老院、仓郎- kaminoge)作为对照组,7家机构(品川透析诊所、目黑车站大楼诊所、东京生会中心医院、大宫吉泽诊所、浦和吉泽诊所、南- ooi诊所、Chuou奈嘉诊所)作为HD组。共纳入132例对照组,223例HD组。对照组中,4例因未征得同意在第一次验血前被排除(1例),1例使用了免疫调节药物(1例),2例不能来我院。随后,4例患者因1例感染COVID-19(1例),1例无法来我院(1例),开始使用免疫调节药物(2例),在第二次血检前被排除。一名患者在第三次血液检测前因死亡被排除(图。1a).在HD组中,11例患者在第一次验血前因得不到同意被排除(5例),不能来我院(2例),没有接种疫苗或有其他疫苗(3例),1例死亡(1例)。然后,5例患者在第一次接种前抗体滴度超过17.8 BAU/ml(3例)或死亡(2例),在第二次血检前被排除。一名患者在第三次血液检测前因死亡被排除(图。1b).最后纳入对照组123例(62.6%男性,中位年龄67.0岁)和HD组206例(64.1%男性,中位年龄66.4岁)(图。1).各组的特征见表1.
试验资料。作为对照组,共招募132例患者,其中4例患者在第一次验血前因无法获得同意被排除(1例),1例患者使用了免疫调节药物(1例),且无法来我院(2例)。随后,4例患者因1例感染COVID-19(1例),1例无法来我院(1例),开始使用免疫调节药物(2例),在第二次血检前被排除。一名患者在第三次血液检测前死亡。最后纳入123例患者(一个).作为HD组,入组223例患者,11例患者因无法获得同意(5例),无法来我院(2例),未接种疫苗或有其他疫苗(3例),1例患者死亡(1例),在第一次验血前被排除。然后,5例患者在第一次接种前抗体滴度超过17.8 BAU/ml(3例)或死亡(2例),在第二次血检前被排除。一名患者在第三次血液检测前死亡。最后纳入206例患者(b).高清,血液透析
抗s1抗体滴度及其影响因素
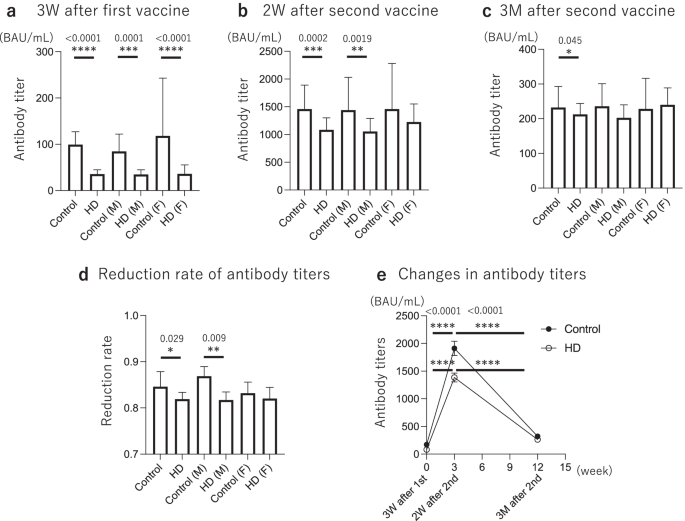
第一次接种后3周,HD组抗s1抗体滴度显著降低(HD: 35.6 BAU/mL vs对照组:99.4 BAU/mL,p< 0.0001),第二次疫苗接种2周后(HD: 1085 BAU/mL vs对照组:1460 BAU/mL,p= 0.0002),第二次接种3个月后(HD: 212.3 BAU/mL vs对照组:232.2 BAU/mL,p= 0.045)高于对照组(图;2a - c)。两组按性别分组比较,男性首次接种疫苗3周后,HD组抗s1抗体滴度明显低于对照组(HD: 34.8 BAU/mL vs Control: 84.6 BAU/mL)。p= 0.0001)和第二次疫苗接种后2周(HD: 1055 BAU/mL vs对照组:1440 BAU/mL,p= 0.0019),但在第二次疫苗接种后3个月无显著差异(HD: 202.7 BAU/mL vs对照组:235.9 BAU/mL,p> 0.05)(图2a - c)。在女性中,HD组的抗s1抗体滴度明显低于对照组在第一次接种后3周(HD: 36.2 BAU/mL vs对照组:118.0 BAU/mL,p< 0.0001),但在第二次疫苗接种后2周无显著差异(HD: 1225 BAU/mL vs对照组:1460 BAU/mL,p> 0.05),在第二次疫苗接种后3个月也没有(HD: 240.1 BAU/mL vs对照组:228.1 BAU/mL,p> 0.05)(图2a - c)。此外,HD组抗s1抗体滴度(从2周到3个月)的降低率明显小于对照组(HD: 0.819 vs对照组:0.846)。p= 0.029)。此外,两组抗s1抗体滴度的降低率按性别比较,HD组降低率较小,但仅在男性显著(男性HD: 0.817 vs对照组:0.869,p= 0.009;女性HD: 0.820 vs对照组:0.832p> 0.05)(图2d).抗s1抗体滴度从第一次接种疫苗后3周到第二次接种疫苗后3个月的时间过程如图所示。2e;对照组在第二次疫苗接种后抗体滴度高于HD组,但在第二次疫苗接种后2周至3个月,对照组抗体滴度下降较快,两组抗体滴度差异逐渐缩小。
接种后各点的抗体滴度。第二次疫苗接种前,HD组抗s1抗体滴度显著降低(HD: 35.6 BAU/mL vs对照组:99.4 BAU/mL;p< 0.0001),第二次疫苗接种2周后(HD: 1085 BAU/mL vs对照组:1460 BAU/mL,p= 0.0002),第二次疫苗接种3个月后(HD: 212.3 BAU/mL vs对照组:232.2 BAU/mL,p= 0.045)高于对照组(一个- - - - - -c).此外,男性在第一次疫苗接种后3周和第二次疫苗接种后2周观察到显著差异,女性仅在第一次疫苗接种后3周观察到显著差异(一个- - - - - -c).此外,在第二次疫苗接种后2周至3个月,HD组抗体滴度(2周至3个月)的降低率明显小于对照组(HD: 0.819 vs对照组:0.846)。p= 0.029),性别差异仅男性显著(d).e抗s1抗体效价的时间病程超过3个月。*p< 0.05, **p< 0.01, ***p< 0.001, ****p< 0.0001。3 W, 3周;2 W, 2周;3m, 3个月;高清,血液透析;米,男;F,女;BAU,结合抗体单位
第一次接种疫苗后3周,HD患者无反应的比例明显高于对照组(HD组26.7% (55/206)vs对照组13.8%(17/123))。p= 0.0082)。然而,各组中第一次疫苗接种3周后无应答者的大多数在第二次疫苗接种2周后出现免疫应答,无应答者的比例显著降低(HD组1.9% (4/206)vs对照组1.6%(2/123)。p= 1.0000)。在第一次疫苗接种后无应答者中,HD组在第二次疫苗接种后2周的抗体滴度明显低于对照组(HD组376.5 BAU/mL vs应答者538.0 BAU/mL,p= 0.038)2).对HD患者无反应者和有反应者的比较显示,两组之间在年龄、性别、共病、透析时间或Kt/V上没有显著差异,但在第二次疫苗接种后2周,无反应者的抗体滴度明显降低(无反应者376.5 BAU/mL vs有反应者1380 BAU/mL)。p< 0.0001),在第二次疫苗接种后3个月(无应答者74.6 BAU/mL vs应答者257.7 BAU/mL,p< 0.0001)(表2).
中和抗体滴度
对照组和HD组的中和抗体滴度与抗s1抗体滴度均呈强正相关(HD:r= 0.81,p< 0.0001,对照:r= 0.40,p< 0.0001)(图3.此外,在接种第二种疫苗3个月后,HD组的中和抗体滴度较低(HD: 55.6 AU/mL vs对照组:76.7 AU/mL)。p< 0.0014)(图;3.c)。
抗s1抗体效价的多变量回归分析
第二次接种疫苗后两周
在对照组中,提取年龄、糖尿病(DM)、慢性阻塞性肺疾病(COPD)、尿素氮(BUN)和脑血管疾病进行单因素分析。虽然在多变量回归分析中,抗s1抗体滴度没有显著的独立因素,但在逐步回归分析中,年龄和DM被认为是影响抗s1抗体滴度的显著独立因素3.).在HD组中,单因素分析提取透析时间、年龄、BMI、高血压、心血管疾病、COPD、BUN、IgG,多因素回归分析和逐步回归分析显示,透析时间短(< 4 h)患者抗s1抗体滴度明显降低(表2)4).
第二次疫苗接种后2周至3个月的减少率
对照组采用单因素分析提取BMI、白蛋白、性别、年龄、CRP、IgG和UA。虽然在多变量回归分析中,抗s1抗体滴度的降低没有显著的独立因素,但在逐步回归分析中,BMI是降低率的显著独立因素(表1)3.).在HD组中,提取COPD、高血压、恶性肿瘤、BUN和CRP进行单因素分析。虽然在多变量回归分析中没有显著的降低率的独立因素,但在逐步回归分析中,高血压被确定为降低率的显著独立因素(表4).
接种疫苗后不良反应
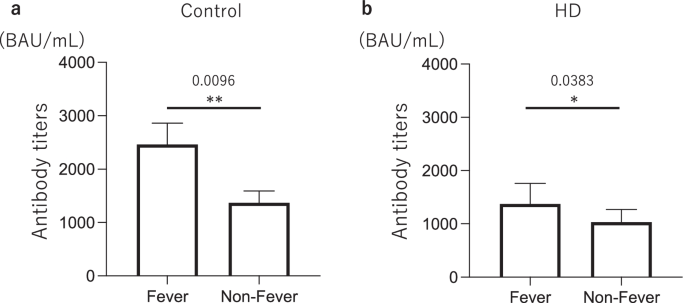
第一次接种后,两组疫苗接种后不良反应发生率比较,差异无统计学意义;然而,HD组发烧和恶心的发生率明显较高(p= 0.039和p= 0.020)第二次接种后。当两组根据性别进一步比较时,男性HD组发热和恶心的发生率明显更高(p= 0.026和p= 0.046),仅在第二次接种疫苗后。然而,在妇女中,第二次疫苗接种后没有显著差异(表5).几乎所有在第二次接种疫苗后出现恶心症状的患者都有发烧症状;因此,我们比较了第二次疫苗接种后发烧和没有发烧的两组患者的抗s1抗体滴度。结果发热组抗s1抗体滴度在第二次接种2周后显著高于对照组(发热:2460 BAU/mL vs非发热:1370 BAU/mL)p= 0.0096)和HD组(发烧:1375 /mL vs非发烧:1030 BAU/mL)p= 0.0383)4).
讨论
对HD患者的疫苗抗体滴度进行了各种研究,但大多数研究都将年龄和性别不匹配的医护人员作为对照组。这项研究对这一问题做出了重大贡献,因为在年龄和性别匹配的情况下,比较了对照组和HD患者的抗体滴度。
先前的报告显示,93-95%的普通人群在第一次免疫接种后3-4周产生体液免疫反应,但只有18-43%的HD患者产生体液免疫反应[9,10,11].在我们的研究中,HD患者在第一次接种疫苗后抗体滴度呈阳性的比例为74%,明显低于非HD患者(86%),但高于之前的报道。本研究甚至包括了与HD患者年龄和性别匹配的老年患者,这可能对对照组有影响。与以往的报道相比,HD组的结果可能是由于日本人种和日本HD的有效性会影响抗体滴度。
对照组和HD组在第二次疫苗接种2周后均诱发体液免疫反应,此时抗体滴度预计会达到最高水平,尽管两组之间存在显著差异。这些数据与以前的报道一致,即在第二次免疫后1个月,82%至96%的病例抗体滴度显著增加[10,11,12].然而,尽管先前报道的数据显示HD患者的抗体滴度为非HD患者的40%,但我们的年龄匹配数据显示非HD患者的抗体滴度为66%。与以往的报道不同,这可能是由于对照组是年龄匹配的HD患者群体。Kageyama等人将免疫抑制药物的使用、年龄、第二次剂量与样本收集之间的时间、糖皮质激素的使用和饮酒列为影响非hd患者最大抗体滴度的因素[13].我们认为年龄和糖尿病是显著的独立因素。由于我们的研究排除了恶性肿瘤患者或使用免疫调节药物的患者,Kageyama等人列出的一些因素没有被确定。由于高血糖和胰岛素抵抗引起的免疫缺陷,糖尿病也被认为是影响抗体水平的重要因素[14].影响抗体水平的因素在每项研究中都有所不同;因此,系统评价形式的综合数据对进一步分析很重要。
Agur等人发现,HD患者年龄较小,白蛋白水平较高,静脉铁剂量较低,BMI小于30 [[14]和Lacson等人还确定了女性、年龄较小、疾病或药物导致的免疫抑制状态、慢性心力衰竭以及疫苗接种前后的其他疫苗接种史或住院史[15].在我们的研究中,透析时间被确定为影响抗体滴度的因素。在透析组中,透析时间较短的患者难以获得抗体滴度。正如先前的报道,尿毒症会扰乱先天性和适应性免疫系统,导致HD患者的抗原处理减少,细胞介导和抗体介导的免疫反应减少[16].因此,通过每天透析较长时间来消除尿毒症毒素可能会导致更高的抗体滴度。
据报道,透析患者的疫苗抗体滴度随着时间的推移而下降[6].Davidovic等人报道,抗体滴度在第一次疫苗接种后6个月下降到基线水平,表明加强疫苗接种的重要性[17].在本研究中,还研究了决定抗体滴度下降速度更快的因素,如降低率。据我们所知,这是第一个使用多变量分析和逐步回归分析评估影响因素的研究。我们发现了与对照组抗s1抗体滴度下降相关的因素;BMI。Pellini等人证明,由于免疫功能障碍,BMI会影响COVID - 19疫苗的抗体效价[18].然而,目前还没有关于抗体保留与BMI之间关系的报道。我们的数据可能表明,BMI指数高的人是加强疫苗接种的更好迹象。另一方面,我们的结果表明,高血压是降低率的显著独立因素,高血压的存在导致降低速度较慢。然而,这很难从免疫学的角度来讨论。
据Polewska等报道,HD患者接种疫苗后的不良反应也有报道,在HD患者接种第一次和第二次疫苗后,最常见的反应是轻度到中度注射部位疼痛,而最常见的全身反应是疲劳、肌痛和关节痛。先前的报道显示,许多局部和全身不良反应在HD患者中观察到的频率较低,即使他们的年龄和性别相匹配[19].然而,我们的数据显示,第一次疫苗接种在Control组和HD组之间的不良反应发生没有显著差异,而第二次疫苗接种后,HD组全身发热和恶心症状明显更高。Zitte等报道HD患者不良反应发生率低于对照组,部分原因是对照组年龄小于HD组[20.].因此,本研究的年龄匹配可能可以更准确地评估HD患者与对照组之间的不良反应发生率,即避免了对照组由于年龄较小而导致不良反应发生率较高的偏差。在HD组,第二次疫苗接种后全身不良反应更常见,因为HD患者在第一次疫苗接种后获得抗体的可能性较低,而抗体滴度在第二次疫苗接种后倾向于增加,这可能增加了第二次疫苗接种后发热患者的数量。我们的研究表明,无论是对照组还是HD组,第二次接种后出现发热的患者抗s1抗体滴度均明显高于未出现发热的患者。因此,在第二次疫苗接种后抗体滴度大幅增加的人可能会出现发烧。在先前的报告中,第二次接种疫苗后出现发烧的健康参与者的IgG滴度明显高于没有发烧的参与者[21].据认为,在HD患者中,发烧反映了强烈的先天免疫反应,可能是抗体滴度升高的一个指标。
作为限制,在我们的研究中,对照组由养老院居民和医院门诊患者组成,这可能不是典型的对照组。此外,该研究的受试者未感染过SARS-CoV-2,在第一次接种疫苗前抗体滴度被确认为阴性,但不能排除第二次接种疫苗后3个月内无症状感染的病例。同时测定HD组和对照组在同一时间点的抗s1抗体滴度。然而,Kitamura等人报道,超过一半的老年HD患者在第二次疫苗接种后2至3周内抗刺突IgG滴度增加,尽管84%的健康对照组在同一时期内出现下降[22].因此,与对照组相比,HD患者,特别是老年患者,可能具有较慢的抗体滴度速率,并且在第二次接种疫苗2周后可能无法准确评估抗体滴度峰值。
结论
HD患者在完全接种疫苗后,抗s1抗体滴度明显低于年龄和性别匹配的非透析个体。透析时间是影响HD组SARS-CoV-2 IgG滴度的一个因素,透析时间越长,最大SARS-CoV-2 IgG滴度越高。透析患者接种疫苗后的全身反应提示有有效的免疫反应。
数据和材料的可用性
在当前研究期间生成和/或分析的数据集可根据合理要求从通信作者处获得。
缩写
- COVID-19:
-
2019冠状病毒病
- SARS-CoV-2:
-
严重急性呼吸综合征2型冠状病毒
- 高清:
-
血液透析
- JSDT:
-
日本透析治疗学会
- 体重指数:
-
身体质量指数
- TP:
-
血清总蛋白
- 铝青铜:
-
白蛋白
- AST:
-
天冬氨酸转氨酶
- ALT:
-
丙氨酸转氨酶
- 高山:
-
碱性磷酸酶
- γ三磷酸鸟苷:
-
γ谷酰基转肽酶
- 包子:
-
血尿素氮
- Cre:
-
肌酸酐
- UA:
-
尿酸
- 免疫球蛋白:
-
免疫球蛋白
- 菲:
-
铁
- TIBC:
-
总铁结合能力
- c反应蛋白:
-
c反应蛋白
- 糖化血红蛋白:
-
糖化血红蛋白
- 白细胞:
-
白细胞
- Hb:
-
血红蛋白
- 糖尿病:
-
糖尿病
- 慢性阻塞性肺病:
-
慢性阻塞性肺疾病
参考文献
李国强,李国强,李国强,等。BNT162b2 mRNA Covid-19疫苗的安全性和有效性。中华实用医学杂志,2015;29(3):344 - 344。
De Meester J, De Bacquer D, Naesens M, Meijers B, Couttenye MM, De Vriese AS。肾替代治疗成人中COVID-19的发病率、特征和结局:一项区域性注册研究中国生物医学工程学报,2011;32(2):385-96。
日本透析医师协会COVID-19工作队委员会;日本透析治疗学会;日本肾脏学会。透析患者新型冠状病毒感染累计登记病例数。https://www.jsdt.or.jp/info/3559.html.2022年7月31日访问。
巴登LR, El Sahly HM, Essink B, Kotloff K, Frey S, Novak R,等。mRNA-1273 SARS-CoV-2疫苗的有效性和安全性。中华实用医学杂志,2015;26(5):344 - 344。
Shimabukuro TT, Cole M, Su JR. 2020年12月14日- 2021年1月18日美国接受mRNA COVID-19疫苗后发生过敏反应的报告。《美国医学协会杂志》上。2021年,325(11):1101 - 2。
Speer C, Schaier M, Nusshag C, Töllner M, Buylaert M, Kälble F,等。腹膜透析和血液透析患者接种COVID-19疫苗后12周的纵向体液反应疫苗(巴塞尔)。2021; 9(10): 1130。
杨东,王志强,王志强,等。covid -19中和抗体可以预测疾病严重程度和生存期。细胞。2021;184 (2):476 - 88. - e11。
杨晓东,李志强,李志强,等。在接种疫苗的医护人员中发现Covid-19突破性感染。中华医学杂志。2021;35:14 74 - 84。
Goupil R, Benlarbi M, Beaubien-Souligny W, Nadeau-Fredette AC, Chatterjee D, Goyette G,等。血液透析患者1剂BNT162b2疫苗后的短期抗体反应协会。2021; 193 (22): E793-e800。
Speer C, Göth D, Benning L, Buylaert M, Schaier M, Grenz J,等。BNT162b2疫苗接种后血液透析患者的早期体液反应临床临床杂志,2021;16(7):1073-82。
张志刚,张志刚,张志刚,张志刚,等。维持性血液透析患者对BNT162b2疫苗的抗体应答肾内科杂志,2017;29(6):489 - 489。
葛洛普A,沙伦N,芬恩T,科恩R,以色列M, Agbaria A,等。维持性血液透析患者对辉瑞BNT162b2疫苗的体液反应临床临床杂志,2016;16(7):1037-42。
龟山T,池田K,田中S,谷口T, Igari H, Onouchi Y,等。日本一家三级转诊医院医护人员对BNT162b2 mRNA COVID-19疫苗的抗体应答及其预测因子临床微生物感染杂志,2021;27(12):1861.e1-1861.e5。
张志刚,张志刚,张志刚,张志刚,等。透析患者对SARS-CoV-2疫苗mRNA抗体应答的前瞻性研究Nephrol Dial Transplant. 2021; 36:1347-9。
李志强,李志强,李志强,等。SARS-CoV-2疫苗在透析中的免疫原性。中国农业大学学报。2021;32:2735-42。
贾恩·M,科尔斯·J,多施·欧,阿纳斯塔修·欧,佐格·哈迪克·B, Tyczynski B,等。BNT162b2 (Pfizer-BioNTech)对血液透析患者sars - cov -2疫苗接种的体液反应疫苗(巴塞尔)。2021; 9(4): 360。
杨晓明,王晓明,王晓明,杨晓明,等。血液透析患者在SARS-CoV-2接种mRNA-BNT162b2疫苗6个月后体液反应减弱:是时候增强了。肾内科杂志。2021;100(6):1334-5。
Pellini R, Venuti A, Pimpinelli F, Abril E, Blandino G, Campo F,等。首剂量BNT162b2后早期出现SARS-COV-2抗体:与年龄、性别和BMI的相关性疫苗(巴塞尔)。2021; 9(7): 685。
Polewska K, Tylicki P, Biedunkiewicz B, rucizynska A, szydowska A, Kubanek A,等。BNT162b2 mRNA COVID-19疫苗在透析患者中的安全性和耐受性COViNEPH项目(考纳斯)。2021; 57(7): 732。
张志刚,张志刚,张志刚,等。mRNA-BNT162b2 SARS-CoV-2疫苗在血液透析患者中的安全性和免疫原性前沿免疫。2021;12:704773。
山本S,福永A,田中A,竹内JS,井上Y,木村M,等。第二剂BNT162b2 COVID-19疫苗后的反应原性与SARS-CoV-2抗体之间的关联疫苗。2022;40(13):1924 - 7。
北村M,高野T,山本K,原田T, Funakoshi S, Mukae H,等。接受血液透析的养老院居民对BNT162b2疫苗COVID-19的低体液免疫反应:一项病例对照观察研究Ren Replace Ther. 2022;8(1):8。
确认
我们特别感谢吉泽守博士、加藤文彦博士、猪西洋次博士、水野武彦博士、原田优子博士、小泽美典博士、中村直树博士、望月直树先生和近藤典彦先生为招募学员做出的巨大贡献。我们也感谢东京生会中心医院肾脏科、透析中心和临床检验科的工作人员采集血液。我们要感谢Editage (www.editage.com)进行英文编辑。
资金
作为COVID-19疫苗接种的紧急事项,研究经费由JSDT在JSDT董事会批准下提供。
作者信息
作者及隶属关系
贡献
AY、MR和YK在JSDT感染控制委员会的批准下设计了这项研究。AY、MR、KKikuchi、TK和KS对参与者入组有贡献。KKatayama测量了患者的抗体滴度。AY、MT、EO对临床资料进行总结和数据分析。MK作为统计专家做出了重大贡献。AY、MT和MR起草了手稿。KKikuchi, TK, KS, EO, KKatayama, MK, YU, NO, YK, HK, TS, YT, JT, KH, YN, NHasegawa, NHanafusa, FH, KM, SW, HN, YT修改了手稿。所有作者都已阅读并批准了最终稿。
相应的作者
道德声明
伦理批准并同意参与
日本透析治疗学会伦理委员会(JSDT)批准了这项研究(批准号1-10)。这项研究是根据1964年《赫尔辛基宣言》及其后来的修正案进行的。所有参与者都提供了书面的知情同意书。
发表同意书
不适用。
相互竞争的利益
作者宣称他们之间没有利益冲突。
额外的信息
出版商的注意
伟德体育在线施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条所提供的资料,除非在资料的信用额度中另有说明。
关于本文
引用本文
吉富士,户田,男,龙崎,男。et al。COVID-19疫苗在日本CKD患者血液透析治疗中的疗效调查Ren代替Ther8, 39(2022)。https://doi.org/10.1186/s41100-022-00427-2
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s41100-022-00427-2
关键字
- 新型冠状病毒肺炎
- 血液透析
- 疫苗接种
- 不良反应