- 研究gydF4y2Ba
- 开放获取gydF4y2Ba
- 发表:gydF4y2Ba
ALV-K env的199-205、269、319、321和324关键氨基酸位点导致ALV-K的复制能力弱于ALV-AgydF4y2Ba
RetrovirologygydF4y2Ba体积gydF4y2Ba19gydF4y2Ba,文章号:gydF4y2Ba19gydF4y2Ba(gydF4y2Ba2022gydF4y2Ba)gydF4y2Ba
摘要gydF4y2Ba
背景gydF4y2Ba
禽白血病病毒(ALV)是一种传染性逆转录病毒,主要引起家禽各种形式的肿瘤、免疫抑制、产蛋率下降和体重增长缓慢。ALV由A-K等11个亚群组成,其中ALV- k是近10年来流行的一个新兴亚群。大多数ALV-K菌株复制能力较弱,致病性较弱。本研究从ALV-K gp85与Tva受体相互作用的角度探讨了ALV-K复制能力弱的问题。gydF4y2Ba
方法gydF4y2Ba
通过用ALV-K gp85蛋白骨架替代ALV-A gp85蛋白的序列差异区(hr1、hr2和vr3),构建了14个可溶性重组ALV-A/K gp85嵌合蛋白,用于co-IP和竞争性阻断试验。gydF4y2Ba
结果gydF4y2Ba
ALV-K gp85与Tva的结合能力显著弱于ALV-A gp85 (P < 0.05), ALV-K env的199-205、269、319、321和324关键氨基酸位点导致ALV-K复制能力弱于ALV-A。gydF4y2Ba
结论gydF4y2Ba
本研究首次从ALV-K gp85与Tva相互作用的角度揭示了ALV-K复制能力弱的分子因素,为进一步阐明ALV-K感染机制提供了依据。gydF4y2Ba
背景gydF4y2Ba
禽白血病病毒(alv)是引起鸡各种肿瘤疾病的一种逆转录病毒,分为11个亚群:ALV-A至ALV-K [gydF4y2Ba1gydF4y2Ba,gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3.gydF4y2Ba].ALV给家禽业造成了巨大的经济损失,尤其是ALV- j,其致癌性高,影响肉鸡生长。随着提纯过程的进展,近年来在中国发现了一个新的ALV亚群ALV- k [gydF4y2Ba4gydF4y2Ba,gydF4y2Ba5gydF4y2Ba,gydF4y2Ba6gydF4y2Ba,gydF4y2Ba7gydF4y2Ba].ALV-K分离株具有较弱的复制能力和致病性,这使得ALV-K逃脱了一些公司的AL纯化程序,长期潜伏在鸡群中。这也导致ALV-K有突变或与其他alv重组的趋势,导致出现一种致命的ALV-K致病菌株,并给家禽业造成严重的经济损失[gydF4y2Ba7gydF4y2Ba,gydF4y2Ba8gydF4y2Ba,gydF4y2Ba9gydF4y2Ba].gydF4y2Ba
ALV-K与ALV-A共享Tva受体并侵入宿主[gydF4y2Ba10gydF4y2Ba,gydF4y2Ba11gydF4y2Ba];但ALV-A的复制能力强于ALV-K [gydF4y2Ba5gydF4y2Ba,gydF4y2Ba6gydF4y2Ba].我们前期研究表明,ALV-K的长末端重复(long terminal repeat, LTR)启动子活性弱于其他外源alv,这可能是其复制能力较低的原因[gydF4y2Ba12gydF4y2Ba].此外,缺失一些氨基酸编码的gydF4y2Ba波尔gydF4y2Ba基因导致逆转录酶活性增加,从而增强ALV-K分离株的竞争复制优势[gydF4y2Ba8gydF4y2Ba].当ALV-K分离株与其他外源性alv进行重组时,它们的复制能力和致病性会通过其他alv亚群的骨架得到增强[gydF4y2Ba7gydF4y2Ba,gydF4y2Ba9gydF4y2Ba].在本研究中,我们将重点放在ALV-A和ALV-K的gp85上,以探索这些病毒与Tva受体的结合是否也会影响ALV-K的复制能力。gydF4y2Ba
ALV-A-E gp85的hr1和hr2区域被认为是受体结合的关键区域[gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba13gydF4y2Ba,gydF4y2Ba14gydF4y2Ba,gydF4y2Ba15gydF4y2Ba].在逆转录病毒包膜蛋白功能域的研究中,通常将病毒包膜蛋白替换为不相关的序列,构建重组嵌合蛋白,分析其与受体蛋白的结合能力。此外,分析病毒在受体免疫粘附素压力下的突变方向也是确定病毒包膜蛋白功能域的常用方法。张等。[gydF4y2Ba16gydF4y2Ba]通过将ALV-J gp85蛋白片段替换为包含一个不相关序列的ha标记蛋白片段,确定了ALV-J gp85蛋白的功能域。ALV-B和ALV-C在其免疫粘附素Tvb-mIgG和Tvb-mIgG的选择压力下,env的部分片段缺失或突变发生。由此推断突变区域为受体结合区域[gydF4y2Ba14gydF4y2Ba,gydF4y2Ba15gydF4y2Ba].在我们之前的研究中,我们将ALV-K和ALV-E的差异序列(用Tvb作为宿主受体[gydF4y2Ba17gydF4y2Ba]),并发现ALV-K包膜蛋白(env)在hr1残基194-198、206-216、hr1和hr2残基251-256以及hr2残基269-280的突变会影响其与Tva受体的结合[gydF4y2Ba18gydF4y2Ba].gydF4y2Ba
在可溶性SUA-rIgG免疫黏附素阻断作用下,ALV可改变其与细胞表面受体结合的氨基酸,利用其他ALV亚群的细胞受体入侵细胞[gydF4y2Ba19gydF4y2Ba,gydF4y2Ba20.gydF4y2Ba],为ALV膜蛋白不同亚群间氨基酸置换的研究思路提供了依据。在我们的研究中,重组嵌合ALV gp85蛋白或重组嵌合ALV是通过替换ALV- a和ALV- k的hr1、hr2和vr3区域的差异片段构建的,这对ALV gp85蛋白的空间结构几乎没有影响(附加文件gydF4y2Ba1gydF4y2Ba:图S1)。gydF4y2Ba
材料与方法gydF4y2Ba
细胞培养和抗体gydF4y2Ba
293个T细胞在Dulbecco改良的Eagle 's培养基(DMEM;Gibco, Life Technologies, Carlsbad, CA, USA)补充10%胎牛血清(BioInd, USA),存在5% COgydF4y2Ba2gydF4y2Ba在37℃。DF-1细胞在含有10% FBS (Gibco, Life Technologies, Carlsbad, CA, USA)的DMEM中培养,存在5% COgydF4y2Ba2gydF4y2Ba在39℃。抗ha标签购自Thermo Scientific公司(Rockford, IL, USA),而抗M2标记抗体和抗gapdh抗体购自Sigma公司(Aldrich, St. Louis, MO)。gydF4y2Ba
重组病毒复制能力的比较分析gydF4y2Ba
根据以往的研究方法[gydF4y2Ba18gydF4y2Ba],以RCASBP(A)-EGFP逆转录病毒为载体,构建点突变重组RCASBP(A)-EGFP逆转录病毒质粒,将1µg重组逆转录病毒转染6孔板DF-1细胞。连续传代后,在转染(DPT)后第3、6、9天荧光显微镜下观察细胞。胰酶消化后用流式细胞仪检测GFP阳性细胞的百分比。分析ALV-A(RSA GenBank接入号)的复制竞争力。NC_001408.1)和ALV-K(GDFX0602 GenBank登录号。构建EGFP或mCherry标记的重组病毒,各0.5µg共转移至6孔板中的DF-1细胞。在3、6、9 DPT荧光显微镜下观察细胞,胰酶消化后用流式细胞仪检测GFP/mCherry阳性细胞的百分比。gydF4y2Ba
不同嵌合可溶性gp85蛋白的表达gydF4y2Ba
为了鉴定ALV-A gp85蛋白与Tva相互作用的关键氨基酸残基,将ALV-A RSA的gp85克隆到真核表达载体pCAGGS中,并与3 × flag标记序列融合。为了确保gp85蛋白以可溶性形式表达,将编码信号肽(pCAGGS-s-gp85-flag)的片段与gp85蛋白的n端融合。通过每隔5或6个氨基酸替换RSA和GDFX0602相应的序列残基,构建了一系列嵌合可溶性gp85蛋白(图2)。gydF4y2Ba4gydF4y2Bas1~vr3),用同样的方法构建了重组单氨基酸突变体gp85蛋白。gydF4y2Ba
共免疫沉淀(co-IP)实验和下拉实验gydF4y2Ba
根据制造商的说明,用PolyJet (SignaGen Laboratories, Rockville, MD, USA)在60mm培养皿中分别用5µg嵌合gp85质粒转染293个T细胞。转染48 h后,收集293 T细胞上清液,用0.22- M滤膜过滤,浓缩至1/10体积进行co-IP实验。在体外结合实验中,Tva与人IgG-Fc片段融合,特异性结合到293 T细胞中表达的质粒pCAGGS-Tva-HA-Fc的蛋白A/G上。收集细胞培养基,用蛋白A/G (Santa Cruz, Lexington, MA, USA)在4℃温和搅拌2小时纯化蛋白。用冰冷的磷酸盐缓冲盐水(PBS)洗涤5次后,将琼脂糖与分别转染重组pCAGGS-s-gp85-flag和pCAGGS-Tva-HA-Fc的293 T细胞上清在4℃温和搅拌下孵育6小时。冷PBS洗涤5次后,用SDS-PAGE分离结合蛋白,用抗ha、抗flag和抗gapdh单克隆抗体进行western blotting。gydF4y2Ba
西方墨点法gydF4y2Ba
高温变性蛋白在12% SDS-PAGE凝胶中分离,转移到NC膜上。用5% (W/V)脱脂牛奶在室温下阻塞1 h后,与抗ha单抗、抗flag单抗和抗gapdh单抗在4℃孵育过夜。PBS洗涤3次后,用IRDye培养NC膜gydF4y2Ba®gydF4y2Ba680RD驴抗小鼠IgG (H + L)抗体(LI-COR Biosciences, Lincoln, NE)室温作用1小时。最后,使用奥德赛红外成像系统(LI-COR Biosciences)对NC膜进行扫描。gydF4y2Ba
竞争性阻塞测验gydF4y2Ba
为了进一步验证一系列重组gp85系列蛋白与Tva受体的结合能力,将10µg重组pCAGGS-s-gp85-flag质粒在100 mm培养板中转染293个T细胞。48 h后,收集细胞上清液,用超滤管浓缩至体积的1/10,用0.22 μ m滤膜过滤后,用4℃浓缩后的重组gp85蛋白孵育1 h,然后用RCASBP(a)-EGFP病毒感染DF-1细胞。72 h后对细胞进行消化,流式细胞术计算gfp阳性细胞的百分比。gydF4y2Ba
重组病毒突变体的构建gydF4y2Ba
为进一步验证gp85突变片段或单个氨基酸对Tva结合的影响,以RCASBP(A)- egfp为骨架,通过重叠PCR构建一系列重组RCASBP(A)- egfp相关病毒,将1µg重组逆转录病毒转染到6孔板DF-1细胞中。连续传代后,在9 DPT对细胞进行消化,流式细胞术计算gfp阳性细胞的百分比。gydF4y2Ba
恢复突变体的构建gydF4y2Ba
在蛋白水平上,将ALV-A gp85定向突变鉴定的氨基酸逐步替换为ALV-K gp85为骨架,通过重叠PCR构建恢复突变体,然后进行co-IP试验。在病毒水平上,按照蛋白水平恢复突变体构建的思路,以RCASBP(K)-EGFP为骨架构建恢复突变体重组病毒,感染到DF-1细胞中,连续传代后,流式细胞术计算GFP阳性细胞的百分比,评价恢复突变体重组病毒的复制能力。gydF4y2Ba
ALV-A和ALV-K gp85蛋白空间结构分析gydF4y2Ba
为了评价ALV-A和ALV-K gp85序列逐段替换对gp85蛋白空间结构的影响,I-Trasser (gydF4y2Bahttps://zhanggroup.org/I-TASSER/gydF4y2Ba)对ALV-A gp85进行空间结构分析,然后以ALV-A gp85为模板,采用SWISS-MODEL (gydF4y2Bahttps://swissmodel.expasy.org/gydF4y2Ba).利用PyMOL软件(软件版本2.2.0)对ALV-A和ALV-K gp85蛋白的空间结构进行拟合。gydF4y2Ba
结果gydF4y2Ba
ALV-A和ALV-K复制能力比较gydF4y2Ba
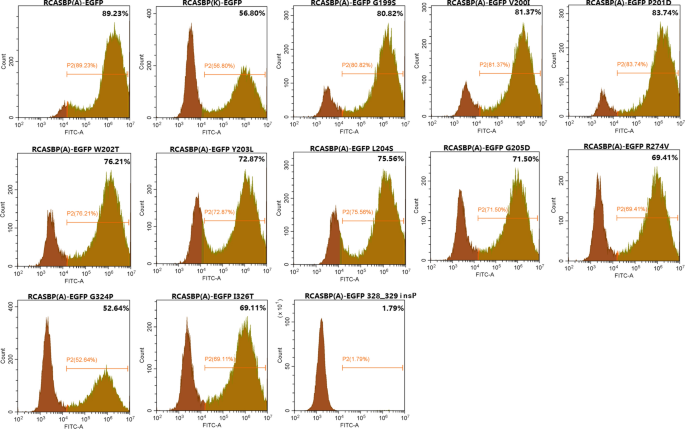
连续传代转染RCASBP(A)-EGFP和RCASBP(K)-EGFP的DF-1细胞,分别于3、6、9 DPT进行荧光显微镜观察。结果表明,转染RCASBA-EGFP的DF-1细胞在3,6,9 DPT时具有较高的荧光信号强度。RCASBP(K)-EGFP转染后荧光信号强度呈明显升高趋势,尤其是在3 DPT时,转染RCASBP(A)-EGFP的GFP阳性细胞比例明显强于转染RCASBP(K)-EGFP的细胞(图2)。gydF4y2Ba1gydF4y2Baa, b, P < 0.001)。gydF4y2Ba
ALV-A和ALV-K的竞争复制优势比较gydF4y2Ba
为了评估共享Tva作为受体的ALV-A和ALV-K的竞争性复制优势,分别将0.5µg RCASBP(A)-EGFP/mCherry和0.5µg RCASBP(K)-mCherry/EGFP共转染到6孔板中的DF-1细胞。连续传代后,在3,6,9 DPT荧光显微镜下观察荧光信号强度。结果表明,无论是EGFP还是mCherry标记,RCASBP(A)的荧光信号始终具有主要的复制优势(图2)。gydF4y2Ba2gydF4y2Ba模拟)。gydF4y2Ba
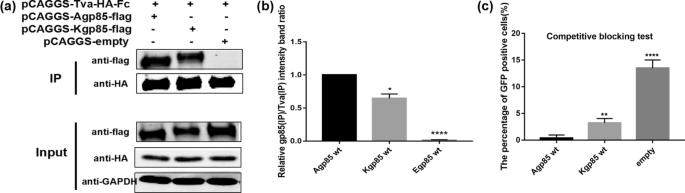
ALV-A gp85 wt和ALV-K gp85 wt与Tva受体结合的比较gydF4y2Ba
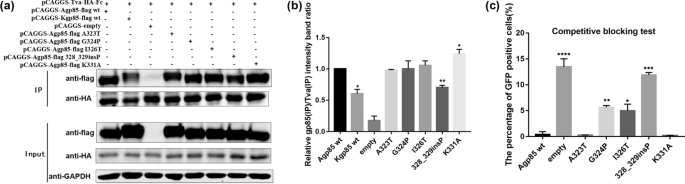
为了探究环境对ALV-A和ALV-K复制能力差异的影响,本研究分析了ALV-A gp85wt和ALV-K gp85wt与Tva受体的结合情况。co-IP结果显示ALV-K gp85 wt与Tva的结合明显弱于ALV-A gp85 wt(图5)。gydF4y2Ba3.gydF4y2Baa, b, P < 0.05)。此外,将10µg pCAGGS-s-A/K gp85 wt转染到100 mm板的293 T细胞中,10倍浓度的ALV-A gp85几乎完全阻断了RCASBP(A)-EGFP对DF-1细胞的感染,但在相同条件下,阻断ALV-K gp85 wt后,约3.0%的DF-1细胞呈gfp阳性(图2)。gydF4y2Ba3.gydF4y2Bac)。gydF4y2Ba
分析ALV-A和ALV-K gp85蛋白与Tva受体的结合。gydF4y2Ba一个gydF4y2Ba,gydF4y2BabgydF4y2BaALV-A和ALV-K gp85蛋白与Tva受体相互作用的co-IP检测结果和灰色值分析结果。gydF4y2BacgydF4y2Ba评估ALV-A和ALV-K gp85蛋白对RCASBP(A)-EGFP感染的竞争性阻断作用。进行了三个独立的实验,数据显示为来自代表性实验的三个重复样本的平均值±SD。使用GraphPad Prism 7进行统计分析(双向方差分析);* * * P < 0.05, P < 0.01, * * * * * * P < 0.001, P < 0.0001gydF4y2Ba
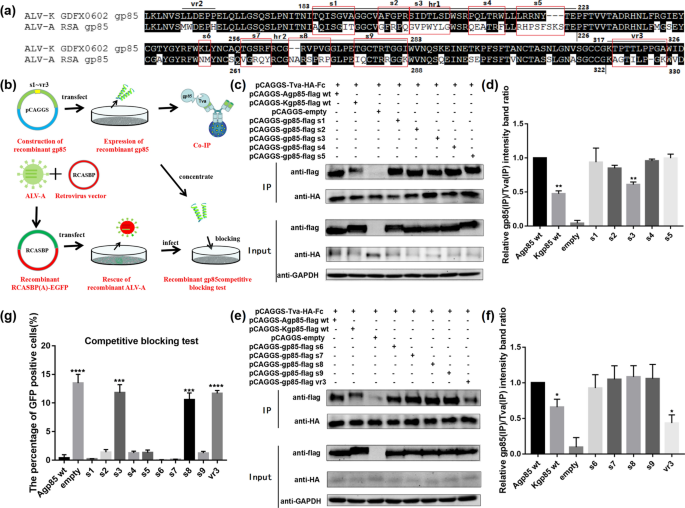
ALV-A/K gp85节段置换结合Tva的分析gydF4y2Ba
为了研究ALV-A和ALV-K gp85与Tva受体结合差异的关键氨基酸,将ALV-A和ALV-K gp85的不同部位hr1和hr2分为10个片段(gp85 s1~vr3),并逐个替换相应的片段(图。gydF4y2Ba4gydF4y2Baa).一系列可溶性重组嵌合蛋白被表达用于co-IP和竞争性阻断实验,以分析可溶性重组嵌合蛋白与Tva受体的结合(图。gydF4y2Ba4gydF4y2Bab). co-IP结果显示可溶性重组嵌合蛋白gp85 s3和vr3与Tva受体的结合明显弱于ALV-A的gp85 wt(图5)。gydF4y2Ba4gydF4y2Bac-f, P < 0.01)。除了可溶性重组嵌合蛋白gp85 s3和vr3外,可溶性重组嵌合蛋白gp85 s8处理的DF-1细胞也显示约11.0%的gfp阳性,但gfp阳性细胞的比例略低于重组嵌合蛋白gp85 s3和vr3处理的DF-1细胞(图5)。gydF4y2Ba4gydF4y2Baf).值得注意的是,co-IP实验中未发现可溶性重组嵌合蛋白gp85 s8;我们推测co-IP实验的敏感性低于竞争阻塞实验。gydF4y2Ba
重组嵌合ALV-A/K gp85蛋白与Tva受体结合的分析gydF4y2Ba一个gydF4y2BaALV-A RSA与ALV-K GDFX0602 gp85蛋白序列的同源性比较gydF4y2BabgydF4y2Baco-IP和竞争性阻塞测试技术路线图;gydF4y2BacgydF4y2Ba,gydF4y2BadgydF4y2BaAgp85蛋白的重组嵌合片段s1-s5与Tva受体的结合及相对灰色值;gydF4y2BaegydF4y2Ba,gydF4y2BafgydF4y2BaAgp85蛋白的重组嵌合片段s1-s5与Tva受体的结合及相对灰色值;gydF4y2BaggydF4y2Ba重组嵌合ALV-A/K gp85蛋白竞争性阻断。进行了三个独立的实验,数据显示为来自代表性实验的三个重复样本的平均值±SD。使用GraphPad Prism 7进行统计分析(双向方差分析);* * * P < 0.05, P < 0.01, * * * * * * P < 0.001, P < 0.0001gydF4y2Ba
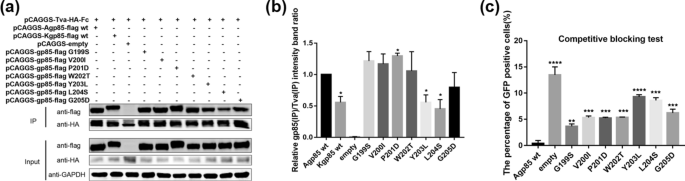
单氨基酸取代ALV-A/K gp85 s3与Tva结合的分析gydF4y2Ba
为了进一步确定导致ALV-A gp85与Tva结合比ALV-K gp85与Tva结合更强的关键氨基酸,将残基s3的氨基酸逐个替换,进行co-IP和竞争阻断实验,co-IP实验结果表明,单氨基酸突变体Y203L和L204S与Tva的结合明显弱于ALV-A gp85 wt(图5)。gydF4y2Ba5gydF4y2Baa, b).当可溶性重组ALV-A gp85竞争性阻断DF-1细胞表面受体时,单氨基酸突变体Y203L和L204S阻断ALV-A感染DF-1细胞的效率较低,而其他单氨基酸突变体(G199S, V200I, P201D, W202T和G205D)的阻断效率也低于ALV-A gp85 wt(图。gydF4y2Ba5gydF4y2Bac),因此s3片段的所有氨基酸都影响ALV-A gp85与Tva受体的结合。gydF4y2Ba
重组gp85 s3蛋白点突变体与Tva受体结合的分析。gydF4y2Ba一个gydF4y2Ba,gydF4y2BabgydF4y2Ba可溶性重组gp85嵌合蛋白与Tva受体相互作用的Co-IP测试结果及灰色值分析结果;gydF4y2BacgydF4y2Ba评价可溶性重组嵌合gp85蛋白竞争性阻断RCASBP(A)-EGFP感染的效率。进行了三个独立的实验,数据显示为来自代表性实验的三个重复样本的平均值±SD。使用GraphPad Prism 7进行统计分析(双向方差分析);* * * P < 0.05, P < 0.01, * * * * * * P < 0.001, P < 0.0001gydF4y2Ba
ALV-A/K gp85 s8单氨基酸取代突变体与Tva结合分析gydF4y2Ba
为了进一步确定使ALV-A gp85与Tva结合比ALV-K gp85与Tva结合更强的关键氨基酸,将残基s8的氨基酸逐个替换。co-IP结果显示重组ALV-A gp85 s8点突变体与Tva的结合能力无显著差异(图5)。gydF4y2Ba6gydF4y2Baa, b, P > 0.05)。然而,竞争性阻断试验结果显示重组ALV-A gp85 R274V对应的DF-1细胞gfp阳性约9.5%(图。gydF4y2Ba6gydF4y2Bac),高于重组ALV-A gp85 wt和其他s8点突变体对应的gfp阳性DF-1细胞。值得注意的是,在co-IP试验中没有发现ALV-A gp85 R274V,这可能是因为co-IP试验的敏感性弱于竞争性阻断试验。gydF4y2Ba
ALV-A/K gp85 vr3单氨基酸取代突变体与Tva结合分析gydF4y2Ba
为了进一步探索影响重组ALV-A gp85 vr3与Tva结合能力低的氨基酸,将ALV-A和ALV-K env vr3的单氨基酸逐个取代,构建vr3点突变体。在ALV-A env的328和329位点之间有一个单一的脯氨酸(Pro)插入,本研究将其命名为突变体328_329insP。co-IP测试结果显示,单氨基酸突变体328_329insP与Tva的结合明显弱于ALV-A gp85 wt(图。gydF4y2Ba7gydF4y2Ba, p < 0.01)。竞争性阻断试验结果与co-IP的结果基本一致,可溶性重组ALV-A gp85 328_329insP阻断DF-1细胞后,重组病毒RCASBP(A)-EGFP感染DF-1细胞,gfp阳性的DF-1细胞仍有12.5%存活。与其他单氨基酸重组突变体相比,可溶性重组突变体ALV-A gp85 328_329insP的阻断效率最低。此外,单氨基酸可溶性重组突变体ALV-A gp85 G324P和I326T在DF-1细胞中gfp阳性率仍约为5.5%和4.5%(图2)。gydF4y2Ba7gydF4y2Bac).结果表明,vr3中ALV-A gp85 328_329insP突变体极大地影响了ALV-A gp85与Tva的结合。点突变体G324P和I326T也能影响ALV-A gp85与Tva的结合,但其作用弱于点突变体328_329insP。gydF4y2Ba
重组gp85 vr3蛋白点突变体与Tva受体结合的分析。gydF4y2Ba一个gydF4y2Ba,gydF4y2BabgydF4y2Ba可溶性重组gp85嵌合蛋白与Tva受体相互作用的co-IP检验和灰色值分析结果;gydF4y2BacgydF4y2Ba评价可溶性重组嵌合gp85蛋白竞争性阻断RCASBP(A)-EGFP感染的效率。进行了三个独立的实验,数据显示为来自代表性实验的三个重复样本的平均值±SD。使用GraphPad Prism 7进行统计分析(双向方差分析)。使用GraphPad Prism 7进行统计分析(双向方差分析);* * * P < 0.05, P < 0.01, * * * * * * P < 0.001, P < 0.0001gydF4y2Ba
点突变体病毒重建实验gydF4y2Ba
按照之前的构建方法,以RCASBP(A)-EGFP为骨架构建一系列点突变重组病毒,转染到DF-1细胞中。连续传代后,流式细胞术检测gfp阳性细胞的百分比。结果显示,RCASBP(A)-EGFP转染gfp阳性的DF-1细胞中G199S、V200I、P201D、W202T、Y203L、L204S、R274V、G324P、I326T和328_329insP的比例低于RCASBP(A)-EGFP转染的DF-1细胞(图2)。gydF4y2Ba8gydF4y2Ba).特别是转染RCASBP(A)-EGFP 328_329insP的DF-1细胞中gfp阳性的比例仅为1.79%,远低于转染RCASBP(K)-EGFP的gfp阳性细胞的比例。然而,除了RCASBP(A)-EGFP G324P和328_329insP外,转染其他重组RCASBP(A)-EGFP病毒的细胞中gfp阳性细胞的百分比高于转染RCASBP(K)-EGFP的DF-1细胞的百分比。这表明ALV-A的复制能力受到ALV-A环境病毒G199S、V200I、P201D、W202T、Y203L、L204S、R274V、G324P、I326T和328_329insP的影响。特别是vr3区点突变体328_329insP使ALV-A的体外复制能力大大降低。gydF4y2Ba
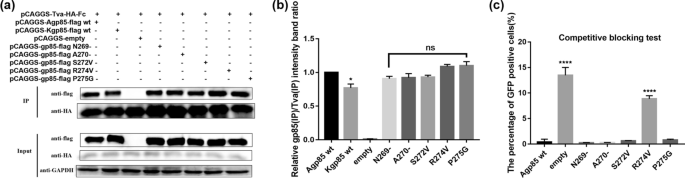
以ALV-K为骨架的点突变恢复实验gydF4y2Ba
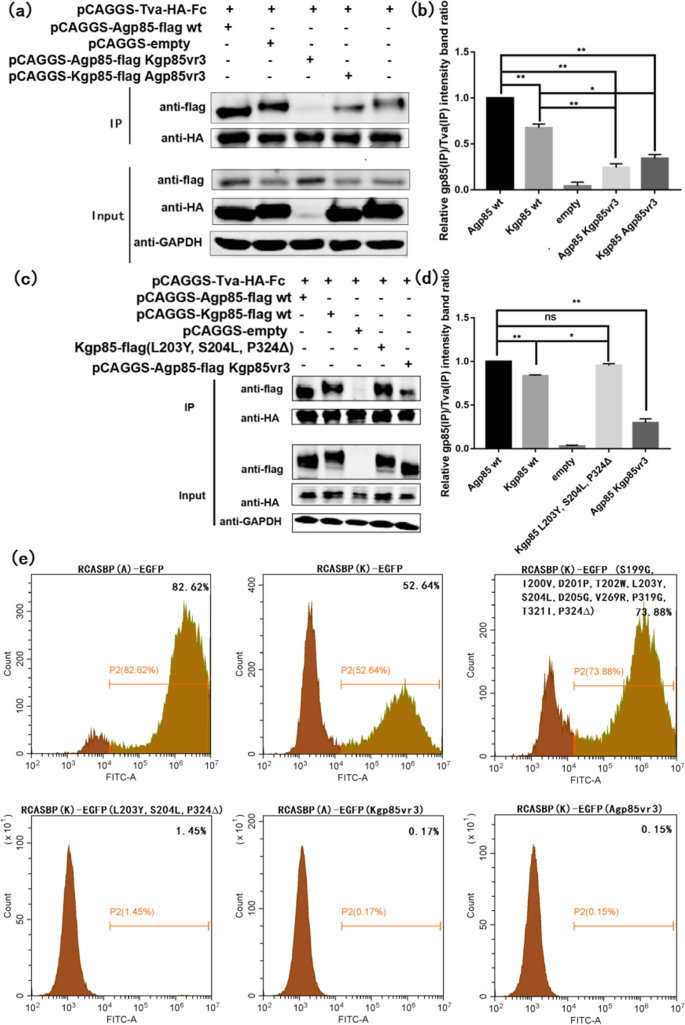
对比ALV-A gp85和ALV-K gp85的氨基酸序列,鉴定出的关键氨基酸位点G199S、V200I、P201D、W202T、Y203L、L204S、G205D、R274V、G324P、I326T和328_329insP分别对应于ALV-K gp85的氨基酸位点S199G、I200V、D201P、T202W、L203Y、S204L、D205G、V269R、P319G、T321I和P324Δ。为了进一步验证已确定的导致ALV-A gp85与Tva受体结合的关键氨基酸位点,以ALV-K gp85蛋白序列为骨架,进行co-IP测试。结果表明,ALV-K突变体gp85 (L203Y, S204L和P324Δ)与Tva受体的结合类似于ALV-A gp85 wt与Tva受体的结合(图2)。gydF4y2Ba9gydF4y2Bac, d, P > 0.05),但显著强于ALV-K gp85 wt对Tva受体的抑制作用(P < 0.05)。这表明ALV环境氨基酸位点L203Y、S204L和328_329insP是影响ALV- a gp85比ALV- k gp85对Tva受体更强结合能力的重要因素。此外,值得注意的是,重组ALV-A gp85 (Kgp85 vr3)和ALV-K gp85 (Agp85 vr3)与Tva受体的结合亲和力弱于ALV-K gp85 wt(图5)。gydF4y2Ba9gydF4y2Baa, b, P < 0.01)。在病毒水平上,重组病毒RCASBP(K)-EGFP的gfp阳性细胞比例(L203Y、S204L和P324Δ)仅为1.45%,而转染重组病毒RCASBP(K)-EGFP的gfp阳性DF-1细胞比例(S199G、I200V、D201P、T202W、L203Y、S204L、D205G、V269R、P319G、T321I和P324Δ)为73.88%,高于转染RCASBP(K)-EGFP的gfp阳性DF-1细胞的52.64%,低于转染RCASBP(A)-EGFP的gfp阳性DF-1细胞的82.62%。结果表明,ALV-K膜蛋白199 ~ 205、269、319、321和324位点是导致ALV-K复制能力弱于ALV-A的关键氨基酸位点。gydF4y2Ba
ALV-K gp85蛋白点突变体恢复试验。gydF4y2Ba一个gydF4y2Ba,gydF4y2BabgydF4y2Ba可溶性重组gp85 vr3蛋白与Tva受体相互作用的co-IP检验和灰色值分析结果。gydF4y2BacgydF4y2Ba,gydF4y2BadgydF4y2Ba可溶性重组gp85蛋白点突变体与Tva受体相互作用的co-IP检验和灰色值分析结果;gydF4y2BaegydF4y2Ba流式细胞术检测点突变恢复突变体gfp阳性细胞的百分比。进行了三个独立的实验,数据显示为来自代表性实验的三个重复样本的平均值±SD。使用GraphPad Prism 7进行统计分析(双向方差分析);* p < 0.05, ** p < 0.01gydF4y2Ba
讨论gydF4y2Ba
ALV-K分离株的复制能力和致病性弱于其他外源alv。前期研究发现ALV-K LTR启动子活性较弱,导致ALV-K复制滴度较低[gydF4y2Ba12gydF4y2Ba].因此,在ALV纯化过程中,ALV- k不易被检测到,可以长期潜伏在鸡体内,逃过一些公司现有的纯化工艺。近年来,ALV- k分离株已被证明与其他外源ALV LTR发生LTR重组,Li等分离出一株重组ALV- k菌株JS15SG01,具有多个ALV- k、ALV- e和ALV- j片段,包含ALV- e LTR的R3和U5区域以及ALV- j LTR的U3区域;这种毒株引起鸡的病毒血症和解毒水平升高,并引起鸡的脑组织损伤[gydF4y2Ba9gydF4y2Ba].Lv等发现以ALV-J为骨架,用ALV-K env代替env,重组ALV-K的复制能力和致病性明显强于原ALV-K菌株[gydF4y2Ba7gydF4y2Ba].除了LTR, Su等[gydF4y2Ba8gydF4y2Ba]发现ALV-K逆转录酶24位1个氨基酸和32-39位8个氨基酸的缺失可以增强病毒在体内和体外的复制。因此,我们认为ALV-K的复制能力主要受ALV-K LTR启动子活性和逆转录酶活性的影响。在本研究中,经RCASBP(A)-EGFP转染的gfp阳性DF-1细胞的百分比始终高于经RCASBP(K)-EGFP转染的细胞。此外,当DF-1细胞进一步等量共转染携带不同标签的RCASBP(A)和RCASBP(K)时,RCASBP(A)始终比RCASBP(K)表现出更强的竞争优势(图1)。gydF4y2Ba2gydF4y2Ba模拟)。随后,本研究比较了ALV-A gp85和ALV-K gp85与Tva受体的结合亲和力。结果表明,ALV-A gp85与Tva受体的结合能力明显强于ALV-K gp85(图5)。gydF4y2Ba3.gydF4y2Baa, b),可溶性ALV-A和ALV-K gp85竞争性阻断RCASBP(a)-EGFP感染进一步支持了这一结论(图。gydF4y2Ba3.gydF4y2Bac).因此,ALV-K env与Tva受体的结合也可能是影响ALV-K复制能力的一个因素。gydF4y2Ba
为了进一步鉴定影响ALV-A gp85和ALV-K gp85与Tva受体结合亲和力差异的关键氨基酸,以ALV-K gp85为对照构建了一系列可溶性重组嵌合ALV-A gp85突变体。此外,ALV-A env的hr1氨基酸残基aa199-205、hr2氨基酸残基aa269-275和vr3氨基酸残基aa323-331是ALV-A gp85与Tva结合的关键氨基酸残基。此外,对ALV-A env的199-205、aa269-275和aa323-331单氨基酸位点进行了co-IP测试和竞争阻断测试。co-IP测试结果表明,hr1中aa199-205的203和204位点以及vr3中aa323-331的328-329位点是ALV-A gp85与Tva受体相互作用的关键位点。此外,点突变体竞争阻断试验结果显示,在hr1 199 ~ 205残基中,所有位点(G199、V200、P201、W202、Y203、L204和G205)均存在;hr2的269-275残基中的R274;通过可溶性重组ALV-A gp85点突变体与DF-1细胞表面受体结合,vr3 323-331残基中的G324、I326和328_329insP在竞争性阻断RCASBP(A)感染中发挥重要作用。值得注意的是,co-IP试验和竞争阻断试验鉴定的ALV-A gp85与Tva结合的关键氨基酸位点并不完全一致。其中,ALV-A env的203、204和328-329氨基酸位点在co-IP和竞争阻断试验中均得到鉴定。综上所述,co-IP试验所识别的氨基酸位点均在竞争性阻断试验中被识别,说明竞争性阻断试验比co-IP具有更高的敏感性,能够识别co-IP试验难以区分的蛋白质灰色值差异。gydF4y2Ba
前期研究表明vr3不直接参与ALV env与宿主受体的结合,但在协调hr1与宿主受体的结合中发挥重要作用[gydF4y2Ba19gydF4y2Ba].然而,该研究只针对单个氨基酸突变K261E,不像我们的研究涉及整个vr3区域的替换。我们的结果表明,vr3区域在ALV-A gp85结合Tva受体的过程中发挥了重要作用,而关键的氨基酸变化被确定为Pro插入到ALV-A gp85的328-329残基(图2)。gydF4y2Ba7gydF4y2Baa - c)。在重组病毒水平上,RCASBP(A)-EGFP 328_329insP的复制滴度大大降低(图3)。gydF4y2Ba8gydF4y2Ba).可溶性重组ALV-K gp85 (L203Y, S204L, P324Δ)通过将ALV-A gp85的vr3和hr1区与相应的关键单氨基酸反向突变表达。重组ALV-K gp85 (L203Y, S204L, P324Δ)与Tva受体的结合能力明显强于ALV-K gp85 wt(图2)。gydF4y2Ba9gydF4y2Bac, d, P < 0.05),结合能力接近ALV-A gp85 wt (P > 0.05)。这进一步证明vr3区域参与了ALV-A gp85与Tva受体的相互作用。gydF4y2Ba
大多数ALV- k分离株在体内外复制和致病性较弱,可能长期不易在鸡群中被检测到,这使得分离株有可能逃过一些育种公司的AL纯化程序,ALV- k可能容易发生突变或与其他内源性或外源性ALV重组产生致病性ALV菌株,这将给中国AL的纯化带来新的挑战。本研究从ALV gp85与Tva受体相互作用的角度,首次阐明了受体结合差异影响ALV- k复制的分子机制,为进一步阐明ALV- k感染机制和完善家禽养殖场ALV纯化方案提供了依据。gydF4y2Ba
结论gydF4y2Ba
综上所述,本研究发现ALV-K gp85与Tva的结合明显弱于ALV-A gp85 (P < 0.05), ALV-K env的199-205、269、319、321和324关键氨基酸位点导致ALV-K复制能力弱于ALV-A。本研究首次从ALV-K gp85蛋白与Tva受体结合的角度报道了ALV-K复制能力弱的分子基础,为进一步阐明ALV-K感染机制提供了依据。gydF4y2Ba
数据和材料的可用性gydF4y2Ba
不适用。gydF4y2Ba
参考文献gydF4y2Ba
佩恩LN,布朗SR,巴姆斯特德N,豪斯K,弗雷泽A,索利斯ME。鸡外源性禽白血病病毒的新亚群。中华病毒学杂志,1991;22 (p4): 344 - 344。gydF4y2Bahttps://doi.org/10.1099/0022-1317-72-4-801gydF4y2Ba.gydF4y2Ba
李勇,付杰,崔松,孟F,崔智,范杰,等。禽白血病病毒J亚群在本地鸡群不同个体间Gp85遗传多样性中国家禽科学,2017;96(5):1100-7。gydF4y2Bahttps://doi.org/10.3382/ps/pew407gydF4y2Ba.gydF4y2Ba
Federspiel乔丹。逆向工程提供了关于亚群A到E禽肉瘤和白血病病毒受体特异性的进化的见解。病毒。2019;11(6):497。gydF4y2Bahttps://doi.org/10.3390/v11060497gydF4y2Ba.gydF4y2Ba
崔娜,苏松,陈志明,赵晓明,崔志忠。鸡白血病病毒JS11C1株抢救克隆的基因组序列分析及生物学特性。中国病毒学杂志,2014;49 (Pt 11): 344 - 344。gydF4y2Bahttps://doi.org/10.1099/vir.0.067264-0gydF4y2Ba.gydF4y2Ba
李旭,林伟,常胜,赵鹏,张旭,刘勇,等。华南地区一黄鸡禽白血病病毒新亚群的分离、鉴定及进化分析。中国动物医学杂志,2016;39(10):339 - 339。gydF4y2Bahttps://doi.org/10.1007/s00705-016-2965-xgydF4y2Ba.gydF4y2Ba
赵智,饶敏,廖敏,曹伟。华南地区禽白血病病毒重组K亚群的系统发育分析及致病性评价。病毒。2018;10(4):194。gydF4y2Bahttps://doi.org/10.3390/v10040194gydF4y2Ba.gydF4y2Ba
吕丽,李富峰,胡美美,邓俊杰,刘玉玲,谢强,等。一种重组有效地增加了新型禽白血病病毒K亚群的发病机制。兽医微生物学杂志2019;231(8):214-7。gydF4y2Bahttps://doi.org/10.1016/j.vetmic.2019.03.021gydF4y2Ba.gydF4y2Ba
齐松,杨林,崔震,双成,彭哲。pol基因突变的新型禽白血病病毒在体内外均表现出竞争性复制优势。新兴微生物感染。2018;7(1):117。gydF4y2Bahttps://doi.org/10.1038/s41426-018-0111-4gydF4y2Ba.gydF4y2Ba
李晓霞,马明明,常FF, Muhammad F,于敏敏,任长青,等。一株新型多重重组ALV-K菌株的分子特性及致病性分析。中国畜牧兽医杂志。2017;26(9):109184。gydF4y2Bahttps://doi.org/10.1016/j.vetmic.2021.109184gydF4y2Ba.gydF4y2Ba
picikryl D, Plachý J, Kučerová D, Koslová A, Reinišová M, Šenigl F,等。新型禽白血病病毒K亚群与a亚群共享其细胞鸡受体J病毒,2019;93(17):e519-80。gydF4y2Bahttps://doi.org/10.1128/JVI.00580-19gydF4y2Ba.gydF4y2Ba
Koslová A, Kučerová D, Reinišová M, Geryk J, Trefil P, Hejnar J.通过CRISPR/Cas9编辑鸡细胞特异性受体基因诱导对禽白血病病毒的遗传抗性。病毒。2018;10(11):605。gydF4y2Bahttps://doi.org/10.3390/v10110605gydF4y2Ba.gydF4y2Ba
赵志军,饶明志,陈杰,张军,袁丽霞,廖敏,等。禽白血病病毒k亚群5’ltr启动子活性的研究。中国畜牧兽医学报。2018。gydF4y2Bahttps://doi.org/10.3390/v10110605gydF4y2Ba.gydF4y2Ba
Holmen SL, Melder DC, Federspiel MJ。A亚群禽白血病病毒包膜中决定受体结合亲和力和表达鸡或鹌鹑Tva受体细胞感染性的关键残基的鉴定。中国病毒学杂志,2001;75(2):726-37。gydF4y2Bahttps://doi.org/10.1128/JVI.75.2.726-737.2001gydF4y2Ba.gydF4y2Ba
Taplitz RA, Coffin JM。具有扩展受体使用的禽逆转录病毒突变体的选择。中国病毒学杂志,1997;71(10):7814。gydF4y2Bahttps://doi.org/10.1128/JVI.71.10.7814-7819.1997gydF4y2Ba.gydF4y2Ba
雷尼G,纳森A,麦克斯菲尔德LF,科芬JM。禽逆转录病毒宿主范围扩大机制。中国病毒学杂志,2003;77(12):6709-19。gydF4y2Bahttps://doi.org/10.1128/jvi.77.12.6709-6719.2003gydF4y2Ba.gydF4y2Ba
张勇,于敏敏,邢丽霞,刘鹏,陈宜涛,常福飞,等。J亚群禽白血病病毒gp85 N端和C端二部序列基序在受体结合和病毒进入中起关键作用。中国病毒学杂志,2020;44 (22):e01232-e1320。gydF4y2Bahttps://doi.org/10.1128/JVI.01232-20gydF4y2Ba.gydF4y2Ba
Adkins HB, Brojatsch J, Young J.禽白血病病毒亚组B, D和E的共享tnfr相关受体的鉴定和特征揭示了E亚组病毒进入所需的半胱氨酸残基。中国病毒学杂志,2000;74(8):3572-8。gydF4y2Bahttps://doi.org/10.1128/jvi.74.8.3572-3578.2000gydF4y2Ba.gydF4y2Ba
陈杰,李建强,李丽珍,刘鹏,曹伟。K亚群禽白血病病毒糖蛋白hr1中的单个氨基酸G196和R198是与Tva受体结合的关键。前沿微生物。2020;11:596586。gydF4y2Bahttps://doi.org/10.3389/fmicb.2020.596586gydF4y2Ba.gydF4y2Ba
Melder DC, Pankratz VS, Federspiel MJ。受体竞争对手的进化压力选择不同亚群a禽白血病病毒逃脱变异与改变受体相互作用。中国病毒学杂志,2003;77(19):10504-14。gydF4y2Bahttps://doi.org/10.1128/jvi.77.19.10504-10514.2003gydF4y2Ba.gydF4y2Ba
Munguia A, Federspiel MJ。禽肉瘤和白血病病毒包膜糖蛋白在进入竞争对手的压力下进化以扩大受体的使用。病毒。2019;11(6):519。gydF4y2Bahttps://doi.org/10.3390/v11060519gydF4y2Ba.gydF4y2Ba
确认gydF4y2Ba
不适用。gydF4y2Ba
资金gydF4y2Ba
广东省重点领域研究发展计划项目(2020B020222001);国家自然科学基金项目(No. 31672552);广东省禽肉产业技术体系(2021KJ128);农业部中国农业研究系统(car -41)。gydF4y2Ba
作者信息gydF4y2Ba
作者及隶属关系gydF4y2Ba
贡献gydF4y2Ba
WSC和ML参与研究设计,JC进行实验,收集和分析数据并起草稿件,JQL和XYD构建一系列基于rcasbp的重组病毒和基于pcaggs的重组gp85蛋白。所有作者都阅读并批准了最终的手稿。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
伦理批准并同意参与gydF4y2Ba
本研究所有实验均经华南农业大学生物安全委员会批准,符合中国相关法律法规,实验室条件合格(如ABSL-2、ABSL-3)。欲了解更多信息,请查看附加文件gydF4y2Ba2gydF4y2Ba.gydF4y2Ba
发表同意书gydF4y2Ba
不适用。gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者声明没有利益竞争。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Ba
伟德体育在线施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。gydF4y2Ba
补充信息gydF4y2Ba
附加文件1:图S1。gydF4y2Ba
利用PyMOL软件分析ALV-A RSA gp85和ALV-K GDFX0602 gp85的空间结构。红色区域:hr1黄色区域:hr2紫色区域:vr3。gydF4y2Ba
附加文件2:gydF4y2Ba
生物安全声明。gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba.创作共用公共领域奉献弃权书(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)适用于本条所提供的资料,除非在资料的信用额度中另有说明。gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
陈俊,李俊,董旭。gydF4y2Baet al。gydF4y2BaALV-K env的199-205、269、319、321和324关键氨基酸位点导致ALV-K的复制能力弱于ALV-A。gydF4y2BaRetrovirologygydF4y2Ba19gydF4y2Ba, 19(2022)。https://doi.org/10.1186/s12977-022-00598-0gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s12977-022-00598-0gydF4y2Ba
关键字gydF4y2Ba
- 禽白血病病毒K亚群gydF4y2Ba
- EnvgydF4y2Ba
- 流域的受体gydF4y2Ba
- 重组嵌合体gydF4y2Ba
- 结合能力gydF4y2Ba