摘要
2019年新型冠状病毒病(COVID-19)在大流行的第一年就在全球感染了1亿多人。仅在美国就有超过50万人死亡,遏制大流行的前提是在全球范围内实现群体免疫。这意味着至少有70- 80%的人口必须对严重急性呼吸综合征冠状病毒2型(SARS-CoV-2)产生主动免疫,要么是因为以前感染过COVID-19,要么是因为接种过SARS-CoV-2疫苗。2020年12月,美国FDA通过紧急使用授权批准了前两种疫苗。这些疫苗基于mRNA疫苗平台,由辉瑞/BioNTech和Moderna共同开发。已发表的安全性和有效性试验报告了两次间隔剂量后的94% - 95%的高有效率,同时副作用有限,不良反应率低。疫苗开发的快速步伐和潜在的长期不良反应的不确定性使全球社会对mRNA疫苗产生了一定程度的犹豫。成功的疫苗接种运动取决于在适当的储存条件下广泛获得疫苗,部署足够数量的疫苗接种人员,以及民众愿意接种疫苗。因此,澄清与疫苗安全性有关的客观数据非常重要,包括已知的副作用和潜在的不良反应。本综述旨在提供有关SARS-CoV-2 mRNA疫苗安全性和有效性的最新科学现状。
背景
严重急性呼吸综合征-2病毒(SARS-CoV-2)是一种高度传染性呼吸道病毒,是目前全球2019年冠状病毒病(COVID-19)大流行的原因[1].目前,美国已经有超过3000万例COVID-19病例,在起草本文时,据报道有超过50万人死亡(www.cdc.gov).由于此次大流行的严重影响,科学地关注COVID-19疫苗开发已成为抗击该病毒的全球举措的前沿[2,3.,4].
疫苗的历史
建立疫苗是降低全球感染率和发病率的一项重要手段[5].疫苗接种的最初前提可以追溯到11世纪,即人类接触少量某种疾病,以提高对随后接触大量相同病原体的保护和免疫力[6].这在中国文献中首次有记载,即摄入少量毒药可以防止大剂量毒药的潜在死亡[7,8].路易·巴斯德在19世纪进行的研究进一步推进了疫苗接种的这些基本原则,结果发现将减毒病原体接种到受试者体内,以防止暴露于同一病原体时可能发生的感染[9].这一发现的一个重要方面是能够减弱病原体[10].这提供了注射病原体的能力,可产生有限的不良影响,引发免疫反应以形成保护,并防止疾病的收缩[11].
疫苗的开发一直持续到今天,虽然基于同样的原理,但抗原引入的方法已经发展了[12].巴斯德介绍的疫苗平台仍然与当前的疫苗研究高度相关,但现代有一系列新的疫苗平台可用[13].目前的疫苗平台包括:减毒活疫苗、灭活疫苗、类毒素疫苗、亚基疫苗、重组疫苗、多糖疫苗、结合疫苗和最新的平台;信使rna疫苗[14].所有这些疫苗接种机制最终都源自数百年前发现的基本原理[15].表中列出了疫苗开发的历史里程碑1.
mRNA疫苗平台
自21世纪初以来,mRNA疫苗的概念一直具有科学意义,然而,辉瑞/BioNTech和Moderna COVID-19疫苗的开发首次大规模应用了这种类型的接种[16].以前的平台利用了类似的疫苗接种机制,通过将受试者暴露于病原体或病原体的特定方面,如糖或衣壳。然而,信使rna疫苗提供了一种提供病原体免疫的新方法[17].信使RNA疫苗提供病原体相关抗原的遗传密码。然后这个信使RNA被宿主翻译成来自被研究病原体的相关蛋白质。换句话说,疫苗为细胞提供了构建蛋白质的蓝图[18].这一过程允许宿主对构建的外源蛋白产生免疫反应[18].然后,细胞在蛋白质发育后破坏蓝图,即注入的mRNA [18].mRNA的半衰期很短,只在人体组织中停留几天[19].免疫反应引起抗体的产生,使身体对特定病原体产生一定程度的免疫力[20.].通过COVID-19的自然收缩也会产生类似的免疫反应,但使用mRNA疫苗,身体将不需要忍受实际暴露于病原体,同时仍会产生免疫反应[21].一个常见的误解是,mRNA疫苗代表了一种为对抗COVID-19而开发的新疫苗平台。然而,多年来,针对其他病原体,如埃博拉病毒、寨卡病毒、狂犬病、流感和巨细胞病毒,已经设计和开发了mRNA疫苗[22,23].
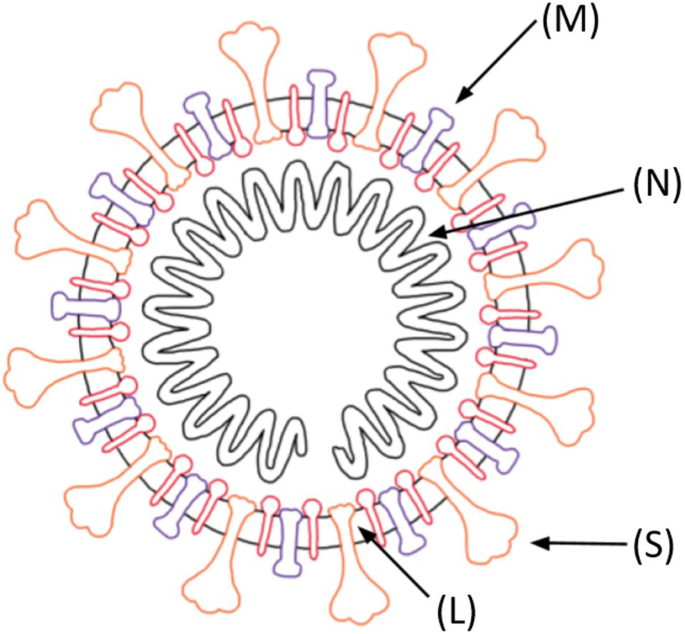
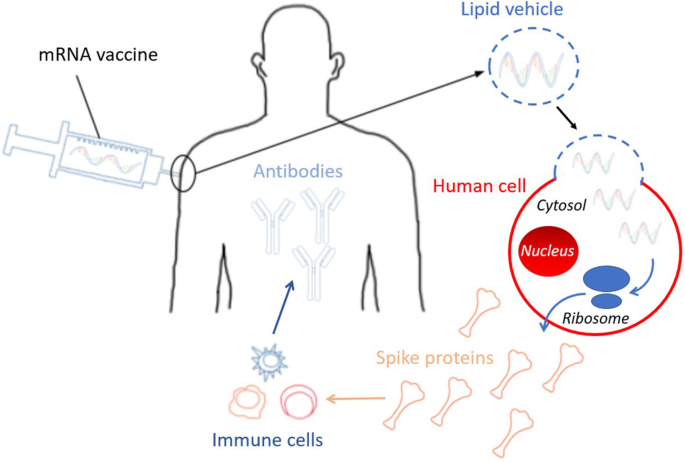
当特异性地将mRNA疫苗平台应用于SARS-CoV-2时(图2)。1),了解特定的mRNA疫苗机制至关重要[24,25].以SARS-CoV-2为例,mRNA为COVID-19的刺突蛋白提供了遗传蓝图[26].具体而言,该疫苗是一种脂质纳米颗粒包封的mRNA疫苗,编码灌注稳定的全长刺突蛋白[2].脂质纳米颗粒,这是最常用的载体在活的有机体内RNA传递-保护mRNA免于降解,并介导内吞作用和内体逃逸[27].带正电荷的脂质纳米颗粒有助于将mRNA带到带负电荷的细胞膜,促进随后的细胞质内吞作用。mRNA要被转录,它必须逃离脂质纳米颗粒和核内体[28].免疫细胞随后在其表面显示刺突蛋白,并分解指令以构建由mRNA疫苗提供的刺突蛋白(图2)。2).免疫系统识别出这种蛋白质是外来的,并指示免疫系统产生针对COVID-19的抗体[24].这种机制为免疫系统提供保护,防止随后的感染,并绕过将实际病原体注射到体内的风险,无论是活的还是减毒的[5,7].
临床试验
自大流行开始以来,开发抗击COVID-19的疫苗一直至关重要[2].本综述的范围主要集中在Moderna和Pfizer/ BioNTech mRNA疫苗的安全性和有效性。辉瑞/BioNTech疫苗(BNT162b2)试验报告该疫苗的有效率为95% [29].这项试验总共招募了43548名成年志愿者,其中一半的参与者注射了安慰剂,另一半则注射了真正的疫苗。两组均有170人感染了COVID-19:其中8人属于疫苗组,其他162人属于安慰剂组。170例病例中有10例为重症病例,10例重症病例中有9例是安慰剂组的参与者[29].
Moderna疫苗(mRNA-1273)试验招募了30420名志愿者,其中一半参与者接种了疫苗,另一半接受了安慰剂[30.].在安慰剂组的15210名参与者中,185人感染了COVID-19,而疫苗组的11人感染了病毒。这些结果表明疫苗的有效率为94.1% [30.].在撰写本文时,COVID-19 mRNA疫苗对新型SARS-CoV-2突变株的有效性仍然未知,有待进一步研究。
安全注意事项
常见副作用
截至本文发表,正在进行的Moderna和Pfzier/BioNTech mRNA疫苗三期临床试验均未发现严重副作用[29,30.].轻微的局部副作用,包括发热、疼痛、红肿,疫苗比安慰剂(生理盐水)更常见[29,30.].其他全身副作用,包括疲劳、发烧、头痛、肌痛和关节痛,接种疫苗比安慰剂更常发生,大多数发生在接种后1至2天内[29,30.].在两项试验中,安慰剂组和疫苗组均同样报告了超敏反应不良副作用[31].据报道,mRNA疫苗的两剂方案可使16岁及以上人群对COVID-19的保护率达到94- 95%,在中位数2个月的时间内,疫苗的安全性与其他病毒疫苗相当[29,30.].
局部反应
初步发表的针对COVID-19的mRNA疫苗试验报告,与接受安慰剂的对照组相比,疫苗接受者的局部反应更多[29,30.].最常见的局部反应是接种疫苗后一周内注射部位疼痛。大部分局部反应轻微至中度,持续24至48小时[29,30.].在所有年龄组中,只有不到1%的参与者报告了严重疼痛,而55岁以上的参与者报告的任何类型的疼痛都不太常见[29,30.].
系统性反应
在同样的试验中,较年轻的疫苗接种者(16至55岁之间)比较年长的疫苗接种者(55岁以上)更频繁地报告全身事件[29,30.].与老年人群相比,这种较高的系统性事件发生率可能代表了年轻人更强大的免疫反应。与第一剂疫苗相比,第二剂疫苗报告了更多的副作用[29,30.].在第二次注射后,疲劳和头痛是最常见的副作用。然而,安慰剂组的大量对照组患者也报告了这些副作用[29,30.].除疲劳(3.8%)和头痛(2.0%)外,接种第一剂疫苗后全身副作用发生率低于1%,接种第二剂疫苗后全身副作用发生率低于2% [29,30.].在第一次注射后,只有0.2%的疫苗接受者和0.1%的安慰剂接受者报告发烧至40°C。在第二次注射后,0.8%的疫苗接受者和0.1%的安慰剂接受者再次发烧至40°C。疫苗组和安慰剂组各有两个人报告温度高于40°C。全身性事件,包括寒战及发热,在接种疫苗后24至48小时内消退[29,30.].
不良事件
与安慰剂组(12%)相比,接种疫苗组(27%)报告的不良事件更常见[29,30.].这些比率在很大程度上归因于在疫苗组中更频繁报道的短暂反应原性事件的变化。4名疫苗接种者报告了相关的严重不良事件(疫苗接种相关的肩部损伤、右腋窝淋巴结病变、阵发性室性心律失常和右腿感觉异常)。两名疫苗接受者死亡(一人死于动脉硬化,一人死于心脏骤停),而安慰剂组有四人死亡(一人死于出血性中风,一人死于心肌梗死,两人死于不明原因)。调查人员没有发现任何一例死亡与疫苗或安慰剂有关。此外,在本报告所述期间,未观察到与covid -19相关的死亡病例,也未满足停止规则标准。接种第二剂疫苗后,安全监测计划继续进行2年[29,30.].最近的数据表明,由辉瑞/BioNTech疫苗引起的过敏反应发生率约为1:20 000人[29].这一比率与大多数疫苗每百万分之一的比率形成鲜明对比。致病抗原和相关机制仍在调查中,尽管聚乙二醇被认为是潜在的罪魁祸首[32].辉瑞/BioNTech过敏反应事件对肾上腺素治疗有反应,尽管许多病例需要一次以上的肾上腺素剂量[33].辉瑞/BioNtech BNT162b2和Moderna mRNA-1273疫苗均有相关的口面和眼面副作用[34].这些观察到的不良事件很少见(约1:10 00),包括面部、唇部和舌部水肿[34].急性、暂时性、单侧周围性面瘫(贝尔氏麻痹,特发性第七脑神经麻痹)也有报道[34].该不良事件涉及先前接受面部美容注射的个体[34]或已知有贝尔氏麻痹病史的人[35].常见副作用、主要不良事件和推测的并发症的摘要见表2.
应承担的风险人群
老年人
在55岁以上人群中,与疫苗相关的最常见副作用是发冷、头痛、注射部位疼痛、疲劳和肌痛[36].据报告,接种第二剂疫苗后,局部和全身反应发生率较高[29,30.].症状通常在接种疫苗后24小时内出现,并迅速消退。3名参与者报告了持续5至7天的轻度红斑。一名参与者报告了疫苗接种后第3天开始的持续5天的肌痛。在第二次剂量后,仅发生了两例被归类为严重的全身不良事件:25 μ g剂量亚组中,一名56 - 70岁的参与者报告发烧,100 μ g剂量亚组中另一名年龄超过70岁的参与者报告疲劳[37].在报告的71例不良事件中,研究人员认为有17例与疫苗有关。除了一名56 - 70岁25µg剂量亚组参与者报告的食欲下降的“中度”病例外,所有这些不良事件都被归类为轻度。一例严重低血糖(葡萄糖水平,每分升50毫克;参考范围,65至99毫克/分升),由56至70岁的受试者在禁食和从事剧烈运动后100微克剂量亚组。研究人员认为这种并发症与疫苗无关[37].
孕妇
关于在怀孕期间使用辉瑞/BioNTech和Moderna COVID-19 mRNA疫苗的数据有限。美国疾病控制中心(CDC)报告称,在2020年3月1日至8月22日期间,因COVID-19住院的育龄妇女(15-49岁)中约有25%是孕妇,孕妇往往比非孕妇更需要机械通气[38].美国疾病控制与预防中心还指出,怀孕期间感染COVID-19的女性早产风险更大[38].在已知妊娠期的SARS-CoV-2感染妇女所生婴儿中,12.9%为早产(< 37周),而全国估计为10.2% [39].内分泌、免疫和物理妊娠变化使孕妇及其胎儿患传染病引起的严重并发症的风险增加,这并非COVID-19所独有[40].目前通过紧急使用授权(EUA)批准的辉瑞/BioNtech和Moderna COVID-19 mRNA疫苗不使用佐剂,也不是活疫苗[29,30.].因此,美国妇产科医师学会(ACOG)和母胎医学学会(SMFM)建议孕妇和哺乳妇女不应拒绝接种这些疫苗[41].然而,迄今为止尚未对已批准的COVID-19疫苗的有效性、免疫原性、反应原性或对孕妇的安全性进行测试[41].Pfizer-BioNtech mRNA BNT162b2疫苗的结果显示,对疫苗有广泛的免疫应答,包括刺激男性和非孕妇的中和抗体应答、刺激CD4 +细胞和效应记忆CD8 + T细胞的生长[42].目前尚不清楚孕妇是否也会出现同样的免疫反应。这些数据引起了人们的担忧,因为良好的围产期结局在很大程度上取决于扩增的辅助性T细胞2型和调节性T细胞活性以及Th1反应的降低。妊娠期间CD4 + T细胞反应的改变与不利的妊娠结局有关,如早产和胎儿丢失[43].此外,一些证据表明,具有变异CD4 + T细胞反应的母亲所生的婴儿可能遭受持久的不良后果[44].
到目前为止,FDA还没有发布任何关于在孕妇中使用COVID-19疫苗的明确指南。相反,FDA在EUA信函和提供给医疗保健提供商的个别疫苗情况说明书中提到了孕妇。Moderna和辉瑞/BioNTech疫苗的EUA信中都包含要求授权后进行观察性研究的条款,并将孕妇标记为这些研究的“感兴趣人群”,理由是缺乏关于怀孕期间疫苗风险的数据。Moderna疫苗说明书特别提到了在雌性大鼠中进行的生殖毒性研究;评估了对胎儿发育、女性生育能力和早期后代发育的不良影响,未观察到不良结果。Moderna疫苗还设有妊娠暴露登记,旨在监测在妊娠期间接种疫苗的妇女的妊娠结局。迄今为止,Moderna和辉瑞都没有发布关于其疫苗和妊娠的指南或指南[41].尽管存在上述担忧,但最近的数据表明,“在怀孕期间诊断为SARS-CoV-2感染的妇女和未诊断为SARS-CoV-2感染的妇女中,早产、严重特征的先兆子痫和胎儿指征剖宫产的复合主要结局没有差异”(52名妇女[21%]对684名妇女[23%];相对风险,0.94;95% ci, 0.73-1.21;P= .64点)。感染SARS-CoV-2的妇女在怀孕期间也没有死产[45].
免疫功能不全的患者
目前的证据表明,Moderna和辉瑞/BioNTech疫苗都引起了强烈的体液反应,这是由于中和抗体的产生,以及通过诱导功能性和促炎性CD4 +和CD8 + T细胞和Th1细胞因子的表达而产生的强烈细胞反应[46].值得注意的是,最初的疫苗试验排除了免疫功能低下的患者,包括使用免疫抑制药物的患者和有自身免疫性疾病的患者[29,30.].这一人群需要特别考虑,因为感染是其中最常见的死亡原因之一。尽管如此,迄今为止,来自COVID-19风湿病登记的数据并未证明免疫功能受损患者COVID-19并发症的风险增加,服用中度或高剂量皮质类固醇的患者除外[47].除了COVID-19疫苗在这些患者中的有效性尚不确定之外,关于在使用免疫抑制剂的患者中接种疫苗,还有其他各种未回答的问题[46,47,48].已知接受免疫抑制治疗的患者对疫苗的免疫反应较弱,因此需要特别考虑COVID-19疫苗[42].由于该患者群体未被纳入初步试验,因此mRNA疫苗的免疫有效性仍未知[29,30.].医疗保健提供者可考虑在接种疫苗后进行免疫抑制治疗两周,直至未来的临床试验提供进一步的科学指导[47].对于Moderna和辉瑞/BioNTech疫苗,FDA为免疫功能低下的患者提供的唯一建议是疫苗反应缓和的可能性。美国疾病控制与预防中心指出,免疫功能受损的患者如无接种疫苗禁忌症,可接种疫苗,但应告知他们疫苗在免疫功能受损人群中的疗效和安全性尚不确定。[47].
讨论
尽管存在个体免疫状况和环境因素,但现有证据似乎有利于大多数人接种Moderna或辉瑞/BioNTech mRNA疫苗。疫苗接种计划的有效性取决于令人信服的疗效和安全性数据,再加上公众的普遍接受和接种[49].然而,在美国,疫苗犹豫仍然是一个值得注意的挑战[50].这种犹豫很大程度上源于相对较短的临床试验过程;尽管时间紧迫,但患者和提供者应记住,这些疫苗与以前的疫苗一样,都经过了适当的尽职调查。疾控中心还将继续密切监测这些疫苗的安全性和有效性。此外,美国联邦政府和工业界伙伴在疫苗批准前提前建造了疫苗生产设施。通常,疫苗制造商在第三阶段完成之前不会建造此类设施[51].
疫苗犹豫症被描述为"对疫苗接种缺乏信心和/或对疫苗接种感到自满",可能导致延迟或不接种疫苗,尽管有可获得的服务[50].特别是COVID-19疫苗的快速疫苗开发时间表,再加上社会政治格局的高度分化,可能会进一步损害疫苗接种信心,加剧对疫苗接种的自满情绪[50].在特殊人群(如养老院居民)中接种疫苗后,新发COVID-19感染率显著下降,凸显了广泛免疫的重要性。实施旨在改变行为的全面循证努力对于解决持续的疫苗犹豫是必要的。最近的研究显示,相当大比例的公众对疫苗持犹豫态度和矛盾态度[52].这些调查进一步表明,在受COVID-19影响较大的人群中,包括失业人员和受教育程度较低的人群,以及包括非洲裔美国人和西班牙裔美国人在内的某些少数种族群体中,疫苗犹豫更为明显[53,54].
为了解决疫苗犹豫问题并加强COVID-19疫苗的采用,必须实施多层次、基于证据的方法。它们包括来自行为科学、传播科学、实施科学和社会科学的循证举措,可以指导组织、关系和个人层面的临床项目,以支持公共卫生举措并挑战COVID-19疫苗犹豫不决[50].重要的疫苗教育平台包括;网站、电视、学校教育节目和疫苗教育计划为技术联系有限的地区提供服务。增加疫苗采用的有效策略包括在以下地区实施疫苗接种计划:学校和大学、妇幼项目以及地理上距离疫苗接种中心较近的贫困地区[55].尽管有人指出,儿童发生不良反应的风险较低,但在这一人群中接种疫苗对于限制COVID-19的传播和实现群体免疫仍然至关重要。医疗保健提供者的认可已被证明导致更多地采用各种预防性保健活动,包括接种疫苗。医疗保健专业人员被认为是最值得信赖的信息来源,特别是在COVID-19方面。卫生保健提供者提出的明确而坚定的建议可能会减轻对安全性的担忧,并促进疫苗的采用[56].证据表明,在没有其他举措的情况下,个人层面的战略在很大程度上仍然无效。然而,当作为社区和人际行动的辅助手段使用时,个人方法可以提高疫苗接种率,并加强旨在减少犹豫的行动[57].此外,提供者必须认识到疫苗在个人和人群层面预防COVID-19的关键作用。开发具有不同剂量时间表和储存需求的各种疫苗,突出了有效和一致的沟通和后勤标准的必要性。因此,医疗保健提供者必须具备培训和资源,以便提出强有力的建议和处理疫苗犹豫问题[50].制定和分发一致的、具有文化敏感性的、直截了当的患者教育材料,配合其他循证战略,可提高疫苗接种率[58].这一策略可以通过利用传播科学数据来支持,例如积极框架的信息,并呼吁利他主义和亲社会行为来增加采用[59].
值得注意的是,凯撒家庭基金会最近进行的一项调查发现,29%的医疗保健提供者自己对接种COVID-19疫苗表示犹豫。同一项调查发现,在普通公众中,报告说他们“绝对不会接种疫苗”的群体可能是最难以通过最传统的公共卫生手段接触到的群体。在这组人中,至少一半的人认为只有两名使者是值得信赖的消息来源:他们的个人医疗保健提供者(59%)和前总统特朗普(56%)。这些发现表明,个人卫生保健提供者的认可和支持可能是向这一群体提供可靠和及时的疫苗信息的唯一途径之一[60].
实际的限制迫使组织从现有的基于证据的方法中进行选择,以确定在其特定环境和环境中可实现和充分的战略。因此,必须选择和定制旨在改善COVID-19疫苗接种的举措,以符合临床环境的具体需求和资源,并解决公认的采用障碍。因此,医疗保健组织必须评估当地情况,以了解相关的障碍和资源。此外,在迭代评估方法中构建计划可以帮助随着时间的推移有效地识别和修改适当的策略。
结论
目前的数据表明,目前批准的基于mrna的COVID-19疫苗对绝大多数人群是安全有效的。此外,广泛接种疫苗对于实现群体免疫至关重要;这是减少未来COVID-19感染激增的重要因素。确保公众充分接受COVID-19疫苗接种,将涉及关注对大流行感到厌倦的人群日益增加的疫苗犹豫。联邦、州、市和组织各级的循证方法对于改善疫苗接种工作和减少犹豫是必要的。教育公众了解当前和即将推出的疫苗的安全性,对公共卫生以及正在进行和未来的大规模疫苗接种举措具有至关重要的意义。
数据和材料的可用性
如需资料,请与作者联系。
改变历史
2021年5月18日
参考文献
魏志刚,李志刚,李志刚,李志刚。2019冠状病毒病(COVID-19)的病理生理学、传播、诊断和治疗综述《美国医学协会杂志》上。2020, 324(8): 782 - 93。
Vabret N. SARS-CoV-2 mRNA疫苗的临床前数据。免疫免疫学杂志2020;20(8):461。
Ahammad I, Lira SS.新型SARS-CoV-2 mRNA疫苗的设计:免疫信息学方法。中国生物医学杂志,2010;
拉赫曼·IU,阿里·N,伊贾兹·F,阿夫扎尔·A,阿卜杜勒·阿拉EF。COVID-19——开发和使用疫苗的重要考虑因素。Hum Vaccin Immunother, 2020:1-2。
Lombard M, Pastoret PP, Moulin AM。疫苗和接种的简要历史。科学通报,2007;26(1):29-48。
普罗金SA。疫苗:过去、现在和未来。Nat Med. 2005;11(4增刊):S5-11。
普罗金SA。疫苗:四世纪。临床疫苗免疫。2009;16(12):1709-19。
哈吉·侯赛因一世,Chams N, Chams S, El Sayegh S, Badran R, Raad M, Gerges-Geagea A, Leone A, Jurjus A.几个世纪以来的疫苗:全球卫生的主要基石。《前线公共卫生》2015;3:269。
比格斯点。戈登纪念讲座。疫苗和疫苗接种——过去、现在和未来。家禽科学1990;31(1):3-22。
达文波特调频。流感病毒灭活疫苗。过去,现在和未来。中国气象杂志。1961;832(2)Pt): 146-56。
Plotkin SA, Rees J.疫苗:面对免疫学前景的复杂问题。专家评论疫苗。2014;13(8):939-41。
布莱克尼AK,叶S,吉尔AJ。自扩增mRNA疫苗研究进展。疫苗(巴塞尔)。2021; 9(2): 97。
普罗金SA。疫苗诱导保护的免疫学相关研究进展。疫苗。2020;38(9):2250 - 7。
基于合成信使rna的疫苗:从鄙视到炒作。病毒。2021;13(2):270。
Piret J, Boivin G.历史上的流行病。前沿微生物。2020;11:631736。
何伟,高敏,李峰,李铮,张晓青,徐旭:下一代疫苗:纳米颗粒介导的DNA和mRNA传递。Adv健康线2021:e2001812。
徐松,杨凯,李锐,张磊。mRNA疫苗时代机制、药物平台及临床展望。中华分子生物学杂志,2020;21(18):6582。
Van Lint S, Heirman C, Thielemans K, Breckpot K. mRNA:从蛋白质生产的化学蓝图到现成的治疗方法。中华免疫杂志,2013;9(2):265-74。
李文杰,李志强,李志强。开发mrna疫苗技术。中国生物医学工程学报。2012;9(11):1319-30。
Gergen J, Petsch B:基于mrna的疫苗和作用模式。Curr Top Microbiol Immunol 2021[2月17日,在线印刷前]。
陆陆J, G,谭年代,夏J,熊H,于X,气Q,于X,李L, Yu H,等。一种编码SARS-CoV-2病毒样颗粒的COVID-19 mRNA疫苗在小鼠体内诱导了强烈的抗病毒样免疫反应。Cell res 2020;30(10): 936-9。
梅耶M,黄娥,Yuzhakov O, Ramanathan P, Ciaramella G, Bukreyev A.改良的基于mrna的疫苗引起强烈的免疫反应,保护豚鼠免受埃博拉病毒病的感染。中华流行病学杂志,2018;26(3):451 - 551。
Rauch S, Jasny E, Schmidt KE, Petsch B:对抗疫情的新疫苗技术。2018年FrontImmunol 9:1963。
林纳雷斯-费尔南德斯,拉克鲁瓦C, Exposito JY, Verrier B.定制mRNA疫苗平衡先天/适应性免疫反应。趋势Mol医学2020;26(3):311-23。
Sandbrink JB, Shattock RJ。RNA疫苗:应对新出现的流行病的合适平台?免疫前沿。2020;11:608460。
张娜娜,李晓峰,邓玉青,赵辉,黄玉军,杨刚,黄文军,高鹏,周超,张仁仁,等。一种抗COVID-19的耐热mRNA疫苗。细胞学报。2020;182(5):1271-1283 e1216。
怀特海德KA,兰格R,安德森DG。打破障碍:siRNA递送的进展。新药品发现,2009;8(2):129-38。
Reichmuth AM, Oberli MA, Jaklenec A, Langer R, Blankschtein D.利用脂质纳米颗粒传递mRNA疫苗。中国医药科学,2016;7(5):319-34。
Polack FP, Thomas SJ, Kitchin N, Absalon J, Gurtman A, Lockhart S, Perez JL, Perez Marc G, Moreira ED, Zerbini C,等。BNT162b2 mRNA Covid-19疫苗的安全性和有效性。中华实用医学杂志,2015;29(3):344 - 344。
巴登LR, El Sahly HM, Essink B, Kotloff K, Frey S, Novak R, Diemert D, Spector SA, Rouphael N, Creech CB,等。mRNA-1273 SARS-CoV-2疫苗的有效性和安全性中华实用医学杂志,2015;26(5):344 - 344。
Castells MC, Phillips EJ。保持SARS-CoV-2疫苗的安全性。中华实用医学杂志,2015;29(7):344 - 344。
Caminati M, Guarnieri G, Senna G.谁真的有COVID-19疫苗过敏反应的风险?疫苗(巴塞尔)。2021; 9(1): 38。
Turner PJ, Ansotegui IJ, Campbell DE, Cardona V, Ebisawa M, El-Gamal Y, Fineman S, Geller M, Gonzalez-Estrada A, Greenberger PA,等。COVID-19疫苗相关过敏反应:世界过敏反应组织过敏反应委员会的声明。世界过敏器官杂志,2021;14(2):100517。
报告的COVID-19疫苗的口面不良反应:已知和未知。《口腔病理医学》,2021年2月1日,在线出版前。
赖晓玲,徐萍,刘安。有复发性贝尔麻痹病史的患者接种辉瑞新冠疫苗后出现贝尔麻痹。《脑行为与健康》,2021;13:100217。
康诺斯J,贝尔先生,马西J,库兹勒M,哈达德EK。免疫老化对SARS- CoV-2疫苗研制的影响Geroscience》2021。在线先于印刷。
Anderson EJ, Rouphael NG, Widge AT, Jackson LA, Roberts PC, Makhene M, Chappell JD, Denison MR, Stevens LJ, Pruijssers AJ,等。SARS-CoV-2 mRNA-1273疫苗在老年人中的安全性和免疫原性中华实用医学杂志,2015;29(3):344 - 344。
Delahoy MJ, Whitaker M, O 'Halloran A, Chai SJ, Kirley PD, Alden N, Kawasaki B, Meek J, Yousey-Hindes K, Anderson EJ,等。2020年3月1日至8月22日,13个州经实验室确诊的COVID-19 - COVID-NET住院孕妇的特征及孕产妇和分娩结局。MMWR Morb Mortal Wkly代表2020;69(38):1347-54。
Woodworth KR, Olsen EO, Neelam V, Lewis EL, Galang RR, Oduyebo T, Aveni K, Yazdy MM, Harvey E, Longcore ND,等。实验室确认的怀孕期间SARS-CoV-2感染后的出生和婴儿结局- SET-NET, 16个司法管辖区,2020年3月29日至10月14日。MMWR Morb Mortal Wkly代表2020;69(44):1635-40。
怀孕与感染:利用疾病发病机制为疫苗策略提供信息。NPJ疫苗,2018;3:6。
Klein SL, Creisher PS, Burd I.有必要对怀孕女性进行COVID-19疫苗检测。中国临床医学杂志,2011;29(5):374 - 374。
Walsh EE, Frenck RW, Falsey AR Jr., Kitchin N, Absalon J, Gurtman A, Lockhart S, Neuzil K, Mulligan MJ, Bailey R.两种基于rna的Covid-19候选疫苗的安全性和免疫原性。中华实用医学杂志,2015;29(3):349 - 349。
Saito S, Nakashima A, Shima T, Ito M. Th1/Th2/Th17与妊娠调节性T细胞范式。中华流行病学杂志,2010;29(6):531 - 531。
Helmo FR, Alves EAR, Moreira RAA, Severino VO, Rocha LP, Monteiro M, Reis MAD, Etchebehere RM, Machado JR, Correa RRM。宫内感染、免疫系统和早产。中华母胎新生儿医学杂志,2018;31(9):1227-33。
Adhikari EH, Moreno W, Zofkie AC, MacDonald L, McIntire DD, Collins RRJ, Spong CY.有和没有严重急性呼吸综合征冠状病毒感染的妇女的妊娠结局。美国医学会网络公开赛。2020;3(11):e2029256。
Sahin U, Muik A, Derhovanessian E, Vogler I, Kranz LM, Vormehr M, Baum A, Pascal K, Quandt J, Maurus D,等。COVID-19疫苗BNT162b1引发人抗体和TH1 T细胞应答。大自然。2020;586(7830):594 - 9。
Sonani B, Aslam F, Goyal A, Patel J, Bansal P.免疫功能低下患者COVID-19疫苗接种。临床风湿病杂志。2021;40(2):797-8。
Jackson LA, Anderson EJ, Rouphael NG, Roberts PC, Makhene M, Coler RN, McCullough MP, Chappell JD, Denison MR, Stevens LJ,等。SARS-CoV-2 mRNA疫苗初步报告。中华实用医学杂志,2015;29(3):344 - 344。
Cordero DA:重建公众信任:明确应对COVID-19疫苗犹豫困境。J公共卫生(Oxf) 2021年。[2月5日,在线印刷前]。
Dror AA, Eisenbach N, Taiber S, Morozov NG, Mizrachi M, Zigron A, Srouji S, Sela E.疫苗犹豫:抗击COVID-19的下一个挑战。中国流行病学杂志,2020;35(8):775-9。
Lurie N, Saville M, Hatchett R, Halton J.以大流行的速度开发Covid-19疫苗。中华口腔医学杂志,2015;29(4):369 - 369。
Kreps S, Prasad S, Brownstein JS, Hswen Y, Garibaldi BT, Zhang B, Kriner DL。与美国成年人接受COVID-19疫苗接种可能性相关的因素美国医学会网络公开赛。2020;3(10):e2025594。
Malik AA, McFadden SM, Elharake J, Omer SB.美国COVID-19疫苗接受度的决定因素。EClinicalMedicine。2020; 26:100495。
Reiter PL, Pennell ML, Katz ML.美国成年人中COVID-19疫苗的可接受性:有多少人会接种疫苗?疫苗。2020;38(42):6500 - 7。
Hardt K, Bonanni P, King S, Santos JI, El-Hodhod M, Zimet GD, Preiss S.疫苗策略:优化结果。疫苗。2016;34(52):6691 - 9。
Brewer NT, Hall ME, Malo TL, Gilkey MB, Quinn B, la罗尔斯C.提高HPV疫苗接种覆盖率的公告与对话:一项随机试验儿科。2017;139 (1):e20161764。
Jacobson RM, Agunwamba AA, St Sauver JL, Finney Rutten LJ。推进人类乳头瘤病毒疫苗接种的最有效和最有前途的人口卫生战略。专家评论疫苗。2016;15(2):257-69。
李国强,李国强,李国强。COVID-19疫苗接种计划。《美国医学协会杂志》上。2020; 323(24): 2458 - 9。
周ws, Budenz A.在COVID-19疫苗传播中考虑情感:解决疫苗犹豫和培养疫苗信心。卫生公共,2020;35(14):1718-22。
凯撒家庭基金会:COVID-19疫苗监测:2020年12月。https://www.kff.org/coronavirus-covid-19/report/kff-covid-19-vaccine-monitor-december-2020/.2021年4月5日访问。
资金
这篇社论没有外部资金来源。
作者信息
作者及隶属关系
贡献
这篇综述由PA和VPS共同设计撰写。副总裁起草了数字内容。在提交之前,两位作者都阅读并批准了手稿的最终版本。
相应的作者
道德声明
伦理批准并同意参与
不适用(审查)。
FDA批准
不适用(审查)。
发表同意书
不适用(审查)。
相互竞争的利益
这篇社论不存在任何经济利益冲突。
作者声明,这篇综述文章的内容仅代表他们的个人观点,不反映任何医疗保健实体的官方立场,包括医院和相关设施、医疗保健系统或专业协会和机构。
额外的信息
出版商的注意
伟德体育在线施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
这篇文章的原始在线版本进行了修改:注意到这篇文章的出版版本包含不正确的标题。正确的标题是“Covid-19 mRNA疫苗的安全性:综述”。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条所提供的资料,除非在资料的信用额度中另有说明。
关于本文
引用本文
Anand, P., Stahel,副总裁。Covid-19 mRNA疫苗的安全性:综述。病人安全外科15, 20(2021)。https://doi.org/10.1186/s13037-021-00291-9
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s13037-021-00291-9
关键字
- 冠状病毒
- 新型冠状病毒肺炎
- SARS-CoV-2
- 信使核糖核酸疫苗
- 疫苗安全