- 方法gydF4y2Ba
- 开放获取gydF4y2Ba
- 发表:gydF4y2Ba
利用田口法优化二维凝胶电泳方案gydF4y2Ba
蛋白质组学gydF4y2Ba体积gydF4y2Ba2gydF4y2Ba、物品编号:gydF4y2Ba6gydF4y2Ba(gydF4y2Ba2004gydF4y2Ba)gydF4y2Ba
摘要gydF4y2Ba
背景gydF4y2Ba
定量蛋白质组学分析传统上使用二维凝胶电泳(2DE)来分离和表征复杂的蛋白质混合物。与此方法相关的困难之一是等电聚焦(IEF)的蛋白质混合物的溶解。为了找到多组分IEF再水合缓冲液(RB)的最佳配方,我们采用了田口方法(一种广泛用于复杂工业过程稳健优化的方法),使用市供的固定化pH梯度(IPG)凝胶条确定了RB中洗涤剂、载体两性水解物和还原剂的最佳浓度。gydF4y2Ba
结果gydF4y2Ba
我们的优化提高了蛋白质的溶解度,提高了2D凝胶的分辨率和可重复性,使用了各种各样的样品。使用更新后的方案,我们通常在含有复杂蛋白质混合物的样品上检测到大约4倍多的多肽,这些蛋白质混合物在小格式2D凝胶上溶解。此外,可以分辨蛋白质的pI和大小范围也有了很大的提高。此外,随着样品装载和分辨率的提高,通过免疫印迹和质谱分析单个斑点揭示了多种染色质蛋白中先前未表征的转录后修饰。gydF4y2Ba
结论gydF4y2Ba
虽然优化的RB (oRB)是特定于我们使用的凝胶和分析方法,但我们使用的田口方法应该普遍适用于广泛的电泳和分析系统。gydF4y2Ba
背景gydF4y2Ba
在细胞周期进程中,不同的功能蛋白复合物与染色体DNA结合或分离[gydF4y2Ba1gydF4y2Ba,gydF4y2Ba2gydF4y2Ba]。我们已经采取了蛋白质组学策略来鉴定和表征在细胞周期的特定阶段与染色质结合的蛋白质,这些蛋白质来源于无细胞提取物gydF4y2Ba非洲爪蟾蜍gydF4y2Ba鸡蛋。二维凝胶电泳(2DE)和质谱(MS)的结合是这一分析的有力工具。gydF4y2Ba
de能够在一次分离过程中分解数千种蛋白质[gydF4y2Ba3.gydF4y2Ba]。固定化pH梯度(IPG)的发展,加上预制梯度聚丙烯酰胺凝胶和新的敏感荧光染色剂的引入,大大简化了2D凝胶的容量,灵敏度和可重复性。然而,这些最近的技术进步并没有消除与2DE分离蛋白质相关的一些困难。一个主要问题是等电聚焦(IEF)过程中蛋白质混合物的溶解,[gydF4y2Ba4gydF4y2Ba])。此外,2DE蛋白样品的还原和烷基化尚未完全优化[gydF4y2Ba5gydF4y2Ba,gydF4y2Ba6gydF4y2Ba]。因此,传统的蛋白质溶解和修饰方法不能可靠地为电泳提供最佳样品。gydF4y2Ba
蛋白质样品的良好增溶对高性能二维电泳至关重要,文献中报道了多种蛋白质增溶鸡尾酒。然而,我们还没有发现任何系统的研究报告关键成分的最佳浓度,可能是因为传统的优化方法非常耗时:依次改变所有可能的成分和组合是相当费力的。然而,有一些方法可以降低多参数矩阵的复杂性。田口法已经在工业过程的发展中被广泛应用了几十年,最近在生命科学领域找到了它的方法[gydF4y2Ba7gydF4y2Ba- - - - - -gydF4y2Ba10gydF4y2Ba]。传统的优化实验需要依次对每个变量进行独立测试。例如,测试四种不同反应组分在三种不同浓度水平下的作用和相互作用,将需要用81(即3)进行实验gydF4y2Ba4gydF4y2Ba)分开的反应。使用田口法,同样的任务在实验中只需要9个反应就可以完成。gydF4y2Ba
为了找到2DE的最优和最稳健的条件,我们采用了一种改进的田口方法[gydF4y2Ba9gydF4y2Ba]用于配制再水化缓冲液(RB),用于在IEF期间溶解和运行蛋白质混合物。我们还优化了样品还原和烷基化程序,传统上是在IEF步骤后进行的。由此产生的方案,大大提高了溶解度和分辨率的蛋白质混合物,从各种来源的2DE。gydF4y2Ba
结果gydF4y2Ba
选择优化RB的元件gydF4y2Ba
IEF的再水合缓冲液通常由杂合物(尿素、硫脲)、洗涤剂、还原剂和载体两性电解质组成(参见[gydF4y2Ba11gydF4y2Ba])。标准配方RB (sRB)含有8 M尿素[gydF4y2Ba12gydF4y2Ba]。然而,据报道,与单独使用8 M尿素相比,7 M尿素和2 M硫脲组合在固定pH梯度(IPG)下产生更好的2D图像[gydF4y2Ba13gydF4y2Ba],这一混合物被选为所有后续补液的基础。gydF4y2Ba
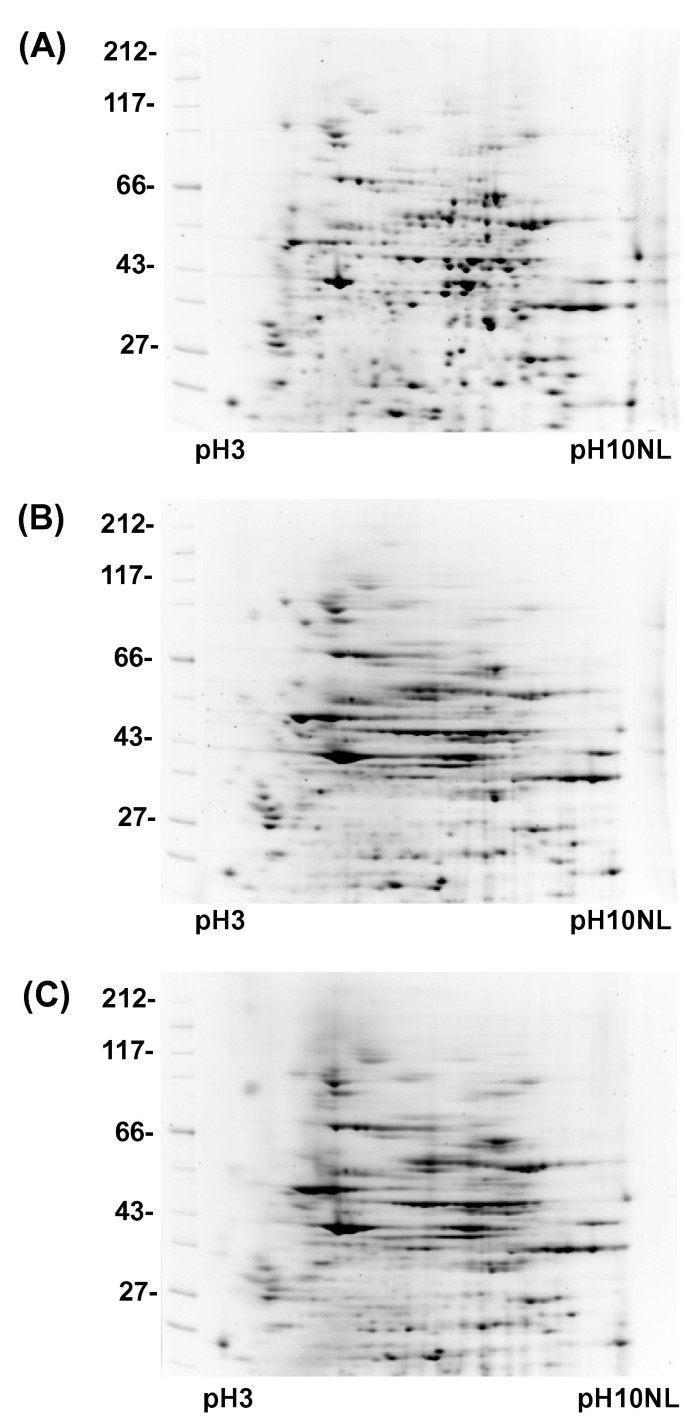
在IEF期间,蛋白质必须保持在完全还原状态。使用含有7 M尿素、2 M硫脲、4% CHAPS、0.5%两性水解物和20 mM DTT、2 mM TBP或10 mM TCEP的RB,在相同条件下测试三种还原剂:DTT、TBP和TCEP。50 μg微球gydF4y2Ba非洲爪蟾蜍gydF4y2Ba鸡蛋蛋白溶解在每个RB中,用2DE分离(图2)gydF4y2Ba1gydF4y2Ba).TBP和TCEP都降低了凝胶系统的聚焦。含DTT的RB的聚焦效果最好,因此连续的优化实验都选择该化合物。gydF4y2Ba
RBs中的洗涤剂有助于防止蛋白质相互作用和聚集,它们的性质对蛋白质的溶解至关重要。据报道,当在溶解鸡尾酒中加入不同的两性离子洗涤剂时,2D凝胶中检测到的蛋白质数量增加[gydF4y2Ba14gydF4y2Ba- - - - - -gydF4y2Ba16gydF4y2Ba]。因此,我们决定优化两种广泛使用的洗涤剂CHAPS和ASB14的组合[gydF4y2Ba17gydF4y2Ba,gydF4y2Ba18gydF4y2Ba]。gydF4y2Ba
载体两性水解物的加入增强了单个蛋白质在接近等电点时的溶解度。它们还在不影响其形状的情况下,在pH梯度上产生近似均匀的电导率。基于这些原因,我们还优化了增溶缓冲液中载体两性电解质的浓度。gydF4y2Ba
一个有代表性的优化实验中使用的组分浓度范围见表gydF4y2Ba1gydF4y2Ba.为了适应增加的载体两性电解质浓度,我们增加了电泳聚焦时间的长度。我们发现,在250 V下初始阶段30分钟后,在250 - 5500 V之间的一步快速斜坡梯度对于不同pH范围(pH 3-10, pH 4-7, pH 6-11)的7 cm IPG条都很有效。IEF步骤的持续时间取决于样品电导率和蛋白质负载,如果执行的总电压超过33000伏特小时,则产生良好的结果。由于电流被限制在50 μA/条,实际电压受到限制。这个总伏时值足以在具有最高载体两性电解质浓度的样品中完成聚焦。gydF4y2Ba
IEF后,制备聚焦凝胶用于SDS-PAGE,通常分别在含有DTT或IAA的两种平衡缓冲液中连续孵育。IAA用于烷基化还原半胱氨酸残基,并防止其在SDS-PAGE期间和之后的修饰。有证据表明,由于平衡溶液中的SDS干扰IAA烷基化,该方案不是很有效。可变烷基化会在二维凝胶上产生大量的人造斑点[gydF4y2Ba6gydF4y2Ba,gydF4y2Ba19gydF4y2Ba]。解决该问题的方法之一是在IEF前在增溶缓冲液中对蛋白质混合物进行烷基化处理。然而,RB中硫脲的存在阻碍了IAA对蛋白质的有效烷基化[gydF4y2Ba5gydF4y2Ba]。丙烯酰胺是一种可替代的烷基化剂,在质谱研究中广泛用于蛋白质修饰。为了烷基化半胱氨酸,我们将蛋白质颗粒在指定量的DTT存在下溶解2小时后,将RB中的丙烯酰胺浓度调整到60 mM。作为平衡程序的一部分,丙烯酰胺处理也在IEF后重复(见材料和方法)。gydF4y2Ba
田口优化RBgydF4y2Ba
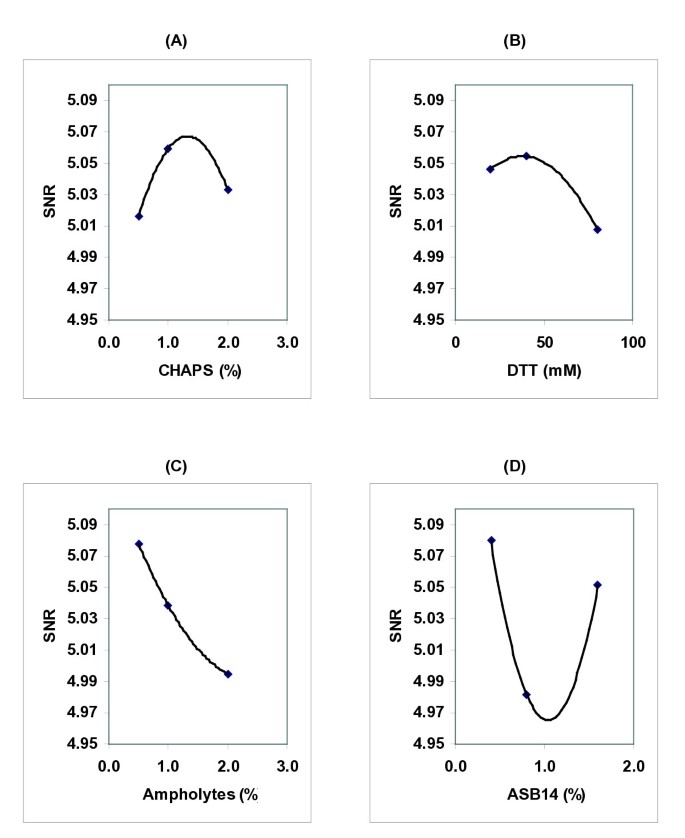
总量的等比gydF4y2Ba非洲爪蟾蜍gydF4y2Ba将含50 μg蛋白质的蛋提取物溶解在按表所示L9正交田口阵列配制的补液缓冲液中gydF4y2Ba1gydF4y2Ba然后被2DE隔开。所得的二维凝胶呈现出不同程度的聚焦和斑点呈现,特别是在凝胶的高分子量区域(图2)gydF4y2Ba2gydF4y2Ba).利用商业图像分析软件在每个凝胶中检测到的斑点数来计算田口氏值gydF4y2Ba信噪比gydF4y2Ba给定组件的每个级别的值。信噪比(gydF4y2Ba信噪比gydF4y2Ba)函数是性能的统计度量,同时考虑到平均值和变异性。最简单的形式是gydF4y2Ba信噪比gydF4y2Ba是均值(信号)与标准差(噪声)之比。虽然有很多不同的可能gydF4y2Ba信噪比gydF4y2Ba他们的简单解释总是一样的:越大gydF4y2Ba信噪比gydF4y2Ba越好。我们用的是田口牌gydF4y2Ba信噪比gydF4y2Ba函数最适用于期望优化工艺的最高收率的情况(见材料和方法)。gydF4y2Ba
数字gydF4y2Ba3.gydF4y2Ba展示了gydF4y2Ba信噪比gydF4y2Ba一个有代表性的优化实验图。对于本实验中的两个变量CHAPS和DTTgydF4y2Ba信噪比gydF4y2Ba函数在分析范围内有最大值和最大值gydF4y2Ba信噪比gydF4y2Ba在1.32% CHAPS和34 mM DTT下获得了5个(图2)gydF4y2Ba3、3 bgydF4y2Ba).相比之下,最高的gydF4y2Ba信噪比gydF4y2Ba两性电解质和ASB14的浓度最低(图gydF4y2Ba3 c, dgydF4y2Ba).gydF4y2Ba
为了分析我们方法的可重复性,我们重复实验三次,确定RB组分的最佳浓度为(1.20±0.18)% CHAPS,(43±12)mM DTT, 0.25%两性聚合物和0.4% ASB14(后两个是我们优化实验中使用的最低浓度)。gydF4y2Ba
的gydF4y2Ba信噪比gydF4y2Ba对ASB14的反应表明,可能有两种浓度增加了检测到的斑点数量。虽然我们选择检测到的光斑数作为RB性能的一般报告,但光斑圆度、条纹、光斑强度等其他因素也很重要。我们注意到,浓度略高于2.0%的ASB14诱导了显著的条纹和斑点形状变化,导致可检测斑点数量减少(见gydF4y2Ba附加文件1gydF4y2Ba).这表明ASBB14浓度接近2.0%时表现不佳,即微小的变化会对2DE产生有害影响。gydF4y2Ba
数字gydF4y2Ba3 cgydF4y2Ba和gydF4y2Ba3 dgydF4y2Ba提示低浓度的两性电解质和ASB14可以提高检测到的斑点数量。为了确定我们是否达到了这些成分的最佳浓度,我们分析了进一步减少这些成分的量是否会增加检测到的斑点数量并进一步提高2DE性能。使用浓度为0.1% - 0.4%的ASB14和0.05% - 0.25%的两性电解质,我们发现检测到的斑点数量没有显著变化(见gydF4y2Ba附加文件1gydF4y2Ba).因此,所选浓度的ASB14和两性电解质具有良好的性能,因此我们认为它们对于我们的2DE系统是优化的。gydF4y2Ba
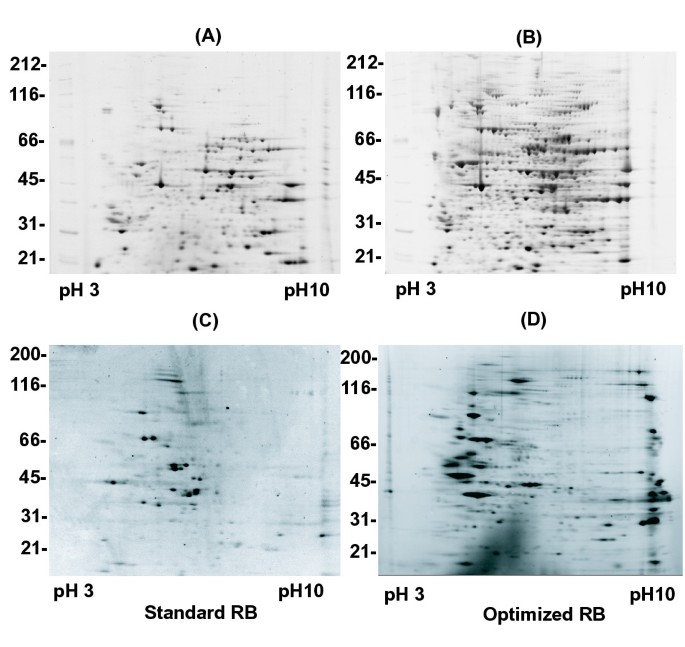
为了确认最佳ASB14浓度的选择是正确的,我们比较了2D凝胶的总量gydF4y2Ba非洲爪蟾蜍gydF4y2Ba用sRB (8 M尿素,4% CHAPS, 0.5%两性电解质,20 mM DTT)和oRB (7 M尿素,2 M硫脲,1.2% CHAPS, 0.4% ASB14, 0.25%两性电解质)分离的鸡蛋蛋白(图1)gydF4y2Ba4、4 bgydF4y2Ba).我们观察到oRB中检测到的斑点数(659个斑点)比标准缓冲成分(425个斑点)至少增加了50%。gydF4y2Ba
2 . sRB (A、C)和oRB (B、D)中两组不同蛋白的de,共50 μggydF4y2Ba非洲爪蟾蜍gydF4y2Ba鸡蛋提取物(A, B)或25 μg蛋白质,从有丝分裂染色体中洗脱,在有丝分裂中组装30分钟gydF4y2Ba非洲爪蟾蜍gydF4y2Ba鸡蛋提取液(C、D)分别溶于sRB (8 M尿素、4% CHAPS、0.5%两性电解质、20 mM DTT)和oRB (7 M尿素、2 M硫脲、1.2% CHAPS、0.4% ASB14、0.25%两性电解质、43 mM DTT、30 mM Tris)中,按照材料和方法进行分离。检测到的斑点:(A) 425, (B) 659, (C) 112, (D) 350。gydF4y2Ba
为了扩展我们的分析,我们用各种不同的样本评估了oRB的性能。染色质相关蛋白通常富含赖氨酸和精氨酸残基,介导与DNA的相互作用。当我们分析有丝分裂染色体蛋白的制备时[gydF4y2Ba20.gydF4y2Ba]使用sRB,我们注意到凝胶上检测到明显缺乏碱性和高分子量多肽(图2)gydF4y2Ba4摄氏度gydF4y2Ba).用oRB对染色体相关蛋白进行2DE分析,发现了大量的碱性蛋白,以及许多高分子量多肽,包括已知的高分子量染色体成分,如DNA拓扑异构酶II和凝聚蛋白[gydF4y2Ba21gydF4y2Ba)(图gydF4y2Ba4 dgydF4y2Ba).人类核仁蛋白、小鼠和虾线粒体的制备也有类似的表现(数据将在其他地方介绍)。因此,我们得出结论,我们优化的2DE方法可以成功地应用于各种各样的样品。gydF4y2Ba
翻译后修饰的2DE分析gydF4y2Ba
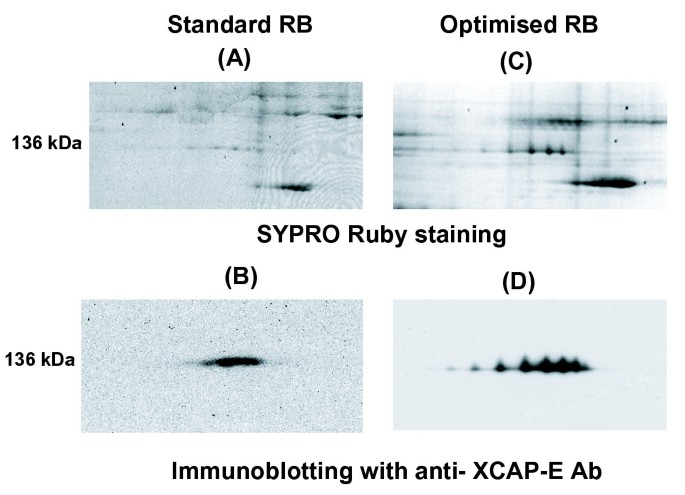
作为oRB使用的测试,我们描述了一系列众所周知的染色质蛋白,其功能在细胞周期中受到调节。我们改进的RB和修订的烷基化程序消除了高分子量蛋白质免疫印迹中的模糊性,并揭示了以前未描述的特异性修饰。XCAP-E (M.W. 140 kDa),凝缩蛋白的一种成分,凝缩蛋白是一种参与有丝分裂染色体组装的蛋白质复合体[gydF4y2Ba21gydF4y2Ba],在有丝分裂染色质洗脱液中进行分析。使用sRB,用SYPRO-Ruby染色或用抗xcap - e抗体免疫印迹的2D凝胶只产生一个涂片,提示溶解性差或聚焦(图2)gydF4y2Ba5、5 bgydF4y2Ba).通过oRB和丙烯酰胺烷基化将同一样品分解成7个不同的斑点(图2)gydF4y2Ba5 c, 5 dgydF4y2Ba).gydF4y2Ba
磷酸化是一种可以改变蛋白质pI的转录后修饰。先前的分析没有检测到XCAP-E的显著磷酸化,用磷酸酶处理这些样品没有产生2DE模式的变化(数据未显示)。我们目前正在探索这个明显特定的修改的本质。无论如何,优化的2DE方法可以揭示多种形式的蛋白质,甚至是传统上难以解决的相对较大的蛋白质。gydF4y2Ba
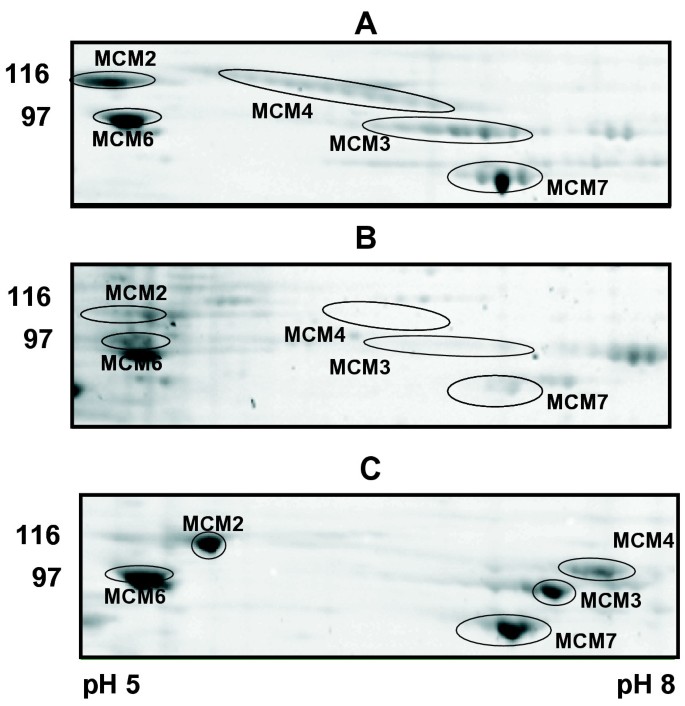
6个迷你染色体维持蛋白MCM2-7是复制许可系统的核心组成部分gydF4y2Ba非洲爪蟾蜍gydF4y2Ba染色质从有丝分裂末期释放出来,并在s期释放[gydF4y2Ba22gydF4y2Ba,gydF4y2Ba23gydF4y2Ba]。6个蛋白(m.w ~ 90-105 kDa)通过免疫印迹分析和MALDI-TOF从复制的染色质洗脱液中用2DE鉴定(数据未显示)。数字gydF4y2Ba6gydF4y2Ba显示MCM2, 3,4,6和7从复制中洗脱的2DE图像gydF4y2Ba非洲爪蟾蜍gydF4y2Ba对照实验中s期开始时的染色质(图2)gydF4y2Ba6gydF4y2Ba)和用双联蛋白处理的提取物,这可以防止MCM2-7装载到染色质上(图2)gydF4y2Ba6 bgydF4y2Ba) [gydF4y2Ba24gydF4y2Ba- - - - - -gydF4y2Ba26gydF4y2Ba]。λ-磷酸酶处理染色质洗脱液改变了MCM2、3和4对应的斑点分布,而MCM6和MCM7则基本保持不变(图2)gydF4y2Ba6摄氏度gydF4y2Ba).随着oRB提供的2DE分辨率的提高和样品处理,现在可以分析相对较大的蛋白质的翻译后修饰。gydF4y2Ba
讨论gydF4y2Ba
在这项研究中,我们成功地应用了改进的田口策略[gydF4y2Ba9gydF4y2Ba]来优化2DE的条件。采用基于正交L9阵列的田口实验设计确定了用于溶解蛋白质和在第一维运行IPG条的补液缓冲液的最佳配方(表1)gydF4y2Ba1gydF4y2Ba).gydF4y2Ba
我们观察到,超过100 kDa的蛋白质的分辨率在很大程度上取决于RB的组成,并且能够定义一个配方,为许多不同的样品提供显着改善的2DE性能。gydF4y2Ba
我们的数据表明,在复水合溶液中,不同洗涤剂的组合提高了蛋白质在2D凝胶上的溶解度和分辨率,尽管它们在混合物中的最佳浓度可能与单一洗涤剂溶液的最佳浓度有很大不同。此外,我们发现两性电解质的浓度对gydF4y2Ba信噪比gydF4y2Ba最小值0.25%产生的变异最大gydF4y2Ba信噪比gydF4y2Ba.然而,2D凝胶的不同区域反应不同,低于30 kDa的蛋白质在低两性电解质浓度下变得不太好分解。虽然进一步降低RB中两性电解质的浓度可能有利于高分子量蛋白质的分离,但只有在不需要分离低分子量蛋白质时才应该这样做。因此,我们的研究结果提出了一种显著提高2DE性能的方法,尽管我们不能指定一个单一的、普遍适用的电泳方案。gydF4y2Ba
为了验证oRB对不同蛋白质样品的适用性,我们应用标准和最佳条件分离重组染色体中洗脱的蛋白质组分gydF4y2Ba非洲爪蟾蜍gydF4y2Ba蛋精[gydF4y2Ba27gydF4y2Ba,gydF4y2Ba28gydF4y2Ba),全gydF4y2Ba非洲爪蟾蜍gydF4y2Ba蛋提取物、人核仁、小鼠和虾线粒体。在这些实验中产生的蛋白质量是有限的,样品的完全溶解是2DE和MS分析的一个重要问题。使用我们的oRB提高了2DE的分辨率和检测,并增加了我们可以为ms提供的蛋白质量。迄今为止,我们还没有观察到RB的组成与蛋白质来源的任何依赖。在我们的实验室里,我们使用一种凝胶和一种凝胶分析系统,我们现在有一个标准的RB组成,似乎适用于所有样品。gydF4y2Ba
我们优化的RB组成是通过使用特定的商业IPG凝胶条,预制SDS-PAGE凝胶和市售的2DE分析软件对观察到的斑点数量进行评分来确定的。很可能RB的最佳组成取决于这些参数中的每一个。例如,不同的2DE点查找算法可能会发现一组稍微不同的点,特别是在凝胶的极端区域,从而改变田口法确定的RB的最佳组成。此外,光斑数不能反映其他光斑特征,如强度、圆度等。使用单一参数进行性能评估是田口方法的基本原则,它的选择定义了优化实验的结果。因此,我们使用单一的性能标准作为oRB的主要决定因素,并结合其他特征来改进我们对oRB成分的选择。gydF4y2Ba
因此,我们最重要的发现是:(1)两性离子洗涤剂的组合,适当优化,可以提供更好的蛋白质溶解2DE;(2)必须优化载体两性电解质的浓度;(3)使用像田口法这样的技术可以快速且相对容易地确定2DE的RB组分的最佳组合。然而,对多组件系统中所有可能的组合进行系统评估是非常昂贵和耗时的,田口方法提供了对系统行为的系统评估,这是相当简单的。gydF4y2Ba
我们的结果也扩展了2DE在分析翻译后修饰方面的能力。对于随后的蛋白质质谱鉴定和翻译后修饰的表征,必须解决差异溶解度和聚焦的困难。oRB解决了这些问题,并大大提高了蛋白质异构体的分辨率,包括那些大于100 kDa的蛋白质异构体。gydF4y2Ba
结论gydF4y2Ba
我们已经成功地应用田口方法来优化2DE中使用的复水缓冲液的复杂组成。与经典设计相比,该策略大大减少了所需的实验次数,降低了成本,并大大改进了2DE RB。gydF4y2Ba
材料与方法gydF4y2Ba
化学品和设备gydF4y2Ba
Immobiline DryStrip 7 cm凝胶和不同pH范围的载体两性液购自Amersham Pharmacia Biotech UK Ltd。BioRad (Bio-Rad Laboratory Ltd, Hemel Hempsted, UK)的Protean IEF细胞用于等电聚焦分离。对于第二次面,聚焦后的IPG条带被加载到预制的Novex ZOOM凝胶(Invitrogen, Ltd, Paisley, UK)上,并按照制造商的指示与NuPage MOPS SDS缓冲液一起运行。gydF4y2Ba
两性离子洗涤剂ASB14来自Calbiochem (Merck Biosciences, Ltd, Nottingham UK)。AristaR级尿素和其他AnalaR级一般化学品购自BDH (Merck House, Poole, Dorset, UK)。根据生产建议使用SYPRO Ruby (Molecular Probes, Leiden, Netherlands)对1D和2D凝胶进行染色。染色凝胶的图像由富士成像仪LAS1000使用Dark Reader反照器(Clare Chemical Research, Inc., Dolores, USA)获取。利用Phoretix 2D Pro软件(Nonlinear Dynamics Ltd, Newcastle, UK)进行斑点检测、匹配、定量和分析。抗XCAP-E的抗体(R5-5)由T. Hirano [gydF4y2Ba21gydF4y2Ba,gydF4y2Ba29gydF4y2Ba]。gydF4y2Ba
样本的准备工作gydF4y2Ba
非洲爪蟾蜍gydF4y2Ba鸡蛋提取液制备、染色质重构和染色体蛋白洗脱如前所述[gydF4y2Ba27gydF4y2Ba,gydF4y2Ba28gydF4y2Ba,gydF4y2Ba20.gydF4y2Ba]。对于IEF,将含有50 μg蛋白质(或另有说明)的甲醇/氯仿沉淀样品溶解在标准复水缓冲液(sRB: 8 M尿素/4% CHAPS/0.5%两性电解质/20 mM DTT)或根据田口正交阵列制备的RBs中(表1)gydF4y2Ba1gydF4y2Ba).优化后的复水剂组成为:7 M尿素/2 M硫脲/1.2% CHAPS/0.4%ASB14/0.25%两性电解质/43 mM DTT/30 mM Tris碱)。在室温下,在振动筛上进行2小时的增溶。为了在IEF前将蛋白质烷基化,将新鲜制备的9 M水丙烯酰胺加入每个样品至终浓度为60 mM,在室温下继续孵育1.5小时。孵育结束时,样品在16000 ×下纺丝10分钟gydF4y2BaggydF4y2Ba在微型离心机中转移到再水化室。在IEF分离前,让干燥的IPG条在RBs中重新膨胀。对于在sRB中制备的样品,在开始IPG重新膨胀之前,在没有烷基化的情况下继续增溶2小时。gydF4y2Ba
电泳和斑点检测gydF4y2Ba
采用两相协议进行等电聚焦:(1)250 V持续30分钟,(2)250 - 5500 V快速斜坡电压梯度累积33000总伏特小时。聚焦后的IPG条带在二次元SDS-PAGE前进行额外的还原和烷基化处理。试纸在25 mM DTT中平衡20 min,溶解于6 M尿素/2% SDS/30%甘油/50 mM Tris HCl pH8.8中,然后在相同的缓冲液中与360 mM丙烯酰胺孵育20 min。将平衡的IPG条应用于预制的Novex 4-12% Zoom凝胶,在200 V下室温运行1小时。对SYPRO Ruby染色凝胶进行成像,通过Phoretix 2D Pro成像软件确定单个凝胶中的斑点总数。结果数据被目视检查以去除背景伪影。在每个凝胶中确定的斑点数量用于田口计算。gydF4y2Ba
田口实验设计gydF4y2Ba
田口法将优化变量排列成正交数组(表1)gydF4y2Ba1gydF4y2Ba, L9正交阵列为代表性实验)。对于2DE,每一列对应于单独的缓冲液成分,每一行代表单独的IEF补液缓冲液。每种成分以三种确定的浓度(A, B和C)服用,覆盖其效果可以确定的范围。用单个RB组合物制备的2D凝胶中可检测到的斑点数量(试验的产率)用于评估该组分的效果。这是通过计算田口的信噪比(gydF4y2Ba信噪比gydF4y2Ba)。2DE的目标是最大限度地增加可探测点的数量。为此,G.田口设计了如下方案gydF4y2Ba信噪比gydF4y2Ba功能:gydF4y2Ba
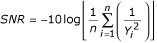
在哪里gydF4y2Ba信噪比gydF4y2Ba为信噪比,gydF4y2BangydF4y2Ba在给定的浓度下,试验的数量是多少gydF4y2BaYgydF4y2Ba我gydF4y2Ba对应试验的产量是[gydF4y2Ba9gydF4y2Ba,gydF4y2Ba30.gydF4y2Ba]。要计算gydF4y2Ba信噪比gydF4y2Ba例如,对于1%的CHAPS,我们使用凝胶2、5和8中的总斑点数(gydF4y2BangydF4y2Ba= 3),其中CHAPS以1%的水平存在(表3)gydF4y2Ba1gydF4y2Ba).采用二阶多项式拟合计算最大值对应的浓度gydF4y2Ba信噪比gydF4y2Ba如果它出现在图表上。gydF4y2Ba
质谱分析gydF4y2Ba
从2D凝胶中切除感兴趣的斑点,并在邓迪大学后基因组学和分子相互作用中心进行MALDI-TOF或LC/MS-MS分析。gydF4y2Ba
缩写gydF4y2Ba
- RB:gydF4y2Ba
-
补液缓冲gydF4y2Ba
- sRB:gydF4y2Ba
-
标准补水缓冲液gydF4y2Ba
- oRB:gydF4y2Ba
-
优化的补水缓冲液gydF4y2Ba
- 信噪比gydF4y2Ba:gydF4y2Ba
-
信噪比gydF4y2Ba
- 真沸点:gydF4y2Ba
-
tributylphosphinegydF4y2Ba
- TCEP:gydF4y2Ba
-
三羟甲基氨基甲烷(2-carboxyethyl)液磷化氢盐酸gydF4y2Ba
- 德勤:gydF4y2Ba
-
二硫苏糖醇gydF4y2Ba
- 国际宇航科学院:gydF4y2Ba
-
碘乙酰胺gydF4y2Ba
- IPG:gydF4y2Ba
-
固定pH梯度gydF4y2Ba
- 罗马数字:gydF4y2Ba
-
迷你染色体维持蛋白gydF4y2Ba
- 铝:gydF4y2Ba
-
转录后修饰gydF4y2Ba
参考文献gydF4y2Ba
Swedlow JR,平野T:gydF4y2Ba有丝分裂染色体的形成:对经典问题的现代见解。gydF4y2Ba摩尔细胞gydF4y2Ba2003年,gydF4y2Ba11:gydF4y2Ba557 - 569。10.1016 / s1097 - 2765 (03) 00103 - 5gydF4y2Ba
打击JJ:gydF4y2Ba爪蟾胚胎早期染色体DNA复制的控制。gydF4y2BaEmbo JgydF4y2Ba2001年,gydF4y2Ba20:gydF4y2Ba3293 - 3297。10.1093 / emboj / 20.13.3293gydF4y2Ba
奥法雷尔PH值:gydF4y2Ba蛋白质的高分辨率双向电泳。gydF4y2Ba生物化学gydF4y2Ba1975年,gydF4y2Ba250:gydF4y2Ba4007 - 4021。gydF4y2Ba
Rabilloud老师:gydF4y2Ba蛋白质组学的二维凝胶电泳:很老,很过时,但它仍然在爬山。gydF4y2Ba蛋白质组学gydF4y2Ba2002年,gydF4y2Ba2:gydF4y2Ba3 - 10。10.1002 / 1615 - 9861 (200201) 2:1 < 3:: AID-PROT3 > 3.3.CO;我gydF4y2Ba
galgalvani M, Rovatti L, Hamdan M, Herbert B, Righetti PG:gydF4y2Ba蛋白质组分析中存在/不存在硫脲的蛋白质烷基化:基质辅助激光解吸/电离飞行时间质谱法研究。gydF4y2Ba电泳gydF4y2Ba2001年,gydF4y2Ba22:gydF4y2Ba2066 - 2074。10.1002 / 1522 - 2683 (200106) 22:10 < 2066:: AID-ELPS2066 > 3.0.CO; 2 - 8gydF4y2Ba
Herbert B, Galvani M, Hamdan M, Olivieri E, mccarthy J, Pedersen S, Righetti PG:gydF4y2Ba还原和烷基化的蛋白质在制备二维图分析:为什么,何时,以及如何?gydF4y2Ba电泳gydF4y2Ba2001年,gydF4y2Ba22:gydF4y2Ba2046 - 2057。10.1002 / 1522 - 2683 (200106) 22:10 < 2046:: AID-ELPS2046 > 3.0.CO; 2摄氏度gydF4y2Ba
Jeney C, Dobay O, Lengyel A, Adam E, Nasz I:gydF4y2Ba田口优化ELISA程序。gydF4y2BaJ免疫方法gydF4y2Ba1999年,gydF4y2Ba223:gydF4y2Ba137 - 146。10.1016 / s0022 - 1759 (98) 00185 - 9gydF4y2Ba
Burch GJ, Ferguson CH, Cartwright G, Kwong FY:gydF4y2Ba田口实验设计在杆状病毒表达系统优化中的应用。gydF4y2Ba生物化学SocgydF4y2Ba1995年,gydF4y2Ba23:gydF4y2Ba107年代。gydF4y2Ba
柯布BD,克拉克森JM:gydF4y2Ba改进田口法优化聚合酶链反应(PCR)的简单程序。gydF4y2Ba核酸类gydF4y2Ba1994年,gydF4y2Ba22:gydF4y2Ba3801 - 3805。gydF4y2Ba
田口G:gydF4y2Ba质量工程导论。gydF4y2Ba纽约:UNIPAB 1986。gydF4y2Ba
Shaw MM, Riederer BM:gydF4y2Ba二维凝胶电泳的样品制备。gydF4y2Ba蛋白质组学gydF4y2Ba2003年,gydF4y2Ba3:gydF4y2Ba1408 - 1417。10.1002 / pmic.200300471gydF4y2Ba
PROTEAN IEF细胞说明书gydF4y2BaBio-RadgydF4y2Ba
莫雷议员:gydF4y2Ba膜蛋白二维电泳固定化pH梯度。gydF4y2Ba学生物化学肛门gydF4y2Ba2000年,gydF4y2Ba280:gydF4y2Ba1 - 10。10.1006 / abio.2000.4514gydF4y2Ba
Molloy MP, Herbert BR, Walsh BJ, Tyler MI, Traini M, Sanchez JC, Hochstrasser DF, Williams KL, Gooley AA:gydF4y2Ba用微分增溶法提取膜蛋白,用于二维凝胶电泳分离。gydF4y2Ba电泳gydF4y2Ba1998年,gydF4y2Ba19:gydF4y2Ba837 - 844。gydF4y2Ba
塔斯特C,夏蒙S,谢瓦莱M,卢奇S,拉比卢德T:gydF4y2Ba两性离子洗涤剂在双向电泳中作为蛋白质增溶剂的构效关系。gydF4y2Ba蛋白质组学gydF4y2Ba2003年,gydF4y2Ba3:gydF4y2Ba111 - 121。10.1002 / pmic.200390019gydF4y2Ba
Chevallet M, Santoni V, Poinas A, Rouquie D, Fuchs A, Kieffer S, Rossignol M, Lunardi J, Garin J, Rabilloud T:gydF4y2Ba新型两性离子洗涤剂改进了膜蛋白的双向电泳分析。gydF4y2Ba电泳gydF4y2Ba1998年,gydF4y2Ba19:gydF4y2Ba1901 - 1909。gydF4y2Ba
Perdew GH, Schaup HW, Selivonchick DP:gydF4y2Ba两性离子洗涤剂在鳟鱼肝微粒体二维凝胶电泳中的应用。gydF4y2Ba学生物化学肛门gydF4y2Ba1983年,gydF4y2Ba135:gydF4y2Ba453 - 455。gydF4y2Ba
Molloy MP, Herbert BR, Slade MB, Rabilloud T, Nouwens AS, Williams KL, Gooley AA:gydF4y2Ba大肠杆菌外膜蛋白质组学分析。gydF4y2Ba生物化学gydF4y2Ba2000年,gydF4y2Ba267:gydF4y2Ba2871 - 2881。10.1046 / j.1432-1327.2000.01296.xgydF4y2Ba
M, Hamdan M, Herbert B, Righetti PG:gydF4y2Ba二维图谱制备中蛋白质的烷基化动力学:基质辅助激光解吸/电离-质谱研究。gydF4y2Ba电泳gydF4y2Ba2001年,gydF4y2Ba22:gydF4y2Ba2058 - 2065。10.1002 / 1522 - 2683 (200106) 22:10 < 2058:: AID-ELPS2058 > 3.0.CO; 2 zgydF4y2Ba
穆尼恩ME、亚当斯RR、卡利斯特DM、阿利斯CD、恩肖WC、斯韦德洛JR:gydF4y2Ba染色质相关蛋白磷酸酶1调节极光蛋白b和组蛋白H3磷酸化。gydF4y2Ba生物化学gydF4y2Ba2001年,gydF4y2Ba276:gydF4y2Ba26656 - 26665。10.1074 / jbc.M102288200gydF4y2Ba
平野T,小林R,平野M:gydF4y2Ba缩合蛋白,染色体缩合蛋白复合物,含有XCAP-C, XCAP-E和非洲爪蟾同源的果蝇不育蛋白。gydF4y2Ba细胞gydF4y2Ba1997年,gydF4y2Ba89:gydF4y2Ba511 - 521。10.1016 / s0092 - 8674 (00) 80233 - 0gydF4y2Ba
久保田Y,三村S,西本S,增田T,野岛H,泷泽H:gydF4y2Ba爪蟾卵中MCM/P1蛋白多蛋白复合体的DNA复制许可。gydF4y2BaEmbo JgydF4y2Ba1997年,gydF4y2Ba16:gydF4y2Ba3320 - 3331。10.1093 / emboj / 16.11.3320gydF4y2Ba
thomas P, Kubota Y, Takisawa H, Blow JJ:gydF4y2Ba复制许可系统的RLF-M成分形成包含所有六种MCM/P1多肽的复合物。gydF4y2BaEmbo JgydF4y2Ba1997年,gydF4y2Ba16:gydF4y2Ba3312 - 3319。10.1093 / emboj / 16.11.3312gydF4y2Ba
McGarry TJ, Kirschner MW:gydF4y2Ba双链蛋白是一种DNA复制抑制剂,在有丝分裂过程中被降解。gydF4y2Ba细胞gydF4y2Ba1998年,gydF4y2Ba93:gydF4y2Ba1043 - 1053。10.1016 / s0092 - 8674 (00) 81209 - xgydF4y2Ba
李建军,刘建军,李建军,刘建军,刘建军,刘建军。gydF4y2Ba中期起源组装的抑制依赖于双联蛋白对RLF-B/Cdt1的抑制。gydF4y2Ba细胞生物学gydF4y2Ba2001年,gydF4y2Ba3:gydF4y2Ba107 - 113。10.1038 / 35055000gydF4y2Ba
Wohlschlegel JA, Dwyer BT, Dhar SK, Cvetic C, Walter JC, Dutta A:gydF4y2Ba双链蛋白结合Cdt1抑制真核生物DNA复制。gydF4y2Ba科学gydF4y2Ba2000年,gydF4y2Ba290:gydF4y2Ba2309 - 2312。10.1126 / science.290.5500.2309gydF4y2Ba
Swedlow JR:gydF4y2Ba染色体的组装gydF4y2Ba在体外gydF4y2Ba使用gydF4y2Ba非洲爪蟾蜍gydF4y2Ba鸡蛋中提取。gydF4y2Ba见:染色体结构分析gydF4y2Ba(编辑:Bickmore WA)。gydF4y2Ba牛津:牛津大学1999,:167-182。gydF4y2Ba
打击JJ:gydF4y2Ba在单细胞周期中防止DNA的再复制:复制许可因子的证据。gydF4y2BaJ细胞生物学gydF4y2Ba1993年,gydF4y2Ba122:gydF4y2Ba993 - 1002。10.1083 / jcb.122.5.993gydF4y2Ba
平野T, Mitchison TJ:gydF4y2Ba体外有丝分裂染色体凝聚所需的异二聚体卷曲卷曲蛋白。gydF4y2Ba细胞gydF4y2Ba1994年,gydF4y2Ba79:gydF4y2Ba449 - 458。10.1016 / 0092 - 8674 (94) 90254 - 2gydF4y2Ba
Caetano-Anolles G:gydF4y2Ba田口法优化DAF及热循环参数对DNA扩增的影响。gydF4y2Ba生物学技术gydF4y2Ba1998年,gydF4y2Ba25:gydF4y2Ba472 - 480。gydF4y2Ba
致谢gydF4y2Ba
作者感谢T. Hirano的抗xcap - e抗体,以及Swedlow和Blow实验室的成员对这项工作的有益讨论和批评。这项工作由英国癌症研究中心资助C303/A2666和C303/A3135。质谱数据由邓迪大学后基因组学和分子相互作用中心获得,由Wellcome Trust基金60269资助。J. R. Swedlow是威康信托基金会高级研究员。gydF4y2Ba
作者信息gydF4y2Ba
作者及单位gydF4y2Ba
相应的作者gydF4y2Ba
额外的信息gydF4y2Ba
相互竞争的利益gydF4y2Ba
没有宣布。gydF4y2Ba
作者的贡献gydF4y2Ba
GAK设计并进行了优化实验,2DE分析gydF4y2Ba非洲爪蟾蜍gydF4y2Ba许可复合体和人类核仁蛋白并起草了手稿。IMP进行了2DE分析gydF4y2Ba非洲爪蟾蜍gydF4y2Ba小鼠和虾细胞凝缩蛋白复合物和线粒体提取物。JJB参与了设计的研究和协调。JRS构思了这项研究,并参与了其设计和协调。所有作者都阅读并批准了最终的手稿。gydF4y2Ba
电子补充资料gydF4y2Ba
12953 _2004_13_moesm1_esm.pdfgydF4y2Ba
附加文件1:2DE对ASB14和两性电解质浓度变化的响应。总剂量为50 μggydF4y2Ba非洲爪蟾蜍gydF4y2Ba鸡蛋提取液溶解在含有7 M尿素、2 M硫脲、1.2% CHAPS、43 DTT和可变量ASB14和两性电解质的RBs中,如图所示。检测到的斑点:(A) 682, (B) 227, (C) 662, (D) 640。(pdf 6mb)gydF4y2Ba
作者提交的原始图片文件gydF4y2Ba
下面是作者提交的原始图片文件的链接。gydF4y2Ba
权利和权限gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
Khoudoli, g.a., Porter, i.m., Blow, J.J.gydF4y2Baet al。gydF4y2Ba利用田口法优化二维凝胶电泳方案。gydF4y2Ba蛋白质组学科学gydF4y2Ba2gydF4y2Ba, 6(2004)。https://doi.org/10.1186/1477-5956-2-6gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/1477-5956-2-6gydF4y2Ba
关键字gydF4y2Ba
- 非洲爪蟾蜍gydF4y2Ba鸡蛋中提取gydF4y2Ba
- 染色质gydF4y2Ba
- 细胞周期gydF4y2Ba
- 双向凝胶电泳gydF4y2Ba
- 蛋白质组学gydF4y2Ba
- 田口方法gydF4y2Ba
- 优化gydF4y2Ba