Sporke J, Patterson JL, Beltranena E, Foxcroft GR。在商业养猪操作中使用Matrix和PG600进行母猪开发单元管理。Proc Allen D Leman猪会议2005;2005:72 - 100。
谷歌学者
罗德里格斯LA,阿尔梅达FRCL,佩洛索JV,费雷拉FNA,艾利森J,丰特斯做。促性腺激素释放激素免疫对重仔母猪生长性能、繁殖活性和胴体性状的影响。动物。2019;13:1326-31。
文章中科院PubMed谷歌学者
杨晓平,李丽娟,李丽娟,等。提高母猪繁殖性能和畜群生产力的因素。《Porc Health Manag》2017;3:1-10。
文章谷歌学者
2002年的超多产管理:对技术成果和母猪寿命有什么影响?J Rech Porcine Fr. 2004; 36:429-34。
谷歌学者
陈志伟,陈志伟,陈志伟,等。母猪初次发情年龄和第三次发情饲养对母猪体重变化和长期繁殖性能的影响。中国动物科学,2010;29(3):344 - 344。
文章中科院PubMed谷歌学者
Kummer R, Bernardi ML, Wentz I, Bortolozzo F.早期人工授精高生长率母猪繁殖性能研究。动物科学进展。2006;26(6):344 - 344。
文章PubMed谷歌学者
Rohrer GA, Cross AJ, Lents CA, Miles JR, Nonneman DJ, Rempel LA。母猪全寿命生产力的遗传改良。中国动物科学,2017;26(5):529 - 529。
文章谷歌学者
Patterson J, Foxcroft G. Gilt生育和长寿管理。动物。2019;9:434。
文章公共医学中心谷歌学者
罗西提采,张志刚,张志刚,等。背膘厚度对母猪繁殖性能的影响。泰国兽医杂志。2014;44:171-8。
谷歌学者
谷志勇,李志勇。种猪妊娠失败的扑杀风险因素。中国农业科学,2016;9:109-17。
谷歌学者
Stancic I, Stancic B, Bozic A, Anderson R, Harvey R, Gvozdic D.延迟青春期母猪的卵巢活动和子宫器官测量。以及动物生殖部。技术部2011;76:1022-6。
文章PubMed谷歌学者
生理学和内分泌学研讨会:影响母猪和母猪卵泡发育的因素和用于调节生长以控制发情和排卵的管理策略。中国动物科学,2019;
文章PubMed公共医学中心谷歌学者
Falceto MV。猪健康和生产的基本指南。母猪卵巢病理生理学。第二版《萨拉戈萨:编辑服务》;2016
Tummaruk P, Kesdangsakonwut S.热带地区精选长×大母猪排卵次数与年龄、体重和生长速率的关系。中国兽医医学杂志,2015;
文章PubMed公共医学中心谷歌学者
Signoret JP。猪的繁殖行为。中国农业科学,2000;11(增刊1):105-17。
谷歌学者
张志刚,张志刚,张志刚,张志刚,等。围产期对母猪发育期的影响。动物科学学报,1986;42(2):344 - 344。
文章中科院PubMed谷歌学者
Flowers B, Cantley TC, Martin MJ, Day BN。环境温度升高对母猪青春期的影响。中国畜牧兽医杂志,1989;29(3):339 - 344。
文章中科院PubMed谷歌学者
Karlbom I, Einarsson S, Edqvist LE。雌猪青春期的实现:孕酮、雌二醇-17β和LH的临床表现和模式。动物科学,1982;4:301-12。
文章中科院谷歌学者
Prunier A, Bonneau M, Etienne M.年龄和活重对母猪和公猪性发育的影响。《营养学杂志》1987;27:689-700。
文章中科院PubMed谷歌学者
Dyck GW, Swierstra EE。育成期:母猪从出生到青春期生殖道的生长中华动物科学杂志,1983;43(3):344 - 344。
文章谷歌学者
杜志刚,王志刚,王志刚。阴道-宫颈长度测量在母猪未来繁殖性能评价中的应用:商业条件下的初步研究。动物。2019;9:158。
文章公共医学中心谷歌学者
De Alba C, Falceto V, Zebeli Q, Romero a .阴道-宫颈长度作为预测母猪产仔数的工具。会议记录:第17届国际猪兽医大会,2002年6月2-5日,美国爱荷华州艾姆斯。埃德。佩里,爱荷华州:IPVS 2002。第二卷:海报展示
Gaughan JB, Cameron RD, Dryden总经理,Young BA。选择体成分对大白母猪繁殖发育的影响。中国动物科学(英文版),2000;
文章中科院PubMed谷歌学者
Ahmed ML, Ong KKL, Morrell DJ, Cox L, Drayer N, Perry L, Preece MA, Dunger DB。青春期瘦素浓度的纵向研究:性别差异和与身体成分变化的关系。中华内分泌杂志,1999;24(4):389 - 395。
中科院谷歌学者
格雷夫斯KL,莫德霍斯特BR,赖特EC,黑尔BJ,斯托德KJ,基廷AF,罗斯JW。确定预测母猪青春期开始年龄的措施。中国动物科学,2020;4(1):285-92。
文章PubMed谷歌学者
韦泽凯,李文杰,李文杰,李文杰。利用经皮超声检测母猪排卵的研究。《再述家庭动物》1989;24:40-2。
文章谷歌学者
埃本谢德KL,柏森AM,坎特利TC, Day BN。血浆激素浓度的变化与母猪青春期的开始有关。中国畜牧兽医杂志,1982;54(2):320-4。
文章中科院PubMed谷歌学者
埃文斯AC,奥多尔蒂JV。影响母猪青春期的内分泌变化及管理因素。生态学报,2001;29(1):1 - 12。
文章谷歌学者
Martinat-Botté F, Royer E, Venturi E, Boisseau C, Guilouet P, Furstoss V, Terqui M.用超声技术测定母猪青春期前后子宫变化并评估青春期诊断。生态学报。2003;43(3):225-36。
文章PubMed谷歌学者
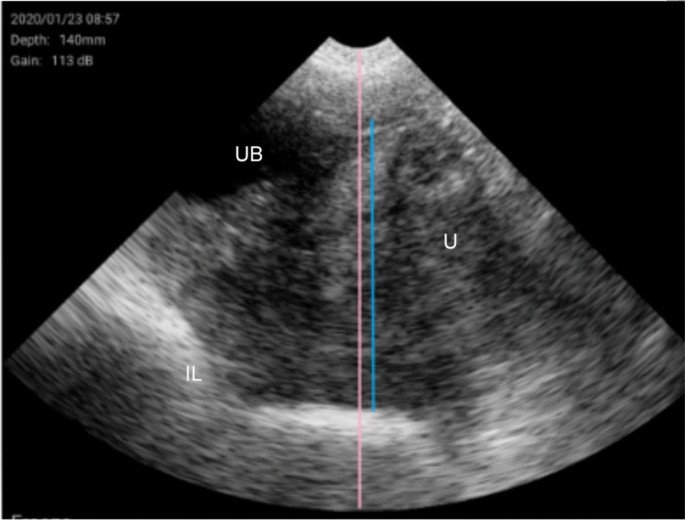
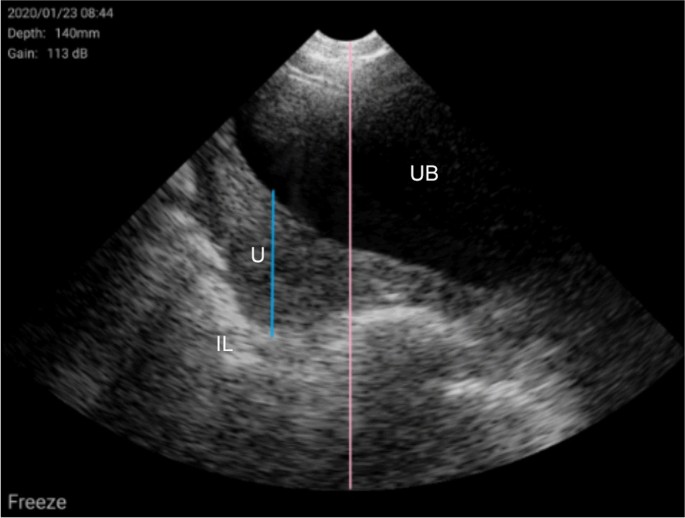
Kauffold J, Peltoniemi O, Wehrend A, Althouse GC。母猪繁殖实时超声检查原理及临床应用。动物。2019;9:950。
文章公共医学中心谷歌学者
doue - l - 2009 - 80287。2009.指令2008/120/CE欧洲会议Unión欧洲2008年第18次会议,相对标准mínimas para la protección cerdos。http://www.boe.es/doue/2009/047/L00005-00013.pdf.2021年11月7日访问。
2013年第53号敕令热8号,相对于正常情况básicas适用条款protección动物利用方式experimentación罚款científicos,包括时间。https://www.boe.es/eli/es/rd/2013/02/01/53.2021年11月7日访问。
Muirhead M, Alexander T.营养与疾病。管理猪的健康和疾病的治疗。动物科学,1997;(4):381 - 381。
谷歌学者
一头猪应该出多少肉。https://livestock.extension.wisc.edu/articles/how-much-meat-should-a-hog-yield/.2022年2月24日访问
奥特曼DG。医学研究的实用统计学。动物科学,1986;62:1203-9。
谷歌学者
霍金RR。一篇生物识别邀请论文。线性回归中变量的分析和选择。生物识别技术。1976;32:1-49。
文章谷歌学者
弗莱彻RH,弗莱彻SW。临床流行病学:要点。第4版。巴尔的摩:利平科特威廉姆斯和威尔金斯;2005.
谷歌学者
Hilbe JM。逻辑回归模型。纽约:查普曼和霍尔/CRC;2009.
书谷歌学者
Zak LJ, Gaustad AH, Bolarin A, Broekhuijse ML, Walling GA, Knol EF。复杂性状的遗传控制,重点关注猪的繁殖。Mol red开发,2017;84:1004-11。
文章中科院PubMed谷歌学者
maopolska MM, Tuz R, Lambert BD, Nowicki J, Schwarz T.替代母猪:改进种群的当前策略。中国畜牧兽医,2018;26:208-14。
谷歌学者
李强,潘霞,李宁,龚伟,陈勇,袁霞。青春期初期母猪下丘脑环状rna的鉴定。基因。2021;12:84。
文章PubMed公共医学中心中科院谷歌学者
stanovic I, radovic I, stanovic B, stevanovic O, stevanovic M.野猪效应对母猪发情反应的影响。中国生物医学工程学报。2021;1:1540-50。
谷歌学者
格拉索F, Castonguay F, Daviault E, Matton P, Minvielle F, Dufour JJ。青春期前母猪卵泡发育及卵巢形态类型遗传的研究动物科学学报,1988;26(2):349 - 349。
文章中科院PubMed谷歌学者
Kapelanski W, Jankowiak H, Bocian M, Grajewska S, Dybata J, Zmudzinska A.体重为100 kg时波兰大白母猪和波兰长白母猪生殖系统的形态特征。动物科学,2012;13:45-53。
谷歌学者
Žarković B. (Ed):母猪子宫角长度与青春期发育之间的关系。动物科学国际研讨会:2014年9月23 - 25日,塞尔维亚贝尔格莱德;2014.
Oberlender G, Pontelo TP, Miranda JR, Miranda DR, Zangeronimo MG, Silva AC, Menezes TA, Rocha LGP。青春期前母猪卵巢、输卵管和子宫在不同发情期的形态学和形态计量学评价。Pesq兽医胸罩。2014;34:83-90。
文章谷歌学者
Young MG, Tokach MD, Aherne FX, Dritz SS, Goodband RD, Nelssen JL, Loughin TM。在商品猪生产体系中,饲养空间预留和选择标准对三胎龄以上母猪生产性能的影响。动物科学学报,2008;26(2):381 - 391。
文章中科院PubMed谷歌学者
Tummaruk P, Kesdangsakonwut S, Kunavongkrit A.泰国因繁殖失败而被扑杀的母猪生殖道形态、生殖数据和扑杀具体原因之间的关系以及动物生殖部。2009;技术部71:369 - 75。
文章中科院PubMed谷歌学者
福克斯克罗夫特GR,阿尔梅达F,帕特森JL,威利斯HJ。青春期的年龄和体重与一生的表现有关。Proc VIth Int Conf Pig red . 2001;2001:1 - 5。
谷歌学者
图玛鲁克,卢德海姆,艾纳松,大林。产仔数、胎次数、生长率、背膘厚度和初次交配年龄对母猪繁殖性能的影响。生物工程学报,2001;26(2):366 - 366。
文章中科院PubMed谷歌学者
Amaral Filha WS, Bernardi ML, Wentz I, Bortolozzo FP。生长率和猪龄是影响母猪青春期的因素。生物工程学报,2009;30(4):344 - 344。
文章谷歌学者
Magnabosco D, Bernardi ML, Wentz I, Cunha ECP, Bortolozzo FP。低出生体重影响母猪的一生生产性能和寿命。生命科学,2016;184:119-25。
文章谷歌学者
李志刚,李志刚,李志刚,马志刚。青春期年龄和背膘选择对母猪繁殖、生长和成分的影响。科学通报。1990;24:237-47。
文章谷歌学者
赖德默,埃利亚森-塞尔,约翰松,斯特恩,安德森,K.青春期发情症状的遗传研究及其与母猪生长和瘦弱的关系。中国动物科学,1994;
文章中科院PubMed谷歌学者
Patterson JL, Ball RO, Willis HJ, Aherne FX, Foxcroft GR.精瘦生长率对母猪青春期发育的影响。中国畜牧兽医杂志,2002;30(2):344 - 344。
文章中科院PubMed谷歌学者
罗文敏,王志强,王志强,王志强。家畜高产选育不良副作用综述。环境科学学报,1998;26(6):529 - 531。
文章谷歌学者
Kuehn LA, Nonneman DJ, Klindt JM, Wise TH。母猪体成分、血清瘦素与青春期年龄的遗传关系。中国动物科学,2009;26(3):349 - 349。
文章中科院PubMed谷歌学者
Rozeboom DW, Pettigrew JE, Moser RL, Cornelius SG, Kandelgy SM。青春期母猪的身体组成。中国畜牧兽医杂志,1995;43(2):344 - 344。
文章中科院PubMed谷歌学者
母猪青春期与生产性状的关系。2.青春期的发情症状。动物科学,1991;25:25 - 64。
文章谷歌学者
钟伟文,程伟富,吴少林,杨普平。利用血浆孕酮谱预测无发情母猪和母猪的繁殖状况。以及动物生殖部。2002;技术部58:1165 - 74。
文章中科院谷歌学者
Kauffold J, Rautenberg T, Richter A, Waehner M, Sobiraj A.青春期前和青春期母猪卵巢和子宫的超声特征。以及动物生殖部。技术部2004;61:1635-48。
文章PubMed谷歌学者
考夫德J,郭特沙尔克J,施耐德S,贝农N,韦纳M.哺乳期饲喂水平对初产母猪FSH和LH分泌模式及卵泡发育的影响。Dom Anim. 2008;43:23 34 - 8。
文章中科院谷歌学者