摘要
背景
随着全球养猪生产的不断扩大,商品房和猪群管理为猪流感病毒(swIAV)的持续传播提供了最佳环境,从而对农民和兽医提出了确定最佳控制措施的挑战。本研究的目的是调查母猪在猪流感病毒传播动态中的作用,并评估不同控制措施(如检疫和母猪接种疫苗)的影响。
方法
该研究是在10个丹麦母猪群中进行的横断面研究,包括5个接种了swIAV疫苗的母猪群和5个未接种swIAV疫苗的母猪群。在生产系统的不同阶段(检疫进出期、交配期、妊娠期和分娩期)采集了母猪、一胎母猪和仔猪的血液和鼻拭子样本,并分析了swIAV和swIAV抗体的存在。随后,研究了swIAV检测、血清流行率、抗体水平、母猪和母猪疫苗接种策略和检疫生物安全之间的关联,以确定swIAV在畜群内引入和持续存在的可能风险因素。
结果
该研究的10个畜群中有9个存在swIAV循环,并且在检疫、交配和分娩单元中检测到swIAV。在接种疫苗的母猪群中,血清阳性的母猪和一胎母猪的流行率显著较高,但在这些母猪群中,母猪、一胎母猪和仔猪的鼻拭子中仍然存在swIAV。检疫母猪接种疫苗和全入/全进管理导致检疫期结束时swIAV阳性母猪显著减少。
结论
结果强调,群体疫苗接种和/或检疫设施对于避免swIAV传入母猪群至关重要。
背景
在过去的10年里,一些研究已经将swIAV在畜群层面的持久性描述为有利于大规模生产系统的养猪生产扩大的结果[1,2,3.,4,5,6,7].这些生产系统,如果没有采用非常严格的生物安全措施,以避免年龄群体的混合等,提供每周恒定的naïve个人流动,确保持续的swIAV循环[1,2,3.,8].只有少数研究调查了母猪和初胎母猪在swIAV群内持久性中的作用[7,9,10,11,12].然而,母猪可能在新型swIAV引入中发挥重要作用,因为大多数母猪群只从外部来源引入与种畜替换相关的动物[7,13].此外,如果母猪在进入母猪群前未进行适当的免疫接种,它们可能是swIAV流行株的naïve,从而有助于持续的地区性swIAV流行[8].以前的两项研究表明,引进母猪与畜群水平的swIAV持续性风险增加之间存在相关性[9,10].然而,据笔者所知,之前的研究均未对不同生产系统/年龄的母猪和一胎母猪进行采样,并进一步将swIAV和swIAV抗体的检测与群体疫苗接种策略和检疫措施联系起来。
因此,本研究的目的是调查母猪在swIAV传播动态中的作用,通过评估从到达检疫单位到分娩后1周期间母猪和第一胎母猪的swIAV和swIAV抗体的流行率。第二个目的是评估猪群中swIAV疫苗接种、检疫管理和生物安全措施与猪群中swIAV和swIAV抗体流行率之间的关系。
方法
道德的声明
本研究严格按照欧盟采用的良好实验规范(GEP)标准的指导方针进行。此外,所有实验程序都按照哥本哈根大学兽医和动物科学系提供的建议进行。
研究设计
本研究在畜牧兽医的协助下,采用方便的方法选择了10个畜群。纳入标准为;至少有800头母猪,以确保每个单位有足够的母猪进行抽样,不存在猪繁殖和呼吸综合征病毒(PRRSV)或PRRSV稳定性(无临床症状),至少有一个检疫单位,并从外部来源购买母猪。此外,5个猪群应使用Respiporc FLU3进行swIAV疫苗接种(Ceva Santé Animale,法国),并采用类似的疫苗接种策略,包括每年三次大规模母猪疫苗接种和单独的母猪疫苗接种策略。大规模母猪接种疫苗意味着农场中所有的母猪和母猪同时接种疫苗。丹麦市场上有两种swIAV疫苗,其中Respiporc FLU3 (Ceva Santé Animale,法国)针对在丹麦流行的最流行的swIAV毒株[14].剩下的5个母猪群至少1年内不应进行任何swIAV疫苗接种。
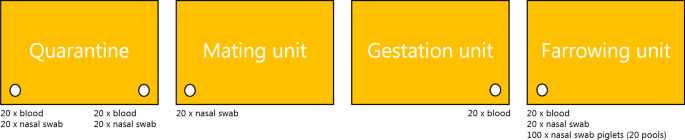
在每个畜群中进行抽样作为横断面研究,目的是在同一天获得所有样本。然而,在10个畜群中,有7个畜群不可能在检疫中对新引进的母猪和准备在同一天离开检疫的母猪进行抽样。因此,对这7个畜群分别进行了两次访问。采样进度如图所示。1.
由于经济和实际的限制,每个单位的样本量为20头母猪和20窝仔猪。这种样本量允许在单位流行率至少14%的情况下检测出一个抗体或病毒阳性个体。在每个畜群中,在到达检疫后大约1周和离开检疫前1周采集20头母猪的血液和鼻拭子。此外,在到达交配单位1周后,从母猪身上收集了20个鼻拭子,而只从大约20只母猪身上获得了血液样本。离开妊娠单位前1周。最后,在分娩1周后,采集20头胎母猪(第一窝母猪)的血液和鼻拭子,同时采集每头母猪一窝5头仔猪的鼻拭子,并将其集中在一管中。如果某批稳定单位(检疫单位、配种单位、妊娠单位和产仔单位)的特定批次中存在超过20头母猪,则通过计算该批母猪的数量并将数量与样本量除以,从而获得采样频率。如果结果是十进制数,则对其进行四舍五入。如果一个批次内的母猪少于20头,则包括前一批母猪(小1周),直到20头为止。术语“gilt”用于怀孕第一窝母猪,而它们在生下第一窝母猪后被称为“第一胎母猪”。
在第1猪群中,在第一次访问后3个月收集了额外的样本,以调查第一次采样期间发现的病毒是否已从隔离区传播到母猪群(分娩单位)。额外的样本包括12个来自分娩单元的1至4周龄仔猪的汇总样本,结果是从每个年龄组收集的5个鼻拭子的3个汇总样本。
血液样本来自于腔jugularis并储存在真空血清管(Becton-Dickinson,丹麦)。用或大或小的无菌人造棉签从两个鼻孔收集鼻拭子(Medical Wire, UK),并将其插入两个鼻孔并旋转360度。鼻拭子保存在含有2 mL无菌0.9%等渗NaCl的5 mL Eppendorf管中。所有样本在5-8℃保存,直到在12-48小时内到达实验室。到达实验室后,所有血液样本在3000转/分下离心10分钟,以获得血清,随后将其冷冻,直到在−20℃下进一步分析。同样,所有的鼻拭子都是旋涡状和约。各样品600 μl倒入1.5 mL Eppendorf管中,- 80℃保存,待进一步分析。
血液样本分析
采用商业阻断酶联免疫吸附试验(ELISA) (IDEXX甲型流感Ab测试,IDEXX Laboratories, Inc.),按照推荐程序筛选血清,以检测抗IAV高度保守核蛋白(NP)的抗体。样本-阴性(S/N) < 0.60为IAV抗体阳性,S/N≥0.60为阴性。个体S/N值用于后续分析的抗体水平的测量。由于应用的ELISA是阻断ELISA,低S/N值表明swIAV抗体水平高。
实时RT - PCR法检测鼻拭子上的swIAV病毒
将鼻拭子离心,200μL转入样品架,与含有2-巯基乙醇的RLT-buffer (QIAGEN, Copenhagen, Denmark) (Merck, Darmstadt, Germany) 400 μl混合。然后,根据供应商的说明,使用QIAcube HT (QIAGEN)上自动化的Cador pathogen 96 QIAcube HT Kit (QIAGEN)从鼻拭子中提取所有病原体核酸。
将得到的提取物进行先前发表的针对IAV基质基因的实时RT - PCR,以确定样本是否为swIAV阳性[15].实时RT - PCR在Rotor-Gene Q (QIAGEN)上进行,程序如下:50°C, 30分钟;95°C, 15分钟;循环45 ×(95°C, 10 s, 60°C 20 s, 64°C 1 s, 68°C 1 s, 72°C 30 s)。所有试验均纳入阳性和阴性对照,当Ct值< 36时为阳性。IAV阳性样本使用先前发表的实时RT - PCR多重检测方法测定HA和NA谱系[1].
如前所述,从每个群体中选取两个Ct值最低的样本进行HA和NA基因的Sanger测序[16].来自LGC Genomics (Berlin, Germany)的正向和反向引物测序数据通过人工连接和校对。人工修剪引物结合区域,生成HA和NA基因的一致序列。为了确定样本的子类型,然后使用“BLAST against NCBI”函数检查一致性序列的最接近序列匹配,并使用MUSCLE算法进行对齐[17]以及当前丹麦HA和NA亚型的选择,然后使用“创建邻居连接树”功能进行系统发育分析。随后,HA和NA序列被翻译成氨基酸并使用MUSCLE算法进行比对[17]与Respiporc FLU3疫苗株(注册编号:;GQ161124、GQ161100及GQ161104) [18],并利用“创建两两比较”功能对氨基酸同一性的整体水平进行了研究。此外,抗原位点(Ca1, Ca2, Cb, Sa和Sb [19,20.,21,22])与受体结合位点一起注释到氨基酸序列上,以确定这些位点上氨基酸残基的差异。
问卷调查
在牧群参观中,对农民进行了访谈,并根据访谈和农场观察填写了为本研究开发的问卷和清单。调查问卷涉及母猪的招募、检疫、检疫中对母猪的处理和疫苗接种策略,在5个未接种疫苗的畜群中未得到回答。问卷包括12个封闭式问题(是/否或多项选择)和16个半开放式问题(即定量变量和隔离访问后限制的描述)(附加文件)1:表S2)。检查清单包括内部和外部生物安全措施的信息(即在每个稳定单位更换衣服和靴子)和在畜群中执行的其他疫苗接种策略以及抗生素的使用(附加文件)2:表S3)。
统计数据
在R版本4.0.4中进行统计。回归模型使用Package lme4 [23].
为了研究病毒脱落和抗体水平与疫苗接种计划和检疫措施的关系,建立了logistic模型和线性模型,均以畜群为固定效应。
为研究检疫特征对离场母猪病毒脱落的影响,基于检疫“全入/全进”(AIAO)管理,提出了一个新的变量。
结果
不同稳定单位的SwIAV抗体和SwIAV患病率
表中总结了10个研究畜群在不同生产阶段(检疫入/出、交配、妊娠和分娩后1周)的母猪、一胎母猪和仔猪IAV抗体ELISA和实时RT - PCR检测结果1.
在研究中包括的10个畜群中,有2个畜群在检疫刚到达时产下了swIAV阳性的母猪,而6个畜群在检疫结束时产下了swIAV阳性的母猪。隔离内外的病毒状态无显著相关性(p= 0.5)。大多数畜群(10个中的9个)在检疫中收到血清阳性的母猪,但畜群之间的流行率差异很大,从15%到95%的母猪血清阳性。在隔离期结束时,所有畜群的母猪血清呈阳性,患病率从20%到100%不等。
在交配单元中,swIAV阳性母猪的患病率很低,因为有四个畜群在这个阶段有5%的母猪检测呈阳性。
妊娠和分娩单位swIAV抗体阳性的母猪/一胎母猪的患病率分别为55 ~ 100%和40 ~ 100%。此外,在分娩单元中,有3头胎母猪鼻拭子检测呈swIAV阳性,10头牛中有6头在分娩单元中有1周龄母猪swIAV阳性。swIAV阳性母猪的产仔比swIAV阴性母猪的产仔病毒阳性(50%比11%)。p= 0.048),但病毒阳性母猪个体数量相当低(n = 4)。对于抗体状态的影响,抗体阳性仔猪与抗体阴性仔猪的病毒阳性仔猪数量差异无统计学意义(12比11%)。p= 0.4)。
播种猪流感疫苗
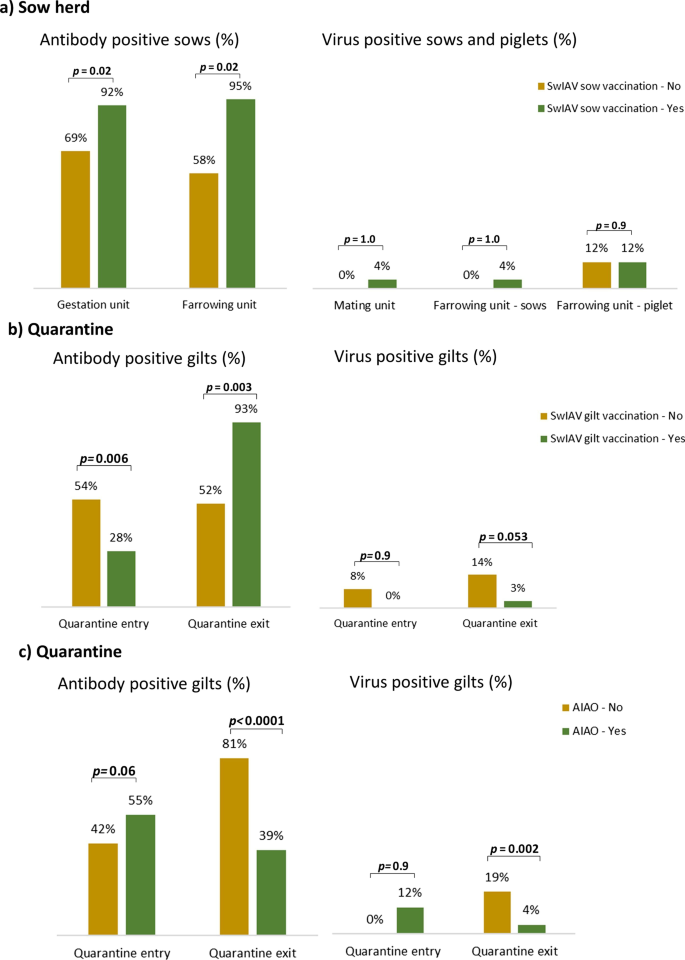
swIAV阳性母猪/一胎母猪和swIAV抗体阳性母猪/一胎母猪的流行率与swIAV疫苗在母猪群中的应用关系如图所示。2.
在未接种疫苗的猪群中,交配和分娩单元的母猪中未发现swIAV,然而,5个猪群中有3个猪群在分娩单元的仔猪中流行swIAV,患病率为10%至35%(表2)1).
在采用swIAV母猪疫苗接种策略的畜群中,交配单元中5个畜群中有4个母猪病毒呈阳性,患病率均为5%。在分娩单元中,3个猪群病毒阳性母猪患病率为5%至10%,3个猪群(两个与病毒阳性母猪有关)病毒阳性仔猪患病率为5%至45%(表2)1).
病毒阳性母猪或仔猪的流行率在未接种疫苗和接种疫苗的畜群之间没有显著差异(p> 0.9,表2).
在妊娠单位中,未接种疫苗和接种疫苗的母猪中,血清阳性第一胎母猪的流行率有显著差异(69% vs. 92%)。p= 0.013)和分娩单位(58% vs. 95%,p= 0.02)。在妊娠期,swIAV抗体阳性的母猪和未接种疫苗的母猪和接种疫苗的母猪S/N值也有显著差异(0.31 vs. 0.21)。p= 0.03)和分娩单位(0.33 vs. 0.20,p= 0.02),表明接种疫苗的母猪/一胎母猪抗体水平显著较高。
隔离-猪流感病毒疫苗接种和全面/全面管理
在所有纳入的10个畜群中,有2个畜群在检疫期间对母猪进行了初级(prime-boost)疫苗接种计划(表2)3.).
swIAV阳性和swIAV抗体阳性母猪的流行率与检疫期间对母猪实施初级疫苗接种(prime-boost)计划的关系的比较总结在图中。2b。
在隔离期结束时,发现血清阳性母猪的流行率有显著差异(52比93%,p= 0.003),在未接种疫苗的母猪中,病毒阳性母猪的患病率也存在抚育差异(14%比3%,p= 0.053)4).
图中显示了swIAV和swIAV抗体流行率与全入/全进(AIAO)隔离管理的比较。2c.对检疫进行AIAO管理的定义是,所有新入检疫的猪同时进入检疫区,所有猪同时离开检疫区,导致母猪群中不会持续摄入母猪。在这10个畜群中,有5个畜群接受了AIAO管理(表1)5).
在采用AIAO管理的畜群中,血清阳性(81% vs. 39%,p< 0.0001)和swIAV阳性(19 vs 4%,p= 0.002)的母猪(表4).
结合检疫疫苗接种和AIAO管理的结果,5个既没有接种疫苗也没有AIAO管理检疫的牛群在检疫期结束时出现了18只(23%)病毒阳性的母猪。在对母猪进行检疫接种而不进行AIAO管理或未对母猪进行疫苗接种而实施AIAO管理的畜群中,病毒阳性分别为3%和5%(表2)5).10个畜群均未进行过母猪检疫接种和AIAO管理。
以畜群为固定效应的回归模型显示,在隔离期结束时,使用swIAV疫苗或AIAO管理隔离,病毒脱落的风险显著降低(表2)6).
调查问卷
问卷调查结果及核对表见表3.和附加文件3.:表S1。表格3.提供在接种了疫苗的畜群中应用的疫苗接种策略的概述。简而言之,应该指出的是,在接种流感疫苗的猪群中,只有两个猪群在隔离期间进行了初级(prime-boost)疫苗接种,所有猪群在其大规模母猪疫苗接种计划中都包括了母猪/一胎母猪。此外,所有接种疫苗的牛群在接种流感疫苗的同时,还接种了其他几种疫苗。具体来说,第10畜群正在使用一种针对猪繁殖和呼吸综合征病毒(PRRSv)的改良活疫苗,同时使用Respiporc FLU3疫苗(Ceva Santé Animale,法国)。额外的文件3.表S1提供了有关畜群规模和生产系统以及人员健康状况、检疫地点和管理以及IAV疫苗接种情况的信息。简而言之,应该指出的是,其中5个猪群持续向母猪群摄入母猪,只有一个猪群的工作人员(7名工人中有4名)接种了人类季节性流感病毒疫苗。
谱系和测序
从9个swIAV阳性畜群中的6个(4个未接种疫苗,2个接种疫苗)中,可以通过测序确定畜群中流通的HA和NA谱系。其余3个swIAV阳性畜群的病毒载量太低,无法获得高质量的序列。将HA和NA序列与Respiporc FLU3中相应疫苗株的序列进行比较[18)(表3.).对于鉴定出欧亚鸟类H1谱系(H1av)血凝素(HA)蛋白的四个畜群,将其与Respiporc FLU3相应的H1av疫苗成分进行比较。比较显示出主要的差异,因为总体氨基酸身份在89-92%之间,并且抗原位点(as)和受体结合位点(RBS)的几个残基是不同的(表7和附加文件4:图S1)。四个畜群中有一个畜群接种了Respiporc FLU3疫苗(畜群10)。剩下的接种过疫苗的人群可以从中确定流行毒株的谱系,当检测到H1pdm09N1av毒株时,发现使用了不匹配的疫苗。
1号畜群是一个新开始的畜群,有一个新的种畜。有趣的是,在隔离结束时,该母猪群中30%的母猪对H1N1pdm09呈阳性反应,从而使swIAV引入新建立的母猪群的风险很高,在本研究中,至少在母猪、一胎母猪和仔猪中没有记录swIAV。因此,决定调查3个月后swIAV是否在母猪群中传播。值得注意的是,这些“随访”样本显示,在分娩单元中获得的9/12池中有H1N1pdm09阳性,包括1至4周龄的猪。
讨论
本研究提出的结果表明,母猪和胎次母猪有助于swIAV的传播动态,因为在这些动物的整个生产阶段(检疫进出、交配和分娩)都可以检测到swIAV。
根据在母猪和胎次母猪中检测到swIAV的不同生产阶段,可以预期会产生不同的影响。在检疫开始时出现swIAV病毒阳性的母猪,要么表明该病毒是由供方畜群的母猪引入的,要么是由于不适当的生物安全措施而从母猪畜群引入检疫的[24,25].然而,本研究的结果表明,如果采用AIAO管理检疫,并且不持续摄入母猪,那么在检疫开始时出现swIAV的后果不一定会造成问题,因为swIAV的传播在检疫期结束时就会停止传播。这反过来也取决于整个隔离期的长度。
另一方面,在检疫结束时出现swIAV阳性的母猪,对猪群构成了一个主要问题,因为swIAV最有可能在母猪引进期间被引入母猪群。如果母猪感染了另一种swIAV毒株/谱系,而不是在母猪群中传播的病毒,或者如果母猪群对swIAV呈阴性,如第一群所示,这尤其值得关注。幸运的是,我们的研究结果表明,对检疫母猪采取额外的生物安全措施,如AIAO管理,可以在母猪进入母猪群之前限制swIAV在母猪中的存在。另一种选择是在隔离期间对母猪进行初级疫苗接种(prime-boost),我们的结果也表明,这对限制隔离结束时swIAV的存在有影响。所纳入的十个猪群中,没有一个既采用AIAO管理检疫,又在检疫范围内使用初级swIAV疫苗接种(prime-boost)。我们期望这将是降低将swIAV引入母猪群风险的最佳方法。在之前的一项研究中已经调查了引入swIAV阳性母猪的后果,该研究记录了在母猪群中引入swIAV阳性母猪时,出现swIAV阳性3周龄仔猪的风险增加了1.67倍[10].这些结果可以解释为什么另一项研究发现,利用数学建模,尽量减少每年引进的母猪数量可以降低swIAV循环的地方性动物水平的风险[9].
另一种新型IAV传入兽群的途径是受感染人员。值得注意的是,没有一个研究畜群鼓励员工接种季节性流感疫苗,只有一个畜群的少数员工接种了IAV疫苗。在1号兽群中,H1N1pdm09可能是从外部来源(如在兽群中工作的人)引入隔离的,因为病毒只在隔离期结束时才存在。病毒不太可能是从母猪群引入隔离区的,因为母猪群是新建立的,对swIAV检测呈阴性。进一步支持这一观点的是,在采样期间,H1N1pdm09是丹麦主要的季节性流感[26].
交配单元的母猪在引入母猪群1周后检测到SwIAV,这意味着母猪可能从隔离中将病毒引入母猪群。另一种选择是,母猪进入母猪群naïve到母猪群品系时,在交配单元中被感染。对于接种了疫苗的猪群来说,这可能是由于母猪在隔离期间没有接受完整的初级(prime-boost) swIAV疫苗接种,或者由于疫苗株刺激的抗体与猪群株之间缺乏同源性。在本研究中测序的不同群体株疫苗株的HA和NA蛋白之间确实存在很大的差异。此外,在疫苗株和群体株之间发现的一些变化是在抗原位点和受体结合位点上发现的,这表明它们可能会对疫苗的效率产生负面影响。先前的几项研究已经记录了H1av谱系的大规模遗传漂变,并将其与主要抗原距离联系起来,表明不同H1毒株之间极有可能缺乏交叉保护[13,14,27,28,29,30.,31,32].
根据我们的结果,疫苗似乎能够刺激明显的抗体反应,因为接种疫苗的群体通常有较高的抗体阳性的母猪和一胎母猪的患病率。然而,该结果并没有证明血清阳性母猪和一胎母猪患病率的增加与仔猪swIAV检出率的降低有关。这可能强调了疫苗株和群体株之间具有同源性的重要性[33,34],人类IAV疫苗也是如此,已知抗原位点的少数突变可导致非常低的效率[35,36].然而,也不能指望Respiporc FLU3疫苗(Ceva Santé Animale, France)会降低猪群中swIAV的流行率,因为它并没有声称提供无菌免疫,而是减少了临床症状和病毒向肺部的传播[18],本研究未对其进行评估。应该提到的是,本研究中包括的畜群不是随机选择的,因此选择可能有偏差。然而,所有的计算都考虑了种群间的差异。
当在一个特定的群体中选择疫苗接种策略时,疫苗刺激的免疫持续时间是重要的考虑因素。一般而言,丹麦现有的swIAV疫苗声称免疫期为3-6个月[18,37].这意味着,在这项研究中,每年三次大规模接种母猪疫苗的畜群可能会在母猪体内保持高抗体水平方面存在问题。此外,通过使用大规模母猪疫苗接种,你有可能在母猪第一次分娩前不给母猪/初胎母猪再次接种疫苗,这意味着它们缺乏增强剂,可能会削弱通过初乳mda在分娩前转移到仔猪的抗体数量。先前的研究表明,仔猪中获得的丙二醛水平对于预防swIAV感染和疾病很重要[38,39,40,41].因此,母猪进入母猪群后应采用单独的疫苗接种策略,以确保足够的MDA水平。
另一方面,本研究所有接种了疫苗的畜群在对母猪进行swIAV疫苗接种的同时,也进行了其他疫苗接种。第10牧群使用改良活疫苗(MLV)接种了PRRSv疫苗。据作者所知,swIAV和PRRSv疫苗之间可能的相互作用尚未得到调查。然而,另一项研究表明,MLV PRRSv疫苗与灭活支原体疫苗一起应用具有负面影响[42],同时感染PRRSv和swIAV已被证明可提高疾病的严重程度[43].因此,在未来的研究中,应该研究swIAV和MLV之间可能的相互作用。
最后,在1周大的仔猪中检测到swIAV证实了先前几项记录极早期swIAV感染的研究结果,并进一步证实了swIAV从母猪到仔猪和/或仔猪到母猪的传播,如前所述[1,5,8,13,16,44].在产房中进行swIAV循环并不理想,因为高增殖母猪处于高生产压力和哺乳期高峰。此外,在此期间,仔猪经常在母猪之间混合,从而促进了swIAV在仔猪之间的进一步传播,并导致了swIAV的种群状态。
结论
综上所述,结果表明,母猪和胎次母猪在猪群中对swIAV的持续传播和新引入有显著贡献。然而,适当的检疫管理,包括AIAO和检疫中的初级(主-增强)swIAV疫苗接种,可以帮助在母猪进入母猪群之前减少swIAV在母猪中的存在。此外,大规模的母猪疫苗接种计划可以提高抗体阳性母猪的患病率和抗体水平,但其他因素如疫苗-群体毒株同源性可能会影响疫苗的效益。
数据和材料的可用性
所有数据均包含在原稿和补充材料中。序列可在NCBI Genbank获得。
缩写
- AIAO:
-
全进/全出
- 为:
-
抗原的网站
- Ct:
-
循环阈值
- ELISA:
-
酶联免疫吸附试验
- 哈:
-
血凝素
- IAV:
-
甲型流感病毒
- MDA:
-
母源抗体
- MLV:
-
改良活疫苗
- 拿拿淋:
-
神经氨酸酶
- PRRSv:
-
猪繁殖与呼吸综合征病毒
- 苏格兰皇家银行(RBS):
-
受体结合位点
- 实时RT PCR:
-
实时逆转录聚合酶链反应
- swIAV:
-
甲型猪流感病毒
参考文献
Ryt-Hansen P,等。纵向实地研究显示,尽管存在来自母体的抗体,仔猪仍会早期感染甲型流感病毒并持续存在。兽医决议2019;50:36。https://doi.org/10.1186/s13567-019-0655-x.
Simon-Grifé M,等。两个猪场猪流感病毒感染动态分析纵向评估结果。兽医决议2012;43:24。https://doi.org/10.1186/1297-9716-43-24.
罗斯N,等。A型流感病毒在永久感染猪场的感染动态:反复感染、几种猪流感病毒传播和重组事件的证据。兽医决议2013;44:72。https://doi.org/10.1186/1297-9716-44-72.
Allerson MW, Davies PR, Gramer MR, Torremorell M. 2009年H1N1流感大流行病毒在两位点猪群中的感染动态。跨界新兴杂志,2014;61:490-9。https://doi.org/10.1111/tbed.12053.
Diaz A,等。猪场内A型流感病毒的全基因组测序揭示了不同病毒基因型的出现、持续和消退。中国病毒学杂志,2017;91:e00745-e817。https://doi.org/10.1128/JVI.00745-17.
Diaz A,等。在流行事件期间,相似和不同的A型流感病毒的多个基因组星座在猪中共同循环。科学通报2017;7:11886。https://doi.org/10.1038/s41598-017-11272-3.
Diaz A,等。A型流感病毒感染与地方性感染种猪亚群之间的关系。PLoS ONE。2015; 10: e0129213。https://doi.org/10.1371/journal.pone.0129213.
Ryt-Hansen P,等。甲型猪流感病毒血凝素蛋白的大量抗原漂移。2020年病毒。。https://doi.org/10.3390/v12020248.
White LA, Torremorell M, Craft ME。猪种猪群中的甲型流感病毒:疫苗接种和生物安全措施相结合可以降低地方性仔猪水库的可能性。2017年。https://doi.org/10.1016/j.prevetmed.2016.12.013.
Chamba Pardo FO,等。与仔猪在断奶时感染甲型流感病毒相关的育种到断奶农场因素。兽医医学。2018。https://doi.org/10.1016/j.prevetmed.2018.10.008.
SerafiniPoetaSilva AP,等。巴西南部种猪群中与甲型流感病毒血清流行率相关的生物安全措施2019年。https://doi.org/10.1016/j.prevetmed.2019.02.013.
Simon-Grifé M,等。西班牙猪流感的血清流行率和危险因素。兽医微生物,2011。https://doi.org/10.1016/j.vetmic.2010.10.015.
Ryt-Hansen P,等。急性甲型流感病毒在地方性动物感染母猪群中的爆发:对病毒动力学、遗传和抗原变异性以及母源抗体和疫苗接种效果的影响。PLoS ONE。2019; 14: e0224854。https://doi.org/10.1371/journal.pone.0224854.
Ryt-Hansen P,等。携带季节性人类流感病毒和猪流感病毒基因的猪中多种a型流感重组基因的共循环。Elife。2021;10:e60940。https://doi.org/10.7554/eLife.60940.
Nagy A,等。用于普遍检测来自鸟类和哺乳动物的甲型流感病毒的一步实时RT-PCR检测方法的开发和评估《病毒学》,2010;155:665-73。https://doi.org/10.1007/s00705-010-0636-x.
Ryt-Hansen P, Larsen I, Kristensen CS, Krog JS, Larsen LE。甲型流感病毒疫苗对感染地方性兽疫母猪群仔猪的影响有限。兽医科学2019;127:47-56。https://doi.org/10.1016/j.rvsc.2019.10.015.
C. Edgar, R. MUSCLE:多序列比对,高精度,高通量。2013.https://doi.org/10.1093/nar/gkh340.
IDT Biologika GmbH。附件一产品特性概要- respiporc FLU3。1 - 6页。https://www.ema.europa.eu/en/documents/product-information/respiporc-flu3-epar-product-information_en.pdf.
Manicassamy B,等。通过1918年类猪H1N1疫苗和经典猪H1N1疫苗保护小鼠免受2009年甲型H1N1流感病毒的致命挑战。科学通报。2010;6:e1000745。https://doi.org/10.1371/journal.ppat.1000745.
Caton AJ, Brownlee GG, Yewdell JW, Gerhard W.流感病毒A/PR/8/34血凝素(H1亚型)的抗原结构。细胞。1982;31:417-27。https://doi.org/10.1016/0092 - 8674 (82) 90135 - 0.
Rudneva I等。2009年甲型H1N1流感病毒逃逸突变体:血凝素抗原特异性和受体亲和力的变异。病毒决议2012;166:61-7。https://doi.org/10.1016/j.virusres.2012.03.003.
王志强,王志强,王志强,等。流感病毒H1型血凝素结构和功能的分子基础。Proc Japan Acad Ser B. 2012; 88:226-49。https://doi.org/10.2183/pjab.88.226.
R统计计算基金会,维也纳。R:用于统计计算的语言和环境。
Torremorell M, Allerson M, Corzo C, Diaz A, Gramer M.甲型流感病毒在猪中的传播。跨界新兴Dis 2012; 59:68-84。https://doi.org/10.1111/j.1865-1682.2011.01300.x.
Allerson MW, Cardona CJ, Torremorell M.甲型流感病毒在两种不同生物安全环境下猪群之间的间接传播。PLoS ONE。2013; 8: e67293。https://doi.org/10.1371/journal.pone.0067293.
研究所,S.血清。丹麦国家流感监测。https://www.ssi.dk/aktuelt/nyhedsbreve/influenza-nyt.
Henritzi D,等人。对欧洲家猪种群的监测发现了一个潜在的人畜共患甲型猪流感病毒的新储存库。细胞宿主微生物,2020。https://doi.org/10.1016/j.chom.2020.07.006.
Deblanc C,等。来自欧洲类人重组猪H1N2流感病毒的新抗原变异的致病性和逃避疫苗保护的评价病毒。2020;12:1155。https://doi.org/10.3390/v12101155.
Zell R,等。德国新型H1N2重组株取代Gent/1999年类人猪H1N2流感病毒A系拱门病毒,2020年。https://doi.org/10.1007/s00705-019-04457-w.
沃森SJ,等。2009年至2013年在欧洲猪中传播的流感病毒的分子流行病学和进化中国病毒学杂志,2015;https://doi.org/10.1128/JVI.00840-15.
刘易斯NS,等。甲型猪流感病毒的全球抗原多样性。Elife。2016;5:e12217。https://doi.org/10.7554/eLife.12217.
Trebbien R,等。丹麦流行的禽样H1N1和H3N2亚型重组产生的一种鸟样H1N2猪流感病毒的遗传和生物学特征中国生物技术研究院,2013;https://doi.org/10.1186/1743-422X-10-290
文森特·艾尔等人。甲型流感疫苗。兽医微生物,2017;206:35-44。https://doi.org/10.1016/j.vetmic.2016.11.026.
Reeth KV, Ma W.猪流感疫苗:改还是不改,这是个问题。《微生物免疫学杂志》2013。https://doi.org/10.1007/82-2012-266.
Petrie JG,等。针对当前甲型流感(H1N1)疫苗株的抗体不能保护一些人免受当前流行的甲型流感(H1N1)病毒株的感染。中国传染病杂志,2016;214:1947-51。https://doi.org/10.1093/infdis/jiw479.
Petrova VN, Russell CA.季节性流感病毒的进化。微生物学报,2018;16:47-60。https://doi.org/10.1038/nrmicro.2017.118.
IDT Biologika GmbH。附件1产品特性概要- respiporc氟潘。1 - 6页,https://www.ema.europa.eu/en/documents/product-information/respiporc-flupan-h1n1-epar-product-information_en.pdf.
抗体介导的免疫抑制对猪流感感染临床、病毒和免疫反应的影响。Am J Vet Res. 1975; 36:5-13。
Deblanc C,等。母源性抗体不能抑制猪流感病毒在仔猪中的复制,但会降低排泄病毒的传染性并损害感染后免疫反应。兽医微生物,2018;216:142-52。https://doi.org/10.1016/j.vetmic.2018.01.019.
Cador C,等。来自母体的抗体不能防止甲型猪流感病毒在猪之间的传播。兽医决议2016;47:86。https://doi.org/10.1186/s13567-016-0365-6.
罗芬WL,海宁P,比安奇AT,洪曼W,魏海登JH。母源抗体对猪初次和继发感染H1N1流感病毒后临床体征和免疫反应的影响兽医免疫学杂志,2003;92:23-35。https://doi.org/10.1016/s0165 - 2427 (03) 00019 - 9.
张志刚,张志刚,张志刚。猪肺炎支原体对猪繁殖与呼吸综合征病毒(PRRSV)感染的影响。疫苗。2000。https://doi.org/10.1016/s0264 - 410 x (99) 00395 - 3.
Van Reeth K, Nauwynck H, Pensaert M.猪繁殖和呼吸综合征病毒继发于猪呼吸道冠状病毒或猪流感病毒的双重感染:临床和病毒学研究。兽医微生物学,1996;48:325-35。https://doi.org/10.1016/0378 - 1135 (95) 00145 - x.
Garrido-Mantilla J等。田间条件下护理母猪对猪中甲型流感病毒传播的影响2021;188:105257。https://doi.org/10.1016/j.prevetmed.2021.105257.
确认
作者要感谢参与的畜群和畜群兽医。
资金
这项研究由丹麦SEGES猪研究中心资助。
作者信息
作者及隶属关系
贡献
PRH起草了手稿,设计了研究,并协助分析数据。HGN和SSS获得了所有的样品,进行了所有的分析和校对手稿。IL帮助设计研究,并协助统计分析和校对论文。CSK帮助设计了研究并校对了手稿。LEL帮助设计研究,协调研究和校对手稿。所有作者都阅读并批准了最终的手稿。
相应的作者
道德声明
伦理和同意参与
这项研究不需要伦理批准,因为它只包括了类似于牛群常规诊断的抽样。所有牧群主人都同意参与这项研究。
相互竞争的利益
一位作者曾在SEGES丹麦猪研究中心工作。SEGES从事私人研究、创新和知识传播。SEGES涵盖农业和农场管理的所有方面,从作物、气候和环境、自然保护到畜牧业和有机生产。知识通过各种渠道传播,例如丹麦和国际期刊上的技术和科学文章。SEGES与国内和国际上的一系列私人和公共研究机构以及知识传播组织合作。SEGES的几个项目全部或部分由公共资金资助。作者声明,这项研究是在没有商业或财务关系的情况下进行的,这些关系可能被解释为潜在的利益冲突。
额外的信息
出版商的注意
伟德体育在线施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
补充信息
附加文件1:表S2。
问卷调查。
附加文件2:表S3。
清单。
附加文件3:表S1。
畜群信息,包括生物安全措施和检疫管理。*“SPF状态”是通过宣布不受特定病原体感染而获得的健康状态。蓝色状态表示您没有肺炎支原体(MYC)、胸膜肺炎放线菌血清型2 (AP2)、6 (AP6)和12 (AP12)、PRRSv 1型和2型、舌痢疾短螺旋体、多杀性巴氏杆菌、猪肉麻球菌和猪血蜱。“NA”表示群没有SPF健康状态。
附加文件4:图S1。
对Respiporc FLU3 (Haselünne/IDT2617/2003 (H1N1))中包含的H1av疫苗株,以及在第2、第4、第5和第10群中获得的4株H1av株进行氨基酸比对。疫苗株和群体株之间的氨基酸差异用红色标记,字母表示特定的氨基酸残留。灰色箭头突出了H1的抗原位点(Ca1, Ca2, Cb, Sa和Sb),而绿色箭头突出了受体结合位点。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条所提供的资料,除非在资料的信用额度中另有说明。
关于本文
引用本文
莱特-汉森,P.,尼尔森,h.g., Sørensen, S.S.et al。母猪在猪流感病毒传播动态中的作用以及疫苗接种策略和检疫管理的影响。Porc Health Manag8, 19(2022)。https://doi.org/10.1186/s40813-022-00261-2
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s40813-022-00261-2
关键字
- 甲型猪流感病毒
- 动物病感染
- 金边债券
- 检疫
- 生物安全
- 疫苗接种
- 管理