弗林WT,赛义夫LJ。猪肠内杯状病毒样病毒在原代猪肾细胞培养中的连续繁殖。中华微生物学杂志,1988;26:206-12。
文章中科院谷歌学者
Green KY, Chanock RM, Kapikian AZ.人类杯状病毒。进:Knipe DM, Howley PM,编辑。病毒学领域。费城:利平科特·威廉姆斯和威尔金斯;2001.p . 841 - 74。
谷歌学者
郭敏,艾佛曼。临床正常水貂可培养杯状病毒及与水貂腹泻相关的肠道杯状病毒的检测与分子特性。拱微生物学报,2001;146:479 - 93。
科奇·马修·d和舒尔茨·切里·斯泰西。鸟类astroviruses。鸟类病理学,2002;31日213 - 27所示
Martella V, Moschidou P, Buonavoglia C.狗的星状病毒。兽医临床杂志。2011;41(6):1087-95。https://doi.org/10.1016/j.cvsm.2011.09.001.
文章PubMed公共医学中心谷歌学者
Green KY, Ando T, Balayan MS, Berke T, Clarke IN, Estes MK, Matson DO, Nakata S, Neill JD, Studdert MJ, Thiel HJ。杯状病毒的分类。中华传染病杂志2000;18:S322-30。
文章谷歌学者
杯状病毒复制与逆向遗传学。病毒性肠胃炎,2016;p . 355 - 78。https://doi.org/10.1016/B978-0-12-802241-2.00017-1
Vinjé J.诺如病毒检测和分型的实验室方法进展。中国临床微生物学杂志,2015;https://doi.org/10.1128/JCM.01535-14.
文章中科院PubMed公共医学中心谷歌学者
冈田,王强,片山K,赛义夫。人皂荚病毒综合综述。临床微生物学杂志2015;28:32-53。https://doi.org/10.1128/CMR.00011-14.
文章中科院PubMed公共医学中心谷歌学者
Sunagaa F, Masudab T, Aokic H, Itod M, Sanoe K, Naoie Y, Katayamae Y, Omatsue T, Obae M, Furuyag T, Shiraig J, Mizutanie T, Okah T, Nagaia M.猪皂形病毒基因群(G) X和GXI的全基因组测序和遗传特征:GVI, GVII, GX和GXI皂形病毒具有共同的基因组特征,形成独特的猪SaV分支。感染Genet Evol, 2019。doi:https://doi.org/10.1016/j.meegid.2019.103959
Poel WH, Vinjé J, Heide R, Herrera MI, Vivo A, Koopmans MP。农场动物诺瓦克样杯状病毒基因。新兴感染杂志2000;6:36-41。
文章谷歌学者
Sugieda M, Nakajima S.在健康猪盲肠内容物中检测到的病毒代表诺瓦克样病毒属基因组II中的一个新的遗传簇。病毒决议2002;87:165-72。
文章中科院谷歌学者
王强,韩mg, Cheetham S, Souza M, Funk JA, Saif LJ。猪诺如病毒与人类诺如病毒相关。新兴感染,2005;11:1874-81。https://doi.org/10.3201/eid0601.000106.
文章中科院PubMed公共医学中心谷歌学者
郑东,Ando T, Fankhauser RL, Beard RS, Glass RI, Monroe SS.诺瓦克病毒分类及其命名方法。病毒学。2006;346:312-23。
文章中科院谷歌学者
Di Bartolo I, Tofani S, Angeloni G, Ponterio E, Ostanello F, Ruggeri FM。意大利猪杯状病毒的检测与鉴定。Arch Virol. 2014; 159:2479-84。
文章谷歌学者
晁东,魏军,常伟,王娟,王磊。台湾无症状猪杯状病毒多基因型感染的检测。人畜共患病公共卫生,2012;59:434-44。
文章谷歌学者
库尼亚JB, de Mendonça MCL, Miagostovich MP, Leite JPG。拉丁美洲首次发现猪诺如病毒GII.18。兽医科学2010;89年,126 - 9。
Cunha J, de Mendonça M, Miagostovich M, Leite J.巴西里约热内卢de Janeiro州猪肠道杯状病毒的遗传多样性。中国生物医学工程学报,2010;
文章中科院谷歌学者
Keum H, Moon H, Park S, Kim H, Rho S, Park B.韩国养猪场的猪诺如病毒和皂化病毒。Adv Virol, 2009; 154:1765-74。
中科院谷歌学者
Mauroy A, Scipioni A, Mathijs E, Miry C, Ziant D, Thys C, Thiry E.比利时猪中的诺如病毒和圣病毒。阿奇·维罗尔,2008;153:1927-31。https://doi.org/10.1007/s00705-008-0189-4.
文章中科院PubMed谷歌学者
Mijovski JZ, poljak - prijatelj M, Steyer A, barliv - maganja D, Koren S.斯洛文尼亚农场无症状猪和牛诺瓦克病毒和沙病毒的检测和分子特征。《传染病杂志》2010;10:413-20。
文章中科院谷歌学者
沈强,张伟,杨松,崔玲,华霞。一株新基因型猪诺如病毒的全基因组序列。中国病毒学杂志,2012;86:7015-6。
文章中科院谷歌学者
席尔瓦PF,阿尔菲利AF,巴里AF,莱姆R,加迪纳利N,普尔W,阿尔菲利AA。热带动物健康和生产在巴西生猪生产系统中,猪诺瓦克病毒感染的发生率很高。热带动物健康杂志,2015;47:37 - 41。
文章谷歌学者
赛赛Z,吉坑A,贝赫N,贝雷G,阿贝加兹WE,王庆华,赛义夫LJ。埃塞俄比亚首次在猪中检测到具有人畜共患潜力的萨病毒和诺如病毒。Arch Virol. 2016; 161:2739-47。
文章中科院谷歌学者
王庆昌,王志强,王志强。猪肠内杯状病毒与人类杯状病毒的遗传和抗原相关性、诊断和流行病学。疫苗。2007;25:5453 - 66。
文章中科院谷歌学者
王强,苏泽M,范克JA,张伟,赛义夫。通过逆转录pcr和微孔杂交测定不同年龄猪中诺如病毒和皂形病毒的流行率。临床微生物学杂志。2006;44:2057-62。
文章中科院谷歌学者
Scheuer K, Oka T, Hoet A, Gebreyes W, Molla B, Saif L, Wang Q.猪诺如病毒流行、美国肥育猪新发猪皂化病毒分子特征及皂化病毒统一分类方案。中国临床微生物学杂志,2013;
文章谷歌学者
Flynn WT, Saif LJ, Moorhead PD。猪肠内杯状病毒样病毒在4日龄未生猪中的发病机制。amj兽医Res. 1988; 49:819-25。
中科院PubMed谷歌学者
郭敏,海耶斯J, Cho KO, Parwani AV, Lucas LM, Saif LJ。组织培养与野生型考登猪肠杯状病毒(PEC)在无生猪体内的发病机制及静脉接种野生型考登猪肠杯状病毒诱导腹泻的比较中国病毒学杂志2001;75:9239-51。https://doi.org/10.1128/JVI.75.19.9239-9251.2001.
文章中科院PubMed公共医学中心谷歌学者
Collins PJ, Martella V, Buonavoglia C, O 'Shea H.爱尔兰农场无症状动物中猪皂形病毒的检测和特征。兽医微生物学杂志,2009;139:176-82。https://doi.org/10.1016/j.vetmic.2009.05.013.
文章中科院PubMed谷歌学者
金浩,文洪杰,朴世杰,金洪洪,朴博凯。韩国养猪场的猪诺如病毒和皂化病毒。《寄生虫学》,2009;154:1765-74。https://doi.org/10.1007/s00705-009-0501-y.
文章中科院PubMed谷歌学者
Reuter G, Zimsek-Mijovski J, polj萨克- prijatelj M, Di Bartolo I, Ruggeri FM, Kantala T,等。欧洲猪sap病毒的发病率、多样性和分子流行病学。临床微生物学杂志。2010;48:363-8。https://doi.org/10.1128/JCM.01279-09.
文章中科院PubMed谷歌学者
张伟,沈强,华鑫,崔玲,刘娟,杨松。中国猪萨波病毒株首次在仔猪中引起肠胃炎暴发。中国病毒学杂志,2008;82:8239-40。https://doi.org/10.1128/JVI.01020-08.
文章中科院PubMed公共医学中心谷歌学者
Cunha JB, de Mendonça MC, Miagostovich议员,Leite JP。里约热内卢州饲养的猪肠道杯状病毒的遗传多样性。巴西拱门病毒,2010;155:1301-5。https://doi.org/10.1007/s00705-010-0695-z.
文章中科院PubMed谷歌学者
刘国华,李荣荣,黄志斌,杨军,肖婷婷,李娟,等。RT-PCR法检测湖南断奶仔猪猪萨波病毒。热带动物保健,2012;44:1335-9。https://doi.org/10.1007/s11250-012-0138-9.
文章PubMed谷歌学者
Martínez MA, Alcalá AC, Carruyo G, Botero L, Liprandi F, Ludert JE。委内瑞拉农场猪肠内杯状病毒的分子检测。兽医微生物学,2006;116:77-84。https://doi.org/10.1016/j.vetmic.2006.03.016.
文章中科院PubMed谷歌学者
Dufkova L, Scigalkova I, Moutelikova R, Malenovska H, Prodelalova J.猪萨布病毒、科布病毒和星状病毒在无症状猪中的遗传多样性:一种新兴的萨布病毒GIII基因型。《寄生虫学》,2013;158:549-58。https://doi.org/10.1007/s00705-012-1528-z.
文章中科院PubMed谷歌学者
于约金,金DG,金,李JB,公园SY,歌曲CS,胫骨HC, Seo KH、崔。戊型肝炎病毒和皂荚病毒在断奶仔猪中的流行情况及其遗传多样性的鉴定。《寄生虫学》,2008;153:739-42。
文章中科院谷歌学者
Cavicchio L, Tassoni L, Laconi A, Cunial G, Gagliazzo L, Milani A, Campalto M, Di Martino G, Forzan M, Monne I, Beato MS.意大利东北部猪群中未揭示的GII诺瓦克病毒遗传多样性。科学通报2020;10:9217。https://doi.org/10.1038/s41598-020-66140-4.
文章中科院PubMed公共医学中心谷歌学者
Villabruna N, Koopmans MPG, de Graaf M.动物作为人类诺瓦克病毒的宿主。病毒。2019;11(5):478。https://doi.org/10.3390/v11050478.
文章中科院公共医学中心谷歌学者
Mattison K, Shukla A, Cook A, Pollari F, Friendship R, Kelton D, Bidawid S, Farber JM。猪和牛身上的人类诺如病毒。新兴感染杂志2007;13:1184-8。
文章中科院谷歌学者
Rodríguez-Lázaro D, Diez-Valcarce M, Montes-Briones R, Gallego D, Hernández M, Rovira J.国际航空旅客非法进口到欧盟的肉类和肉制品中存在致病性肠道病毒。国际微生物学杂志。2015;209:39-43。
文章谷歌学者
诺如病毒株的出现:两个基因的故事。病毒进化第5卷,2019;2019年7月第2期,vez048,https://doi.org/10.1093/ve/vez048
Rivera R, Nollens HH, Venn-Watson S, Gulland FMD, Wellehan JFX Jr.海洋哺乳动物星状病毒系统发育多样性的特征。中国病毒学杂志,2010;29(1):344 - 344。https://doi.org/10.1099/vir.0.015222-0.
文章中科院PubMed谷歌学者
De Benedictis P, Schultz-Cherry S, Burnham A, Cattoli G.人类和动物中的星状病毒感染:分子生物学,遗传多样性和种间传播。中华流行病学杂志,2011;11(7):1529-44。
文章谷歌学者
Vu DL, Bosch A, Pintó R, Guix S.经典和新型人类星状病毒的流行病学:肠胃炎及其他疾病。病毒。2017;9(2):33。https://doi.org/10.3390/v9020033.
文章公共医学中心谷歌学者
Bouzalas IG, Wüthrich D, Walland J, Drögemüller C, Zurbriggen A, Vandevelde M, Oevermann A, Bruggmann R, Seuberlich T.欧洲非化脓性脑炎牛的嗜神经星形病毒。临床微生物学杂志,2014;52(9):3318-24。https://doi.org/10.1128/JCM.01195-14.
文章中科院PubMed公共医学中心谷歌学者
易松,牛健,王宏,董刚,郭勇,董宏,王凯,胡刚。东北家猫星状病毒的分子特征。PLoS ONE。2018; 13 (10): e0205441。https://doi.org/10.1371/journal.pone.0205441.
文章中科院PubMed公共医学中心谷歌学者
Arruda B, Arruda P, Hensch M,陈q,郑勇,杨c, Gatto IRH, Ferreyra FM, Gauger P, Schwartz K,等。猪脊髓灰质炎脑脊髓炎中枢神经系统中的猪星状病毒3型。新兴感染杂志,2017;23(12):2097-100。https://doi.org/10.3201/eid2312.170703.
文章中科院PubMed公共医学中心谷歌学者
Blomström AL, Widén F, Hammer AS, Belák S, Berg M.利用病毒宏基因组学检测抖貂综合征水貂脑组织中一种新型星状病毒。临床微生物学杂志,2010;48(12):4392-6。https://doi.org/10.1128/JCM.01040-10.
文章中科院PubMed公共医学中心谷歌学者
Bidin M, Bidin Z, Majnaric D, Tisljar M, Lojkic I.鸡和火鸡源星状病毒在家鸭体内的循环和系统发育关系。禽病原学杂志,2012;41(6):555-62。https://doi.org/10.1080/03079457.2012.733340.
文章中科院PubMed谷歌学者
Bidin M, Lojkic I, Tisljar M, Bidin Z, Majnaric D.鸭和鹅胚胎发育迟缓和孵化前死亡率相关的星状病毒。禽病原学杂志,2012;41(1):91-7。https://doi.org/10.1080/03079457.2011.642796.
文章中科院PubMed谷歌学者
Sajewicz-Krukowska J, Domanska-Blicharz K.从“白鸡”病鸡中分离出的一种新型星状病毒的近全基因组序列。中国寄生虫病杂志,2016;61(9):2581-7。https://doi.org/10.1007/s00705-016-2940-6.
文章中科院PubMed公共医学中心谷歌学者
布里杰JC。用电子显微镜检测腹泻仔猪粪便中的杯状病毒、星状病毒和轮状病毒样颗粒。兽医杂志1980;107(23):533 - 3。
中科院PubMed谷歌学者
刘志强,李志强,李志强,等。猪星形病毒在家猪中的高流行率和遗传异质性。兽医学杂志,2014;32(2):369 - 369。https://doi.org/10.1016/j.tvjl.2014.08.015.
文章PubMed谷歌学者
Bosch AGS, Krishna NK, Méndez E, Monroe SS, patin - jackwood M, Schultz-Cherry S.星状病毒科。In: King AMQ, Lefkowitz E, Adams MJ, Carstens EB, edotors。病毒分类学:病毒的分类和命名法(国际病毒分类学委员会第九次报告)。美国纽约:爱思唯尔学术出版社;2011;p . 953 - 959。
猪星状病毒的流行病学、诊断和临床意义综述。综述文章,Transbound Emerg Dis. 2021;00:1-12。2021年4月21日doi:https://doi.org/10.1111/tbed.14123
Padmanabhan A, Hause BM。急性呼吸道疾病猪鼻拭子猪星状病毒4基因型的检测与鉴定病毒学报,2016161(9):2575-2579。https://doi.org/10.1007/s00705-016-2937-1
张海辉,李建勇,胡WQ,宋yt, Opriessnig T,肖婷婷。2017年湖南省病猪和无症状猪星形病毒株高遗传多样性和重组事件病毒基因,2019;55(5):673-81。https://doi.org/10.1007/s11262-019-01692-w.
文章中科院PubMed谷歌学者
Xiao CT, Giménez-Lirola LG, Gerber PF, Jiang WH, Halbur PG, Opriessnig T.新型猪星形病毒(PAstV)的鉴定与鉴定。中国病毒学杂志,2013;44 (Pt3): 529 - 529。https://doi.org/10.1099/vir.0.048744-0.
文章中科院PubMed谷歌学者
李建军,李明哲,郑立林,刘宁,李德东,段志军。来自中国家仔猪的两种猪星状病毒的鉴定和遗传特性。中国生物防治学报。2015;30(12):339 - 344。https://doi.org/10.1007/s00705-015-2569-x.
文章中科院PubMed谷歌学者
Salamunova S., Jackova A., Mandelik R., Novotny J., Vlasakova M. & Vilcek S.斯洛伐克家猪肠道病毒的分子检测和猪星状病毒和沙病毒的遗传特征。BMC兽医研究2018。第14卷,文章编号:313
罗志刚,罗瑞生,李志刚,李志刚,李志刚,李志刚。猪体内多种新型流行星状病毒的研究。《兽医微生物学》2011;149(3): 316 - 323。2010年在线发布。doi:https://doi.org/10.1016/j.vetmic.2010.11.026
Mor SK, Chander Y, Marthaler D, Patnayak DP, Goyal SM。猪腹泻相关星状病毒株的检测与分子特征。中华兽医杂志。2012;24:106 - 7。https://doi.org/10.1177/1040638712458781.
文章谷歌学者
brniic D, prpiic J, Keros T, roic B, starehina V, jemeriira L.克罗地亚大量饲养的猪星形病毒病毒血症和高遗传变异性。《中国医学杂志》2013;14:258-64。
文章谷歌学者
马诺斯卡P, Ellerbroek L, Johne R.德国屠宰猪粪便中潜在人畜共患病毒的检测和特征。中国畜牧兽医杂志,2014;29(1):344 - 344。https://doi.org/10.1016/j.vetmic.2013.10.018.
文章PubMed谷歌学者
O 'Shea E, Collins P.J, Gunn L, Matthijnssens J, Zeller M., Heylen E., Conceicao-Neto N., McKillen J., Morgan J., Staines A., O 'Shea H.爱尔兰猪肠道病毒的分离与分析:猪星状病毒和猪teschovirus的近全基因组序列。ipv 2016; 1378年。
Arruda B, Arruda P, Hensch M,陈q,郑勇,杨c, Gatto IRH, Matias FF, Gauger P, Schwartz K,等。猪脊髓灰质炎脑脊髓炎中枢神经系统中的猪星状病毒3型。新兴感染杂志2017;23:2097-100。https://doi.org/10.3201/eid2312.170703.
文章中科院PubMed公共医学中心谷歌学者
拉查佩尔V.,莱泰利A.,弗拉瓦洛P.,布拉萨J., L'Homme .用肠道病毒作为分子标记的猪生产网络病毒分布动态。应用环境微生物学。2017;83 (4): e03187-16。2017年2月1日在线发布。2016年在线预出版。doi:https://doi.org/10.1128/AEM.03187-16
马蒂亚·范夫,阿鲁达·P., Hench M., Gatto I.R.H., Hause B.,李国强,陈强,郑勇,杨超,哈蒙·K.等。神经疾病和脑脊髓炎猪中枢神经系统组织中发散型猪星状病毒3型的鉴定:诊断调查、病毒特征和历史病例的回顾性分析美国兽医实验室诊断医师协会年会论文集;圣地亚哥,加利福尼亚州,美国。2017年10月12-18日。
Rawal G., Matias F.F., Mueller A., Allison G., Hedberg W., Macedo N., Bradner L., Harmon K., Linhares D., Arruda B.猪星状病毒3型是一种新兴的非典型神经疾病的病因:感染流的诊断病例和感染动态;美国猪兽医协会第50届年会论文集;奥兰多,佛罗里达州,美国。2019年3月9日至12日a。
Schiavon E., De Battisti C., Tonon F., Mion M., Mone I., Beato M.S.猪星状病毒在意大利仔猪肠道发病中的参与。ipv 2016;1257
秦勇,方强,李霞,李峰,刘浩,魏志,欧阳康,陈勇,黄伟。广西猪星形病毒分子流行病学及病毒血症研究。BMC Vet Res. 2019;15:471。https://doi.org/10.1186/s12917-019-2217-x.
文章中科院PubMed公共医学中心谷歌学者
Zhou W, Ullman K, Chowdry V, Reining M, Benyeda Z, Baule C, Juremalm M, Wallgren P, Schwarz L, Zhou E, pedro SP, Hennig-Pauka I, Segales J, Liu L.欧洲五国猪肠道病毒流行率和病毒载量的分子调查兽医微生物学。2016;182:75 - 81。doi:https://doi.org/10.1016/j.vetmic.2015.10.019.Epub 2015 10月21日
Rawal G., Ferreyra F.M., Macedo N.R., Bradner L.K., Harmon K.M., Mueller A., Allison G., Linhares D.C.L.和Arruda B.L.猪星状病毒3型在养殖场的检测和细胞趋同性。病毒。2019 b;11(11): 1051。2019年在线发布。doi:https://doi.org/10.3390/v11111051
Boros A, Albert M, Pankovics P, Bíró H, Pesavento PA, Phan TG, Delwart E, Reuter G.与断奶猪脑脊髓炎、虚弱和瘫痪相关的神经侵入性星状病毒暴发。匈牙利新兴传染病,2017;23:1999-2010。https://doi.org/10.3201/eid2312.170804.
文章中科院谷歌学者
Matias FF, Bradner LK, Burrough ER, Cooper VL, Derscheid RJ, Gauger PC, Harmon KM, Madson D, Piñeyro PE, Schwartz KJ, Stevenson GW, Zeller MA, Arruda BL.家猪脊髓灰质炎脑脊髓炎与猪星状病毒3型相关。兽医病理学。2020;57(1):82-9。https://doi.org/10.1177/0300985819875741.
文章中科院谷歌学者
国家养猪户猪星状病毒3型正在成为猪神经系统疾病的病因。2019年8月15日访问;网上:https://www.nationalhogfarmer.com/animal-health/porcine-astrovirus-type-3-emerging-cause-neurologic-disease-swine.
Mauroy, A, Van der Poel, W.H, Hakze-Van der Honing, R, Thys, C.和Thiry, E, SYBR绿色RT-PCR的开发和应用,用于猪萨波病毒感染的一线筛选和定量。BMC兽医研究,2012;8 (1), pp.1-11。
迪马蒂诺B,迪罗科C,塞西C,马西里奥F.猫杯状病毒从狗粪便样本分离的特征。兽医微生物学,2009;139(1): 52-57。2009年在线发布。doi:https://doi.org/10.1016/j.vetmic.2009.04.033
Ntafis V, Xylouri E, Radogna A, Buonavoglia C, Martella V.犬诺瓦克病毒感染在幼犬中的爆发。临床微生物学杂志,2010;48(7): 2605 - 8。2010年在线发布。doi:https://doi.org/10.1128/JCM.02528-09
Farkas T., Fey B., Parcells M., Ladman B., Murgia M.,和Saif Y.鸡和火鸡中新型小核糖核酸病毒的分子检测。病毒基因,2012;44(2): 262 - 272。2011年在线发布。doi:https://doi.org/10.1007/s11262-011-0695-4
蒋曦,黄培文,钟文敏,Farkas T, Cubitt DW, Matson DO。RT-PCR检测诺沃克和札幌样杯状病毒引物对的设计和评价中华病毒学杂志,1999;83:145-54。
文章中科院谷歌学者
乔健,田玲,孟q,张鑫,卢宏,宫生,程震,蔡鑫,张杰,张震,蔡凯,陈超。新疆仔猪猪萨波病毒感染的血清学和分子生物学调查。中国热带动物卫生杂志,2016;48(4):863-9。https://doi.org/10.1007/s11250-016-1023-8(Epub 2016年2月22日).
文章谷歌学者
张志刚,张志刚,张志刚。人类和动物柯布病毒流行病学研究。病毒病。2014; 25(2): 195 - 200。
文章谷歌学者
Proietto S, Killoran K, Leedom Larson KR.猪健康信息中心和食品安全和公共卫生中心,2016。http://www.cfsph.iastate.edu/pdf/shic-factsheet-porcine-kobuvirus.
Yamashita T, Sakae K, Ishihara Y, Isomura S, Utagawa E.新分离的细胞病变小圆病毒(爱知株)在日本的流行情况。临床微生物学杂志,1993;31(11):2938-43。
文章中科院谷歌学者
陈玲,朱玲,周勇,徐震,郭伟,杨伟。四川猪柯布病毒VP1区分子和系统发育分析。Virol J. 2013;第10卷,文章编号:281
King A.M.Q., Adams M.J., Carstens E.B., Lefkowitz E.J.病毒分类学:病毒的分类和命名:国际病毒分类学委员会的第九届报告。2011.
La Rosa G, Muscillo M, Di Grazia A, Fontana S, Iaconelli M, Tollis M.猪teschovirus和肠道病毒分子特征的RT-PCR检测。中华兽医医学杂志。2006;53(6):257-65。
文章谷歌学者
Buitrago D, Cano-Gomez C, Aguero M, Fernandez-Pacheco P, Gomez-Tejedor C, Jimenez-Clavero MA。西班牙猪粪便样本中小核糖核酸病毒和腺病毒的调查。中华兽医医学杂志。2010;22(5):736 - 6。
文章谷歌学者
Cano-Gomez C, Palero F, Buitrago MD, García-Casado MA, Fernández-Pinero J, Fernández-Pacheco P, Agüero M, Gómez-Tejedor C, Jiménez-Clavero MÁ。利用完整的VP1序列分析西班牙猪群中teschovirus的遗传多样性。中华流行病学杂志,2011;11(8):2144-50。
文章谷歌学者
Cano-Gomez C, Garcia-Casado MA, Soriguer R, Palero F, Jimenez-Clavero MA。西班牙野猪粪便样本中的teschovirus和sapelovirus。中国兽医杂志,2013;26(1):1 - 5。
文章中科院谷歌学者
兰德龙,季文华,杨世祥,崔玲,杨震,袁春,华霞。中国猪萨波病毒首株的分离与鉴定。中国寄生虫病杂志,2011;36(4):344 - 344。
文章中科院谷歌学者
Schock A, Gurrala R, Fuller H, Foyle L, Dauber M, Martelli F, Scholes S, Roberts L, Steinbach F, Dastjerdi A.英国一起由神经侵入性猪萨波病毒引起的脑脊髓炎暴发的调查。中国兽医杂志,2014;34(3):381-9。
文章谷歌学者
Dunne HW, Gobble JL, Hokanson JF, Kradel DC, Bubash GR.与新发现的SMEDI小核糖核酸病毒群相关的猪繁殖失败。美国兽医杂志,1965;26(11):1284-97。
中科院PubMed谷歌学者
路透社G, Boldizsár A, Pankovics P.猪柯布病毒的完整核苷酸和氨基酸序列和遗传组织,柯布病毒属科小核糖核酸病毒科一个新种的成员。中国寄生虫病杂志,2009;26(1):344 - 344。https://doi.org/10.1007/s00705-008-0288-2(Epub 2008 12月19日).
文章中科院PubMed谷歌学者
路透社G,潘科文P, Boros a .匈牙利家猪中新型星状病毒的鉴定。中国寄生虫病杂志,2011;36(1):339 - 339。https://doi.org/10.1007/s00705-010-0827-5(Epub 2010年10月8日).
文章中科院PubMed谷歌学者
库马尔S, Stecher G,李M, Knyaz C, Tamura K. MEGA X:基于计算平台的分子进化遗传学分析。中国生物医学杂志,2018;35(6):1547。
文章中科院谷歌学者
Leigh J, Bryant D. Popart:单倍型网络构建全功能软件。方法生态学报,2015;6:1110-6。https://doi.org/10.1111/2041-210X.12410.
文章谷歌学者

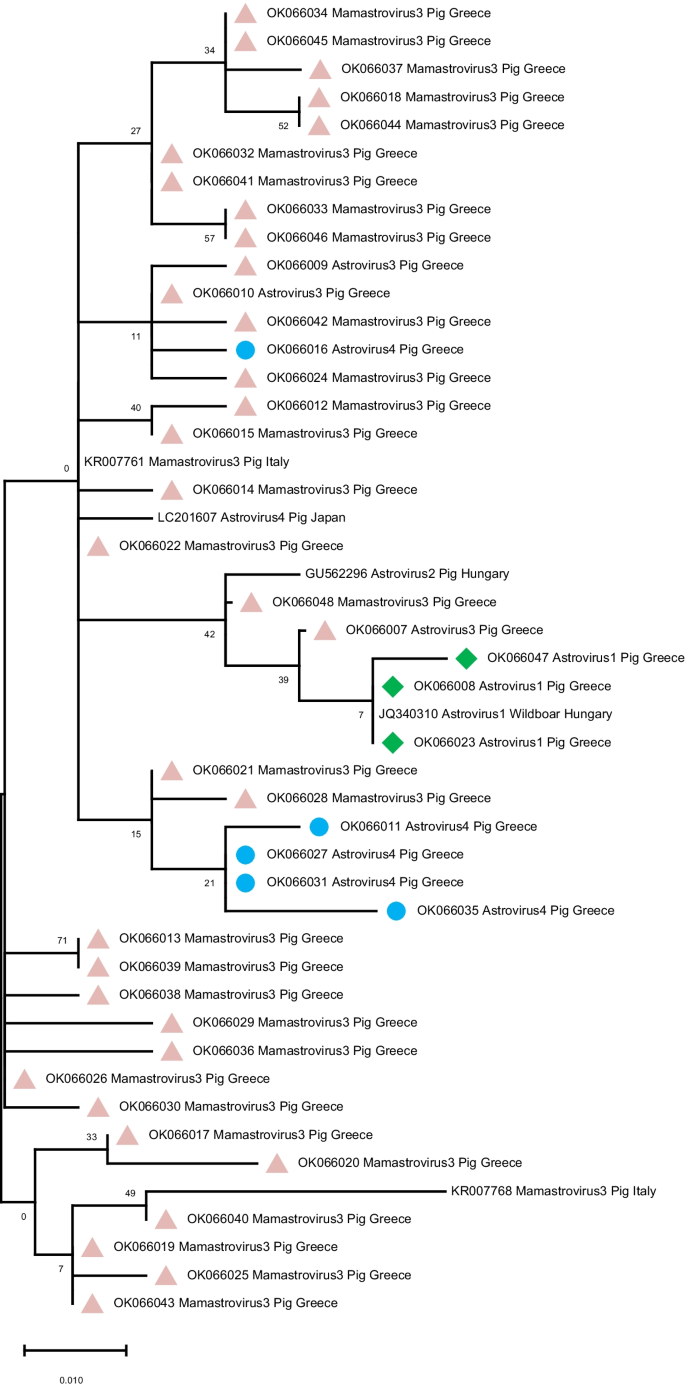
 ).本研究中检测到的PAstV1序列以绿色菱形标记(
).本研究中检测到的PAstV1序列以绿色菱形标记( ), PAstV4的序列用蓝色圈表示(
), PAstV4的序列用蓝色圈表示( ).GenBank登录号显示在树状图上
).GenBank登录号显示在树状图上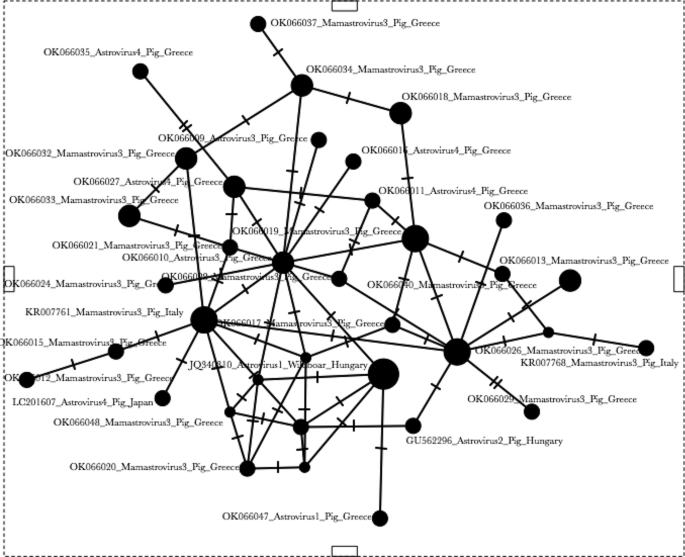
 ).GenBank登录号显示在树状图上
).GenBank登录号显示在树状图上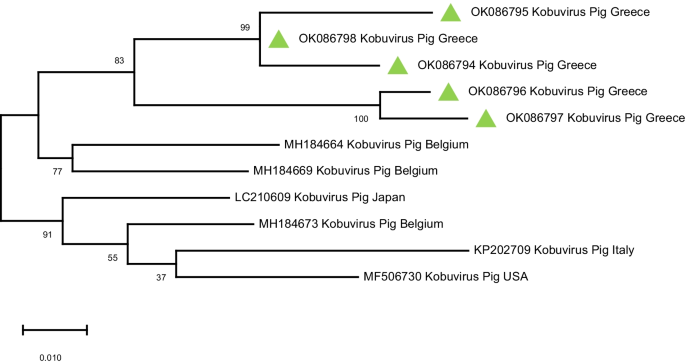
 ).从GenBank获得的猪Kobuvirus参考序列被纳入系统发育树。GenBank登录号显示在树状图上
).从GenBank获得的猪Kobuvirus参考序列被纳入系统发育树。GenBank登录号显示在树状图上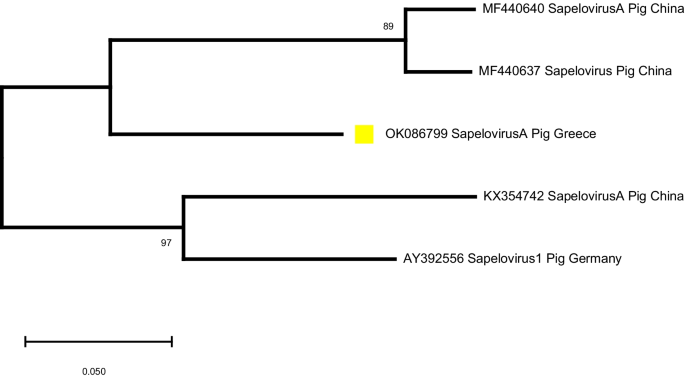
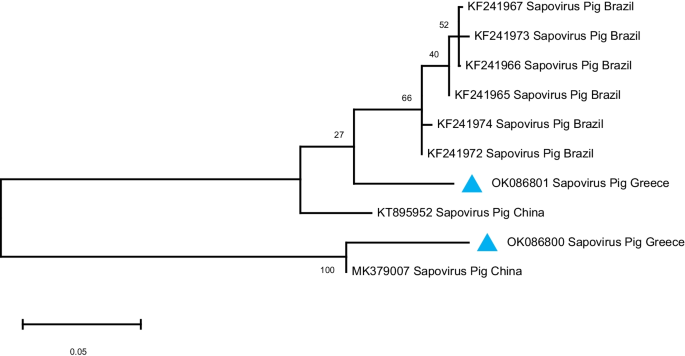
 ).从GenBank获得的猪萨波病毒参考序列被纳入系统发育树。GenBank登录号显示在树状图上
).从GenBank获得的猪萨波病毒参考序列被纳入系统发育树。GenBank登录号显示在树状图上