- 研究gydF4y2Ba
- 开放获取gydF4y2Ba
- 发表:gydF4y2Ba
bZIP转录因子UvbZIP6介导真菌生长,胁迫反应和假黑穗病的形成gydF4y2BaUstilaginoidea液对gydF4y2Ba
植物病理学研究gydF4y2Ba体积gydF4y2Ba4gydF4y2Ba文章编号:gydF4y2Ba32gydF4y2Ba(gydF4y2Ba2022gydF4y2Ba)gydF4y2Ba
摘要gydF4y2Ba
水稻假黑穗病,由gydF4y2BaUstilaginoidea液对gydF4y2Ba它是世界主要水稻产区最具破坏性的疾病之一。碱性亮氨酸拉链(bZIP)蛋白属于进化保守的转录因子家族,在真核生物的各种生物过程中发挥着关键作用,此前已在真核生物中被发现gydF4y2Ba液对gydF4y2Ba;但是,它们的功能还有待进一步阐明。因此,我们旨在分析UvbZIP6的生物学作用gydF4y2Ba,gydF4y2Ba中的bZIP家族的成员gydF4y2Ba液对gydF4y2Ba.在这项研究中,我们发现gydF4y2BaUvbZIP6gydF4y2Ba在接种后第7天高度上调。删除gydF4y2BaUvbZIP6gydF4y2Ba在gydF4y2Ba液对gydF4y2Ba导致真菌生长和对刚果红和氟钙白的敏感性增加,而对高渗透、氧化和十二烷基硫酸钠胁迫的敏感性降低。分生能力降低gydF4y2BaUvbZIP6 -gydF4y2Ba敲除突变体,但分生孢子形态和萌发不受影响。虽然gydF4y2BaUvbZIP6 -gydF4y2Ba敲除突变体在水稻植株中引起侵染,不能形成假黑穗病球。我们的研究表明,UvbZIP6是真菌生长、分生、胁迫反应和假黑穗病球形成所必需的gydF4y2Ba液对gydF4y2Ba.gydF4y2Ba
背景gydF4y2Ba
转录因子(TFs)是一种蛋白质,它与目标基因的特定DNA序列结合,调节基因的转录,因此在调节生长、发育和抗应激能力中发挥重要作用(Lambert等。gydF4y2Ba2018gydF4y2Ba).碱性亮氨酸拉链蛋白(bZIP)是tf的一个超家族,在真核生物中都有发现。bZIP蛋白参与各种生物过程,如抵抗非生物和生物胁迫、种子萌发和发育、形态发生和激素调节(Zhang et al。gydF4y2Ba2016gydF4y2Ba;Droge-Laser et al。gydF4y2Ba2018gydF4y2Ba;Droge-Laser和WeistegydF4y2Ba2018gydF4y2Ba;郝et al。gydF4y2Ba2019gydF4y2Ba).gydF4y2Ba
在植物中,bZIP蛋白发挥多种功能,包括种子和花的发育、激素合成和信号转导,以及对非生物和生物胁迫的响应。过度的gydF4y2BaZmbZIP4gydF4y2Ba在玉米中促进根系发育和增强脱落酸的合成,从而提高植物对非生物胁迫的耐受性(Ma et al。gydF4y2Ba2018gydF4y2Ba).苹果bZIP蛋白MdHY5调控转录gydF4y2BaMdMYB10gydF4y2Ba和花青素生物合成基因,促进硝酸盐还原酶基因和硝酸盐摄取基因的表达,从而在花青素积累和硝酸盐同化中发挥重要作用(An et al.)。gydF4y2Ba2017gydF4y2Ba).bZIP蛋白OsABF1通过调控水稻抗旱性gydF4y2BaCOR413-TM1gydF4y2Ba它编码一种假定的类囊体膜蛋白。此外,OsABF1直接调控各种基因的表达,在干旱或脱落酸信号通路中形成复杂的反馈回路(Zhang et al.)。gydF4y2Ba2017gydF4y2Ba).在gydF4y2Ba粳稻gydF4y2Ba大米、bZIP73 (bZIP73gydF4y2Ba日本gydF4y2Ba)与bZIP71相互作用,调节脱落酸和活性氧(ROS)的稳态,从而增强水稻对寒冷气候的适应能力(Liu et al.)。gydF4y2Ba2018gydF4y2Ba).水稻内质网(ER)膜相关TF OsbZIP74在热应激诱导的蛋白质展开中起着重要作用(Lu et al。gydF4y2Ba2012gydF4y2Ba).质膜相关的NAC转录因子OsNTL3调控了gydF4y2BaOsbZIP74gydF4y2Ba通过在热应激下与其启动子结合,反过来,OsbZIP74也调节gydF4y2BaOsNTL3gydF4y2Ba.因此,OsbZIP74和OsNTL3可以通过调节内质网、质膜和细胞核之间的相互作用形成适应热应激的回路(Liu et al.)。gydF4y2Ba2020gydF4y2Ba).gydF4y2Ba
在丝状真菌和卵菌中已经发现了许多bZIP蛋白,其中一些参与发育、营养利用和应激反应。过度的gydF4y2BaRsmAgydF4y2Ba,一个bZIP的tf编码基因gydF4y2Ba曲霉属真菌nidulansgydF4y2Ba,显著增加次生代谢产物的产生,并增强对捕食者的抵抗力。此外,RsmA结合于的启动子区域gydF4y2BaaflRgydF4y2Ba在窄尾半胱氨酸基因簇中gydF4y2Ba,gydF4y2Ba它编码C6 TF (Yin et al。gydF4y2Ba2012gydF4y2Ba).MetR调节硫同化和影响铁的平衡,因此它对致病性是必要的gydF4y2Ba来自烟曲霉属真菌gydF4y2Ba(一种人类病原体)gydF4y2Ba2013gydF4y2Ba).在HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba应激条件下,裂变酵母增加bZIP TF基因的表达水平gydF4y2BaATF1gydF4y2Ba而且gydF4y2BaPCR1gydF4y2Ba以成功适应氧化应激(Fernández-Vázquez等。gydF4y2Ba2013gydF4y2Ba).bZIP蛋白HapXgydF4y2Ba尖孢镰刀菌gydF4y2Ba在铁稳态、毒力和根际能力中起着主要作用(López-Berges等。gydF4y2Ba2012gydF4y2Ba).在gydF4y2Ba镰刀菌素graminearumgydF4y2BaFpo1是包皮发育的负调控因子,对营养生长、无性产孢和毒力起着至关重要的作用。删除gydF4y2BaFpo1gydF4y2Ba导致碳代谢的重新编程,包括脂肪酸的产生,这是有性繁殖必不可少的(Shin等。gydF4y2Ba2020gydF4y2Ba).Mrap1调节真菌形态、毒力和微菌核的形成gydF4y2Ba绿僵菌属rileyigydF4y2Ba(歌等。gydF4y2Ba2018gydF4y2Ba).VdAtf1是穿透性聚乙二醇形成的必要条件,并通过调节一氧化氮(NO)抗性和无机氮代谢促进致病性gydF4y2Ba黄萎病dahliaegydF4y2Ba(唐et al。gydF4y2Ba2020gydF4y2Ba).中的bzip的系统描述gydF4y2BaMagnaporthe oryzaegydF4y2Ba揭示了真菌生长、分生、环境胁迫、宿主渗透和致病性的调节机制(Kong等。gydF4y2Ba2015gydF4y2Ba;唐等。gydF4y2Ba2015gydF4y2Ba).gydF4y2Ba
Ustilaginoidea液对gydF4y2Ba水稻稻曲病是世界水稻产区危害最大的水稻病害之一。典型症状是出现黄橙色或深绿色的黑穗病球。除产量损失外,菌痢菌素的产生受到影响gydF4y2Ba液对gydF4y2Ba对人和动物有害(Hu et al。gydF4y2Ba2019gydF4y2Ba).随着基因组数据的发布和高效的CRISPR-Cas9敲除基因系统的开发,包括tf编码基因在内的基因功能的研究已经在加速gydF4y2Ba液对gydF4y2Ba(Zhang et al。gydF4y2Ba2014gydF4y2Ba;梁等。gydF4y2Ba2018gydF4y2Ba).保守的真菌特异性转录因子UvPRO1在菌丝生长、分生、胁迫耐受和发病机制中是必不可少的。gydF4y2Ba2016gydF4y2Ba).同源体转录因子UvHOX2有助于衣原体孢子的形成、分生和致病性(Yu等。gydF4y2Ba2019gydF4y2Ba).gydF4y2Ba
在此之前,我们已经确定了bZIP基因gydF4y2Ba液对gydF4y2Ba(阴等。gydF4y2Ba2017gydF4y2Ba),但它们的功能仍不清楚。在这项研究中,通过敲除UvbZIP6的基因来评估其生物学作用gydF4y2Ba液对gydF4y2Ba.结果表明,UvbZIP6参与了真菌的生长、分生和胁迫反应gydF4y2Ba液对gydF4y2Ba.此外,我们还发现gydF4y2BaUvbZIP6 -gydF4y2Ba敲除突变体能够在水稻植株中成功建立侵染,但不能产生假黑穗病球,说明UvbZIP6参与了假黑穗病的形成。gydF4y2Ba
结果gydF4y2Ba
UvbZIP6的序列分析gydF4y2Ba
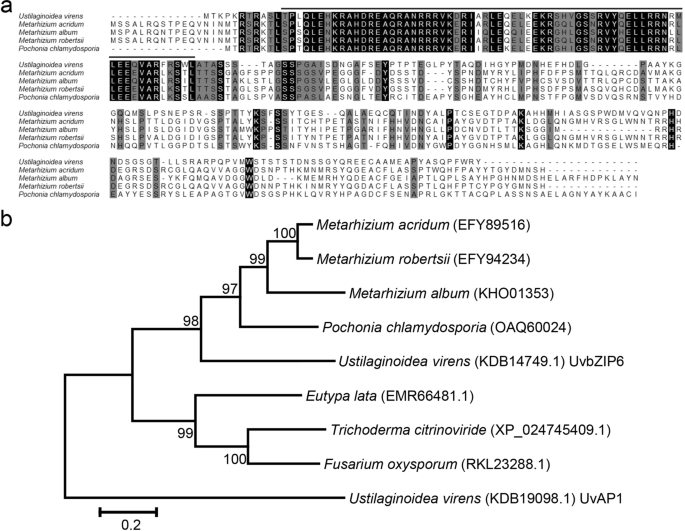
目的:探讨bZIP蛋白的功能gydF4y2Ba液对gydF4y2Ba,我们选择了一个含有254个氨基酸(aa)的UvbZIP6蛋白(GenBank: KDB14749.1)作为进一步研究的参考。我们放大了相应的序列gydF4y2BaUvbZIP6gydF4y2Ba从gydF4y2Ba液对gydF4y2Ba应变JS60-2。结果表明,它编码265-aa蛋白(附加文件gydF4y2Ba1gydF4y2Ba:图S1)。另外,UvbZIP6含有一个bZIP结构域,17号氨基酸是谷氨酸而不是谷氨酰胺。UvbZIP6的同源物也在gydF4y2BaPochonia chlamydosporiagydF4y2Ba和三个gydF4y2Ba绿僵菌属gydF4y2Ba物种;序列比对分析表明,它们在这些物种中是保守的,特别是在bZIP域(图。gydF4y2Ba1gydF4y2Baa).以UvAP1 (GenBank: KDB19098.1)为外群进行系统发育分析gydF4y2Bam . oryzaegydF4y2BabZIP TF MoAP1,与UvbZIP6相似度低。结果进一步表明UvbZIP6在这5种真菌中具有一定的保守性(图5)。gydF4y2Ba1gydF4y2Bab).此外,UvbZIP6的同源物在真菌中分布并不广泛,这表明它们在少数物种中具有潜在的独特作用。gydF4y2Ba
表达谱的gydF4y2BaUvbZIP6gydF4y2Ba在不同的阶段gydF4y2Ba液对gydF4y2Ba感染gydF4y2Ba
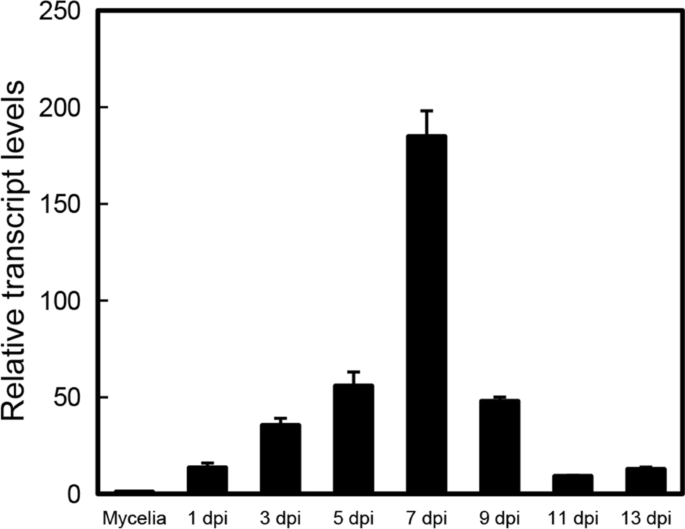
深入了解…可能的功能gydF4y2BaUvbZIP6gydF4y2Ba我们采用实时荧光定量PCR (qPCR)方法分析其在不同感染阶段的表达情况。结果表明gydF4y2BaUvbZIP6gydF4y2Badpi在接种7 d时达到峰值(图5)。gydF4y2Ba2gydF4y2Ba),与when的时间点相吻合gydF4y2Ba液对gydF4y2Ba显示感染成功,这反映在水稻小穗中产生大量菌丝(Song et al。gydF4y2Ba2016gydF4y2Ba).这表明UvbZIP6可能在gydF4y2Ba液对gydF4y2Ba感染。gydF4y2Ba
UvbZIP6gydF4y2Ba基因缺失和ΔgydF4y2BaUvbZIP6gydF4y2Ba突变体互补gydF4y2Ba
描述…的生物功能gydF4y2BaUvbZIP6gydF4y2Ba,我们用之前描述的方法敲除了该基因(Xie et al。gydF4y2Ba2019gydF4y2Ba).碎片两侧约1.5 kb的上游或下游gydF4y2BaUvbZIP6gydF4y2BaORF区与湿霉素B磷酸化转移酶基因部分(gydF4y2BahphgydF4y2Ba).pCAS9:tRp-gRNA载体的构建如前所述(Liang et al。gydF4y2Ba2018gydF4y2Ba).我们生成了gydF4y2BaUvbZIP6gydF4y2Ba的ORF来删除突变体gydF4y2BaUvbZIP6gydF4y2Ba在野生型(WT)菌株JS60-2中,供体模板包含gydF4y2BahphgydF4y2Ba通过线性供体DNA片段和pCAS9:tRp-gRNA载体转化原生质体。利用不同的引物对,通过PCR扩增对转化子进行验证gydF4y2Ba1gydF4y2Ba:图S2a、b和附加文件gydF4y2Ba2gydF4y2Ba:表S1)。通过引入ORF序列得到补充菌株gydF4y2BaUvbZIP6gydF4y2Ba包含本机启动子的区域,进入ΔgydF4y2BaUvbZIP6gydF4y2Ba-5突变(附加文件gydF4y2Ba1gydF4y2Ba:图S3a, b)gydF4y2BaUvbZIP6gydF4y2Ba在ΔgydF4y2BaUvbZIP6gydF4y2Ba用逆转录PCR (RT-PCR)检测突变株和补充株gydF4y2Ba1gydF4y2Ba:图S4)。这些结果表明gydF4y2BaUvbZIP6gydF4y2Ba完全灭活在ΔgydF4y2BaUvbZIP6gydF4y2Ba而其在WT和补充株中的转录水平相似。gydF4y2Ba
UvbZIP6参与植物的营养生长和分生gydF4y2Ba液对gydF4y2Ba
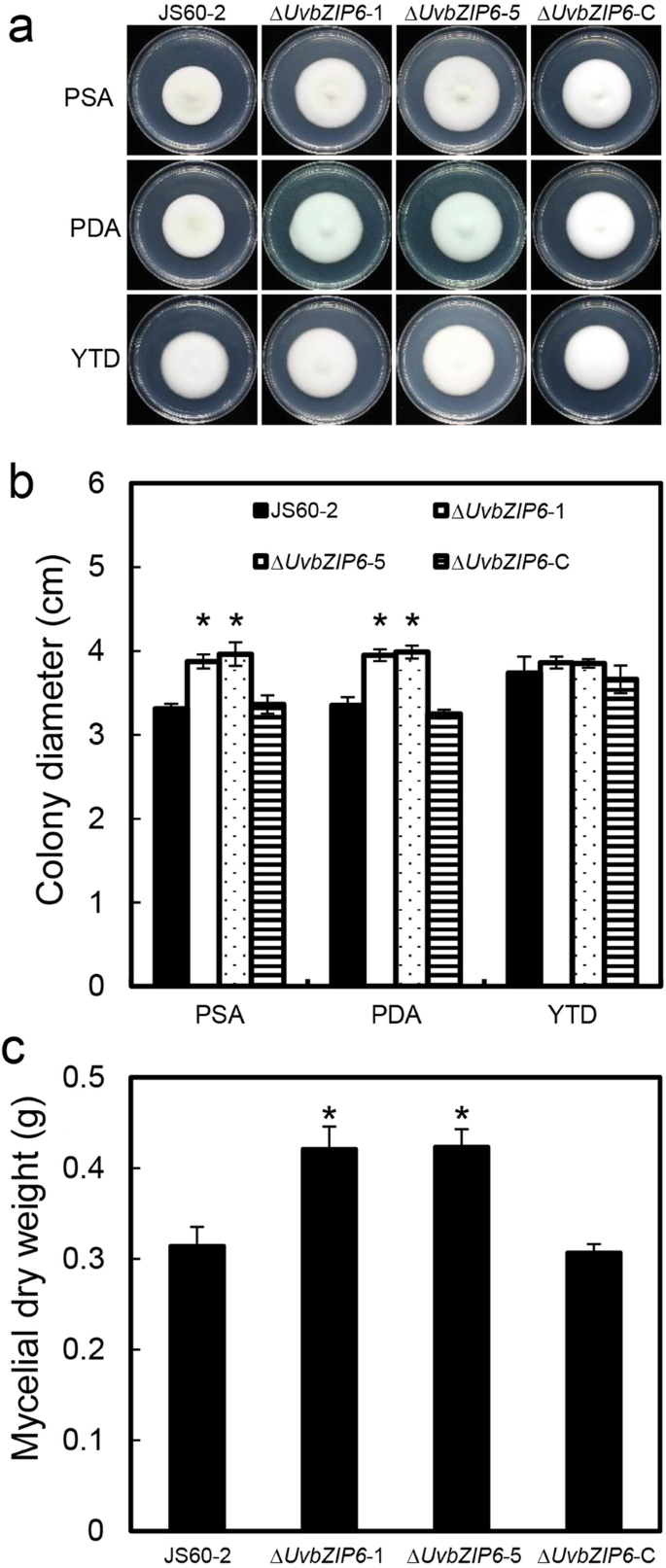
为了研究UvbZIP6在菌丝生长中的作用,我们培养了WT菌株ΔgydF4y2BaUvbZIP6gydF4y2Ba在三种不同的培养基(PSA, YTD和PDA)上进行突变和补充菌株。与WT和补充菌株相比,ΔgydF4y2BaUvbZIP6gydF4y2Ba突变体在PSA和PDA培养基上生长速度较快;但在YTD培养基上,这三种菌株的生长速率没有显著差异(图5)。gydF4y2Ba3.gydF4y2Baa, b)。另外,测定菌丝干重,ΔgydF4y2BaUvbZIP6gydF4y2Ba突变体表现出比WT和补充菌株更高的生物量(图。gydF4y2Ba3.gydF4y2Bac).这些结果表明,UvbZIP6是营养生长的负调控因子。gydF4y2Ba
基因敲除的gydF4y2BaUvbZIP6gydF4y2Ba促进植物的生长gydF4y2Ba液对gydF4y2Ba.gydF4y2Ba一个gydF4y2Ba菌落形态的gydF4y2Ba液对gydF4y2BaPSA、PDA和YTD菌株。WT,gydF4y2BaUvbZIP6 -gydF4y2Ba敲除突变体和补充菌株在27°C培养基上培养14天。gydF4y2BabgydF4y2Ba菌落的直径gydF4y2Ba液对gydF4y2Ba不同介质上的压力。gydF4y2BacgydF4y2Ba供试菌株菌丝干重。收集菌丝,在27°C的PSB中培养7天后晾干。误差条表示标准差,星号表示显著差异(gydF4y2BaPgydF4y2Ba< 0.05)gydF4y2Ba
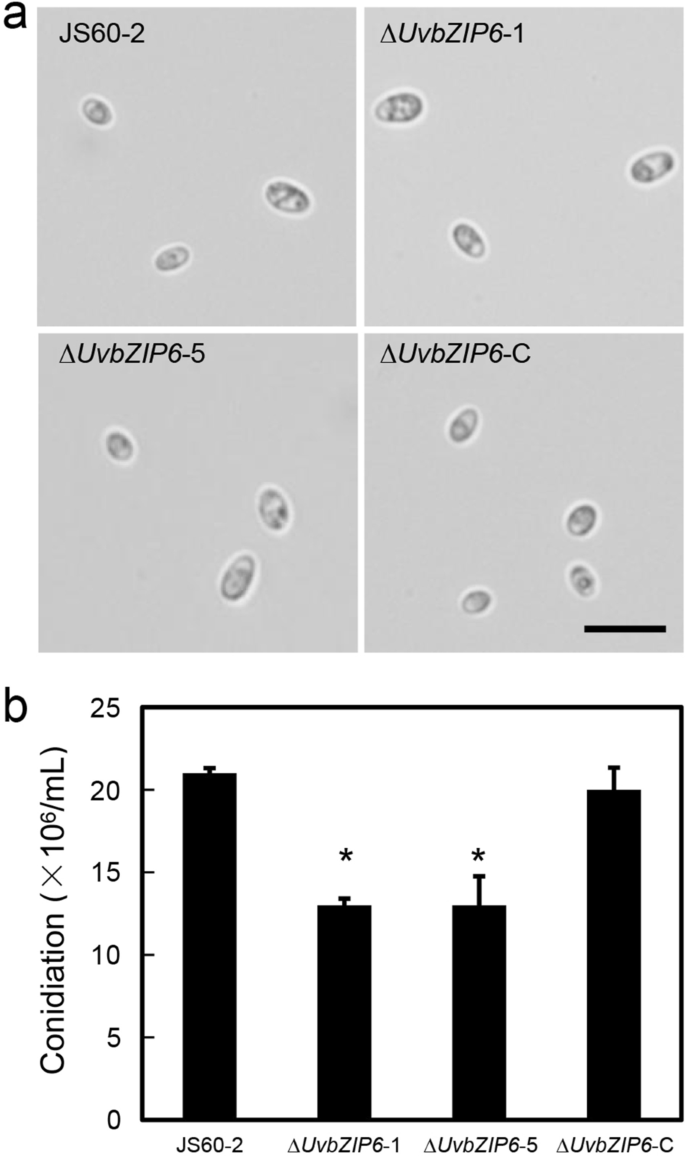
对分生孢子的生产也进行了检测,以研究UvbZIP6是否参与分生孢子的形成。结果表明,菌株Δ的分生孢子明显减少gydF4y2BaUvbZIP6gydF4y2Ba突变体与WT和补充菌株的比较(图。gydF4y2Ba4gydF4y2Ba).而WT、Δ之间的分生孢子形态和萌发无明显差异gydF4y2BaUvbZIP6gydF4y2Ba,以及补充菌株(图。gydF4y2Ba4gydF4y2Baa和附加文件gydF4y2Ba1gydF4y2Ba:图S5)。这些结果表明,UvbZIP6参与了植物的分生gydF4y2Ba液对gydF4y2Ba.gydF4y2Ba
UvbZIP6参与了植物的应激反应gydF4y2Ba液对gydF4y2Ba
为了研究UvbZIP6是否参与胁迫反应,将菌株培养在添加不同胁迫诱导剂的PSA培养基上。与WT和补充菌株相比,ΔgydF4y2BaUvbZIP6gydF4y2Ba突变体在高渗透和氧化胁迫下表现出较低的生长抑制率(图。gydF4y2Ba5gydF4y2Ba).相比之下,刚果红(CR)或氟钙白(CFW)培养皿的抑制率更高(图1)。gydF4y2Ba5gydF4y2Ba).这些结果表明,UvbZIP6负向调控高渗、氧化和SDS胁迫反应,而正向调控CR和CFW胁迫反应,表明UvbZIP6参与了植物的胁迫反应gydF4y2Ba液对gydF4y2Ba.gydF4y2Ba
UvbZIP6调节植物的应力响应gydF4y2Ba液对gydF4y2Ba.gydF4y2Ba一个gydF4y2Ba菌落形态的gydF4y2Ba液对gydF4y2Ba不同应力剂对介质的应变。在PSA培养板上,加入0.5 M NaCl、0.9 M山梨醇、0.04%十二烷基硫酸钠(SDS)、200 μg/mL刚果红(CR)、120 μg/mL氟钙白(CFW)和0.03% HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba为14天。gydF4y2BabgydF4y2Ba不同胁迫剂对被试植物营养生长的抑制率gydF4y2Ba液对gydF4y2Ba菌株。星号表示有显著差异(gydF4y2BaPgydF4y2Ba< 0.05)gydF4y2Ba
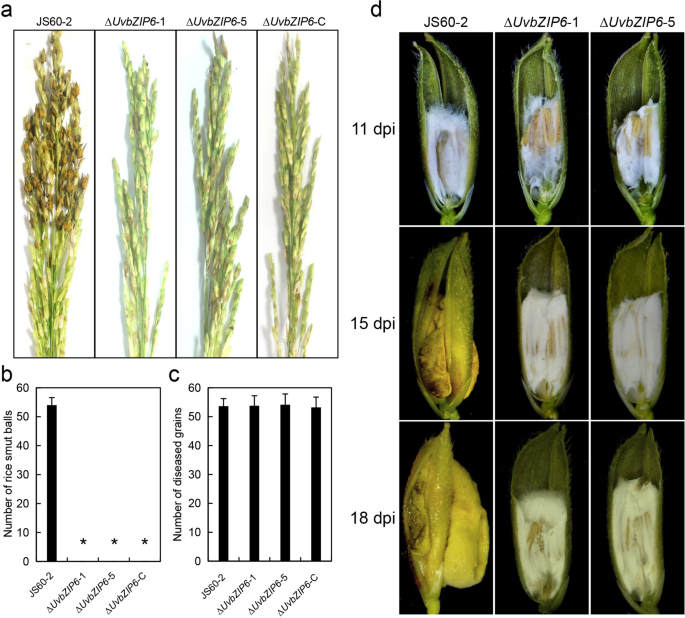
UvbZIP6有助于假黑穗病球的形成,而不是感染gydF4y2Ba
通过接种试验确定了UvbZIP6在致病性中的作用gydF4y2Ba液对gydF4y2Ba.虽然接种Δ的水稻小穗中未发现黑穗病球gydF4y2BaUvbZIP6gydF4y2Ba突变体在21 dpi(图。gydF4y2Ba6gydF4y2Baa, b),突变体能够成功感染水稻植株,WT Δ引起的感染小穗数量无显著差异gydF4y2BaUvbZIP6gydF4y2Ba,以及补充菌株(图。gydF4y2Ba6gydF4y2Bac).进一步观察发现,WT和Δ感染的小穗中发现了丰富的菌丝gydF4y2BaUvbZIP6gydF4y2Ba11 dpi突变体;在15 dpi时,在wt感染菌中开始形成黑穗病球,而不是在Δ中gydF4y2BaUvbZIP6gydF4y2Ba来华的小穗;在18 dpi时,WT产生典型的成熟黑穗病球。但在感染了Δ菌的植株中未观察到黑穗病球gydF4y2BaUvbZIP6gydF4y2Ba(无花果。gydF4y2Ba6gydF4y2Bad).此外,还对水稻植株的卵巢发育进行了研究。卵巢被Δ感染gydF4y2BaUvbZIP6gydF4y2Ba保持绿色(附加文件gydF4y2Ba1gydF4y2Ba:图S6)。这些结果表明,UvbZIP6在黑穗病假球形成过程中起着重要作用。gydF4y2Ba
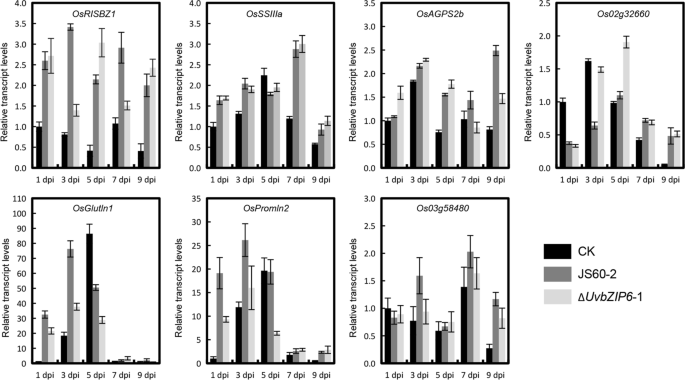
删除gydF4y2BaUvbZIP6gydF4y2Ba是否影响水稻籽粒灌浆相关基因的表达gydF4y2Ba
的gydF4y2Ba液对gydF4y2Ba感染可以通过模拟卵巢受精诱导籽粒充盈相关基因的表达(Song et al。gydF4y2Ba2016gydF4y2Ba;风扇等。gydF4y2Ba2020gydF4y2Ba).本研究选取了7个与籽粒填充相关的基因进行转录评价,以确定这些基因是否被诱导。结果表明,这些基因在WT-或Δ中均有诱导作用gydF4y2BaUvbZIP6 -gydF4y2Ba尽管它们的表达水平在不同的感染阶段有所不同(图。gydF4y2Ba7gydF4y2Ba).一般情况下,这些基因在接种WT或Δ后的表达谱gydF4y2BaUvbZIP6gydF4y2Ba结果是相似的,这表明突变体仍然可以通过操纵水稻来获取营养。这些结果表明,ΔgydF4y2BaUvbZIP6gydF4y2Ba突变体不能形成假黑穗病可能是由于发育缺陷,而不是营养吸收能力不足。gydF4y2Ba
全基因组转录分析gydF4y2BaUvbZIP6gydF4y2Ba缺失突变体gydF4y2Ba
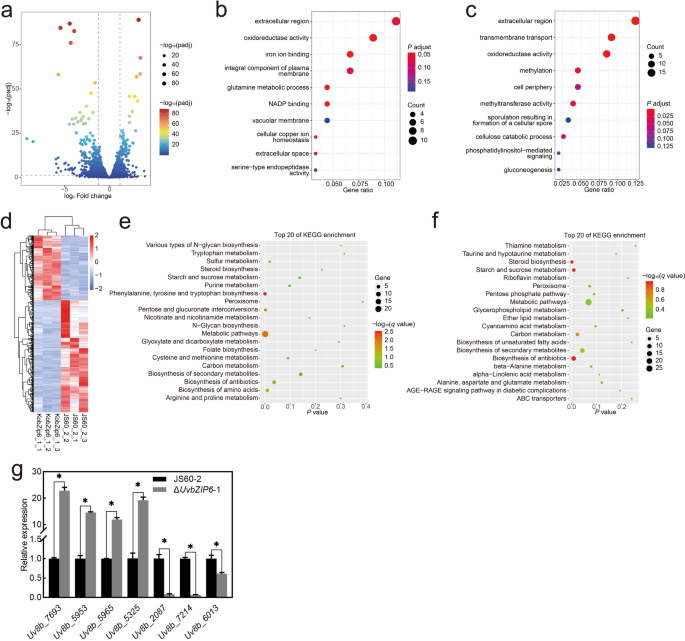
tf是基因表达的重要调节因子。目的:探讨UvbZIP6调控的潜在基因gydF4y2Ba液对gydF4y2Ba在美国,我们使用了WT的三个生物重复-或ΔgydF4y2BaUvbZIP6gydF4y2Ba-接种水稻小穗进行RNA序列(RNA seq)分析在11 dpi,这是黑穗病球形成的关键早期阶段。每个样本产生了超过4600万个唯一标识符读取(附加文件gydF4y2Ba2gydF4y2Ba:表S2);超过95%的读取映射在gydF4y2Ba液对gydF4y2Ba或者水稻基因组,大部分都在gydF4y2Ba美国virengydF4y2Bas基因组(附加文件gydF4y2Ba2gydF4y2Ba:表S2)。共检测到565个差异表达基因(DEGs)gydF4y2BaUvbZIP6gydF4y2Ba突变体和WT,包括207个上调基因和358个下调基因,使用阈值为>的两倍表达变化和agydF4y2BaPgydF4y2Ba-value < 0.05gydF4y2Ba8gydF4y2Baa, d;额外的文件gydF4y2Ba2gydF4y2Ba:表S3)。利用基因本体(GO)分析对这些DEGs进行了分类,主要与细胞外区域、质膜、液泡膜和细胞外周的组成部分相关。DEGs主要与氧化还原酶活性、铁离子结合、NADP结合和甲基转移酶活性的分子功能有关。此外,在生物过程中,它们主要与谷氨酰胺代谢过程、跨膜转运和甲基化有关(图1)。gydF4y2Ba8gydF4y2Bab, c).基于KEGG途径的DEGs功能富集gydF4y2Ba液对gydF4y2Ba表明它们与代谢途径有关。对富集前20个KEGG通路的测定结果显示,代谢通路、次生代谢物生物合成和抗生素生物合成是富集前3个通路(图5)。gydF4y2Ba8gydF4y2Bae, f).选择7个基因,通过qPCR分析确认RNA-seq揭示的基因表达模式。每个上调或下调基因的表达模式与RNA-seq数据一致(图1)。gydF4y2Ba8gydF4y2Bag).这些结果表明gydF4y2BaUvbZIP6gydF4y2Ba可能在次生代谢物和抗生素的代谢途径和生物合成中发挥重要作用。gydF4y2Ba
通过转录组学分析来识别差异表达基因(DEGs)gydF4y2BaUvbZIP6gydF4y2Ba-敲除突变株和野生型菌株JS60-2。gydF4y2Ba一个gydF4y2BaDEGs的火山图。gydF4y2BabgydF4y2Ba,gydF4y2BacgydF4y2Ba基因本体论富集分析显示,基因表达上调gydF4y2BabgydF4y2Ba和下调的DEGsgydF4y2BacgydF4y2Ba.gydF4y2BadgydF4y2Ba每对比较中565个deg的fpkm标准化转录水平热图。gydF4y2BaegydF4y2Ba,gydF4y2BafgydF4y2Ba上调前20名(gydF4y2BaegydF4y2Ba)和下调的deg (gydF4y2BafgydF4y2Ba)在KEGG富集分析中。gydF4y2BaggydF4y2BaqPCR分析验证DEGs的正确性。∆各基因的相对转录水平gydF4y2BaUvbZIP6gydF4y2Ba与来自JS60-2的基因比较归一化(相对转录水平= 1.0)。星号表示突变体与JS60-2之间的显著差异(gydF4y2BaPgydF4y2Ba< 0.05)。误差条表示标准差gydF4y2Ba
讨论gydF4y2Ba
bZIP蛋白是广泛分布于真核生物中的转录因子,其中一些参与营养生长、发育、应激反应和激素调节。然而,UvbZIP6的同源序列仅在少数物种中发现,说明其具有潜在的特异性功能。在本研究中,我们发现UvbZIP6在植物的营养生长、分生孢子、胁迫反应和假黑穗病形成中起着重要作用gydF4y2Ba液对gydF4y2Ba.gydF4y2Ba
一些bZIP基因敲除突变体gydF4y2Bam . oryzaegydF4y2Ba表明它们是营养生长的调节因子(Tang et al。gydF4y2Ba2015gydF4y2Ba).删除gydF4y2BaUvbZIP6gydF4y2Ba在gydF4y2Ba液对gydF4y2Ba导致营养菌丝生长和生物量增加,这在gydF4y2BaUvBI-1gydF4y2Ba敲除突变体(Xie et al。gydF4y2Ba2019gydF4y2Ba).在gydF4y2Ba疫霉突变gydF4y2Ba,沉默gydF4y2BaPsBZP32gydF4y2Ba导致囊肿萌发下降,但不影响菌丝生长、孢子囊形成和卵孢子的产生(Sheng等。gydF4y2Ba2021gydF4y2Ba).在gydF4y2Bam . oryzaegydF4y2Ba,破坏bZIP基因gydF4y2BaMoAP1gydF4y2Ba导致分生孢子形态异常和分生孢子减少(Guo et al。gydF4y2Ba2011gydF4y2Ba).在菌丝生长和分生孢子形成方面也有缺陷gydF4y2BaFpAda1gydF4y2Ba敲除突变体的gydF4y2Ba镰刀菌素pseudograminearumgydF4y2Ba(陈等。gydF4y2Ba2020gydF4y2Ba).在本研究中,分生孢子产量降低gydF4y2BaUvbZIP6gydF4y2Ba-敲除突变体,表明gydF4y2BaUvbZIP6gydF4y2Ba调节分生孢子生产在gydF4y2Ba液对gydF4y2Ba.gydF4y2Ba
相当数量的bzip参与真菌和卵菌的应激反应。在gydF4y2BaPeronophythora荔枝gydF4y2Ba,gydF4y2BaPlBZP32gydF4y2Ba-沉默突变体比WT菌株对氧化应激更敏感(Kong et al。gydF4y2Ba2020gydF4y2Ba).在植物内生真菌中gydF4y2BaPestalotiopsis ficigydF4y2Ba,删除gydF4y2BaPfzipAgydF4y2Ba使其对氧化试剂叔丁基过氧化氢、双胺和甲二酮亚硫酸氢钠(MSB)具有抗性,并增加对HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba王(et al。gydF4y2Ba2015gydF4y2Ba).植物中的bZIP蛋白也参与胁迫反应。gydF4y2BaZmbZIP4gydF4y2Ba是在非生物胁迫下诱导的,而过表达gydF4y2BaZmbZIP4gydF4y2Ba导致玉米脱落酸合成和抗非生物胁迫的能力增加(Ma et al。gydF4y2Ba2018gydF4y2Ba).在本研究中,删除gydF4y2BaUvbZIP6gydF4y2Ba增加了对高渗透、氧化和SDS应激的抵抗力;但对CR和CFW应力的敏感性增加。CR和CFW为细胞壁应力,SDS为膜稳定性应力。这些结果表明UvbZIP6在不同胁迫下的调控机制不同。gydF4y2Ba
接种后7 ~ 9天gydF4y2Ba液对gydF4y2Ba已经被证明是假黑穗病最初形成的关键时期(Song et al。gydF4y2Ba2016gydF4y2Ba).在我们的研究中,gydF4y2BaUvbZIP6gydF4y2Ba在7 dpi时表达量最高。这时,宿主被殖民化gydF4y2Ba液对gydF4y2Ba已经完成,并且产生了大量的菌丝,这表明gydF4y2BaUvbZIP6gydF4y2Ba在调节菌丝过渡中。OverexpressinggydF4y2BaDKMgydF4y2Ba,一个bZIP基因gydF4y2Ba拟南芥gydF4y2Ba,导致营养和生殖发育缺陷,而gydF4y2BaDKMgydF4y2Ba缺失突变体有更多的花蕾和更长的果实(Lozano-Sotomayor et al。gydF4y2Ba2016gydF4y2Ba).除了减少营养生长,无性产孢,和毒力,删除gydF4y2BaFpo1gydF4y2Ba在gydF4y2BaFgydF4y2Ba.gydF4y2BagraminearumgydF4y2Ba增加包膜的产生和成熟(Shin et al。gydF4y2Ba2020gydF4y2Ba).在这项研究中,尽管gydF4y2BaUvbZIP6 -gydF4y2Ba敲除突变体导致成功感染,它们失去了形成假黑穗病球的能力,这表明UvbZIP6在假黑穗病球的形成中起着关键作用。gydF4y2Ba
在本研究中,我们发现补充菌株不能形成假黑穗病球,但其他表型与WT菌株相似。补充菌株不能恢复WT的全部毒力的现象在之前的一项研究中也得到了证实(Zhang et al。gydF4y2Ba2020gydF4y2Ba).这说明并不是所有的基因都能被完全补充gydF4y2Ba液对gydF4y2Ba.gydF4y2Ba
bZIP结构域包含一个基本的DNA结合区域和一个相邻的亮氨酸拉链,使bZIP二聚(Dröge-Laser等)。gydF4y2Ba2018gydF4y2Ba).TubZIP28通过结合启动子和上调胞质agpase编码基因来促进小麦淀粉合成(Song et al。gydF4y2Ba2020gydF4y2Ba).通过调节的表达gydF4y2BaVdNut1gydF4y2Ba, VdAtf1影响渗透栓的形成和营养缺乏性(Tang等。gydF4y2Ba2020gydF4y2Ba).在本研究中,RNA-seq数据揭示了参与代谢途径、次生代谢物生物合成和抗生素生物合成的DEGs。这些结果表明,UvbZIP6通过参与代谢途径的调控促进了黑穗病的形成。因此,该bZIP蛋白的调控机制有待进一步研究。gydF4y2Ba
结论gydF4y2Ba
在这项研究中,我们发现gydF4y2BaUvbZIP6gydF4y2Ba是营养生长和抗应激的负调节因子gydF4y2Ba液对gydF4y2Ba.此外,删除gydF4y2BaUvbZIP6gydF4y2Ba的能力gydF4y2Ba液对gydF4y2Ba产生假黑穗病球,表明其在这一生物过程中的关键作用。然而,尽管在gydF4y2BaUvbZIP6 -gydF4y2Ba敲除突变体后,基因直接受gydF4y2BaUvbZIP6gydF4y2Ba仍然是未知的。因此,UvbZIP6调控的基因有待于进一步研究,以揭示小麦假黑穗病形成的分子机制gydF4y2Ba液对gydF4y2Ba.gydF4y2Ba
方法gydF4y2Ba
序列分析gydF4y2Ba
本研究使用的基因和蛋白质的数据下载自gydF4y2Ba液对gydF4y2Ba数据库(gydF4y2Bahttps://www.ncbi.nlm.nih.gov/nuccore/JHTR00000000gydF4y2Ba).使用BioEdit进行序列比对,使用基于邻居连接算法的MEGA 7.0进行系统发育分析(Kumar等。gydF4y2Ba2016gydF4y2Ba).gydF4y2Ba
真菌菌株和培养基gydF4y2Ba
的gydF4y2Ba液对gydF4y2BaWT菌株JS60-2和gydF4y2BaUvbZIP6 -gydF4y2Ba敲除突变体在马铃薯蔗糖琼脂(PSA)培养基上培养27℃。在PSA(马铃薯200 g/L,蔗糖20 g/L,琼脂15 g/L),马铃薯葡萄糖琼脂(PDA)(马铃薯200 g/L, D-葡萄糖20 g/L,琼脂15 g/L)和酵母胰蛋白酶葡萄糖(YTD)(酵母提取物1 g/L,胰蛋白酶1 g/L, D(+) -葡萄糖10 g/L,琼脂15 g/L)培养基上培养,评估菌落生长速率。在生物量测定中,6个直径为3毫米的真菌菌塞在50 mL的PSB(无琼脂PSA)培养基中培养7天,转速为160转,温度为27°C;用两层棉纱过滤采集菌丝,50℃干燥3 d后测定重量。菌株在PSB培养基中孵育7天,转速160转,温度27°C。然后,对培养的混合物进行过滤,并用血细胞计测定分生孢子浓度。分生孢子在培养皿上进行萌发试验;在一个平板上选择三个区域,每个区域内观察到100个分生孢子。为了测试抗压能力,我们评估了gydF4y2Ba液对gydF4y2Ba菌株在含0.5 M NaCl、0.9 M山梨醇、0.03% H的PSA培养基上生长14 dgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba、0.04% SDS、120 μg/mL CFW或200 μg/mL CR,抑菌率计算为:抑菌率(%)= [(PSA上的平均菌落直径-加胁迫剂后PSA上的平均菌落直径)/ PSA上的平均菌落直径]× 100。所有试验均重复3次,每次3个重复。gydF4y2Ba
基因表达分析gydF4y2Ba
使用TRIzol试剂(Invitrogen)分离总RNA样本,使用Thermo scientific的RevertAid First Stand cDNA Synthesis Kit (Thermo Fisher scientific)合成cDNA。将反应混合物稀释6倍作为模板。qPCR使用CFX96实时PCR检测系统(Bio-Rad Laboratories Inc.)进行。基因的相对表达量用2gydF4y2Ba−ΔΔCtgydF4y2Ba方法。使用三个生物重复的数据计算平均值和标准差。RT-PCR 30个循环,以确认该基因的缺失和重新引入gydF4y2BaUvbZIP6gydF4y2Ba带有指示引物的基因。本试验中使用的所有引物都列在附加文件中gydF4y2Ba2gydF4y2BaS1:表。gydF4y2Ba
的建设与互补gydF4y2BaUvbZIP6gydF4y2Ba缺失突变体gydF4y2Ba
对于CRISPR/Cas系统载体的构建,通过退火有意义(CRISPR_UvbZIP6-F)和反义(CRISPR_UvbZIP6-R)寡核苷酸生成一个短盒(附加文件gydF4y2Ba2gydF4y2Ba:表S1),并插入两者之间gydF4y2BaEspgydF4y2BapCas9: tRp-gRNA载体的3I位点如前所述(Liang et al。gydF4y2Ba2018gydF4y2Ba).的gydF4y2BaUvbZIP6gydF4y2Ba通过双联PCR方法生成基因置换结构(Yu et al。gydF4y2Ba2004gydF4y2Ba).简单地说,上游1.8 kb序列的片段和下游1.9 kb序列的片段gydF4y2BaUvbZIP6gydF4y2Ba被放大gydF4y2Ba液对gydF4y2Ba用第一轮扩增引物扩增基因组DNA。接下来,5 '和3 '部分gydF4y2BahphgydF4y2Ba分别用引物HYG-F、H3和H2、HYG-R进行扩增。上游和下游的侧翼层序与5 '和3 '部分相连接gydF4y2BahphgydF4y2Ba基因,分别。利用原生质体介导的转化方法将CRISPR载体和重组片段导入原生质体中。产生互补的菌株gydF4y2BaUvbZIP6gydF4y2Ba在缺失突变体中,扩增该基因上游和下游分别有2.0 kb和0.5 kb侧面序列的全长基因组序列,并插入到含有遗传素抗性基因的pKNRG823载体中。然后,利用原生质体介导的转化将载体转化为突变体。gydF4y2Ba
致病性和植物感染分析gydF4y2Ba
的gydF4y2Ba液对gydF4y2Ba按照上述描述(Jia et al.)将菌株接种在易感水稻品种(Wanxian-98)上。gydF4y2Ba2015gydF4y2Ba;歌等。gydF4y2Ba2016gydF4y2Ba).从14日龄真菌菌落上剪下菌丝插头,置于PSB培养基中,以160转/分、27°C振荡7天;收集菌丝并粉碎,测定分生孢子并调整至浓度为5 × 10gydF4y2Ba6gydF4y2Ba与公安局/毫升。在孕穗期后期(抽穗前3-5天),将含有分生孢子和菌丝的悬液大约2 mL注射到单个水稻穗中。接种后的植株在27°C、相对湿度90-100% (RH)的温室中保存7天,然后置于27°C、80% RH的环境中直至出现症状。接种21 d后测定黑穗病球数。至少进行3次独立生物学试验,每次试验至少12个重复。gydF4y2Ba
RNA序列gydF4y2Ba
RNA提取、文库制备和高通量测序数据分析由康思科技有限公司(中国武汉)完成。使用TRIzol试剂(Invitrogen)提取总rna。使用KC-DigitalTM Illumina®的链RNA文库准备试剂盒(目录NO. 2)制备2 μg总RNA用于链RNA测序文库制备。赛康科技股份有限公司武汉,中国)。对200-500 bp的产物进行富集、定量,最后在Illumina Novaseq 6000上测序。原始测序数据首先由Trimmomatic(0.36版本)过滤,然后用内部脚本进一步处理干净的读取,以消除在文库准备和测序过程中引入的重复偏差。它们被映射到参考基因组gydF4y2Ba栽培稻gydF4y2Ba粳稻集团(gydF4y2Bahttps://www.ncbi.nlm.nih.gov/genome/10gydF4y2Ba),gydF4y2BaUgydF4y2Ba.gydF4y2Ba液对gydF4y2Ba(gydF4y2Bahttp://www.ncbi.nlm.nih.gov/nuccore/JHTR00000000.1gydF4y2Ba),使用STAR软件(版本2.5.3a)及默认参数。每个基因外显子区域的Reads通过featucounts (Subread-1.5.1;Bioconductor),然后计算每千基百万的读数(RPKM)。使用edgeR包(3.12.1版本)识别组间差异表达的基因。错误发现率(FDR)得到纠正gydF4y2BapgydF4y2Ba用0.05的-值截断和2的折叠变化截断来判断基因表达差异的统计学意义。基因本体论(GO)和京都基因与基因组百科全书(KEGG)对DEGs的富集分析均采用KOBAS软件(版本:2.1.1)实现,并进行了修正gydF4y2BapgydF4y2Ba-值截断0.05确定富集有统计学意义。使用rMATS(3.2.5版本)检测备选剪接事件,FDR值截断值为0.05,Δψ绝对值为0.05。gydF4y2Ba
统计分析gydF4y2Ba
使用Microsoft Office 2016对数据进行统计分析。数据使用Microsoft Office 2016和GraphPad Prism 8.0制作。显著差异(gydF4y2BaPgydF4y2Ba= 0.05)基于单因素方差分析(ANOVA)和LSD检验(使用SPSS Statistics 21.0)确定。gydF4y2Ba
数据和材料的可用性gydF4y2Ba
不适用。gydF4y2Ba
缩写gydF4y2Ba
- bZIP:gydF4y2Ba
-
基本亮氨酸拉链gydF4y2Ba
- CFW:gydF4y2Ba
-
Calcofluor白gydF4y2Ba
- 克雷格:gydF4y2Ba
-
刚果红gydF4y2Ba
- dpi:gydF4y2Ba
-
天post-inoculationgydF4y2Ba
- 度:gydF4y2Ba
-
差异表达基因gydF4y2Ba
- 呃:gydF4y2Ba
-
内质网gydF4y2Ba
- 走:gydF4y2Ba
-
基因本体论gydF4y2Ba
- 最高有效位:gydF4y2Ba
-
甲萘醌亚硫酸氢钠gydF4y2Ba
- 没有:gydF4y2Ba
-
一氧化氮gydF4y2Ba
- 子:gydF4y2Ba
-
开放阅读框gydF4y2Ba
- RH:gydF4y2Ba
-
相对湿度gydF4y2Ba
- RNA-seq:gydF4y2Ba
-
RNA序列gydF4y2Ba
- ROS:gydF4y2Ba
-
活性氧gydF4y2Ba
- SDS:gydF4y2Ba
-
十二烷基硫酸钠gydF4y2Ba
- TFs:gydF4y2Ba
-
转录因子gydF4y2Ba
- WT:gydF4y2Ba
-
野生型gydF4y2Ba
参考文献gydF4y2Ba
Amich J, Schafferer L, Haas H, Krappmann S.硫同化调节对人致病性霉菌的毒力和铁稳态至关重要gydF4y2Ba来自烟曲霉属真菌gydF4y2Ba.PLoS Pathog. 2013;9: e1003573。gydF4y2Bahttps://doi.org/10.1371/journal.ppat.1003573gydF4y2Ba.gydF4y2Ba
安建平,曲芳军,姚建峰,王晓宁,尤春霞,王晓峰,等。bZIP转录因子MdHY5调节苹果花青素积累和硝酸盐同化。Hortic杂志2017;4:17023。gydF4y2Bahttps://doi.org/10.1038/hortres.2017.23gydF4y2Ba.gydF4y2Ba
陈磊,马勇,赵军,耿旭,陈伟,丁硕,等。bZIP转录因子FpAda1在真菌生长和分生中是必不可少的gydF4y2Ba镰刀菌素pseudograminearumgydF4y2Ba.咕咕叫麝猫。2020;66:507-15。gydF4y2Bahttps://doi.org/10.1007/s00294-019-01042-1gydF4y2Ba.gydF4y2Ba
Dröge-Laser W, Weiste C. C/S1 bZIP网络:协调植物能量稳态的调节枢纽。植物科学进展2018;23:422-33。gydF4y2Bahttps://doi.org/10.1016/j.tplants.2018.02.003gydF4y2Ba.gydF4y2Ba
Dröge-Laser W, Snoek BL, Snel B, Weiste C. ThegydF4y2Ba拟南芥gydF4y2BabZIP转录因子家族-更新。植物生物学杂志2018;45:36-49。gydF4y2Bahttps://doi.org/10.1016/j.pbi.2018.05.001gydF4y2Ba.gydF4y2Ba
范杰,刘杰,龚志英,徐培忠,胡晓华,吴建林,等。假黑穗病病原体gydF4y2BaUstilaginoidea液对gydF4y2Ba假黑穗病球的形成需要水稻雄蕊。环境Microbiol。2020;22:646-59。gydF4y2Bahttps://doi.org/10.1111/1462-2920.14881gydF4y2Ba.gydF4y2Ba
Fernández-Vázquez J, Vargas-Pérez I, Sansó M,布恩K,卡莫纳M,保罗E,等。通过伸长器修饰tRNA(Lys) UUU对于有效转译应力mrna是必不可少的。PLoS Genet 2013;9: e1003647。gydF4y2Bahttps://doi.org/10.1371/journal.pgen.1003647gydF4y2Ba.gydF4y2Ba
郭梅,陈燕,杜燕,董燕,郭伟,翟森,等。bZIP转录因子MoAP1介导氧化应激反应,对稻瘟病菌的致病性至关重要gydF4y2BaMagnaporthe oryzaegydF4y2Ba.PLoS Pathog. 2011;7: e1001302。gydF4y2Bahttps://doi.org/10.1371/journal.ppat.1001302gydF4y2Ba.gydF4y2Ba
郝曦,钟勇,Nützmann HW,付旭,闫涛,沈强,等。光诱导的青蒿素生物合成受bZIP转录因子AaHY5的调控gydF4y2Ba青蒿gydF4y2Ba.植物细胞物理学报2019;60:1747-60。gydF4y2Bahttps://doi.org/10.1093/pcp/pcz084gydF4y2Ba.gydF4y2Ba
胡铮,党颖,刘超,周磊,刘辉。急性暴露于ustiloxin A对早期生命斑马鱼生长发育的影响,gydF4y2Ba鲐鱼类gydF4y2Ba.臭氧层。2019;226:851-7。gydF4y2Bahttps://doi.org/10.1016/j.chemosphere.2019.04.002gydF4y2Ba.gydF4y2Ba
贾强,吕斌,郭爱梅,罗春霞,郑林,项涛,等。水稻生育期、温度、相对湿度和湿度持续时间对水稻穗病的影响gydF4y2BaVillosiclava液对gydF4y2Ba.植物病理学杂志,2015;gydF4y2Bahttps://doi.org/10.1007/s10658-014-0516-4gydF4y2Ba.gydF4y2Ba
孔山,朴世玉,李永华。稻瘟病菌bZIP转录因子基因家族的系统表征gydF4y2BaMagnaporthe OryzaegydF4y2Ba.环境Microbiol。2015;17:1425-43。gydF4y2Bahttps://doi.org/10.1111/1462-2920.12633gydF4y2Ba.gydF4y2Ba
孔刚,陈勇,邓勇,冯东,江林,万磊,等。与氧化应激反应相关的碱性亮氨酸拉链转录因子PlBZP32对荔枝绒枯卵菌的致病性至关重要gydF4y2BaPeronophythora litchiigydF4y2Ba.mSphere。2020; 5: e00261-20。gydF4y2Bahttps://doi.org/10.1128/mSphere.00261-20gydF4y2Ba.gydF4y2Ba
Kumar S, Stecher G, Tamura K. MEGA7:用于更大数据集的分子进化遗传学分析7.0版本。Mol Biol Evol. 2016; 33:19 70 - 4。gydF4y2Bahttps://doi.org/10.1093/molbev/msw054gydF4y2Ba.gydF4y2Ba
兰伯特萨,乔玛A, Campitelli LF, Das PK,尹Y, Albu M,等。人类转录因子。细胞。2018;172:650 - 65。gydF4y2Bahttps://doi.org/10.1016/j.cell.2018.01.029gydF4y2Ba.gydF4y2Ba
梁艳芳,韩勇,王芳芳,蒋晨,徐建军gydF4y2Ba美国网球gydF4y2Ba而且gydF4y2BaUvSLT2gydF4y2Ba基因有效地gydF4y2BaUstilaginoidea液对gydF4y2Ba用CRISPR-Cas9系统。植物科学进展2018;9:699。gydF4y2Bahttps://doi.org/10.3389/fpls.2018.00699gydF4y2Ba.gydF4y2Ba
刘超,欧思,毛波,唐杰,王伟,王辉,等。早期的选择gydF4y2BabZIP73gydF4y2Ba促进了改编的gydF4y2Ba粳稻gydF4y2Ba大米适合寒冷的气候。Nat Commun。2018;9:3302。gydF4y2Bahttps://doi.org/10.1038/s41467-018-05753-wgydF4y2Ba.gydF4y2Ba
刘晓红,吕云云,杨伟,杨忠涛,卢世杰,刘建新。水稻耐热性与膜相关的NAC转录因子OsNTL3有关。植物生物技术学报,2020;18:1317-29。gydF4y2Bahttps://doi.org/10.1111/pbi.13297gydF4y2Ba.gydF4y2Ba
López-Berges MS, Capilla J, Turrà D, Schafferer L, Matthijs S, Jöchl C,等。hapx介导的铁稳态对根际能力和土传病原体的毒力至关重要gydF4y2Ba尖孢镰刀菌gydF4y2Ba.植物细胞。2012;24:3805-22。gydF4y2Bahttps://doi.org/10.1105/tpc.112.098624gydF4y2Ba.gydF4y2Ba
Lozano-Sotomayor P, Chávez Montes RA, Silvestre-Vañó M, Herrera-Ubaldo H, grereco R, Pablo-Villa J,等。bZIP转录因子DRINK ME的表达改变影响生长和生殖发育gydF4y2Ba拟南芥gydF4y2Ba.植物j . 2016; 88:437-51。gydF4y2Bahttps://doi.org/10.1111/tpj.13264gydF4y2Ba.gydF4y2Ba
吕世杰,杨志涛,孙磊,孙磊,宋志涛,刘建新。ire1调控的水稻bZIP74 mRNA非传统剪接的保存(gydF4y2Ba栽培稻gydF4y2BaL.)参与内质网应激反应。摩尔。2012;5:504-14。gydF4y2Bahttps://doi.org/10.1093/mp/ssr115gydF4y2Ba.gydF4y2Ba
吕斌,郑琳,刘浩,唐婷婷,项涛,黄剑杰。随机T-DNA突变在基因鉴定中的应用gydF4y2BaUvPRO1gydF4y2Ba在植物中,它是分生孢子、应激反应和毒力的调节剂gydF4y2BaUstilaginoidea液对gydF4y2Ba.Microbiol前面。2016;7:2086。gydF4y2Bahttps://doi.org/10.3389/fmicb.2016.02086gydF4y2Ba.gydF4y2Ba
马宏,刘超,李铮,冉强,谢刚,王波,等。ZmbZIP4通过调节ABA的合成和根系发育来促进玉米的抗逆性。植物杂志。2018;178:753。gydF4y2Bahttps://doi.org/10.1104/pp.18.00436gydF4y2Ba.gydF4y2Ba
盛勇,林玲,陈浩,朴涛,刘旭,董松,等。bZIP转录因子PsBZP32参与包囊萌发、氧化应激反应和致病性gydF4y2Ba疫霉突变gydF4y2Ba.Phytopathol杂志2021;3:1。gydF4y2Bahttps://doi.org/10.1186/s42483-020-00078-3gydF4y2Ba.gydF4y2Ba
Shin J, Bui D-C, Kim S, Jung SY, Nam HJ, Lim JY,等。新型bZIP转录因子Fpo1通过调控子囊菌的碳代谢负向调控子囊菌的包膜发育gydF4y2Ba镰刀菌素graminearumgydF4y2Ba.环境Microbiol。2020;22:2596 - 612。gydF4y2Bahttps://doi.org/10.1111/1462-2920.14960gydF4y2Ba.gydF4y2Ba
宋建华,魏伟,吕斌,林燕,尹伟祥,彭永利,等。水稻黑穗病菌通过阻断和模仿水稻子房受精来劫持水稻养分供给。环境Microbiol。2016;18:3840-9。gydF4y2Bahttps://doi.org/10.1111/1462-2920.13343gydF4y2Ba.gydF4y2Ba
宋铮,尹燕,林燕,杜峰,任刚,王铮。bZIP转录因子激活蛋白-1调控gydF4y2Ba绿僵菌属rileyigydF4y2Ba形态学和介导微菌核的形成。应用微生物生物技术。2018;102:4577-88。gydF4y2Bahttps://doi.org/10.1007/s00253-018-8941-5gydF4y2Ba.gydF4y2Ba
宋燕,罗刚,沈亮,于凯,杨伟,李旭,等。一种新的bZIP家族转录因子TubZIP28gydF4y2Ba小麦属植物urartugydF4y2Ba和TabZIP28的同源物gydF4y2Ba小麦gydF4y2Ba,促进小麦淀粉合成。新植醇。2020;226:1384 - 98。gydF4y2Bahttps://doi.org/10.1111/nph.16435gydF4y2Ba.gydF4y2Ba
唐伟,茹勇,洪磊,朱强,左锐,郭旭,等。bZIP转录因子蛋白参与感染相关形态发生的全系统特征gydF4y2BaMagnaporthe oryzaegydF4y2Ba.环境Microbiol。2015;17:1377 - 96。gydF4y2Bahttps://doi.org/10.1111/1462-2920.12618gydF4y2Ba.gydF4y2Ba
唐晨,李婷,Klosterman SJ,田晨,王颖。bZIP转录因子VdAtf1通过介导氮代谢调节毒力gydF4y2Ba黄萎病dahliaegydF4y2Ba.新植醇。2020;226:1461 - 79。gydF4y2Bahttps://doi.org/10.1111/nph.16481gydF4y2Ba.gydF4y2Ba
王旭,吴峰,刘磊,刘旭,车勇,Keller NP,等。bZIP转录因子PfZipA调节植物内生真菌的次生代谢和氧化应激反应gydF4y2BaPestalotiopsis ficigydF4y2Ba.真菌基因生物学2015;81:221-8。gydF4y2Bahttps://doi.org/10.1016/j.fgb.2015.03.010gydF4y2Ba.gydF4y2Ba
谢少林,王艳芳,魏伟,李春春,刘燕,曲俊杰,等。Bax抑制剂UvBI-1是一种抑制菌丝生长和分生的负调控因子,介导胁迫反应,对水稻黑穗病菌的致病性至关重要gydF4y2BaUstilaginoidea液对gydF4y2Ba.咕咕叫麝猫。2019;65:1185 - 97。gydF4y2Bahttps://doi.org/10.1007/s00294-019-00970-2gydF4y2Ba.gydF4y2Ba
尹文彬,Amaike S, Wohlbach DJ, Gasch AP,蒋耀明,王春昌,等。一个gydF4y2Ba曲霉属真菌nidulansgydF4y2BabZIP反应通路,为防御次生代谢所固有gydF4y2BaaflRgydF4y2Ba.摩尔Microbiol。2012;83:1024-34。gydF4y2Bahttps://doi.org/10.1111/j.1365-2958.2012.07986.xgydF4y2Ba.gydF4y2Ba
尹文祥,崔鹏,魏伟,林燕,罗春霞。植物中碱性亮氨酸拉链(bZIP)转录因子基因家族的全基因组鉴定与分析gydF4y2BaUstilaginoidea液对gydF4y2Ba.基因组。2017;60:1059 - 67。gydF4y2Bahttps://doi.org/10.1139/gen-2017-0089gydF4y2Ba.gydF4y2Ba
余建华,Hamari Z,韩克明,徐佳,reys - dominguez Y, Scazzocchio C.双关节PCR:一种基于PCR的丝状真菌基因操作分子工具。真菌基因生物学2004;41:973-81。gydF4y2Bahttps://doi.org/10.1016/j.fgb.2004.08.001gydF4y2Ba.gydF4y2Ba
于晶,于敏,宋涛,曹辉,潘旭,勇敏,等。同源体转录因子UvHOX2调节衣原体孢子的形成,孢子分化和致病性gydF4y2BaUstilaginoidea液对gydF4y2Ba.Microbiol前面。2019;10:1071。gydF4y2Bahttps://doi.org/10.3389/fmicb.2019.01071gydF4y2Ba.gydF4y2Ba
张勇,张凯,方阿,韩勇,杨杰,薛明,等。特定的适应gydF4y2BaUstilaginoidea液对gydF4y2Ba比较基因组学和功能基因组学揭示的占位宿主小花。Nat Commun。2014;5:3849。gydF4y2Bahttps://doi.org/10.1038/ncomms4849gydF4y2Ba.gydF4y2Ba
张春春,刘娟,赵涛,Gomez A,李超,余春春,等。干旱诱导的bZIP转录因子OsABF1延缓了水稻的繁殖时机。植物杂志。2016;171:334-43。gydF4y2Bahttps://doi.org/10.1104/pp.16.01691gydF4y2Ba.gydF4y2Ba
张超,李超,刘杰,吕勇,于超,李辉,等。OsABF1转录因子通过激活植物的转录来提高抗旱性gydF4y2BaCOR413-TM1gydF4y2Ba在大米。J Exp Bot. 2017; 68:4695-707。gydF4y2Bahttps://doi.org/10.1093/jxb/erx260gydF4y2Ba.gydF4y2Ba
张楠,杨建勇,方阿福,王建勇,李元元,李永杰,等。关键效应器SCRE1在gydF4y2BaUstilaginoidea液对gydF4y2Ba通过小肽区抑制水稻免疫力。植物病理学杂志2020;21:445-59。gydF4y2Bahttps://doi.org/10.1111/mpp.12894gydF4y2Ba.gydF4y2Ba
确认gydF4y2Ba
感谢西北农林科技大学、普渡大学徐金荣教授提供CRISPR-Cas9系统质粒。gydF4y2Ba
资金gydF4y2Ba
基金资助:湖北省重点研发计划项目(No. 2021BBA236)、国家自然科学基金项目(No. 31701736)和国家重点研发计划项目(No. 2016YFD0300700)资助。gydF4y2Ba
作者信息gydF4y2Ba
作者和联系gydF4y2Ba
贡献gydF4y2Ba
JQ、YW、WY、CL设计实验;JQ、YW、MC、YL、LG、YD、CX、RW分别进行实验;YW、MC、PZ、YL、WY、CL对数据进行分析;JQ, YW, WY和CL写了手稿。所有作者阅读并批准了最终稿件。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
伦理批准和同意参与gydF4y2Ba
不适用。gydF4y2Ba
同意出版gydF4y2Ba
不适用。gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者声明他们没有竞争利益。gydF4y2Ba
补充信息gydF4y2Ba
附加文件1:图S1。gydF4y2Ba
UvbZIP6蛋白的序列比对gydF4y2Ba液对gydF4y2BaJS60-2和UV-8b菌株。gydF4y2Ba图S2。gydF4y2Ba目标基因敲除的gydF4y2BaUvbZIP6gydF4y2Ba和转化株验证。gydF4y2Ba一个gydF4y2Ba不同引物对敲除转化子的PCR验证。菌丝在PSB培养基中培养7 d后提取DNA。的片段gydF4y2Baβ微管蛋白gydF4y2Ba作为对照来检测DNA质量。WT为野生型菌株JS60-2。gydF4y2BabgydF4y2Ba目标敲除策略示意图gydF4y2BaUvbZIP6gydF4y2Ba.箭头显示了本研究中的引物。gydF4y2Ba图S3。gydF4y2Ba验证的gydF4y2BaUvbZIP6gydF4y2Ba补充压力。gydF4y2Ba一个gydF4y2Ba用不同的引物对扩增互补的转化子。质粒,∆gydF4y2BaUvbZIP6gydF4y2Ba5gydF4y2Ba,gydF4y2Ba和WT表示补向量包含gydF4y2BaUvbZIP6gydF4y2Ba片段,gydF4y2BaUvbZIP6 -gydF4y2Ba敲除突变株和JS60-2野生型菌株。gydF4y2BabgydF4y2Ba验证中使用的互补策略和引物。gydF4y2Ba图S4。gydF4y2Ba检测gydF4y2BaUvbZIP6gydF4y2Ba表达gydF4y2BaUvbZIP6 -gydF4y2Ba半定量RT-PCR敲除突变体和补充菌株。取菌丝在PSB培养基中培养7天的RNA样品。的片段gydF4y2Baβ微管蛋白gydF4y2Ba放大作为参考。gydF4y2Ba图S5。gydF4y2Ba供试菌株分生孢子发芽率。分生孢子铺于水琼脂(WA)或PSA平板上。gydF4y2Ba图S6。gydF4y2BaJS60-2或JS60-2接种水稻子房后的显微观察gydF4y2BaUvbZIP6 -gydF4y2Ba敲除突变体。gydF4y2Ba
附加文件2:表S1。gydF4y2Ba
本研究中使用的引物。gydF4y2Ba表S2。gydF4y2Ba样品测序数据的质量评价和统计分析。gydF4y2Ba表S3。gydF4y2Ba基因上调或下调的基因列表gydF4y2BaUvbZIP6gydF4y2Ba敲除突变体。gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循创作共用署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),该协议允许在任何媒体或格式中使用、分享、改编、分发和复制,只要您给予原作者和来源适当的署名,提供创作共用许可协议的链接,并说明是否有更改。本文中的图片或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果材料不包含在文章的创作共用许可中,并且您的预期用途不被法律法规允许或超出了允许的用途,您将需要直接从版权所有者那里获得许可。欲查看此许可证的副本,请访问gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba.gydF4y2Ba
关于这篇文章gydF4y2Ba
引用这篇文章gydF4y2Ba
曲建华,王玉玉,蔡明。gydF4y2Baet al。gydF4y2BabZIP转录因子UvbZIP6介导真菌生长,胁迫反应和假黑穗病的形成gydF4y2BaUstilaginoidea液对gydF4y2Ba.gydF4y2BaPhytopathol ResgydF4y2Ba4gydF4y2Ba32(2022)。https://doi.org/10.1186/s42483-022-00137-xgydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s42483-022-00137-xgydF4y2Ba
关键字gydF4y2Ba
- 大米假弄脏gydF4y2Ba
- Ustilaginoidea液对gydF4y2Ba
- bZIP蛋白质gydF4y2Ba
- UvbZIP6gydF4y2Ba
- 假黑穗病的形成gydF4y2Ba