摘要
的WRKY转录因子(TF)基因家族在从绿藻到开花植物的进化过程中,通过全基因组、片段复制和串联复制,得到了极大的扩展。来自不同植物物种的基因组序列为包含WRKY结构域的蛋白质的起源和进化提供了有价值的信息。累积的数据表明WRKY tf绑定W-box和/或其他独联体-元素,揭示的特殊性独联体基于WRKY蛋白的结构以及与核心序列相邻的核苷酸进行元素识别。WRKY蛋白之间或WRKY蛋白与其他调控因子之间的物理相互作用为研究该TF家族的调控提供了重要的视角。WRKY蛋白是激酶信号网络中的重要角色。植物抗性(R)蛋白与WRKY转录因子的相互作用以及不寻常的R-WRKY蛋白嵌合的存在表明了快速免疫反应信号通路的多样性。本文主要综述了WRKY转录因子在生物胁迫应答中的作用及其在生物胁迫中的多重作用拟南芥和水稻。
背景
WRKY转录因子(tf)是一个庞大的基因家族。自从第一份报告WRKY甘薯基因(石黑和中村1994),很多WRKY来自广泛植物物种的基因已被鉴定并显示参与生长、发育、代谢和对环境线索的反应(Chi et al。2013;Schluttenhofer和人民币2015;Phukan et al。2016;陈等人。2017年,一个;江等。2017年,一个).积累的数据表明,很大一部分WRKY基因对病原体、激发子和与防御相关的植物激素如水杨酸(SA)或茉莉酸(JA)有反应,这意味着WRKY植物免疫中的基因家族。WRKY转录因子正向或负向调控植物先天免疫系统的各个方面,包括病原体相关分子模式(PAMP)触发免疫(PTI)和效应者触发免疫(ETI) (Jones and Dangl2006).WRKY蛋白参与代谢,包括植物激素、植物抗毒素和其他与防御相关的化学物质的合成。2010;Schluttenhofer和人民币2015;梁等。2017).WRKY转录因子在调节植物生长发育中也起着重要作用(Grunewald等。2012;Cai et al。2014;丁等。2015 b;李等人。2015;田等。2017).此外,WRKY蛋白参与了植物对非生物胁迫的反应。2007;Yokotani et al。2013;李等人。2018).
越来越多来自不同植物物种的基因组测序数据为WRKY家族基因的全基因组分析提供了良好的平台。修改后的假设WRKY基因进化已经提出基于基因组探索和系统发育分析(Rinerson等。2015).嵌合WRKY tf包含WRKY结构域(WD)和其他新的蛋白质结构域已通过基因组挖掘发现(Rinerson等人)。2015;Mohanta et al。2016).基因组序列促进了基因家族的转录组学分析,如WRKY在特定的生理过程或应激条件下发现重要基因(Ning et al。2017;杨et al。2017;谢等。2018).此外,染色质免疫沉淀测序(ChIP-seq)和DNA亲和纯化测序(DAP-seq)已被用于识别tf的全基因组结合位点,如WRKY tf (Liu et al.)。2015;奥马利等。2016;Birkenbihl et al。2017).现有数据的整合可能为同源基因的功能和进化关系提供有价值的信息。
在WRKY转录因子中,经常观察到同源和异质复合体的形成,通过自调节和交叉调节机制调节基因表达(Xu等。2006;刘等人。2016).WRKY蛋白也与其他蛋白质相互作用,如受体、激酶和其他tf,并在转录调节网络中相互交织(Ishihama et al。2011;张等。2013;谢等。2014;谢赫等。2016;Lal et al。2018).蛋白质与蛋白质之间动态相互作用的形成是实现生物功能的重要步骤。一般来说,WRKY转录因子通过结合W-box (TTGACY,核心序列TGAC)调控靶基因独联体-基因启动子中的元素。然而,一些WRKY tf识别独联体-没有w盒核心序列的元素。本文综述了WRKY的进化和DNA结合活性的研究进展,重点介绍了WRKY蛋白的相互作用,特别是在生物胁迫和代谢调控下的相互作用。
WRKY结构及其演化
WRKY结构域(WD)长度约为60个氨基酸残基,具有潜在的DNA结合活性。WD是由经典的C2H2锌指通过在锌指上游添加wrky样基序出现在突变转座子中(Babu et al。2006).根据锌指基序的类型和wd的数量,WRKY蛋白被分为三组(Eulgem et al. 2000)。第一组和第二组成员包括C2H2而III组的WRKY蛋白有C2HC锌手指。通过系统发育分析,WRKY基因被进一步划分为亚组,尤其是第II组,它被分为至少5个亚组(IIa到IIe)。水稻WD各亚群的方案如图所示。1.观察到两个分类角色之外的不一致。其原因可能是关键氨基酸残基的突变,如非常保守的七肽WRKYGQK和参与锌结合的氨基酸;锌指长度的变化;(子)群之间的进化中间体;和WD删除。例如,集群在IIIa子组中的OsWRKY5和OsWRKY68包含CX7残雪23HXH (X为任何氨基酸)锌指,类似于IIIa CX亚群7残雪23HXC锌指,暗示C可能发散2H2和C2HC锌指(Wu et al。2005).小麦TaWRKY157含有两个wd,但因为它有一个C2HC锌指,被认为是I组和III组的中间成员(Ning et al。2017).延伸的锌指在水稻、毛竹和小麦III组WRKY蛋白中发现,即CX6 - 7残雪nHXC与n23 (Wu et al.;2005;李等人。2017;宁等。2017).第二组的成员有CX5残雪23除IIc亚群有CX外,其余均为HXH锌指基序4残雪23与I组WRKY蛋白c端WD (CTWD)相同的HXH锌指。IIc亚群成员可以聚集成独立的演化支,其中古IIc演化支与CTWD演化支相邻(Xu等。2016;江等。2017 b),表明I组和IIc亚组的基因之间存在密切的进化关系。亚群IIc也被Zhang和Wang (2005)或Ib亚群(Wu et al.)2005).除了锌指基型的变异外,WRKYGQK序列的突变也经常出现在各种植物物种中,经常观察到的变异包括WRKYGKK和WRKYGEK (Wu等。2005;姚明et al。2015;江等。2017 b;杨et al。2017;歌等。2018).
WRKY域演化方案。一个各(子)组的代表性WRKY域(WD)。水稻WDs的一致氨基酸序列。红色的是保守的锌指;绿色的R以粗体显示对于保守的r -内含子(第二阶段),但r -内含子处于衣藻reinhardtii在划线的位置大胆的R (I CT线)代替;浅蓝色V字以粗体显示对于IIa和IIb子组的保守v内含子(0期)。的内含子之一c . reinhardtii位于加下划线K的位置(阶段2)以粗体显示但在水稻和拟南芥I NT WDs中无内含子。b假设WD进化。一个假设的古代WD作为所有人的祖先存在WRKY基因。古WD呈I - CT/IIc和IIb结构。IIa和IIe wd分别由IIb和IIe推导而来。可通过区域复制和子功能化来获得新信号。N端和c端I WD分别为I NT和I CT;进化方向的箭头
的多元化WRKY基因可以用几种假设来解释。最初,组我WRKY基因被认为是他人的祖先WRKY基因,可能是由于只有一个第一类的存在WRKY单细胞绿色琼脂中的基因衣藻reinhardtii(吴et al。2005;谢等。2005;张、王2005).后来,可利用的丝状陆生藻类基因组序列Klebsormidium flaccidum显示了两个WRKY基因,一个在组I包含两个wd,另一个在亚组IIb,反映了亚组IIb基因在植物进化早期的存在(Hori et al。2014).III族和III族类基因也存在于卷柏moellendorffii而且Physcomitrella金属盘苔藓。然而,小组活动花絮WRKY基因缺失美国moellendorffii(Rinerson et al。2015;仁瑟等。2008).因此,Rinerson等(2015)提出了两个替代假设WRKY基因进化:“I族假说”和“IIa + IIb分离假说”。“第一组假设”表明所有WRKY在ctwd和IIc、IId和III亚组中存在的保守的r型内含子(在Arg密码子处拼接,第2期)出现之前,IIa + IIb亚组中的基因发生了多样化。然而,IIa和IIb基因包含一个v型(0期)内含子,位于wd中Val残基之前(图。1).内含子位置的差异暗示着分歧。另一种“IIa + IIb分离假说”认为,IIa和IIb亚群的基因直接从祖先藻类中的一个WD基因进化而来,它们的谱系不同于另一个I亚群WRKY基因(Rinerson et al。2015).此外,似乎有理由假设一个古老的,类似iic的亚群WRKY基因是所有生物的祖先WRKY如Xu等人所提出的。2016).非植物的存在WRKY真菌、对角虫和阿米巴虫物种的基因表明,在开花植物中WRKY基团形成之前发生的横向基因转移事件,并反映了包含单一WD的古代WRKY蛋白质(Rinerson等。2015).
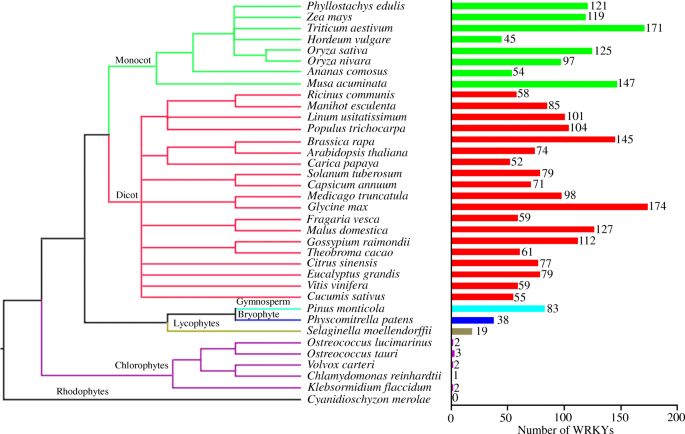
的WRKY基因家族在进化过程中大大扩展,从绿藻中的一个或几个基因到最早的陆生植物苔藓的30多个基因和一些开花植物的100多个基因。2和额外的文件1:表S1)。全基因组复制、片段复制和串联复制是基因扩增的主要原因WRKY基因家族。III组扩增WRKY基因在o .漂白亚麻纤维卷ssp。粳稻而且o . nivara来源于分段和串联基因复制(Wu et al。2005;徐等。2016).第三组WRKY基因是进化动态的,在植物的适应过程中起着重要作用。对10个代表性的单子叶和双子叶植物的III组WRKY蛋白进行系统发育分析,发现单子叶和双子叶植物特异性进化支(Xie等。2018),支持了一些多样化的假设WRKY基因发生在单子叶和双子叶分化后(Wu et al。2005).近一半的TaWRKY基因产生于片段复制(Ning et al。2017).第一组和第二组的扩大WRKY基因在Gossypium通过WGD(全基因组复制)和串联复制(Ding et al。2015年,一个).菠萝的基因组相对较少WRKY这可能是由于在菠萝进化过程中缺乏pangrass ρ WGD事件(Xie等。2018),而WGD和局部基因重复导致大豆中存在大量紧密的GmWRKY同源体(Yang et al.)。2017).
WRKY家族基因在36种植物中的分布基于NCBI分类浏览器(https://www.ncbi.nlm.nih.gov/Taxonomy/CommonTree/wwwcmt.cgi)和FigTree_v1.4.3 usingCyanidioschyzon merolae作为一个外围集团。右边的wrky的数量(参考参见附加文件)1:表S1)。的扩张WRKY家族基因主要是全基因组复制、片段复制和串联复制
WRKY绑定元素
大多数WRKY蛋白在体外结合W-box序列,由电泳迁移率转移试验(EMSAs)确定。AtWRKY4 CTWD配合物的w盒元素的溶液结构由核磁共振得到(Yamasaki等。2012).结果表明,一个四股的β-片以一种非典型的方式进入b型DNA的主槽,其中β-片近似垂直于DNA螺旋轴。在保守的WRKYGQK序列中,残基主要通过与胸腺嘧啶甲基广泛的极性接触与DNA碱基接触,这一点通过用尿嘧啶取代胸腺嘧啶碱基得到证实(Yamasaki等。2012).WD-DNA复合体的结构可以很容易地解释之前突变实验的结果,并表明WRKYGQK序列中的Trp、Tyr和两个Lys残基对DNA结合是不可或缺的(Maeo et al.)。2001;段等。2007;Ciolkowski et al。2008).WRKY蛋白结合W-box元件也需要WDs的锌指结构,因为锌离子螯合物的添加消除了emsa的结合活性(Rushton等。1995).最近,锌离子被证明在OsWRKY45晶体结构中起到了WDs二聚的桥梁作用(Cheng等。2019).WD二聚体与W-box元件的主槽相互作用,水介导的氢键参与蛋白质与DNA的碱基特异性相互作用。这些结果也解释了为什么WRKY蛋白经常形成同质和异质复合体。
已有一些关于含有WRKYGKK序列的WRKY蛋白与DNA相互作用的报道独联体元素。辣椒CaWRKY1是一种植物防御的负调控因子,它与一个含有三个TTGAC元素的DNA片段结合,如EMSA分析所示(Oh等。2008),而大豆GmWRKY6和GmWRKY21不能结合W-box (Zhou et al.)。2008).GmWRKY167含有一个WRKYEDK序列的WD,在系统发育上接近I组WRKY蛋白的n端WD (NTWD),在体外无法与W-box元件结合(Chi等。2015;杨et al。2017).目前尚不清楚GmWRKY167无法结合W-box是否由于靠近NTWD的WD中常见的GQK序列变为EDK,因为I组WRKY蛋白的ctwd主要负责DNA结合(Ishiguro和Nakamura)1994;de Pater等人。1996;Maeo et al。2001)、它在高尔基的位置,或者两者都有。烟草NtWRKY12也包含WRKYGKK序列,它与WK-box (TTTTCCAC)相互作用,但与一致W-box不相互作用。需要WK-box来诱导PR-1aSA和细菌激发子的表达,如烟草叶片(van Verk et al。2008).将GKK序列突变为GQK或GEK取消了NtWRKY12与WK-和w -box的结合活性,含有GKK的AtWRKY51重组蛋白不与WK-或w -box结合(van Verk et al.)。2008).包含WRKYGKK序列的水稻OsWRKY7与W-box形成了复合体,但与WK-box没有形成复合体,EMSA检测显示,GKK到GQK的突变增强了W-box结合活性(Chen et al.未发表数据)。此外,WRKY蛋白具有共同的WRKYGQK基序结合不同类型的独联体元素。OsWRKY13结合到W-box和PRE4 (TACTGCGCTTAGT)上,这两者也存在于其自身的启动子中,无论是在体外还是在体内(Xiao et al.)。2013).大麦2中的糖信号(SUSIBA2, HvWRKY46)与糖响应元件(SURE, TAAAGATTACTAATAGGAA)和W-box元件结合(Sun等。2003).AtWRKY70不仅与经典的W-box结合,还与WT-box (YGACTTTT, GACTTT为核心序列)结合,这是引发欧芹原生质体中基因表达激活的必要条件(Machens et al.)。2014).最近,AtWRKY50的WD被证明与WT-box和WT-box类元素相互作用,但重组全长AtWRKY50的使用阻碍了DNA结合(Hussain et al。2018).根据结构模型估计,AtWRKY50的n端区域可能阻碍DNA结合。此外,AtWRKY50与TGA2和TGA5受体相互作用,并同时与近端结合独联体元素PR1启动子;然后协同刺激sa诱导的表达PR1(Hussain et al。2018).这些数据表明,WRKYGQK七肽和其他WRKY蛋白之间的氨基酸差异可能会影响WD结构,导致对核苷酸基的偏好,从而使WRKY转录因子能够选择性和协调地调节许多目标基因。此外,核心序列附近的核苷酸也会影响TF结合,正如AtWRKY70所观察到的那样(Machens et al。2014).
分子技术已经发展到在全基因组尺度上表征调控元件和TF功能。DAP-seq方法通过重组TF蛋白查询基因组DNA,以发现TF结合位点(O’malley等。2016).ChIP-seq方法成功地识别了AtWRKY33蛋白的结合位点拟南芥感染后的基因组葡萄孢菌AtWRKY33对ABA生物合成基因有负调控作用NCED3而且NCED5对这种坏死性真菌的耐药性(Liu et al。2015).Birkenbihl等(2017)比较了flg22(鞭毛蛋白的22个氨基酸表位)中的AtWRKY18、AtWRKY40和AtWRKY33结合位点,从而为定义涉及WRKY tf的防御反应的全基因组转录调控网络提供了有价值的见解。对WRKY结合位点的全基因组分析也使我们能够破译它的多效性功能。
WRKY快捷免疫信号
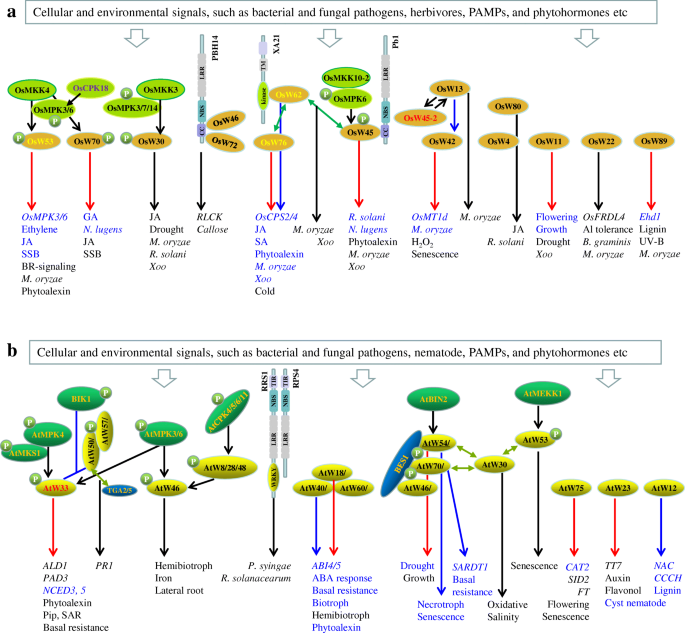
宿主抗性(R)蛋白对菌株特异性病原体效应因子的识别与一系列防御反应的激活有关。植物R蛋白,被称为NLRs,由n端卷曲线圈(CC)或toll -白介素1受体(TIR)结构域和核苷酸结合和富含亮氨酸的重复序列组成。R蛋白在植物中与tf相互作用。大麦霉病A (MLA)基因座编码cc型NLR (CNL)蛋白,该蛋白介导对抗白粉病真菌病原体Blumeria茎(沈et al。2007).MLA10的CC结构域与两个亚群IIa WRKY蛋白HvWRKY1和HvWRKY2相互作用(Shen等。2007).HvWRKY1和HvWRKY2在基础防御中起抑制作用,这与WRKY家族IIa亚群成员在基础防御中的作用相似拟南芥.随后,MLA10 CC结构域也被证明与HvMYB6结合,HvMYB6在基础和mla触发的抗b .茎(Chang et al。2013).激活MLA10是为了从HvWRKY1抑制复合体中释放HvMYB6并刺激HvMYB6调控基因的表达。数据表明,活跃的MLA10将HvMYB6作为转录重编程的即时激活因子,在静息状态下被HvWRKY1抑制因子隔离(Chang et al.)。2013).圆锥花序爆炸1(Pb1),它编码一种CNL蛋白,具有持久的广谱耐药性Magnaporthe oryzae种族(Inoue et al。2013).Pb1通过其CC结构域与细胞核中的OsWRKY45相互作用,相互作用保护OsWRKY45不受泛素蛋白酶体系统降解的影响。相反,pb1介导的爆炸抗性依赖于OsWRKY45。信令网络中涉及的OsWRKY tf的示意图如图所示。3.a. XA21是一种受体激酶,是一种模式识别受体黄oryzaepv。oryzae(Xoo语)抵抗(朴和罗纳德2012).XA21细胞内区域仅与水稻原生质体核中的IIa亚群OsWRKY62阻遏子相互作用。有趣的是,XA21被裂解释放细胞内激酶结构域以进行核易位,这是XA21介导的核易位所必需的Xoo语阻力。xa21介导的免疫反应通过与OsWRKY62的相互作用涉及到防御的解压抑(Peng et al。2008;公园和罗纳德。2012).OsWRKY46和OsWRKY72与cnl型BPH14(褐飞虱抗性14)蛋白相互作用(Hu等。2017).BPH14相互作用增加了OsWRKY46和OsWRKY72的稳定性,从而刺激受体样胞浆激酶的表达(RLCK)基因和胼胝质合成酶基因通过与它们的启动子结合,为研究昆虫抗性机制提供了重要线索(图1)。3.一个)。
拟南芥葡萄孢属-诱导激酶1 (BIK1)是RLCK家族的一员,在模式识别受体(PRRs)-BAK1复合体的下游起作用(Veronese等。2006).EFR,细菌翻译延伸因子Tu (EF-Tu)受体,在一个独特的延伸环上磷酸化BIK1,远离BIK1激酶的核心结构域(Lal等。2018).这些位点的拟磷突变体表现出JA和SA积累增加,对细菌的抵抗力增强两pv。番茄(太平洋标准时间) DC3000。BIK1位于细胞核内,与AtWRKY33、AtWRKY50和AtWRKY57相互作用。有趣的是,与原生BIK1相比,BIK1拟磷突变体对AtWRKY33、AtWRKY50和AtWRKY57的反式磷酸化活性显著降低(Lal等。2018).有人提出,病原菌激活的BIK1降低了AtWRKY50/AtWRKY57和AtWRKY33的反式磷酸化,从而分别抑制了tf介导的JA和SA诱导的负调控(Lal等。2018).数字3.b显示参与信号通路的AtWRKY tf。
嵌合蛋白由通常在R蛋白和WRKY tf中发现的结构域组成,似乎可能存在于许多植物物种中(Rinerson et al。2015;Mohanta et al。2016).AtWRKY52由tir型NLR结构和c端WD组成。的对低湿度敏感(SLH1)基因被分离为R基因RRS1-R(AtWRKY52-like)并对青枯病病菌产生抗性Ralstonia solanacearum(Deslandes et al。2002;Noutoshi et al。2005).的slh1该突变是由SLH1 WD中的一个氨基酸插入导致的,从而削弱了其W-box结合能力,在低湿度条件下赋予了本构防御激活,表明WD在SLH1抗病中起负作用(Noutoshi et al.)。2005).RRS1-R的WD是一种“融合诱饵”,当病原体效应因子试图以WRKY tf为靶点抑制免疫转录时,它会拦截病原体效应因子(Le Roux等)。2015;Sarris et al。2015).的r . solanacearum具有乙酰转移酶活性的效应子PopP2与植物细胞核中的RRS1-R相互作用,使WRKYGQ中的赖氨酸残基乙酰化Kmotif来阻止WD绑定到W-box元素。面对面的RRS1和RPS4对,它们都识别PopP2和丁香。AvrRps4效应器集成了WD诱饵来劫持以WRKY tf为目标的效应器(Le Roux等。2015;Sarris et al。2015).最近,马等人(2018)表明,在没有效应子的情况下,RRS1中的WD与其相邻结构域相互作用,使RRS1- rps4 NLR复合体保持在非激活状态。效应因子AvrRps4能够与WD相互作用,从而破坏分子内的结合并解除NLR复合体的抑制,而popp2触发的激活以一种更复杂的方式发生。NLR受体与转录网络的相互作用和不寻常的NLR- wrky蛋白的存在表明信号通路的多样性或通过快捷信号通路加速信号的可能性,以早期、即时的免疫反应对抗不同的入侵病原体。
WRKY与激酶的相互作用
丝裂原激活蛋白激酶(MPK)级联是植物防御入侵病原体的重要信号事件。MPK通过被MPK激酶(MKKs或MEKs)磷酸化而激活,而这些激酶又被上游的MPK激酶激酶(MEKKs)磷酸化。MPK3、MPK4和MPK6通常与植物对生物和非生物胁迫的反应有关。越来越多的WRKY转录因子被认为是这些MPK的底物,也是调控植物免疫和胁迫适应的MPK信号通路中的重要成分。在烟草benthamiana, I组NbWRKY8包含一个D(对接)结构域,在n端区域有一个SP(丝氨酸/脯氨酸残基)簇,这在一些I组WRKY蛋白中高度保守(Ishihama et al.)。2011).在体外,NbWRKY8的SP位点可以被WIPK和SIPK(分别是AtMPK3和AtMPK6的同源物)磷酸化,只有两个SP位点被磷酸化在足底通过MEK2激活NbMPKs (Ishihama et al。2011).NbWRKY8的磷酸化增加了其与W-box元件的结合和转激活活性。nbmpk介导的NbWRKY8的磷酸化在激活免疫反应中起着重要作用,这一点通过使用仿磷和病毒诱导的基因沉默突变体(Ishihama et al。2011).随后,NbWRKY8及其近亲NbWRKY7、NbWRKY9和NbWRKY11被证明与的启动子结合NbRBOHB通过MEK2DD-和INF1信号响应w盒包含积极调节的元件NbRBOHB表达(Adachi et al。2015).此外,作者还证实了NbRBOHB通过MPK-WRKY途径仅发生在ETI诱导的持久而强大的第二次ROS(活性氧)爆发之后,而不是由PTI触发的快速ROS爆发(Adachi et al。2015).
AtWRKY33是NbWRKY8的同源物,在AtMPK3/AtMPK6-和病原体诱导的camalexin(一种吲哚类植物alexin和植物激素乙烯)的生物合成中是必需的拟南芥(毛等。2011;李等人。2012).AtWRKY33在体外和体内均被AtMPK3/AtMPK6磷酸化b .灰质感染,AtWRKY33磷酸化位点的突变削弱了其完全补充camalexin积累不足的能力atwrky33突变体。Pathogen-inducibleAtWRKY33是由AtMPK3/AtMPK6级联在一个潜在的正反馈调控循环中调控的,因为AtWRKY33靶向自己的启动子。AtWRKY33也存在于AtMPK4和AtMKS1之间的核复合体中,AtMPK4的底物之一(Qiu等。2008).AtWRKY33从三元配合物中释放p .两或通过激活AtMPK4使AtMKS1磷酸化而引起的flg22处理。随后,释放的AtWRKY33靶向的启动子PAD3(植物抗毒素不足3),它编码P450酶CYP71B15,用于camalexin生物合成的最后一步(图。3.b).然而,在生产camalexin时不需要AtMPK4拟南芥为了应对b .灰质入侵(毛等人。2011).尽管如此,这些结果表明AtWRKY33在调节cam氨苄素生物合成中起着位于AtMPKs下游的作用。Pipecolic acid (Pip),赖氨酸分解产物,是建立系统获得性抗性(SAR)的关键拟南芥局部的病原体感染。Pip通过ALD1(类agd2防御反应蛋白1)合成,并进一步被FMO1(黄素依赖性单加氧酶1)转化为n-羟基胡椒酸,这是SAR激活的重要成分(Hartmann et al.)。2018).激活AtMPK3 / AtMPK6诱发ALD1AtWRKY33介导的表达升高局部Pip积累(Wang等。2018).此外,pip诱导的AtMPK3/AtMPK6激活或病原体触发的AtMPK激活在atwrky33而且ald1突变体。这些结果表明,AtMPK3/AtMPK6和AtWRKY33与ALD1和Pip一起形成了SAR激活的正调控环(Wang et al.)。2018).
通过体外磷酸化分析,AtWRKY46,一个III组WRKY蛋白成员,被确定为AtMPK3的底物(Sheikh等。2016).在用flg22处理的原生质体中,AtWRKY46的稳定性降低,而两个磷酸化位点的突变使AtWRKY46失活,使蛋白质稳定。在之前的一项研究中,AtWRKY46表达不亲和组合的原生质体和植物中转录水平强烈上调RPM1或PRS2与avrRpm1,avrB或avrRpt2,AtWRKY46是收敛的ETI信号通路中的早期标记基因(Gao et al。2013).此外,AtWRKY46是由wrkyys协同调控的,如IIc亚群wrkyys AtWRKY8、AtWRKY28和AtWRKY48与Ca2 +-依赖蛋白激酶(CPKs) CPK4, CPK5, CPK6和CPK11。CPKs磷酸化AtWRKY8、AtWRKY28和AtWRKY48,增强了它们与W-box元素的结合活性。与鞭毛蛋白的诱导不同,AvrRPm1和AvrRpt2效应子可引发快速和持久的CPK激活,但AtMPK激活很少,这表明CPKs在RPS2和RPM1介导的ETI信号传导中起主导作用拟南芥(Gao et al。2013).MPKs和CPKs在早期先天免疫中也以平行或协同的方式发挥作用(Boudsocq等。2010).此外,水稻OsCPK18与OsMPK5(相当于文中的OsMPK3)相互作用并通过磷酸化激活OsMPK5 (Xie et al.)。2014).OsCPK18-OsMPK5途径负向调控水稻抗病m . oryzae代表了钙信号和MPK级联之间的直接联系。
水稻中I组WRKY蛋白OsWRKY30与多个osmpkk相互作用,并被OsMPK3、OsMPK7和OsMPK14磷酸化(Shen等。2012).在所有SP位点上磷酸化阴性的OsWRKY30突变体在转基因水稻植株中没有表现出耐旱性的提高。在另一项研究中,过度表达OsWRKY30增加抵抗m . oryzae对抗叶鞘枯萎菌辣椒(Peng et al. 2012)。抗病能力的增强与JA生物合成基因的上调和病原菌感染时JA产量的增加有关。此外,OsWRKY30是OsMKK3-OsMPK7模块的下游靶点,正向调控对细菌的防御反应Xoo语(Jalmi和Sinha2016).致病性OsWRKY53是NbWRKY8的同源物。OsWRKY53中n端保守SP簇是OsMPK3/OsMPK6的磷酸化位点,由OsMKK4激活(Chujo et al.;2014).磷酸化的OsWRKY53具有较高的转激活活性,但其结合W-box元素的能力没有变化。的过度表达OsWRKY53仿磷进一步增强了对一种有毒物质的抵抗力m . oryzae与过度表达的本地植物相比,菌株和强烈上调了许多防御相关基因的表达OsWRKY53(Chujo et al。2014).OsWRKY53也能被伤口迅速诱导,被条纹茎螟虫(SSB)的攻击也能延迟诱导。卡勒suppressalis2015).OsMPK3 / OsMPK6积极调节OsWRKY53转录;然而,OsWRKY53消极地影响OsMPK3 / OsMPK6SSB幼虫侵染后的转录和激酶活性。因此,OsWRKY53与野生型和RNAi株系相比,过表达植株在应对SSB攻击时积累较少的乙烯和茉莉酸盐,并减弱对SSB幼虫的抵抗力。2015).这些结果表明,OsWRKY53作为OsMPK3/OsMPK6的负反馈调节剂,在防御草食动物中起作用,但却激活了对blast真菌的疾病抗性(图。3.a).令人好奇的是,OsWRKY53调节OsMPK3/OsMPK6对病原体感染的反应,并对响应草食动物和病原体入侵的特定基因亚群具有拮抗作用。第一组OsWRKY70通过增加防御性植物激素JA的生物合成和降低生长激素GA的水平来优先考虑防御而不是生长c . suppressalis(李等。2015).OsWRKY70基因的激活使水稻植株对咀嚼食草动物的抵抗力增强c . suppressalis但更容易感染稻飞虱摘要研究选择性,一种刺吸昆虫。进一步的实验表明,JA水平的升高与c . suppressalis而GA水平的降低是导致抗性的原因n .选择性易感性(Li et al。2015).最近,OsWRKY53被确定为水稻油菜素内酯(BR)信号的阳性调控因子,作用于OsMKK4-OsMPK6级联的下游,控制植物结构(Tian等。2017).BRs促进OsWRKY53蛋白水平,然后负调控自身表达。免疫和生长之间的权衡对进化和利用免疫反应有重要意义,以帮助保护作物免受生物胁迫而不影响生长。
WRKY复合体和级联
蛋白质相互作用对我们理解复杂的功能相互作用网络具有重要意义。越来越多的数据表明,WRKY蛋白可以形成同质和异质复合体。在拟南芥AtWRKY18、AtWRKY40和AtWRKY60这三个IIa亚群成员相互作用,并通过亮氨酸拉链基序相互作用(Xu等。2006).这三个WRKY基因是基础防御的负调控因子,作用方式复杂,具有加性和拮抗作用(Xu等。2006).AtWRKY18、AtWRKY40和AtWRKY60的附加效应从它们在生物营养和半生物营养病原体感染反应中基于单、双或三突变体表型的部分冗余作用中可以明显看出(Xu等人)。2006;et al。2013).此外,过度表达AtWRKY18增加阻力p .两而AtWRKY18与AtWRKY40或AtWRKY60共表达使植物对病原体易感(Xu et al。2006).这三个WRKY基因也在ABA信号通路中起作用。ABA-inducedAtWRKY60转录被强烈抑制atwrky18或atwrky40突变体,提示AtWRKY18和AtWRKY40在转录激活AtWRKY60对ABA的响应(Chen et al。2010).AtWRKY40被认为与红光和ABA信号通路相关,通过下调ABA对种子萌发的抑制负向调节ABI5(Geilen和Bohmer2015).AtWRKY18、AtWRKY40和AtWRKY60之间的物理相互作用可能会改变它们的W-box结合能力。AtWRKY60单独具有很少的W-box结合活性,可以增强AtWRKY18,但减少AtWRKY40与含W-box序列的结合(Xu et al.)。2006).这三种WRKY蛋白在与某些W-box元件结合时表现出拮抗作用ABI4而且ABI5被测试的启动子(Liu等。2012).
WRKY基因转录遵循顺序调控级联。ⅲ组WRKY蛋白OsWRKY45是水稻抗稻瘟病菌的重要积极分子m . oryzae(Shimono et al。2007).IIe亚群中的OsWRKY13和IId亚群中的OsWRKY42是转录阻遏子OsWRKY13或者是对OsWRKY42增强抵抗m . oryzae(肖et al。2013;程等。2015).OsWRKY42功能在OsWRKY13的下游,OsWRKY13作用在OsWRKY45 - 2的下游,OsWRKY45 - 2是OsWRKY45/OsWRKY45 - 1的等位基因,与明辉63有10个氨基酸的差异籼稻大米(肖等。2013;程等。2015).OsWRKY13和OsWRKY45-2相互结合,并结合各自的启动子,这表明OsWRKY13和OsWRKY45-2相互控制彼此基因的转录,并可能通过自身的自动调节进行微调。OsWRKY45-2-upregulated OsWRKY13抑制OsWRKY42;反过来,它的蛋白质会抑制与ja相关的基因m . oryzae感染(Cheng等。2015).此外,转基因水稻植株过度表达OsWRKY42显示早期衰老表型与过氧化氢含量升高,可能通过抑制OsMT1d基因表达(Han et al。2014).OsWRKY62是WRKY的IIa亚群成员,被分析为抗病阻遏因子(Peng et al.)。2008;刘等人。2016).有趣的是,OsWRKY62在与OsWRKY45形成异质复合体后,在抗稻瘟病和叶枯病病原体中发挥积极作用,而OsWRKY62同质复合体在缺氧反应中起抑制作用(Fukushima et al.)。2016).
OsWRKY80是由JA和水稻纹枯病菌诱导的吗r .以上(彭et al。2016).水稻overexpressingOsWRKY80表现出增强的抵抗力r .以上伴随而来的是OsWRKY4转录。此外,OsWRKY80特异性地与的启动子相互作用OsWRKY4,它正调节着对r .以上通过JA/乙烯依赖的信号通路(Wang et al。2015;彭等。2016).这些数据表明,OsWRKY80和OsWRKY4在抗病性中共同发挥着正向调节回路的作用。
WRKY调节代谢产物
当病原体感染时,植物被触发产生被称为植物抗菌素的活性抗菌化合物,它们的组成化学物质被命名为植物原素(VanEtten et al。1994).这类化合物通常与防御反应有关,尽管每种化合物对感染性病原体的作用或大或小。例如camalexin和吲哚-硫代葡萄糖苷拟南芥燕麦中的三萜皂苷在植物抵御某些病原体方面发挥着重要作用(Papadopoulou et al。1999;et al。2013).越来越多的信息揭示了这些生物活性化合物(包括植物抗毒素)的调控网络和生物合成途径。Schluttenhofer和Yuan (2015).
受细菌和真菌病原体感染的水稻植株,或经紫外线辐射处理的水稻植株,会产生二萜、樱糖苷、酚酰胺等植物抗毒素(Cho和Lee2015).一些化合物对细菌和真菌病原体表现出不同的活性(Cho和Lee2015).OsWRKY45是苯并噻二唑(BTH)引物后合成的二萜如莫内酯A和植物cassanes C和Em . oryzae接种(Akagi et al。2014).IIa亚群成员OsWRKY62和OsWRKY76形成同质和异质复合体,并负调控水稻防御反应(Liu et al。2016).击倒的OsWRKY62而且OsWRKY76通过RNA干扰(dsOW62/76)导致两个基因的选择性剪接和免疫m . oryzae而且Xoo语感染。个体淘汰赛OsWRKY62或OsWRKY76显示了它们在负反馈调节中的作用(Liu et al。2016).与野生型植株相比,dsOW62/76植株的一级和二级代谢被重编程(Liang等。2017).更重要的是,dsOW62/76植株积累了大量的二萜、樱莓素和酚酰胺,而游离类黄酮池减少。此外,dsOW62/76植株和个体的SA和JA/ il -JA含量均有所增加OsWRKY62而且OsWRKY76敲除系与野生型植物的敲除系比较。相比之下,过度表达OsWRKY62或OsWRKY76抑制二萜和樱莓素的积累(Yokotani et al。2013;梁等。2017).
植物抗毒素camalexin(3-噻唑-2 ' -酰基吲哚)对一些坏死性、半生物营养性和生物营养性病原体具有重要的防御功能,如果不是全部的话(Ahuja等。2012).如前所述,磷酸化的AtWRKY33调节camalexin生物合成基因,如CYP71A13而且PAD3(邱et al。2008).AtWRKY18和AtWRKY40也参与植物抗毒素的生物合成。双atwrky18 atwrky40突变体显示cam氨苄素和吲哚-硫代葡萄糖苷生物合成相关基因的转录激活,这些生物活性化合物的积累是抵抗生物营养性白粉病真菌所必需的Golovinomyces orontii(et al。2013).IIc亚群中的AtWRKY12通过调节木质素沉积作用于苯丙类途径(Wang et al。2010).植物表达一个atwrky12变种人,和它的同类一样Medicago truncatula(mtstp),显示髓细胞壁二次增厚,茎生物量显著增加。AtWRKY12负调控下游NAC和ccch型锌指转录因子,它们控制木质素、木聚糖和纤维素的形成(Wang等。2010,无花果。3.b).同样,在柳枝稷和玉米中抑制AtWRKY12同源基因会导致次生细胞壁异位沉积(Gallego-Giraldo等。2016).这些结果表明,参与代谢的WRKY转录因子可能在植物物种间具有保守作用(Schluttenhofer and Yuan2015).
茉莉酸常被用作调节次生代谢的关键激发子。茉莉酸响应型转录因子,如WRKYs和MYCs,参与调节植物代谢。的异位表达AtWRKY18而且AtWRK40在一起AtMYC2激活MEP (2-C-甲基- d -赤藓糖醇4-磷酸)通路鼠尾草sclarea从而提高了阿异烷二萜的含量(Alfieri et al。2018).Catharanthus roseus也叫生产各种萜类吲哚类生物碱,具有重要的药学意义。meja诱导的CrWRKY1, OsWRKY45的同源物,正向调控色氨酸脱羧酶基因通过与启动子结合,导致色胺增加,随之而来的是蛇纹石积累(Suttipanta et al。2011).在罂粟里(果实), PsWRKY绑定到酪氨酸脱羧酶调控苄基异喹啉生物碱生产的基因启动子(Mishra et al。2013).这些脱羧酶产生的胺和酚酸在苯丙烷途径中可以形成酚酰胺,正如在水稻中观察到的那样(Liang et al。2017).酚酸和多胺缀合物也在抗病方面发挥作用。在小麦中,TaWRKY70赋予了对赤霉病病原体的抵抗力镰刀菌素graminearum通过调节香豆素酰丙马汀和香豆素酰腐胺的合成(Kage et al。2017).在另一份报告中,TaWRKY70与高温小麦幼苗对条锈菌的抗性呈正相关柄锈菌striiformisf . sp。tritici王(et al。2017).
WRKY在多种途径
植物激素BRs调节多种植物生长和发育过程,以及它们对环境挑战的反应。BR信号可能通过负作用的糖原合成酶激酶3样激酶BIN2 (BR不敏感2)转导到BES/BZR1 (BR不敏感- ems抑制剂-1/油菜素唑耐药1)家族转录因子,该家族转录因子调节BR响应基因的表达。三个拟南芥III组WRKY tf,AtWRKY46,AtWRKY54,AtWRKY70,是由BRs诱导的,在br调节的植物生长中发挥冗余作用(Chen et al。2017 b).这三个wrky与BES1互作,协同调控BES1靶基因。BES1上游调控因子BIN2也能与AtWRKY46、AtWRKY54和AtWRKY70相互作用并磷酸化,导致至少AtWRKY54的不稳定性在足底(陈等。2017年,一个,b).的atwrky46 atwrky54 atwrky70三重突变体缺乏br调控的植物生长,但比野生型植物更耐旱,表明AtWRKY46、AtWRKY54和AtWRKY70在植物生长中发挥积极作用,在干旱反应中发挥消极作用(Chen et al。2017 b).此外,AtWRKY46还参与抗病、缺铁状态下的铁转运和侧根发育等多个过程(Hu et al.)。2012;丁等。2015 b;燕等。2016).
的atwrky54 atwrky70双突变体SA和H积累增加2O2叶片衰老加速,对坏死性病原体的抵抗力增强b .灰质而且Pectobacterium carotovorum表明AtWRKY70及其最接近的同源物AtWRKY54负调控衰老和对坏死性细胞的抵抗(Besseau et al。2012;李等人。2017).这很可能是由于玉米中SA含量的升高atwrky54 atwrky70双突变体刺激H2O2和细胞壁强化,从而提高对坏死营养体的抵抗力,但这不足以增加对生物营养体或半生物营养体的抵抗力(Li et al。2017).AtWRKY30与两个负衰老调控因子AtWRKY54和AtWRKY70以及一个衰老激活因子AtWRKY53相互作用,AtWRKY53是第一个被鉴定为衰老调控因子的WRKY TF。的表达AtWRKY30,AtWRKY53,AtWRKY54,AtWRKY70部分依赖于衰老过程中SA的合成,而AtWRKY30而且AtWRKY53但不是AtWRKY54而且AtWRKY70对活性氧如H2O2臭氧(Besseau et al。2012).β-葡糖苷酸酶活性受AtWRKY30启动子是由几丁质,特别是纤维二糖(β-1,4-二葡糖)强烈诱导的,它作为一种损伤相关的分子模式分子(Souza et al。2017).的本构表达增加了对氧化和盐胁迫的耐受性AtWRKY30(Scarpeci et al。2013).AtWRKY70结合W-和WT-box元素AtWRKY30启动子,提示AtWRKY70可能直接调控AtWRKY30表达式(Machens et al。2014),而不仅仅是上面提到的蛋白质-蛋白质相互作用。最近,AtWRKY70被证实具有抑制作用SARD1(全身性获得性抵抗力缺乏)通过直接结合到的启动子中的WT-boxSARD1该基因编码了一种促进SA生物合成的植物防御正调控因子(Zhou et al。2018).转录组学分析显示,AtWRKY70在没有病原体的情况下主要是一种免疫抑制因子,但在病原体攻击后激活免疫。表达改变基因的启动子在WT-box元件中富集。作者认为抑制SARD1AtWRKY70有助于健康,因为WT-box主题是保守的十字花科家庭(周等。2018).AtMEKK1调节AtWRKY53, AtWRKY53被激酶磷酸化,显示出DNA结合活性的增加(Miao et al.)。2007).有趣的是,AtMEKK1与的启动子结合AtWRKY53AtMEKK1中的结合基序是年龄调节所必需的AtWRKY53表达(Miao et al。2007).AtWRKY75是叶片衰老和开花时间的正向调控因子(Guo et al.)。2017;Zhang et al。2018).AtWRKY75结合到开花轨迹T(英国《金融时报》)基因,而DELLA蛋白与AtWRKY75相互作用减弱其激活(Zhang et al。2018).AtWRKY75表达受年龄、SA和H的诱导2O2.同时,AtWRKY75通过上调SA的合成促进SA的合成SID2(SA induction-deficient 2)转录和抑制CAT2(过氧化氢酶2郭等。2017).AtWRKY75的过表达加速了叶片的衰老,沉默可以抑制这一过程SID2或者增加过氧化氢酶活性。提出了一个涉及AtWRKY75、SA和ROS的三方扩增环模型,为研究衰老的分子调控网络提供了新的思路(Guo et al.)。2017).这些结果支持SA和ROS在叶片衰老过程中的促进作用。
AtWRKY23是IIc亚群WRKY蛋白,通过控制生长素分布参与根的发育(Grunewald等。2012).AtWRKY23调节黄酮醇的合成,特别是在根尖,通过刺激转录TT7(透明的外种皮7),它编码黄酮3 ' -羟化酶,并介导二氢山奈酚向二氢槲皮素的转化(Grunewald等。2012).因此,槲皮素(一种生长素运输的内源性负调控因子)的积累在组构表达的植物根系中升高AtWRKY23与野生型植物根中的含量相比。在早期的研究中,AtWRKY23被报道为一种植物寄生囊肿线虫(异皮线虫属schachtii)诱导基因(Grunewald et al。2008).的表达AtWRKY23是在前期刺激线虫取食部位的建立,而抑制AtWRKY23降低对寄生线虫的敏感性(Grunewald et al。2008).Auxin-inducibleAtWRKY23表达受孤根/吲哚-3-乙酸14 (SLR/IAA14)及其下游转录因子生长素反应因子(ARF) 7和ARF19控制。因此,atwrky23介导的黄酮醇诱导的生长素运输调节在进化过程中可能被植物病原体劫持(Grunewald等。2012).功能获得的突变体,dlf1的,OsWRKY11的一个非常接近的同系词AtWRKY23,表现为半矮和晚开花表型,由于升高OsWRKY11由T-DNA插入引起的转录(Cai等。2014).在dlf1突变体,另一种剪接OsWRKY11由于第三外显子的缺失导致过早的翻译,同时观察到较短的转录本的存在。过表达短转录本的植物表现出非常高的转基因转录水平和表型相似dlf1突变(Cai et al。2014).野生型的过度表达OsWRKY11株高降低,但抗Xoo语而且耐旱胁迫,而击倒OsWRKY11损害了这些表现型(Lee et al。2018).这些结果表明,OsWRKY11正向调节生物和非生物胁迫反应,可能对生长产生抑制作用。的转录水平OsWRKY89(被CGSNL改名为104)被MeJA和UV-B辐射强烈诱导(Wang等。2007;大米WRKY工作组2012).过度的OsWRKY89提高木质素和SA含量,增强抗病性m . oryzae以及对UV-B照射的耐受性。此外,OsWRKY104在ABA响应元件结合因子1 (OsABF1)下游发挥作用(Zhang等。2016).干旱诱导基因的过表达OsWRKY104的抑制延迟了航向时间提前启航日期1(Ehd1)的表达,表明OsABF1至少部分地通过激活OsWRKY104对水亏缺的响应(Zhang et al。2016).
基因敲除oswrky22品系不仅增加了对毒性和无毒性的易感性m . oryzae但也改变了细胞对非宿主的反应m .盘菌大麦白粉病病原体(Abbruscato et al。2012).此外,沉默OsWRKY22增强对铝应力的敏感性(Li et al。2018).OsWRKY22结合了启动子OsFRDL4(柠檬酸转运体样)基因通过w -box和促进铝在水稻中诱导柠檬酸分泌和铝耐受性(Li等。2018).OsWRKY45参与对生物和非生物信号的响应。OsWRKY45可以被OsMPK4和OsMPK6在体外磷酸化,OsMKK4, OsMKK6或OsMKK10-2激活,但OsMKK1不激活(Ueno等。2013).OsWRKY45通过OsMKK10-2-OsMPK6级联磷酸化是其在sa依赖性疾病抵抗中的活性所必需的(Ueno等。2015).然而,BTH-inducedm . oryzaeABA处理或低温、高盐度等非生物胁迫降低了抗性,暗示非生物胁迫的拮抗作用可能是由ABA信号介导的。两种酪氨酸磷酸酶osppp1 /2在ABA存在的情况下使OsMPK6去磷酸化,导致OsWRKY45激活不足,增加对blast真菌的敏感性(Ueno et al.)。2015).在oswrky45介导的生物刺激反应中也观察到拮抗作用。过度的OsWRKY45提高对生物营养性和半生物营养性病原体的耐药性,如细菌Xoo语和真菌m . oryzae,而击倒OsWRKY45增强对坏死性真菌病原体的抵抗力r .以上还有像褐飞虱这样的食草动物摘要研究选择性(Shimono et al。2012;Huangfu et al。2016).
结束语
WRKY tf参与一个整合内部和环境因素的调节网络,以调节防御反应的各个方面。WRKY转录因子之间的相互作用为研究靶基因在功能上的协同和拮抗作用提供了新的思路。WRKY基因家族的自调节和交叉调节意味着WRKY级联可能通过自身的自动调节微调这种调节。但是,要详细解决这个机制,还需要做很多工作。一些WRKY转录因子与受体或信号接收复合体的组成部分相互作用,提示信号通路的潜在捷径。更重要的是,WRKY tf的激活或增强激活通常与其他信号传导成分相关,如蛋白激酶。因此,R蛋白- wrky复合体如何招募新成员以促进植物免疫,需要研究。一种特殊的策略是将越来越多的测序数据与WRKY介导的重要生物过程中蛋白质-蛋白质和蛋白质- dna相互作用的信息结合起来,建立一个全面的WRKY信号通路和转录调控网络。由于WRKY转录因子对植物代谢至关重要,阐明WRKY蛋白如何调节代谢是调节作物免疫的关键步骤。此外,值得注意的是,WRKY转录因子在防御不同病原体、耐非生物胁迫和农艺性状方面的多功能性可能限制了这些基因在作物改良方面的应用。
缩写
- 阿坝:
-
脱落酸
- ALD1:
-
类agd2防御反应蛋白1
- 东盟地区论坛:
-
生长素响应因子
- 蓝芽:
-
Benzothiadiazole
- CGSNL:
-
基因符号化、命名和连锁研究委员会
- ChIP-seq:
-
染色质immunoprecipitation-sequencing
- 肌酸磷酸激酶:
-
Calcium-dependent蛋白激酶
- CTWD:
-
c端WD
- CYP:
-
细胞色素P450单氧酶
- DAP-seq:
-
DNA亲和纯化测序
- Ehd1:
-
提前启航日期1
- EMSA:
-
电泳迁移率迁移试验
- 呃:
-
内质网
- 指数:
-
Effector-triggered免疫力
- flg22:
-
鞭毛蛋白22个氨基酸表位
- FMO1:
-
Flavin-dependent单氧酶1
- 是:
-
茉莉酸
- MEK或MKK:
-
MPK激酶
- MEKK:
-
MPK激酶激酶
- MPK:
-
增殖蛋白激酶
- NTWD:
-
氨基端WD
- PAMP时:
-
其分子模式
- 皮普:
-
Pipecolic酸
- PTI:
-
PAMP-triggered免疫力
- 接待员:
-
电阻
- RBOH:
-
呼吸爆裂氧化酶同源物
- RLCK:
-
受体细胞质激酶
- 山:
-
水杨酸
- 特别行政区:
-
系统获得性耐药
- 单反/ IAA14:
-
孤独的根/ INDOLE-3-ACETIC ACID14
- 单边带:
-
条纹天牛
- TF:
-
转录因子
- TT7:
-
透明的外种皮7
- WD:
-
WRKY域
- WGD:
-
全基因组复制
参考文献
缩写cato P, Nepusz T, Mizzi L, Del Corvo M, Morandini P, Fumasoni I,等。OsWRKY22,单子叶植物WRKY22基因在抗爆反应中起着重要作用。植物病理学杂志2012;13:828-41。
田立H,中野T,宫川N,石滨N,吉冈M,加头Y,等。WRKY转录因子被MAPK磷酸化,调控植物免疫NADPH氧化酶烟草benthamiana.植物细胞。2015;27:2645 - 63。
阿胡贾I,基森R,博恩斯AM。植物抗菌素对病原体的防御作用。植物学报,2012;17:73-90。
赤城A,福岛S,冈田K,江CJ,吉田R,中山A,等。wrky45依赖的水稻二萜类植物抗毒素生物合成启动及细胞分裂素在引发该反应中的作用植物分子生物学,2014;86:171-83。
Alfieri M, Vaccaro MC, Cappetta E, Ambrosone A, De Tommasi N, Leone A鼠尾草sclarea通过WRKY和MYC2转录因子的异源表达。Sci众议员2018;8:11009。
Babu MM, Iyer LM, Balaji S, Aravind L. WRKY-GCM1锌指的自然历史和转录因子与转座子的关系。核酸学报。2006;34:650 - 20。
WRKY54和WRKY70在植物叶片衰老过程中的负调控作用拟南芥.J Exp Bot 2012; 63:2667-79。
Birkenbihl RP, Kracher B, somssiich IE。诱导全基因组的三种结合拟南芥WRKY转录因子在早期mamp触发免疫中的作用植物细胞。2017;29:20-38。
Boudsocq M, Willmann MR, McCormack M, Lee H, Shan L, He P,等。不同的先天免疫信号通过Ca2 +传感器蛋白激酶。大自然。2010;464:418-22。
Cai Y,陈X,谢K,邢Q,吴Y,李江,et al。Dlf1是WRKY转录因子,参与水稻花期和株高的调控。《公共科学图书馆•综合》。2014;9:e102529。
常超,于东,焦静,静S, Schulze-Lefert P,沈qh。大麦MLA免疫受体直接干扰拮抗作用的转录因子,启动抗病信号。植物细胞。2013;25:1158 - 73。
陈峰,胡勇,Vannozzi A,吴凯,蔡宏,秦勇,等。模式植物和作物中的WRKY转录因子家族。植物学报,2017a; 36:311-35。
陈浩,赖铮,史杰,肖燕,陈铮,徐旭拟南芥WRKY18、WRKY40和WRKY60转录因子在植物对脱落酸和非生物胁迫响应中的作用植物生物学杂志2010;10:281。
陈静,诺兰TM,叶浩,张敏,童浩,辛萍,等。拟南芥WRKY46、WRKY54和WRKY70转录因子参与油菜素调控的植物生长和干旱响应。植物细胞。2017 b; 29:1425-39。
程红,刘红,邓勇,肖娟,李旭,王珊。WRKY45-2 WRKY13 WRKY42转录调控级联是水稻抗真菌病原菌的必要条件。植物杂志。2015;167:1087 - 99。
程曦,赵颖,蒋强,杨军,赵伟,Taylor IA,等。水稻WRKY结构域二聚及双W-box DNA识别的结构基础。核酸Res. 2019。https://doi.org/10.1093/nar/gkz113.
杨气Y, Y,李G,王F,风扇B,陈z识别和描述小说群legume-specific,高尔基apparatus-localized WRKY和Exo70从大豆蛋白。J Exp Bot. 2015; 66:3055-70。
迟勇,杨勇,周勇,周军,范斌,余建强,等。WRKY转录因子调控中的蛋白-蛋白相互作用。摩尔。2013;6:287 - 300。
赵mh,李sw。水稻酚类植物抗毒素的生物学功能和生物合成。国际分子生物学杂志2015;16:29120-33。
Chujo T, Miyamoto K, Ogawa S,增田Y,清水T,岸-卡博西M,等。过表达的磷酸化突变OsWRKY53可增强水稻的抗稻瘟病能力。《公共科学图书馆•综合》。2014;9:e98737。
Ciolkowski I, Wanke D, Birkenbihl RP, Somssich IE。WRKY转录因子的dna结合选择性研究为研究WRKY结构域功能提供了结构线索。植物分子生物学,2008;68:81-92。
王晓燕,王晓燕,王晓燕。一种锌依赖性转录激活子的研究进展拟南芥.核酸条例1996;24:4624-31。
Deslandes L, Olivier J, Theulieres F, Hirsch J, Feng DX, bittn - eddy P,等。抵抗Ralstonia solanacearum在拟南芥是隐性授予的吗RRS1-R基因,一个新的抗性基因家族的成员。中国科学(英文版)2002;39(2):347 - 347。
丁梅,陈杰,蒋勇,林玲,曹勇,王梅,等。全基因组调查和转录组分析WRKY基因家族在Gossypium.生物学报,2015a;29:151 - 71。
丁志军,闫建勇,李春霞,李桂霞,吴yr,郑世杰。转录因子WRKY46调节细胞的发育拟南芥在渗透/盐胁迫条件下,通过调节ABA信号和生长素内稳态来调节侧根。植物j . 2015 b; 84:56 - 69。
段锐,南俊,梁玉华,毛平,卢亮,李磊,等。高分辨率的晶体结构揭示了DNA的结合机制拟南芥WRKY1蛋白质。核酸决议2007;35:1145-54。
转录因子WRKY62在水稻病原防御和缺氧反应基因表达中起作用。植物细胞物理学报2016;57:2541-51。
Gallego-Giraldo L, Shadle G, Shen H, Barros-Rios J, Fresquet Corrales S, Wang H,等。结合提高生物量密度和降低木质素水平来提高饲料品质。植物生物技术学报,2016;14:895-904。
高鑫,陈鑫,林伟,陈硕,吕东,牛勇,等。分岔的拟南芥NLR免疫信号通路通过Ca2 +端依赖蛋白激酶。公共科学图书馆Pathog。2013;9:e1003127。
WRKY40的动态亚核再定位,aba依赖性转录因子调控的一种潜在新机制。植物信号行为学报2015;10:e1106659。
Grunewald W, De Smet I, Lewis DR, Lofke C, Jansen L, Goeminne G,等。转录因子WRKY23协助植物生长素的分布模式拟南芥通过局部控制黄酮醇生物合成根的发育。中国科学:地球科学,2012;39(4):447 - 447。
Grunewald W, Karimi M, Wieczorek K, Van de Cappelle E, Wischnitzki E, Grundler F,等。AtWRKY23在植物寄生线虫取食位点建立中的作用。植物杂志。2008;148:358 - 68。
郭鹏,李铮,黄鹏,李斌,方硕,褚杰,等。由转录因子WRKY75、水杨酸和活性氧组成的三重扩增环加速了叶片的衰老。植物细胞。2017;29:2854 - 70。
韩敏,金采,李俊,李sk,全济士。OsWRKY42压制OsMT1d诱导活性氧和叶片衰老。摩尔细胞。2014;37:532-9。
Hartmann M, Zeier T, Bernsdorff F, Reichel-Deland V, Kim D, Hohmann M,等。黄素单加氧酶产生的n -羟基酚酸是植物系统免疫的重要成分。细胞。2018;173:456 - 69。
Hori K, Maruyama F, Fujisawa T, Togashi T, Yamamoto N, Seo M,等。Klebsormidium flaccidum基因组揭示植物陆地适应的主要因素。Nat Commun。2014;5:3978。
胡林,吴勇,吴东,饶伟,郭军,马勇,等。水稻褐飞虱抗性14的卷曲卷曲结构域和核苷酸结合结构域在水稻褐飞虱的信号传递和抗性中起作用。植物细胞。2017;29:3157 - 85。
胡丽,叶敏,李锐,张涛,周刚,王强,等。水稻转录因子WRKY53通过作为丝裂原激活蛋白激酶活性的负反馈调节剂来抑制草食动物诱导的防御。植物杂志。2015;169:2907-21。
胡勇,董强,于东。拟南芥WRKY46与WRKY70和WRKY53协同抗病原体基础抗性两.植物科学。2012;185 - 186:288 - 97。
黄福军,李娟,李锐,叶敏,蒯萍,张涛,等。转录因子OsWRKY45负向调节水稻对褐飞虱的抗性摘要研究选择性.国际分子科学杂志2016;17:697。
侯赛因RMF, Sheikh AH,海德尔一世,Quareshy M, Linthorst HJM。拟南芥WRKY50与TGA转录因子协同激活PR1.植物科学进展2018;9:930。
井上H, N Hayashi, Matsushita,新琼L,中山A, Sugano S,等。CC-NB-LRR蛋白Pb1的Blast抗性是由WRKY45通过蛋白-蛋白相互作用介导的。中国生物医学工程学报2013;38(3):447 - 447。
编码一种新的dna结合蛋白SPF1的cDNA的表征,该蛋白可识别甘薯中编码孢粉酶和-淀粉酶基因5 '上游区域的SP8序列。Mol Gen Genet 1994; 244:563-71。
石滨N,山田R,吉冈M,加头S,吉冈h烟草benthamianaWRKY8转录因子受MAPK影响在防御反应中起作用。植物细胞。2011;23:1153 - 70。
Jalmi SK, Sinha AK。丝裂原激活蛋白激酶模块OsMKK3-OsMPK7-OsWRK30在介导抗黄oryzae在大米。Sci众议员2016;6:37974。
蒋超,沈庆军,王斌,何斌,肖松,陈磊,等。转录组分析WRKY基因家族在选用officinalisWall ex Watt和WRKY参与反应的基因黄oryzaepv。oryzae压力。《公共科学图书馆•综合》。2017 b; 12: e0188742。
蒋军,马松,叶楠,蒋敏,曹军,张军。WRKY转录因子在植物逆境响应中的作用。植物生物学杂志,2017a; 59:86-101。
琼斯JD,丹格尔JL。植物免疫系统。大自然。2006;444:323-9。
小麦QTL-2DL中TaWRKY70转录因子调控下游代谢物生物合成基因抵抗镰刀菌素graminearum感染在穗内传播。Sci众议员2017;7:42596。
Lal NK, Nagalakshmi U, Hurlburt NK, Flores R, Bak A, Sone P,等。受体样细胞质激酶BIK1定位于细胞核,在植物固有免疫过程中调节防御激素的表达。细胞宿主微生物。2018;23:485-97。
Le Roux C, Huet G, Jauneau A, Camborde L, Tremousaygue D, Kraut A,等。与整合诱饵配对的受体可将病原体致残的转录因子转化为免疫。细胞。2015;161:1074 - 88。
李宏,车杰,崔超,崔宁,池宏,朴SR,等。WRKY11在水稻抗病和抗旱性中发挥作用。大米。2018;十一5。
毛李G,孟X,王R, G,汉族L,刘Y, et al。乙烯诱导过程中MPK3/MPK6级联及其下游WRKY转录因子对ACC合成酶活性的双水平调控拟南芥.公共科学图书馆麝猫。2012;8:e1002767。
李广广,王志强,横正K,丁乙,范伟,龚QQ,等。转录因子WRKY22通过活化促进铝耐受性OsFRDL4水稻中柠檬酸分泌的表达与增强(栽培稻).新植醇。2018;219:149 - 62。
李娟,钟瑞,Palva等。WRKY70及其同源物WRKY54负向调节坏死性病原体的细胞壁相关防御拟南芥.《公共科学图书馆•综合》。2017;12:e0183731。
李锐,张军,李军,周刚,王强,边伟,等。通过WRKY调节,植物防御优先于生长,有利于非目标食草动物的侵扰。eLife。2015; 4: e04805。
梁霞,陈霞,李晨,范杰,郭铮。干扰防御的代谢和转录变化OsWRKY62而且OsWRKY76在水稻转录。Sci众议员2017;7:2474。
刘杰,陈旭,梁旭,周旭,杨峰,刘杰,等。水稻的替代剪接WRKY62而且WRKY76病原体防御中的转录因子基因。植物杂志。2016;171:1427-42。
刘s,克拉切B,齐格勒J,波肯比尔RP, somsich IE。WRKY33对ABA信号的负调控是重要的拟南芥免疫对葡萄孢菌2100.eLife。2015; 4: e07295。
刘志强,闫亮,吴铮,梅超,陆凯,余玉涛,等。WRKY18、WRKY40和WRKY60三个wrky域转录因子在抑制两个aba响应基因中的协同作用ABI4而且ABI5在拟南芥.J Exp Bot 2012; 63:6371-92。
马勇,郭华,华磊,马丁内斯PP, Moschou PN, Cevik V,等。不同的减压模式拟南芥免疫受体复合体由两种不同的细菌效应器组成。中国生物医学工程学报2018;15:10218 - 27。
王晓燕,王晓燕,王晓燕,等。诱导反应型WRKY转录因子结合位点的鉴定独联体序列从拟南芥.植物分子生物学,2014;84:371-85。
Maeo K, Hayashi S, Kojima-Suzuki H, Morikami A, Nakamura K. WRKY结构域保守残基在烟草WRKY家族蛋白dna结合中的作用。生物技术与生物化学,2001;65:2428-36。
毛刚,刘勇,郑铮,陈铮,张珊。WRKY转录因子被两个病原体响应MAPKs磷酸化,促进植物抗毒素的生物合成拟南芥.植物细胞。2011;23:1639-53。
苗颖,兰tm, Smykowski A, Zentgraf U。拟南芥MEKK1可以走一条捷径:它可以在蛋白质水平上直接与衰老相关的WRKY53转录因子相互作用,并与其启动子结合。植物分子生物学,2007;65:63-76。
Mishra S, Triptahi V, Singh S, Phukan UJ, Gupta MM, Shanker K,等。伤口诱导的苯基异喹啉通路的转录调控和伤口诱导的PsWRKY转录因子的表征果实.《公共科学图书馆•综合》。2013;8:e52784。
Mohanta TK, Park YH, Bae h。植物谱系中WRKY转录因子的基因组和进化的新见解。Sci众议员2016;6:37309。
宁鹏,刘超,康健,吕杰。小麦WRKY转录因子全基因组分析(小麦L.)和水分亏缺条件下的差异表达。PeerJ。2017; 5: e3232。
吕志勇,伊藤田,关木M,中下H,吉田S,马可Y,等。蛋白WRKY结构域的一个单氨基酸插入拟南芥tir - nbs - lrr - wrky型抗病蛋白SLH1(对低湿度敏感1)会激活防御反应和超敏细胞死亡。植物j . 2005; 43:873 - 88。
O 'Malley RC, Huang SC, Lewsey MG, Bartlett A, Nery JR,等。源层和外源层的特征形成了调控DNA的格局。细胞。2016;165:1280 - 92。
吴sk,白赫,Park JM, Yi SY, Yu shh, Kamoun S,等。甜椒WRKY蛋白CaWRKY1是病原体防御的负调控因子。新植醇。2008;177:977 - 89。
帕帕佐普洛K,梅尔顿RE,莱格特M,丹尼尔斯MJ,奥斯本AE。缺乏皂苷的植物的抗病性降低。美国科学与技术研究所1999;96:12923-8。
Park CJ, Ronald PC。水稻XA21免疫受体的裂解和核定位。Nat Commun。2012;3:920。
彭旭,王浩,张锦江,肖涛,何浩,江东,等。OsWRKY80-OsWRKY4模块作为水稻抗性的正向调节电路辣椒.大米。2016;9:63。
Peng Y, Bartley LE, Chen X, Dardick C, Chern M,阮锐,等。OsWRKY62是一种负性的基础和调节因子Xa21介导的防御黄oryzaepv。oryzae在大米。摩尔。2008;1:446-58。
Phukan UJ, Jeena GS, Shukla RK。WRKY转录因子:植物的分子调控与胁迫响应。植物科学,2016;7:760。
邱建林,Fiil BK, Petersen K, Nielsen HB, Botanga CJ, Thorgrimsen S,等。拟南芥MAP激酶4通过核内转录因子的释放调节基因表达。EMBO j . 2008; 27:2214-21。
Rensing SA, Lang D, Zimmer AD, Terry A, Salamov A, Shapiro H,等。的Physcomitrella基因组揭示了植物征服土地的进化洞见。科学。2008;319:64-9。
大米WRKY工作组。水稻WRKY -基因命名冲突及其解决方法的命名报告。大米。2012;5:3。
Rinerson CI, Rabara RC, Tripathi P, Shen QJ, Rushton PJ。WRKY转录因子的进化。BMC Plant Biol. 2015;15:66。
Rushton PJ, Macdonald H, Huttly AK, Lazarus CM, Hooley R.一个新的dna结合蛋白家族的成员与一个保守的独联体的启动子中的-元素alpha-Amy2基因。植物分子生物学,1995;29:691-702。
Sarris PF, Duxbury Z, Huh SU, Ma Y, Segonzac C, Sklenar J,等。植物免疫受体检测以WRKY转录因子为靶点的病原体效应子。细胞。2015;161:1089 - 100。
Scarpeci TE, Zanor MI, muller - roeber B, Valle EM.过表达AtWRKY30增强生长早期对非生物胁迫的耐受力拟南芥.植物生物学杂志,2013;83:265-77。
王晓东,王晓东。WRKY转录因子对特化代谢的调控作用。植物杂志。2015;167:295 - 306。
Schön M, Toller A, Diezel C, Roth C, Westphal L, Wiermer M,等。分析wrky18 wrky40植物揭示了SA/EDS1信号通路和吲哚-硫代葡萄糖苷生物合成的重要作用Golovinomyces orontii阻力和阻力的损失两pv。番茄AvrRPS4。植物与微生物的相互作用。2013;26:758-67。
Sheikh AH, Eschen-Lippold L, Pecher P, Hoehenwarter W, Sinha AK, Scheel D,等。有丝分裂原激活蛋白激酶对WRKY46转录因子功能的调控拟南芥.植物科学,2016;7:61。
沈辉,刘超,张颖,孟X,周旭,褚超,等。OsWRKY30被MAP激酶激活,使水稻具有耐旱性。植物生物学杂志,2012;80:241-53。
沈qh, Saijo Y, Mauch S, Biskup C, Bieri S, Keller B,等。MLA免疫受体的核活性连接孤立特异性和基础抗病反应。科学。2007;315:1098 - 103。
下野明,古贺贺华,赤木明,林林,后藤明,泽田明,等。水稻WRKY45在抗真菌和细菌病害方面发挥着重要作用。植物病理学杂志2012;13:83-94。
下野M,杉野S,中山A,江cj,小野K,户木S,等。WRKY45在苯并噻二唑诱导的稻瘟病抗性中起着至关重要的作用。植物细胞。2007;19:2064 - 76。
宋宏,孙伟,杨刚,孙杰。豆科植物WRKY转录因子的研究。BMC Plant Biol 2018; 18:43。
Souza CA, Li S, Lin AZ, Boutrot F, Grossmann G, Zipfel C,等。纤维素衍生的低聚物作为损伤相关的分子模式并触发防御反应。植物杂志。2017;173:2383 - 98。
孙CX, Palmqvist S, Olsson H, Borén M, Ahlandsberg S, Jansson C.一种新的WRKY转录因子SUSIBA2,通过与大麦中的糖响应元件结合,参与大麦中的糖信号传递iso1启动子。植物细胞。2003;15:2076 - 92。
Suttipanta N, Pattanaik S, Kulshrestha M, Patra B, Singh SK, Yuan L.转录因子CrWRKY1正向调控萜类吲哚生物碱的生物合成Catharanthus roseus也叫.植物杂志。2011;157:2081 - 93。
田鑫,李鑫,周伟,任勇,王铮,刘铮,等。转录因子OsWRKY53正向调控油菜素内酯信号通路和植物结构。植物杂志。2017;175:1337-49。
上野阳,吉田R,岸史-卡波斯M,松下A,蒋cj,后藤S,等。MAP激酶磷酸化水稻WRKY45。植物信号行为学报,2013;8:e24510。
上野阳,吉田R,岸史-卡波斯M,松下A,蒋cj,后藤S,等。非生物胁迫通过OsMPK6的酪氨酸去磷酸化拮抗水稻防御途径。公共科学图书馆Pathog。2015;11:e1005231。
van Verk MC, Pappaioannou D, Neeleman L, Bol JF, Linthorst HJ。需要一种新的WRKY转录因子来诱导PR-1a水杨酸和细菌激发子的基因表达。植物杂志。2008;146:1983 - 95。
VanEtten HD, Mansfield JW, Bailey JA, Farmer EE。两类植物抗生素:植物抗菌素和“植物素”。植物细胞。1994;6:1191-2。
Veronese P, Nakagami H, Bluhm B, Abuqamar S, Chen X, Salmeron J,等。的membrane-anchoredBOTRYTIS-INDUCED KINASE1扮演着不同的角色拟南芥抗坏死性和生物营养性病原体。植物细胞。2006;18:257 - 73。
王宏,Avci U, Nakashima J, Hahn MG,陈芳,Dixon RA。在双子叶植物中,WRKY转录因子的突变启动了髓次生壁的形成并增加了茎的生物量。中国科学(d辑:自然科学版)2010;
王辉,郝杰,陈旭,郝震,王旭,娄烨,等。过度的大米WRKY89增强水稻植株对紫外线B的耐受性和抗病能力。植物分子生物学2007;65:799-815。
王辉,孟J,彭旭,唐旭,周平,向杰,等。水稻WRKY4作为一种转录激活因子介导防御反应辣椒是水稻纹枯病的致病源。植物生物学杂志2015;89:157-71。
王杰,陶峰,安峰,邹勇,田伟,陈曦,等。小麦转录因子TaWRKY70是否与高温幼苗植物抗柄锈菌striiformisf . sp。tritici.植物病理学杂志2017;18:649-61。
王颖,Schuck S,吴娟,杨萍,Doring AC, Zeier J,等。MPK3/6-WRKY33-ALD1-Pipecolic acid调控环有助于系统性获得性耐药。植物细胞。2018;30:2480 - 94。
吴KL、郭ZJ王HH,李j .大米和WRKY转录因子家族拟南芥和他们的起源。DNA研究》2005;12:9-26。
肖军,程红,李旭,肖军,徐超,王珊。水稻WRKY13通过选择性结合不同的WRKY13调控非生物胁迫和生物胁迫信号通路之间的交叉信号独联体元素。植物杂志。2013;163:1868 - 82。
谢坤,陈娟,王强,杨勇。钙依赖性蛋白激酶对水稻丝裂原活化蛋白激酶的直接磷酸化和活化作用。植物细胞。2014;26:3077 - 89。
谢涛,陈超,李超,刘杰,刘超,何勇WRKY菠萝基因家族:发育和胁迫过程中的进化和表达谱。BMC基因组学。2018;19:490。
谢铮,张志林,邹旭,黄杰,Ruas P, Thompson D,等。水稻的注释与功能分析WRKY基因超家族揭示了糊粉细胞脱落酸信号的阳性和阴性调控因子。植物杂志。2005;137:176 - 89。
徐辉,渡边佳,张磊,沈启军。野生水稻WRKY转录因子基因选用nivara.DNA研究》2016;23:311-23。
徐曦,陈超,范斌,陈卓拟南芥WRKY18, WRKY40和WRKY60转录因子。植物细胞。2006;18:1310-26。
山崎明,基川明,渡边明,井上明,山崎明,关明,等。序列特异性DNA识别的结构基础拟南芥WRKY转录因子。生物化学杂志2012;287:7683-91。
闫建勇,李春霞,孙磊,任建勇,李光新,丁志军,等。WRKY转录因子调节缺铁状态下的铁易位。植物杂志。2016;171:2017-27。
杨勇,周勇,迟勇,范斌,陈卓。大豆的性状分析WRKY大豆基因家族及其鉴定WRKY促进大豆囊线虫抗性的基因。Sci众议员2017;7:17804。
姚启勇,夏恩华,刘芳华,高丽珍。全基因组鉴定和表达比较分析表明,大白菜WRKY基因家族中复制基因的快速扩增和功能分化。芸苔属植物oleraceavar。性的.基因。2015;557:35-42。
横谷N,佐藤Y,田边S, Chujo T,清水T,冈田K,等。WRKY76是一种水稻转录抑制因子,在稻瘟病抗性和耐冷胁迫方面起相反作用。J Exp Bot 2013; 64:5085-97。
张超,刘杰,赵涛,Gomez A,李超,于超,等。一种干旱诱导的转录因子延缓了水稻的繁殖时间。植物杂志。2016;171:334-43。
张丽,陈丽,于东。转录因子WRKY75与DELLA蛋白相互作用影响开花。植物杂志。2018;176:790 - 803。
张颖,王磊。WRKY转录因子超家族:在真核生物中的起源和在植物中的扩展。生物学报2005;5:1。
周明,陆Y, Bethke G, Harrison BT, Hatsugai N, Katagiri F,等。WRKY70通过直接抑制植物免疫的无菌激活SARD1.新植醇。2018;217:700-12。
周启勇,田银,邹洪峰,谢志明,雷刚,黄杰,等。大豆wrky型转录因子基因GmWRKY13,GmWRKY21,GmWRKY54,在转基因中对非生物胁迫具有不同的耐受性拟南芥植物。植物工程学报。2008;6:486-503。
确认
我们要感谢匿名审稿人为本文所做的工作。
资金
国家自然科学基金项目(31571947和31171833)资助。
数据和材料的可用性
不适用。
作者信息
作者和联系
贡献
XC和ZG撰写了手稿。CL, HW和ZG画了图。所有作者阅读并批准了最终稿件。
相应的作者
道德声明
伦理批准和同意参与
不适用。
同意出版
不适用。
相互竞争的利益
作者声明他们没有竞争利益。
额外的文件
额外的文件1:
表S1。WRKY36种植物的家族基因。(多克斯27 kb)
权利和权限
开放获取本文根据创作共用署名4.0国际许可协议发布(http://creativecommons.org/licenses/by/4.0/),该协议允许在任何媒体上不受限制地使用、分发和复制,前提是您适当地注明原作者和来源,提供创作共用许可的链接,并说明是否有更改。创作共用公共领域奉献放弃书(http://creativecommons.org/publicdomain/zero/1.0/)除另有说明外,适用于本条提供的资料。
关于这篇文章
引用这篇文章
陈晓霞,李晨,王慧慧。et al。WRKY转录因子:进化、结合和作用。Phytopathol Res113(2019)。https://doi.org/10.1186/s42483-019-0022-x
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s42483-019-0022-x
关键字
- 独联体元绑定
- 进化
- 新陈代谢
- 植物免疫
- 蛋白质磷酸化
- WRKY转录因子