摘要
在过去十年中,由欧盟(EU)资助的项目生成的几个数据库中,纳米基因毒理学领域的出版物数量和关于纳米材料(NMs)的遗传毒性数据量有所增加。与此同时,大量的研究工作促进了我们对NM表征的关键物理化学(PC)参数的理解,以及最初为可溶性化学品设计的毒理学分析的局限性。因此,越来越明显的是,从监管的角度来看,并非所有这些数据都是可靠的或相关的。本系统综述的目的是调查根据现行标准可被认为可靠和相关的NMs遗传毒性研究的程度,并从监管的角度关注需要什么才能使研究有用。由于现有的研究数量众多,我们选择将搜索范围限制在两大组,这两大组近年来引起了人们的极大兴趣:纳米纤维(包括纳米管)和含金属纳米颗粒.以同行评审的出版物为重点,我们根据EU FP-7 GUIDEnano项目开发的质量评估方法,评估了被测试NMs的PC表征、模型系统文档、研究设计和结果的完整性。此外,基于最近发表的纳米基因毒理学研究最佳实践建议,我们创建了一套用于风险评估目的的分析特异性可靠性和相关性的标准。然后回顾文章,讨论合格的出版物,并强调NM基因毒性研究中最常见的缺陷。此外,FP7和H2020框架下的几个欧盟项目设定了目标,将它们产生的信息集体输入eNanoMapper数据库。因此,多年来,eNanoMapper数据库已经根据输入时的现有知识扩展了各种质量的数据。这些活动是高度相关的,因为负面结果往往不发表。在这里,我们回顾了eNanoMapper数据库下的NanoInformaTIX实例,该数据库承载了来自九个欧盟计划的数据。我们从监管的角度评估了每个实验条目的数据质量和使用数据的可行性。
背景
纳米材料(NMs)是指至少有一个尺寸尺寸在1到100纳米之间的材料[1].由于尺寸减小和相应的表面积增加,NMs具有适合许多工业应用的独特性质,然而,这也引起了人们对其不良健康影响的关注[2,3.].因此,纳米材料——尤其是金属、金属氧化物和纳米纤维——因其安全性而得到了广泛的研究[2,4].
与NMs安全性相关的一个重要问题是其产生遗传损伤的能力[3.,5].未修复的基因毒性事件可导致遗传物质的永久性变化(即突变),如果发生在关键基因中,可能导致癌症[6].因此,每一种诱变原都被认为具有潜在致癌性[3.].由于对人类健康的重要后果,致突变性是所有产品法规中要求的危险端点,因此,在大多数为NMs开发的测试策略中,致突变性是一个关键端点[5,7,8,9,10].
21世纪发表的纳米基因毒理学研究论文数量稳步上升[11].与此同时,在几个项目(例如,欧盟项目)中产生了大量与纳米毒性相关的数据。然而,出于监管目的,这些数据只有在公布时才能检索,而负面结果通常不是这样。不幸的是,从出版物中手动检索和审查信息非常耗时,这阻碍了数据的重用。例如,最近消费者安全科学委员会(SCCS)关于化妆品中NMs的意见无法解决关于使用SiO的结论2由于缺乏资料[12];然而,在eNanoMapper数据库下进行快速搜索,可以找到至少200个与该物质毒性有关的条目。因此,目前尚不清楚利益相关者是否不了解数据库,数据库搜索是否过于耗时,或者从监管角度来看,这些数据库中提供的信息是否毫无用处。
与此同时,大量的研究工作促进了我们对NM表征的关键物理化学(PC)参数的理解,以及最初为可溶性化学品设计的毒理学分析的局限性[5,13,14].因此,越来越明显的是,从监管的角度来看,并非所有生成的信息都是可靠的或相关的;也就是说,它可以提供证据,证明研究结果的清晰性和合理性,以及数据和测试在何种程度上适合于危险特征描述[15].
为了利用现有的毒理学数据,已经制定了纳米毒理学研究的质量评估方法和最佳实践建议,例如,在欧盟FP-7 GUIDEnano [5,16]及H2020 caLIBRAte项目[17],并由国际生命科学研究所(ILSI)健康与环境科学研究所(HESI)遗传毒理学技术委员会(GTTC) [13].基于这些研究方法,目前缺少一个关键方面:了解获得的信息如何适合监管方法。
因此,本系统综述的目的是调查在当前标准下可被认为可靠和相关的关于NMs遗传毒性的研究和数据的程度,并从监管的角度关注需要什么才能使研究有用。根据GUIDEnano质量评估方法,对同行评审的出版物进行了测试NMs的PC表征的完整性和研究的可靠性评估。此外,这些研究的相关性通过一套测定特异性标准进行了评估,这些标准是在最近发表的纳米基因毒理学研究最佳实践建议的基础上创建的。同时,对NanoInformaTIX实例检索到的基因毒性数据进行了类似的评估,主要关注有关数据质量的监管需求。讨论了合格的出版物,并根据发现的最常见缺陷提出了未来的研究需求。
文献检索
在PubMed和Scopus上对NMs遗传毒性的同行评议研究出版物进行了搜索,范围在2009年至2019年之间。我们重点研究了两大类NMs -纳米纤维(包括纳米管)和含金属纳米颗粒(NPs),与其他NMs相比,它们在文献和数据库中有更多关于遗传毒性潜力的可用信息。对每组NMs分别进行搜索。在每种材料类型中,分别进行了体外和体内研究。
根据表中所列的纳入标准,发表的文章仅限于经过验证的分析1,其中还描述了用于纳米纤维和含金属NPs的搜索词。细菌基因突变分析被省略,因为由于粒子摄取有限,它们通常对NMs没有信息[18].体外单细胞凝胶电泳(comet)检测未包括在内,因为在缺乏指导方针和标准化的情况下,方案有相当大的差异,并且溶解后NM干扰DNA可能导致假阳性结果[19].另一方面,体内研究接受了所有暴露途径。由于预计通过吸入进行的研究很少,因此考虑了通过呼吸途径的其他给药方法- (oro)咽吸或气管内灌注,因为据报道这些方法是评估NM暴露的肺部结果的可靠方法[20.,21].
根据摘要确认了每次检索所产生的出版物的适用性。体外研究的检索词产生了许多体内研究,但未被体内检索覆盖,反之亦然。这些研究被移到正确的主题下并纳入评估。出版物,其中包括体外和体内的工作,评估在两组对应的部分。
同行评审文献的质量评价
研究质量根据欧盟FP-7 GUIDEnano项目开发的方法进行评估[16].这种方法建立在以前的倡议基础上,主要是卡德和马格努松的倡议[22就人体毒性研究而言。GUIDEnano方法由两个与物质表征的完整性(S)和研究的可靠性(K)相关的评分组成。每个评分中包含的标准由Fernández Cruz等人早些时候发布.[16],在附加文件中转载1:表S1-S3。由于GUIDEnano方法的范围很广,因此需要补充额外的标准来评估每个给定环境和人类毒性终点的研究相关性。
基于GUIDEnano质量方法的评价
首先,应用S评分来筛选NM表征不完整的研究。S分数(附加文件1:表S1)涉及在考虑的研究中是否评估了NMs的最小一组关键PC属性(包括暴露介质中提供的和测量的)。在选定的参数中,有些被认为是强制性的属性(“红色问题”,例如化学成分、尺寸、形状和表面化学),如果不满足这些参数,则忽略该研究[16].此外,如果没有达到最低分数,研究也会被忽略。
对于包含多个NM的测试结果的研究,分别为每个NM确定S评分,并对具有可接受的材料表征的NMs进行进一步评估。
其次,采用K评分来评估具有可接受的NM特征的研究的可靠性。K分数(附加文件1:表S2和表S3)的设计是为了确定对模型系统和研究设计的充分描述、适当的结果文档和结果的合理性。不同的问题组被用于体外和体内研究,其中一些被确定为“红色问题”。评估后,该研究被分配到Klimisch等人建立的类别之一.[23: K1(无限制可靠)、K2(有限制可靠)或K3(不可靠)。没有通过后一类的研究,要么因为没有通过所有红色问题,要么因为没有达到最低分数,就不会被考虑进行进一步的评估。
基因毒性分析的特异性评价
除了应用GUIDEnano质量评估方法外,我们还通过创建一套处理分析特定细节的标准,进一步评估了用于检测NMs的基因毒性分析的相关性和局限性。这些标准是基于Doak等人提出的建议.[24, Pfuhler等人.[25, Elespuru等.[13], Catalán等.[5],以及相应的OECD测试指引[26,27,28,29,30.,31,32,33].
体外哺乳动物细胞遗传毒性试验的评价标准见表2.有些标准被认为是强制性的,因为它们在相应的OECD tg中已经被要求,因此被认为适用于NMs,或者因为有足够的证据表明它们与评估NMs的遗传毒性相关。在前者中,必须报告背景频率,因为过高的水平可能表明不适当的实验设置,阳性对照应产生统计上显著的增加,或应使用验证的参数进行同时的细胞毒性评估。后者包括要求细胞松弛素B (Cyt-B) -一种肌动蛋白聚合抑制剂,通常用于抑制细胞分裂并能够识别分裂细胞[34-在进行细胞分裂阻断微核(MN)测定时,应在开始暴露后不少于6小时添加。这样,就有可能确保细胞在缺乏Cyt-B的情况下暴露于NM一段时间,而Cyt-B可能会阻止细胞摄取NMs [35,36].但是,由于这一标准是为了避免出现假阴性结果而建立的,因此无论如何都可以接受阳性结果。
另一个强制性标准是治疗时间表。为了能够诱导原发性直接遗传毒性,NMs应被细胞内化并与遗传物质接触[3.].由于一些NMs不能通过核膜,在最理想的情况下,细胞应在NM存在的情况下完成至少一个细胞周期,以便在有丝分裂过程中核膜破裂时,内化的NMs可以直接与DNA接触[37,38].然而,这两项要求同样主要涉及阴性结果,而明确的阳性结果可被认为是相关的,无论细胞摄取的证据或足够的治疗时间。值得注意的是,关于治疗时间,当前OECD体外基因毒性测试指南可能不适用于NMs。在经合组织人造纳米材料工作组的框架下,目前正在对经合组织纳米材料测试指南进行调整和验证,例如,项目4.95:关于将体外哺乳动物细胞为基础的遗传毒性tg用于人造纳米材料测试的指导文件[39].
我们还建立了一套非强制性标准,用于收集可用于在个案基础上评估分析相关性的信息。这些标准不被认为是强制性的,因为它们在指南中没有要求,或者更难以应用于NMs。例如,OECD tg为低毒物质(未达到55±5%的细胞毒性极限)确定的最高测试浓度2 mg/ml通常被认为是NMs的过量。应避免导致广泛聚集的高浓度[40].此外,由于大量沉积的物质导致细胞窒息,可诱发人为的积极效应[41].然而,100µg/ml的低剂量上限[40]或200µg/ml (EU NANoREG项目)是最近才提出的,这也取决于每种特定材料的分散性和稳定性。因此,我们决定设置一个250微克/毫升的限制,可以适合大多数人。
哺乳动物体内基因毒性试验的评价标准列于表中3..和以前一样,制定了强制性和非强制性标准。在前者中,包括适当的细胞毒性参数或包括足够数量的细胞以达到可接受的敏感性,根据相应的OECD指南的最新版本[30.,31,32],是必需的。然而,如果MN和染色体畸变(CA)试验结果明显阳性,阴性对照在正常范围内,也应遵守相同指南的先前版本(分别为OECD TG 473和474)[42,43被认为是可以接受的。
NMs的体内评估最关键的问题是处理计划,以确保足够数量的物质到达目标组织,并在样本收集时发挥作用[5,25].评估所有体内试验的治疗计划和采样时间,考虑到结果和可用的生物分布数据,对计划不充分的试验进行逐个评估。虽然经合组织指南中描述了在不同暴露情景下进行采样的正确时间窗口,但某些NMs在目标组织中积累可能需要更长的时间,因此最佳时间窗口可能比指南中描述的时间更晚[5,24,25].然而,如果没有生物分布数据表明该物质实际上已经积累,并且具有生物持久性,那么比推荐时间晚几天或几个月收集的样品的阴性结果是没有意义的。无论治疗方案是否合理,均接受阳性结果。
作为非强制性标准,生物分布数据的可用性被评估,以确定NM在遗传毒性试验中测量的目标组织的程度。在评估阴性测试结果的相关性时,这一点尤其重要。尽管该标准具有相关性,但该标准被认为是非强制性的,因为为适应NMs而制定的新TG(或现有TG 417关于毒物动力学的修订)目前正在进行中[39].
文献质量评价结果
监管风险评估相关出版物概述
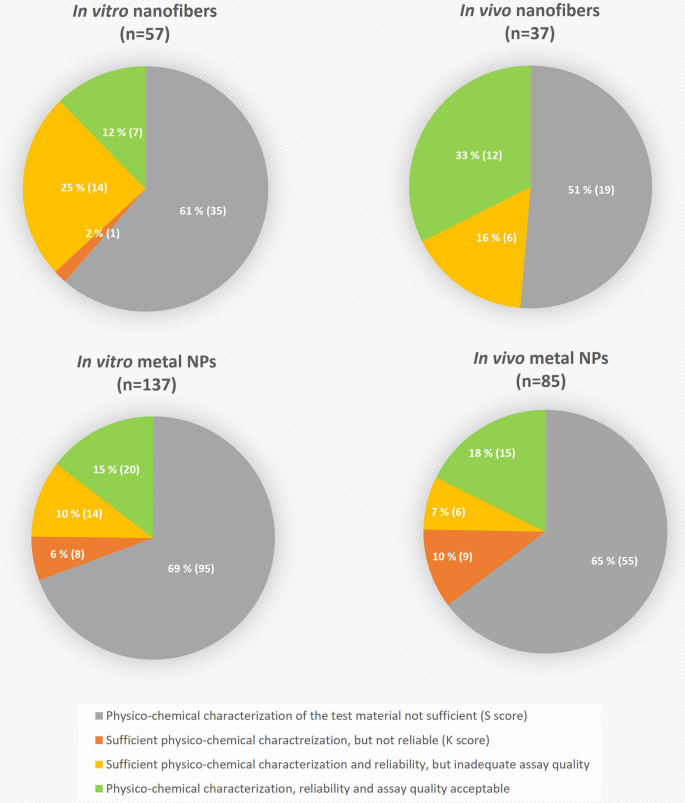
在原始的468和152篇含金属NPs和纳米纤维的文献搜索结果中,分别约有52%(246)和38%(58)被排除在外,因为该研究不在本综述的范围内,无法获得全文访问,或者结果已经被其他搜索词覆盖。最终在137项含金属NPs的体外研究和85项含金属NPs的体内研究以及57项纳米纤维的体外研究和37项纳米纤维的体内研究中评估了物质(S)评分,这符合本综述的范围。
在质量评估的每个步骤中评估的纳米纤维或含金属NPs的研究数量如图所示。1.在所有组中,到目前为止,由于被测NM的不完整PC表征(S评分)而被拒绝的研究数量最多。对于含金属的NPs,研究的比例略大(i为69%和65%n体外与纳米纤维(分别为61%和51%)相比,在此基础上被拒绝。根据GUIDEnano可靠性评价(K评分),含金属NPs的体外和体内研究分别有6%和10%被认为是不可靠的,而除一项(2%)纳米纤维研究外,其余研究都被认为是可靠的。这种差异可能是由于纳米纤维的出版物数量少得多,但由于对每种纳米类型的评估是由不同的评估人员进行的,因此不能完全排除对评估标准的主观解释。对于含金属NPs和纳米纤维,通过所有评估阶段的体外研究比例相似,分别为15%和12%。在体内研究中,18%的含金属NPs和33%的纳米纤维最终被接受。
基于GUIDEnano质量方法的质量评价结果
S评分是最具限制性的评价步骤(图。1).对于含金属的NPs和纳米纤维,分别只有31%和39%的体外研究和35%和49%的体内研究具有可接受的纳米特性。这些资料可以从出版物本身或其他明确指出的来源获得。未能达到可接受物质特征的主要原因是未能达到至少一个“红色问题”(强制性标准),较少的原因是未能达到评分所要求的最低分数。对于含金属的NPs和纳米纤维,分别高达65%和28%的体外研究和58%和29%的体内研究不通过至少一个红色问题。这与Fernández-Cruz等人的研究结果一致.[16],他发现在GUIDEnano方法开发过程中评估的毒性研究的主要弱点是对所测试的NMs特性描述不足。
物质表征中最常见的缺陷是未能提供NM的纯度和暴露期间的尺寸分布,这也与GUIDEnano的评价一致[16].在许多在本次评估中获得可接受的S分的论文中,可以从供应商的网站上找到识别良好的商业NM的纯度。这在评估中被认为是可以接受的,尽管应该注意的是,随着时间的推移,网站上的信息往往不可用,而且通常需要相当详细的信息(例如,产品和批号)才能从供应商的网站上识别准确的产品。不通过这个问题的其他原因包括以前发表的特征数据被错误引用或以前的出版物无法从典型来源获得。与含金属的NPs相比,纳米纤维的纯度是一个更容易获得的标准。碳纳米管(CNTs)的特性从根本上与它们的碳纯度有关,并且是其已发表的PC特征集的一个极其常见的特征。纯度的问题在鉴别时变得特别相关.,除了NM400中金属杂质含量较高外,NM401和NM400非常相似,这是催化剂的伪影。尽管如此,强烈建议提供以前出版物、物质供应商网站提供的材料特性摘要,或与基因毒性测试结果在同一出版物中的分析证明。
关于曝光过程中大小分布的评估,动态光散射(DLS)是最常用的表征曝光介质中NPs的方法之一。然而,对于非球形材料,它可能给出不准确的尺寸分布。透射电子显微镜(TEM)是一种更适合于精确测量纳米纤维粒径的方法,尽管它不能很好地估计样品中的尺寸分布。在某些情况下,介质中的颗粒大小随浓度而变化[44].虽然S评分不要求测量所有测试剂量下暴露介质的粒径,也不作为我们评估的标准,但与剂量相关的粒径可能有助于更好地解释结果。
我们遇到的另一个红色问题与主要粒子的形状有关,这对于含金属的NPs来说并不总是很好地描述。理想情况下,这些信息应该清楚地给出,对于球形或非晶态NMs也是如此。然而,在这次评估中,我们接受了TEM图像作为粒子形状的证据。
在评估了材料表征的完整性后,共对64项体外研究(分别是42项和22项含金属NPs和纳米纤维出版物)和48项体内研究(分别是30项和18项含金属NPs和纳米纤维出版物)的质量进行了进一步评估。
研究的可靠性通过K评分进行评估(图2)。1).对于纳米纤维,只有一项体外研究被认为是不可靠的,因为它至少没有达到一项基本标准。在含金属NPs的情况下,大多数具有完整材料表征的研究(81%在体外和74%在体内)也被认为是可靠的。在所有情况下,至少有一个“红色问题”不及格是未能通过K分的原因。在体外研究中,最常见的缺点是未能清楚地描述测试系统的来源,以及研究终点和方法。在体内研究中,最关键的缺点是缺乏阳性对照。我们的发现与Fernández-Cruz等人的发现一致.[16他们的结论是,一般来说,同行评议的出版物符合K评分中包含的大部分问题。然而,如前所述,对于材料表征和方法描述,通常不建议参考可能随时间变化或变得不可用的来源。相反,所有相关细节应与基因毒性数据在同一出版物中引用,以确保可获得性。
分析特异性评价结果
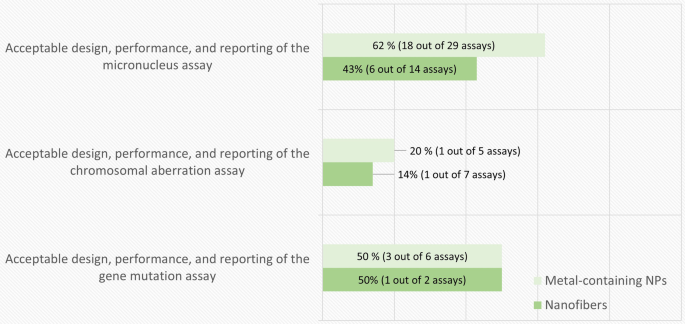
在基于K评分的评估中,共有55项体外研究(分别是34项和21项含金属NPs和纳米纤维出版物)和39项体内研究(分别是21项和18项含金属NPs和纳米纤维出版物)被认为是可靠的。这些研究根据表中详细的分析标准进行了进一步评估2而且3..
体外实验
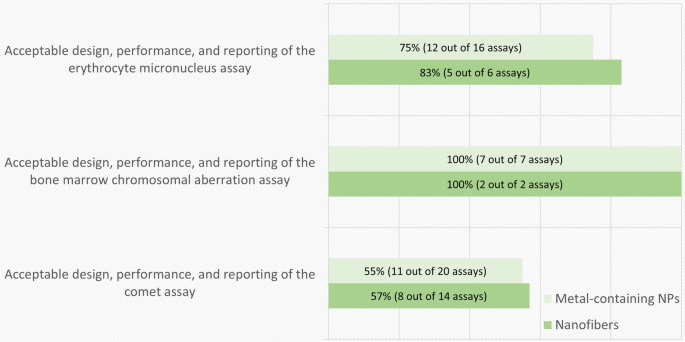
在55篇体外研究论文中,含金属NPs的MN、CA和基因突变检测分别为29、5和6例,纳米纤维的MN、CA和基因突变检测分别为14、7和2例。在一些出版物中,使用了一种以上的化验方法。数字2总结了成功满足表中所列分析特定标准的研究的比例2.用MN和基因突变测定法进行的研究中约有一半符合标准。然而,当使用CA法时,这一比例要低得多。
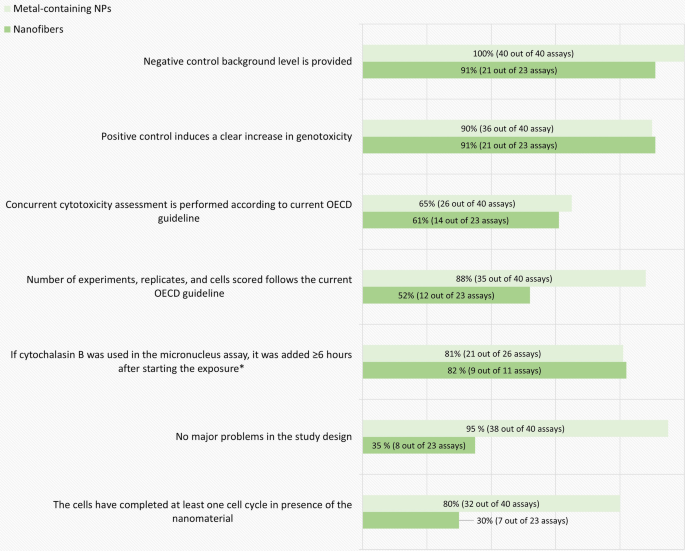
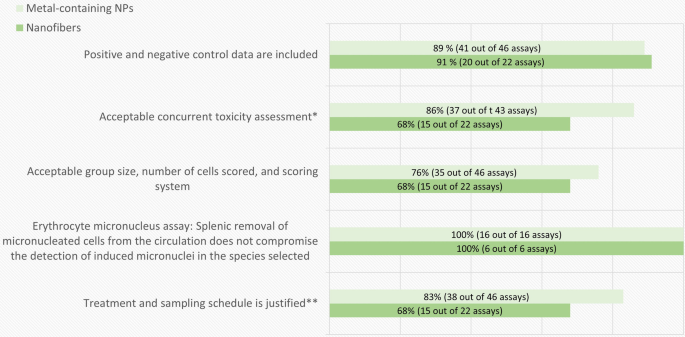
根据强制性标准,体外试验质量评价结果的细目如图所示。3..导致体外遗传毒性试验排除的所有类型材料的最常见缺陷是缺乏或不充分的同步细胞毒性测量。此外,与含金属NPs的研究相比,纳米纤维的研究在处理计划、研究设计和遵守经合组织指南建议的样本量或重复或实验数量方面存在明显的缺陷。
同时进行细胞毒性测定的目的是确定基因毒性分析的相关剂量范围。根据经合组织准则,至少应进行三次(锰和钙测定)或四次(基因突变测定)剂量的试验,试验浓度应达到最高,锰和钙测定的目标是细胞毒性达到50-60%,基因突变测定的目标是存活率达到10-20%(表中的标准9、15和21)2).毒性浓度过高的基因毒性分析可能导致假阳性结果[5,24].另一方面,只测试毒性过低的剂量可能会阻止或低估对NMs基因毒性潜力的检测[5,45,46].需要同时进行基于细胞增殖的推荐细胞毒性参数的细胞毒性评估(如表中的标准6、13和19所述)2).在测试NMs时,在同一实验中评估细胞毒性与遗传毒性预测因子尤其重要,因为其中一些NMs在分散体之间表现出较差的重复性。
治疗计划可以被认为明显不足以分别在20%和高达70%的含金属NPs和纳米纤维的评估基因毒性试验中检测直接遗传毒性(图。3.).更大比例的研究没有描述相对于细胞周期的暴露时间,也没有包括所选模型系统中细胞周期长度的任何信息。在本评估中,如果治疗时间在正常的平均细胞周期长度(15-24小时)范围内,则认为治疗时间是可接受的。然而,如果结果明显为阳性,无论治疗时间是否不足,专家判断也可以认为测试结果是可接受的。
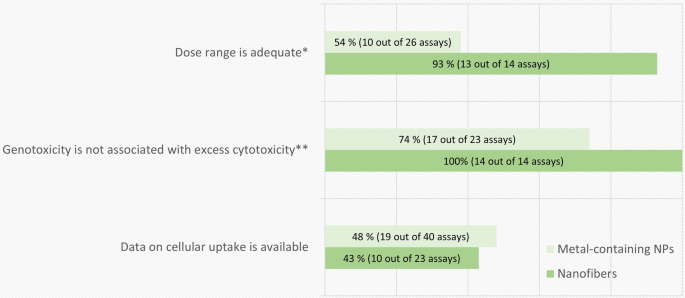
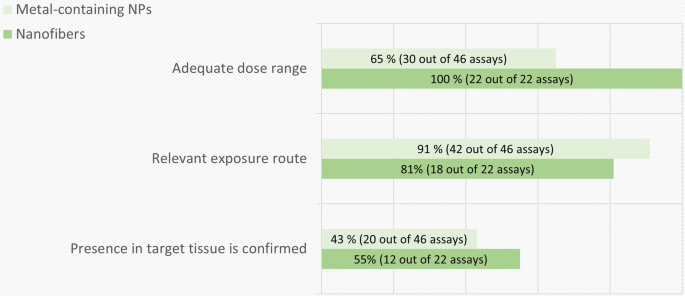
根据非强制性标准,体外遗传毒性试验质量评价结果的分解如图所示。4.这些标准的主要缺点是缺乏对细胞摄取的确认。如上所述,为了与遗传物质接触,NMs应该被细胞内化。在本次评估中,我们没有将颗粒吸收评估视为强制性要求,而是将其作为辅助信息,以弥补其他缺陷并权衡阴性测试结果的相关性。Di Bucchianico等人的研究是在测试系统中对细胞摄取进行良好调查的一个例子.[47].作者利用电感耦合等离子体质谱(ICP-MS)测试了Ni和NiO NPs摄取的时间和剂量依赖性,并通过透射电镜(TEM)证实了Ni在最后分析时间点以颗粒形式存在。他们发现,在所选择的测试系统中,摄取是快速的,并且依赖于剂量。然而,其他细胞系、NMs或分散方法也不能这样假设,因此,特别是在遗传毒性测试结果为阴性的情况下,研究描述细胞系在进行遗传毒性测试的相同时间点和相同条件下内化材料的能力是很重要的。
在同时进行细胞毒性测定的含金属NPs检测中,几乎有一半未能选择合适的剂量范围。此外,在四分之一显示阳性结果的检测中,阳性结果与过量的毒性剂量有关(图2)。4).如上所述,覆盖适当的剂量范围对于正确解释遗传毒性结果至关重要。一些被评估的研究只分析了无毒或极低的细胞毒性剂量。另一方面,其他药物没有包括足够的低毒剂量,这可能使对阳性检测结果的解释更加可靠。我们承认,由于方法上的限制,使用NMs实现可接受剂量范围的监管要求可能具有挑战性。在高剂量下,测试材料可能发生严重的团聚,使测试材料有效地非纳米,或者覆盖在细胞表面的材料团聚会阻碍显微分析。但是,在这种情况下,应明确说明所测剂量范围的限制和理由。
体内实验
在总共39篇体内论文中,报道的含金属NPs MN、CA、彗星和基因突变(Pig-a)分析的数量分别为16、7、20和3次,纳米纤维分别为6、2、14和0次。在大多数出版物中,使用了一种以上的检测方法。数字5总结了成功满足表中所列分析特定标准的研究的比例3..所有使用CA法进行的研究,以及大多数使用MN法进行的研究,都符合标准。然而,几乎一半使用彗星试验的研究都没有。另一方面,没有一项涉及猪-a红细胞基因突变试验的研究是可接受的。
根据强制性标准,体内遗传毒性试验质量评价结果的分解如图所示。6.最常见的缺陷是样本量小于当前OECD指南推荐的样本量(样本量在2014年版本中进行了修订),或者对于Pig-a检测,样本量小于该指南的草案。然而,在MN和CA测定的情况下,样本量通常遵循经合组织1997年版指南。在这种情况下,如果阴性对照达到足够的水平,能够进行可靠的分析,并且测试结果为阳性,专家判断可以认为测试是可接受的。一个类似的方法应用于并行毒性测量,其中唯一的抱怨是细胞毒性参数分析的细胞数量。罕见的事件,如染色体畸变,通常需要分析更多的中期阶段(每只动物200个细胞),而不是OECD指南的旧版(1997年)(每只动物100个细胞),然而,在大多数情况下,即使遵循旧版指南,这些数据也是有用的。然而,样本量过低的设计可能在解释阴性或弱阳性结果时产生问题,因为缺乏统计能力会降低检验的敏感性[48].
另一个缺点与处理和采样计划有关。治疗计划的论证应最佳地依赖于毒动力学研究,这些研究确认在给定时间点靶器官中存在试验材料,同时考虑到所测现象的短暂性。使用不合理的治疗计划的研究只有在测试结果为阳性的情况下才能被接受。然而,在本次评估中,我们接受了遵循OECD建议的研究,尽管与可溶性化学物质相比,NMs可能需要更长的时间才能到达目标器官,因此它们对NMs的适用性有时可能存在疑问[5].特别是在彗星试验的情况下,它是基于DNA损伤,通常在几个小时内修复,如果样品收集时间晚于建议时间,则应确认纳米材料的生物持久性。
根据非强制性标准的体内遗传毒性试验质量评价结果分解如图所示。7.这些标准的主要缺点是未能确认靶组织中存在的物质,如前一段所述,这对于正确解释阴性结果是必要的。例如,在含金属NPs的情况下,21项研究中只有3项评估了测量遗传毒性的所有靶组织中的生物分布,而13项研究包含了一些生物分布数据,但没有测量所有靶组织,5项研究没有包含生物分布数据。尽管21项研究中有17项评估了系统性遗传毒性,但只有3项研究测量了骨髓中的积累。在这17项研究中,有9项将外周血作为系统分布的指标。然而,由于骨髓是目前公认的全身遗传毒性检测的靶器官,与外周血相比,骨髓中可用的NM可能明显较少,因此测量血液中的积累可能是不够的。其中一项研究确实考虑了骨髓中的生物分布,与其他器官相比,口服不同大小的Ag NPs导致银在血液中,特别是在骨髓中积累最少[49].不幸的是,如前所述,用于评估NMs毒性动力学的合适TG仍在开发中[39].
关于使用适当的接触途径,大多数研究被认为符合这一标准。尽管应根据实际人体接触情况选择接触途径,但值得注意的是,根据欧洲化学品管理局关于NMs安全评估的建议,建议通过呼吸途径进行研究[36].只有两项研究(一项通过吸入,另一项通过气管内灌注)探讨了含金属NPs情况下NMs的呼吸暴露,而在纳米纤维情况下共有11项研究(一项通过吸入)进行了研究。
合格出版物成果
对于含金属的NPs,符合GUIDEnano质量评估要求的34篇体外论文中有20篇(59%)和21篇体内论文中有15篇(71%)也通过了本文作者提出的分析特异性标准。在纳米纤维方面,21篇体外论文中有7篇(33%),18篇体内论文中有12篇(71%)。因此,在体内观察到的这种提高的成功率可能是由于更严格的测试指导,适用于动物模型的毒理学测试,而不是体外培养。考虑到本研究评估的论文总数(图;1),从含金属NPs的监管角度来看,137篇体外发表的论文中只有20篇(15%)和85篇体内发表的论文中只有15篇(18%)被认为质量可接受。在纳米纤维的情况下,相应的数量为57个体外评估出版物中的7个(12%)和37个体内评估出版物中的12个(32%)。
合格的出版物涵盖了广泛的含金属NPs,除TiO外,每种化学成分只有1-2份出版物2Ag NPs,有更多的结果可用。相反,大多数纳米纤维研究涉及单壁或多壁碳纳米管(SWCNT和MWCNT),在评估其他纤维(包括纳米纤维素、碳纳米纤维、伊莫golite、铕纳米棒、棉纤维和石墨烯纳米带)的出版物中,只有一篇通过了质量评估。大多数检测结果为阳性,这可能反映了真正的nm诱导的遗传毒性,但也可能是发表偏倚的结果,因为阴性结果通常更难以发表。此外,如前几节所示,对报告阴性结果的研究应用了更严格的质量标准(例如,在阴性结果的情况下,需要对治疗计划、细胞摄取或生物分布进行更多的说明)。
TiO2纳米粒子
表S4(附加文件2表S4)总结了使用不同类型TiO进行的体外研究2NPs。由于使用不同类型的NPs和细胞系统,结果不一致。TiO2P25 AEROXIDE(也称为JRC nm -105),一个15-30 nm的TiO2锐钛矿/金红石在许多研究中被用作基准NP,在不同细胞系中产生不一致的结果。在支气管上皮BEAS-2B细胞中,与未处理的细胞相比,P25 AEROXIDE在20、50和100µg/ml时诱导MN显著增加,并具有显著的剂量反应,但仅当使用含血清的培养基时[44].有趣的是,这些作者还发现遗传毒性结果高度依赖于分散质量。P25 AEROXIDE还诱导小鼠Balb/3T3成纤维细胞中MN的显著增加,但仅在最低测试浓度(10µg/cm)下2) [50].相反,同样的材料并没有增加人TK6淋巴母细胞和人淋巴细胞中MN的频率[51].然而,细胞内化在后面的研究中没有得到证实。迪·布基亚尼科等人。[52]测试了三种TiO2具有不同的粒径和晶体结构。5-8 nm锐钛矿(nm -100)和22-28 nm金红石分别在1和1 - 5µg/ml时诱导MN显著增加。然而,更大的50 - 150nm锐钛矿颗粒(nm -103),具有形成大聚集的倾向,无论确认颗粒摄取与否,都产生了负面结果。然而,正如作者所认识到的,细胞摄取仅通过流式细胞仪侧散射来评估,因此无法区分颗粒是否已被内化或附着在细胞表面。50 nm TiO处理也能显著提高MN含量2表皮样癌细胞系A431中的锐钛矿[53].Caco-2细胞体外细胞分裂阻断纳米(CBMN)法检测20 ~ 60 NM TiO时,结果为阴性2锐钛矿(54];然而,这项研究没有包括对细胞摄取的评估。
一项研究通过CA法研究了< 25 nm TiO2锐钛矿在人淋巴细胞培养24、48和72 h后的致突变性[55].在48小时的培养中,畸变显著增加,同时出现显著的剂量反应。
TiO2是我们发现的唯一一种可接受的呼吸途径体内数据的含金属纳米颗粒(附加文件2:表S5)。sd大鼠反复气管内灌注P25 AEROXIDE,给药35天后外周血微核红细胞显著增加[56].另一方面,雄性C57BL/6 J小鼠吸入21 nm TiO2锐钛矿/紫砂处理5天,4 h/d,也能提高外周血红细胞微核的频率[57].这两项研究还分析了彗星试验对DNA损伤的诱导作用。然而,由于样本量小且缺乏细胞毒性指标,该方法在任何研究中都不被认为是可接受的。第三项具有可接受的彗星试验数据的研究发现,在14天重复口服10-100 mg/kg 20-50 nm TiO后,瑞士雄性白化小鼠肝细胞的DNA损伤显著增加2锐钛矿(58].有趣的是,当应用酶(Fpg)版本的彗星试验时,结果也是阳性的,表明氧化DNA损伤。
基于上述结果,一定形式的TiO2NPs在体内似乎具有诱变潜力。然而,目前尚不清楚这些影响是否仅由次要作用机制引起,因为体外试验的结果只能检测主要机制[38——在粒子和细胞系统之间是矛盾的。有趣的是,欧洲食品安全局最近的一项科学观点[59]得出结论,TiO的遗传毒性值得关注2不能排除可能存在于食品添加剂e171中的颗粒。
Ag纳米颗粒
体外检测质量评估产生了四篇关于Ag的可接受的出版物,包括原始的、柠檬酸盐包被和聚乙烯吡咯烷酮(PVP)包被Ag NPs的数据(附加文件)2:表S6)。结果似乎更多地取决于初级尺寸而不是涂层。在TK6淋巴母细胞中,无论涂层如何,MN检测结果对小(≤20 nm) Ag颗粒呈阳性,但只有在细胞毒剂量下,对较大的50-100 nm Ag颗粒呈阴性或阳性[60,61].另一方面,在L5178Y小鼠淋巴瘤细胞中,只有柠檬酸盐包覆的20 nm Ag NPs具有明显的阳性反应,而在pvc包覆的更大的50-100 nm颗粒中,统计学上显著的阳性反应与显著的细胞毒性相一致[60].与之前一样,pvp包裹的42.5 nm颗粒在支气管上皮BEAS-2B细胞中也给出了阴性结果[62].小鼠淋巴瘤试验结果为阴性(原始颗粒)或仅在同样表现出显著细胞毒性的剂量(包被颗粒)时呈阳性[60,63].然而,两项始终为阴性的研究并未证实细胞摄取[62,63].
在我们的评估中确定为可接受的两项Ag体内研究中,不同大小的原始、pvp涂层和二氧化硅涂层Ag颗粒通过外周血MN测试进行了测试(附加文件)2:表S7)。Boudreau等人.未发现系统性遗传毒性,尽管口服灌胃后骨髓和血液中Ag NPs的积累比其他器官小[49].Li等人的另一项研究。[64]在静脉注射PVP和二氧化硅包被Ag颗粒后没有发现遗传毒性。然而,可接受的数据有限,仅适用于全身遗传毒性。由于体外研究表明在某些条件下可能存在基因毒性潜能,因此需要更多的体内证据。
其他含金属纳米颗粒
除了TiO2Ag NPs,主要是每种化学成分的1-2个研究在分析质量评价中被认为是可接受的。这些研究报告了Co的阳性遗传毒性结果3.O4, Cu-Zn合金,Fe3.O4, Ni, NiO, ZnO,各种包被量子点(QD), W,和WC-Co体外(附加文件2:表S8)和CeO2、铬2O3., MgO和MnO2,我们3.,和Y2O3.体内(附加文件2:表S9)。只有一项含铁的体内研究2O3.骨髓CA试验和外周血彗星试验报告阴性结果[65].然而,与肝脏、脾脏、肾脏和心脏相比,骨髓中只发现了少量的物质,因此测试这些其他器官是有必要的。
对于氧化锌,我们发现了两种可接受的体外MN测试,然而这两种测试都有一些局限性。Senapati等人[66]在治疗THP-1单核细胞3小时后观察到细胞摄取并报告阳性结果,因此,尽管治疗时间短,但该研究被认为是可以接受的。Zijno等。[54]也在肠上皮Caco-2细胞中得出阳性结果,但由于MN试验仅在高细胞毒剂量下得到阳性结果,且未检测剂量反应,因此应谨慎解释结果。我们没有发现可接受的氧化锌NPs体内研究。
在一项研究中,用BEAS-2B体外支气管上皮细胞测试了NiO NPs [47]和一项体内灌胃研究[67].在两项研究中,NiO NPs均表现出遗传毒性。在体内研究中,NiO NPs在白化雌性Wistar大鼠的所有被测器官中均有发现,并且在外周血白细胞、肝脏和肾脏的彗星试验、红细胞MN试验和骨髓CA试验中系统地观察到局部和全身遗传毒性[67].至于我们在本次评估中发现的其他含金属NPs的体内研究,与体外测试的NMs没有重叠。
对于氧化钨(WO3.)和氧化钇(Y2O3.) NPs,发现了两项可接受的研究,每种材料的遗传毒性结果均为阳性,均由同一研究小组进行。这些研究包括雌性Wistar大鼠的单次口腔暴露,以及雄性和雌性Wistar大鼠28天的重复口腔暴露研究。单剂量Y处理大鼠的肝脏和外周血红细胞的Comet和MN试验均为阳性2O3.,以及单剂量和重复剂量WO3.在最高测试剂量下(1000毫克/公斤体重)[68,69,70].在大鼠体内反复注射Y2O3.,在120-480 mg/kg体重下,所有测试均呈阳性[71].
基于上述结果,许多评估的NPs似乎可以通过主要机制诱导遗传毒性。以ZnO为例,基因毒性和细胞毒性剂量之间的部分重叠[72],可能会影响化验结果。另一方面,为镍化合物(包括NiO)设定了职业接触限制(OEL),因为考虑到这些基因毒性致癌物存在一个基于作用方式的阈值[73].但是,这种OEL不适用于纳米颗粒。尽管大多数显示原发性遗传毒性的NMs被认为是通过间接机制起作用(不涉及与DNA分子的直接相互作用)[3.,13,37],可以有一个阈值响应[74],尚不清楚截断值是否与对应粒子的截断值相似。
纳米纤维
在体外发表的论文中,合格的7篇论文都在研究CNTs作为试验NM(附加文件)2:表S10)。在这7篇文章中,有6篇关注体外CBMN测定。有趣的是,在体外CBMN试验被利用的每一个场合,测试材料诱导了至少一个浓度的阳性反应。对于这些出版物,细胞摄取在两项研究中得到了证实,其中第一项研究是在2013年由Manshian及其同事[75].Manshian等人.报告显著点突变与产生Hprt在暴露于三种SWCNTs变体后,分别对MCL-5和BEAS-2B细胞进行了原发性遗传毒性测定。这些CNTs的长度主要不同,分别为400 ~ 800 nm、1 ~ 3µm和5 ~ 30µm。这些CNTs暴露于细胞的浓度范围为100µg/ml。
Catalan等人在体外研究中使用BEAS-2B细胞检测碳纳米管暴露后的遗传毒性。[76]和Louro及其同事[77].加泰罗尼亚语等。[76],报告了5、10和100µg/cm对体外CBMN测定无统计学显著影响2风险敞口。Louro和同事们[77相反,尽管在人肺泡上皮(A549)细胞类型中,体外CBMN试验显示显著数据。然而,这确实需要相当高浓度的NM401和NM402 (NM400和NM403不诱导遗传毒性),浓度范围可达150µg/cm2[77].塔瓦雷斯等人[78,以及加泰罗尼亚等人.[55],两者都利用了人类血液来源的淋巴细胞,都能够显示出显著的DNA损伤。首先,Tavares及其同事通过体外CBMN实验证明,仅15µg/ml的MWCNTs可诱导显著的染色体损伤,但这被证明是cnt类型依赖的[78].Catalan及其同事报道,6 ~ 300µg/ml之间的SWCNTs和MWCNTs都能诱导人血源性淋巴细胞中ca的显著增加。这些影响似乎与时间有关,因为在48和72小时接触后发现了重要的数据结果[55].
对于成功通过分析特异性标准的体内出版物(附加文件)2:表S11),只有一篇文章关注了CNTs以外的材料。加泰罗尼亚等.[79]研究了纳米纤颤纤维素(NFC)在10、20、40、80、200µg/小鼠范围内的作用,通过咽吸进入雌性C57BI/6小鼠。然后,作者利用体内彗星试验和骨髓红细胞MN试验。从研究中,作者报告了NFC在支气管和巨噬细胞中的剂量依赖性积累。这对应于彗星试验中显著的DNA损伤,然而在MN试验中报告了阴性结果[79].其余11篇通过分析特异性指南的体内研究均聚焦于SWCNTs或MWCNTs。从这些出版物中,体内彗星试验被证明是一种用于确定碳纳米管遗传毒性的常用技术。从体内彗星数据来看,有3份报告没有显著发现,而有7份报告至少有一份显著剂量可诱导基因毒性反应。在三个负面研究中,Pothmann等人.[80, Christophersen等人.[81和本田等人.[82]均报告无显著结果。这三项研究都使用了不同的啮齿动物模型、不同剂量的碳纳米管(其中两项是多壁碳纳米管),其中两项研究研究了毒性动力学。在Pothmann和Honda及其各自团队的工作中,他们证实了到达靶组织的碳纳米管的肺泡沉积,并且在体内彗星试验中仍报告了阴性结果[80,81,82].在利用体内锰含量测定染色体损伤的研究中,有5项报告了阴性数据,而只有2项报告了显著的剂量反应数据。这些结果由Patlolla等人发表.2010年[83]及2016年[84],他通过腹腔内暴露0.25、0.5和0.75 mg/kg的MWCNTs和SWCNTs,研究了MWCNTs和SWCNTs对成年雄性瑞士韦氏小鼠的影响。这些研究的MN数据显示,只有前两种剂量可以诱导显著的染色体断裂,这在两种情况下都得到了积极的彗星数据和ca的进一步支持[83,84].
从合格的体外实验论文中得出结论,我们可以推断出纳米纤维在低浓度和高浓度的情况下,在急性(24小时或更短)和略长时间(48小时和72小时)暴露后,可以在几个关键细胞系中显示出遗传毒性。此外,在将摄取作为方法的一部分的研究中,细胞内化已使用TEM得到证实。然而,就诱导其基因毒性效应的作用方式而言,这些发现似乎并不能区分SWCNTs和MWCNTs。它们的几何形状和纤维模式似乎更有可能是驱动其遗传毒性的主要因素,这在文献和本研究的合格出版物中都得到了支持。就合格的体内出版物而言,大多数数据表明即使在高剂量时也有负反应,但仍使用了足够的剂量。此外,当进行体内彗星试验时,其中11项研究报告了测试材料存在于目标组织中,从而证明了可靠地报告了毒性(或无毒性)。从合格的研究来看,目前的数据还不足以将纳米纤维(其中大部分是碳纳米管)严格归类为遗传毒性。
数据库搜索
NanoinformaTIX数据库是eNanoMapper数据库的一个实例(https://search.data.enanomapper.net/projects/nanoinformatix/),收集欧盟8项计划和美国caNanoLab的数据。该数据库还从目前仍在进行的NanoinformaTIX项目收集数据,并定期更新。因此,数据库中的信息是动态的,应该定期检查。因此,本文中提供的信息代表了特定时间的快照。
对于目前的研究,我们在NanoInformaTIX实例中搜索基因毒性条目,并选择相关过滤器。所有关于基因毒性的条目都被考虑了——无论它们使用的是经过验证的还是未经验证的测定法——因为主要的想法是提供一个关于基因毒性如何被数据库覆盖的概述,以及未来利益相关者可以从中受益的数据量。在纳米材料菜单下选择“金属”或“碳基”材料进行过滤。后者被期望捕获与在文献综述中获得的相似的材料时,搜索“纳米纤维,因为大多数都是碳纳米管。结果将在protocols选项卡下进行第二个过滤步骤。以下选择:“彗星或彗星(牛DNA损伤)或彗星(原发性DNA损伤)或彗星(Fpg)或彗星(NET-Fpg)或彗星- sb,或遗传毒性或细胞转化试验(CTA)或DNA链断裂或体外微核或体内彗星试验或微核或小鼠淋巴瘤L5178Y/TK±试验或体内遗传毒性。或HCA OR pH2Ax4h OR pH2Ax4h in vivo”。据我们所知,这个广泛的条目涵盖了数据库中所有可能的DNA损伤相关数据。
基因毒性数据可在NanoInformaTIX实例中获得
在NanoInformaTIX实例中进行搜索后,发现基因毒性条目的相关NMs为CNTs、TiO2, ZnO, BaSO4, Ag, Fe3.O4和ZrO2.如附加文件所示2:图S1,与每种材料的总体毒性数据条目相比,关于遗传毒性的数据条目的比率从7% (Ag)到40% (ZrO)不等2).因此,NanoInformaTIX实例包含大量的遗传毒性信息。在NanoInformaTIX实例中,共鉴定出41个与遗传毒性相关的数据条目。如附加文件所示2:图S2,每种材料的基因毒性相关数据条目的分布如下:碳纳米管(34%),TiO2(29%), ZnO (12%), Ag (10%), BaSO4 (2%), F3.O4(2%)、ZrO2(2%)。此外,在一般纳米材料名称下确定了不同的纳米形式,这些名称在附加文件中显示2:表S12。正如预期的那样,这些数字与文献搜索中发现的NMs的优势相关。
关于分析,每种分析提供了不同的名称(如附加文件所示)2:表S13)。这是因为由输入数据的实验室来决定如何命名每种测定方法。在某些情况下,不同名称的存在是合理的,因为它们指的是同一化验方法的不同变体。例如,甲酰胺嘧啶DNA糖基化酶(Fpg)修饰的彗星试验是对标准彗星试验的改进,其中添加了修复酶,可以测量氧化损伤的DNA [85].然而,在其他情况下,相同的方法需要不同的名称(例如,体外微核和微核)。在某些情况下,这种情况阻碍了结果概述,因为必须在搜索引擎中输入准确的名称,因此,在此审查中包含了几种可能性,以获得数据库中收集的信息的全貌。
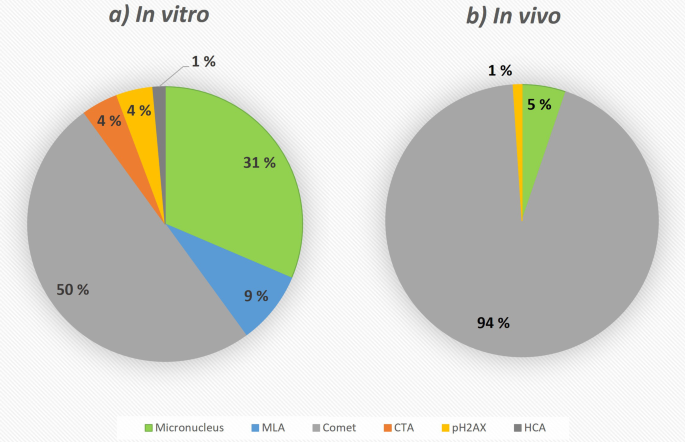
对于NanoInformaTIX数据库中确定的体外研究(图2)。8A),至少有一半确定的测定方法代表不同版本的彗星测定(50%),其次是微核(31%)和小鼠淋巴瘤(9%)测定。尽管在文献搜索中没有考虑体外彗星试验,因为它不是一个有效的试验[13],据报道,它是同行评审出版物中使用最多的测定方法[3.].第二个最常报道的是锰含量测定,与数据库一致。然而,在数据库中没有发现CA的数据,尽管已有出版物使用了这种方法。组蛋白变体H2AX的Ser-139残基的磷酸化(4%)以及其他蛋白质残基的磷酸化(1%)也可以用作基因毒性的生物标志物[86].这些研究也在数据库中找到,但程度较小,主要由一个特定的机构进行[87].这些特定的研究是一系列研究的一部分,这些研究包括细胞计数、核大小评估、核强度、活性Caspase-3、gH2AX、磷酸化p53、磷酸化atm和通过Ki-67的细胞计数,因此也包括在高含量分析条目(HCA)中。另一方面,细胞转化试验(CTA, 4%)不是评估基因毒性,而是评估致癌性。然而,该试验检测到的一些起始事件对应于诱变事件[88].同样,最流行的体内方法是彗星试验,其对应于所有体内研究的94%(图。8b).事实上,所谓的“DNA链断裂”试验,虽然单独报道,也指彗星试验。另一方面,其余的体内条目与微核和H2AX磷酸化实验相对应(分别为5%和1%)。与体外试验一样,没有发现CA的数据,尽管在文献检索中报道了使用该试验的研究。
NanoInformaTIX实例中可用数据的质量
阻碍涉众使用数据库信息的一个主要问题通常是存储数据质量的潜在不确定性。因此,与本文前几节中描述的工作一致,我们也根据解决的问题对NanoInformaTIX实例进行了审查,以满足S分的要求。大多数所需的信息可以很容易地找到,并在附加文件中进行审查2:表S14,其中描述了所处理的问题和每个问题的结果摘要。
综上所述,关于S评分,可以得出结论,不同的PC方法学对NMs总体上有很好的表征。例如,基于不同的方法,如TEM,小角度x射线散射(SAXS),广角x射线散射(WAXS),提供了颗粒尺寸。唯一的缺点通常是缺乏内毒素污染数据和PC表征与毒理学结果之间的缺失环节。这一发现与同行评议的出版物中缺乏完整的描述形成了鲜明对比。解释这种差异的一个原因可能是,数据库中包含的大多数数据都起源于强大的联盟,这些联盟已经共同努力提供一个可靠的特征描述。然而,对于外部用户来说,不清楚如何将PC结果与特定的毒理学实验联系起来(同样适用于基因毒性评估)。
同样,对检索到的信息进行审查,以评估它是否满足体外K分(附加文件2:表S15)和in vivo(附加文件2:表S16)。总的来说,现有数据符合大部分K评分标准。然而,正如PC表征所发生的那样,(细胞)毒性数据与同一实验中产生的遗传毒性数据都没有关联,这阻碍了对遗传毒性结果的正确解释。由于没有对验证方法进行选择,因此在本例中没有应用分析特异性标准。
挑战从NanoInformaTIX实例检索数据
在使用数据库时的一个主要问题是,它们中的大多数都不向外部利益相关者开放,这可能已经是一个问题,阻碍了它们的广泛接受和使用。其次,即使搜索字符串很清楚,也会发现几个名称表示一个给定的测定方法,而且由于搜索不灵活,需要选择不同的可能性来覆盖给定测定方法的所有潜在条目。为eNanoMapper数据库提供数据的不同项目已经发现了这个问题,目前正在不同的欧洲计划中解决[89].查看检索到的分析,所提供的数据结构良好,大多数条目满足S和K分的要求,但不幸的是,属于同一实验的S和K分相关数据没有关联,或者至少这对用户来说不明显,因此不可能像NANoREG项目所推荐的那样,在实验之前、期间和之后评估特定材料的PC状态。这些信息以前是为了便于实验室间的比较而使用的,应该朝着这个方向努力,以最大限度地利用数据库条目。同样,实验在细胞毒性和遗传毒性结果方面没有联系,如果有联系,对读者来说并不明显。因此,目前还不可能确定亚毒性浓度,这将有助于基因毒性实验的规划。
尽管在公开提供数据之前通常会设置封锁期,以允许研究人员发表他们的结果,但数据库中通常不提供与这些出版物的链接。因此,不可能跟踪数据库中可用的信息是否存在于已发表的文献中。这种相互联系有助于研究的合格和使用,因为一些缺失的资料(例如出版物中没有适当报道的关于个人电脑属性的详细资料)可以在数据库中得到。事实上,满足S评分标准是已发表文献的一个关键缺陷,对数据库来说似乎不是问题。
另一个可能妨碍监管机构使用数据库的问题是,其中包含的信息由原始数据组成。因此,这类信息的使用可能在某种程度上仅限于该领域的专家,因为没有提供遗传毒性评估的结果。此外,也不可能知道阳性的比例vs。阴性结果出现,使得不可能与已发表的信息进行比较。
设计具有调控相关性的纳米材料遗传毒性研究的建议
根据我们的质量评估,在已发表的关于NMs遗传毒性的信息中,只有17%(316篇被评估的出版物中有54篇)被监管机构认为是可靠和相关的,因为这些出版物符合质量标准。考虑到我们的搜索仅限于使用验证方法的研究,并且应用S评分仅评估是否分析了某些PC特征,而没有评估这些特征的质量,这个百分比尤其小。这些发现要求反思如何设计和执行基因毒性研究,以提供不仅科学相关,而且符合监管要求的数据。表中总结了一组建议4.
大多数被拒绝的研究未能提供被测材料的完整PC表征。近年来,已发表的文献中PC表征的完整性有所增加,与此同时,这些特性可能在NMs的毒理学反应中发挥关键作用的证据也在增加[90],以及分组策略如何从了解这些关系中获益[91].然而,对于测量某些性质,还没有达成一致的标准化方法[39].另一方面,其中一些实验室所需的专业知识和设备超出了大多数毒理学实验室的能力。因此,在我们的研究过程中,许多表现良好的基因毒性研究由于所能提供的特征信息有限而被拒绝。有助于未来研究阐明纳米基因毒性的因素将在出版物中报告材料的完整PC特征。不同合作伙伴之间共同的特征描述工作,如在几个正在进行的项目中执行的那样,并反映在评估的数据库中,可以有助于克服单个实验室层面特征描述资源的缺乏。
通过K评分和分析特异性标准评估的可靠性和相关性不足,涉及16-27%具有适当特征的文章。有几个原因可以解释这一现象。首先,值得一提的是,一些被拒绝的文章的重点并不是基因毒性的评估。例如,纳米和非纳米颗粒之间的比较有时只使用一到两剂。尽管在科学上是合理的,但由于缺乏第三次剂量,这类研究被排除在外。所有基因毒性试验的一个典型缺点是缺乏同步细胞毒性数据或使用了一个参数,而这个参数不在经合组织推荐的参数之列。在某些情况下,显示了来自单独实验的细胞毒性数据,但这是不可取的,除非有明确的证据表明实验具有良好的可重复性,且实验条件之间没有其他差异。因此,强烈建议在开始实验之前,研究人员检查指导方针,并确定应该包括哪些额外参数,以实现他们的研究目标,同时提供充分的基因毒性效应评估。
其次,虽然现有的大多数指南都适用于NMs,但其中一些仍然需要进行一些调整。一些强制性的特定检测标准,例如延迟Cyt-B治疗或至少一个细胞周期的治疗,在当前的OECD指南中没有为NMs设置。因此,尽管符合指南的要求,一些研究还是被拒绝了。虽然监管机构已经采纳了一些纳米特定要求[36,40,研究人员应该知道在哪里找到合适的信息。迫切需要调整和更新OECD的tgg来评估NMs的遗传毒性。在经合发组织NMs方案的框架下,目前正在努力解决这一问题[39].
值得一提的是,缺乏对哺乳动物基因突变测定的调查。这些方法仅进行了8个体外和3个体内实验。其中,只有一半的体外实验和没有一个体内实验通过了质量评估。目前欧盟H2020 RiskGONE项目内的工作已致力于协调产生Hprt基因突变检测方案,以适应NMs的评价。基本上,这种方法的OECD TG是合适的,但是,建议进行小的调整,包括额外的清洗步骤,以便在暴露期后更好地去除试样。
除了经过验证的遗传毒性tg外,还需要与NMs暴露相关的其他指南,以正确解释遗传毒性结果。目前正在制定的NMs毒性动力学指南就是如此[39].尽管在监管信息要求中不要求进行毒动力学评估,但未来使用NMs进行的体内遗传毒性研究应确认靶组织中存在该物质,特别是如果结果为阴性时。从这个意义上说,目前的一些体内遗传毒性指南(例如,关于哺乳动物红细胞微核测定的OECD TG 474)可能也需要进行调整,因为NMs的一个主要问题是,当使用针对可溶性化学物质优化的治疗方案时,它们是否能到达目标组织[5].同时,应该验证能够评估NMs在接触部位的影响的新测定方法(例如,肺细胞中的微核),以确保NMs的适当诱变性评估。
关于数据库,需要统一分析的名称和报告结果的方式。协调从不同实验室、不同项目(如NanoInformaTIX)收集的大量条目是一项具有挑战性的工作,目前,对于外部用户来说,确保检索到所有感兴趣的条目是一项具有挑战性的任务。尽管如此,作者充分意识到目前在eNanoMapper数据库(Jeliazkova,个人沟通).数据库也是动态的,数据上传是在常规基础上进行的。从eNanoMapper数据库检索到的数据通常包含S和K分数所需的所有信息,表明该数据库可作为学术界、工业界或监管机构等高质量数据的来源。使用的掩码或接口可能表示一个较小的缺陷,这有时可能不是外部用户查找相关信息的最佳选择。另一方面,从数据库收集的数据输出可能不适合风险评估人员,他们可能不一定熟悉测试及其结果值,但需要解释结果。在这方面,数据库可能受益于一个名为“结果解释”的额外列。在将来,数据库还建议包含一个链接到已生成或重新使用这些数据的已发表出版物。在负面结果的情况下,发表的可能性更小,应该开发新的工具,让利益相关者(包括监管机构)在没有高基因毒性专业知识的情况下分析数据。
正如在整个审查过程中所述的几点,我们重点关注用于满足监管信息要求的已验证测定法。然而,监管机构也需要进行机制研究,这可能有助于研究NMs的遗传毒性作用机制。目前关于基因毒性致癌物的范式认为,只有dna反应性物质具有非阈值的作用模式[92,93].涉及炎症细胞和靶细胞的共培养系统可以在不需要动物研究的情况下区分初级和次级基因毒性机制,并且已经与NMs一起使用[38,94,95].结合使用着丝粒探针与MN测定可以鉴定出无生成物质,这些物质也被认为具有阈值反应[96].
虽然在本综述中提出的质量评估方法中没有提及,但为了增加基因毒性研究的信心,详细了解测试系统,提出选择它的合理理由,了解它如何响应阳性粒子、化学物质和分析特异性对照,并监测其特性以发现可能影响测试结果的异常情况也是有用的[97].目前还不可能评估研究设计的所有方面,因为对于应该被认为是最相关的方法没有明确的共识。无论试验系统或研究设计有多么具有代表性,能够显示NM的遗传毒性潜力都被认为是重要的,但另一方面,需要更复杂、更有代表性和更现实的模型来增加预测性和减少不确定性,特别是与非动物模型相关的[98].然而,出于监管目的,这些方法需要具有可重复性和有效性。开发这种方法的国际努力正在进行中,但缺乏验证方法所需的体内数据和资源,给快速实施带来了挑战。在未来,不良结果途径可能会提供一种更快、更经济的策略,以增加对非动物方法的信心。
结论
大多数已发表的关于NMs致突变作用的研究不符合从监管角度被认为是完整、可靠和相关的要求。监管机构和研究人员之间最重要的障碍是缺乏基因毒性测定和支持信息(如NMs的PC表征和毒性动力学)的纳米特异性指南。此外,迫切需要经过验证的新方法来克服当前指南的一些限制,并提供更多的机制信息。此外,数据库可能包含相关信息,特别是有关负面结果的信息,可以支持监管评估。然而,由于使用的术语缺乏统一,加上查找和链接数据存在困难,目前阻碍了监管机构对其的使用和实施。
参考文献
委员会2022年6月10日关于纳米材料定义的建议。可以从:https://ec.europa.eu/environment/chemicals/nanotech/pdf/C_2022_3689_1_EN_ACT_part1_v6.pdf.
纳米材料与基因毒性——文献综述。瑞典化学品局;2020年9月6日。报告没有。: 361 218。
Kohl Y, Rundén-Pran E, Mariussen E, Hesler M, El Yamani N,龙欣EM,等。纳米材料的遗传毒性:用于人类危害评估的先进体外模型和高通量方法——综述。纳米材料。2020;10(10):1911。
郭旭,陈涛。工程纳米材料遗传毒性评价研究进展。入:Soloneski S, Larramendy ML,编辑。纳米材料的毒性和风险评估。2015.https://doi.org/10.5772/61013.
Catalán J, Stockmann-Juvala H, Norppa H.纳米材料致突变潜力加权评估的理论方法。纳米毒理学。2017;11(8):964 - 77。https://doi.org/10.1080/17435390.2017.1382601.
Hartwig A, Arand M, Epe B, Guth S, Jahnke G, Lampen A,等。基于行动的基因毒性致癌物风险评估模式。中国生物医学工程学报。2020;94(6):1787-877。https://doi.org/10.1007/s00204-020-02733-2.
Dekkers S, Oomen AG, Bleeker EAJ, Vandebriel RJ, Micheletti C, Cabellos J,等。一种用于风险评估的纳米特异性方法。Regul Toxicol Pharmacol. 2016; 80:46-59。https://doi.org/10.1016/j.yrtph.2016.05.037.
Dusinska M, Boland S, Saunders M, Juillerat-Jeanneret L, Tran L, Pojana G,等。朝向用于纳米医学的纳米材料的替代测试策略:来自NanoTEST的经验教训。纳米毒理学。2015;9 (sup1): 118 - 32。https://doi.org/10.3109/17435390.2014.991431.
杜辛斯卡,杜林斯卡,埃尔·亚马尼,Kuricova M, Liskova A, Rollerova E,等。纳米材料的免疫毒性、遗传毒性和表观遗传毒性:毒性测试的新策略?食品化学毒物。2017;109(Pt 1): 797-811。https://doi.org/10.1016/j.fct.2017.08.030.
史东V, Pozzi-Mucelli S, Tran L, Aschberger K, Sabella S, Vogel U,等。its - nano优先考虑纳米安全研究,以开发利益相关者驱动的智能测试策略。纤维毒性。2014;11(1):9。https://doi.org/10.1186/1743-8977-11-9.
黄睿,周勇,胡松,周培坤。纳米材料对DNA的靶向和非靶向效应:挑战和展望。环境科学与生物/技术。2019; 18(4): 617 - 34。https://doi.org/10.1007/s11157-019-09510-3.
张晓东,李志强,张志强,等。SCCS对化妆品中纳米材料的安全性提出了科学建议。Regul毒理学药物。2021;126:105046。https://doi.org/10.1016/j.yrtph.2021.105046.
陈涛,王志强,王志强,等。纳米材料的遗传毒性评估:最佳实践、测定和方法的建议。中国生物医学工程学报,2018;26(2):391-416。https://doi.org/10.1093/toxsci/kfy100.
Johnston LJ, Gonzalez-Rojano N, Wilkinson KJ,邢斌。工程纳米材料安全性评价的关键挑战。NanoImpact。2020; 18:100219。https://doi.org/10.1016/j.impact.2020.100219.
代理电子商务。信息要求和化学品安全评估指南。B部分:危害评估,2011。可以从:https://echa.europa.eu/documents/10162/17235/information_requirements_part_b_en.pdf/7e6bf845-e1a3-4518-8705-c64b17cecae8.
Fernández-Cruz ML, Hernández-Moreno D, Catalán J, Cross RK, Stockmann-Juvala H, Cabellos J,等。用纳米材料进行的人体和环境毒性研究的质量评估——GUIDEnano方法。环境科学学报,2018;5(2):381-97。https://doi.org/10.1039/C7EN00716G.
Nymark P, Grafström R, Noorlander C, Catalán J, Rodriguez-Llopis I, Suarez-Merino B,等。caLIBRAte d5.3 -数据质量标准文件。2017.https://doi.org/10.5281/ZENODO.3859951.
克利夫特MJD,雷米DO, Endes C,阿里Z, Lehmann AD, Brandenberger C,等。艾姆斯试验能否深入研究纳米物体的致突变性?研究纳米物体和细菌之间的相互作用。纳米毒理学。2013;7(8):1373 - 85。https://doi.org/10.3109/17435390.2012.741725.
George JM, Magogotya M, Vetten MA, Buys AV, Gulumian M.封面:金纳米颗粒在常用的体外致突变性和基因毒性实验中的遗传毒性和干扰研究。中国生物医学工程学报,2017;26(1):344 - 344。https://doi.org/10.1093/toxsci/kfw247.
Shvedova AA, Kisin E, Murray AR, Johnson VJ, Gorelik O, Arepalli S,等。在C57BL/6小鼠中吸入与吸入单壁碳纳米管:炎症、纤维化、氧化应激和突变。中国生物医学工程杂志,2008;29(4):457 - 457。https://doi.org/10.1152/ajplung.90287.2008.
Gaté L, Knudsen KB, Seidel C, Berthing T, Chézeau L, Jacobsen NR,等。两种不同的多壁碳纳米管对大鼠的肺毒性:气管内灌注和吸入暴露的比较。毒物应用药物。2019;375:17-31。https://doi.org/10.1016/j.taap.2019.05.001.
卡JW,马格努森BA。一种评估工程纳米材料毒性研究质量的方法。中国药理学杂志,2010;29(4):402-10。https://doi.org/10.1177/1091581810370720.
李志强,李志强,李志强。一种评价实验毒理学和生态毒理学数据质量的系统方法。中国药物学杂志。1997;25(1):1 - 5。https://doi.org/10.1006/rtph.1996.1076.
Doak SH, Manshian B, Jenkins GJ, Singh N.纳米材料的体外遗传毒性测试策略和当前OECD指南的适应性。Mutat res 2012;745(1-2): 104-11。https://doi.org/10.1016/j.mrgentox.2011.09.013.
李志强,李志强,李志强,等。纳米材料的遗传毒性:危害识别的改进策略和测试。环境化学。2013;54(4):229-39。https://doi.org/10.1002/em.21770.
经济合作与发展组织。试验第476号:使用Hprt和xprt基因的体外哺乳动物细胞基因突变试验2015。
经济合作与发展组织。试验编号490:体外哺乳动物细胞基因突变测试使用胸苷激酶基因2015。
经济合作与发展组织。试验编号487:体外哺乳动物细胞微核试验2016。
经济合作与发展组织。试验编号473:体外哺乳动物染色体畸变试验2016。
经济合作与发展组织。试验编号475:哺乳动物骨髓染色体畸变试验2016。
经济合作与发展组织。试验编号474:哺乳动物红细胞微核试验2016。
经济合作与发展组织。试验编号489:体内哺乳动物碱性彗星试验2016。
经济合作与发展组织。猪体内红细胞-基因突变分析-第1部分详细综述和回顾性性能评估2020。
Fenech M, Morley AA。人淋巴细胞的细胞分裂阻滞微核法:体内衰老和低剂量x射线照射的影响。Mutat Res. 1986;161(2): 193-8。https://doi.org/10.1016/0027 - 5107 (86) 90010 - 2.
孙晓明,李志强,李志强,等。纳米材料的遗传毒性研究进展。诱变。2011;26(1):185 - 91。https://doi.org/10.1093/mutage/geq088.
代理电子商务。信息要求和化学品安全评估指南。附录R7-1适用于第r7a章端点特定指南2021的纳米材料。可以从:https://echa.europa.eu/documents/10162/13632/appendix_r7a_nanomaterials_en.pdf/1bef8a8a-6ffa-406a-88cd-fd800ab163ae.
Gonzalez L, Kirsch-Volders M.人类暴露于纳米材料的遗传毒性效应的生物监测:未来的挑战。Mutat Res Rev Mutat Res 2016; 768:14-26。https://doi.org/10.1016/j.mrrev.2016.03.002.
埃文斯SJ,克利夫特MJD,辛格N,威尔斯JW, Hondow N,威尔金森TS,等。工程纳米材料诱导遗传毒性的体外二级机制的体外检测。部分纤维毒理学。2019;16(1):8。https://doi.org/10.1186/s12989-019-0291-7.
拉斯穆森K, Rauscher H, Kearns P, González M, Riego SJ。制定经合组织纳米材料监管测试指南,以确保相互接受测试数据。Regul Toxicol Pharmacol. 2019; 104:74-83。https://doi.org/10.1016/j.yrtph.2019.02.008.
委员会ES, More S, Bampidis V, Benford D, Bragard C, Halldorsson T,等。用于食品和饲料链的纳米材料风险评估指南:人类和动物健康。欧洲食品安全杂志,2021;19(8):e06768。https://doi.org/10.2903/j.efsa.2021.6768.
快速重力沉降导致纳米结构物质过多地传递到淹没细胞。化学工程学报。2011;5(5):3766-78。https://doi.org/10.1021/nn200112u.
经济合作与发展组织。第474号试验:1997年哺乳动物红细胞微核试验。
经济合作与发展组织。试验编号473:1997年体外哺乳动物染色体畸变试验。
李志强,李志强,李志强,等。处理介质对二氧化钛纳米颗粒团聚的影响:对遗传毒性、细胞相互作用和细胞周期的影响。生物化学学报。2013;7(3):1929-42。https://doi.org/10.1021/nn302280n.
格林伍德SK,希尔RB,孙JT,阿姆斯特朗MJ,约翰逊TE,加拉JP,等。种群加倍:在体外染色体畸变测定中对细胞生长抑制的简单和更准确的估计,减少不相关的阳性结果。环境化学。2004;43(1):36-44。https://doi.org/10.1002/em.10207.
体外染色体畸变试验和微核试验的细胞毒性测定。中国生物工程学报。2011;26(1):1 - 7。https://doi.org/10.1016/j.mrgentox.2011.05.003.
Di Bucchianico S, Gliga AR, Åkerlund E, Skoglund S, Wallinder IO, Fadeel B,等。镍金属和氧化镍纳米颗粒在人肺细胞中的钙依赖性细胞和遗传毒性。部分纤维毒理学。2018;15(1):32。https://doi.org/10.1186/s12989-018-0268-y.
经济合作与发展组织。2017年遗传毒理学研究综述。
Boudreau MD, Imam MS, Paredes AM, Bryant MS, Cunningham CK, Felton RP,等。银纳米颗粒和银离子对Sprague Dawley大鼠组织积累、分布和毒性的差异影响,每天口服灌胃13周。中国生物医学工程学报,2016;30(1):344 - 344。https://doi.org/10.1093/toxsci/kfv318.
斯多科罗A,迪布奇阿尼科S, Uboldi C, Coppedè F,庞蒂J, Placidi C,等。一组体外试验评估原始和修复的二氧化钛和氧化锆纳米颗粒对Balb/3T3细胞的遗传毒性和形态学肿瘤转化潜力。诱变。2016;31(5):511 - 29。https://doi.org/10.1093/mutage/gew015.
Kazimirova A, Baranokova M, Staruchova M, Drlickova M, Volkovova K, Dusinska M.二氧化钛纳米颗粒在体外、体外和体内用彗星和微核试验进行了遗传毒性测试。Mutat Res/Genet Toxicol Environ Mutagen. 2019; 843:57-65。https://doi.org/10.1016/j.mrgentox.2019.05.001.
迪·布恰尼科,卡佩里尼F,勒·比哈尼克F,张杨,德莱杰K,卡尔松HL。TiO的遗传毒性2通过微凝胶彗星试验和流式细胞仪微核评分评估纳米颗粒。诱变。2016;32(1):127 - 37。https://doi.org/10.1093/mutage/gew030.
刘志刚,刘志刚,刘志刚,刘志刚,等。二氧化钛纳米颗粒对人表皮细胞ros介导的遗传毒性研究。中国药理学杂志。2011;25(1):231-41。https://doi.org/10.1016/j.tiv.2010.11.008.
Zijno A, De Angelis I, De Berardis B, Andreoli C, Russo MT, Pietraforte D,等。氧化锌和二氧化钛纳米颗粒对人结肠癌细胞的DNA氧化损伤和遗传毒性诱导机制不同。毒理学杂志。2015;29(7):1503-12。https://doi.org/10.1016/j.tiv.2015.06.009.
Catalán J, Järventaus H, Vippola M, Savolainen K, Norppa H.碳纳米管和二氧化钛纳米颗粒诱导体外人淋巴细胞染色体畸变的研究。纳米毒理学。2012;6(8):825 - 36。https://doi.org/10.3109/17435390.2011.625130.
Relier C, Dubreuil M, Lozano Garcìa O, Cordelli E, Mejia J, Eleuteri P,等。大鼠反复呼吸暴露后肺负荷和非负荷条件下TiO2 P25纳米颗粒对肺、血液和肝细胞的遗传毒性研究。中国生物医学工程学报,2017;26(2):527-37。https://doi.org/10.1093/toxsci/kfx006.
Lindberg HK, Falck GC, Catalán J, Koivisto AJ, Suhonen S, Järventaus H,等。吸入纳米TiO(2)对小鼠的遗传毒性。Mutat res 2012;745(1-2): 58-64。https://doi.org/10.1016/j.mrgentox.2011.10.011.
舒克拉RK, Kumar A, Vallabani NV, Pandey AK, Dhawan A.二氧化钛纳米颗粒诱导的氧化应激引发小鼠DNA损伤和肝损伤。纳米(Lond)。2014; 9(9): 1423 - 34。https://doi.org/10.2217/nnm.13.100.
添加剂EPanel oF,调味品,Younes M, Aquilina G, Castle L, Engel K-H,等。二氧化钛(E171)作为食品添加剂的安全性评价。欧洲食品安全杂志,2021;19(5):e06585。https://doi.org/10.2903/j.efsa.2021.6585.
郭旭,李勇,闫娟,Ingle T, Jones MY, Mei N,等。银纳米颗粒的尺寸和涂层依赖的细胞毒性和遗传毒性使用体外标准试验进行评估。纳米毒理学。2016;10(9):1373 - 84。https://doi.org/10.1080/17435390.2016.1214764.
李勇,陈德华,闫娟,陈勇,Mittelstaedt RA,张勇,等。用Ames试验和体外微核试验评价银纳米颗粒的遗传毒性。Mutat res 2012;745(1-2): 4-10。https://doi.org/10.1016/j.mrgentox.2011.11.010.
杨晓燕,杨晓燕,杨晓燕,等。聚乙烯吡咯烷酮包被银纳米颗粒在BEAS 2B细胞中的遗传毒性。毒理学。2013;38 - 48。313 (1):https://doi.org/10.1016/j.tox.2012.09.014.
Gábelová A, El Yamani N, Alonso TI, Buliaková B, Srančíková A, Bábelová A,等。纳米银的纤维状结构是其致突变性和致癌性的基础,而表面化学性质则影响了氧化铁纳米颗粒的生物安全性。诱变。2016;32(1):193 - 202。https://doi.org/10.1093/mutage/gew045.
李勇,Bhalli JA,丁伟,闫娟,Pearce MG, Sadiq R,等。银纳米颗粒对小鼠的细胞毒性和遗传毒性评价。纳米毒理学。2014;8 (sup1): 36-45。https://doi.org/10.3109/17435390.2013.855827.
辛格SP, Rahman MF, Murty US, Mahboob M, Grover P.纳米和微米氧化铁急性口服治疗后大鼠遗传毒性和组织分布的比较研究。中国药物学杂志。2013;26(1):457 - 457。https://doi.org/10.1016/j.taap.2012.10.016.
Senapati VA, Kumar A, Gupta GS, Pandey AK, Dhawan A. ZnO纳米颗粒诱导人血细胞炎症反应和遗传毒性:一种机制方法。食品化学毒物。2015;85:61-70。https://doi.org/10.1016/j.fct.2015.06.018.
杜玛拉,曼格拉姆帕利,陈德华,马胡布,等。氧化镍纳米颗粒在雌性Wistar大鼠急性口腔暴露后的遗传毒性研究。诱变。2017;32(4):417 - 27所示。https://doi.org/10.1093/mutage/gex007.
秦德,杜玛拉,马赫曼,马博,等。氧化钨纳米颗粒在大鼠急性口腔暴露后的毒理学评估。环境科学学报,2017;24(15):13576-93。https://doi.org/10.1007/s11356-017-8892-x.
陈德华,陈志伟,陈志伟,等。纳米和微米级氧化钨反复口服Wistar大鼠28 d后的毒理学评价。中国生物工程学报。2017;819:1-13。https://doi.org/10.1016/j.mrgentox.2017.05.003.
潘雅娜,陈德华,陈志伟,陈志伟。纳米氧化钇对大鼠急性口服治疗后的遗传毒性和生物分布的评价。应用毒理学杂志,2017;37(12):1379-95。https://doi.org/10.1002/jat.3505.
潘雅娜,秦德,史文杰,马博,等。氧化钇纳米和微粒在Wistar大鼠反复口服28天后毒理学评估的比较研究。诱变。2019;34(2):181 - 201。https://doi.org/10.1093/mutage/gey044.
罗泽,Catalán J, Järventaus H, Lindberg HK, Suhonen S, Vippola M,等。氧化锌颗粒大小和分散状态对人支气管上皮细胞细胞毒性和遗传毒性的影响。毒理学环境诱变剂。2016;805:7-18。https://doi.org/10.1016/j.mrgentox.2016.05.008.
代理电子商务。关于科学评价镍及其化合物职业接触限值的意见2018。可以从:https://echa.europa.eu/documents/10162/13641/nickel_opinion_en.pdf/9e050da5-b45c-c8e5-9e5e-a1a2ce908335.
E委员会,SA就业和包容总司。化学制剂职业接触限值推导方法:职业接触限值科学委员会(SCOEL) 2017年一般决策框架:出版物办公室;2018.
Manshian BB, Jenkins GJ, Williams PM, Wright C, Barron AR, Brown AP,等。单壁碳纳米管:与物理化学性质相关的差异基因毒性潜能。纳米毒理学。2013;7(2):144 - 56。https://doi.org/10.3109/17435390.2011.647928.
Catalán J, Siivola KM, Nymark P, Lindberg H, Suhonen S, Järventaus H,等。直碳纳米管与缠结多壁碳纳米管在体内和体外的基因毒性效应。纳米毒理学,2016;10(6):794 - 806。https://doi.org/10.3109/17435390.2015.1132345.
Louro H, Pinhão M, Santos J, Tavares A, Vital N, Silva MJ。评价基准多壁碳纳米管的细胞毒性和遗传毒性效应与它们的物理化学性质。毒理学杂志2016;262:123-34。https://doi.org/10.1016/j.toxlet.2016.09.016.
Tavares AM, Louro H, Antunes S, Quarré S, Simar S, De Temmerman PJ,等。纳米二氧化钛、合成无定形二氧化硅和多壁碳纳米管在人淋巴细胞中的遗传毒性评价。毒理学杂志。2014;28(1):60-9。https://doi.org/10.1016/j.tiv.2013.06.009.
Catalán J, Rydman E, Aimonen K, Hannukainen KS, Suhonen S, Vanhala E,等。纳米纤颤纤维素在小鼠肺中的遗传毒性和炎症作用。诱变。2017;32(1):23-31。https://doi.org/10.1093/mutage/gew035.
Pothmann D, Simar S, Schuler D, Dony E, Gaering S, Le Net JL,等。在对大鼠进行90天纯鼻吸入暴露后,对工业多壁碳纳米管进行彗星和微核分析,发现肺部炎症和缺乏遗传毒性。纤维毒物。2015;12:21。https://doi.org/10.1186/s12989-015-0096-2.
Christophersen DV, Jacobsen NR, Andersen MH, Connell SP, barford KK, Thomsen MB,等。多壁碳纳米管对apoe缺陷小鼠口腔和肺部暴露的心血管健康影响毒理学。2016;371:29-40。https://doi.org/10.1016/j.tox.2016.10.003.
Honda K, Naya M, Takehara H, Kataura H, Fujita K, Ema M.大鼠单次气管内灌注后长、短单壁碳纳米管104周肺毒性评估。吸入毒物。2017;29(11):471-82。https://doi.org/10.1080/08958378.2017.1394930.
巡警AK,侯赛因SM,施拉格JJ,巡警S,春乌PB。功能化和非功能化多壁碳纳米管在瑞士韦伯斯特小鼠骨髓细胞中破片性的比较研究。环境毒理。2010;25(6):608-21。https://doi.org/10.1002/tox.20621.
帕特拉AK,帕特拉PK,比目鱼M,春乌PB。功能化单壁碳纳米管在小鼠骨髓细胞中的细胞遗传学评价。环境毒理学杂志,2016;31(9):1091-102。https://doi.org/10.1002/tox.22118.
Møller P.使用彗星法测量哺乳动物细胞中氧化损伤DNA:有效性、可靠性和可变性的反映。突变Res/Genet毒理学环境诱变剂。2022;873:503423。https://doi.org/10.1016/j.mrgentox.2021.503423.
Nelson BC, Wright CW, Ibuki Y, Moreno-Villanueva M, Karlsson HL, Hendriks G,等。高通量纳米材料基因毒理学的新兴计量学。诱变。2017;32(1):215 - 32。https://doi.org/10.1093/mutage/gew037.
项目N. NANoREG D5.07 SOP 16基于高含量分析的纳米毒性评估2017。可以从:https://www.rivm.nl/sites/default/files/2018-11/NANoREG%20D5.07%20SOP%2016%20High%20Content%20Analysis-based%20nanotoxicity%20assessment.pdf.
酒井A,佐佐木K,林林K,村松D,新井S,恩斗N,等。用于预测化学致癌性的Bhas 42细胞转化试验的国际验证研究。Mutat Res. 2011;725(1-2): 57-77。https://doi.org/10.1016/j.mrgentox.2011.07.006.
Comandella D, Gottardo S, Rio-Echevarria IM, Rauscher H.纳米材料物理化学数据质量:数据完整性和可变性的评估。纳米级。2020;12(7):4695 - 708。https://doi.org/10.1039/c9nr08323e.
Braakhuis HM, Park MVDZ, Gosens I, De Jong WH, Cassee FR.影响肺部炎症的纳米材料的物理化学特性。纤维毒性。2014;11(1):18。https://doi.org/10.1186/1743-8977-11-18.
卜伟辉,马霍克,李志强,等。一种综合的测试和评估方法,以支持吸入暴露后纳米材料的分组和解读。应用于体外毒理学。2021;7(3):112-28。https://doi.org/10.1089/aivt.2021.0009.
雅各布MN, Colacci A, Corvi R, Vaccari M, Aguila MC, Corvaro M,等。化学致癌物安全性测试:经合组织专家组关于制定化学非遗传毒性致癌物测试和评估综合方法的国际共识。中国生物医学工程学报。2020;94(8):2899-923。https://doi.org/10.1007/s00204-020-02784-5.
欧洲C,就业总局SA,包容。化学制剂职业接触限值推导方法:职业接触限值科学委员会(SCOEL) 2017年一般决策框架:出版物办公室;2018.
张志刚,张志刚,张志刚,等。在体外上皮屏障模型中,少层石墨烯可诱导原发性和继发性遗传毒性。纳米生物技术,2021;19(1):24。https://doi.org/10.1186/s12951-021-00769-9.
文图拉C, Lourenço AF, Sousa-Uva A, Ferreira PJT, Silva MJ。评价纤维素纳米纤维在人肺上皮细胞和单核细胞来源的巨噬细胞共培养中的遗传毒性。毒理学杂志2018;291:173-83。https://doi.org/10.1016/j.toxlet.2018.04.013.
Gonzalez L, Cundari E, Leyns L, kirch - volders M.迈向纳米基因毒理学的新范式:面对纳米材料细胞相互作用和影响的复杂性。基础临床药物学。2017;121(S3): 23-9。https://doi.org/10.1111/bcpt.12698.
Clift MJD, Jenkins GJS, Doak SH.降低工程纳米材料对人类健康风险的另一种观点。小。2020;16(36):2002002。https://doi.org/10.1002/smll.202002002.
Doak SH, Clift MJD, Costa A, Delmaar C, Gosens I, Halappanavar S,等。实现欧洲委员会的纳米材料可持续化学战略之路——新方法方法的巡逻视角。小。2022;18 (17):e2200231。https://doi.org/10.1002/smll.202200231.
资金
该研究已获得欧盟“地平线2020”纳米信息项目研究和创新计划的资助,资助协议号为814426。
作者信息
作者及隶属关系
贡献
KMS、MJB、JC进行文献检索;KMS、MJB、MJDC、SHD和JC建立了测定特异性标准集;采用KMS、MJB、BS-M对文献结果进行质量评价;KMS和MJB审查了符合条件的研究;BS-M进行数据库检索和质量评估;KMS, MJB, BS-M和JC在MJDC和SHD的输入下撰写了手稿。所有作者都阅读并批准了最终的手稿。
相应的作者
道德声明
伦理批准并同意参与
这项研究既不涉及在动物身上进行的研究实验,也不涉及对人类样本的分析。
发表同意书
不适用。
相互竞争的利益
作者宣称他们之间没有利益冲突。
额外的信息
出版商的注意
伟德体育在线施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条所提供的资料,除非在资料的信用额度中另有说明。
关于本文
引用本文
西沃拉,k.k.,伯格姆,m.j., Suárez-Merino, B。et al。纳米材料遗传毒性研究的系统质量评价和综述:监管视角。部分纤维毒物19, 59(2022)。https://doi.org/10.1186/s12989-022-00499-2
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12989-022-00499-2
关键字
- 基因毒性
- 诱变
- 纳米粒子
- 纳米纤维
- 纳米管
- 质量
- 可靠性
- 相关性
- 数据库
- 化验