摘要
背景
流行病学新出现的证据表明,人类暴露于环境中存在的一些纳米材料将有助于阿尔茨海默病(AD)的发病和/或进展。然而,纳米颗粒对神经元产生不良影响并参与AD病理的细胞和分子机制尚不清楚。
结果
在这里,我们提供了二氧化钛(TiO2)和炭黑(CB)纳米颗粒(NPs)结合细胞形式的朊病毒蛋白(PrPC),是一种质膜蛋白,因其在朊病毒疾病和朊病毒样疾病(如AD)中的作用而闻名。TiO之间的相互作用2-或CB-NPs和PrPC在培养物中生长的神经元细胞表面会腐蚀PrPC信号的功能。这会触发PrPC依赖于NADPH氧化酶的激活,随后产生改变氧化还原平衡的活性氧(ROS)。透过PrPC相互作用,NPs还促进3-磷酸肌醇依赖性激酶1 (PDK1)的激活,这反过来刺激神经保护TACE α-分泌酶的内化。这转移了TACE切割活性,使其远离(i) TNFα受体(TNFR),其在质膜上的积累增加了np暴露的神经元细胞对TNFα相关炎症的脆弱性,和(ii)淀粉样前体蛋白APP,导致神经毒性淀粉样Aβ40/42多肽的过度生产。PrP的沉默C或者对PDK1的药理学抑制可以保护神经元细胞免受TiO的侵害2-和CB-NPs对ROS产生、TNFα超敏性和Aβ的影响上升。最后,我们证明了PrP的失调C-PDK1-TACE通路可能发生在注射TiO的小鼠大脑中2当我们监测位于不同大脑区域的几组神经元细胞表面TNFR的升高时,脑室内通路的-NPs。
结论
因此,我们的体外和体内研究首次确定了正常细胞朊病毒蛋白PrPC作为TiO的神经元受体2-和CB-NPs并识别PrPC通过这些纳米颗粒改变氧化还原平衡,增强神经元对神经炎症的内在敏感性,并引发a β肽的上升。通过识别TiO失调的信号级联2-和CB-NPs,我们的数据阐明了人类接触某些NPs可能与AD有关。
背景
世界范围内神经退行性疾病发病率的增加被怀疑与人类接触各种污染物的增加有关。这包括一些纳米尺寸的材料,即所谓的纳米粒子(NPs),它们显示出容易跨越生理障碍和与生物系统高度反应的能力(有关综述,请参阅[1]及其中的参考资料)。掺入的NPs是存在于空气中的超细颗粒物,但也有制造的NPs,如银,无定形二氧化硅,二氧化钛(TiO2)和炭黑(CB)纳米颗粒,市场上的炭黑数量每年都在增加,这对工人和消费者都有影响([2],如欲查阅,请参阅[3.]及其中的参考资料)。鉴于NP在日常产品(如食品、化妆品、颜料工业等)中的应用多样性以及这些产品释放的NPs,人类经常通过吸入、摄入和/或皮肤途径暴露于这些纳米颗粒。长期接触NPs,即使是低剂量,也会增加NPs转移到大脑的频率,从而增加NPs参与大脑疾病,包括神经退行性疾病的可能性(回顾,见[1]及其中的参考资料)。
根据经济合作与发展组织的数据,阿尔茨海默病(AD)是人类最常见的痴呆症,其负担自1990年以来不断增加,目前全球有5000万人受到影响[4].这种神经退行性疾病由于神经毒性淀粉样蛋白Aβ肽在大脑中以老年斑的形式积累和沉积,慢慢破坏记忆和思维能力。Aβ肽起源于淀粉样前体蛋白(APP)的淀粉样β-和γ-分泌酶的蛋白水解过程[5].在AD受试者中,Aβ肽的过量产生取决于几个事件或多或少同时发生,即。, APP表达增加,淀粉样APP加工增加[6,7], α-分泌酶减少保护性APP切割[8,9],和/或a β降解酶的损伤[10].例如,流行病学和实验研究表明,人类接触环境化学污染物,如农药或金属,与痴呆症和痴呆的风险增加有关特发性晚年AD(回顾,见[11]及其中的参考文献,[12,13,14])。这主要与这些化学物质增加Aβ水平、促进Aβ42的聚集和原纤维以及破坏Aβ清除的能力有关[14].最近,空气中的纳米颗粒物质也被认为与阿尔茨海默病有关,因为生活在空气污染的墨西哥城的年轻人在他们的脑干中表现出阿尔茨海默病的病理迹象[15].然而,环境超细颗粒物(空气动力学直径< 100纳米)的复杂组成使空气中的纳米颗粒影响神经系统的机制分析变得困难。由于空气中的纳米颗粒主要由碳质材料构成,因此工程炭黑纳米颗粒(CB-NPs)有时被用作空气中的纳米颗粒的替代品[16].这种工程的CB-NPs显示出比空气中的纳米颗粒更均匀和更明确的物理化学成分和类似的形态。这意味着,在职业或环境人类暴露的背景下,工程NPs也会刺激AD的发病和/或促进AD的进展[1].
其中产量最大的工程NPs(所有外部尺寸< 100nm)是炭黑(CB-NPs)和二氧化钛(TiO2-NPs)纳米粒子[17].人造CB-NPs广泛用于橡胶和黑色颜料。尽管吸入的CB-NPs在小鼠体内具有有害作用,但CB-NPs对脑功能的影响和CB-NPs的神经毒性仍然没有明确的特征,值得进行更多的研究。据报道,在给药后,成年小鼠单次暴露于纯CB-NPs不会改变中枢神经系统(CNS)中IL-1β促炎细胞因子的水平[18].当怀孕小鼠通过气道暴露于CB-NPs时,子代小鼠会出现神经毒理学症状,包括反应性星形胶质细胞增生[19]以及血管周围富含β-sheet蛋白的增加[20.].关于纳米TiO2粒子,TiO2-NPs是金属氧化物纳米颗粒,广泛应用于食品和化妆品行业,由于其光催化活性,可作为白色颜料的改性剂/增强剂,紫外线阻断剂或抗微生物剂。至于其他金属NPs可以通过嗅觉和/或三叉神经以及体循环到达小鼠和人类的中枢神经系统[21,22,23), TiO2-NPs可以穿过血脑屏障并在大脑中积聚[24,25],尤其是在海马体中[26],这是一种参与记忆过程的大脑结构,在AD中受到早期和严重的影响[27].在海马体中,不同形式的TiO2-NPs被证明会产生一些不良影响,如氧化应激、线粒体功能障碍、胶质细胞增生,并引发神经元损伤[1,28,29,30.].利用重构神经元网络,TiO2-NPs也被报道严重损害神经元的电活动[31].然而,CB-和TiO2-NPs影响神经元内稳态并将神经元置于退化路径尚不清楚。
细胞朊病毒蛋白(PrPC),因其不仅可用于朊病毒疾病而闻名(有关综述,请参阅[32]和其中的参考文献),还有阿尔茨海默病[9,30.,33].PrPC是一种普遍存在的蛋白质,主要在神经元中表达,通过糖基磷脂酰肌醇(GPI)部分连接到质膜的外叶,分布在耐洗涤剂的微域,即。脂筏或脂囊[34].在1C11神经元干细胞系的帮助下,可以分化成血清素能(1C11−5 HT)或去甲肾上腺素能(1C11 .不)神经元经适当诱导后[35],我们为gpi锚定的PrP分配了一个信令功能C,作为细胞表面受体或辅助受体[36]并控制不同的信号效应器[37].这包括NADPH氧化酶和随后产生的有助于氧化还原敏感靶标活化的无毒ROS [38,39].我们进一步证明了PrPC与淀粉样朊病毒肽106-126的相互作用破坏PrPCNADPH氧化酶的过度刺激和氧化应激条件的发生在神经元细胞中的信号传导[40].最近,我们证明了PrPC与神经毒性朊病毒(PrPSc)或Aβ肽和随后的PrP调节异常C信号分别在朊病毒感染或阿尔茨海默氏症神经元的质膜上取消了TACE α-分泌酶(ADAM17)的神经保护性切割活性[9,41].这种TACE失调使患病神经元对tnf α相关炎症高度敏感,并放大PrP的产生ScAβ肽在AD中的作用以及在朊病毒疾病中的作用[9,42].因为PrPC结合PrP的寡聚物、聚集物和/或原纤维Sc朊病毒疾病[43],以及AD中Aβ肽的寡聚物[33,44,45],细胞朊病毒蛋白被怀疑在更广泛的意义上作为一种广泛的传感器,用于检测各种淀粉样蛋白的聚合体[46].值得注意的是,许多NPs的物理化学性质使它们能够在生物流体中形成聚集物/团聚体[17].专注于TiO2-和CB-NPs,本研究调查PrPC也将是神经元细胞表面受体的聚集/凝聚这些纳米颗粒。TiO之间的相互作用2-或CB-NPs和PrPC会腐败人民党C-偶联信号效应,导致神经元细胞功能障碍和阿尔茨海默病分子体征的诱导。
结果
TiO2和CB纳米颗粒结合重组细胞朊蛋白PrPC
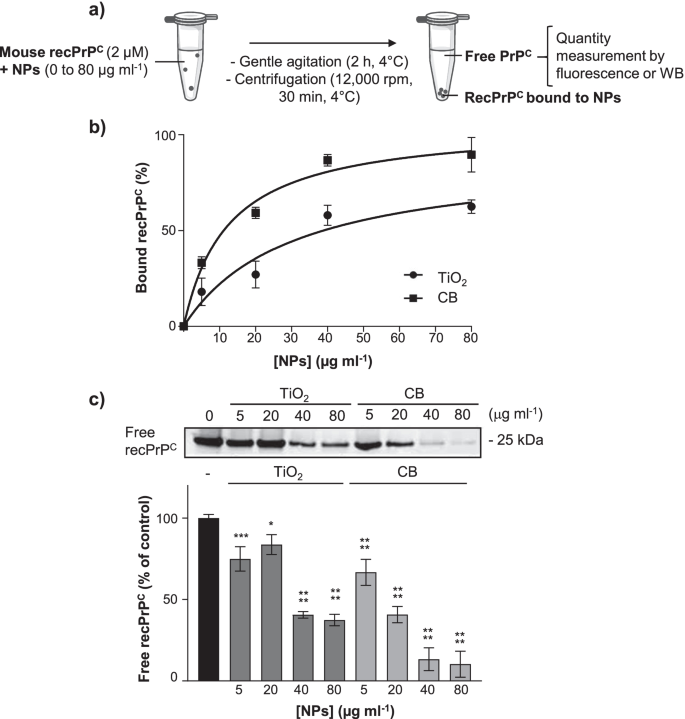
首先要评估TiO2- (P25)或CB- (FW2) NPs与细胞朊病毒蛋白PrP相互作用C,我们使用商业全长重组小鼠PrP折叠成PrP进行体外结合试验C.PrPC(2 μ M)在4°C下孵育2 h,增加TiO浓度2-或CB-NPs(0-80µg ml−1)(附加文件1:表S1)在轻度搅拌下。然后将混合物以13,523 g离心30分钟,并保留PrPC利用PrP的本征荧光对上清液中的游离分子进行滴定C(λexc= 280 nm;λ新兴市场= 340 nm)。PrP的数量C通过减去滴定后游离PrP的荧光水平,推导出与纳米颗粒的结合C到PrP的荧光水平C(2µM)在不含纳米颗粒的情况下测量(图。1一)。1b表示两个TiO2-和CB-NPs与重组全长PrP相互作用C.PrP的数量C与纳米颗粒结合的纳米颗粒浓度随纳米颗粒浓度的变化呈现符合相互作用平衡的双曲曲线C= PrPC(NP)。滴定数据的双曲拟合表明PrP亲和CCB (K)D12.4±2.2µg ml−1)比用TiO测量的高2(KD30.4±10.9 μ g ml−1).
TiO2CB纳米颗粒与PrP相互作用C.一个评估全长重组小鼠PrP相互作用的实验程序示意图C(recPrPC, 2µM)和TiO2-或CB-NPs(0-80µg ml−1)利用PrP的固有荧光C或者通过western blotting (WB)。b荧光滴定曲线显示了TiO的结合2-或CB-NPs到全长小鼠recPrPC.recPrP的数量C通过减去滴定后游离PrP的荧光水平,推导出与纳米颗粒的结合C到总PrP的荧光水平C在没有纳米颗粒的情况下测量。采用Kaleidagraph软件(Abelbeck Software)计算拟合双曲曲线。c代表性Western-blot和定量直方图显示游离recPrP减少C在recPrP之间的离心反应介质的上清液中的量C和TiO2-或CB-NPs。实验共进行3次,每次重复3次。数值为平均值±SEM。*表示p< 0.05, ***p< 0.001, ****p< 0.0001相对于recPrPC无纳米颗粒孵育
为了排除游离纳米颗粒,PrP会被淬火C荧光导致高估与PrP结合的纳米颗粒的数量CWestern blotting检测重组游离PrP水平C离心后存在于上清液中。PrP的定量C水平证实了TiO2-和CB- nps都与蛋白质相互作用,对CB的亲和力比对TiO强2(无花果。1c)。
这些体外实验数据表明TiO2CB纳米颗粒是两种化学成分和物理化学性质不同的NPs [17,47],两者都绑定PrPC.
PrPC促进TiO的绑定2和炭黑纳米颗粒到1C11前体和血清素能1C11的质膜−5 HT神经细胞
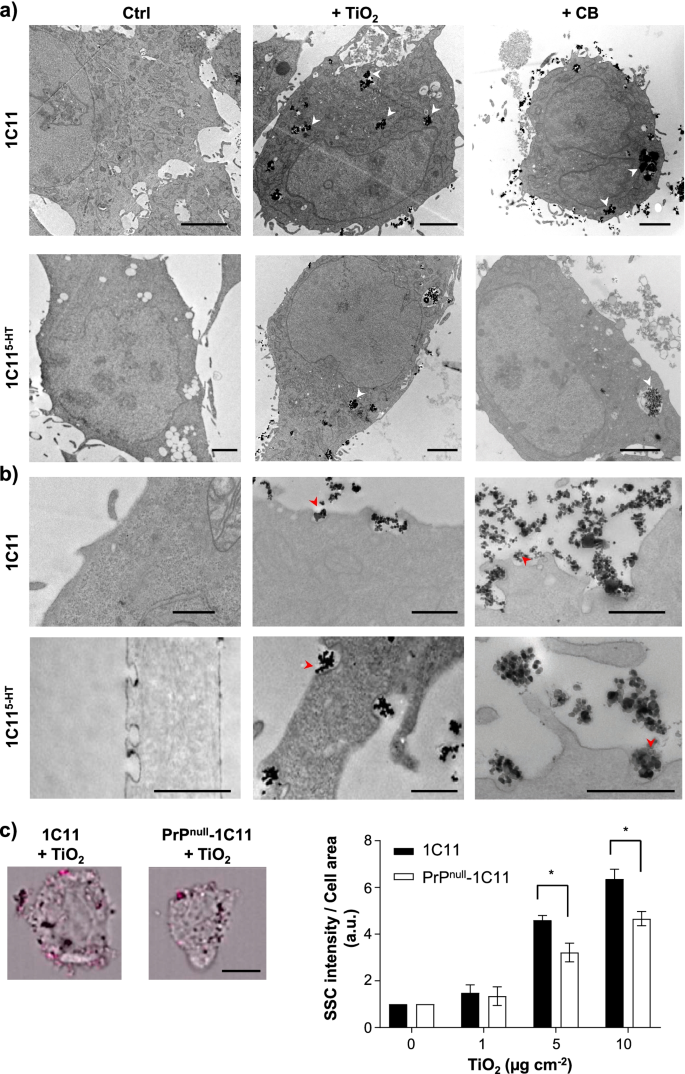
对下一步探测是否TiO2-和CB-NPs会与PrP相互作用C在细胞表面,我们开发了1C11神经外胚层细胞系,这是一种神经干细胞,具有分化为血清素能1C11的能力−5 HT神经元细胞经适当诱导[48].无论微分状态是什么−5 HT细胞内源性表达PrPC在细胞表面相似的水平[49].在第一组实验中,1C11和1C11−5 HT细胞暴露于TiO2-或CB-NPs(10µg cm−224 h后,透射电镜(TEM)分析纳米颗粒的细胞分布。对于这两种类型的纳米颗粒,透射电镜分析显示存在大量的TiO聚集物2-和1C11和1C11内的CB-NPs−5 HT细胞,可能反映了纳米颗粒的内吞作用(图;2a). TiO的小聚集体2-和CB-NPs也附着在1C11和1C11的质膜上−5 HT区域内的细胞类似网格蛋白包被的凹坑和包被的小穴(图。2b),其中PrP .C显著分布[34,48].
PrPC促进纳米颗粒与1C11前体和1C11质膜的相互作用−5 HT神经细胞。一个,b透射电子显微镜实验显示大量的TiO聚集体2-和CB-NPs(白色箭头)在1C11前体细胞和1C11内−5 HT神经细胞一个以及TiO的小聚集体2-和CB-NPs(红色箭头)在1C11和1C11的质膜上−5 HT细胞b24 h后暴露于10µg cm−2纳米粒子。比例尺bar = 2µm in一个.比例尺= 0.5 μ m inb.c基于光散射的相互作用TiO的FACS分析2-表面为1C11和PrP的nps零-1C11细胞暴露至10µg cm−2纳米粒子。(左)1C11和PrP的代表性亮场图像零-1C11细胞暴露于5µg cm−2TiO2-NPs与TiO的光散射信号合并2-NPs(粉红色信号)在细胞内掩蔽后被吸附到质膜上(见方法)。(右)TiO的量化直方图2-NPs存在于1C11和PrP表面零1 c11细胞。比例尺bar = 5µm。实验共进行3次,每次重复3次。数值为平均值±SEM。*表示p与暴露于纳米颗粒的1C11细胞相比< 0.05
探讨PrPC将有助于纳米颗粒与1C11细胞质膜的相互作用,我们利用了TiO2-NPs和PrP零-1C11细胞是慢性PrP抑制的1C11细胞C至少95%的表达[50].为了避免纳米颗粒被细胞内吞,PrP零-1C11细胞及其PrPC表达的小鼠暴露在不断增加的TiO浓度中2-NPs(0-10µg cm−2)在PBS加叠氮化物(0.05%)中4°C浸泡15分钟。TiO2用流式细胞仪滴定质膜上吸附的-NPs [51].由于该方法灵敏度低,有明显的TiO相互作用2-NPs与PrPC-表达的1C11细胞开始被TiO检测到2-NP浓度高于1µg cm−2.TiO的量2-NPs附着在1C11细胞表面的数量随着TiO的增加而增加2-NP暴露浓度(图;2c).值得注意的是,TiO大团聚体的形成2-NPs浓度大于10µg cm−2使得用流式细胞仪探测纳米颗粒与细胞的相互作用成为不可能。由于这种技术限制,TiO21C11细胞表面的-NP结合从未达到一个平台,尽管膜有饱和的趋势(图11)。2c).与PrP零-1C11细胞,我们显示TiO减少~ 25-30%2-NP与质膜结合,无论测试的纳米颗粒浓度与PrP相比C-表达1C11细胞(图;2c),表示PrPC参与TiO的交互作用2-NPs与1C11细胞。
TiO2和CB纳米颗粒选择性结合全长PrPC
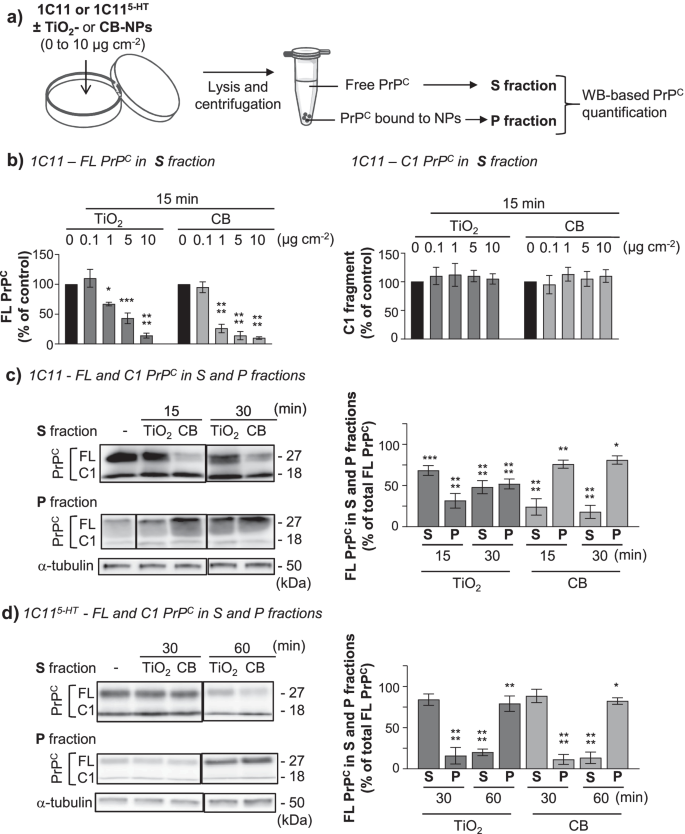
在质膜上存在多种PrP异构体C,即全长PrPC和截断的PrPC残基111/112之间(也称为PrPCC1片段)。全长和截短PrPC可以是非糖基化,单糖基化,或双糖基化(回顾,见[52]及其中的参考资料)。以评估哪些PrPCTiO的目标是异构体2-或CB-NPs,细胞暴露于0-10µg cm−2纳米颗粒(附加文件)2:图S1),在37°C下,从15到60分钟溶解。细胞裂解液在21,130 g离心分离游离可溶性PrPC在PrP的上清液(S部分)中C被颗粒中的纳米颗粒捕获(P部分)。对两个组分进行PrP检测CPNGase处理后Western-blotting去除糖基化(图。3.一个)。
TiO2-和CB-NPs专门与全长PrP相互作用C在1C11神经元细胞系中一个实验程序的示意图,以评估的相互作用的TiO2-和CB-NPs与PrPC在1C11前体细胞的质膜和它们的血清素能1C11上表达−5 HT通过western blotting研究神经元后代。b定量直方图从Western-blot实验推导出显示全长(FL) PrP的数量C(左)和C1片段(右)的上清液(S部分)后裂解1C11细胞暴露于增加浓度的TiO2-或CB-NPs(0至10µg cm−2) 15分钟,裂解物离心。c,d代表性的western -blot和定量直方图显示FL PrP水平的时间变化C从1C11衍生出的S和P组分中的C1片段c和1 c11−5 HTd暴露于TiO的细胞2-或CB-NPs(1µg cm−2).α-微管蛋白用于PrP的归一化CS分数的水平。实验共进行3次,每次重复3次。数值为平均值±SEM。*表示p< 0.05, **p< 0.01, ***p< 0.001, ****p与未暴露细胞相比< 0.0001
对于1C11前体细胞,我们观察到全长(FL) PrP的耗竭C在暴露15分钟时,S分数从1µg cm开始−2TiO2-或CB-NPs(图;3.b,左)。FL - PrP下降CS分数的含量取决于纳米颗粒的浓度:TiO的浓度较高2-和CB-NPs,更明显的是FL PrP的降低C(图。3.b,左)。用10µg cm−2TiO2-或CB-NPs, FL PrPC在暴露于纳米颗粒15分钟后,在S分数中几乎检测不到(图;3.b,左)。相比之下,无论NPs的浓度如何,C1片段的水平保持不变。3.b,对吧)。这表示TiO2-和CB-NPs与全长PrP特异性相互作用C.
值得注意的是,随着质膜FL PrP的耗竭CTiO诱导2-和CB-NPs在5µg cm时非常强−2和较高的纳米颗粒浓度,可能会影响PrP的鉴定C-耦合信号通路被纳米颗粒失调。在接下来的实验中,我们决定固定使用的TiO浓度2-和CB-NPs至1µg cm−2.在这些条件下,FL-PrP的消耗C由1C11细胞暴露于TiO诱导2-NPs(1µg cm−2)在15和30分钟时,比CB-NPs观察到的更明显(图。3.c).相反,FL PrP的量C与TiO相比,CB-NPs对1C11细胞P部分的积累更为重要2nps(无花果。3.c).这表明PrPC在1C11细胞的质膜上,对CB-的亲和力高于对TiO的亲和力2-NPs,与微分K一致D用重组PrP测量的值C(无花果。1b)。
1 c11−5 HT暴露于1µg cm的神经元细胞−2TiO2-或CB-NPs,我们还在FL PrP的S分数中显示了特异性消耗CC1片段水平的不变性(图。3.d).相反,FL PrPC发现在P片段中积累,而C1片段几乎检测不到(图。3.d).与1C11前体细胞相比(图;3.c),我们观察到纳米颗粒与FL PrP相互作用的时滞C由1C11表示−5 HT神经元细胞:FL PrPCS分数的消耗和FL PrP的相互积累CP分数(图;3.d)在暴露于TiO 30 - 60分钟之间开始2-或CB-NPsvs。15分钟1C11前体(图;3.c). 1C11祖细胞与1C11的差异−5 HT神经元细胞可能反映了全长PrP的一些神经特异性C这可能是在近端细胞区域化水平(somavs。神经突)和质膜亚定位(筏vs。非筏),糖基化,和/或PrP的相互作用组C[34,52].
综上所述,这些数据支持了全长PrPC由1C11前体细胞及其血清素能神经元子代表达,是TiO的候选受体2-和CB-NPs。
TiO的相互作用2CB纳米颗粒与PrPC促进1C11细胞系中NADPH氧化酶依赖性活性氧的产生
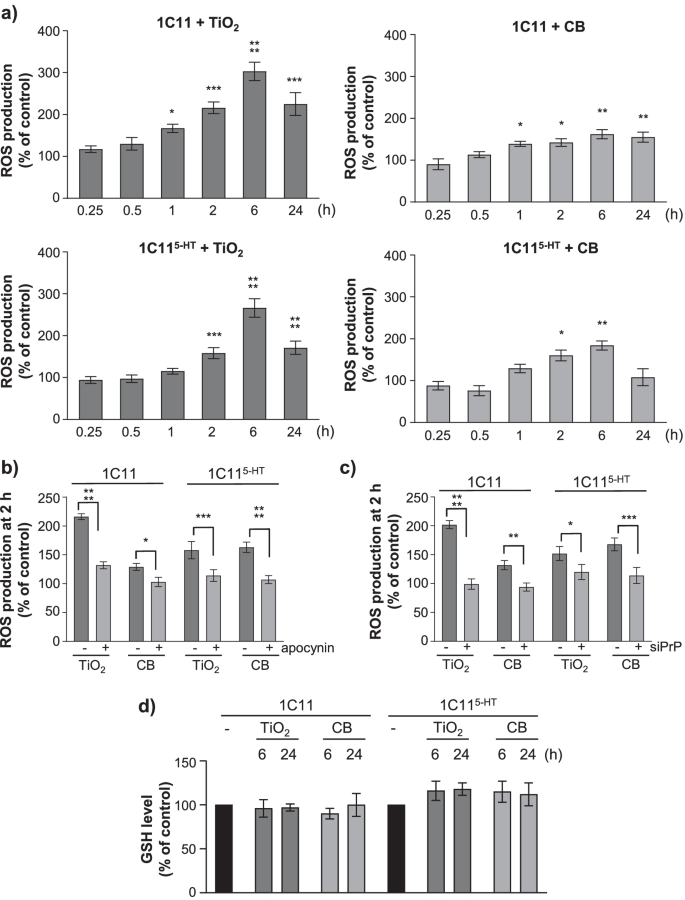
因为纳米颗粒暴露会引起上皮细胞的氧化应激条件[17]并引发小鼠大脑的氧化损伤[28,30.],我们检测了纳米颗粒是否与全长PrP相互作用C会打扰PrP吗C-NADPH氧化酶的功能关系[38],促进ROS的积累。
1C11前体细胞及其血清素能1C11−5 HT神经元后代暴露于1µg cm−2TiO2-或CB-NPs在37°C下放置15分钟至24小时。用荧光探针CM-H测定细胞ROS水平2DCFDA检测超氧阴离子和过氧化氢。曝光1C11或1C11−5 HTcell to TiO2-或CB-NPs触发的ROS生成随时间而变化(图。4a).无论哪种纳米颗粒,在1C11细胞暴露1小时后开始产生ROS,在1C11细胞暴露2小时后开始产生ROS−5 HT神经元细胞和峰值在6小时在两种细胞类型。与细胞分化阶段无关,TiO诱导的ROS反应最大2- nps是基础水平的2.5- 3倍。使用CB-NPs时,ROS产生的强度不如使用TiO时重要2-在1C11和1C11中,最大ROS反应比基础水平高1.5- 1.8倍−5 HT细胞,分别。
TiO2以及CB纳米颗粒与PrP的相互作用C促进NADPH氧化酶依赖性ROS的产生。一个TiO暴露诱导ROS生成动力学2-和CB-NPs(1µg cm .−2)−5 HT神经细胞。bNADPH氧化酶参与np诱导的ROS产生(1µg cm−22 h)使用NADPH氧化酶抑制剂夹桃苷(500µM)。c定量直方图显示基于sirna的PrPC沉默(siPrP)可以消除TiO诱导的ROS生成2-或CB-NPs(1µg cm−22小时)在1C11和1C11−5 HT细胞。dGSH水平在1C11和1C11保持不变−5 HT暴露于TiO的神经元细胞2-或CB-NPs(1µg cm−2)持续24 h。试验共进行3次,每次3个重复。数值为平均值±SEM。*表示p< 0.05, **p< 0.01, ***p< 0.001, ****p与未暴露细胞相比< 0.0001
对于两个TiO2炭黑纳米颗粒(1µg cm−2),诱导的ROS生成在1C11和1C11被猝灭−5 HT当使用药理抑制剂罗布麻苷(500µM)抑制NADPH氧化酶时,细胞(图;4b),表明np诱导的ROS生成依赖于NADPH氧化酶的募集。我们还监测到np诱导的ROS生成在PrP沉默的1C11细胞中被取消C表达式(无花果。4c)支持人民党的腐败C通过TiO与NADPH氧化酶偶联2-和CB-NPs。
最后,我们探讨了在1C11和1C11中纳米颗粒是否会引起ROS水平的升高−5 HT通过使用CellTracker Green CMFDA荧光探针测量还原性谷胱甘肽(GSH)水平,细胞将与氧化应激条件的发生相关。无论暴露时间(6或24小时),1C11或1C11的治疗−5 HT带有TiO的电池2-或CB-NPs(1µg cm−2)不影响谷胱甘肽水平(图;4d),表明暴露于TiO的这种条件2-或CB-NPs不会促进1C11前体细胞及其血清素能神经元衍生物的氧化应激。
总的来说,这些数据表明急性暴露于TiO2- CB-NPs激发PrPC依赖于NADPH氧化酶的激活和短暂的ROS积累,这改变了细胞的氧化还原状态,而不会在1C11细胞系中引发氧化应激条件。
TiO的相互作用2CB纳米颗粒与PrPC渲染1C11和1C11−5 HT通过中和TACE α分泌酶活性对促炎TNFα细胞因子高度敏感的细胞
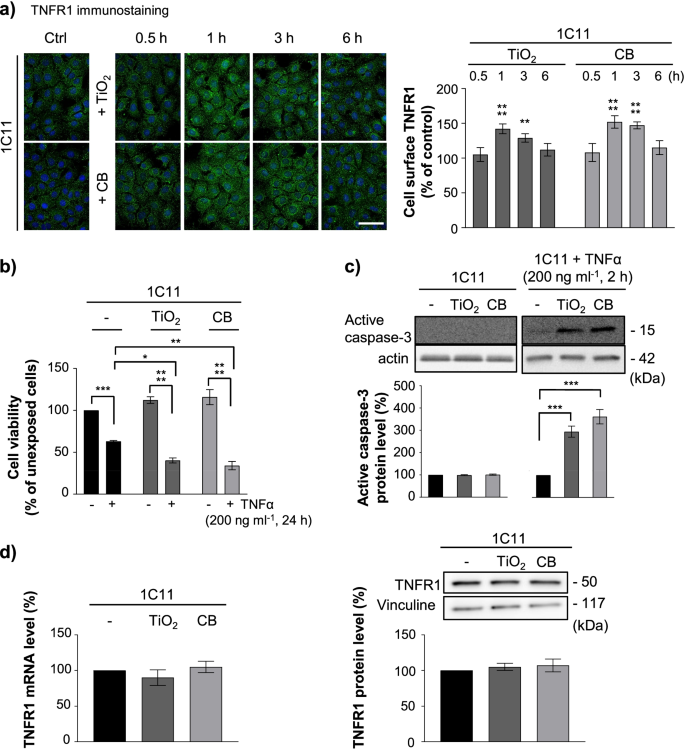
我们接下来评估了TiO2- CB-NPs也会干扰PrPC-PDK1-TACE信号通路[9,53].致病朊病毒PrP对这一途径的调控异常Sc或Aβ肽下调TACE脱落活性,从而导致1型TNFα受体(TNFR1)在质膜上的积累,从而使朊病毒感染和阿尔茨海默氏神经元对TNFα毒性高度敏感[9,41].
1C11前体急性暴露于TiO2-或CB-NPs(1µg cm−230min至6 h)可促进质膜上TNFR1免疫染色1 h的增加。细胞表面TNFR1水平的上升最大(增加~ 50%)vs。在纳米颗粒暴露6小时后,TNFR1水平恢复到基础水平(图2)。5a).用血清素1C11−5 HT暴露于1µg cm的神经元细胞−2TiO2-或CB-NPs时,质膜TNFR1水平在4 h时记录到最大的增加(附加文件3.:图S2a)。细胞表面TNFR1的增加本身不影响暴露于TiO的细胞的活力2-或CB-NPs(1µg cm−2)长达24小时,但使np暴露的细胞对外源性TNFα的毒性非常脆弱(图。5b),即。,启动np暴露细胞TNFα炎症应激。用TiO处理1C11细胞24 h2-或CB-NPs(1µg cm−2)与TNFα (200 ng ml−1),我们确实测量到细胞活力降低了60 - 70%,而仅用TNFα处理1C11细胞的活力降低了40%(图。5b). np暴露的细胞对TNFα敏感性的增加与增强TNFα介导的caspase-3激活有关(图。5c), TNFR1死亡信号的下游效应因子[54].在np暴露的细胞中,TNFR1在质膜上的过度暴露并不是由于TiO诱导TNFR1基因转录或翻译的增强2-或CB-NPs(图;5d)来源于TNFR1的α-分泌酶TACE下脱落。免疫荧光实验显示,暴露于TiO的细胞表面的TACE信号降低(25-35%)2-或CB-NPsvs。未暴露细胞(图;6a,附加文件3.:图S2b)。
TiO2以及CB纳米颗粒与PrP的相互作用C渲染1C11和1C11−5 HT通过促进TNFR1在质膜上的积累,神经元细胞对TNFα的损伤高度敏感。一个TiO作用下1C11细胞质膜上TNFR1升高的动力学2-或CB-NPs(1µg cm−2)和免疫染色TNFR1的相关定量直方图。比例尺bar = 10µm。b生存能力和ccaspase-3在暴露于TiO的1C11细胞中的激活2-或CB-NPs(1µg cm−2)与TNFα (200 ng ml−1).d通过RT-qPCR和Western-blotting检测暴露于TiO的1C11细胞中TNFR1表达水平2-或CB-NPs(1µg cm−2) 1 h。用文青碱进行归一化。实验共进行3次,每次重复3次。数值为平均值±SEM。*表示p< 0.05, **p< 0.01, ***p< 0.001, ****p与未暴露细胞相比< 0.0001
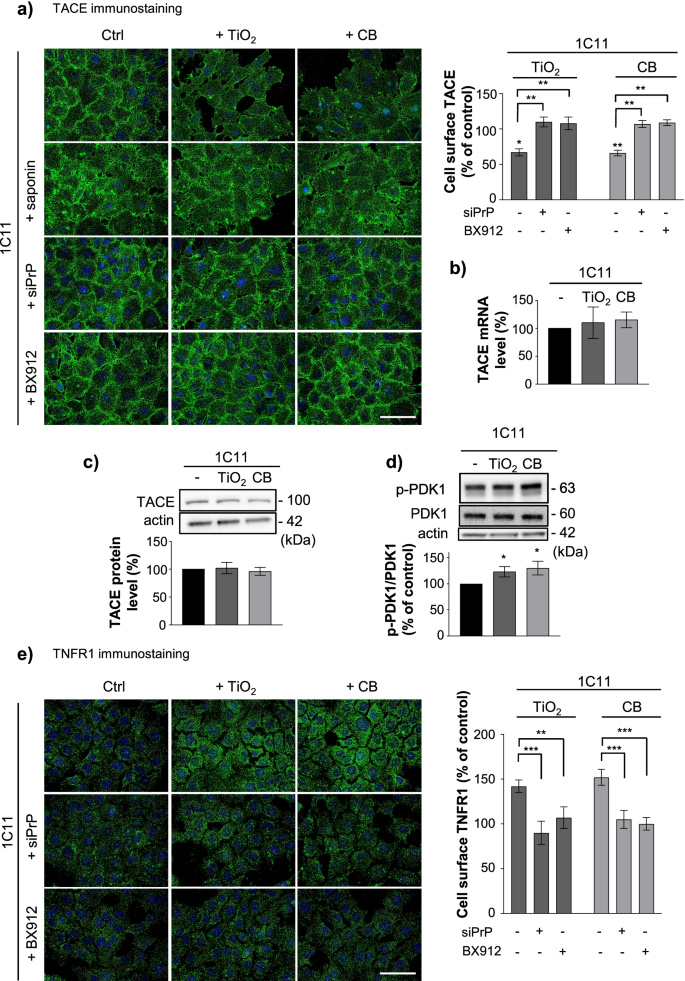
TiO2以及CB纳米颗粒与PrP的相互作用C以pdk1依赖的方式促进TACE内化,这是细胞表面TNFR1过度暴露的根源。一个TiO暴露1C11细胞质膜的TACE免疫染色2-或CB-NPs(1µg cm−2) 1小时,无论是否存在siRNA向PrPC(siPrP)或PDK1抑制剂,BX912(1µM)和相关的定量直方图。皂苷(0.05%)的细胞通透性显示暴露于纳米颗粒的1C11细胞TACE内化。比例尺bar = 10µm。b,cRT-qPCR检测TACE表达水平b和免疫印迹c在暴露于TiO的1C11细胞中2-或CB-NPs(1µg cm−2) 1小时。d通过Western-blotting在暴露于TiO的1C11细胞中评估PDK1 Ser241 (p-PDK1)磷酸化状态2-或CB-NPs(1µg cm−2) 1小时。e对暴露于TiO 1 h的1C11细胞的质膜进行TNFR1免疫染色2-或CB-NPs(1µg cm−2)在是否存在siRNA的情况下向PrP转移C(siPrP)或PDK1抑制剂,BX912(1µM)和相关的定量直方图。比例尺bar = 10µm。实验共进行3次,每次重复3次。数值为平均值±SEM。*表示p< 0.05, **p< 0.01, ***p与未暴露细胞相比< 0.001
然而,在mRNA上没有记录到TACE表达的显著变化(图。6b)和蛋白质(图。6C)暴露于或未暴露于纳米颗粒的细胞之间的水平。用皂苷(0.05%)渗透细胞时,在np暴露的细胞内发现TACE(图5)。6a),表示np诱导的TACE内化。
至于朊病毒感染和阿尔茨海默氏症神经元[9,41],我们发现在np暴露的细胞中TACE内化和随后的TNFR1脱落缺陷依赖于PrPC-介导的PDK1激酶的激活。TiO2-和CB-NPs引起了PDK1活性的上升,根据暴露于纳米颗粒(1µg cm)的1C11细胞中Ser241上磷酸化的PDK1分子数量增加了约1.3倍−2, 1 h)(图6d). sirna介导的PrP沉默C或药理抑制剂BX912抑制PDK1(在NP暴露前1µM抑制30 min)阻止了TACE的内化(图。6a,附加文件3.:图S2b)和TNFR1的质膜积累(图S2b)6e、附加文件3.:图S2a) TiO诱导2-或1C11和1C11中的CB-NPs−5 HT神经细胞。
总之,这些数据证明了交互作用TiO2-或CB-NPs与PrPC腐败PrPC-PDK1信号通路导致TACE α-分泌酶内化。这使得TACE切割活性远离质膜,从而导致细胞表面TNFR1的积累,这是np暴露的1C11和1C11过敏的根源−5 HT细胞对TNFα炎症应激的影响。
人民党的腐败C-PDK1-TACE通路2CB纳米颗粒触发Aβ肽在1C11和1C11的积累−5 HT细胞
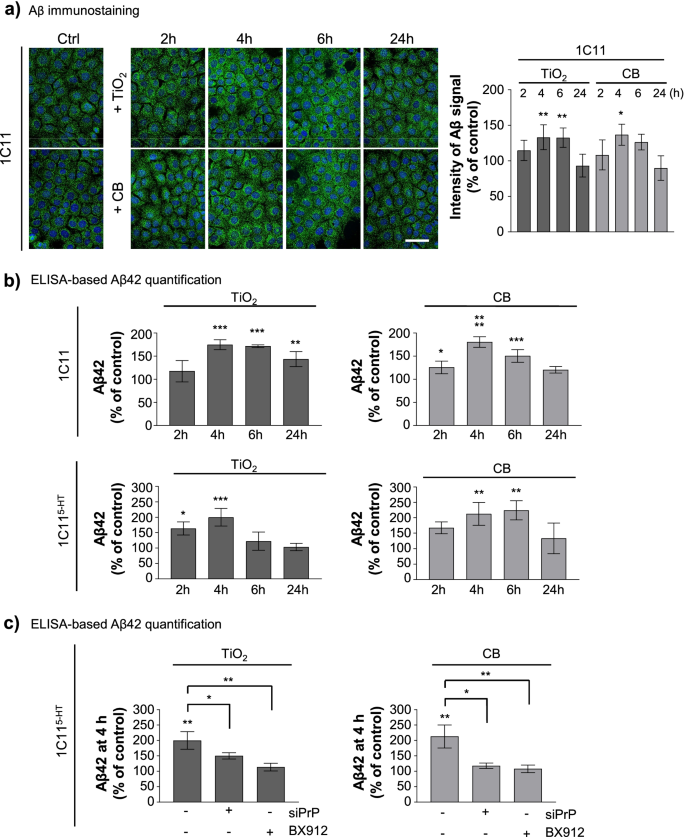
在朊病毒和阿尔茨海默病中,我们之前证明了PrPSc-或a β诱导的TACE α-分泌酶在神经元中的内化也维持了APP转化为神经毒性Aβ40/42肽的淀粉样变性过程[9,42].因此,我们试图确定人民革命党是否腐败C-PDK1-TACE通路可引起a β生成的增加。
免疫荧光实验(图;7a)和elisa定量(图;7b、附加文件4:图S3a)显示1C11和1C11急性暴露−5 HTcell to TiO2-或CB-NPs(1µg cm−2)作用2 ~ 24 h,促进了Aβ40和Aβ42肽在细胞内的瞬时上升。在1C11和1C11中,Aβ40/42多肽的积累开始于纳米颗粒暴露2 - 4小时之间−5 HTa β肽在4 - 6小时内达到最大值,1C11细胞的a β肽水平是基础水平的1.5- 1.8倍,神经元细胞的a β肽水平是基础水平的2.0- 2.5倍。我们排除了纳米颗粒诱导的Aβ肽的增加源于APP和/或β-分泌酶(BACE1)表达的增加,因为在暴露于TiO的细胞中,APP或BACE1 mrna和蛋白质没有显著变化2-或CB-NPs 4小时与未暴露的单元格(附加文件4:图S3b)。值得注意的是,PrP的沉默CBX912抑制PDK1(1µM)可抑制TiO诱导的Aβ40/42肽的积累2-或CB-NPs(图;7c、附加文件4:图S3c)。这显示了TiO的容量2-和CB-NPs通过与PrP相互作用增强阿尔茨海默病神经毒性Aβ肽的产生C颠覆PrPC与PDK1-TACE-APP通路耦合。
细胞暴露于TiO2CB纳米颗粒通过腐蚀PrP促进Aβ42的上升C的基因通路。一个TiO作用下1C11细胞内Aβ积累动力学2-或CB-NPs(1µg cm−2)及相关免疫染色Aβ定量直方图。比例尺bar = 10µm。belisa法定量Aβ42多肽在1C11和1C11−5 HT暴露于TiO的神经元细胞2-或CB-NPs(1µg cm−2)长达24小时。celisa法测定1C11中Aβ42多肽−5 HT暴露于TiO的神经元细胞2-或CB-NPs(1µg cm−2) 4小时,无论是否存在siRNA朝向PrPC(siPrP)或PDK1抑制剂BX912(1µM)。实验共进行3次,每次重复3次。数值为平均值±SEM。*表示p< 0.05, **p< 0.01, ***p< 0.001, ****p与未暴露细胞相比< 0.0001
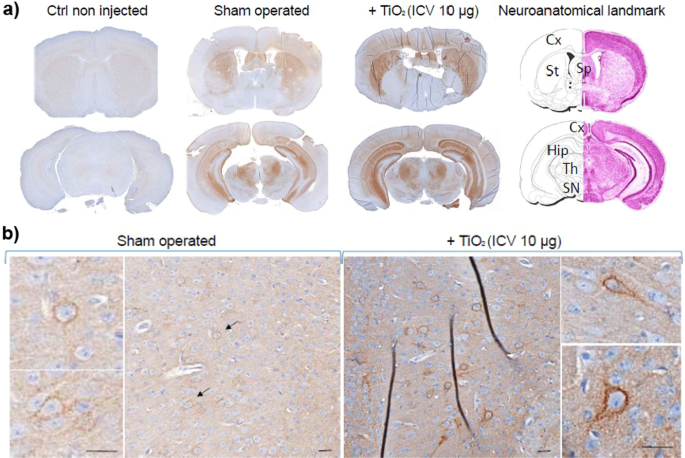
大脑暴露于TiO2纳米颗粒触发TNFR1在小鼠体内的积累
为了评估我们与1C11神经元细胞系获得的数据的体内相关性,我们利用了来自先前概念证明研究的小鼠大脑材料,在该研究中,雌性C57Bl/6 J小鼠的大脑暴露于单剂量的TiO2(P25)纳米颗粒(10µg)经脑室内(ICV)途径[55].与未暴露或假手术的小鼠相比,注射TiO的小鼠2-NPs在8周内表现出显著的、进行性的、严重的运动退化。根据TiO整个大脑的微胶质细胞激活,这些行为异常与神经炎症过程相关2-NPs注射小鼠[55].因此,我们试图评估TNFR1水平的升高,即。,一种启动TNFα毒性的细胞,将伴随TiO诱导的神经炎症状态2nps。TNFR1在两个具有代表性的脑切片上的免疫组化分析显示,TNFR1的基础水平非常微弱,在未注射的小鼠大脑中基本检测不到(图2)。8a).在假手术小鼠中,TNFR1免疫染色在不同脑区均有升高,包括皮层、中隔、纹状体、海马体、丘脑和黑质,提示术后效果(图;8a).小鼠ICV-注入TiO2在相同的大脑结构中,-NPs比假手术小鼠表现出更高的TNFR1水平。8a),表明TiO2-NPs促进TNFR1在体内的增强。如图所示,皮质的亚矢区。8b),对大脑进行高倍检查,发现TiO诱导TNFR1升高2-NPs主要发生在细胞中,其形状和位置(灰质核)是神经元的唤起。对于1C11细胞系,暴露于TiO的小鼠大脑中TNFR1的积累2-NPs反映TACE向TNFR1的脱落活性不足。因为NPs刺激TNFα的产生[55],在TiO的大脑中TNFR1的这种增强2-NPs注射小鼠会使神经元对神经炎症高度脆弱。
讨论
我们的工作证实了TiO2-和CB-NPs对神经元细胞产生不良影响,并通过与非病理性细胞朊蛋白PrP相互作用引发阿尔茨海默病的分子体征C人民党腐败C神经保护信号功能。TiO的相互作用2-和CB-NPs与质膜PrPC促进(i)通过NADPH氧化酶产生ROS和(ii) TACE α-分泌酶的内化,TACE α-分泌酶是一种细胞事件,不仅使神经元对TNFα炎症应激进行准备,而且还刺激APP的淀粉样加工,导致神经毒性a β肽的积累。最后,我们证明了脑室内注射TiO2-NPs在C57Bl/6 J小鼠中引发TNFα受体在几个大脑区域的积累,这将使中枢神经系统更容易受到神经炎症的影响。
在抗洗涤剂微域中,即。质膜上的脂筏或脂囊,PrPC在生理上表现为参与神经元和非神经元细胞内稳态的受体或辅受体[36,37].PrP之外C结合致病朊病毒PrP的能力Sc朊病毒疾病[43], Aβ淀粉样肽在阿尔茨海默病中的作用[33],或α-突触核蛋白在帕金森病中的作用[56],我们的数据表明,PrPC也可高亲和力固定(10 ~ 30 μ g ml−1)两种类型的纳米颗粒聚集体,TiO2-和CB-NPs,尽管大小、化学成分和反应性质不同[47].这为PrP识别分子谱提供了主要证据C不局限于错误折叠蛋白质的聚集物。值得注意的是,个人TiO2-和CB-NPs小于15 nm,但在生物介质中自发聚集/团聚成复杂的多分散结构,平均水动力学直径为100-600 nm,这取决于NPs的浓度(附加文件1和2:表S1和图S1) [17].此外,Aβ多肽的体外生化研究表明,PrPC结合直径在6 - 120nm之间的球形Aβ低聚物,可能对应于Aβ肽的六聚体或十二聚体,最小的低聚物和5-10 × 10的组装4Aβ分子最大,而Aβ单体不与PrP相互作用C[57].人们很容易推测,组装物体的大小和形状是PrP识别它们的关键参数C.
这PrPC区域与TiO相互作用2-还是CB-NPs?对于Aβ肽,在全长PrP上鉴定出三个结合域C,主要位于PrP的n端23-110柔性部分C[57,58].这PrPC区域由八重基序组成,结合铜等二价离子(氨基酸51-90)[59,60也可能吸引纳米颗粒。为了支持这一假设,我们证明了TiO2-和CB-NPs结合全长PrPC(氨基酸23-230)在质膜上,但不与PrP的C1片段相互作用C(氨基酸111-230),即PrP的截断形式C缺乏与全长PrP共存的八重母题C在细胞表面。
与PrP一样Sc或Aβ肽[9,33,44,61,62],我们提供了TiO结合的证据2-或CB-NPs在PrP上C在神经元细胞的细胞表面参与和腐蚀PrPC信令功能(附加文件5:图S4)。这些纳米粒子/ PrPC互动显著招募PrPC偶联到NADPH氧化酶/ROS的产生[38].神经细胞急性暴露于TiO2-或CB-NPs激发NADPH氧化酶的瞬时激活,随后产生ROS。在1C11细胞系中,纳米颗粒诱导的ROS产生不会促进氧化应激条件,这与暴露于TiO的动物大脑中的氧化损伤形成对比2nps (28,30.].这些差异可能首先反映了急性与神经元长期暴露在纳米颗粒下。在动物中,神经元与纳米颗粒的重复接触可能会发生,这反过来可能促进NADPH氧化酶的持续激活并产生氧化应激。另外,在接受纳米颗粒处理的动物大脑中观察到的氧化损伤可能反映了与TiO内化相关的纳米颗粒诱导的不良反应的晚期事件2-及CB-NPs [63]以及它们靶向线粒体上的溶酶体隔室或NP作用[64,65]在严重的ROS产生的根源(有关综述,请参阅[66]及其中的参考文献,[17])。在任何情况下,明显的PrPC我们在神经元细胞中发现的依赖纳米颗粒诱导的无毒ROS产生将通过改变PrP的状态来改变神经元表型C-控制的氧化还原敏感靶点,如(i)应激激活的ERK1/2 MAP激酶[38], (ii) CREB转录因子[67],或(iii) 5 -羟色胺合成酶色氨酸羟化酶[68],所有这些都涉及神经元功能的微调和可塑性。
最重要的是PrP的失调C-PDK1-TACE α分泌酶通路[9,41,42,53] by TiO2-和CB-NPs(附加文件5:图S4)。首先,纳米颗粒诱导的PDK1过度激活和随后的TACE内化取消了TACE介导的TNFR1脱落,从而促进TNFR1在神经元细胞质膜上的积累,增加了纳米颗粒暴露的神经元对外源性TNFα毒性的固有敏感性。这种由纳米颗粒引起的TNFR1水平的增加并不局限于培养的神经元,因为我们在体内监测了注射纳米TiO的小鼠大脑2TNFR1在神经元群的质膜上的积累属于几个大脑区域,包括海马体,皮层,纹状体和黑质.与炎症应激条件的发生有关(有关综述,见[3.]和其中的参考文献),这些纳米颗粒暴露的神经元对TNFα的脆弱性增强将导致神经退行性变,可能是运动能力丧失的原因[55以及其他大脑功能的改变,如记忆技能。在小鼠脑内接种TiO的体内实验2纳米颗粒是一个概念证明,表明一旦TiO2纳米颗粒已经到达中枢神经系统,它们会引起阿尔茨海默病的不良反应。需要进一步的体内实验来评估(i) CB-NPs是否也会促进TNFR1的升高并使神经元对小鼠大脑中的炎症应激敏感,以及(ii)更现实的TiO暴露2或CB-NPs,特别是气道会在大脑中引发这种异常。二是TACE的内部化2-和pb - nps转移了TACE α-切割神经保护活性,使APP远离。因此,APP参与了神经毒性Aβ40/42肽积累的根源β-淀粉样加工级联[691C11前体和血清素1C11−5 HT神经元细胞暴露在纳米颗粒中。考虑到PrPC与Aβ多肽相互作用继发Aβ毒性[33,44]并增加AD中Aβ的产生[9],纳米颗粒通过刺激a β40/42多肽的产生,可能会导致a β产生/扩增的恶性循环,从而导致a β的发生特发性阿尔茨海默氏症。
结论
这项体外和体内研究的主要发现是正常细胞朊病毒蛋白PrPC作为两种TiO聚集物的结合受体2和CB纳米颗粒进入神经元并转导np相关的毒性信号。尽管TiO2-和CB-NPs被报道在肺上皮细胞中触发不同的毒性机制[47], PrP失调C这两种NPs的信号传递功能是神经元NP毒性的共同机制。PrP失真C-耦合信号的TiO2-和CB-NPs不仅能改变氧化还原平衡,还能使神经元对tnf α-炎症应激高度敏感,并促进神经毒性Aβ肽的过度产生。这种np诱导神经毒性的合理机制可以解释氧化应激、炎症环境和暴露于CB-NPs的小鼠大脑中富含β-sheet淀粉样蛋白的沉积[20.,70].因此,我们的研究为人类如何暴露于某些纳米颗粒可能导致神经退行性疾病提供了新的见解,从而支持了一些工程和环境纳米颗粒在阿尔茨海默病症状发作中可能起因果作用的假设。最后,通过识别TiO2-和CB-NPs破坏神经元中的信号级联并改变神经元稳态,本研究可能有助于现代毒理学了解中枢神经系统中纳米颗粒启动的不良结果通路。
方法
纳米粒子,重组PrPC和抗体
二氧化钛(TiO)2, P25,西格玛-奥尔德里奇,圣昆汀法拉维尔,法国)和炭黑(CB, FW2, Evonik工业/德古萨,埃森,德国)由Sonja Boland博士(功能和适应生物学单位,Université巴黎Cité)提供。二氧化钛2P25纯度99%,由球形颗粒组成,平均直径22 nm,混合结晶度85%锐钛矿和15%金红石。CB FW2的化学成分为97-99%的元素碳和1-2%的有机碳,平均直径为13 nm。冻干的全长重组小鼠PrP购自Alicon AG (Zürich,瑞士),并重新折叠成PrPC根据制造商的说明。小鼠Sha31 PrP单克隆抗体购自SPI-Bio公司(Montigny Le Bretonneux, France)。兔TNFR1多克隆抗体来自NeoBiotech (Nanterre, France)。兔TACE多克隆抗体来自Biovision (San Francisco, CA, USA)。兔APP多克隆抗体来自Novus Biologicals (Littleton, CO, USA)。兔BACE单克隆抗体来自Cell Signaling (Leiden, Netherlands)。兔PDK1多克隆抗体和Ser241磷酸化特异性PDK1抗体购自Cell Signaling (Leiden, Netherlands),通过Western-blot检测PDK1水平和间接活性。为了标准化,使用了以下抗体:来自Proteintech (Rosemount, IL, USA)的小鼠单克隆α-管状蛋白抗体,来自Invitrogen (ThermoFisher Scientific, MA, USA)的小鼠单克隆β-肌动蛋白抗体,以及来自Merck (Sigma-Aldrich, St. Louis, MO, USA)的小鼠单克隆温库素抗体。单克隆β-淀粉样蛋白(D54D2) XP®兔抗体来自Cell Signaling (Leiden, Netherlands)。
TiO的表征2-和CB-NPs动态光散射(DLS)
二氧化钛团聚体的水动力直径2-和CB-NPs用DLS测定。纳米颗粒原液悬浮液(2毫克ml−1)用Bioruptor进行超声检测®Plus超声系统(Diagenode公司,Denville, NJ, USA) (20khz, 320w),每次30秒。超声处理后,将NPs按如下方式稀释:在22°C的PBS中以5、20、40和80µg ml稀释−1在DMEM/F12 37°C中,5、10、25和50µg ml−1(后一种浓度对应于0.1至10 μ g cm之间的NPs暴露剂量−2在细胞实验中)。NP悬浮液在2000克的浓度下离心2秒以去除大的团聚体。上清液进行DLS分析。值得注意的是,5µg ml−1PBS和DMEM/F12中NPs的浓度太低,不能用DLS估计水动力直径。对于其他NPs浓度,使用Vasco Kin™粒度分析仪(Cordouan Technology, Pessac, France)结合NanoKin软件(V2.3.3.0)测量水动力直径。选择以下Vasco Kin粒度分析仪参数:温度(22°C或37°C),激光功率(70 - 80%之间),采集模式(连续)和分析模式(累积量)。散射角为170°。每次测量一式三份(附加文件1和2:表S1和图S1)。
PrP与PrP的体外结合实验C和纳米粒子
在PBS中稀释的超声纳米颗粒浓度增加(高达80µg ml−1)与重组PrP孵育C(2 μ M)在PBS (100 μ l)中,在4°C下轻度搅拌2小时。然后将溶液在13523 g下离心30分钟,在4°C下制成颗粒状纳米颗粒并结合PrPC.荧光与游离PrP相对应C在上清液(λexc= 280 nm,狭缝宽度= 5 nm;λ新兴市场= 340 nm,狭缝宽度= 10 nm)使用Cary Eclipse荧光计(Varian Inc., Agilent Technology)。免费的PrPC也通过Western-blotting进行量化。
细胞培养,1C11细胞的神经元分化和纳米颗粒暴露
1C11细胞在Dulbecco 's Modified Eagle培养基(DMEM高葡萄糖,GlutaMAX™补充剂,Gibco)中培养,并添加10%胎牛血清(FCS, Biochrom GmBH, Berlin, Germany)。在添加1 mM二丁基环AMP (dbcAMP, Sigma-Aldrich, Darmstadt, Germany)和0.05%环己基羧酸(Sigma-Aldrich, Darmstadt, Germany)后,几乎100%的1C11细胞在4天内获得了完整的血清素能表型(1C11−5 HT) [35].在细胞暴露于纳米颗粒之前,纳米颗粒原液(2 mg ml−1)用Bioruptor进行超声检测®Plus超声系统(Diagenode Inc., Denville, NJ, USA) (20 kHz, 320 W)在3个周期中进行,每次30秒,然后在无血清DMEM/F-12中稀释到适当浓度,以2000 g离心2秒,并立即使用。将制备好的纳米颗粒应用于生长到90-95%合流的细胞上,使用剂量公制µg cm−2,是指分布在细胞培养板表面的纳米颗粒浓度。与其他细胞范式一样[17,31],并确定NPs促进细胞内稳态丧失的分子途径,1C11细胞及其血清素能神经元子代急性暴露于几种浓度的TiO2-或CB-NPs 0.1 - 10µg cm−2.
透射电子显微镜
细胞在24孔板中Aclar膜(EMS, Hatfield, PA, USA)上培养至约90%,在0.1 M磷酸盐缓冲液(PB)中冲洗两次。用1%磷酸盐缓冲的戊二醛(Sigma-Aldrich, Darmstadt, Germany)在室温(RT)下固定15分钟,并用PB漂洗两次。在室温下用0.5%四氧化锇在PB中固定30分钟后,细胞制剂分别用增加浓度的乙醇(50,70,95,2 *100%)浸泡8分钟,然后用环氧丙烷浸泡2次8分钟。在RT条件下进行1 / 2 Araldite/ 1 / 2环氧丙烷处理,然后在RT条件下进行2 h Araldite处理。在60℃下聚合48 h后,在超微切片机(Leica, Wetzlar, Germany)中切割70 μm超细切片。所用造影剂为柠檬酸铅。切片使用日立H7500透射电子显微镜(日本东京),配备AMT滨松数字相机(滨松光子学,滨松市,日本)。
细胞提取物制备及western blot分析
细胞在PBS/Ca/Mg中洗涤,并在裂解缓冲液(50 mM Tris-HCl pH 7.4, 150 mM NaCl, 5 mM EDTA, 1% Triton X-100,蛋白酶和磷酸酶抑制剂鸡尾酒[Roche, Basel, Switzerland])中4°C孵育30分钟。裂解液离心(14000 × g, 30分钟)后,用双辛酸法(Pierce, Rockford, IL, USA)测定上清液中蛋白质的浓度。
对于PNGase测定,15µg蛋白质提取物与500 U肽n -糖苷酶F (New England Biolabs, Ipswitch, MA, USA)在37℃下孵育1小时。用SDS/10% PAGE分离10微克蛋白质,并转移到硝化纤维膜(Amersham, Arlington Heights, IL, USA)。用3%的脱脂干牛奶在0.1%吐温20的PBS中堵塞膜,RT下1小时,然后在4°C下用0.02µg ml孵育过夜−1Sha31一抗prp抗体。结合抗体通过增强化学发光检测显示,使用小鼠二抗偶联HRP (GE Healthcare, UK)。
PrPC沉默
我们利用1C11前体细胞稳定地向PrP表达shRNAC,其中PrPC表达被抑制95%以上(称为PrP零-1C11单元格)[50,53].1C11和1C11−5 HT用针对PrP的siRNA瞬时转染神经元细胞(感觉序列5 ' -CAGUACAGCAACCAGAACAdTdT-3 ') [40]使用脂质体2000试剂,按照制造商的说明(Invitrogen, Carlsbad, CA, USA)。
流式细胞术
1C11或PrP零-1C11细胞胰化,用冷PBS冲洗,并在冰上暴露于纳米颗粒15分钟,用0.1%叠氮化钠防止纳米颗粒内化。在1200 g(4°C)离心5 min后,细胞在3.6%多聚甲醛-PBS溶液中固定15 min,然后用冷PBS洗涤两次。使用Amnis ImageStream对细胞进行分析x平台(Amnis, Proteigene, Saint Marcel, France)和Inspire™系统软件(Amnis)。相机放大倍数为40倍。785 nm激发激光功率为0.03 mW。在正常景深下获取图像,提供4 μm聚焦深度的细胞横截面图像。通过明场图像定义代表整个细胞的掩膜,通过将整个细胞掩膜腐蚀6个像素(相当于3 μm,因为1个像素的大小为0.5 μm)来定义内部掩膜,以选择附着在细胞表面的纳米颗粒发出的信号。结果采用IDEAS软件(Amnis)进行分析。计算每个样品至少500个细胞的平均侧散射(SSC)强度和细胞面积。
荧光法检测ROS
ROS在1C11前体细胞中的产生,1C11−5 HT神经元细胞和对应的PrP沉默C用细胞内荧光试剂CM-H检测表达2DCFDA根据制造商的说明(分子探针,尤金,OR,美国)。细胞暴露于纳米粒子后,荧光被记录(λexc= 507 nm,狭缝宽度= 10 nm;λ新兴市场= 528 nm,狭缝宽度= 10 nm)使用Cary Eclipse荧光计(Varian Inc., Agilent Technology)。
酶抑制
用罗布麻苷抑制NADPH氧化酶活性(Sigma-Aldrich, Darmstadt, Germany)。通过BX912切断PDK1活性(Axon Medchem BV, Groningen, Netherlands)。
细胞内还原性谷胱甘肽的荧光测定
使用谷胱甘肽敏感探针Celltracker Green CMFDA(分子探针,Eugene, OR, USA)测定谷胱甘肽水平。1C11和1C11−5 HT细胞暴露于TiO2或CB纳米颗粒(1µg cm−2然后用Hanks’平衡盐溶液(HBSS)缓冲液(Invitrogen, ThermoFisher Scientific, MA, USA)洗涤细胞两次,并在HBSS中在1µM含氟试剂的37°C下进一步孵育30分钟。去除HBSS,细胞在DMEM、10% FCS中37°C重组30分钟,然后裂解。在λ处记录细胞裂解物的荧光强度新兴市场λ激发后= 517 nm(狭缝宽度= 5 nm)exc= 492 nm(狭缝宽度= 5 nm),使用Cary Eclipse荧光计(Varian Inc., Agilent Technology)。细胞内还原谷胱甘肽的参考水平(100%)是使用未暴露于纳米颗粒的细胞获得的。
免疫荧光实验
PrP的免疫荧光标记C采用标准方案进行TNFR1、TACE和Aβ检测。简单地说,用于细胞表面检测PrPC、TNFR1和TACE,培养于玻璃片上的细胞用冷PBS冲洗,用3.6%多聚甲醛固定。细胞在室温下与一抗(0.5µg ml−1)注入阻断缓冲液(含2%胎牛血清的PBS),然后用Alexa-Fluor 488或594偶联二次免疫球蛋白(1µg ml−1;分子探针,尤金,OR,美国)。为了在细胞内检测TACE和Aβ,在TACE和Aβ免疫染色前,用0.05%皂角苷(Sigma-Aldrich, Darmstadt, Germany)在PBS中室温渗透3.6%甲醛固定的细胞15分钟。使用Fluoromount G (Fisher Scientific, Pittsburgh, PA, USA)将细胞制剂安装在盖玻片下,并使用Leica DMI6000 B显微镜(Wetzlar, Germany)进行宽视野间接免疫荧光分析。对于所有图像,通过使用Autoquant X程序(Meyer Instruments, Houston, TX, USA)中的自适应盲反褶积,以0.3 μ m间隔记录的16组连续光学部分的数字反褶积来减少焦外雾霾。然后将每个焦平面上的所有像素值沿z轴求和,得到最终图像。用AQUA软件对反卷积图像进行图像分析[71].
RNA分离和实时定量RT-PCR分析
根据制造商说明书(Life Technologies),使用Trizol试剂分离总RNA。第一链cDNA合成使用Prime Script RT Master Mix kit (Takara Bio)进行。在ABI Prism 7900HT设备(Applied Biosystems)中使用SYBR Green kit (ABgene)在60°C进行实时定量PCR。使用的引物有:TNFR1转发5′-AGGGCACCTTTACGGCTTCC-3′和反向5′- ggttctccttacagccacacaca -3′,TACE转发5′- cggagagagcaggctctg -3′和反向5′-CCTTTGTTCGAACCCACATC-3′,BACE转发5′- accaccaaccttcgcttgcc -3′和反向5′- aaggggtcgtgccccccccccttgc -3′以及作为内部控制Rplp0转发5′- tacaccttcccacggcctg -3′和反向5′- tctgttcctccgactcttc -3′。
细胞活力测定
生存力~ 1 × 1051C11或1C11−5 HT细胞暴露于或不暴露于纳米颗粒1小时,然后暴露于重组小鼠TNFα (Biosource International, Camarillo, CA, USA),通过四氮唑盐WST-1 (Roche, Hoffmann-La-Roche Ltd, CH4070, Basel, Switzerland)的裂解来评估。使用cleaved caspase-3 (Asp175)抗体(cell Signaling, Leiden, Netherlands), Western-blotting方法评估细胞暴露于纳米颗粒和/或TNFα时caspase-3的激活情况。
Aβ40/42的ELISA测定
酶联免疫吸附试验(ELISA)使用小鼠Aβ40和Aβ42酶联免疫吸附试验试剂盒(Invitrogen, ThermoFisher Scientific, MA, USA),按照制造商说明进行测量。Aβ42试剂盒检测范围为3.12 ~ 200 pg ml−1Aβ40试剂盒在7.81 - 500 pg ml之间−1.5 × 1071C11或1C11−5 HT细胞在暴露于或不暴露于1µg cm的PBS中洗涤−2TiO的2-或CB-NPs在无血清DMEM/F-12培养基中培养24小时。孵育后,细胞在PBS中洗涤并溶解。然后对裂解物进行超声(Diagenode Inc., Denville, NJ, USA) 10个周期,每次30秒,然后离心(16000 × g, 30分钟)。ELISA法测定上清中Aβ40和Aβ42的含量。
伦理语句
所有动物实验均根据法国和欧洲关于实验动物护理和保护的法规(2013年2月1日法国法令2013 - 118和2010年9月22日指令2010/63/EU)进行。实验方案已由动物伦理委员会(国家动物实验伦理委员会(ANSES/ENVA/UPEC))和国家教育、高等教育和研究部评估和批准(11-0042)。体内实验是在ANSES-Lyon实验室的动物设施中进行的,该实验室拥有相关的动物工作批准(C 69 387 0801),由在动物实验单元(许可编号AB: 69 387 531)工作的持牌人员进行。每组动物被安置在一个温度控制的房间里的强化笼子里,光照/黑暗周期为12小时,自由取水和食物。
活体大脑暴露于TiO2纳米粒子
每组15只雌性C57Bl/6J小鼠(Charles River, L’arbresle, France), 6周龄(平均体重19 g),深度麻醉(100 μl Ketamin, 50 μl Xylazin, 400 μl水稀释溶液150 μl腹腔注射),然后采用独特的急性给药TiO2NPs (P25)直接在大脑内使用立体定向设备。这种暴露方式允许直接评估TiO2纳米粒子神经毒性与控制纳米粒子的递送量的好处。脑室被选为NPs传递的部位,因为它带来的优势是在短时间内缓解NPs向整个大脑的传播。一位TiO2-NP溶液(5 μg μl−1)是根据nanogentox联合行动制定的标准化分散方案,由原液混悬液配制而成(www.nanogenotox.eu),以协调和规范纳米颗粒的分散,用于体外和体内毒性测试。简单地说,NPs悬浮在无菌过滤的0.05% w/v bsa水中,浓度为2.56 mg ml−1使用4°C的高能探头超声波。用DLS测量了悬浮液的水动力直径,平均直径为350 nm。使用10 μ l Hamilton注射器,2 μ l新超声TiO2在电动微注射泵的控制下,将纳米颗粒悬浮体立体定向注入侧脑室右侧(立体定向坐标:前后:−0,22中侧:+ 1背腹侧:−2,25),持续10分钟。假性实验将相同体积(2 μl)的溶剂(无菌过滤0.05% w/v BSA-water)注入对照组C57Bl/6J小鼠右侧侧脑室。在NPs注射时,没有一只小鼠表现出明显的神经损伤。在首次接触后的1、2、3、4和8周,用戊巴比妥致命注射对3只小鼠实施安乐死。放血后取脑,在10%缓冲福尔马林溶液中固定,经经典石蜡包埋后进行组织化学分析。在暴露后8周,观察到的最大神经影响是运动能力的改变和神经炎症。在本研究中,我们选择了暴露后8周牺牲的小鼠脑石蜡包埋切片。
TNFR1免疫组织化学
评估TiO在体内的影响2在5µm厚的福尔马林固定的脑切片上进行免疫组织化学分析,使用特定的兔多克隆TNFα受体1抗体(abcam, ab19139)按照常规程序制备的石蜡包埋组织。简单地说,根据制造商的说明,在自动免疫染色仪(Ventana Discovery XT, Roche, Meylan, France)上使用Omnimap DAB Kit进行免疫组化(包括脱亲和化、抗原检索、内源性过氧化物酶活性的猝灭)。切片用兔TNFR1抗体(按1:1000稀释)孵育。在切片上应用抗兔hrp。用DAB显色底物可见,染色呈典型的棕色。切片用吉尔苏木精反染色。最后,用全景扫描II (3D Histech, Budapest, Hungary)扫描20X的大脑切片。
统计分析
使用NIH ImageJ软件(https://imagej.nih.gov/ij/).对于两组实验,未配对样本采用Student 's t检验。对于3组或3组以上的实验,独立样本分别采用单因素方差分析(one-way ANOVA)检验和Dunnett's或Tukey's post hoc检验比较对照均值和对照均值。所有图上的误差条代表s.e.m.a假定值< 0.05%被认为是显著的(样本量和p数值在图形图例中表示)。
数据和材料的可用性
在本研究过程中产生或分析的所有数据都包含在本文及其补充信息文件中。
缩写
- 1 c11:
-
神经外胚层干细胞
- 1 c115−HT:
-
血清素能神经元细胞
- 广告:
-
阿尔茨海默病
- 应用:
-
淀粉样前体蛋白
- 一个β:
-
β淀粉样肽
- BACE1:
-
β -位点APP裂解酶1
- CB:
-
炭黑
- DLS:
-
动态光散射
- NADPH氧化酶:
-
烟酰胺腺嘌呤二核苷酸磷酸氧化酶
- NP (s):
-
纳米颗粒聚集
- 基因:
-
3-磷酸肌醇依赖激酶
- PNGase:
-
Peptide-N-glycosidase
- PrPC:
-
细胞朊病毒蛋白
- ROS:
-
活性氧
- 别说话:
-
肿瘤坏死因子α转化酶(ADAM17)
- TiO2:
-
二氧化钛
- TNFR:
-
肿瘤坏死因子-α受体
- 肿瘤坏死因子α:
-
肿瘤坏死因子-α
参考文献
Bencsik A, Lestaevel P, Guseva CI。纳米和神经毒理学:一个新兴的学科。《神经生物学》2018;160:45-63。
Kaphle A, Navya PN, Umapathi A, Daima HK。农业、食品和环境的纳米材料:应用、毒性和监管。环境化学学报,2018;16:43-58。
吴涛,唐敏。人造纳米颗粒对哺乳动物靶器官影响的研究进展。应用毒理学杂志,2018;38:25-40。
Deuschl G, Beghi E, Fazekas F, Varga T, Christoforidi KA, Sipido E,等。欧洲神经系统疾病负担:2017年全球疾病负担研究分析《柳叶刀》公共卫生Elsevier, 2020;5: e551-67。
德Strooper B, Vassar R, Golde T.分泌酶:具有治疗阿尔茨海默病潜力的酶。神经科学,2010;6:99-107。
孙X, bromley - britks K, Song W. β位点app -裂解酶1基因表达调控及其在阿尔茨海默病中的作用。神经化学杂志,2012;20(增刊1):62-70。
Piaceri I, Nacmias B, Sorbi S.家族和散发性阿尔茨海默病的遗传学。《前沿生物科学》2013;5:167-77。
Kojro E, Fahrenholz F.非淀粉样通路:α -分泌酶的结构和功能。生物化学。2005;38:105-27。
张志刚,张志刚,张志刚,张志刚,等。PDK1降低tace介导的α-分泌酶活性,促进朊病毒和阿尔茨海默病的疾病进展。2013; 19:1124-31。
Nalivaeva NN, Beckett C, Belyaev ND, Turner AJ。淀粉样降解酶是阿尔茨海默病可行的治疗靶点吗?神经化学杂志,2012;20(增刊1):167-85。
陈晓明,陈晓明,陈晓明,等。环境污染对神经退行性疾病的影响。前细胞神经科学2015;9:124。
Hayden KM, Norton MC, Darcey D, Ostbye T, Zandi PP, Breitner JCS,等。职业暴露于农药增加事件性AD的风险:Cache县的研究。神经学。2010;74:1524-30。
理查森JR,罗伊A,沙拉特SL,冯斯坦RT,侯赛因MM,巴克利B,等。血清农药水平升高与阿尔茨海默病风险增加2014; 71:284-90。
Yegambaram M, Manivannan B, Beach TG, Halden RU。环境污染物在阿尔茨海默病病因学中的作用:综述。Curr Alzheimer Res. 2015; 12:116-46。
Calderón-Garcidueñas L, Torres-Solorio AK, Kulesza RJ, Torres-Jardón R, González-González LO, García-Arreola B,等。步态和平衡障碍在城市年轻人中很常见,并与认知障碍有关。空气污染和老年痴呆症在年轻人中的历史发展。环境决议2020;191:110087。
Schauer JJ。单质碳作为柴油颗粒物标记物的评价。中华流行病学杂志,2003;13:443-53。
胡珊珊,Thomassen LCJ, Ferecatu I, Borot M-C, Andreau K, Martens JA,等。炭黑和二氧化钛纳米颗粒在支气管上皮细胞中诱导不同的凋亡途径。纤维毒物。2010;7:10。
van Berlo D, Hullmann M, Wessels A, Scherbart AM, Cassee FR, Gerlofs-Nijland ME,等。研究碳纳米颗粒短期吸入对c57bl/6j和p47phox−/−小鼠脑和肺的影响。神经毒理学。2014;43:65 - 72。
梅泽M, Onoda A, Korshunova I, Jensen ACØ, Koponen IK, Jensen KA,等。母亲吸入炭黑纳米颗粒会引起小鼠后代神经发育的变化。纤维毒物。2018;15:36。
Onoda A, Kawasaki T, Tsukiyama K, Takeda K, Umezawa M.碳纳米颗粒诱导血管周围的内质网应激,并在后代发育中的大脑中积累错误折叠蛋白。科学通报2020;10:10028。
Kirschvink JL, Kobayashi-Kirschvink A, Diaz-Ricci JC, Kirschvink SJ。人体组织中的磁铁矿:弱ELF磁场生物效应的机制。生物电磁学。1992;13(增刊1):101-13。
Mistry A, Stolnik S, Illum L.直接鼻脑药物递送的纳米颗粒。国际医药杂志。2009;39:46 - 57。
Maher BA, Ahmed IAM, Karloukovski V, MacLaren DA, Foulds PG, Allsop D,等。人类大脑中的磁铁矿污染纳米颗粒。中国生物工程学报,2016;29(3):344 - 344。
李文杰,李文杰,李文杰,等。二氧化钛纳米颗粒口服大鼠后的定量生物动力学:第2部分。纳米毒理学。2017;11:443-53。
Brun E, Carrière M, Mabondzo A.急性和反复/长期暴露于TiO(2)纳米颗粒后血脑屏障功能失调的体外证据。生物材料。2012;33:886 - 96。
王杰,刘勇,焦峰,老峰,李伟,顾勇,等。鼻内灌注TiO(2)纳米颗粒对中枢神经系统的时间依赖性易位和潜在损害。毒理学。2008;254:82 - 90。
年龄相关认知衰退与阿尔茨海默病的分子和细胞方面。Behav Brain Res. 2017; 322:191-205。
Oberdörster G, Elder A, Rinderknecht A.纳米颗粒和大脑:引起关注?纳米技术。2009;9:496 - 497。
王志强,王志强,王志强,等。二氧化钛纳米颗粒对小鼠海马齿状回体视学参数和颗粒神经元形态的影响。国际形态学杂志。2020;38:1623-30。
周勇,洪峰,田勇,赵旭,洪杰,泽勇,等。纳米二氧化钛抑制树突发育参与后代小鼠海马神经元凋亡和自噬。毒理学决议2017;6:889-901。
刘志强,刘志强,王志强,等。纳米颗粒诱导微电极阵列神经芯片上神经元网络电活动的变化。《环境卫生展望》,2010;118:1363-9。
西格德森CJ,巴茨JC, Glatzel M.朊病毒疾病的细胞和分子机制。《病理学年鉴》2019;14:497-516。
Laurén J, Gimbel DA, Nygaard HB, Gilbert JW, Strittmatter SM。细胞朊蛋白介导淀粉样β低聚物对突触可塑性的损害。大自然。2009;457:1128-32。
林登R,马丁斯VR,普拉多MAM, Cammarota M, Izquierdo I, Brentani RR。朊病毒蛋白的生理学。物理学Rev. 2008; 88:673-728。
Mouillet-Richard S, Mutel V, Loric S, Tournois C, Launay JM, Kellermann O.神经递质受体对血清素能或儿茶酚胺能神经元细胞分化的调控。中国生物化学杂志,2000;
Mouillet-Richard S, Ermonval M, Chebassier C, Laplanche JL, Lehmann S, Launay JM,等。朊病毒蛋白信号转导。科学。2000;289:1925-8。
Schneider B, Pietri M, Pradines E, Loubet D, Launay j M, Kellermann O,等。了解朊蛋白信号的神经特异性。《前沿生物科学》,2011;16:169-86。
Schneider B, Mutel V, Pietri M, Ermonval M, Mouillet-Richard S, Kellermann O. NADPH氧化酶和细胞外调节激酶1/2是神经元和非神经元细胞中朊病毒蛋白信号通路的靶点。中国科学院学报(自然科学版),2003;21(2):366 - 366。
Pradines E, Loubet D, Mouillet-Richard S, Manivet P, Launay j m, Kellermann O,等。细胞朊蛋白偶联到tace依赖的tnf - α脱落控制神经元细胞中的神经递质分解代谢。中国神经化学杂志,2009;
张志刚,张志刚,张志刚,等。朊病毒肽106-126过度刺激PrPC信号通路导致生物胺能神经元细胞氧化损伤。生物化学学报。2006;
李志强,李志强,李志强,等。通过神经细胞发生缺陷和朊病毒积累,在朊病毒疾病中持续ROCK激活的双刃剑。公共科学图书馆,2015;11:e1005073。
张志刚,张志刚,张志刚,张志刚,等。prpsc诱导PDK1过度激活后朊病毒疾病模型中可种子淀粉样β肽的产生Nat Commun. 2019;10:3442。
普鲁士SB.朊病毒。中国科学院学报(自然科学版),1998;19(3):366 - 366。
Um JW, Nygaard HB, Heiss JK, Kostylev MA, Stagi M, Vortmeyer A,等。阿尔茨海默淀粉样蛋白-β低聚物结合突触后朊蛋白激活Fyn损害神经元。神经科学。2012;15:1227-35。
Kostylev MA, Kaufman AC, Nygaard HB, Patel P, Haas LT, Gunther EC,等。高分子量朊蛋白相互作用淀粉样蛋白β低聚物与多个阿尔茨海默氏症小鼠模型的记忆障碍密切相关。中国生物医学工程学报,2015;
Resenberger UK, Harmeier A, Woerner AC, Goodman JL, Müller V, Krishnan R,等。细胞朊病毒蛋白介导富含β-表蛋白的构象的神经毒性信号,独立于朊病毒复制。Embo j . 2011; 30:2057-70。
Boland S, Hussain S, bazza - squiban A.炭黑和二氧化钛纳米颗粒诱导不同的毒性分子机制。纳米生物技术。2014;6:41 - 52。
穆利雷·理查德,施耐德B,普拉丁斯E, Pietri M, Ermonval M, Grassi J,等。血清素能神经元细胞中的细胞朊蛋白信号。中国科学(d辑),2007;
莫列-理查德,劳伦多一世,维多M,凯勒曼O,拉普朗什JL。朊病毒蛋白和神经元分化:小鼠诱导神经外胚层祖细胞中朊病毒基因表达的定量分析。微生物感染1999;1:969-76。
卢贝特D, Dakowski C, Pietri M, Pradines E, Bernard S, Callebert J,等。神经细胞发生:朊病毒蛋白控制β1整合素信号通路活性。中国生物医学工程学报。2012;26:678-90。
Vranic S, Boggetto N, Contremoulins V, Mornet S, Reinhardt N, Marano F,等。通过使用成像流式细胞术准确评估内化,破译细胞摄取工程纳米颗粒的机制。纤维毒物。2013;10:2。
李志刚,李志刚,李志刚。朊病毒糖化作用的研究进展。Biochimie。2003;85:33-45。
Ezpeleta J, Boudet-Devaud F, Pietri M, Baudry A, Baudouin V, Alleaume-Butaux A,等。细胞朊蛋白通过TACE α分泌酶对tnf α介导炎症的保护作用。科学通报2017;7:7671。
死亡受体诱导的细胞杀伤。《手机信号》2004;16:139-44。
王志强,王志强,王志强,等。纳米二氧化钛对神经系统的影响2与SiO2在小鼠脑内直接暴露后。中国物理学报,2013;
张晓明,张晓明,张晓明,等。α-突触核蛋白淀粉样蛋白通过劫持朊病毒蛋白进入细胞,促进细胞间扩散和阻断朊病毒复制。科学通报2017;7:10050。
Younan ND, Sarell CJ, Davies P, Brown DR, Viles JH。细胞朊蛋白以低聚体形式捕获阿尔茨海默病Aβ,并分解淀粉样纤维。中国生物医学工程学报。2013;27:1847-58。
陈s, Yadav SP, Surewicz WK。人朊蛋白与淀粉样β (Aβ)寡聚物的相互作用中国生物化学杂志,2010;
布朗DR,克莱夫C,哈斯威尔SJ。抗氧化活性与天然朊病毒蛋白的铜结合有关。神经化学杂志2001;
Jackson GS, Murray I, Hosszu LL, Gibbs N, Waltho JP, Clarke AR,等。人朊病毒蛋白上金属结合位点的位置和性质。自然科学学报,2001;29(2):366 - 366。
Mallucci G, Dickinson A, Linehan J, Klöhn P-C, Brandner S, Collinge J.朊病毒感染中神经元PrP的消耗预防疾病和逆转海绵病。科学。2003;302:871-4。
Chesebro B, Trifilo M, Race R, Meade-White K, Teng C, LaCasse R,等。无锚定朊蛋白可导致感染性淀粉样蛋白病,但无临床痒病。科学。2005;308:1435-9。
王志强,王志强,王志强,等。纳米颗粒活化中性粒细胞的实验研究。科学通报。2011;11:1877-85。
金长勇,朱保生,王晓峰,卢庆华。二氧化钛纳米颗粒对小鼠成纤维细胞的细胞毒性。化学研究毒物。2008;21:1871-7。
张志刚,李志刚,张志刚,张志刚。二氧化钛纳米颗粒与微管蛋白相互作用的研究。生物物理学报。2008;40:777-82。
宋波,周涛,杨伟,刘娟,邵玲。氧化应激对TiO的贡献2nanoparticle-induced毒性。环境毒理学杂志。2016;48:130-40。
Pradines E, Loubet D, Schneider B, Launay J-M, Kellermann O, Mouillet-Richard S.朊病毒蛋白对creb依赖基因调控:对MMP-9和β -营养不良聚糖的影响。《手机信号》,2008;20:2050-8。
侯赛因AM,米特拉AK。活性氧对大鼠脑色氨酸代谢的影响:年龄的影响。生物化学学报,2004;
阿尔茨海默病25年的淀粉样蛋白假说。EMBO Mol Med 2016; 8:595-608。
tin - tin - wen - shwe, Yamamoto S, Ahmed S, Kakeyama M, Kobayashi T, Fujimaki H.超细炭黑鼻内灌注诱导小鼠脑细胞因子和趋化因子mRNA表达。毒理学杂志,2006;163:153-60。
麦凯布A,多尔菲哈特M,坎普RL,里姆DL。自动定量分析(AQUA)原位蛋白表达、抗体浓度和预后。中华肿瘤学杂志2005;37(3):344 - 344。
确认
成像实验、mRNA/蛋白研究和DLS分析分别在生物医学技术设施INSERM US36/CNRS UMS2009/Université Paris Cité的SCM、Cyto2BM和AMS核心设施进行。我们感谢Jacques Monod研究所的ImagoSeine核心设施,法国生物成像(ANR-10-INBS-04)的成员,以及区域Île-de-France (E539)的支持。作者感谢“解剖病理研究平台,Université克劳德·伯纳德·里昂1号,中心Léon Bérard,里昂研究中心cancérologie (CRCL)”的成员,感谢他们出色的组织学技术援助。
资金
这项工作得到了INSERM的支持。ZAA是法国国家研究机构(欧洲神经退行性疾病联合项目和国家研究机构,«PrPC&PDK1»,n°ANR-14-JPCD-0003-01)。
作者信息
作者及隶属关系
贡献
构思设计实验:MP, AB, AB, YB, BS。进行实验:LWR、MP、HAO、FBD、CB、ZAA、AMH、NG、SD。分析数据:LWR、MP、AB、SB、SD、YB、AB、BS。写稿子:好,AB, BS。所有作者都阅读并批准了最终的手稿。
相应的作者
道德声明
伦理批准并同意参与
所有动物实验均根据法国和欧洲关于实验动物护理和保护的法规(2013年2月1日法国法令2013 - 118和2010年9月22日指令2010/63/EU)进行。实验方案已由动物伦理委员会(国家动物实验伦理委员会(ANSES/ENVA/UPEC))和国家教育、高等教育和研究部评估和批准(11-0042)。体内实验是在ANSES-Lyon实验室的动物设施中进行的,该实验室拥有相关的动物工作批准(C 69 387 0801),由在动物实验单元(许可编号AB: 69 387 531)工作的持牌人员进行。每组动物被安置在一个温度控制的房间里的强化笼子里,光照/黑暗周期为12小时,自由取水和食物。
发表同意书
不适用。
相互竞争的利益
作者宣称他们之间没有利益冲突。
额外的信息
出版商的注意
伟德体育在线施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
补充信息
附加文件1:表S1。
水动力直径(nm)2-和CB-NPs在22°C下用DLS测量。二氧化钛聚集体直径(nm)2和CB纳米颗粒(5至80 μ g ml−1)在NP超声、PBS稀释和2000 g离心2秒以去除大团聚体后用DLS测量。对于5µg ml,水动力直径无法测量−1NP浓度。实验一式三次。
附加文件2:图S1。
水动力直径(nm)2-和CB-NPs在37°C的DMEM/F12中通过DLS测量。二氧化钛聚集体直径(nm)2在NPs超声、DMEM/F12稀释、2000 g离心2秒以去除大团聚体后,用DLS测量CB纳米颗粒。10、25、50 μ g ml−1, TiO2-NPs的平均直径分别为130 nm(多分散性指数-PDI = 0.21)、206 nm (PDI = 0.53)和375 nm (PDI = 0.22), CB-NPs分别为171 nm (PDI = 0.13)、188 nm (PDI = 0.15)和327 nm (PDI = 0.52)。实验一式三次。
附加文件3:图S2。
TiO2CB纳米颗粒在血清素能1C11的质膜上引起TACE消耗和TNFR1积累5 -神经元细胞依赖于pdk1。TNFR1一个,别说话b1C11细胞表面免疫染色5 -神经元细胞暴露于TiO 4小时2-或CB-NPs(1µg cm−2)在PDK1抑制剂BX912(1µM)存在或不存在的情况下,以及相关的定量直方图。展示了三次重复进行的三个实验的代表性图像。数值为平均值±SEM。*表示p< 0.05和**p与未暴露细胞相比< 0.01。
附加文件4:图S3。
TiO2CB纳米颗粒可促进1C11前体和1C11中Aβ40的生成5 -神经细胞。一个elisa法定量Aβ40多肽在1C11和1C115 -暴露于TiO的神经元细胞2-或CB-NPs(1µg cm−2)长达24小时。b通过RT-qPCR和Western-blotting检测TiO暴露1C11细胞中APP和BACE1的表达水平2-或CB-NPs(1µg cm−2) 4小时。celisa法测定1C11中Aβ40多肽5 -暴露于TiO的神经元细胞2-或CB-NPs(1µg cm−2) 4小时,无论是否存在siRNA朝向PrPC(siPrP)或PDK1抑制剂BX912(1µM)。实验共进行3次,每次重复3次。数值为平均值±SEM。*表示p< 0.05, **p< 0.01, ***p< 0.001, ****p与未暴露细胞相比< 0.0001。
附加文件5:图S4。
PrP腐败C-耦合信号通路的TiO2-和神经元细胞中的CB-NPs:朝着一些TiO的促阿尔茨海默作用2和溴苯纳米颗粒。细胞朊病毒蛋白PrPC是一种被TiO2-和神经元细胞中的CB-NPs。全长PrP之间的相互作用CNPs动员PrPC-偶联信号通路,导致(i) NADPH氧化酶的激活和ROS的产生,以及(ii) PDK1的激活,促进TACE α-分泌酶的内化,从而在质膜TNFR1的积累和Aβ40/42的产生中降低TACE脱落活性。这种NP干扰PrPC信号网络触发阿尔茨海默病的分子体征:细胞氧化还原平衡的改变,TNFα炎症应激的神经元启动,以及神经毒性Aβ40/42肽的积累(使用Servier医学艺术绘制的图像)。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条所提供的资料,除非在资料的信用额度中另有说明。
关于本文
引用本文
Ribeiro, l.w., Pietri, M, Ardila-Osorio, H。et al。二氧化钛和炭黑纳米颗粒通过过度激活细胞朊蛋白信号来破坏神经元内稳态。部分纤维毒物19, 48(2022)。https://doi.org/10.1186/s12989-022-00490-x
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12989-022-00490-x
关键字
- 纳米粒子
- PrPC受体
- 信号
- 肿瘤坏死因子α受体
- 一个β肽
- 神经炎症
- Nanoneurotoxicity
- 阿尔茨海默病