摘要
背景
空气污染,尤其是细颗粒物(PM),会导致脑损伤、认知能力下降,并增加患神经退行性疾病的风险,尤其是阿尔茨海默病(AD)。在动物实验中,在暴露后的大脑中发现了典型的淀粉样蛋白和tau蛋白积累的病理表现。然而,这些观察是基于高水平的PM暴露,这与世卫组织指南和我们环境中存在的标准相距甚远。此外,空气污染对白质的影响较少报道。因此,本实验旨在模拟真实的人类世界,探讨空气污染可能导致的白质病理。
结果
将6个月大的雌性3xTg-AD小鼠分为暴露组和对照组,在台北空气污染物暴露系统(TAPES)中饲养5个月。暴露后对小鼠进行莫里斯水迷宫测试,然后进行脑解剖以供进一步分析。PM的平均质量浓度2.5暴露时间为13.85 μg/m3..暴露后,两组之间的空间学习功能没有差异,但暴露组的记忆有明显的衰退。暴露后的组织病理学染色显示总脑容量显著下降,大脑和内嗅皮层神经元死亡和胼胝体脱髓鞘增多。但免疫组化染色显示淀粉样蛋白和tau蛋白的积累无差异。在蛋白质分析中,大脑皮层中检测到的淀粉样蛋白水平明显较高,而白质中髓鞘碱性蛋白的表达较低。扩散张量图像研究还揭示了包括视神经束在内的多个白质束的损伤。
结论
总之,这项初步研究表明,即使长期暴露在低PM环境中2.5浓度仍然会引起脑损伤,如脑萎缩、皮质神经元损伤和多发性白质束损伤。暴露后,典型的淀粉样蛋白级联病理学在脆弱的大脑区域没有明显出现。这些结果提示空气污染诱发脑损伤的致病途径多种多样,视神经可能是除嗅觉神经外的另一直接入侵途径。
简介
空气污染是指存在于大气中对生物有害的物质,它已成为现代工业世界中一个当前且日益严重的健康问题。空气污染成分复杂,可能包括颗粒物(PM)、一氧化碳、铅、二氧化氮、臭氧和二氧化硫。其中,直径小于2.5 μ m的小PM (PM2.5)被认为是最有害的[1].《2015年全球疾病、伤害和风险因素负担研究》(GBD 2015)估计,PM2.5是第五大死亡风险因素,占全球死亡总数的7.6% [2].在动物和流行病学研究中,空气污染与呼吸或心血管系统损害之间的关系已得到充分证明[3.,4,5,6,7,8].然而,越来越多的出版物也提到与空气污染有关的认知能力下降和痴呆症[9,10].
PM暴露可导致脑损伤,包括脑容量减少、认知能力下降、血脑屏障异常和脑神经细胞炎症;此外,还会增加患阿尔茨海默病(AD)、帕金森病,甚至缺血性脑血管病的风险[11,12,13].AD是最常见的痴呆症类型,60% - 70%的病例由它引起。在一项荟萃分析和论文综述中,空气污染物与AD的总体优势比(OR)为1.32 (95% CI: 1.09-1.61),尤其是PM2.5[12].《柳叶刀》委员会2020年的报告也将空气污染物列为主要可预防因素之一[14].
淀粉样蛋白级联理论已被用来解释AD的发病机制。由病理性淀粉样β肽(Aβ)和过磷酸化tau蛋白(P-tau)积累的细胞外老年斑和细胞内神经纤维缠结被认为是本病的病理标志物[15].有认知障碍的老年人暴露在高浓度的PM中2.5有更多的脑Aβ斑块,如氟18 [18]F]标记florbetapir PET扫描[16].在高暴露于PM的城市居民中,还报告了AD的特征流体标记物,脑脊液(CSF)中Aβ42降低和P-tau蛋白水平升高2.5[11].暴露于高浓度空气污染物后,动物模型的大脑中发现了加速的淀粉样斑块沉积和P-tau积累,特别是在海马区[17,18,19,20.,21].炎症、氧化应激、小胶质细胞激活、甚至DNA损伤的连续途径被认为会导致这种退行性病理[17,19,22,23,24].
传统上,白质高强度被认为是血管疾病的标志,但在最近的一项研究中,白质高强度在AD病理中也很常见[25].然而,与Aβ或tau积聚的地形无关,这种病理变化被认为是由于血管过程共存或激活的少突胶质细胞对髓磷脂的破坏[26,27].也有报道称,暴露在空气污染中会影响白质,但仅在少数高浓度的动物和人体研究中[28,29].然而,确切的机制还有待进一步研究。
大量动物研究表明,暴露于高浓度PM的小鼠大脑灰质和白质区域存在ad相关的神经毒性[17,23,30.,31].然而,在现实世界中,PM2.5浓度一般不像上面讨论的大多数动物研究中的浓度那么高。在模拟真实情况时,长期暴露于环境空气污染是最好的模型。在我们之前的研究中,AD转基因小鼠暴露于环境空气污染3个月后,仅在一些灰质区域,特别是内嗅皮层出现了轻微的AD样病变[32].因此,我们设计了更长的暴露时间的动物实验,研究ad相关病理和中间致病过程的相关标志物,并利用磁共振成像(DTI-MRI)弥散张量成像技术研究白质损伤。
方法
台北市空气污染物暴露系统(磁带)
本研究采用定制的空气污染物暴露系统(见补充)。该系统由国立台湾大学公共卫生学院(台北市)的实验室建立。将环境空气直接引入实验室内,模拟真实环境。对照组室连接高效空气微粒过滤器。我们使用37毫米特氟龙过滤器(Pall公司,华盛顿港,纽约,美国)和DustTrak™II气溶胶监测仪8530 (TSI,肖维瓦,明尼苏达州,美国)定期记录质量浓度和颗粒大小。这个真实空气污染暴露系统的结构和材料的详细设计已在先前的出版物[33].采用离子色谱法和电感耦合等离子体质谱法对颗粒物的成分进行了进一步分析2.5[34,35].
动物和实验协议
驯化和近交系AD转基因小鼠(3xTg-AD)来自Chiu教授的团队。这些小鼠被安置在单独的通风笼子中,光照/黑暗周期为12小时,恒温(22±2°C)和湿度(50±5%),并可获得饮食(LabDiet®5001;PMI®营养国际,布伦特伍德,密苏里州,美国)和水自由。所有管理均遵照国立台湾大学医学院及公共卫生学院动物护理及使用委员会(许可证号:20160545)的伦理规范。
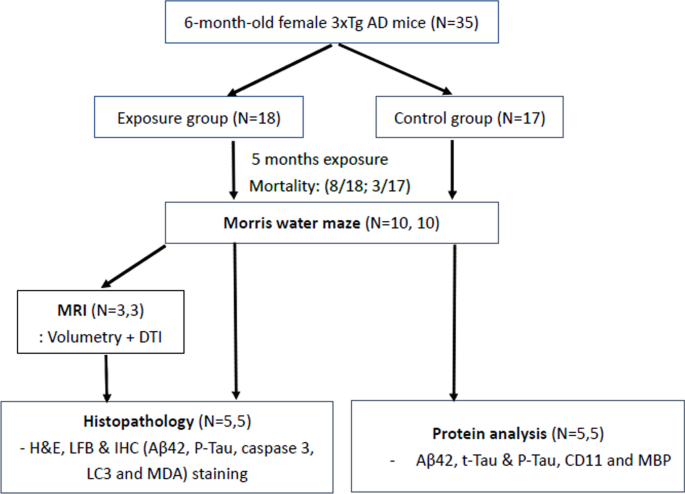
35只6个月大的3xTg-AD雌性小鼠被分为暴露组(n = 18)和对照组(n = 17),在2018年冬季至2019年春季期间暴露在环境空气或过滤空气中5个月。暴露后,存活小鼠(两组数量相等)进行Morris水迷宫试验,CO后处死2麻醉。一半的小鼠用布因溶液进行预处理,然后将整个大脑解剖并保存在10%的福尔马林中,用于脑磁共振成像和组织化学染色。另一半小鼠直接斩首,解剖后的大脑保存在-80°C下,用于进一步的蛋白质分析。完整实验方案如图所示。1.
莫里斯水迷宫(MWM)
这种评估小鼠或大鼠空间学习能力的标准方法是根据原始设计在动物实验室环境中进行的[36].迷宫(直径100厘米的水池)灌满30厘米深的水,用温度调节器保持在24±1°C。在迷宫的一个象限内放置一个低于水面1cm的平台,每个象限的壁上分别贴有4个标记作为线索。在实验的前4天(获取试验),每只小鼠被训练三次,在迷宫的每个象限内60 s内找到平台。如果鼠标失败,则直接将其放置在平台上,再放置10秒。在第5天(探针试验),小鼠被迫在没有平台的水池中游泳60秒。使用动物行为/轨迹跟踪分析系统(Noldus EthoVision 3.1,荷兰)记录逃逸潜伏期和相关参数。
磁共振成像(MRI)
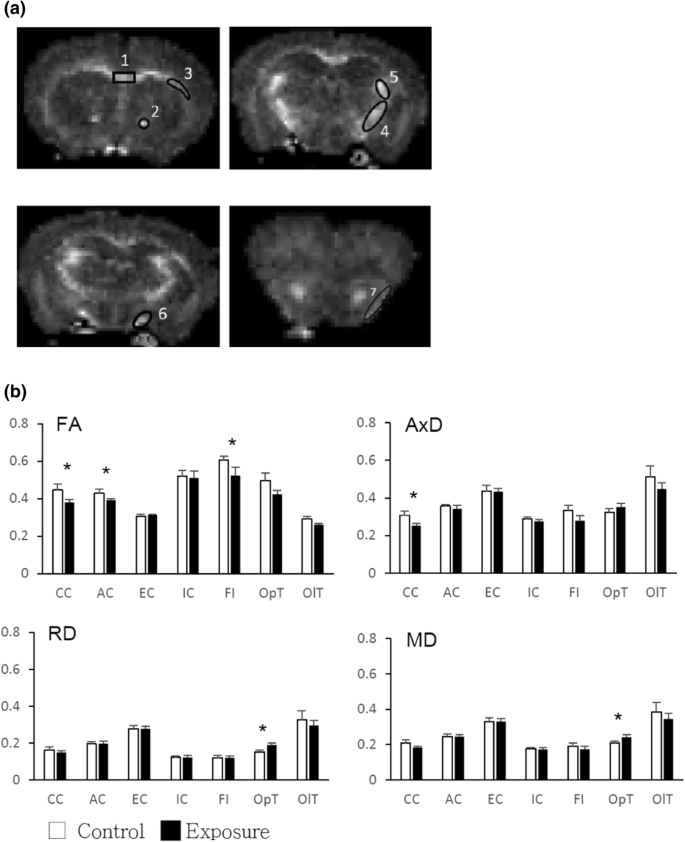
每组选取3只小鼠进行离体MRI脑图像分析。小鼠被麻醉,并提前灌注布因溶液来固定脑组织。整个大脑被解剖并保存在10%的福尔马林中。大脑图像采集在3 T MRI系统(Achieva, Philips Health care, Best, Netherlands)上进行,最高强度为675 mT/m的超高强度梯度线圈。每个样本均可定时进行脑MRI扫描测序,包括高分辨率轴向t2加权成像(TR/TE = 4000/34,切片厚度= 0.5 mm,切片数= 35),用于感兴趣区域的容量分析[37].弥散张量成像(DTI)参数为:TR = 2000 ms, TE = 37 ms,扩散梯度对差值(Δ) = 20 ms,扩散梯度脉冲持续时间(Δ) = 4.5 ms,扩散梯度强度= 19.87 G/cm, b值= 1000 s/mm2.图像数据的切片厚度为0.5 mm,总切片数为30,视场为35 cm × 35 cm,矩阵为192 × 192。数据分析采用ImageJ软件[38].利用扩散张量得到的特征值(λ1、λ2、λ3)计算DTI指标:分数各向异性(FA)、平均扩散系数(MD)、轴向扩散系数(AxD)和径向扩散系数(RD) [39].根据小鼠脑图谱选择视神经束、前连合、胼胝体、内囊、外囊和毛毛的感兴趣区域。利用计算机软件对每个区域的平均DTI指标进行平均。
组织病理学和免疫组化染色
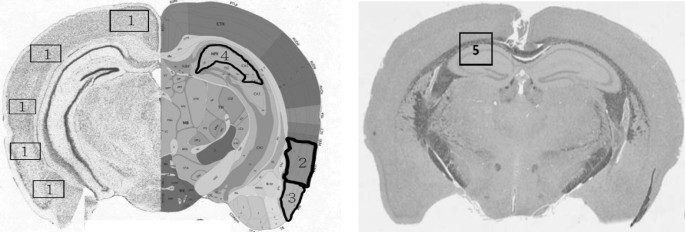
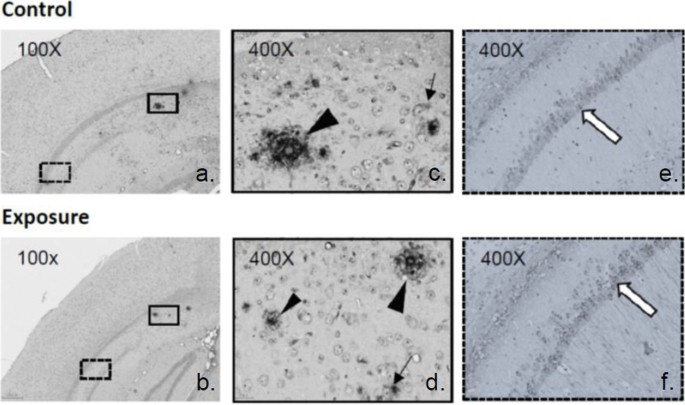
每组5只小鼠进行分析。石蜡包埋福尔马林固定脑,冠状切片厚度为3 ~ 5 μm。石蜡切片再水化后用苏木精-伊红(H&E)和甲酚紫(Nissl染色)染色测定神经元活力,用Luxol耐蚀蓝(LFB)染色髓鞘结构。一名训练有素的助手计算所选皮层区域中存活的神经元,包括大脑、内嗅、梨状和海马CA1区域(图2)。2).在暴露组和对照组的连续冠状动脉切片的lfb染色玻片上,测定了胼胝体中的髓鞘密度比。2).如前所述,使用ImageJ软件进行分析[40].
免疫组化(IHC)染色时,在煮沸的柠檬酸缓冲液(pH为6.0)中提取Aβ42、P-tau、caspase 3、微管相关蛋白1A/ 1b轻链3 (LC3)和丙二醛(MDA)抗原,并孵育20分钟。然后,用以下单个一抗阻断切片:Aβ42 (MOAB-2, NBP2-13,075;Novus Bio, USA) 200倍稀释,磷酸化tau (GTX26864;GeneTec, USA) 50X稀释,Caspase-3 (bs-0081R;biisss, USA) 500倍稀释,LC-3 (MAP LC3α/β抗体G4, Santa Cruz, USA) 300倍稀释,MDA (ab6463;Abcam,美国)稀释200倍。组织切片用3,3 ' -二氨基联苯胺(DAB)和苏木精反染色。
Western blot分析
每组另外5个新鲜冷冻小鼠大脑用于蛋白质分析。每个大脑被分为3个部分:海马体、大脑皮层和皮层下区域(定义为白质区)。详细的western blot分析方案参考了以前的研究,并进行了一些修改[41,42].用BCA蛋白测定试剂盒从脑样本中提取蛋白质。然后用单独的十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)对蛋白质进行电泳,转移并在聚偏氟乙烯膜上进行阻断。处理后的膜与以下不同的一抗在4°C孵育过夜:β淀粉样蛋白1-42抗体(Aβ42, ab201060;1:1000), total-tau (t-tau, GTX112981;1:1000)和磷酸化的tau (P-tau, GTX24864;1:1000),自噬体标记(LC3B, LC2B (D11) XP@ Rabbit mAb, #3868;1:1000)、巨噬细胞和小胶质细胞标志物(anti-CD11, ab133357;1:1000),髓鞘碱性蛋白(MBP, GTX100042;1:1000)和β肌动蛋白(ab133357; 1:1000), purchased from GeneTex (Irvine, CA, USA), Abcam (Cambridge, UK), and Cell Signaling Technology (Danvers, MA, USA). After washing, the membranes were incubated with either anti-rabbit (1:10,000) or anti-mouse (1:10,000) horseradish peroxidase-labeled secondary antibodies purchased from GeneTex (Irvine, CA, USA). Enhanced chemiluminescence (ECL) was used for immunoreaction, and the imaging results were taken by the BioSpectrum 810 Imaging System (UVP, Upland, CA, USA). The protein expression levels were calculated using Image-Pro version 4 (Media Cybernetics, Inc., MD, USA).
统计分析
所有统计分析均采用SPSS 19.0版本for Windows软件包进行。数据以均数±标准误差(SE)表示。组间比较采用独立学生t检验和Wilcoxon秩和检验。显著性水平被设定为P< 0.05。
结果
PM的浓度和化学成分2.5
PM的平均质量浓度2.5暴露时间为13.85 μg/m3.(5.88 ~ 18.79),与13.0 μg/m的年平均值相近3.台北市政府于2018年报告。在PM的化学成分中2.5,水溶性离子最多的是SO42−(67.09%)和NH4 +(22.44%),而Ca、K、Na是最常见的金属成分(数据未显示)。可以估计,这种环境PM2.5主要来自交通尾气。
动物死亡率和莫里斯水迷宫
暴露组和对照组从基线到终点的平均体重无显著差异(26.9-30.9 g VS. 26.8-32.9 g),但暴露组和对照组分别有8只转基因小鼠和3只转基因小鼠在实验期间死亡;PM的死亡率明显较高2.5暴露组(44.4 VS. 17.6%)。
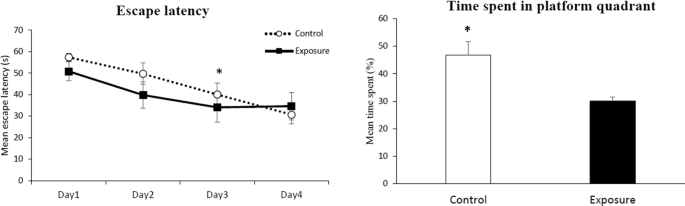
在Morris水迷宫测试中,两组在习得期(第1天和第3天之间)都注意到了学习过程,P<0.05,学生t检验;无花果。3.),但两者并无显著差异。暴露组在第4天没有进一步的学习效果。两组在平均游泳距离和速度上也没有差异2.5暴露组和对照组(数据未显示)。在探测阶段,对照组小鼠在靶区停留的时间比暴露组小鼠长(46.77±4.92% VS. 30.17±1.40%)。P<0.05,学生t检验;无花果。3.).
神经元活力和髓鞘密度
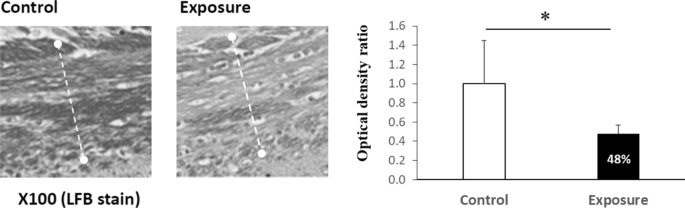
在H&E和nnisl染色切片上,比较暴露组和对照组中每个选定皮层区域的神经元活力(图2)。2).暴露小鼠的大脑和内嗅皮层区有显著水平的神经元损失,但梨状皮层或海马CA1区没有1).从LFB染色来看,与对照组相比,暴露组的胼胝体中髓鞘密度也显著降低(图2)。4).
磁共振成像
定位总脑容量和特定感兴趣区域,并使用ImageJ软件计算脑容量。与对照组相比,暴露组的总脑容量显著降低,但胼胝体无明显差异(表2)2).一些特定区域,如梨状皮层、内嗅皮层和海马CA1也位于特定的MRI切片上。我们没有发现暴露组和对照组之间有显著差异(数据未显示)。
磁共振成像(MRI)中的弥散张量成像(DTI)技术已广泛应用于白质完整性的体内评估。在正常的白质中,轴突排列规律,髓鞘丰富;水分子的随机扩散被限制在一个主要方向[43].分数各向异性(FA)表现出这种偏好,并用于评估尿道完整性,但没有病理特异性[44].平均扩散系数(MD)是膜密度的逆测量,对细胞、水肿和坏死的变化很敏感。完整的白质组织应具有高FA和低MD。为了评估病理特征,轴向扩散率(axial diffusivity, AxD)揭示了水沿纵轴扩散的速度,并与轴突变性有关[45,46].径向扩散率(RD)表示水沿垂直轴扩散的速率,与脱髓鞘或髓鞘异常有关[45,47].
对于DTI分析,选定的感兴趣区域(ROIs)如图所示。5a.除内囊和外囊外,暴露组大部分选定束的平均FA尺度均显著降低;然而,MD和RD测量的显著差异仅在视神经束中观察到(图。5b).与对照组相比,暴露组胼胝体中AxD值也明显降低(图。5b)。
免疫组织化学染色
我们计数了转基因小鼠大脑不同皮层选定区域的淀粉样斑块数量和阳性靶染色细胞比例。选择相同的冠状面,显示每只小鼠的海马CA1和外皮层区域,如图所示。2,在光镜下放大400倍分析。暴露小鼠大脑皮层的其他部位,海马细胞外淀粉样斑块和神经元与细胞内淀粉样蛋白的比例略有增加,但与对照组相比差异不显著(图2)。6A, b, c, d;Addittional文件1:表S1)。在暴露的小鼠海马区P-tau病理的神经元中也观察到这种趋势,但在其他皮质部位没有观察到。6两组间caspase-3、LC-3、MDA的表达也无差异。
亚图c和d为亚图a和b中紧密缠结的放大图像,显示致密的淀粉样斑块(黑色三角形)和细胞内弥漫性淀粉样蛋白(细箭头);亚图e和f是亚图a和b中点状缠结的放大图像(相似位置,不同染色),显示细胞内P-tau(白色箭头)。
蛋白质分析
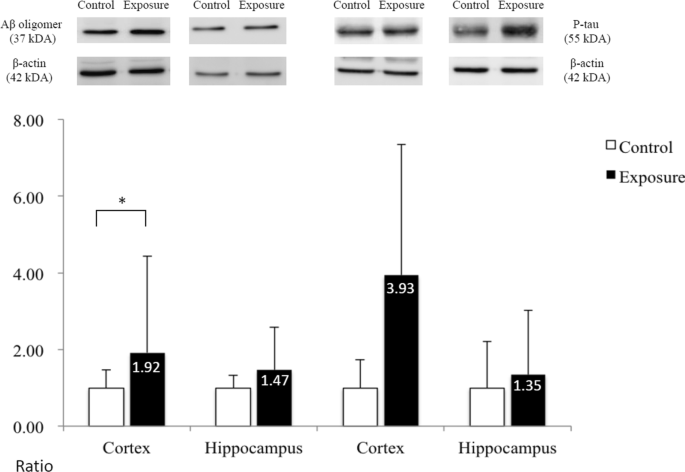
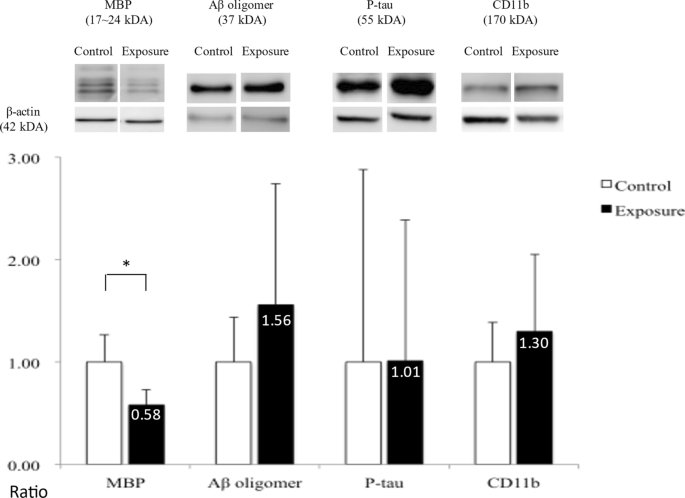
分别比较两组大鼠大脑皮层和脑白质区靶蛋白的数量。在皮层部分,与对照组相比,暴露组在整个大脑皮层中Aβ42寡聚物的表达明显增加,但在海马体中没有增加(P< 0.05);而阿尔茨海默病的另一病理靶蛋白P-tau在两组间仅呈趋势,无明显差异(图2)。7).在白质部分,暴露组的白质MBP水平也显著降低(P< 0.05;无花果。8), LFB染色显示髓鞘损伤。Aβ42寡聚物、P-tau和CD11b的表达水平也无显著差异。
讨论
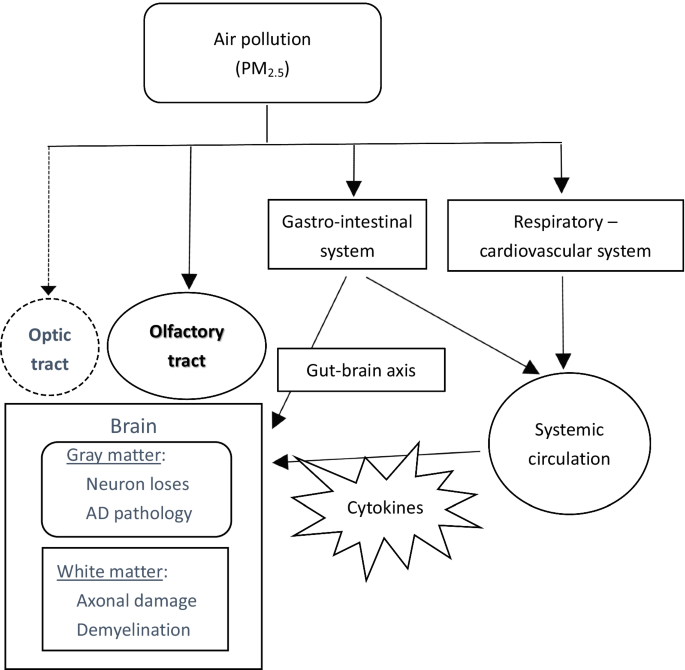
点2.5,由于微粒体积小,可深入呼吸道引发各种健康问题,被广泛认为是空气污染物成分中最有害的因子[48].除了众所周知的呼吸系统和心血管疾病,PM2.5也会对大脑造成损害,包括各种神经退行性疾病,尤其是阿尔茨海默病[49].点2.5通过嗅觉神经直接侵入大脑,并可通过体循环破坏血脑屏障的完整性[50,51].外周全身性炎症物质穿过血脑屏障,容易到达大脑,小胶质细胞也被激活,诱发神经炎症[49,52].更多的促炎细胞因子,如IL-1β和TNF-α被释放,然后导致神经元和轴突的退化[53].此外,PM2.5可直接或间接进入胃肠道,引起肠道微生态失衡。肠道-脑轴功能异常已被证明与许多神经退行性疾病的发展或恶化有很强的关系(图。9,实线)[54,55,56].PM的表观遗传效应2.5也有报道,如反应性氧化对基因组的直接损伤或疾病相关基因的DNA甲基化改变[49,57,58,59].
除了PM的一般路线2.5上述神经毒性,痴呆和AD的确切病理机制仍需进一步阐明。从流行病学研究来看,大多数结果显示认知与PM呈负相关2.5浓度(60,61,62].在这项研究中,长期暴露于低剂量PM2.5,空间学习功能无显著差异,但暴露后记忆容易衰退,Morris水迷宫测试结果显示。以前类似的动物记忆损伤研究可能是剂量依赖的[63,64].相对低剂量的暴露,类似于本研究中环境大气环境的实验设计,只引起极小的认知或行为变化。在我们之前的啮齿类动物模型研究中也报道了类似的发现[18].
因此,长期暴露于环境空气污染后,仍存在一定的脑损伤和身体损伤。尽管在5个月的时间里,体重增加没有明显减少,但暴露小鼠的死亡率比对照组小鼠高2.5倍。我们之前的研究也显示了同样的趋势[32].从大脑MRI测量结果来看,与对照组相比,暴露小鼠的总脑容量明显减少,但在包括海马体在内的不同大脑皮层区域没有检测到这种差异。镜下观察,一般大脑和内嗅皮层区神经元损失较明显,海马区未见神经元损失。对于海马体体积萎缩和神经元丢失的保留,这些发现可以解释水迷宫中空间学习功能障碍的阴性结果,也可能意味着低剂量PM造成的最小脑损伤2.5并不是直接由阿尔茨海默病相关的病理引起的。
这一现象也得到了AD的病理标记物测量的支持。从免疫组化染色结果看,暴露后皮层只有细胞外斑块或细胞内淀粉样蛋白和P-tau增加的趋势。Western blot分析显示,暴露小鼠大脑皮层中a β42的生成显著增加。这一结果似乎与之前的类似动物研究相冲突,后者报告了暴露后大脑中Aβ和P-tau病理水平升高[17,24,65].然而,大多数研究设计了较高水平的PM暴露(范围为65.7 ~ 468.0 μg/m)3.),相当于人类在现实世界中所受辐射的数倍[17,23,53].因此,我们假设长期暴露于环境空气污染的可能性与平均PM2.5在3xTg-AD小鼠模型中,13.85 μg/m3的浓度能够增加毒性淀粉样蛋白和P-tau的产生,但如先前报道的那样,不足以引起阿尔茨海默病的后续和典型的级联损伤。然而,老化效应和更长的暴露时间在这个实验中没有得到验证。
许多神经影像学研究报告了暴露于空气污染与儿童和老年人总脑容量减少之间的关联;然而,当研究集中在灰质,特别是皮层下的大脑结构体积(即海马体、杏仁核和基底神经节)时,这些结果是可变的[60,66,67].相比之下,报告了与空气污染相关的白质总量和不同相关区域(即额叶、顶叶、颞叶和胼胝体)减少的更一致模式[60,66,67,68].最近,白质脱髓鞘也报道在小鼠模型与PM2.5被认为是通过促进神经炎症或损害髓鞘修复而引起的[69].从我们的研究结果来看,暴露于PM的小鼠,胼胝体的髓鞘化减少,白质中MBP的表达减少2.5也支持这个观点。但同时CD11b的表达没有明显增加。由小胶质细胞诱导的神经炎症引起的白质损伤可能不是主要和唯一的原因。
从本研究的DTI测量结果来看,除了内部和外部胶囊外,大多数暴露小鼠的白质束完整性受损,这在AD病理中也较少报道。然而,轴突膜损伤仅见于视神经束。这种环境空气污染可能没有对白质造成严重损害,这一发现也与上面提到的其他病理发现相一致。最有趣的是,视神经束很少被报道受到空气污染的影响。在一项动物实验中,暴露在吸烟环境中的幼鼠视神经纤维的髓鞘形成减少[70].我们的研究也证实了视神经束的脱髓鞘损伤(RD值增加)。因此,除了众所周知的空气污染物通过嗅觉神经直接进入大脑的途径外,视神经和呼吸道系统可能是另一种替代途径。不幸的是,眼球和视神经组织没有被保存下来,以便进一步证明。激活小胶质细胞和巨噬细胞引起神经炎症被认为在污染相关的白质病变中起主要作用。然而,暴露后皮层下白质区神经炎症标志物(CD11b)没有显著升高。另一种常见的小胶质细胞相关标志物Iba-1在我们之前的研究中仅在环境暴露3个月后的大脑皮层中表达上调[32].DTS研究还怀疑胼胝体轴突损伤。这两项发现都表明,空气污染对白质的损伤不仅仅是一种独特的病理机制;和总理2.5不同大脑区域的神经毒性可能不同。可能需要进一步的研究来澄清这些结果,特别是包括完整的炎症调查和血管因素。
本研究设计存在一些不足之处。首先,暴露时间较长的AD转基因小鼠死亡率很高,而且样本量不够,尤其是同时研究灰质和白质。其次,我们试图尽可能地研究空气污染引起神经毒性的可能机制,但无法通过交互途径看到。第三,6个月大的转基因小鼠与人类的中年相吻合。以往关于空气污染引起的神经毒性的流行病学研究大多报告在儿童和老年人中。因此,在该模型中,年轻或年老的小鼠可能是更好的选择。
结论
综上所述,本先导研究研究了慢性环境空气污染对AD转基因小鼠白质的损伤。PM2.5在5个月的暴露期间,大部分浓度没有超过世卫组织的标准。然而,即使在较低的毒性浓度下,它仍然会造成一些脑损伤,如脑萎缩、皮质神经元损伤和多发性白色束损伤。暴露后,典型的淀粉样蛋白级联病理学在脆弱的大脑区域没有明显出现,记忆功能也没有受到严重影响。除皮层神经元丢失外,包括视神经束在内的皮层下区域也有白质损伤。这些结果表明,空气污染引起脑损伤的致病途径多种多样,视神经可能是空气污染除嗅觉神经外的另一条直接入侵途径(图2)。9,虚线)。
数据和材料的可用性
不适用。
参考文献
崔杰,吴志勇,李玉生,闵克勤,许光勇,李世永,等。空气污染对慢性阻塞性肺病严重急性加重的有害影响:颗粒物是有害的。中国医学杂志,2018;13:1053-9。https://doi.org/10.2147/COPD.S156617.https://pubmed.ncbi.nlm.nih.gov/29681728https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5881527/.
Cohen AJ, Brauer M, Burnett R, Anderson HR, Frostad J, Estep K,等。环境空气污染造成的全球疾病负担的估计和25年趋势:2015年全球疾病负担研究数据分析《柳叶刀》2017;389(10082):1907-18。https://doi.org/10.1016/s0140 - 6736 (17) 30505 - 6.https://www.sciencedirect.com/science/article/pii/S0140673617305056
almettwally AA, Bin-Jumah M, Allam AA。环境空气污染及其对人类健康和福利的影响:综述。环境科学学报,2020;27(20):24815-30。https://doi.org/10.1007/s11356-020-09042-2.
程天杰,黄建生,王鹏云,蔡昌峰,陈昌勇,林世华,等。高浓度环境颗粒对肺动脉高压大鼠心率和血压的影响。《环境卫生展望》,2003;111(2):147-50。https://doi.org/10.1289/ehp.5464.https://pubmed.ncbi.nlm.nih.gov/12573896https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1241341/.
庄坤杰,闫艳华,赵淑云,程天杰。台湾老年人长期接触空气污染与心血管疾病的危险因素中华医学杂志,2011;29(1):344。https://doi.org/10.1136/oem.2009.052704.http://oem.bmj.com/content/68/1/64.abstract.
林志刚,王晓明,王晓明。空气污染与心血管疾病的关系。中国心血管病杂志,2015;40(5):207-38。https://doi.org/10.1016/j.cpcardiol.2015.01.003.https://www.sciencedirect.com/science/article/pii/S0146280615000043.
Schraufnagel DE, Balmes JR, Cowl CT, DE Matteis S, Jung S- h, Mortimer K,等。空气污染与非传染性疾病:国际呼吸学会环境委员会论坛综述,第2部分:空气污染与器官系统。胸部。2019;155(2):417 - 26所示。https://doi.org/10.1016/j.chest.2018.10.041.https://www.sciencedirect.com/science/article/pii/S0012369218327223.
闫艳华,黄春华,陈文杰,吴明峰,程天杰。柴油机废气颗粒对异丙肾上腺素心肌损伤大鼠及健康大鼠左心室功能的影响吸入毒物。2008;20(2):199-203。https://doi.org/10.1080/08958370701861082.https://pubmed.ncbi.nlm.nih.gov/18236234.
陈瑞敏,李志刚,陈志强,陈志强。空气污染暴露与认知功能的关系——一项系统的文献综述。环境决议2016;147:383-98。https://doi.org/10.1016/j.envres.2016.01.018.https://www.sciencedirect.com/science/article/pii/S0013935116300172.
彼得斯R,彼得斯J,布斯A,穆德韦I.空气污染与认知能力下降风险增加有关吗?系统回顾。老龄化。2015;44(5):755-60。https://doi.org/10.1093/ageing/afv087.
Calderón-Garcidueñas L, Avila-Ramírez J, Calderón-Garcidueñas A, González-Heredia T, Acuña-Ayala H, Chao C-k,等。高暴露PM 2.5城市人群脑脊液生物标志物:& nbsp的风险阿尔茨海默病和帕金森病在& nbsp;年轻的墨西哥城居民。老年痴呆症杂志2016;54:597-613。https://doi.org/10.3233/JAD-160472.
付鹏,郭旭,张FMH,容家亮。PM2.5暴露与神经系统疾病之间的关联:系统综述和荟萃分析科学通报。2019;655:1240-8。https://doi.org/10.1016/j.scitotenv.2018.11.218.https://www.sciencedirect.com/science/article/pii/S0048969718345741.
洪永春,李建涛,金辉,权洪杰。空气污染:缺血性中风死亡的新危险因素。中风。2002;33(9):2165 - 9。https://doi.org/10.1161/01.str.0000026865.52610.5b.https://pubmed.ncbi.nlm.nih.gov/12215581.
李文斯顿G,亨特利J, Sommerlad A, Ames D, Ballard C, Banerjee S,等。痴呆症的预防、干预和护理:柳叶刀委员会2020年的报告。《柳叶刀》,2020;396(10248):413-46。https://doi.org/10.1016/s0140 - 6736 (20) 30367 - 6.https://www.sciencedirect.com/science/article/pii/S0140673620303676.
Hardy J, Selkoe DJ。阿尔茨海默病的淀粉样蛋白假说:治疗方法上的进展和问题。科学。2002, 297(5580): 353。https://doi.org/10.1126/science.1072994.http://science.sciencemag.org/content/297/5580/353.abstract.
Iaccarino L, La Joie R, Lesman-Segev OH, Lee E, Hanna L, Allen IE,等。环境空气污染与老年认知障碍患者淀粉样正电子发射断层扫描阳性的关系。中国神经科学杂志,2021;78(2):197-207。https://doi.org/10.1001/jamaneurol.2020.3962.
Bhatt DP, Puig KL, Gorr MW, Wold LE, Combs CK。一项初步研究评估长期吸入空气中颗粒物对小鼠大脑早期阿尔茨海默样变化的影响。公共科学学报。2015;10(5):e0127102。https://doi.org/10.1371/journal.pone.0127102.https://www.ncbi.nlm.nih.gov/pubmed/25992783https://www.ncbi.nlm.nih.gov/pmc/PMC4439054/.
庄海春,陈海春,柴培杰,廖海涛,吴昌峰,陈昌林,等。自发性高血压大鼠3个月和6个月低水平PM2.5吸入改变神经病理。部分纤维毒物。2020;https://doi.org/10.1186/s12989-020-00388-6.
Herr D, Jew K, Wong C, Kennell A, Gelein R, Chalupa D,等。在3xTgAD小鼠模型中,高浓度环境超细颗粒物对阿尔茨海默病特征的影响神经毒理学。2021;84:172 - 83。https://doi.org/10.1016/j.neuro.2021.03.010.https://www.sciencedirect.com/science/article/pii/S0161813X21000334.
Hullmann M, Albrecht C, van Berlo D, Gerlofs-Nijland ME, Wahle T, Boots AW,等。柴油机尾气加速了阿尔茨海默病小鼠模型中斑块的形成。部分纤维毒物。2017;14(1):35。https://doi.org/10.1186/s12989-017-0213-5
Sahu B, Mackos AR, Floden AM, Wold LE, Combs CK。颗粒物暴露加剧APP/PS1小鼠淀粉样蛋白β斑块沉积和胶质细胞增生。阿尔茨海默病杂志;https://doi.org/10.3233/JAD-200919.
Calderon-Garciduenas L, Maronpot RR, Torres-Jardon R, Henriquez-Roldan C, Schoonhoven R, Acuna-Ayala H,等。暴露于空气污染物的犬鼻腔和脑组织中的DNA损伤与慢性脑炎症和神经退行性变的证据有关。中国药理学杂志,2003;31(5):524-38。https://doi.org/10.1080/01926230390226645.
Cacciottolo M, Morgan TE, Saffari AA, Shirmohammadi F, Forman HJ, Sioutas C,等。交通相关的空气污染物(TRAP-PM)通过对脂筏的氧化损伤促进神经元淀粉样蛋白的发生。自由基生物医学2020;147:242-51。https://doi.org/10.1016/j.freeradbiomed.2019.12.023.http://www.sciencedirect.com/science/article/pii/S0891584919321793.
王宝荣,史建强,葛楠楠,欧志,田玉玉,姜涛,等。在阿尔茨海默病体外模型中,PM2.5暴露加重低聚淀粉样蛋白β诱导的神经元损伤,并促进NLRP3炎症小体激活。神经炎症杂志,2018;15(1):132。https://doi.org/10.1186/s12974-018-1178-5.https://pubmed.ncbi.nlm.nih.gov/29720213https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5932821/.
格拉夫-雷德福J, Arenaza-Urquijo EM, Knopman DS, Schwarz CG, Brown RD Jr, Rabinstein AA,等。白质高强度:与淀粉样蛋白和tau负担的关系。大脑。2019;142(8):2483 - 91。https://doi.org/10.1093/brain/awz162.
Nasrabady SE, Rizvi B, Goldman JE, Brickman AM。阿尔茨海默病中的白质变化:重点是髓鞘和少突胶质细胞。神经病理学通讯学报。2018; 6(1): 22。https://doi.org/10.1186/s40478-018-0515-3.https://pubmed.ncbi.nlm.nih.gov/29499767https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5834839/.
罗斯伯勒A,拉米雷斯J,布莱克SE,爱德华兹JD。β淀粉样蛋白和白质高强度之间的关系:一项系统综述。老年痴呆症。2017;13(10):1154-67。https://doi.org/10.1016/j.jalz.2017.01.026.
Calderón-Garcidueñas L, Mora-Tiscareño A, Gómez-Garza G, Carrasco-Portugal MDC, Pérez-Guillé B, Flores-Murrieta FJ,等。环氧合酶-2优先抑制剂对暴露于空气污染的健康幼犬的影响:初步研究。中国药理学杂志。2009;37(5):644-60。https://doi.org/10.1177/0192623309340277.
Calderón-Garcidueñas L, Mora-Tiscareño A, Styner M, Gómez-garza G, Zhu H, Torres-Jardón R,等。暴露在空气污染中的儿童的白质高强度、全身炎症、大脑生长和认知功能。老年痴呆症杂志2012;31:183-91。https://doi.org/10.3233/JAD-2012-120610.
K Jew, Herr D, Wong C, Kennell A, Morris-Schaffer K, Oberdörster G,等。暴露于环境超细颗粒物后老年老年阿尔茨海默病小鼠的选择性记忆和行为改变部分纤维毒理学。2019;16(1):45。https://doi.org/10.1186/s12989-019-0323-3
伍华德,Pakbin P, Saffari A, Shirmohammadi F, Haghani A, Sioutas C,等。交通相关空气污染对小鼠大脑的影响加速了CA1神经元髓鞘和神经鞘的衰老变化。神经生物学老化。2017;53:48-58。https://doi.org/10.1016/j.neurobiolaging.2017.01.007.https://pubmed.ncbi.nlm.nih.gov/28212893https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5388507/.
李世华,陈永华,钱春春,闫永华,陈海春,庄海春,等。在阿尔茨海默病小鼠模型中吸入低浓度PM2.5三个月可诱发脑毒性。公共科学学报。2021;16(8):e0254587。https://doi.org/10.1371/journal.pone.0254587.https://pubmed.ncbi.nlm.nih.gov/34437570https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8389369/.
闫永华,张志强。周超,王建生,董春林,李永荣,罗坤,等。吸入环境颗粒物对1型糖尿病大鼠模型葡萄糖稳态和靶器官损伤的亚慢性影响。中国药理学杂志。2014;28(2):211-20。https://doi.org/10.1016/j.taap.2014.10.005.http://www.sciencedirect.com/science/article/pii/S0041008X14003664.
徐少春,刘顺生,黄艳涛,龙世昌,蔡峰,涂建勇,等。根据2002年至2007年初在台湾北部收集的Al浓度数据确定亚洲沙尘事件的标准。地球物理学报,2008;38(3):344 - 344。https://doi.org/10.1029/2007JD009574
萨尔瓦多CM,周CCK。细颗粒物中半挥发性物质(SVM)分析。环境科学学报。2014;29(2):366 - 366。https://doi.org/10.1016/j.atmosenv.2014.06.046.http://www.sciencedirect.com/science/article/pii/S1352231014004920.
用于研究大鼠空间学习的水迷宫程序的发展。神经科学杂志,1984;11(1):47-60。https://doi.org/10.1016/0165 - 0270 (84) 90007 - 4.https://pubmed.ncbi.nlm.nih.gov/6471907.
赵克华,黄世民,崔春华,陈明杰,蒋海华,Buschbeck RP,等。用于小动物MRI的超高强度梯度系统的开发、集成和使用PLoS One. 2019;14(6):e0217916。https://doi.org/10.1371/journal.pone.0217916
Schneider CA, Rasband WS, Eliceiri KW. NIH图像到ImageJ: 25年的图像分析。自然科学进展。2012;9(7):675 - 5。https://doi.org/10.1038/nmeth.2089.https://pubmed.ncbi.nlm.nih.gov/22930834https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5554542/.
李丽娟,李志强,李志强,等。扩散张量成像:概念与应用。磁共振成像。2001;13(4):534-46。https://doi.org/10.1002/jmri.1076.https://doi.org/10.1002/jmri.1076.
山本Y, Ihara M, Tham C, Low RWC, Slade JY, Moss T,等。CADASIL中颞极白质高强度的神经病理学相关。中风。2009;40(6):2004 - 11。https://doi.org/10.1161/STROKEAHA.108.528299.https://pubmed.ncbi.nlm.nih.gov/19359623https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2724668/.
李建民,李建民,李建民,等。蛋白从凝胶到重氮苯羟甲基纸的转移及抗血清检测:一种研究抗体特异性和抗原结构的方法。美国国家科学研究院。1979年,76(7):3116 - 20。https://doi.org/10.1073/pnas.76.7.3116.https://pubmed.ncbi.nlm.nih.gov/91164https://www.ncbi.nlm.nih.gov/pmc/articles/PMC383774/.
施春华,陈建坤,郭丽伟,赵克华,肖天成,林志伟,等。慢性肺部暴露于与交通有关的细颗粒物会导致成年大鼠的脑损伤。部分纤维毒物。2018;15(1):44。https://doi.org/10.1186/s12989-018-0281-1.https://pubmed.ncbi.nlm.nih.gov/30413208https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6234801/.
陈天峰,林春春,陈艳芳,刘红梅,华明生,黄艳春,等。失忆性轻度认知障碍和各种痴呆患者弥散张量的变化。精神病学研究:神经影像学。2009;173 1:15-21。https://doi.org/10.1016/j.pscychresns.2008.09.002.https://www.sciencedirect.com/science/article/pii/S0925492708001443.
张志刚,张志刚,张志刚。弥散张量磁共振成像的研究进展。放射学。1996;201(3):637 - 48。https://doi.org/10.1148/radiology.201.3.8939209.
Alves GS, Oertel Knöchel V, Knöchel C, Carvalho AF, Pantel J, Engelhardt E,等。将逆行理论整合到阿尔茨海默病病理:来自白质微观结构完整性的DTI-TBSS调查的见解。生物医学研究国际。2015; 2015:291658。https://doi.org/10.1155/2015/291658.https://pubmed.ncbi.nlm.nih.gov/25685779https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4320890/.
Mayo CD, Garcia-Barrera MA, Mazerolle EL, Ritchie LJ, Fisk JD, Gawryluk JR,等。阿尔茨海默病DTI指标与认知功能的关系前沿衰老神经科学。2019;10:436。https://doi.org/10.3389/fnagi.2018.00436.https://pubmed.ncbi.nlm.nih.gov/30687081https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6333848/.
王志强,王志强,王志强,等。Junqué C, Solé-Padullés C。正常衰老、健忘性MCI和AD患者DTI多指标分析。与神经心理表现的关系。神经生物学杂志,2012;33(1):61-74。https://doi.org/10.1016/j.neurobiolaging.2010.02.004.https://www.sciencedirect.com/science/article/pii/S0197458010000825.
崔浩,金绍华。空气污染与痴呆。老年痴呆神经认知杂志2019;18(4):109-12。https://doi.org/10.12779/dnd.2019.18.4.109.https://pubmed.ncbi.nlm.nih.gov/31942169https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6946615/.
寿艳,黄艳,朱霞,刘超,胡艳,王慧。PM2.5暴露与阿尔茨海默病发展可能关联的研究进展。生态毒理学杂志2019;174:344-52。https://doi.org/10.1016/j.ecoenv.2019.02.086.https://www.sciencedirect.com/science/article/pii/S0147651319302519.
Calderón-Garcidueñas L, Franco-Lira M, Henríquez-Roldán C, Osnaya N, González-Maciel A, Reynoso-Robles R,等。城市空气污染:对暴露儿童和青年人的嗅觉功能和病理的影响。中国药理学杂志,2010;29(1):1 - 2。https://doi.org/10.1016/j.etp.2009.02.117.https://pubmed.ncbi.nlm.nih.gov/19297138https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2832203/.
Elder A, Gelein R, Silva V, Feikert T, Opanashuk L, Carter J,等。吸入的超细氧化锰颗粒转移到中枢神经系统。环境卫生展望,2006;114(8):1172-8。https://doi.org/10.1289/ehp.9030.https://pubmed.ncbi.nlm.nih.gov/16882521https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1552007/.
徐明霞,朱艳芳,常海峰,梁颖。纳米灰通过抑制Nrf2缺陷小鼠星形胶质细胞活化相关NF-κB通路抑制pm2.5诱导的代谢紊乱和下丘脑炎症。《游离自由基生物医学》2016;99:259-72。https://doi.org/10.1016/j.freeradbiomed.2016.08.021.https://www.sciencedirect.com/science/article/pii/S0891584916304026.
程华,萨法里A,苏塔斯C,福尔曼HJ,摩根TE,芬奇CE。城市交通中的纳米颗粒物可迅速诱导嗅上皮细胞氧化应激和炎症反应,并对大脑产生连带影响。环境卫生展望。2016;124(10):1537-46。https://doi.org/10.1289/ehp134.
Benakis C, Martin-Gallausiaux C, Trezzi J-P, Melton P, Liesz A, Wilmes P.急性和慢性脑疾病中的微生物-肠道-脑轴。《神经生物学杂志》2020;61:1-9。https://doi.org/10.1016/j.conb.2019.11.009.https://www.sciencedirect.com/science/article/pii/S0959438819301084.
Kish L, Hotte N, Kaplan GG, Vincent R, Tso R, Gänzle M,等。环境颗粒物诱发小鼠肠道炎症反应,改变肠道微生物群。公共科学学报,2013;8(4):e62220。https://doi.org/10.1371/journal.pone.0062220.https://pubmed.ncbi.nlm.nih.gov/23638009https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3634745/.
帕金森病的发病机制——肠脑轴与环境因素。神经科学进展。2015;11(11):625-36。https://doi.org/10.1038/nrneurol.2015.197.
Baccarelli A, Wright RO, Bollati V, Tarantini L, Litonjua AA, Suh HH,等。暴露于交通微粒后,DNA甲基化迅速改变。中华呼吸急救杂志。2009;39(7):572 - 572。https://doi.org/10.1164/rccm.200807-1097OC.https://pubmed.ncbi.nlm.nih.gov/19136372https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2720123/.
Tarantini L, Bonzini M, Apostoli P, Pegoraro V, Bollati V, Marinelli B,等。颗粒物对基因组DNA甲基化含量和iNOS启动子甲基化的影响。《环境卫生展望》,2009;117(2):217-22。https://doi.org/10.1289/ehp.11898.https://pubmed.ncbi.nlm.nih.gov/19270791https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2649223/.
王志强,王志强,王志强,等。体外培养的人体细胞和暴露于交通相关颗粒的人体中的氧化DNA损伤和炎症反应。《国际卫生与环境卫生杂志》,2014;217(1):23-33。https://doi.org/10.1016/j.ijheh.2013.03.002.https://www.sciencedirect.com/science/article/pii/S1438463913000400.
陈景晨,王旭,韦伦纽斯,Serre ML, Driscoll I, Casanova R,等。环境空气污染和大脑结构的神经毒性:来自女性健康主动记忆研究的证据。中华神经科学杂志,2015;28(3):466-76。https://doi.org/10.1002/ana.24460.
赫奇斯DW,埃里克森LD,昆泽尔曼J,布朗BL,盖尔SD。在英国生物库中,暴露于空气污染和成年人海马体积之间的关系。神经毒理学。2019;74:108-20。https://doi.org/10.1016/j.neuro.2019.06.005.https://www.sciencedirect.com/science/article/pii/S0161813X19300531.
Wilker EH, Preis SR, Beiser AS, Wolf PA, Au R, Kloog I,等。长期暴露在细颗粒物中,居住在主要道路附近,以及大脑结构的测量。中风。2015;46(5):1161 - 6。https://doi.org/10.1161/strokeaha.114.008348.
库涛,李波,高锐,张勇,严伟,季晓,等。NF-κ b调控的microRNA-574-5p是大气PM(2.5)吸入反应的突触和认知障碍的基础。部分纤维毒物。2017;14(1):34。https://doi.org/10.1186/s12989-017-0215-3.https://pubmed.ncbi.nlm.nih.gov/28851397https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5575838/.
刘娟,杨超,杨娟,宋旭,韩伟,谢敏,等。出生后早期暴露于细颗粒物对未成熟和成熟大鼠情绪和认知发育及结构突触可塑性的影响。大脑与行为。2019;9(12):e01453。https://doi.org/10.1002/brb3.1453.https://doi.org/10.1002/brb3.1453.
Bolton JL, Smith SH, Huff NC, Gilmour MI, Foster WM, Auten RL,等。产前暴露在空气污染中会诱发神经炎症,并使后代在成年后容易以性别特有的方式体重增加。中国生物医学工程学报。2012;26(11):4743-54。https://doi.org/10.1096/fj.12-210989.https://pubmed.ncbi.nlm.nih.gov/22815382.
Calderón-Garcidueñas L, Engle R, Mora-Tiscareño A, Styner M, Gómez-Garza G, Zhu H,等。暴露在严重的城市空气污染中会影响临床健康儿童的认知结果、脑容量和全身炎症。中华脑科学杂志,2011;27(3):344 - 344。https://doi.org/10.1016/j.bandc.2011.09.006.https://www.sciencedirect.com/science/article/pii/S0278262611001850.
杨晓明,杨晓明,杨晓明。空气污染对大脑的影响:环境流行病学与神经影像学研究综述。当前环境健康报告。2018; 5(3): 351 - 64。https://doi.org/10.1007/s40572-018-0209-9.https://pubmed.ncbi.nlm.nih.gov/30008171https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6132565/.
王晓霞,王晓明,王晓明,王晓明,等。一项基于体素的形态测量学研究揭示了老年女性的局部大脑结构变化与周围的细颗粒有关。神经科学,2016;10:495。https://doi.org/10.3389/fnhum.2016.00495.https://pubmed.ncbi.nlm.nih.gov/27790103https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5061768/.
Parolisi R, Montarolo F, Pini A, Rovelli S, Cattaneo A, Bertolotto A,等。暴露于细颗粒物(PM2.5)阻碍了白质脱髓鞘小鼠模型中的髓鞘修复。神经化学杂志2021;145:104991。https://doi.org/10.1016/j.neuint.2021.104991.https://www.sciencedirect.com/science/article/pii/S0197018621000371.
托瑞斯·LH, Annoni R, Balestrin NT, Coleto PL, Duro SO, Garcia RCT,等。出生后早期环境烟草烟雾可引起脑髓鞘形成损伤。中国生物医学工程学报。2015;39(11):2051-8。https://doi.org/10.1007/s00204-014-1343-2.
确认
不适用。
资金
本研究由台湾科技部(MOST 106-2314-B-002-218-MY3)资助。
作者信息
作者及隶属关系
贡献
稿件撰写、审稿、编辑:TFC、SHL、TJC;实验:WRZ、CCH、KHC、LWK、CCC;分析与可视化:TFC、SHL、WRZ、CCH;资源和监督:澳门赛马会、BLT、TJC;研究设计:TJC & TFC;所有作者均已阅读并批准最终稿。
相应的作者
道德声明
伦理批准并同意参与
所有动物管理均遵照国立台湾大学医学院及公共卫生学院机构动物照顾及使用委员会(许可编号:20160545)的伦理规则进行。
发表同意书
不适用。
相互竞争的利益
作者声明没有相互竞争的经济利益。
额外的信息
出版商的注意
伟德体育在线施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
补充信息
附加文件1
.表S1.神经元与弥漫性Aβ的比例42大脑、内嗅皮层和梨状皮层和Aβ42免疫组化研究海马CA1区斑块。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条所提供的资料,除非在资料的信用额度中另有说明。
关于本文
引用本文
陈,特遣部队。,Lee, SH., Zheng, WR.et al。慢性暴露于低水平环境细颗粒物的阿尔茨海默病转基因小鼠的白质病理。部分纤维毒物19, 44(2022)。https://doi.org/10.1186/s12989-022-00485-8
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12989-022-00485-8
关键字
- 环境空气污染
- 阿尔茨海默病
- 白质
- 视神经束