摘要
在消费品中加入纳米材料(NMs)已被证明在许多领域具有很高的价值。然而,不幸的是,同样的纳米特定的物理化学性质,使这些材料具有吸引力,也可能对接触这些材料的人造成危害。NMs的物理化学性质将影响其与生物环境的相互作用,影响其命运和潜在的不良影响,如遗传毒性。由于生产的NMs数量庞大且不断增加,它们以不同纳米形式(NFs)的可用性和各种格式的使用,不可能在单个NF的基础上进行风险评估。为了简化危害评估,需要采用分组等替代方法。GRACIOUS框架提供了一种逻辑和科学证明的方法来对类似NFs进行分组,允许从具有足够危险数据的源NFs(或非NFs)读取危险信息到缺乏此类数据的目标NFs。在这里,我们提出了一个简单的三层测试策略来收集证据,以确定不同NFs是否在诱导遗传毒性的潜力方面足够相似,以便进行分组。分层测试策略包括简单的体外模型,以及一些更复杂的多细胞体外模型,以便更好地了解继发性nm诱导的DNA损伤,直到最近,这在体内更合适。
在过去的二十年中,纳米科学和纳米技术领域取得了迅速的进展。纳米材料的应用为化妆品、电子产品、环境修复以及纳米药物的开发等领域带来了宝贵的技术进步[1].然而,不幸的是,使这些材料如此独特和吸引人的纳米特定物理化学性质也引起了人们对NMs对人类健康潜在危害的担忧[2].这些物理化学性质包括但不限于小尺寸、高表面积与体积比、形状变化、熔点变化、溶解度或溶解速率、增加的表面反应性、变化的电学性质以及与块状材料相比可能改变的晶体结构[3.].目前了解到,纳米药物的接触途径包括摄入、吸入和皮肤接触,其中静脉注射途径对于有意给药纳米药物很重要[4].最近,全面蓄电池在chemico,在体外,体外和体内研究表明,NMs诱导不良反应的能力各不相同,包括细胞毒性[5,6]、炎症[7,8],自噬[9,10]、心脏毒性[11,12,13,14,15]、致癌性[16,17]和遗传毒性[18,19,20.].特别是,在这些相关的nm对人类健康的危害中,由于与癌症的因果关系以及可遗传突变导致出生缺陷的可能性,基因毒性引起了广泛关注[21].
国际癌症研究机构(IARC)根据科学证据的强度,对物质和化学品的潜在致癌性进行分类[22].致癌物是天然的或合成的物质,有可能通过破坏DNA和染色体、诱导非整倍体或破坏正常的细胞代谢过程在活组织中引起癌症。最近已确定了10个关键特征,其中一种或多种是公认的人类致癌物的常见特征。这些特征为从相关机理研究中确定和组织结果的客观方法提供了基础。这些特性是物质的能力:(1)直接或在代谢激活后作为亲电试剂;(2)具有遗传毒性;(3)改变DNA修复或引起基因组不稳定;(4)诱导表观遗传改变;(5)诱导氧化应激;(6)诱发慢性炎症; (7) be immunosuppressive; (8) modulate receptor-mediated effects; (9) cause immortalization; and (10) alter cell proliferation, cell death, or nutrient supply [23].
NMs在单细胞类型内诱导的遗传毒性机制可分为原发性(直接和间接)和继发性损伤[24].在原发性遗传毒性过程中,NMs与细胞的遗传成分直接相互作用可引起损伤。这将要求NMs进入细胞核并直接与DNA相互作用。根据定义,间接遗传毒性不需要NMs与DNA的物理相互作用,但可以由氧化应激或诱变剂与非DNA靶标的相互作用诱导,导致参与DNA复制、细胞分裂或DNA准确性的蛋白质受损。间接作用机制(MoA)要求NMs通过促进ROS产生来消耗抗氧化剂,从而增加氧化损伤,或者通过线粒体活性来增加氧化损伤。继发遗传毒性是指在nm诱导的炎症过程中,吞噬细胞(主要是巨噬细胞和中性粒细胞)产生的ROS损伤,引起其他细胞的下游继发遗传毒性[25,26].体内nm诱导的慢性炎症与生物持久性材料的继发性遗传毒性以及相关的持续生成ROS和活性氮(RNS)导致细胞和组织损伤的风险更大有关[27].
综上所述,NMs的物理化学性质,包括形状、尺寸、溶解度、团聚状态、化学成分、比表面积、晶体结构、表面形貌、涂层和电荷等都会影响其与生物环境的相互作用,影响其在体内的毒动力学和潜在的不良影响。如前所述,ROS是NM诱导的原发性遗传毒性的关键[28].许多NMs,特别是碳基NMs,能够以纳米表面依赖的方式生成ROS或RNS [29].炭黑在体内诱导的肝脏遗传毒性可能是由碳纳米生成的ROS引起的[30.].此外,现在有充分的文献证明,这种材料的小尺寸和随之而来的大表面积显著增加了ROS形成的可能性。增大的表面积成倍地增加纳米层上的电活性位点,使它们易于暴露。与分子氧的增强反应产生过氧化氢(H2O2)或超氧化物(O2−)阴离子[31],从而氧化DNA、RNA和其他分子。
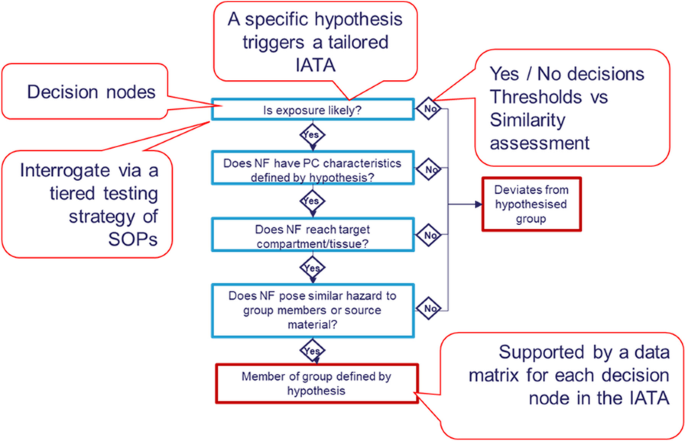
由于以各种格式生产和使用的NMs数量巨大且不断增加,以及它们以不同纳米形式(NFs)的可用性(大小、形状、涂层等各不相同),人们认识到需要替代方法来简化危害和风险评估过程,减少在逐案基础上评估危害的需要。这些过程将有助于使NFs的风险评估和创新在财务和伦理上更可行,并且更有效[32].欧洲化学品管理局(European Chemicals Agency)建议采用分组等替代方法[33].分组需要综合演示物理化学性质(它们是什么)、毒性动力学(它们去哪里)和危害(它们做什么)的相似性。通过执行分组来演示相似性,可以从具有可用危害数据的源物质读取到缺乏毒理学数据的目标物质。H2020欧洲项目GRACIOUS开发了一个框架来支持NFs的分组和读取[34].GRACIOUS框架以科学假设为基础,这些假设确定了与预测的相似暴露途径、毒物动力学和危害结果的NFs分组相关的物理化学描述符。分组假设由综合测试和评估方法(IATA)证实,该方法鼓励对现有信息进行分析,并在需要时生成支持分组决策的新信息。每个IATA由一系列决策节点组成,这些决策节点根据分组假设中确定的相关接触途径、物理化学描述符、毒物动力学和危害确定所需信息。这些决策节点是结构化的(例如35),以促进有效的决策(图35)。1).如果一个组的成员对于决策节点识别的不同描述符足够相似,则可以对特定的危险端点进行监管数据空白填充的读取。组内至少有一个成员需要足够的数据来满足相关危害终点(源材料)的监管要求,通常以体内数据的形式。该框架的设计足够灵敏,可以区分相同NM的不同NFs在细微特征(如尺寸、结晶度、污染物表面的功能化)方面的变化。同时,该框架具有足够的灵活性,允许对不同化学成分的不同NMs进行分组或比较,这在早期创新阶段是有用的。证明这些应用程序的案例研究已经完成,正在为将来的出版作准备。
对于每个决策节点,为用户提供了一个分层测试策略,它确定了收集相关证据(来自现有文献和/或实验)所需的最合适的方法,以便生成答案。例如,对于处理潜在组中NFs的遗传毒性的决策节点,该决策节点可以表述为“候选NFs是否诱导遗传毒性?”或“NFs在诱导遗传毒性方面的能力相似吗?”,通过对分层测试策略生成的数据进行分析,可以得出“是”或“否”的答案。
由于基因毒性评估与所有接触途径和许多靶细胞类型相关,因此也与grace项目中产生的所有人类健康iata相关[35],在这里,我们描述了一个简单的三层测试策略来评估NF基因毒性。分层测试策略采用现有的基因毒性测试策略和方法,但将它们置于支持NFs分组的环境中(图2)。2).该战略是基于并建立在现有的评估nf诱导的遗传毒性指南之上的[36,37,38]并在可用时纳入经合组织指南[39].此外,重要的是,以前的欧盟项目也对NFs所需的基因毒性测试方法的方法适应性进行了工作和贡献(例如NanoGenoTox, NANoREG) [40].数字2可纳入任何现有的人类健康IATA,以便将遗传毒性作为分组假设的一部分加以解决(例如,呼吸性、生物持久性、刚性harn -吸入暴露和harn转位到胸膜后,可发生间皮瘤)[35].此外,分层测试策略可以用于新的用户定义的IATA,以解决目前未被GRACIOUS框架概括的假设,或者它可以用作用户有非常特定分组需求的独立决策节点。
对于一个独立的决策节点,需要一个简单的假设,如“具有X物理化学特征的NFs,遵循Y的暴露路线,将导致Z组织的遗传毒性”。接受每个正在调查的NF的假设将支持一个组的形成。在使用基因毒性分层检测策略之前,对NFs进行表征至关重要,包括最小的尺寸分布、形状、成分(包括结晶度)和表面涂层[34].在应用预先定义的亲切分组假设(例如,生物相关流体中的溶解速率)时,可能需要进一步的描述。此外,NF还需要有关使用和暴露场景的信息,以确保NF的物理化学表征与特定暴露场景(例如,暴露于人体的介质/形式)和由此产生的靶组织相关。描述方法在其他地方有描述[34].此外,如果可以获得毒动力学信息,还需要确定哪些靶器官和组织或细胞类型最适合纳入假设。建议组中的所有候选NFs可能不需要此信息,但是可以在需要时从源NFs/非NFs读取到目标NFs。暴露途径和毒性动力学信息对于识别相关靶细胞类型是有用的。重要的是,对于基因毒性测试,还需要仔细考虑选择具有稳定遗传背景的合适细胞系。
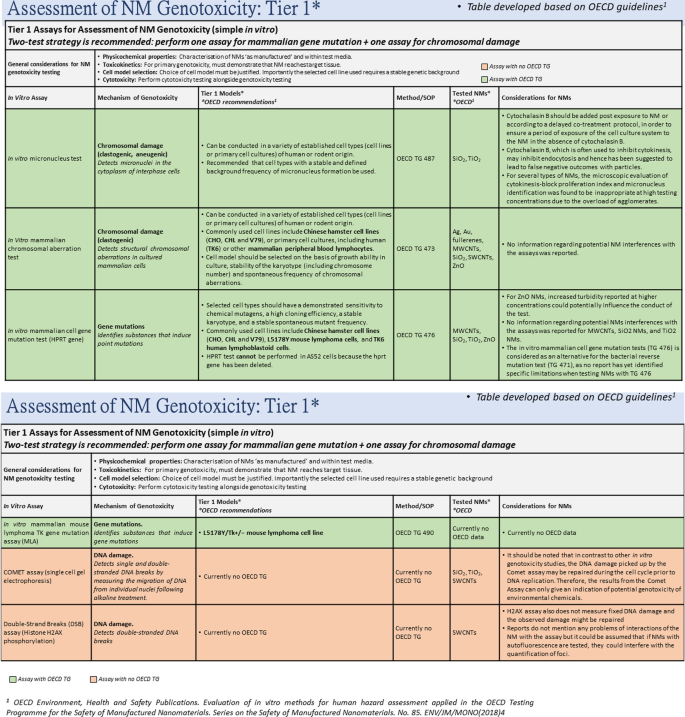
要构建跨读参数,所有目标NFs首先需要第1层或第2层数据,以便对与源的相似性进行初步评估。对于特定IATA决策节点的所有NFs,必须使用来自同一层的相同方法。相似性评估可采用定性(专家判断)或定量[40],可用于支持跨读,以填补Tier 3数据的数据空白。如果使用了第1层数据,但它不足以支持分组决策,例如由于数据的可变性,颗粒对检测的干扰或数据缺失,那么用户可能会移动到第2层。在早期创新阶段,Tier 1数据的使用通常足以支持有关NFs潜在安全性的决策。然而,Tier 1检测只能检测NF的主要遗传毒性潜力。由于大多数可溶性的、无毒的化学物质可能是个例外。纳米尺寸的NaCl)有可能诱导继发遗传毒性,这需要免疫细胞的存在,用户可以决定在创新过程中使用Tier 1之外的Tier 2测试。
如上所述,使用相同的分析方法评估所有NFs是很重要的。在评估NF基因毒性的第一层测试策略中,我们建议选择两种测试——一种用于检测基因突变(即体外哺乳动物细胞基因突变试验或体外哺乳动物小鼠淋巴瘤TK基因突变试验),另一种用于染色体损伤(体外微核试验,体外哺乳动物染色体畸变试验)(图。3.).此外,DNA损伤指标测定,如彗星试验或组蛋白H2AX磷酸化试验,可用于检测nf诱导的DNA链断裂,但这些测定目前还不够充分,也不能用于监管目的。最后,不建议对NFs进行Ames测试,因为细菌内化NFs的能力有限[37,38],因为某些NFs具有杀菌特性。重要的是,基因毒性试验应与细胞毒性实验并行进行,以确保选择适当的剂量范围,因为细胞死亡水平高可能会混淆基因毒性数据的解释。
一旦分层检测策略被用于评估候选组成员的遗传毒性,在所选的Tier 1检测中产生阳性结果的靶标和源NFs(与所选检测的特征良好的基准对照相比)可被认为在性质上相似,并形成初步组。对于任何在Tier 1测试中为阴性的NFs,分组假设被拒绝,NF退出IATA。
然后可以应用定量方法来评估相似性,以确定基因毒性潜力和效力是否足够相似,以支持分组进行法规解读(MoA对于基因毒性分组也很重要)。一系列定量相似度的方法已经在前面描述过[40,41].定量方法既可以根据每个特定试验的遗传毒性对NFs进行两两比较,也可以使用机器学习在多比较分析中对所有试验和所有NFs的所有数据进行比较。成对方法已被证明足够健壮,可用于监管分组和决策制定,而多重比较模型则不太一致,尽管它们提供了对研究有用的潜在有用的机制信息。进行相似度评估,完成高质量的数据集[42]是必需的。在GRACIOUS项目中已经生成了一个用于对数据完整性和质量进行评分的交通灯系统,该系统可应用于上传到eNanoMapper等数据库的数据[43].此外,还对现有的文献进行了回顾,研究了使用在GRACIOUS Tier 1和Tier 2测试策略中推荐的体外试验研究纳米材料(NMs)的遗传毒性,并作为附加文件提供1.
来自第1层的数据对于更好地理解遗传毒性的作用方式以及在需要时为选择最合适的第2层检测提供信息非常重要。至关重要的是,在第1层中强调的分析没有提供关于继发性nf介导的遗传毒性的信息,因此需要转移到第2层以更好地了解炎症诱导的继发性DNA损伤。传统的NFs体外DNA损伤评估严重依赖于单细胞单培养。然而,近年来已经开发了各种替代的更复杂的多细胞方法,用于评估某些毒理学终点,这些毒理学终点允许或复制在体内观察到的不同细胞类型的相互作用.这些多细胞模型也可用于基因毒性评估,目的是更好地理解次级DNA损伤,直到最近,这在体内才更加可行[19,24,26].开发更复杂的测试系统旨在弥合体外和体内NF遗传毒性数据之间的差距。
同样,第2层的测试是基于两种检测方法的利用,体外微核试验,加上彗星检测或组蛋白H2AX磷酸化检测中的一种。值得注意的是,这些实验涉及使用更复杂的生理相关,多细胞测试系统(图。4).在适用和适当的情况下,先进的体外模型方案基于欧盟委员会地平线2020资助的第二个项目巡逻(例如44)中制定的标准操作规程。使用更复杂的Tier 2模型的另一个明显优势是,它们允许重复暴露于NFs,这在使用传统的2D体外模型时并不总是可能的。第2层体外模型,根据其设计(即3D球体),具有更长的生存能力和功能,可以从几天到几周不等。根据感兴趣的器官、接触途径和所涉及的材料,这可能是非常有利的。例如,在肝脏中,除了纳米药物外,进入人体的吸收量非常低,以至于只有在长期重复接触后,才有可能对人体产生“真正的”nf诱发的危害。如上所述,同样重要的是要记住,对于Tier 2测试模型,选择适当的单元类型是至关重要的。例如,原代肝细胞在体外不增殖,因此不适合进行诱变试验;相反,基于增殖细胞的肝细胞可用于此目的[44].最后,有理由认为共培养模型应该包括免疫细胞,这些细胞可以更好地预测体内nf诱导的继发性遗传毒性。
从第1层到第2层的进展也可以用来加强解读论点,通过提供更多生理相关模型的相似性的额外机制证据,而不是第1层中包含的简单体外模型。第2层采用的复杂多细胞模型可基于相关不良结果通路(AOPs)设计,例如,通过关注特定关键事件(KEs)的激活或探测关键事件关系(KERs,通过包含抑制剂等)[12,15].在MoA方面高度相似的证明可以为放弃体内毒性试验提供支持,在体内毒性试验中,相似性主要是基于可能由不同的MoA引起的顶端毒性终点。由于用于评估基因毒性的新方法(NAMs)仍在开发和验证中,监管机构可能仍需要NF暴露的体内基因毒性后果的证据来验证所采用的体外方法的可预测性。然而,群体成员之间高度相似的证据可以支持从源群体成员中读取现有的Tier 3数据,以预测目标群体成员的遗传毒性危害。如果缺少这样的数据,可以选择一个成员(可能是最坏的情况)来生成第3层数据。
总之,在这篇简短的文章中,我们提出了一种简单的三层测试方法,根据NFs的遗传毒性进行分组,这与GRACIOUS框架是一致的。该检测策略可用于收集证据,以确定不同NFs在诱导遗传毒性的潜力方面是否足够相似,以便进行分组。此外,在测试的第二层中,建议使用一些更复杂的多细胞模型作为方法,以便更好地了解nf诱导的继发性DNA损伤,直到最近,这种损伤在体内才更加可行。
数据和材料的可用性
不适用。
参考文献
Gkika DA, Vordos N, Magafas L, Mitropoulos AC, Kyzas GZ纳米材料的风险收益概况。J Mol Struct. 2021;1228:129740。
Lamon L, Aschberger K, Asturiol D, Richarz A, Worth A.纳米材料的分组阅读危害端点:综述。纳米毒理学。2019;13:100-18。
谢华。日常生活中的纳米颗粒:应用、毒性和法规。环境病原毒理学杂志,2018;37:209-30。
Kermanizadeh A, Powell LG, Stone V.肝脏纳米毒理学综述——对近期发现的总结和对下一代研究设计的考虑。J毒理学环境卫生b部分2020;23:137-76。
Belade E, Chrusciel S, Armand L, Simon-Deckers A, Bussy C, Caramelle P, Gagliolo JM, Boyer L, Lanone S, Pairon JC, Kermanizadeh A, Boczkowski J.暴露于人造纳米材料板后p53在肺巨噬细胞中的作用。2015; 89:1543-56。
Vranic S, Gosens I, Jaconsen NR, Jensen KA, Bokkers B, Kermanizadeh A, Stone V, baza - squiban A, Cassee FR, Tran L, Boland S.血清作为分散剂的影响在体外而且在活的有机体内TiO的毒理学评价2纳米粒子。2017; 91:353-63。
巴罗索瓦H, Karakocak BB, Septiadi D, Petri-Fink A, Stone V, Rothen-Rutishauser B. An在体外肺系统评估碳纳米管气溶胶的促炎危害。国际分子生物学杂志2020;21:534。
Kermanizadeh A, Berthing T, Guzniczak E, Wheeldon M, Whyte G, Vogel U, Moritz W, Stone V.使用重复暴露超过21天的3D人原发性多细胞显微组织评估纳米颗粒诱导的肝毒性在体外测试系统作为在活的有机体内代理。部分纤维毒物。2019;16:42。
Kermanizadeh A, Jantzen K, Ward MB, Durhuus JA, Rasmussen LJ, Loft S, Møller P.暴露于三种不同金属材料后,纳米材料诱导肺和肝细胞死亡:自噬和凋亡的作用。纳米毒理学。2017;11:184 - 200。
魏M,乐WG。纳米材料在自噬中的作用。Adv Exp医学生物学2019;1206:273-86。
Hadrup N, Zhernovkov V, Jacobsen NR, Voss C, Strunz M, Ansari M, Schiller HB, Halappanavar S, Poulsen SS, Kholodenko B, Stoeger T, Saber AT, Vogel U.急性期反应作为(纳米)颗粒诱发心血管疾病的生物学作用机制。小。2020;16:e1907476。
Halappanavar S, van den Brule S, Nymark P, Gaté L, Seidel C, Valentino S, Zhernovkov V, Høgh Danielsen P, De Vizcaya A, Wolff H, Stöger T, Boyadziev A, Poulsen SS, Sørli JB, Vogel U.不良结果途径作为测试策略设计的工具,以支持纳米级新兴先进材料的安全性评估。部分纤维毒物。2020;17:16。
Kan H, Pan D, Castranova V.工程纳米颗粒暴露与心血管效应:神经元调节通路的作用。吸入毒物。2018;9-10:335-42。
郭杰柏,李曼,李曼,范德伦,兰Q,罗思曼N,西尔弗曼D,霍特P,高德利斯L, Vermeulen R.多壁碳纳米管暴露对工人心血管疾病的影响。职业环境医学。2018;75:351-8。
奈mark P, Karlsson HL, Halappanavar S, Vogel U.评价纳米颗粒肺致癌性的不良结局途径。前线毒物,2021年。https://doi.org/10.3389/ftox.2021.653386.
Lison D, van den Brule S, van Meale FG。钴及其化合物:基因毒性和致癌活性的最新进展。critical Rev Toxicol. 2018; 48:522-39。
Sobajima, Haniu H, Nomura H, Tanaka M, Takizawa T, Kamanaka T, Aoki K, Okamoto M, Yoshida K, Sasaki J, Ajima K, Kuroda C, Ishida H, Okano S, Ueda K, Kato H, Saito N.转基因ras H2小鼠静脉注射高分散多壁碳纳米管的器官积累和致癌性。中国生物医学工程学报。2019;
Brown DM, Danielsen PH, Derr R, Moelijker N, Fowler P, Stone V, Hendriks G, Møller P, Kermanizadeh A.通过ToxTracker报告系统对食品和营养部门使用的颗粒进行基于机制的毒性筛选。2019;61:104594。
Burgum MJ, Clift MJD, Evans SJ, Hondow N, Taraf A, Jenkins GJ, Doak SH在体外.中国生物工程学报。2021;19:24。
Llewellyn SV, Niemeijer M, Nymark P, Mone MJ, van de Water B, Conway GE, Jenkins GJS, Doak SH.用于纳米材料DNA损伤评估的体外三维肝脏模型。小。2021;17: e2006055
王志强,王志强,王志强,等。纳米材料对小鼠发育毒性的影响。毒理学杂志,2016;299:47-52。
宣传公共研究的准确性。2021.2021年5月13日访问。https://campaignforaccuracyinpublichealthresearch.com/.
Smith MT, Guyton KZ, Gibbons CF, Fritz JM, Portier CJ, Rusyn I, DeMarini DM, Caldwell JC, Kavlock RJ, Lambert PF, Hecht SS, Bucher JR, Stewart BW, Baan RA, Cogliano VJ, Straif K.致癌物的主要特征作为组织致癌机制数据的基础。环境卫生展望,2016;124:713-21。
Evans SJ, Clift MJD, Singh N, Wills JW, Hondow N, Wilkinson TS, Burgum MJ, Brown AP, Jenkins GJ, Doak SH.工程纳米材料遗传毒性体外二级机制的体外检测。部分纤维毒物。2019;16:8。
Akerlund E, Islam MS, McCarrick S, Alfaro-Moreno E, Karlsson HK。Ni和NiO纳米颗粒的炎症和(继发性)遗传毒性。纳米毒理学。2019;13:1060 - 72。
Evans SJ, Clift MJD, Singh N, de Oliveira MJ, Burgum M, Wills JW, Wilkinson TS, Jenkins GJS, Doak SH在体外研究纳米颗粒(次生)遗传毒性的系统。诱变。2017;32:233-41。
潘建平,李志强,李志强。可呼吸晶体二氧化硅的遗传毒性研究进展。纤维毒物。2018;15:23。
Paget V, Moche H, Kortulewski T, Grall R, Irbah L, Nesslany F, Chevillard S.人类细胞系依赖的WC-Co纳米颗粒的细胞毒性和遗传毒性:ROS产生的关键作用。化学通报2015;143:385-97。
Jacobsen NR, Pojana G, White P, Moller P, Cohn CA, Korsholm KS, Vogel U, Marcomini A, Loft S, Wallin H.单壁碳纳米管和C(60)富勒烯在FE1-Mutarade标记小鼠肺上皮细胞中诱导的遗传毒性、细胞毒性和活性氧。环境分子诱变剂。2008;49:476-87。
Modrzynska J, Berthing T, Ravn-Haren G, Jacobsen NR, Weydahl IK, Loeschner K, Mortensen A, Saber AT, Vogel U.小鼠肺暴露于炭黑纳米颗粒后肝脏的原发性遗传毒性。纤维毒物。2018;15:2。
杨晓明,李志强,李志强,等。氧化生成的DNA损伤作为一种潜在的生物标志物在活的有机体内氧化应激。中华医学杂志,2012;12:655-71。
Prescott MJ, Lidster K.通过更好的动物福利提高科学质量:NC3Rs战略。实验室动画,2017;46:152-6。
ECHA对适用于qsar和化学品分组指南的纳米材料的建议。2016。2021年4月15日访问。https://echa.europa.eu/documents/10162/13564/appendix_r6-1_nano_draft_for_committees_en.pdf/cb821783-f534-38cd-0772-87192799b958.
Stone V, Gottardo S, Bleeker EAJ, Braakhuis H, Dekkers S, Fernandes T, Haase A, Hunt N, Hristozov D, Jantunen P, Jeliazkova N, Johnston H, Lamon L, Murphy F, Rasmussen K, Rauscher H, Jimenez AS, Svendsen C, Oomen AG。纳米材料分组和解读框架——支持创新和风险评估。Nano Today, 2020;35:10 00941。
Murphy F, Dekkers S, Braakhuis H, Ma-Hock L, Johnston H, Janer G, Cristo L, Sabella CS, Jacobsen NR, Oomen AG, Hasse A, Fernandes T, Stone V.一种基于常见间皮瘤危害的高纵横比纳米材料测试和评估的综合方法及其分组应用。纳米冲击。2021;22:10 00314。
Braakhuis HM, Murphy F, Ma-Hock L, Dekkers S, Keller J, Oomen AG, Stone V.吸入暴露后纳米材料分组和解读的综合测试和评估方法。体外毒理学应用。2021。https://doi.org/10.1089/aivt.2021.0009.
Doak SH, Manshian B, Jenkins GJS, Singh N.纳米材料的体外遗传毒性测试策略和当前OECD指南的适应性。Mutat Res. 2012; 745:104-11。
Elespuru R, Pfuhler S, Aardema MJ, Chen T, Doak SH, Farabaugh CS, Kenny J, Manjanatha M, Mahadevan B, Moore MM, Ouedrago G, Stankowski LF Jr, Tanir JY.纳米材料的遗传毒性评估:最佳实践、检测和方法的建议。中国生物医学工程学报,2018;
经合组织环境、健康和安全出版物。评价在体外在经合组织人造纳米材料安全性测试计划中应用的人类危害评估方法。人造纳米材料安全系列,第85卷。2018.
Dusinska M, Mariussen E, Rundén-Pran E, Hudecova AM, Elje E, Kazimirova A, El Yamani N, Dommershausen N, Tharmann J, Fieblinger D, Herzberg F, Luch A, Haase A。在体外纳米材料遗传毒性的评估方法。在:纳米毒性:方法和协议。2019.https://doi.org/10.2903/j.efsa.2011.2379.
Jeliazkova N, Bleeker E, Cross R, Haase A, Janer G, Peijnenburg W, Pink M, Rauscher H, Svendsen C, Tsiliki G, Zabeo A, Hristozov D, Stone V, Wohlleben W.我们如何通过分组来证明纳米形式的危害评估以减少动物试验?概念和可用的工具来量化相似性。2021;手稿正在准备中。
Comandella D, Gottardo S, Rio-Echevarria IM, Rauscher H.纳米材料物理化学数据质量:数据完整性和可变性的评估。纳米级。2020;12:4695 - 708。
Basei G, Zabeo A, Rasmussen K, Tsiliki G, Hristozov D. A根据欧盟分类、标签和包装法规标准对纳米材料进行分类的证据权重方法。NanoImpact。2021; 24:100359。
Llewellyn SV, Conway GE, Shah UK, Evans SJ, Jenkins GJ, Clift MJD, Doak SH.长期接触纳米材料后用于体外遗传毒性测试的先进3D肝脏模型。J Vis Exp 2020;160:e61141。
确认
不适用。
资金
这项工作得到了H2020资助项目GRACIOUS[授权代码760840]和patrol[授权代码760813]的资助。
作者信息
作者及隶属关系
贡献
RV, VS和AK撰写了手稿。FM, EC, HJ, SD, UV, AH参与并审阅了手稿。所有作者都阅读并批准了最终的手稿。
相应的作者
道德声明
伦理批准并同意参与
不适用。
发表同意书
本研究不涉及个人信息。
相互竞争的利益
作者声明没有利益冲突。
额外的信息
出版商的注意
伟德体育在线施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
补充信息
附加文件1。
综述了现有的研究纳米材料(NMs)体外遗传毒性的文献。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条所提供的资料,除非在资料的信用额度中另有说明。
关于本文
引用本文
弗登,R.,斯通,V.,墨菲,F.。et al。纳米材料分组的现有遗传毒性方法的应用:朝向测试和评估的综合方法。部分纤维毒物19, 32(2022)。https://doi.org/10.1186/s12989-022-00476-9
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12989-022-00476-9
关键字
- 纳米材料
- 基因毒性
- 分组
- 分层测试策略
- 替代生理多细胞模型