摘要
背景
口服纳米颗粒是人类接触的一个重要途径,需要固体模型进行危害评估。虽然全身利用率一般较低,但摄入不仅会影响胃肠道组织,还会影响肠道微生物。肠道菌群对人体健康有重要贡献,而肠道微生物失调已知会促进几种肠道和肠外疾病。在血液中发现的肠道微生物群衍生的代谢物,是宿主代谢和免疫的关键分子介质。
结果
在接受任何一种SiO的雄性Wistar大鼠中分析肠道微生物群和血浆代谢组2(1000毫克/公斤体重/天)或银纳米颗粒(100毫克/公斤体重/天),在28天的口服灌胃研究中。综合临床、组织病理学和血液学检查均未显示纳米颗粒诱导的毒性迹象。相比之下,肠道微生物群受到两种纳米颗粒的影响,在所有分析的分类水平上都有显著变化。每一种纳米颗粒的处理都导致普雷沃氏菌科(Prevotellaceae)的丰度增加,这是一个已知与肠道炎症相关的肠道物种家族。只有在接触银纳米粒子的动物中,Akkermansia这种植物以其对肠道屏障的保护作用而闻名,其消耗已经几乎无法检测到。在SiO2纳米颗粒处理的动物,几个属明显减少,包括益生菌如肠球菌.从对231种血浆代谢物的分析中,我们发现18种代谢物在ag或SiO中发生了显著改变2nanoparticles-treated老鼠。对于这些代谢物中的大多数,与肠道菌群的关系此前已被报道过。引人注目的是,两种纳米颗粒处理都导致血浆中肠道微生物源性吲哚-3-乙酸的显著减少。芳香烃受体的这种配体对于调节免疫、干细胞维持、细胞分化和异种代谢酶至关重要。
结论
肠道微生物组和血浆代谢组的联合分析可以作为口服纳米颗粒诱导肠道微生物组变化的早期和敏感指标;这将有助于识别这些变化对宿主的潜在不利影响。
背景
口服纳米颗粒暴露(NP)需要固体模型来评估潜在的危害。这包括由于从肠道吸收纳米颗粒而产生的全身效应,以及对肠道和肠道菌群的局部影响。而NP的系统可用性通常较低[1],对肠道的局部影响可能更相关。食源性NP对肠道微生物群的影响尚不清楚,更不用说这些变化对宿主生物的影响了[2].食品级二氧化硅2NP (E551)主要用作食品防结块添加剂,以支持粉状产品的流动性。此外,它们还用于化妆品和医疗产品。据估计,人类饮食中对无定形二氧化硅的平均接触量为9.4毫克/公斤体重/天,其中1.8毫克/公斤体重/天似乎是纳米级的[3.].NP银作为抗菌添加剂被添加到医疗产品(例如伤口敷料、手胶、口腔填充物)、食品包装和厨房用具中,但也作为糖果和巧克力涂层中的珍珠色素(E 174) [4,5,6].这些基于纳米颗粒的产品的商业化正在扩大,全球产量高达150万吨SiO2NP和每年超过500吨的Ag NP,从而增加了口服摄取的潜力[7].因此,这些NP的安全性评估应越来越多地集中于口服毒性研究。
现有的大多数纳米材料口服摄取研究都分析了啮齿动物模型中的Ag NP。一些研究观察到Ag np诱导的体重减轻、炎症反应、肝毒性[8,9,10],和/或心脏毒性(综述见Bostan等人.2016年(11]),而其他许多人则没有发现对健康有不良影响[12,13,14,15,16,17].值得注意的是Hadrup等人.[18]观察到离子银对Wistar大鼠灌胃28天后的毒性作用,而对等摩尔Ag NP (9 mg/kg体重/天)无毒性作用。使用SiO对啮齿动物进行口腔研究2NP还描述了肝脏、肺和睾丸等不同器官的毒性迹象[3.,19],或无不良影响,具体取决于NP [20.,21,22,23,24].据描述,哺乳动物口服银中有0.4 - 18%被吸收,并分布到不同器官,在肠道和胃中观察到的银含量最高[25].大鼠的粪便排泄率为98%,小鼠为99.6%,狗为90%,猴子为98% [26这表明啮齿动物的生物利用度很低,但也意味着它们已经与啮齿动物肠道微生物群接触过。由于已知的抗菌特性,Ag NP对肠道菌群的有害影响是可以想象的。
哺乳动物肠道菌群由大约。1014肠道微生物属于1000多种不同的物种。肠道菌群参与多种功能,包括能量利用、药物代谢和免疫。肠道菌群的变化与多种疾病有关,并影响疾病的发展和进展[27].最近的工作记录了肠道微生物群落的微小改变与人类肿瘤和炎症等胃肠道疾病的关联[28].例如,单一细菌种类的耗竭与人类IBD有关[29].更有趣的是,有人提出了一种肠道-大脑轴,数据表明,肠道微生物群还在调节焦虑、情绪、认知、疼痛和压力方面发挥着作用[30.,31,32].分析肠道菌群的变化是目前诊断和药物功能和治疗评估中的一个主要问题[33,34,35,36].目前对肠道微生物组的研究已经确定了几种对病理生理改变、肠道屏障完整性或炎症过程有重大影响的物种[37].
尽管肠道菌群对人类和动物健康有潜在的影响,但它还没有成为纳米毒理学领域的研究重点。到目前为止,关于NP对肠道菌群的影响只有有限的信息,尽管微生物群落结构的改变可能被用作纳米毒理学的一个重要终点[2].迄今为止,已经发表了一些关于Ag NP对肠道微生物影响的研究[2,38].这些研究大多使用体外培养肠道菌群,这只能提供有限的信息,因为许多肠道细菌无法在标准体外条件下培养。在口服NP暴露的动物的临床和病理结果的比较以及在宿主生物健康状态的稳态中具有已知功能的改变的细菌种类的鉴定方面存在重要的数据空白。此外,纳米毒理学中微生物组变化的效应因子仍不清楚。
最近的工作证明了肠道微生物群对哺乳动物血液代谢物的重大影响,这表明细菌和哺乳动物代谢之间存在重要的相互作用,并为宿主生物体微生物组的功能提供了机制见解[39,40,41].肠道微生物产生不同的维生素和代谢产物,如短链脂肪酸,从而为宿主提供营养支持[42].据估计,哺乳动物血液中发现的代谢物中有10%来自肠道菌群[39].这些代谢产物越来越被认为是微生物组影响疾病的关键分子介质,也是宿主生理的重要组成部分,对免疫功能和肠道稳态具有多重影响[41,43,44].
代谢组学允许在尿液、血液或粪便等易于获取的身体基质中间接研究肠道微生物组的影响。先前的研究利用大鼠血浆代谢组学确定了药物治疗后可能的作用模式或不良结果[45].通过共同的作用方式产生毒性作用的物质产生了一系列共同的代谢物变化。因此,持续调控的代谢物可用于建立毒性相关的代谢模式,作为药物或化学物质诱导的肠道微生物群落变化的指标[46,47,48].
在这里,我们根据OECD试验指南no. 1提供了亚急性口服毒性研究的数据。407,每天每公斤体重摄入1000毫克的二氧化硅2NP或100 mg/kg体重Ag NP对雄性Wistar大鼠的影响。我们根据临床参数全面评估了这些纳米颗粒的潜在毒性作用,并分析了肠道微生物群落的组成和丰度。为了解决微生物改变的效应,我们还分析了SiO血浆中代谢物的水平2Ag np处理的动物通过液相色谱和气相色谱耦合质谱。
结果
在雄性Wistar大鼠中进行了一项28天口服摄取研究,根据OECD试验指南no. 1评估了摄取NP对经典体内毒理学终点、肠道微生物组和受微生物组影响的血浆代谢组的影响。407 (tg 407)在这里,我们进行了限制剂量试验,当毒性预期较低且在限制剂量下不太可能致命时,这是首选的试验。我们使用的SiO建议剂量水平为1000mg /kg体重/天2NP (49].对于Ag NP,预期毒性更高,使用100 mg/kg体重/天。应用剂量远低于LD50在大鼠体内发现280毫克/公斤体重/天的离子银[25,50],因此遵循TG 407似乎是合适的。
既不是Ag NP也不是SiO2NP引起的不良反应由临床观察或病理检测
Ag np处理动物的生活数据:临床检查、食物和水的消耗、体重的发展
所有用Ag50 EO(这里称为Ag NP)处理的动物都显示出黑色的粪便。该影响被评估为与测试物质有关,但不是不利的。所有动物的食物和水的消耗没有受到影响,体重发育也没有受损(附加文件)1:表S1)。
临床病理:血液学、临床化学、急性期蛋白、尿液分析
Ag np处理动物的血液和尿液样本中测量的几乎所有参数与对照动物的值没有显著差异。观察到以下显著变化,但经评估与np处理无关(见表1和附加文件1:表S2-S4)。
Ag NP处理的动物红细胞(RBC)计数较高(8.4 Tera/L),平均红细胞血红蛋白浓度(MCHC;20.41 mmol/L)以及相对网织红细胞计数(1.7%)均低于对照组。RBC和相对网织红细胞计数在历史控制范围内(RBC: 7.59-8.60 Tera/L,相对网织红细胞计数:1.4-3.1%)。计算出的MCHC值略低于历史对照范围(MCHC: 20.43-23.73 mmol/L),但这些个体中所有测量到的红细胞参数要么在研究对照范围(血色素和血红蛋白)内,要么在历史对照范围(RBC)内,因此被认为是偶然的,与治疗无关。
病理:大体病变,绝对和相对器官重量,组织病理学
在消化道的不同位置,Ag np处理的动物中观察到含量的变色。这种变色被认为是由试验物质引起的。我们没有发现任何组织变色,即胃肠道器官的黏膜。我们不认为这是人类皮肤上观察到的银质中毒的迹象[25].最有可能的是,胃肠道腔内银颗粒的存在本身改变了其内容物的颜色。宏观上,黏膜颜色未见变化。然而,在十二指肠镜下检查时,在绒毛尖端的粘膜下层和巨噬细胞内观察到黄色到深色的小颗粒。
此外,所有动物在腺胃粘膜下层均有轻微的炎症细胞浸润。未观察到其他与治疗相关的宏观和组织病理学结果。在任何动物中都没有检测到与治疗相关的器官重量变化(数据未显示)。
SiO的生活数据2NP-treated动物
SiO的临床病理结果2_naked(这里称为SiO2NP)已经由Buesen等人发表.[51].在生活资料、临床病理或组织病理学方面未见与治疗相关的改变。数据显示在表S1-S4(附加文件1),仅供比较,详情见Buesen等人.[51].
雄性Wistar大鼠灌胃开始时肠道菌群分析
为了确定口服纳米颗粒是否会影响大鼠肠道微生物,我们对不同粪便样本进行了16S rRNA微生物/分类学分析。首先,在治疗开始前一天从每只动物身上收集粪便(未处理对照,UC)。其次,在每日灌胃PBS + BSA(对照组,VC)、Ag NP (100 mg/kg体重/天)或SiO后,于第25天收集粪便2NP(1000毫克/公斤体重/天)。从这些样本中提取DNA,然后进行下一代测序(NGS)分析,并使用SILVA数据库用QIIME2分析DNA序列。
由α-多样性定义的扩增子序列变异(asv)的总观察数量和相对丰度在处理组和未处理对照组之间没有显著差异,如Shannon-Wiener指数或Inverse Simpson指数所示(附加文件)1:图S1)。Wilding等人也报道了类似的结果.[52给小鼠注射Ag NP 28天后。为了比较样品之间肠道菌群的多样性,并评估治疗组之间的分化水平,基于所有样品的ASV信息计算β-多样性,并使用主坐标分析(PCoA)进行可视化。未处理的对照(UCs)形成一个集群,并与处理后收集的所有其他样品分离(附加文件)1:图S2a)。与治疗前(第0天)的相同大鼠样本相比,研究第25天的单个样本彼此之间的距离也更大。灌胃25天后UC组与所有样本的共同距离很可能主要反映了所有微生物群落在25天观察期的进展中所经历的时间依赖性转换,受到大鼠性成熟和衰老过程中进一步发育变化的影响。此外,灌胃过程可能诱发应激,但临床观察不明显,以及其他影响肠道微生物组成平衡的因素。通过asv的分类分配进一步评估了门和类的丰度,并在补充信息中显示了未处理和载体处理对照之间的比较(附加文件1:文本部分和图S3、表S5、表S6)。更重要的是,在多样性分析中未处理对照样品的紧密聚类表明,单个大鼠最初(在第0天)在细菌群落结构方面密切相关,彼此相当相似。所有大鼠之间的这些相对较小的多样性差异证实了治疗开始时的适当基线情况。
在第25天,处理组间β-多样性的比较在单独的分析中进行,仅包括灌胃期后的样本(附加文件)1:图S2b)。属于个别处理组的样本,特别是车辆对照,与第0天样本的紧密聚类相比,似乎较少聚集。然而,不同处理组的样品(VC、Ag、NP、SiO)之间存在明显的分离2可以观察到NP),尽管车辆控制样本和Ag NP组之间存在一些有限的重叠。所有样品SiO后2NP处理与vc处理完全分离,Ag灌胃后的样品完全分离,表明个体大鼠已经发展为分化的处理组,每个处理组的肠道菌群具有共同的特征。
Ag NP和SiO2NP诱导雄性Wistar大鼠肠道菌群发生明显改变
Ag NP效应
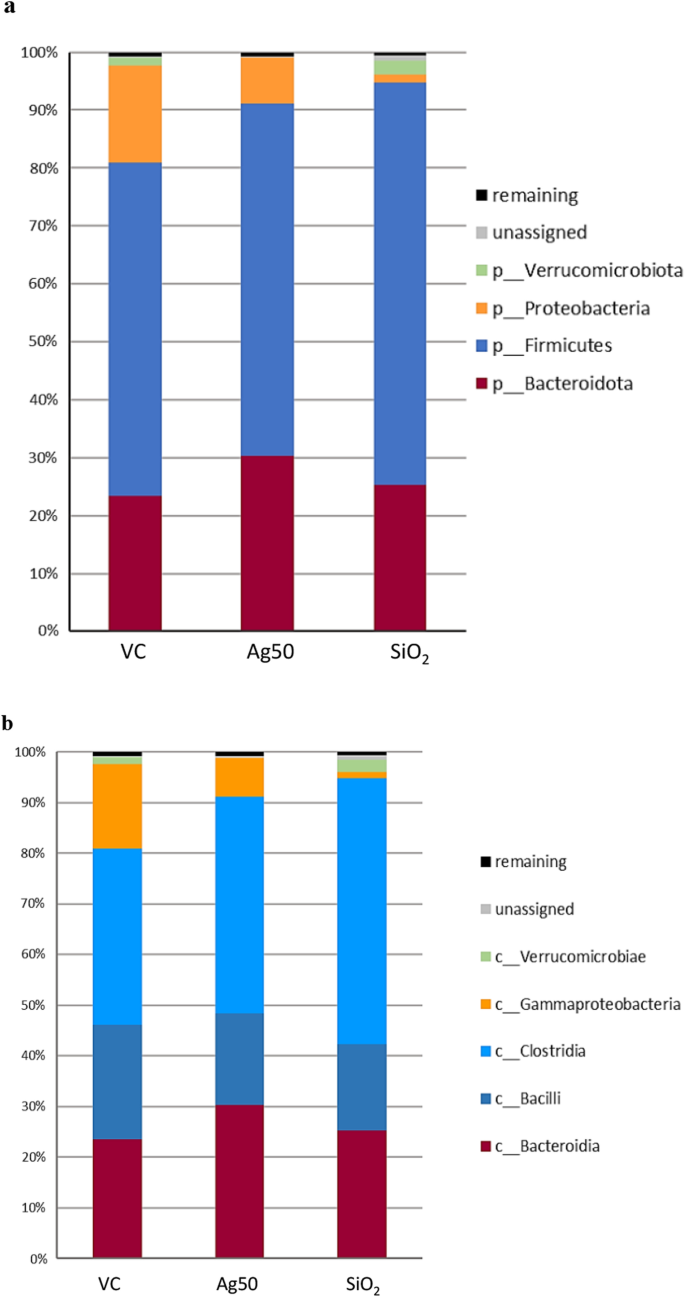
为了评估Ag NP对大鼠肠道微生物组的影响,我们分析了从2级(门)到6级(属)的分类分配后的asv。从β-多样性分析的结果来看,在许多情况下,动物间的变异性相对较高。与第0天确定的相对较小的多样性差异相比,增强的变异性可能来自25天治疗期间大鼠发育和性成熟期间的个体差异(更多细节请参阅附加文件)1:图S2a)。类似的啮齿动物肠道微生物群的个体变异以前也有报道[53].如图所示。1a, Ag NP灌胃(100 mg/kg体重/天)导致肠道菌群在门水平上的结构变化。总共鉴定出四个不同的优势门,相对比例超过1%。厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidota)这两个最丰富的门在载体处理动物中占asv总数的81%,在NP处理后的大鼠中占91%以上。Ag NP灌胃后,拟杆菌的水平从对照(VC)的23.5%上升到30.4% (p= 0.087),而厚壁菌门(Firmicutes)几乎保持在同一水平(60.8% vs.57.5% VC,图;1a,欲了解更多细节,请参阅附加文件1:表S7)。这导致厚壁菌门/拟杆菌门比例(2:1 vs. 2.5:1)降低。Verrucomicrobia门丰度由1.26% (VC)降至0.04%,Proteobacteria门丰度由16.8% (VC)降至7.8%(变化不显著;无花果。1a,附加文件1:表S7)。
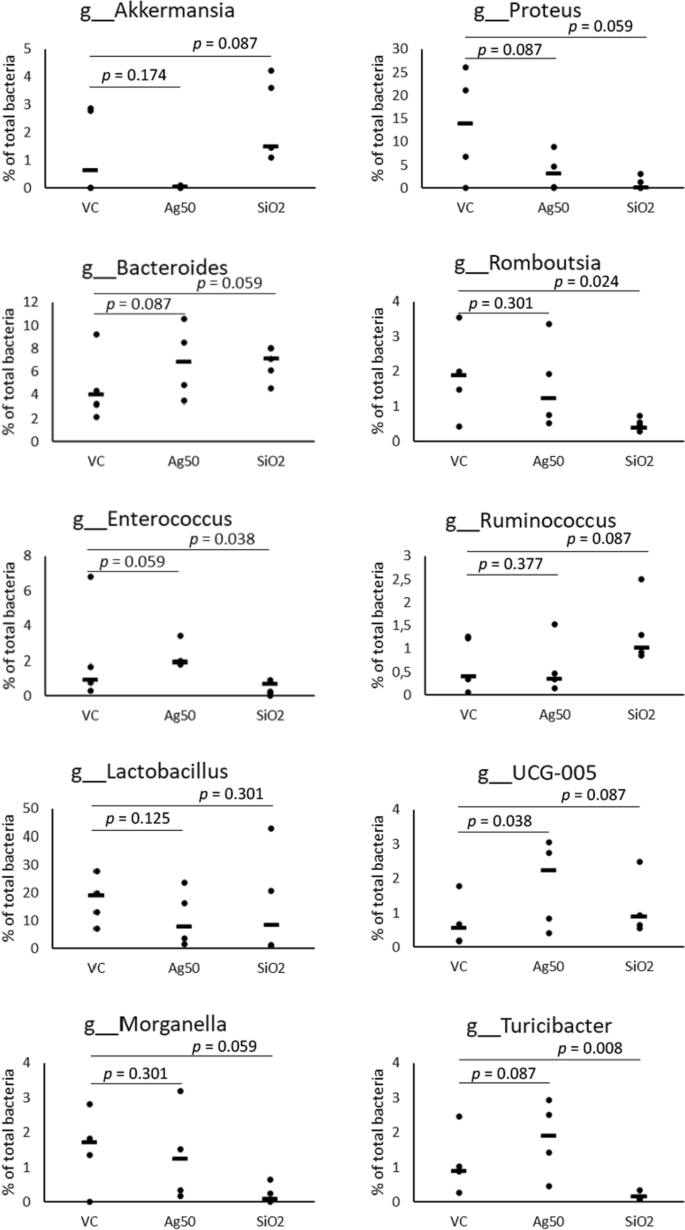
由于有益和有害微生物都存在于这些门中,我们在类、目、科和属的水平上分析了肠道微生物群的组成,以进一步详细评估Ag处理的效果(图2)。1,附加文件1:表S8-S12)。对于Verrucomicrobia门,我们发现从属科Verrrucomicrobiales和属中同样明显下降至0.04%Akkermansia,因为这是本门唯一已确定的代表属。这一属的单一种,a . muciniphila通常占肠道微生物总菌群的1-4%,生活在肠上皮细胞附近的肠黏液层[54].因此,对于我们的动物试验组,我们确定了1-4%的平均水平Akkermansia,除Ag np处理的动物外,其中Akkermansia被发现几乎不存在(图。2).而载具对照的五种动物在丰度上表现出较高的变异Akkermansia(无花果。2),因此,我们的数据在统计上并不显著。
在暴露于Ag或SiO后,所选的最丰富的属得到了散点图2.VC,车辆控制;Ag50,银纳米颗粒(100 mg/kg体重/天);SiO2、SiO2纳米颗粒(1000毫克/公斤体重/天);所选属的中位数相对丰度在至少一组中显示为≥0.2%(进一步丰富的属见图S4)1).p值通过Mann-Whitney-U-test获得。每组N = 5
变形菌门的减少似乎主要是由摩根菌科(Morganellacea)丰度的大幅下降决定的(4.7% vs.15.1%的对照组,p= 0.087;无花果。1d、附加文件1:表S10)和属普罗透斯,在对照组大鼠中数量第三多的属(3.4% vs. 13.5%),p= 0.087;无花果。2,附加文件1:表S11, S12)。而属中的种普罗透斯已知是能够引起人类重大感染和疾病问题(如尿路感染)的机会性病原体,它们在动物中的作用尚不清楚,在某些情况下可能是共生的或从中性/共生转变为寄生虫[55].
在无纳米颗粒对照中,厚壁菌门主要由梭状芽胞菌纲(34.9%)和杆菌纲(22.6%)组成。Ag灌胃后,我们观察到梭状芽孢杆菌类成员的丰度增加(分别为42.8%和18.0%,不显著)。1b、附加文件1:表S8)。相反的趋势似乎是由乳酸菌的减少在很大程度上介导的,乳酸菌存在于三个最丰富的目中(对照组19.5%,ag处理动物12.8%,p= 0.087),而Oscillospirales显著增加(VC为18.9%,VC为13.2%,p= 0.005)和梭菌UCG-014 (10.7% vs. 6.7% VC,p= 0.087;无花果。1c、附加文件1:表S9)。值得注意的是,同样属于芽孢杆菌属的丹毒三hales丰度相当低的目在ag处理的大鼠中丰度显著增加了两倍(3.0% vs. VC 1.5%;p= 0.008;无花果。1c、附加文件1:表S9)。
乳酸菌纲的变化进一步源于属的减少乳酸菌(10.5% vs. 17.4% VC,不显著;无花果。2,附加文件1: S11, S12),在对照大鼠中含量最多。所观察到的示波螺旋级数的升高(图。1c)主要由Ruminococcaceae家族的显著增加(9.0% vs.VC为6.4%;p= 0.038)和Oscillospiraceae (VC为7.9% vs. 5.8%,不显著;无花果。1d、附加文件1:表S10)。导致这两个科的丰度显著增加的相关属,普雷沃氏科(5.6% vs.对照的1.9%),p= 0.024), Ruminococcaceae未被鉴定。
SiO的影响2NP
结果来自大鼠口服1000mg /kg体重/天SiO2与车辆对照组相比,NP暴露出SiO2治疗还引起了肠道菌群的一些结构改变。在门的水平上,我们发现厚壁菌门显著增加(对照组为69.6%,对照组为57.5%,p= 0.008),而拟杆菌的丰度几乎没有变化(在VC中为25.2% vs. 23.5%)(图。1a,附加文件1:表S7)。与Ag的影响相反,这种重排导致厚壁菌门/拟杆菌门比率略有增加(对照为2.8:1 vs. 2.5:1)。为Verrucomicrobia门确定的改变也明显不同于Ag诱导的改变(图。1a). Verrucomicrobia及其隶属属的丰度AkkermansiaSiO灌胃后提高至2.4%2(相对于VC的1.3%,p= 0.087)。
与Ag处理后观察到的效果类似,变形菌门的丰度从对照组的16.8%大幅下降到SiO处理后的1.3%2NP处理(p= 0.038)。Ag处理后,我们发现Morganellaceae家族的丰度明显降低(1.1% vs.15.1%的对照组,p= 0.059;无花果。1d、附加文件1:表S10),属普罗透斯(对照组0.9% vs. 13.5%,p= 0.059;无花果。2,附加文件1:表S11, S12),主要负责减少超纵坐标门Proteobacteria。
在厚壁菌门的分类中,我们观察到梭状芽孢杆菌的水平显著升高(52.5% vs.34.9%的VC,p= 0.038), SiO后类杆菌数量适度减少2NP治疗(17.0% vs. 22.6% VC,不显著)(图。1b、附加文件1:表S8)。丰富的乳酸菌科和属乳酸菌(14.9%在SiO2np处理vs. VC处理17.4%,不显著)主要代表杆菌类。确定葡萄球菌科和属的数量显著减少葡萄球菌(0.02% vs. VC的1.1%,p= 0.014)。同样,肠球菌科和属肠球菌(对照组0.4% vs. 2.1%,p= 0.038;无花果。2,附加文件1:表S11, S12)在大鼠灌胃SiO后显著减少2NP。
与Ag处理后的变化相反,我们发现该属显著减少Turicibacter(对照组0.15% vs. 1.1%,p= 0.008;无花果。2,附加文件1:表S11, S12)在SiO2-处理过的动物,导致丹毒科(对照组为0.3%,对照为1.4%)和丹毒三hales(对照组为0.7%,对照为1.5%;无花果。1c、附加文件1:表S9, S10)。我们还观察到胃链球菌- tissierellales的丰度显著降低(在VC中为0.9%,在VC中为2.8%,p= 0.005),属Romboutsia在SiO2-处理大鼠(0.5% vs.对照组1.9%,p= 0.024,图1c,无花果。2,附加文件1:表S9, S11, 12)。
与口服Ag治疗后的结果相似,SiO中梭状芽孢杆菌显著增加2两科Oscillospiraceae的显著升高(对照组为11.2%,对照组为5.8%,p= 0.038)和Ruminococcaceae (13.4% vs ..对照组为6.4%,p= 0.008;无花果。1d、附加文件1:表S10)。解释这些变化的属无法清楚地确定。梭状芽胞杆菌类内的其他变化与银处理观察到的变化不同。在用SiO处理的大鼠中2NP, Lachnospirales目和Lachnospiraceae科的比例明显增加(18.5% vs.10.1%的人控制,p= 0.038)。1c, 1d,附加文件1:表S9, S10)。我们还发现SiO后Prevotellacea的含量显著增加2NP暴露(4.5% vs.对照组1.9%,p= 0.014;无花果。1d、附加文件1:表S10)。Ag处理也显示出类似的普雷沃氏菌(Prevotellacea)家族丰度的增加,然而,我们的分析无法确定相关属。
Ag NP和SiO2NP导致大鼠血浆中特定代谢产物水平的变化
肠道微生物群对宿主健康和疾病预防或进展的潜在影响最有可能是由微生物群衍生的小分子介导的。因此,在代谢组研究中检测和分析这些分子对于理解微生物组效应至关重要。口服SiO 28天后大鼠血浆代谢组质的变化2之前Buesen等人发表过NP。[51].在这里,我们分析了口服Ag NP和SiO的雄性大鼠的代谢组学变化2更详细的NP,包括微生物群对代谢组的影响。我们还将纳米颗粒诱导的代谢组变化与之前研究的八种抗生素的代谢组谱进行了比较[40,48](附加文件1:表S13)。
从处理过的大鼠血浆样本中鉴定出了231种代谢物。对暴露于SiO后在18种不同代谢物中观察到的显著变化的总结2NP或Ag NP,与车辆处理的对照相比,见表2.
每个治疗组在10种不同的血浆代谢物中均有显著变化。在暴露于SiO的大鼠中2NP,与车辆对照相比,我们发现两种代谢物水平升高,八种代谢物水平下降。Ag NP处理后,分别发现5种不同的代谢物水平分别升高和降低。这些影响大多是Ag或SiO暴露所特有的2.对Ag、NP、SiO有反向反应的代谢物2未检测到NP。
在氨基酸类中,我们仅在Ag np处理的大鼠中发现了显著变化,苯丙氨酸血浆水平显著降低(与对照组相比为0.87倍),脯氨酸和色氨酸显著增加(分别为1.2倍和1.22倍)。相反,在维生素类和相关代谢产物以及能量代谢类和相关代谢产物中,我们发现只有SiO后大鼠的代谢产物受到显著影响2NP治疗。泛酸(维生素B5)减少了0.68倍,与对照组相比,维生素C代谢物苏酸减少了0.79倍,苹果酸减少了0.64倍2).
其他代谢物类别受两者影响,SiO2Ag NP。例如,在激素、信号物质和相关分子的类别中,我们分别发现两种治疗中代谢产物的水平都有所下降。Ag np处理的大鼠,DOPEG和HMPG显著降低(分别为对照组水平的0.81和0.83倍),而SiO处理的大鼠2NP、肾上腺素和甲氧基肾上腺素显著降低(分别为对照组的0.27和0.5倍)2).相比之下,在核碱基类及相关类中,我们发现每种处理的代谢物水平显著增加。Ag np处理大鼠尿囊素增加1.16倍,假尿苷增加1.17倍2NP灌胃(表2).在碳水化合物及其相关类别中,两种纳米颗粒似乎都能诱导己糖-2的水平达到相似的程度(Ag NP-为1.33倍,SiO为1.37倍)2-处理大鼠,表2).
在氨基酸及其相关类中,SiO2-处理大鼠的反式-4-羟脯氨酸水平显著降低(与对照组相比为0.85倍)。最重要的是,我们发现肠道微生物源性吲哚-3-乙酸(IAA)在Ag NP-(对照组水平的0.57倍)和SiO的血浆中均显著降低2np处理大鼠(对照组水平的0.78倍)2).与近期有关抗生素(强力霉素、庆大霉素、左氧氟沙星、莫西沙星和新霉素)疗效研究的代谢组学数据相比[40,48],大多数抗生素治疗后IAA水平类似或更强的下降可以被证实(附加文件1:表S13)。
讨论
在这项工作中,我们提供了关于口服Ag (100 mg/kg体重/天)和SiO影响的毒理学、微生物学和代谢组学数据2NP (1000 mg/kg体重/天)对雄性Wistar大鼠的影响。两种NP的剂量明显高于人类每日口服这些NP的摄入量(SiO为0.3-0.8 mg/kg体重/天2[56]和0.005毫克/公斤体重/天[57,58,59为Ag)。由于个人意外摄入NP(例如在意外情况下或在工作场所情况下)或作为膳食补充剂或药物的预期摄入可能要高得多,因此测试极限剂量与这些暴露相关,还可以提供一般危害信息。OECD测试指南编号。407,然而,可能受益于更新和适应未来的纳米材料的测试。
毒理学终点综合评估未检测到不良反应,如身体/器官重量损失或血液学、组织学或临床化学异常(详情见表1Buesen等人.2014年(51])。然而,我们发现Ag或SiO处理后肠道微生物组发生了一些变化2NP。首先,我们观察到银处理大鼠的厚壁菌门/拟杆菌门比率从对照组的2:5下降到2:1。这种减少被描述为微生物生态失调的一个重要参数[2,60].然而,与我们的观察结果一致的是,此前有报道称,纳米银引起啮齿动物肠道微生物群厚壁菌门/拟杆菌门比例下降,但剂量较低(2.5 mg/kg和高达36 mg/kg体重/天)[61,62].其他研究显示要么没有改变[18,52],或暴露于Ag NP导致厚壁菌门/拟杆菌门比例显著增加[53].结果的差异可能源于研究设计或处理程序的差异,如剂量和应用类型,或不同纳米颗粒的特定物理化学性质(如主要尺寸/团聚,表面修饰)。
其次,我们发现了疣菌门和相应的属Akkermansia在ag处理的大鼠中几乎不存在,而Akkermansia占未处理对照组和SiO肠道微生物群总数的1-4%2-处理过的动物,严格按照既定水平Akkermansia municiphila[54].虽然由于车辆对照组的个体差异,观察到的变化无法被证明具有统计学意义,但在未来的研究中仍应考虑到Akkermansia口服银纳米材料可能会受到强烈影响。对于不同的金属(Al, Cu, Pb, Cd)也有类似的影响,其中亚慢性口服暴露大大降低了丰度Akkermansia在小鼠中[63](请参阅[64])。Akkermansia有助于宿主免疫系统,并刺激小鼠抗炎调节t细胞的增殖。在许多研究中,大量的答:muciniphila在各种肠道疾病,如炎症性肠病(IBD)或阑尾炎,以及肥胖、自闭症或特异反应症等肠外疾病中65,66,67].
我们还发现乳酸菌用银NP处理后。以前曾报道过对ag处理过的啮齿动物的类似观察[61,62].乳酸菌代表一种益生菌属,已被发现可预防IBD [68]并被描述为预防或治疗人类的胃肠疾病[69].的相对丰度也有类似的下降乳酸菌在不同的啮齿动物模型和人类研究中,已发现促进炎症或精神障碍的易感性[30.,69,70,71].
最后,我们在口服Ag NP的大鼠中检测到普雷沃特科家族的丰度显著增加。该家族已知由四个属组成,其中两个已在肠道中鉴定普氏菌:而且Paraprevotella。属Paraprevotella在慢性肾脏病患者的粪便样本中富集[38]和促进狼疮易感小鼠的自身免疫激活[72].属普氏菌包括40多个物种,但其中只有3个已经在肠道中被鉴定出来普氏菌copri通常是最丰富的一种[64].在小鼠中,普氏菌增加了对结肠炎的易感性[73].与此一致,Chen等人.观察到普氏菌口服Ag NP后,伴有溃疡性结肠炎的诱导[62].反之,用稻草衍生的生物炭处理的大鼠表现出较低的丰度Paraprevotella而且普氏菌,以及引发IBD的代谢物的减少[74].因此,我们假设的显著增加Prevotellacea我们在大鼠口服Ag后观察到的不良健康影响。
总之,口服Ag NP治疗后,我们可以确定肠道菌群的几种改变,包括对特定家族和属的不同影响,这些已知会影响宿主的健康。我们假设这些观察到的改变不仅由纳米银介导,而且由部分溶解的银NP介导。若干使用酸性溶剂和胃液的研究表明,Ag NP发生溶解并从其表面释放银离子,这取决于pH值、颗粒大小和表面涂层[75,76,77,78].Axson et al.和Bove et al.的结果表明,高达90%的20 nm银纳米颗粒(NM300K, Bove et al..)会在数分钟内透过胃道溶解[76].由于我们研究中使用的未涂层Ag NP的平均初级颗粒尺寸更小,为7 nm(附加文件)1表S14),我们假设它们通过胃后至少部分溶解。然而,Ag NP的高溶解速率并不一定会导致高浓度的自由银离子。Ag NP衍生银离子可与消化基质结合形成Ag生物分子或聚集物,从而减少可利用的自由离子[76,78],与醋酸银相比,口服Ag NP的银离子生物利用度较低,这一发现也支持了这一发现[79].
口服SiO治疗后2NP,我们观察到肠球菌科和属的水平显著下降肠球菌。肠球菌已发现菌株可诱导显著的抗炎作用,并有助于肠上皮的完整性。它们被用作治疗肠易激综合症或慢性肠道疾病的益生菌,并用于免疫刺激[80,81].的水平明显降低肠球菌因此可能是异常或不健康状态的标志。
此外,我们观察到该属的丰度显著下降Turicibacter在SiO2对待动物。在啮齿动物中,减少Turicibacter水平年代与肥胖状态下的炎症升高相一致[82].Turicibacter似乎可以调节肠道中的细菌定植。t .肝病杂志在小鼠中单定殖被发现调节小肠和结肠中的许多基因,这些基因参与类固醇和脂质代谢途径[83这表明它在肠道微生物-宿主共代谢中起着重要作用。值得注意的是,我们还检测到肽链球菌- tissierellales和该属的水平显著下降Romboutsia在SiO2治疗的老鼠。两属的物种,Romboutsia而且Turicibacter发现通过产生短链脂肪酸来抑制病原体的生长[84].
相反,我们观察到Oscillospiraceae, Ruminococcaceae, Lachnospiraceae和Prevotellaceae家族的丰度增加。这些结果与其他有关口服SiO的报道一致2小鼠的NP。Chen等.[62]报告了Lachnospiraceae, Ruminococcaceae,Oscillobacter属的普氏菌.他们还观察到,喂食二氧化硅的小鼠结肠中促炎细胞因子水平增加2NP (62].该属的水平升高普氏菌可能是导致这一增长的原因普氏菌(以及肠道中数量最多的种类p . copri)会引发炎症[73].
总之,通过经典的病理评估,我们还没有在SiO中发现毒性的指征2np处理大鼠[51].然而,在肠道菌群中观察到的大量扰动如。普氏菌科的显著增加伴随着益生菌属的显著减少,如肠球菌而且Turicibacter,可能对动物健康状况有长期影响。
通常对大鼠血浆进行代谢组分析,以确定指示有害影响的代谢物模式。由于肠道菌群影响宿主的各种代谢途径,代谢组学结果可以显示不利的代谢谱,并识别潜在的负面健康影响[85].除了我们在肠道微生物组中发现的变化外,我们还观察到血浆代谢组的一些变化。表S13总结了不同抗生素治疗后与血浆代谢物变化比较所确定的影响(附加文件1).Ag NP或SiO有10种不同的代谢变化2我们的研究NP处理,分别(表2),并详细介绍了可能涉及的生化途径和肠道微生物组对这些代谢物的具体影响(附加文件1:表S15)。观察到的影响可能来自肠道微生物组的改变或纳米材料与宿主代谢的直接相互作用。口服SiO治疗后2然而,我们不能排除血浆代谢物水平的下降也可能是肠道代谢物或其前体对这些SiO的吸附造成的2NP。我们观察到银NP灌胃后大鼠尿囊素的显著增加,可能是由于银与宿主生物的直接相互作用。之前,Hadrup等人.[86]发现口服Ag NP或离子银(9 mg/kg体重/天,28天)的雌性Wistar大鼠尿液中尿囊素显著增加,这可能是氧化应激和伴随的DNA降解的迹象。有趣的是,他们没有发现雄性Wistar大鼠尿液中的代谢变化,并提示雌性大鼠肾脏对Ag NP比雄性肾脏更敏感[86].相反,我们观察到雄性大鼠血浆中尿囊素水平升高,这一差异可能是由于样本来源不同,也可能表明较高剂量的Ag (100 mg/kg体重/天)弥补了雄性大鼠较低的敏感性。我们进一步观察到在SiO中伪尿苷水平显著增加2np处理的大鼠,这也可能是由于SiO相互作用的应激反应2与主机的NP [87].
对于所有其他代谢产物的途径,发现其水平显著改变,肠道菌群的贡献此前已被报道(详情见附加文件)1:表S15)。肠道菌群已被证明能产生广泛的哺乳动物神经递质,作为与宿主交流的手段[88].高度丰富的属的种变形杆菌,在SiO的丰度下降2和ag处理的大鼠,已被描述产生去甲肾上腺素[88].在np处理的大鼠血浆中,我们注意到儿茶酚胺的水平下降,如3,4二羟基苯乙二醇和肾上腺素,这是去甲肾上腺素的产物。这种效应可能表明神经递质的干扰生产可能对宿主生理产生影响(附加文件)1:表S15)。
我们还发现泛酸(维生素B)显著减少5)在大鼠血浆中2.几乎所有的拟杆菌门和变形杆菌门都能产生维生素B5[89],我们观察到暴露于SiO的大鼠变形菌门显著减少2NP。最近,肠道微生物组的变化被描述为导致人类肠道中B族维生素产量减少,导致泛酸缺乏,并作为促炎症状态对免疫系统产生不利影响[90].
最值得注意的是,我们发现Ag NP-和SiO中吲哚-3-乙酸(IAA)的水平显著降低2NP-treated老鼠。IAA是一种肠道微生物代谢产物,由膳食色氨酸通过吲哚途径产生[91].多种细菌种类能够将色氨酸转化为吲哚和吲哚衍生物,包括乳酸菌Species和Akkermansia muciniphila(附加文件1:表S15) [91,92,93,94].在使用抗生素后,在啮齿类动物中也发现了类似的IAA减少[40,48].然而,据我们所知,纳米颗粒诱导IAA水平的降低还没有被描述。IAA是芳基烃受体(AhR)的配体,AhR是一种重要的转录因子,对T细胞免疫产生许多发育和组织依赖性影响,并在肠道中发挥抗炎作用[44].AhR激活导致多种细胞反应,它协调包括激素和免疫反应在内的途径,因此可以极大地影响健康和疾病风险。不同的报道表明AhR具有肿瘤抑制作用[95].喇嘛等.假设长期使用TiO后,在啮齿动物中观察到np诱导的产生AhR配体的细菌菌株的耗竭2NP代表结肠癌发展的缺失环节[2].由于IAA也被证明可以降低小鼠对结肠炎的易感性[44,93,96]以及调节肝细胞和巨噬细胞的炎症反应[97], np诱导的IAA水平降低可能增加大鼠对慢性疾病的易感性。
总之,我们的限制剂量试验结果表明,大鼠口服暴露于Ag NP或SiO2NP导致肠道细菌群落发生变化,进而改变代谢特征,可能对健康产生长期不良影响(表2)3.).今后应开展剂量-反应研究,根据估计的人类平均膳食摄入量,评估剂量的潜在健康风险。
结论
在这项研究中,口服两种表征良好的纳米颗粒SiO的影响2在雄性Wistar大鼠中研究NP和Ag NP。在组织病理学和临床病理学中,我们没有发现任何与治疗相关的毒性迹象,但我们观察到与不良健康影响相关的肠道微生物群的显著变化,以及与微生物组变化相关的血浆代谢物的变化。我们的研究结果表明,口服摄取二氧化硅2NP或Ag NP在体内可影响肠道菌群。由此产生的肠道微生物群变化对每种类型的NP都是特定的。一些已知在保持个体健康方面发挥重要作用的细菌科和属在np处理的动物中被发现减少。表格4总结了这项研究中最重要的发现(表4).
我们发现np处理过的大鼠血浆代谢组发生了显著而重要的变化,这是每种纳米颗粒所特有的。重要的是,在两种NP灌胃后发现AhR配体IAA的水平显著降低。这是第一份证实np诱导的AhR配体在体内减少的报告,这一观察结果应被仔细关注,以进行健康和疾病风险评估。
尽管在NP暴露28天后,大鼠没有发现毒性迹象,但我们的结果表明,长期影响是可以想象的,应该加以考虑。未来的研究将对长期接触纳米材料和剂量范围内的肠道微生物群和血浆代谢组进行联合分析,更多地反映人类的平均饮食摄入量,这将有助于理解代谢谱改变的相关性。
方法
测试物质和粒子特性
测试物质选自nanoGEM研究的一组[98,99]即。SiO2 NP (SiO2.无不同表面修饰的裸NP;Levasil®200)和Ag NP (Ag50 EO NP)。SiO2由德国路德维希港的巴斯夫公司提供,德国勒沃库森的拜耳材料科学公司提供。测试物质以分散体的形式交付,并根据纳米材料信息要求指南中描述的物理化学端点进行了详细的表征[One hundred.]参阅有关化学品的注册、评估、授权及限制的欧盟规例第1907/2006号[101].利用所示方法测定了以下测试物质的性质[98,102,103].
平均一次粒径和一次粒径(PPS)分布(TEM);水动力粒径[动态光散射(DLS)和分析超离心(AUC)];颗粒形貌[光学显微镜和扫描电子显微镜(SEM)];结晶度[x射线衍射(XRD)];表面化学、纯度和结晶相[x射线光电子能谱(XPS)];有机表面功能化[二次离子质谱(SIMS)];等电点和ζ电位(电泳迁移率滴定法);表面反应性和自由基形成势(电子自旋共振(ESR)利用中心苯氧辛(CPH)或二甲基吡罗啉- n -氧化物(DMPO)自旋陷阱)。为试验材料SiO2Ag为28天口服毒性研究试验物质载体的团聚状态,即。、磷酸盐缓冲盐水(PBS)中添加1 g/L牛血清白蛋白(BSA;为PBS + BSA),采用激光衍射和AUC法测定。
表S14提供了两种测试物质的主要和次要物理化学性质的概述1),已改编自[102,103].有关纳米gem测试物质的制备和表征的进一步信息可从[98].
测试物质的制备
由供应商提供的原始测试悬浮液使用旋涡混合器进行摇晃和混合2分钟,以确保颗粒分布均匀。然后称取所需量的试验物质,用试验物质载体PBS + BSA填充,得到10% wt溶液的均匀试验物质溶液。每天生产测试物质制剂,并保持均匀,直到使用磁力搅拌器连续搅拌。
由于纳米颗粒可以在悬浮液中迅速团聚和沉积,这可能在很大程度上影响到达目标生物体的最终有效剂量,因此有必要评估测试物质的均匀性并验证测试物质制剂中的有效浓度。因此,在给药期开始时,采用电感耦合等离子体-光学发射光谱法(ICP-OES)对所有测试物质悬液(PBS + BSA中“交付时”和“制备时”)进行均匀性和浓度控制分析。为此目的,从小瓶的底层、中层和顶层(在均质悬浮液中必须具有相同的测试物质浓度)提取了三个不同的测试物质制剂样品。各测试物质的金属元素含量(即。硅在SiO的情况下2)进行测量,整个测试物质分子的质量由这些测量得出。用于表面功能化的物质的质量被认为可以忽略不计[104].
测试物质表征
两种测试物质在水中分散良好,团聚数平均(AAN,即。,即团聚体中初级颗粒的平均数量)为1。SiO2在PBS + BSA中保持稳定,只有很少的团聚,但也记录了BSA吸附。当在DMEM + FCS中稀释时,SiO2中度团聚(AAN = 28)。SiO的等电点2的pH值低于1。
当在DMEM + FCS中稀释时,Ag保持良好的分散性(AAN = 1);PBS + BSA中颗粒大小未测定。Ag的等电点在pH值为2.5时。
动物研究结果的表现、统计分析和解释
用雄性Wistar大鼠(Crl:WI(Han), Charles River Laboratories, Sulzfeld, Germany)进行了28天的口服毒性研究。所有动物工作都在动物设施中进行,并持有国际实验动物护理评估和认可协会(AAALAC)的证书。动物研究于2009年1月30日经当地动物实验授权机构(Landesuntersuchungsamt Rheinland-Pfalz, Koblenz, Germany)批准进行,参考批准号23 177-07/G 08-3-007,研究方案符合相应的指南。对于SiO2时,试验以极限试验方式进行,单次剂量水平为1000mg /kg体重/天(参见OECD TG 407第18段)[49].Ag以100 mg/kg体重/天的剂量水平施用。试验物质制剂每天口服灌胃给五只雄性大鼠组,为期四周。对照组5只雄性动物只注射PBS + BSA。动物定期接受详细的临床观察,评估食物和水的消耗和体重;在给药期结束时进行血液学和临床化学检查。在给药期结束后,所有动物都进行了全面、详细的大体尸检,并对OECD试验指南编号中列出的所有器官进行了组织病理学检查。407,第43段[49].
使用MetaMap®Tox方法进行代谢组分析
正如van ravenzway等人所描述的.和坎普等人.[45,46],所有大鼠在牺牲当天采集的EDTA-K3血液样本通过专有方法提取代谢物,分析其代谢物谱:应用GC-MS和LC-MS /MS进行广泛分析和激素测量。该方法得到了225种半定量分析物,其中171种化学鉴定,54种结构未知。利用MetaMap®Tox数据库对记录的代谢物谱进行分析[105],(参见信息框MetaMap®Tox方法学)。
数据采用单变量和多变量统计方法进行分析。日层异方差t-检验(Welch检验)比较np处理组与各自对照组的代谢物水平。对于所有代谢物,变化计算为治疗组中单个大鼠代谢物水平平均值相对于匹配对照组大鼠代谢物水平平均值的比值。的p值,t-值,以及相应组中位数的比例被收集作为代谢谱,并输入MetaMap®Tox数据库[106].在数据库中,所有治疗组都与相应研究的对照组进行了比较。对代谢谱的强度进行了分析。的绝对中位数的四舍五入平均值t值,不仅包括显著变化的代谢物的绝对数量,还包括各自变化的幅度。找到真正调控的代谢物的最大数量,同时使假阳性调控代谢物的数量最小化的最佳平衡是在ap值为0.15。因此,对于模式识别p血浆数据库中使用的值高达0.2。有关MetaMap®Tox中使用统计数据的详细描述,请参阅van ravenzway等人.[106].
粪便取样用于微生物组分析
为此,在固定采样前一天下午将动物转移到代谢笼中(不提供食物和饮用水)。第二天早上,取尿液样本进行预定的尿液分析,而粪便则直接冷冻。所有粪便样本均保存在−80°C下进行进一步分析。
粪便中细菌DNA的分离
在给药期即将结束时收集雄性大鼠的粪便,即。在研究的第25天,并保存在- 80°C。根据制造商的说明,使用innuSPEED粪便DNA试剂盒(analytitikjena, Jena, Germany)从大鼠粪便中进行DNA分离。特别地,我们使用300 mg粪便样本,加入1 mL裂解液(在innuSPEED粪便试剂盒DNA试剂盒中提供),并将其均质约30分钟。根据innuSPEED粪便DNA试剂盒手册的方案2进行样品清理、绑定和洗涤后,使用2 × 100µl洗脱缓冲液从色谱柱中洗脱DNA,随后在−20°C保存。在NanoDrop 2000设备(Fisher Scientific, Schwerte, Germany)上通过琼脂糖凝胶电泳和分光光度法确认分离的基因组DNA的质量和纯度。DNA浓度用Qubit 2.0仪器,应用Qubit dsDNA HS分析(Life Technologies, Invitrogen分部,Darmstadt, Germany)进行估计。
用于微生物群落分析的下一代测序
对于NGS文库制备,使用了Illumina MiSeq系统的16S核糖体RNA基因扩增子的推荐方案(Illumina Inc., San Diego, CA, USA)。建议的通用细菌引物(Bakt_341F:5 ' -CCTACGGGNGGCWGCAG-3 '和Bakt_805r:5 ' -GACTACHVGGGTATCTAATCC-3 ')使用KAPA Hifi HotStart Ready Mix (Roche Diagnostics Deutschland, Mannheim, Germany)通过聚合酶链式反应(PCR)扩增细菌16S rRNA基因的V3和V4高可变区。使用HT DNA高灵敏度LabChip试剂盒(PerkinElmer, Rodgau, Germany),用Caliper GX系统测定扩增子的纯度和精确片段大小。在第二个PCR中,附加了样本特异性的“条形码”引物和适配器序列。所有文库进行标准化和合并,使用MiSeq试剂盒版本(v.) 3 (Illumina, San Diego, CA, USA)进行Illumina MiSeq测序,有300个碱基对(bp)成对的末端reads略有重叠。
生物信息学与统计分析
采用FastQC v0.11.5分析16S rRNA基因测序数据的质量[107].读取使用镰刀v1.33 (https://github.com/najoshi/sickle),并利用Qiime2(2020.11)进行分析[108].简单地说,读取数据被导入Qiime2管道并被解复用。然后使用包含的DADA2管道去噪18,305,252对序列读取,去除嵌合序列,并推断扩增子序列变体(ASV) [109].然后对全长Silva数据库(v138, 99%身份截断值)使用q2-feature-classifier[对asv进行分类学分类]110,111].利用ASV数据计算Bray-Curtis距离的PCoA。Qiime2视图(https://view.qiime2.org/)用于可视化。从2级(门)到6级(属)asv的相对丰度用于进一步分析。在每个水平上,用Mann-Whitney U检验(alpha = 0.05)分析三组间相对丰度的差异。Alpha多样性(即丰富度和均匀度)采用基于Shannon-Wiener和逆辛普森生物多样性指数(Inverse Simpson Index for biodiversity)的asv计算,并使用Student’s进行评估t -显著性测试定义为p< 0.05。从asv生成的稀疏曲线表明,在所有样本中都实现了足够的采样覆盖率(附加文件1:图S5)。用Bray-Curtis距离值计算beta多样性,用R v4.0.2可视化主坐标分析(PCoA) [112].
数据和材料的可用性
本研究中使用和/或分析的所有数据集均可根据合理要求从通讯作者处获得。
参考文献
莫里诺-霍恩M,格贝尔T.颗粒生物耐久纳米材料:没有令人信服的证据,全身毒性。中国生物医学工程学报。2014;44(10):849-75。https://doi.org/10.3109/10408444.2014.938802.
Lamas B, Martins Breyner N, Houdeau E.食源性无机纳米颗粒对肠道微生物-免疫轴的影响:对宿主健康的潜在后果。部分纤维毒性。2020;17(1):19。https://doi.org/10.1186/s12989-020-00349-z.
van der Zande M, Vandebriel RJ, Groot MJ, Kramer E, Herrera Rivera ZE, Rasmussen K,等。大鼠口服纳米结构二氧化硅亚慢性毒性研究。纤维毒物。2014;11:8。https://doi.org/10.1186/1743-8977-11-8.
查卢普卡,马兰姆,西法利安。纳米银是应用于生物医学领域的新一代纳米产品。生物技术。2010;28(11):580-8。https://doi.org/10.1016/j.tibtech.2010.07.006.
王晓明,王晓明,王晓明,等。对银作为食品添加剂重新评价的科学意见(E 174)。欧洲食品安全局J. 2016。https://doi.org/10.2903/j.efsa.2016.4364.
Hadrup N, Sharma AK, Loeschner K.银离子、金属银和纳米银材料在活体真皮和粘膜表面暴露后的毒性研究综述。Regul Toxicol pharmacy . 2018; 98:257-67。https://doi.org/10.1016/j.yrtph.2018.08.007.
Giese B, Klaessig F, Park B, Kaegi R, Steinfeldt M, Wigger H,等。工程纳米材料在环境中的风险、释放和浓度。科学通报2018;8(1):1565。https://doi.org/10.1038/s41598-018-19275-4.
张志刚,张志刚。纳米银对小鼠小肠粘膜的毒性作用。毒醇力学方法。2013;23(3):161-7。https://doi.org/10.3109/15376516.2013.764950.
查坤,洪洪伟,崔永国,李俊梅,朴志华,蔡宏科,等。小鼠肝脏短期暴露于纳米或微米银颗粒急性反应的比较。生物技术通报,2008;30(11):1893-9。https://doi.org/10.1007/s10529-008-9786-2.
朴英杰,裴娥,李俊,金勇,崔凯,李帅,等。口服纳米银对小鼠的重复剂量毒性和炎症反应。环境毒理学杂志。2010;30(2):162-8。
Bostan HB, Rezaee R, Valokala MG, Tsarouhas K, Golokhvast K, Tsatsakis AM,等。纳米颗粒的心脏毒性。生命科学学报,2016;https://doi.org/10.1016/j.lfs.2016.09.017.
金银生,金金杰,赵海生,罗世德,金金敏,朴世杰,等。银纳米颗粒在Sprague-Dawley大鼠的28天口服毒性、遗传毒性和性别相关的组织分布。吸入毒物。2008;20(6):575-83。
郑国宁,赵武武,柳海西,金玉生,宋ks,俞ij。银纳米颗粒给药后大鼠肠道黏蛋白的组织化学研究。中国化学。2010;84(1):63-9。
Maneewattanapinyo P, Banlunara W, Thammacharoen C, Ekgasit S, Kaewamatawong T.胶体银纳米颗粒的急性毒性评价。中华兽医医学杂志,2011;29(4):344 - 344。https://doi.org/10.1292/jvms.11-0038.
金宗杰,宋ks,成俊辉,柳宏,崔bg,赵宏,等。纳米银的遗传毒性,急性口服和皮肤毒性,眼睛和皮肤刺激和腐蚀以及皮肤致敏性评估。纳米毒理学。2013;7(5):953 - 60。https://doi.org/10.3109/17435390.2012.676099.
van der Zande M, Vandebriel RJ, van Doren E, Kramer E, Herrera Rivera Z, Serrano-Rojero CS,等。口服28天后,银纳米颗粒和银离子在大鼠体内的分布、消除和毒性。生物化学学报。2012;6(8):7427-42。
Garcia T, Lafuente D, Blanco J, Sanchez DJ, Sirvent JJ, Domingo JL,等。大鼠口服亚慢性纳米银暴露。食品化学毒理学杂志,2016;92:177-87。
李志强,李志强,李志强,等。纳米银和离子银对大鼠亚急性口服毒性研究。中国药理学杂志。2012;86(4):543-51。https://doi.org/10.1007/s00204-011-0759-1.
Hassankhani R, Esmaeillou M, Tehrani AA, Nasirzadeh K, Khadir F, Maadi H.口服二氧化硅纳米颗粒对健康成年小鼠的体内毒性。环境科学学报,2015;22(2):1127-32。
金永荣,李世勇,李永杰,朴升,成N-W,徐海松,等。胶体二氧化硅纳米颗粒口服大鼠90天的毒性。国际纳米医学杂志,2014;9(增刊2):67-78。
Tarantini A, Huet S, Jarry G, Lanceleur R, Poul M, Tavares A,等。合成无定形二氧化硅纳米颗粒在大鼠短期暴露后的遗传毒性。第一部分:口述路线。环境化学,2015;56(2):218-27。
李继娥,金敏奎,白海杰,金永荣,金敏奎,李继奎,等。口服二氧化硅纳米颗粒在大鼠体内的组织分布和排泄动力学。国际纳米医学杂志,2014;9(增刊2):251-60。
吉田T,吉冈Y,高桥H, Misato K,森T,平井T,等。口服无定形二氧化硅颗粒的肠道吸收和生物学效应。纳米尺度测量,2014;9(1):532。https://doi.org/10.1186/1556-276X-9-532.
付超,刘涛,李玲,刘红,陈东,唐峰。不同暴露途径下介孔二氧化硅纳米颗粒在小鼠体内的吸收、分布、排泄及毒性。生物材料。2013;34(10):2565 - 75。https://doi.org/10.1016/j.biomaterials.2012.12.043.
Hadrup N, Lam HR。银离子、银纳米颗粒和胶体银的口服毒性研究进展。中国药物学杂志。2014;68(1):1 - 7。https://doi.org/10.1016/j.yrtph.2013.11.002.
Furchner JE, Richmond CR, Drake GA。哺乳动物放射性核素的比较代谢。4.小鼠、大鼠、猴、犬110米贮银量。卫生物理。1968;15(6):505。https://doi.org/10.1097/00004032-196812000-00005.
杜邦HL,蒋志东,杜邦AW, Utay NS。肠道微生物在人类健康和疾病中的作用。气候科学学报。2020;131:178-97。
张文杰,李文杰,李文杰,等。炎症性肠病的肠道微生物组结构和代谢活性。中国微生物学杂志,2019;4(2):293-305。https://doi.org/10.1038/s41564-018-0306-4.
肠道微生物群:维和部队。大自然。2015;518 (7540):S3-11。https://doi.org/10.1038/518S3a.
Cryan JF, Dinan TG。改变思维的微生物:肠道微生物群对大脑和行为的影响。神经科学,2012;13(10):701-12。https://doi.org/10.1038/nrn3346.
Sarkar A, Harty S, Lehto SM, Moeller AH, Dinan TG, Dunbar RIM,等。心理学和认知神经科学中的微生物组。中国医学科学,2018;22(7):611-36。https://doi.org/10.1016/j.tics.2018.04.006.
王志强,王志强,王志强,等。应激敏感大鼠肠-脑轴功能障碍模型的代谢组和微生物组分析。科学通报2019;9(1):14026。https://doi.org/10.1038/s41598-019-50593-3.
Poore GD, Kopylova E,朱q, Carpenter C, Fraraccio S, Wandro S,等。血液和组织微生物组分析建议癌症诊断方法。自然。2020;579(7800):567 - 74。https://doi.org/10.1038/s41586-020-2095-1.
药物和微生物群之间的复杂关系。大自然。2020;577 (7792):S10-1。https://doi.org/10.1038/d41586-020-00196-0.
Dolgin E.用微生物对抗癌症。大自然。2020;577 (7792):S16-8。https://doi.org/10.1038/d41586-020-00199-x.
Mesnage R, Antoniou MN, Tsoukalas D, Goulielmos GN, Tsatsakis A.肠道微生物组宏基因组学了解异种生物如何影响人类健康。Curr Opin Toxicol. 2018; 11-12:51-8。https://doi.org/10.1016/j.cotox.2019.02.002.
欧特曼N,葛林斯SY, Aalvink S,德沃斯WM, Belzer cAkkermansia muciniphila微生物群落生态学、健康与疾病。中国消化内科杂志。2017;31(6):637-42。https://doi.org/10.1016/j.bpg.2017.10.001.
李娟,唐敏,薛艳。纳米银暴露对肠道细菌影响的研究进展。应用毒理学杂志,2019;39(1):27-37。https://doi.org/10.1002/jat.3729.
Wikoff WR, Anfora AT, Liu J, Schultz PG, Lesley SA, Peters EC,等。代谢组学分析显示肠道菌群对哺乳动物血液代谢产物有很大影响。美国国家科学研究院。2009, 106(10): 3698 - 703。https://doi.org/10.1073/pnas.0812874106.
Behr C, Ramirez-Hincapie S, Cameron HJ, Strauss V, Walk T, Herold M,等。林可沙胺类抗生素对大鼠肠道菌群组成及血浆和粪便代谢产物谱的影响。毒理学杂志2018;296:139-51。https://doi.org/10.1016/j.toxlet.2018.08.002.
李志强,李志强,李志强,等。微生物代谢产物与宿主免疫的关系。《微生物学杂志》2017;35:8-15。https://doi.org/10.1016/j.mib.2016.10.003.
李志刚,李志刚,李志刚,李志刚。微生物对机体能量稳态的调节作用。中华医学杂志。2019;1(1):34-46。https://doi.org/10.1038/s42255-018-0017-4.
高洁,徐坤,刘华,刘刚,白明,彭超,等。肠道菌群对色氨酸代谢介导的肠道免疫的影响前端细胞感染微生物,2018;8:13。https://doi.org/10.3389/fcimb.2018.00013.
Lavelle A, Sokol H.肠道微生物代谢产物在炎症性肠病中的关键作用。中华胃肠病杂志,2020;17(4):223-37。https://doi.org/10.1038/s41575-019-0258-z.
van ravenzway B, Cunha GCP, Leibold E, Looser R, Mellert W, Prokoudine A,等。利用代谢组学发现新的生物标记物的效果。化学通报,2007;17(1-2):21-8。https://doi.org/10.1016/j.toxlet.2007.05.021.
Kamp H, Strauss V, Wiemer J, Leibold E, Walk T, Mellert W,等。28天重复剂量毒性研究大鼠血浆代谢组分析的重现性和稳健性。毒理学通报2012;215(2):143-9。https://doi.org/10.1016/j.toxlet.2012.09.015.
马志刚,刘志刚,刘志刚,等。用大鼠血浆代谢物谱(代谢组学)检测肝毒性潜能。化学通报,2014;30(3):467-78。https://doi.org/10.1016/j.toxlet.2014.07.021.
Behr C, Kamp H, Fabian E, Krennrich G, Mellert W, Peter E,等。抗生素治疗大鼠血浆肠道微生物组相关代谢变化。中国生物医学工程学报。2017;39(10):344 - 344。https://doi.org/10.1007/s00204-017-1949-2.
经济合作与发展组织。试验编号407:啮齿动物重复剂量28天口服毒性研究。2008.
Tamimi SO, Zmeili SM, Gharaibeh MN, Shubair MS, Salhab AS。新型戒烟漱口水881010对大鼠和兔子的毒性。中华药理学杂志,1998;29(1):1 - 6。https://doi.org/10.1080/009841098159466.
Buesen R, Landsiedel R, Sauer UG, Wohlleben W, groetters S, Strauss V,等。SiO(2), ZrO(2)和BaSO(4)纳米材料表面功能化或不功能化对大鼠28天口腔暴露的影响。中国生物医学工程学报。2014;39(10):1881-906。https://doi.org/10.1007/s00204-014-1337-0.
Wilding LA, Bassis CM, Walacavage K, Hashway S, Leroueil PR, Morishita M,等。不同大小和涂层的银纳米颗粒重复剂量(28天)给药不会显著改变本土小鼠肠道微生物群。纳米毒理学。2016;10(5):513 - 20。https://doi.org/10.3109/17435390.2015.1078854.
van den Brule S, Ambroise J, Lecloux H, Levard C, Soulas R, De Temmerman PJ,等。饮食中的银纳米颗粒可以扰乱小鼠肠道菌群。纤维毒物。2016;13(1):38。https://doi.org/10.1186/s12989-016-0149-1.
张涛,李qq,程林,Buch H,张峰。Akkermansia muciniphila是很有前途的益生菌。生物技术学报,2019;12(6):1109-25。https://doi.org/10.1111/1751-7915.13410.
变形杆菌在自然环境中的意义和作用。微生物学杂志,2016;72(4):741-58。https://doi.org/10.1007/s00248-015-0720-6.
欧洲食品安全局Nda委员会(营养产品NaA委员会)。营养产品、营养和过敏科学小组对委员会要求的有关硅的可容忍的最高摄入量的意见。欧洲食品安全局,2004;60:1-11。
有毒物质。银的毒理学特征。佐治亚州亚特兰大市:美国卫生与公众服务部公共卫生局有毒物质和疾病登记处;1990.
美国环境保护署。银的综合风险信息系统(IRIS)毒理学审查和摘要文件,CASRN 7440-22-4。华盛顿特区:美国环境保护局;1996.
Varner Ke-B A, Feldhake D, Venkatapathy R.科学状况综述:所有纳米银和更多。华盛顿特区:美国环境保护局;2010.(EPA / 600 / R-10 / 084).
马丽婷,李丽娟,李丽娟,等。人体微生物群的厚壁菌门/拟杆菌门比例随年龄而变化。BMC微生物学杂志,2009;9:123。https://doi.org/10.1186/1471-2180-9-123.
Williams K, Milner J, Boudreau MD, Gokulan K, Cerniglia CE, Khare S.亚慢性暴露银纳米颗粒对sd - dawley大鼠回肠肠道菌群和肠道相关免疫反应的影响。纳米毒理学。2015;9(3):279 - 89。https://doi.org/10.3109/17435390.2014.921346.
陈海峰,赵rf,王波,蔡彩霞,郑丽兰,王海林,等。口服Ag, TiO2和SiO2纳米颗粒对小鼠肠道菌群组成和结肠炎诱导的影响。Nanoimpact。2017;8:80-8。https://doi.org/10.1016/j.impact.2017.07.005.
翟庆祥,李tq,余龙,肖勇,冯士生,吴建平,等。亚慢性口服有毒金属对小鼠肠道菌群的影响。科学通报,2017;62(12):831-40。https://doi.org/10.1016/j.scib.2017.01.031.
齐奥西斯J,安东尼欧MN,柯利亚基斯I, Mesnage R, Vardavas CI, Izotov BN,等。单一和联合毒性暴露对肠道微生物群的影响:目前的知识和未来的方向。毒理学杂志2019;312:72-97。https://doi.org/10.1016/j.toxlet.2019.04.014.
杜志强,李志强,李志强,等。muciniphilakkermansia和肥胖饮食干预期间代谢健康的改善:与肠道微生物组丰富度和生态学的关系。肠道。2016;65(3):426 - 36。https://doi.org/10.1136/gutjnl-2014-308778.
Caesar R, Tremaroli V, Kovatcheva-Datchary P, Cani PD, Backhed f肠道微生物群与膳食脂质之间的串扰通过TLR信号加重WAT炎症。中国生物医学工程学报。2015;22(4):658-68。https://doi.org/10.1016/j.cmet.2015.07.026.
德连M,贝尔泽C,德沃斯WM。Akkermansia muciniphila以及它在调节宿主功能方面的作用。微生物病理学杂志,2017;106:171-81。https://doi.org/10.1016/j.micpath.2016.02.005.
炎症性肠病的肠道菌群:正常还是异常?中国胃肠病杂志,2005;21(4):414-8。
沃廷A, Blaut M.代谢疾病中的肠道微生物群。营养。2016;8(4):202。https://doi.org/10.3390/nu8040202.
Lowry CA, Smith DG, Siebler PH, Schmidt D, Stamper CE, Hassell JE Jr,等。微生物群、免疫调节和心理健康:对公共卫生的影响。中国环境卫生研究,2016;3(3):270-86。https://doi.org/10.1007/s40572-016-0100-5.
Guinane CM, Cotter PD。肠道菌群在健康和慢性胃肠道疾病中的作用:了解隐藏的代谢器官。中华胃肠病杂志,2013;6(4):295-308。https://doi.org/10.1177/1756283X13482996.
崔胜,布朗杰,龚敏,葛勇,Zadeh M,李伟,等。肠道菌群失调和改变色氨酸分解代谢有助于狼疮易感小鼠的自身免疫。科学翻译医学2020。https://doi.org/10.1126/scitranslmed.aax2220.
张志强,张志强,张志强,等。肠道copri普氏菌的扩张与增强关节炎易感性相关。Elife. 2013;2: e01202。https://doi.org/10.7554/eLife.01202.
韩娟,孟J,陈淑云,李晨。16S rRNA基因测序和LC/ ms - s代谢组学分析稻草生物炭处理大鼠肠道菌群和代谢组。科学代表2019。https://doi.org/10.1038/s41598-019-54467-6.
Axson JL, Stark DI, Bondy AL, Capracotta SS, Maynard AD, Philbert MA,等。银纳米颗粒在模拟胃液中大小和ph依赖性溶解和聚集的快速动力学。光子学报,2015;29(3):344 - 344。https://doi.org/10.1021/acs.jpcc.5b03634.
Bove P, Malvindi MA, Kote SS, Bertorelli R, Summa M, Sabella S.纳米颗粒溶解试验的风险评估:初步研究。纳米级。2017;9(19):6315 - 26所示。https://doi.org/10.1039/c6nr08131b.
张勇,张志强。银纳米颗粒在中性和酸性pH条件下的尺寸控制溶解:动力学和尺寸变化。环境科学与技术,2014;48(20):11954-61。https://doi.org/10.1021/es5023202.
吴伟,张瑞,McClements DJ, Chefetz B, Polubesova T,邢b。膳食补充剂银纳米颗粒在模拟人胃肠道中的转化及形态分析。环境科学与技术,2018;52(15):8792-800。https://doi.org/10.1021/acs.est.8b01393.
罗旭东,李志强,李志强,等。重复口服纳米银或醋酸银28天后银在大鼠中的分布。纤维毒物。2011;8:18。https://doi.org/10.1186/1743-8977-8-18.
Hanchi H, Mottawea W, Sebei K, Hammami R.肠球菌属:在益生菌潜力和安全问题之间的更新。前沿微生物,2018。https://doi.org/10.3389/fmicb.2018.01791.
张志刚,张志刚,张志刚。肠球菌作为益生菌及其在食品安全中的意义。中国生物医学工程学报。2011;29(2):339 - 339。https://doi.org/10.1016/j.ijfoodmicro.2011.08.014.
焦宁,Baker SS, Nugent CA, Tsompana M,蔡丽婷,王勇,等。肠道微生物组可能有助于肥胖啮齿动物的胰岛素抵抗和全身炎症:一项荟萃分析。中国生物医学工程学报。2018;50(4):244-54。https://doi.org/10.1152/physiolgenomics.00114.2017.
冯忠忠,何伟龙,卢娜,彭丽丽,等。肠道血清素和氟西汀暴露可调节肠道内细菌定植。中国微生物学杂志,2019;4(12):2064-73。https://doi.org/10.1038/s41564-019-0540-4.
马格鲁德,艾德盛,张丽娟,张丽娟,等。肠道共生菌群和肠杆菌科细菌尿和尿路感染的风险降低。肠道微生物,2020年。https://doi.org/10.1080/19490976.2020.1805281.
Tsoukalas D, Fragoulakis V, Papakonstantinou E, Antonaki M, Vozikis A, Tsatsakis A,等。尿有机酸靶向代谢组学分析预测自身免疫性疾病代谢物。2020。https://doi.org/10.3390/metabo10120502.
Hadrup N, Lam HR, Loeschner K, Mortensen A, Larsen EH, Frandsen H.纳米银增加大鼠尿酸和尿囊素排泄,通过代谢组学确定。应用毒理学杂志,2012;32(11):929-33。https://doi.org/10.1002/jat.2779.
胡海林,范XP,郭强,魏新军,杨德强,张碧,等。二氧化硅纳米颗粒通过内质网应激和活性氧的产生诱导胰岛素抵抗。部分纤维毒物。2019。https://doi.org/10.1186/s12989-019-0327-z.
肠道菌群调节神经递质。脑res 2018;1693(Pt B): 128-33。https://doi.org/10.1016/j.brainres.2018.03.015.
Magnusdottir S, Ravcheev D, de Crecy-Lagard V, Thiele I. b族维生素生物合成的系统基因组评估表明肠道微生物之间的合作。前热内。2015;6:148。https://doi.org/10.3389/fgene.2015.00148.
维生素D缺乏会改变肠道微生物群,减少肠道内维生素B的产生。由此导致的泛酸缺乏会对免疫系统产生不利影响,产生与动脉粥样硬化和自身免疫相关的“促炎”状态。医学假说。2016;94:103-7。https://doi.org/10.1016/j.mehy.2016.07.007.
微生物色氨酸分解代谢产物在健康和疾病中的作用。地理学报。2018;9(1):3294。https://doi.org/10.1038/s41467-018-05470-4.
van Beek AA, Hugenholtz F, Meijer B, Sovran B, Perdijk O, Vermeij WP,等。前沿科学:色氨酸限制在WT和过早衰老的Ercc1(-/Delta7)小鼠中阻止B细胞发育并增强微生物多样性。中国生物医学工程杂志,2017;29(4):529 - 529。https://doi.org/10.1189/jlb.1HI0216-062RR.
Lamas B, Richard ML, Leducq V, Pham HP, Michel ML, Da Costa G,等。CARD9通过改变肠道微生物群的色氨酸代谢为芳基烃受体配体来影响结肠炎。中国医学杂志,2016;22(6):598-605。https://doi.org/10.1038/nm.4102.
王刚,黄松,王勇,蔡松,于宏,刘宏,等。通过代谢物连接肠道免疫和肠道微生物群。中国生物医学工程学报,2019;26(4):379 - 379。https://doi.org/10.1007/s00018-019-03190-6.
梅蒂吉A, Omenetti S, Crotta S, Li Y, Nye E, Ross E,等。环境传感器AHR通过维持肠道干细胞稳态和屏障完整性来保护炎症损伤。免疫力。2018;(2):353。https://doi.org/10.1016/j.immuni.2018.07.010.
史伟强,傅军,常PV。微生物色氨酸代谢物通过芳香烃受体调节肠道屏障功能。美国国家科学研究院2020年。https://doi.org/10.1073/pnas.2000047117.
Krishnan S, Ding Y, Saedi N, Choi M, Sridharan GV, Sherr DH,等。肠道微生物来源的色氨酸代谢物调节肝细胞和巨噬细胞的炎症反应。Cell Rep. 2018;23(4): 1099-111。https://doi.org/10.1016/j.celrep.2018.03.109.
Hellack B, Hülser T, Izak E, Kuhlbusch T, Meyer F, Spree M,等。所有纳米gem材料的表征报告。2012.
Wohlleben W, Kuhlbusch TAJ, Schnekenburger J, Lehr C-M,编辑。纳米材料生命周期内的安全性:释放、暴露和对人体的危害。博卡拉顿:CRC出版社;2014.
韩克勒F, Tralau T, Tentschert J, Kneuer C, Haase A, Platzek T,等。化妆品中纳米材料的风险评估:欧盟的观点。中国药理学杂志,2012;86(11):1641-6。https://doi.org/10.1007/s00204-012-0944-x.
REACH, Anon: 2006年12月18日欧洲议会和理事会关于化学品注册、评估、授权和限制(REACH)的法规(EC) No 1907/2006,建立欧洲化学品管理局。编辑:UNION EPATCOTE2006。
Wohlleben W, Ma-Hock L, Boyko V, Cox G, Egenolf H, Freiberger H,等。REACH中的纳米特异性指导:15种材料的比较物理化学表征与方法相关性。硅酸盐学报。2013;4(2):93-104。https://doi.org/10.4416/Jcst2012-00045.
Landsiedel R, Sauer UG, Ma-Hock L, Schnekenburger J, Wiemann M.纳米材料的肺毒性:体外实验与体内吸入或灌注研究的关键比较。纳米(伦敦)。2014; 9(16): 2557 - 85。https://doi.org/10.2217/nnm.14.149.
E委员会,JR中心,保护IfHaC。REACH实施项目纳米材料物质鉴定(RIP-oN 1). 2011。http://ec.europa.eu/environment/chemicals/nanotech/pdf/report_ripon1.pdf.
van ravenzway B, Herold M, Kamp H, Kapp MD, Fabian E, Looser R,等。代谢组学:一种早期检测毒理学效应的工具,以及一个基于生物学的化学分组的机会——从QSAR到QBAR。兵工学报,2012;746(2):144-50。https://doi.org/10.1016/j.mrgentox.2012.01.006.
van ravenzway B, Sperber S, Lemke O, Fabian E, Faulhammer F, Kamp H,等。代谢组学作为解读工具:苯氧基除草剂的案例研究。Regul Toxicol Pharmacol. 2016; 81:288-304。https://doi.org/10.1016/j.yrtph.2016.09.013.
Andrews S. FastQC:高通量序列数据的质量控制工具。剑桥:Babraham生物信息学,Babraham研究所;2010.
Bolyen E, Rideout JR, Dillon MR, Bokulich NA, Abnet CC, al - ghalith GA,等。利用QIIME 2可重复、交互式、可扩展和可扩展的微生物组数据科学。中国生物工程学报。2019;37(8):852-7。https://doi.org/10.1038/s41587-019-0209-9.
杨晓明,杨晓明,杨晓明,杨晓明。基于Illumina扩增子数据的高分辨率样本推断。Nat Methods. 2016;13(7): 581-3。https://doi.org/10.1038/nmeth.3869.
Quast C, Pruesse E, Yilmaz P, Gerken J, Schweer T, Yarza P,等。SILVA核糖体RNA基因数据库项目:改进的数据处理和基于网络的工具。Nucleic Acids Res. 2013;41(数据库issue): D590-6。https://doi.org/10.1093/nar/gks1219.
Bokulich NA, Kaehler BD, Rideout JR, Dillon M, boolyen E, Knight R,等。利用QIIME 2的q2-feature-classifier插件优化标记基因扩增子序列的分类。微生物。2018;6(1):90。https://doi.org/10.1186/s40168-018-0470-z.
R核心团队。R:用于统计计算的语言和环境。维也纳:R统计计算基金会;2020.
确认
我们感谢A. Brock博士Á。Peña和C. Behr,感谢他们对准备手稿的帮助。
资金
由Projekt DEAL启动和组织的开放获取资金。这项工作得到了联邦德国教育和研究部BMBF(将nanoGEM和nanoGRAVUR授予RL和JS)和“巴斯夫关键技术能力建设替代毒理学方法”对BvR、RL、SSp和WW的部分支持。资助机构没有参与研究的设计、数据的收集、分析和解释,也没有参与手稿的撰写。
作者信息
作者及隶属关系
贡献
j.s.、R.v.B.和R.L.负责研究的概念和设计。W.W.制备并表征了纳米颗粒。r。b。负责动物实验。s。g。做了动物的临床病理。V.S.和S.S.进行代谢组学研究。D.H.对微生物组和代谢组数据进行了分析和解释。l.s., k.p., h.w., S.R.和D.H.进行了实验微生物组分析。s.r.、H.W.和U.D.对微生物组数据进行了统计分析。d.h., R.O.和J.S.准备了手稿。所有作者都阅读并批准了最终的手稿。
相应的作者
道德声明
伦理批准并同意参与
在该实验中进行所有动物实验的动物设施持有国际实验动物护理评估和认可协会(AAALAC)的证书。动物研究经当地监管机构批准进行,研究方案符合相关指南。
发表同意书
不适用。
相互竞争的利益
作者宣称他们之间没有利益冲突。
额外的信息
出版商的注意
伟德体育在线施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
补充信息
附加文件1
.灌胃给药25天后雄性Wistar大鼠肠道微生物组成的变化:在门和类的分类水平上,进一步分析0天未处理大鼠与25天灌胃给药对照组大鼠肠道微生物组成的差异。表S1:体重。表S2:血液学:红细胞和凝血参数。表S3:血液学:白细胞参数。表S4:血液样本中的临床化学。表S5:雄性Wistar大鼠粪便中细菌门的相对丰度(至少一组≥0.1%)。表S6:雄性Wistar大鼠粪便中细菌种类的相对丰度(至少一组≥0.1%)。表S7:雄性Wistar大鼠粪便中细菌门的相对丰度(至少一组≥0.1%)。表S8:雄性Wistar大鼠粪便中细菌种类的相对丰度(≥0.1%)。表S9:雄性Wistar大鼠粪便中细菌顺序的相对丰度(至少一组≥0.1%)。表S10:雄性Wistar大鼠粪便中细菌家族的相对丰度(至少一组≥0.1%)。表S11:雄性Wistar大鼠肠道菌群中细菌属的相对丰度(至少一组≥1%)。表S12:雄性Wistar大鼠肠道菌群中所选最丰富的细菌属(至少一组≥1%)相对丰度的单个样本和中值。表向:Ag NP或SiO2 NP治疗雄性Wistar大鼠28 d后血浆代谢物变化与不同抗生素治疗后变化的总体比较。表S14系列:测试物质的物理化学表征(改编自:Hellack等人,2012;Wohlleben等,2013[8,9])。表S15:Ag NP或SiO2 NP处理大鼠血浆代谢物途径的改变及其与肠道菌群的功能关系图S1:雄性Wistar大鼠暴露于交通工具、Ag NP (Ag50)或SiO2 NP (SiO2)之前(未经处理)和之后肠道微生物群的α多样性,以Shannon-Wiener指数(a)或Inverse Simpson指数(b)表示。图S2:以PCoA图显示肠道菌群的beta多样性。未处理的雄性Wistar大鼠样本(第0天)与灌胃25天后的相同动物相比(a),或灌胃25天后的雄性Wistar大鼠样本仅与灌胃25天后的灌胃处理、Ag NP和SiO2 NP进行比较(b)。图S3:雄性Wistar大鼠灌胃PBS + BSA 25天前(未处理)和灌胃25天后肠道菌群中细菌门(a)和类(b)的相对丰度(≥1%)。无花果。S4:在暴露于Ag或SiO2 NP(至少一组的中位相对丰度≥1%)后,所选最丰富的属获得的散点图。图S5:用于分析的所有动物的稀疏曲线(第0天未处理的大鼠样本;分别在第25天,Ag NP和sio2np处理的样品)。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条所提供的资料,除非在资料的信用额度中另有说明。
关于本文
引用本文
Landsiedel, R., Hahn, D., Ossig, R.et al。口服纳米颗粒后大鼠肠道微生物组和血浆代谢组的变化:可能的不良健康影响的敏感指标。部分纤维毒物19, 21(2022)。https://doi.org/10.1186/s12989-022-00459-w
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12989-022-00459-w
关键字
- 纳米材料
- 代谢组学
- 肠道微生物群
- 肠道微生物组
- 口服纳米颗粒给药
- 银纳米粒子
- SiO2纳米粒子