摘要
背景
几份报告显示,贝氏病进一步蔓延到以下国家Besnoitia besnoiti-受感染的牛群尚未被注意到。没有临床症状的感染牛可能是宿主。有必要对流行地区受影响的畜群或动物进行血清学分析,以确定亚临床或隐性感染并阻止传播到naïve动物或畜群。单屏AbELISABesnoitia besnoiti(BIO K 466)是基于先前发表的内部竞争性ELISA, b- celisa1,但具有不同的测试架构。本研究旨在使用先前评估Bb-cELISA1的血清来评估BIO K466是否显示相同的结果。此外,进一步分析特征明确的阳性和阴性样本,以估计诊断敏感性和特异性。
方法
第一组血清由总共305份牛血清组成,这些牛血清是从德国感染了牛血清的牛群中收集的b . besnoiti,Neospora caninum或肉孢子虫属血清已通过参考血清学试验(即免疫印迹、免疫荧光抗体试验和内部间接ELISA)进行了特征分析。第二组由200名确诊患者组成b . besnoiti-阳性的法国牛血清牛血清阴性(n= 624)起源于挪威和荷兰,这两个国家还没有牛贝氏病的报道。
结果
使用第一组血清,BIO K466显示出相对于参考血清学测试的估计诊断敏感性为97.9% (95% CI: 91.9%-99.6)和诊断特异性为99.5% (95% CI: 96.9%-100%)。结果的直接比较表明,内部Bb-cELISA1的结果与商业化版本的结果几乎完全一致(kappa 0.98;95% ci: 0.95-1)。使用来自法国的阳性牛血清和来自其他欧洲国家的阴性血清进行验证,诊断敏感性为97.5% (95% CI: 93.9%-99.1%),特异性为99.5% (95% CI: 98.5%-99.9%)。
结论
总之,BIO K 466似乎是诊断牛白菌病的合适工具,但需要进一步验证,特别是在其他血清学测试中出现不确定、疑似假阳性或阴性结果的情况下。
图形抽象

背景
牛牛皮癣病是养牛业的一个问题,在欧洲一些国家,包括法国、西班牙和意大利,这一问题日益重要。[1,2]以及比利时,那里最近报告了许多受感染的畜群病例[3.].牛牛皮癣是由Besnoitia besnoiti是一种单细胞原生动物,与其他寄生病原体密切相关,如刚地弓形虫,Neospora caninum而且肉孢子虫属食肉动物是其他寄生虫的最终宿主,它们能够通过粪便将抗环境的卵囊或孢子囊释放到环境中,与之相反,这种寄生虫的最终宿主仍然未知b . besnoiti[4].牛唯一确定的感染方式是水平通过叮咬和吸血昆虫,如虻和Stomoxysspp。5,6,7].昆虫能够通过水平机械传播传播感染,但很可能只能在很短的距离内传播[8].动物贸易和运输以及无意中将受感染动物纳入naïve畜群被认为是感染在区域内传播和跨越国家边界的主要方式[1,2]正如最近在专家启发式中提到的[9].
因此,在将动物纳入另一畜群之前对其进行血清学检测,可有效防止意外将受感染的动物重新装入naïve畜群[1,2].唯一的限制是,在急性感染期间,动物的血清学尚未呈阳性,但可能能够传播感染的窗口期很短[10,11].在感染的早期,临床症状可能会阻止动物的运输,但贝氏皮炎的症状并不总是严重到农民会注意到它们[8].
诊断特征上的血清学差异,特别是包括市售检测在内的血清学检测诊断特异性不足,可能导致不确定的结果或被怀疑为假阳性的结果[2,12,13].不确定的或被怀疑为假阳性的检测结果会造成额外的费用,因为动物的血清学状况需要使用非标准化的血清学检测来确定,例如免疫印迹(Western blot的血清学检测),通常只有在专门的实验室才能获得。此外,疑似病例可能只有在密集的临床检查以及通过分子分析来确认或放弃现有感染的假设后才能得到澄清。
为建立具有高诊断特异性的血清学测试,首个竞争性酶联免疫吸附试验(Bb-cELISA1)已确定[11].这项内部测试是基于小鼠单克隆抗体(Mab 1/24-9-1A4)识别的表位在表面b . besnoiti个速。该单抗也被用于建立一个商业cELISA, Monoscreen AbELISABesnoitia besnoiti(生物k 466)。虽然使用相同的单克隆抗体,但这种竞争性ELISA的原始内部版本和商业版本之间的测试设计有所不同。由于目前还没有关于这种新的商业测试的适用性的公开信息,本研究的目的是使用之前内部b- celisa1评估的血清来研究这种新测试是否显示相同的结果。此外,诊断特征通过另一组血清进行评估,包括来自受感染的法国牛的样本和来自其他欧洲国家的阴性牛的样本,这些国家未知有贝氏腺病病例。结果表明,新的测试具有较高的诊断敏感性和特异性。
方法
血清
为了进行这项评估,使用了两组牛血清。第一组由总共305份牛血清组成,取自感染了该病毒的两个德国牛群b . besnoiti,Neospora caninum或肉孢子虫属这些血清是用于验证内部b- celisa1的血清的一个子集[11].的b . besnoiti-阳性血清通过四项参考血清学试验(即两项免疫印迹试验、一项免疫荧光抗体试验[IFAT]和内部的BbAPureELISA)进行了表征。所选的阳性血清在至少两项参考试验中呈阳性,并在IFAT中代表不同的阳性水平(表2)1).
第二组由824份牛血清组成,其中200份为血清阳性b . besnoiti来自法国10个省(Ariège, Aude, Tarn, Aveyron, Lozère, Ardèche, Drôme, Isère, Haute-Savoie, Allier)的12个法国畜群。这些动物的免疫印迹检测呈阳性[14],由法国国家贝氏病参考实验室Maisons-Alfort提供,用于在法国正式验证该测试。其余624种血清被认为是可能的b . besnoiti阴性,并在挪威收集(n= 260)和荷兰(n= 364),该地区尚未报道牛贝氏菌病。
血清学测试
用于测定血清中抗血清阳性的试验b . besnoiti或n caninum(b . besnoiti: IFAT、速殖子免疫印迹、缓殖子免疫印迹[15, BbAPureELISA试剂盒[10], b- celisa1 [11];n caninum: p38 ELISA试剂盒;表格1)已在先前的研究中有所描述[11].正在验证的商业测试,单筛AbELISA Besnoitia besnoiti, BIO K 466 (BIO - x Diagnostics, Rochefort, Belgium)是基于先前报道的同一单克隆抗体(1/24-9-1A4),可以识别出该抗体表面的表位b . besnoiti速殖子,并用于建立内部Bb-cELISA,以前[11].简单地说,BIO K 466酶联免疫吸附试验板被一种裂解物包被b . besnoiti速殖子从细胞培养物中纯化,随后被阻断。
所有样品均严格按照制造商的说明使用BIO-X诊断试剂盒进行测试。在每个孔中加入50µl稀释溶液后,装入50µl血清样品,并在37°C下孵育2小时。洗涤(3 × 300 μ l,洗涤液)后,将100 μ l共轭溶液(即与过氧化物酶偶联的Mab 1/24-9-1A4)加入每孔并孵育(30分钟,37°C)。洗涤(3 × 300 μ l,洗涤液)后,加入100 μ l 3,3 ', 5,5 ' -四甲基联苯胺溶液,并通过每孔加入50 μ l停止溶液(1 M磷酸)来停止显色(21°C, 10分钟)。在加入停止溶液后5分钟内,用带450 nm滤光片的平板分光光度计读出光密度。每个板包含孔,阳性和阴性对照血清进行测试;对照血清结果用于验证(OD阴性血清- OD阳性血清> 0.700),并计算试验血清抑制单抗1/24-9-1A4过氧化物酶缀合物反应的百分比(抑制= (OD阴性对照血清- OD样品)/OD阴性对照血清)。如果样品的抑制作用为> 0.50,则认为样品为阳性2).
统计分析
R, 4.0.2版(R统计计算基础,维也纳,奥地利;http://www.R-project.org)和R包“最优”。切点”用于确定诊断敏感性和特异性,包括95%置信区间(95% CI)。在R中使用“lm”命令计算相关系数。Kappa值使用在线工具计算(http://vassarstats.net/kappa.html).使用R 4.0.2版本(包“ggplot2”和“scales”)组装图形。
结果与讨论
使用先前研究中的血清进行验证,以表征内部b- celisa1
使用之前建立的用于描述内部竞争ELISA b- celisa1的第一组血清,BIO K 466显示出97.9%的诊断敏感性(95% CI: 91.9% - 99.6%)和99.5%的诊断特异性(95% CI: 96.9% - 100%),相对于由以前发表的四个试验组成的参考,即使用两个免疫印迹试验b . besnoiti速殖子或缓殖子抗原[15],基于速殖子抗原的IFAT [15]和内部的BbAPureELISA [10]与内部的b- celisa1 [11](附加文件1:数据集S1)。
进一步的验证,使用来自法国的200份免疫印迹证实阳性的牛血清和来自其他欧洲国家的628份阴性血清,这些国家尚未报告牛白皮炎病例(附加文件)2:数据集S2),诊断敏感性为97.5% (95% CI: 93.9%-99.1%),特异性为99.5% (95% CI: 98.5%-99.9%)。
迄今为止,仅建立了基于总速殖子细胞裂解物、冻干速殖子或半纯化但仍然复杂的速殖子抗原(即富集诊断相关抗原的抗原)的间接ELISA试验。这还包括一些商业化的测试,目前还没有竞争性的ELISA可用于诊断贝氏病[2].对于这些间接ELISA检测,报道的中位诊断敏感性为92.2%(最低为75.5%,最高为100%),中位诊断特异性为97.3%(最低为93%,最高为100%),检索自先前回顾的出版物[2].用于验证各种间接ELISA检测特性的血清组往往不相同;此外,不同研究定义阳性的标准也不同。因此,不同组对这些elisa提供的诊断特征的估计是不能直接比较的。然而,在本研究中,与所使用的血清组无关,诊断敏感性和特异性的估计水平达到了超过先前报道的值。这表明,bioc466的诊断特征可能比至少一些间接的内部和商业更好b . besnoiti基于粗抗原或半纯化抗原的elisa。然而,由于本出版物的作者存在利益竞争,因此需要由其他人使用额外的参考血清组进行独立验证,并同时优化测试其他一些间接elisa。
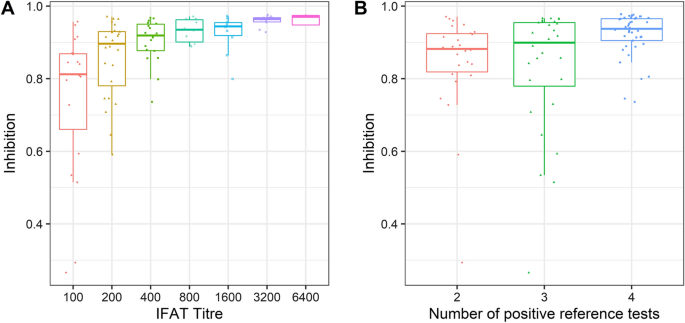
用来描述。的五种测试之一b . besnoiti本研究中使用的第一组血清(即四项参考试验和b- celisa1)的阳性为IFAT。IFAT滴度直接反映血清中抗体的浓度,特异性的表面b . besnoiti个速。在为本研究选择血清时,我们特别关注仅显示低IFAT滴度的血清(1:100,1:200),并在第一组中添加少量IFAT滴度高或非常高的血清。在IFAT滴度与BIO K 466中抑制值的比较中,所有IFAT滴度为1:200的血清和大多数(17/19)IFAT滴度为1:100的血清在竞争性ELISA中显示的抑制超过了0.50的截止值(图4)。1A).这一发现与之前的一项研究一致。15],这表明在IFAT滴度为1:100时,该测试的诊断特异性开始减弱,IFAT倾向于产生假阳性结果,至少在我们实验室的测试条件下是这样[15].
BIO k466中抑制的中值为b . besnoiti-阳性牛血清随着参考试验中单个血清获得阳性结果的数量而增加(图2)。1B). BIO K 466中仅有的两种假阴性血清仅在四种参考试验中的两种或三种中呈阳性(图。1B).此外,图的结果。1B表明,即使在并非所有参考试验都呈阳性的情况下,biok466对这些血清检测呈阳性也足够敏感。
单筛AbELISA的抑制关系Besnoitia besnoiti到内部Bb-cELISA1获得的
BIO K 466的结果与内部Bb-cELISA1的结果相关性良好,具有较高的相关性R2值为0.86(图;2).此外,两种试验应用的截线似乎非常相似,两种试验的正负检验结果基本一致(图2)。2),在总共305份血清中,只有5份显示出不同的结果。这五种血清中有两种参考阳性,在BIO K 466中检测为假阴性;一种参考阳性血清在BIO K 466中检测为正阳性,但在内部的Bb-cELISA1中为假阴性,一种参考阴性血清在BIO K 466中检测为假阳性,其余血清为参考阴性,但免疫荧光滴度为1:100,在BIO K 466中检测为正阴性,但在内部的Bb-cELISA1中为假阳性(图)。2).
总体而言,直接比较结果显示,内部Bb-cELISA1的结果与商业版本的结果几乎完全一致(kappa 0.98;95% ci: 0.95-1)。因此,可以得出结论,竞争性ELISA的商业版本和内部版本之间的测试设计存在差异,即使用粗b . besnoiti速殖子抗原代替半纯化抗原,单克隆抗体直接偶联到报告酶上,而不是使用二级抗小鼠偶联物[11],分别对在ELISA、商业和内部的Bb-ELISA1测试血清中观察到的抑制值只有边际影响(图2)。2).
结论
综上所述,商业版具有竞争力的ELISA检测b . besnoiti抗体似乎是诊断牛贝氏菌病的合适工具,但需要进一步验证,特别是在其他血清学测试结果不确定、疑似假阳性或阴性的情况下。此外,应考虑在其他动物物种(如驴)中使用的验证。
数据和材料的可用性
支持本文结论的数据包含在本文及其附加文件中。本研究中使用和分析的原始数据集可根据合理要求从通讯作者处获得。
缩写
- 置信区间:
-
置信区间
- ELISA:
-
酶联免疫吸附试验
- IFAT:
-
免疫荧光抗体试验
参考文献
Alvarez-Garcia G, Frey CF, Mora LM, Schares G.一个世纪的牛牛皮癣病:一种在欧洲重新出现的未知疾病。寄生虫学杂志,2013;29:407-15。
Gutierrez-Exposito D, Ferre I, Ortega-Mora LM, Alvarez-Garcia G.牛牛皮癣病诊断的进展:当前的选择和控制应用。国际寄生虫学杂志,2017;47:37 - 51。
李国强,李国强,李国强Besnoitia besnoiti在比利时。病原体。2021;10:1。
Basso W, Schares G, golnick NS, Rutten M, deazes pBesnoitia besnoiti-实验性感染推定的最终和中间宿主物种。兽医寄生虫,2011;178:223-34。
沙里夫S, Jacquiet P, Prevot F, Grisez C, Bouhsira E, Franc M,等。持续性评估Besnoitia besnoiti(Henry, 1913)赤纹斑蝽中的缓缓子(双翅目:蝇科)。图卢兹兽医。2017; 168:197 - 203。
Lienard E, Salem A, Jacquiet P, Grisez C, Prevot F, Blanchard B,等。的能力测试协议的开发Stomoxys calcitrans(林奈,1758)(双翅目:蝇科)传播Besnoitia besnoiti(Henry, 1913)(尖状复合体:肉囊杆菌科)。寄生虫,2013;112:479-86。
实验室和现场调查确定的牛贝氏菌病流行病学特征的新概念。Onderstepoort J兽医决议1968;35:3-137。
golnick NS, Scharr JC, Schares G, Langenmayer MC.天然Besnoitia besnoiti牛的感染:疾病进展的年代学。BMC Vet Res. 2015;11:35。
张志刚,张志刚,张志刚,张志刚,等。专家首次对欧洲牛牛皮癣病出现的驱动因素进行了知识启发。病原体。2022;第十一章。
沙瑞思G, Langenmayer MC, Scharr JC, Minke L, Maksimov P, Maksimov A,等。诊断和鉴别急性和慢性牛贝氏菌病的新工具。中国寄生虫学杂志,2013;43(3):344 - 344。
Schares G, Nascimento D, Bärwald A, Jutras C, Rivard S, Brodeur V,等。首个高灵敏度和特异性的竞争性酶联免疫吸附试验用于检测牛白杆菌病,具有作为多物种试验的潜力。国际寄生虫学杂志。2020;50:389-401。
Gazzonis AL, Alvarez Garcia G, Zanzani SA, Garippa G, Rossi L, Maggiora M,等。Besnoitia besnoiti在意大利岛屿和西北部的牛中:地方性感染还是孤立爆发?寄生虫载体。2014;7:585。
Garcia-Lunar P, Ortega-Mora LM, Schares G, Gollnick NS, Jacquiet P, Grisez C,等。血清学工具用于诊断的实验室间比较研究Besnoitia besnoiti牛的感染。跨界新兴,2013;60:59-68。
Lienard E, Salem A, Grisez C, Prevot F, Bergeaud JP, Franc M,等。纵向研究Besnoitia besnoiti感染和季节性丰富Stomoxys calcitrans在法国西南部的一个奶牛场。兽医寄生虫,2011;177:20-7。
Schares G, Basso W, Majzoub M, Rostaher A, Scharr JC, Langenmayer MC,等。比较评价免疫荧光抗体和新的免疫印迹试验的特异性检测抗体Besnoitia besnoiti牛血清中的速殖子和缓殖子。兽医寄生虫,2010;171:32-40。
确认
我们感谢Lilo Minke提供的出色技术援助。
资金
由Projekt DEAL启动和组织的开放获取资金。没有收到外部资金。
作者信息
作者及隶属关系
贡献
GS和PC设计了这项研究。PC、MAV、FB、BB和GS采集数据。AB、PC、MAV和GS对样品进行了实验分析。PC、MAV和GS对数据进行了分析。PC、MAV、FB、BB和GS对数据进行解释。GS、MAV、FB、BB、PC对稿件的撰写做出了重要贡献。所有作者都阅读并批准了最终的手稿。
相应的作者
道德声明
伦理批准并同意参与
没有要申报的。
发表同意书
不适用。
相互竞争的利益
作者声明了相互竞争的利益。MAV, FB, BB和PC是Bio-X Diagnostics s.a.的员工,Rue de la Calestienne, 38,5580 Rochefort, Belgium。AB和GS从Bio-X diagnostics S.A.获得版税
额外的信息
出版商的注意
伟德体育在线施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
补充信息
附加文件1:数据集S1。
本研究选用的牛血清的详细特征来自以前用于验证内部b- celisa的血清组
附加文件2:数据集S2。
一组来自法国、荷兰和挪威的牛血清的详细特征,即用于法国BIO K 466官方验证的一组血清。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条所提供的资料,除非在资料的信用额度中另有说明。
关于本文
引用本文
Schares, G., Bärwald, A., Vernet, MA。et al。一种竞争性酶联免疫吸附试验的商业版本的验证,用于检测抗体Besnoitia besnoiti.寄生虫向量15, 455(2022)。https://doi.org/10.1186/s13071-022-05591-2
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s13071-022-05591-2
关键字
- 牛besnoitiosis
- cELISA
- 大
- 抑制ELISA
- 血清学试验