- 研究gydF4y2Ba
- 开放获取gydF4y2Ba
- 发表:gydF4y2Ba
焦annulatagydF4y2BaSVSP455与宿主HSP60相互作用gydF4y2Ba
寄生虫和病媒gydF4y2Ba体积gydF4y2Ba15gydF4y2Ba,文章号:gydF4y2Ba308gydF4y2Ba(gydF4y2Ba2022gydF4y2Ba)gydF4y2Ba
摘要gydF4y2Ba
背景gydF4y2Ba
焦annulatagydF4y2Ba它是一种转化寄生虫,侵入牛B细胞、树突状细胞和巨噬细胞,促进这些细胞不受控制地增殖。这种原生动物进化出复杂的策略来破坏与抗凋亡信号通路相关的宿主细胞信号通路,以使宿主细胞内的生存和增殖。然而,分子机制诱导的细胞转化gydF4y2Bat . annulatagydF4y2Ba仍不清楚。虽然一些研究预测,亚端粒编码可变分泌蛋白(SVSP)家族在宿主-寄生虫相互作用中发挥作用,但这方面的证据有限。gydF4y2Ba
方法gydF4y2Ba
在本研究中,SVSP455 (gydF4y2BaTA05545gydF4y2Ba)基因为目的分子,该基因属于SVSP基因家族。SVSP455在植物不同生命周期阶段的表达谱gydF4y2Bat . annulatagydF4y2Ba采用实时荧光定量PCR检测感染,共聚焦显微镜观察SVSP455的亚细胞分布。使用Y2H系统筛选与SVSP455相互作用的宿主细胞蛋白,并通过双分子荧光互补和共聚焦显微镜以及免疫共沉淀实验在体内和体外验证了它们的相互作用。通过过表达、RNA干扰和药物处理实验进一步探讨SVSP455在细胞转化中的作用。gydF4y2Ba
结果gydF4y2Ba
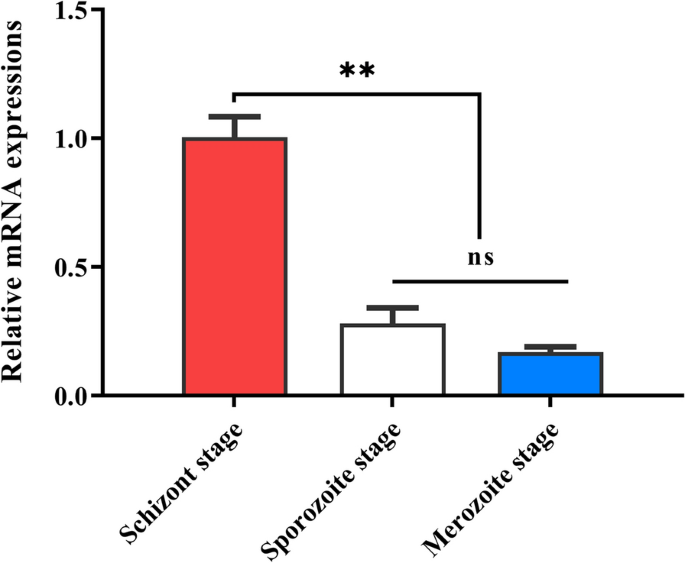
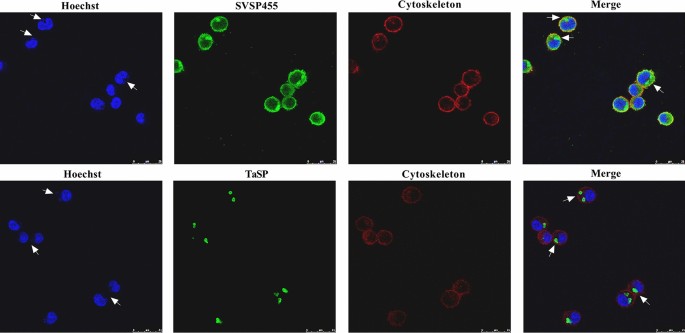
SVSP455转录本最高水平出现在小鼠分裂期gydF4y2Bat . annulatagydF4y2Ba该蛋白位于分裂体表面和宿主细胞质中。此外,体外实验还发现SVSP455与热休克蛋白60之间存在相互作用,它们之间的联系可能调控宿主细胞凋亡gydF4y2Bat . annulatagydF4y2Ba来华的细胞。gydF4y2Ba
结论gydF4y2Ba
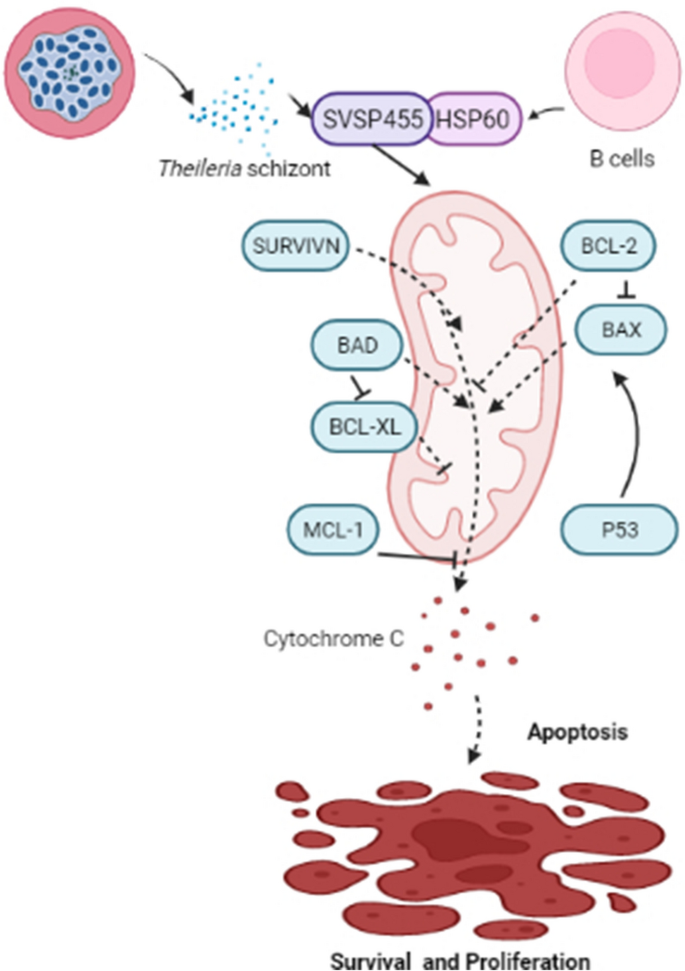
我们的研究结果首次揭示了这一点gydF4y2Bat . annulatagydF4y2BaSVSP455分子直接与外源性和内源性牛HSP60蛋白相互作用,SVSP455-HSP60的相互作用可能操纵宿主细胞凋亡信号通路。这些结果提供了对潜在的癌症样表型的见解gydF4y2BaTheileragydF4y2Ba转化和治疗对其他病原体的保护。gydF4y2Ba
图形抽象gydF4y2Ba
背景gydF4y2Ba
焦annulatagydF4y2Ba是引起牛热带灰虱病的病原体,可导致牛的急性淋巴增生性疾病,其临床特征与人类白血病有许多相同之处[gydF4y2Ba1gydF4y2Ba].该病对非洲、欧洲、地中海盆地、中东和亚洲等亚热带和热带国家的牛构成重大威胁[gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba4gydF4y2Ba,gydF4y2Ba5gydF4y2Ba,gydF4y2Ba6gydF4y2Ba,gydF4y2Ba7gydF4y2Ba,gydF4y2Ba8gydF4y2Ba].热带theilerosis也会给畜牧业造成重大经济损失,因为它会导致易感动物的死亡[gydF4y2Ba9gydF4y2Ba,gydF4y2Ba10gydF4y2Ba]以及购买抗蜱虫药物和治疗的高昂成本[gydF4y2Ba11gydF4y2Ba].与其他尖复体寄生虫不同,gydF4y2Bat . annulatagydF4y2Ba而且gydF4y2Ba焦parvagydF4y2Ba感染牛白细胞并诱导宿主细胞转化[gydF4y2Ba12gydF4y2Ba,gydF4y2Ba13gydF4y2Ba],但这两种寄生虫的细胞取向是不同的。具体地说,gydF4y2Bat . parvagydF4y2Ba侵袭宿主T淋巴细胞和B淋巴细胞gydF4y2Bat . annulatagydF4y2Ba转化牛树突状细胞、B细胞和巨噬细胞[gydF4y2Ba14gydF4y2Ba,gydF4y2Ba15gydF4y2Ba].虽然这两种转化物种都感染宿主B细胞,但研究人员尚未阐明这两种物种的转化机制是否相同。更重要的是,表型gydF4y2Ba焦gydF4y2Ba-转化细胞与癌细胞的某些特征相同,包括不受控制的增殖、增加的侵袭性和转移以及抑制细胞死亡[gydF4y2Ba1gydF4y2Ba,gydF4y2Ba16gydF4y2Ba].特别有趣的是,gydF4y2Bat . annulata -gydF4y2Ba体外抗寄生虫药物布帕伐醌(Bup)处理后,转化细胞失去了它们的癌样表型,并抑制了凋亡敏感性[gydF4y2Ba1gydF4y2Ba,gydF4y2Ba11gydF4y2Ba].gydF4y2Ba
在gydF4y2Ba焦gydF4y2Ba-诱导转化后,几种宿主细胞信号通路被激活,参与控制寄生虫的增殖和存活,包括NF-kB、c-Jun n -末端激酶(JNK)和c-Myc信号通路[gydF4y2Ba1gydF4y2Ba,gydF4y2Ba17gydF4y2Ba,gydF4y2Ba18gydF4y2Ba,gydF4y2Ba19gydF4y2Ba],但确切的机制尚不清楚。几十年的研究已经确定了许多有助于转化的寄生虫蛋白质,包括TaPIN1 [gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba21gydF4y2Ba], TaSP [gydF4y2Ba22gydF4y2Ba,gydF4y2Ba23gydF4y2Ba]和Ta-p104 [gydF4y2Ba24gydF4y2Ba].然而,在转化过程中起关键作用的分子尚不清楚。亚端粒编码可变分泌蛋白(SVSP)家族是世界上最大的多基因家族gydF4y2Bat . annulatagydF4y2Ba而且gydF4y2Bat . parvagydF4y2Ba基因组和具有独特的基因特征,包括非典型密码子使用,长度多样性和高水平的插入和删除[gydF4y2Ba25gydF4y2Ba].基于先前的证据,SVSP家族可能在宿主细胞的免疫逃避和转化中发挥重要作用[gydF4y2Ba1gydF4y2Ba,gydF4y2Ba25gydF4y2Ba,gydF4y2Ba26gydF4y2Ba,gydF4y2Ba27gydF4y2Ba],但SVSP分子启动宿主细胞信号“中枢”导致癌症样表型的机制仍然未知。gydF4y2Ba
因此,阐明SVSP家族成员在寄生虫-宿主相互作用中的作用将提供一个新的探索机会gydF4y2Ba焦gydF4y2Ba诱导细胞转化。在本研究中,SVSP455是SVSP多基因家族的成员gydF4y2Bat . annulatagydF4y2Ba被证实与牛热休克蛋白60 (HSP60)蛋白直接相互作用并改变宿主细胞线粒体凋亡通路。gydF4y2Ba
方法gydF4y2Ba
细胞培养gydF4y2Ba
HEK293T - - -gydF4y2Bat . annulatagydF4y2Ba分裂感染细胞由中国兰州兽医研究所(LVRI)媒介和媒介传播疾病小组提供。HEK293T细胞在Dulbecco's Modified Eagle培养基(Gibco™,Thermo Fisher Scientific, Waltham, MA, USA)中培养,添加10%胎牛血清(FBS) (Gibco™,Thermo Fisher Scientific), 37℃,存在5% COgydF4y2Ba2gydF4y2Ba.gydF4y2Ba焦annulatagydF4y2Ba感染细胞保存在含有10%胎牛血清的RPMI 1640培养基(以色列Kibbutz Beit Haemek的生物工业公司)中。gydF4y2Ba
实时定量PCRgydF4y2Ba
提取总RNAgydF4y2Bat . annulatagydF4y2Ba使用RNeasy Mini Kit (QIAGEN, Hilden, Germany)根据用户手册对三个生命周期阶段(裂殖体、子殖子和裂殖子)进行检测。互补DNA (cDNA)模板然后使用PrimeScript™RT Reagent Kit与gDNA Eraser (Perfect Real Time;TaKaRa, Bio Inc., Kusatsu, Shi, Japan)对RNA的浓度和质量进行评估。根据NCBI数据库的序列,设计了目的基因的特异性引物。β-肌动蛋白转录本水平gydF4y2Bat . annulatagydF4y2Ba牛细胞被用于标准化。本研究中使用的引物序列均见附加文件gydF4y2Ba1gydF4y2Ba:表S1。实时定量PCR检测在Stratagene MX3005P热循环仪(安捷伦科技,Santa Clara, CA, USA)中进行,并使用TB Green®Premix Ex Taq™试剂盒(Tli RNaseH Plus;TaKaRa Bio Inc.)根据用户手册。利用比较周期阈值计算靶基因的相对转录水平(2gydF4y2Ba−ΔΔgydF4y2BaCTgydF4y2Ba)方法。gydF4y2Ba
Western blotting分析gydF4y2Ba
细胞用RIPA裂解缓冲液裂解(Boster Bio, Pleasanton, CA, USA;#AR0102)含有蛋白酶抑制剂(Roche, Basel, Switzerland;#4693132001)和磷酸酶抑制剂鸡尾酒(罗氏,巴塞尔,瑞士,#4906845001)在冰上30分钟。然后通过15,000离心收集细胞上清液gydF4y2BaggydF4y2Ba在4°C下加热15分钟,使用Pierce™BCA蛋白检测试剂盒(赛默飞世尔科学公司;# 23225)。蛋白质样品在十二烷基硫酸钠-聚丙烯酰胺电泳凝胶中分离,并转移到PVDF膜(MilliporeSigma, Burlington, MA, USA)。首先用阻断缓冲液(tris缓冲盐水,pH 7.4,含0.05% Tween-20和5%牛血清白蛋白[BSA])在RT下阻断细胞膜2小时,然后在4℃下与相关一抗孵育过夜。用马萝卜过氧化物酶(HRP)偶联抗兔或抗小鼠二抗孵育(Abcam,剑桥,英国;#ab6721或#ab6789)在室温(RT)下进行1 h。使用SuperSignal™West Pico PLUS化学发光衬底(Thermo Fisher Scientific;# 34577)。gydF4y2Ba
SVSP455蛋白的亚细胞定位gydF4y2Bat . annulatagydF4y2Ba来华的细胞gydF4y2Ba
SVSP455蛋白编码序列(CDS)由gydF4y2Ba焦annulatagydF4y2Ba采用PCR法检测SVSP455基因序列,信息学分析SVSP455基因序列。以SVSP455残基21 ~ 421氨基酸为目标序列,制备SVSP455抗体。经测序和酶切鉴定,成功获得重组表达质粒SVSP455-pET30a。重组蛋白SVSP455表达于gydF4y2Ba大肠杆菌gydF4y2Ba经Ni-NTA琼脂糖纯化。在确定纯化蛋白的浓度和反应性后,用200 mg蛋白免疫家兔,每隔14天注射3次。收集来自兔免疫的SVSP455蛋白血清,使用NAb™protein A/G Spin Kit (Thermo Fisher Scientific;# 89980)。阳性对照为TaSP抗体。SVSP455的亚细胞分布gydF4y2Bat . annulatagydF4y2Ba-感染细胞用共聚焦显微镜检测。简而言之,对于共聚焦显微镜实验,gydF4y2Bat . annulatagydF4y2Ba以3.0 × 10的初始密度将感染细胞接种到12孔细胞培养板的载玻片上gydF4y2Ba6gydF4y2Ba细胞/ml, 37°C和5% CO孵育gydF4y2Ba2gydF4y2Ba然后用4%多聚甲醛在RT下固定细胞30分钟,用磷酸盐缓冲盐水(PBS)洗涤,用0.5% Triton X-100在PBS中渗透15分钟。PBS洗涤三次后,用3% BSA在RT下阻塞细胞1小时,然后用抗svsp455抗体在含3% BSA的PBS中以1:100稀释,4℃孵育过夜。接下来,500 μl驴抗兔二抗偶联Alexa Fluor 488 (Life Technologies, Thermo Fisher Scientific;加入#A21206), rt培养37°C。最后,用Hoechst 33342和Alexa Fluro™594偶联phalloidin (Life Technologies, Thermo Fisher Scientific;#H3570和#A13281)。使用共聚焦显微镜(TCA;徕卡Microsystems, Wetzlar, Germany), 63×油物镜,并使用每个样品中最具代表性的图像进行演示。gydF4y2Ba
饵质粒的构建及生物信息学分析gydF4y2Ba
从植物的cDNA中扩增出SVSP455片段gydF4y2Bat . annulatagydF4y2Ba根据参考序列(Accession No: XM_950455.1 or piroplasdb: TA05545)设计特异性引物进行PCR扩增。用于检测SVSP455的引物序列为SVSP455- f (5 ' -CCG)gydF4y2BaATTCgydF4y2Ba3 ')和SVPS455-R (5 ' - TGCAgydF4y2BaCTGCAGgydF4y2BaTGCATGTTTTATAGGTCGCTTTAAT-3”);下划线序列表示限制性内切酶位点(EcoRI和PstI)。PCR产物使用Cycle-Pure试剂盒(OME Bio-Tek, Norcross, GA, USA)进行纯化。pGBKT7载体和SVSP455 PCR纯化产物均经酶切gydF4y2Ba生态gydF4y2Ba国际扶轮和gydF4y2Ba太平洋标准时间gydF4y2Ba赛默飞世尔科技公司;#FD0274和#FD0614),然后用T4 DNA连接酶将载体和SVSP455的消化产物连接(New England Biolabs, Ipswich, MA, USA;#M0202S)根据制造商的说明。最后对重组饵质粒SVSP455-pGBKT7进行测序(生工生物科技,上海,中国)。gydF4y2Ba
饵质粒的自动激活和毒性评估gydF4y2Ba
空pGBKT7质粒和构建的诱饵质粒使用Quick & Easy酵母转化混合物(Clontech实验室,Mountain View, CA, USA)转化为Y2H Gold活性细胞。然后将转化体在含有SDO、SDO/X和SDO/X/A(琼脂板描述见缩写列表)的琼脂糖板上孵育3-5天,温度为30°C。当在SDO和SDO/X琼脂板上生长的菌落呈白色或淡色时,诱饵质粒没有自动激活。在SDO/X/ ar板块上没有菌落生长。此外,如果在SDO和SDO/X ar板上培养的SVSP455-pGBKT7菌落的大小明显小于用pGBKT7质粒转化的菌落,则认为SVSP455-pGBKT7具有毒性。用于筛选相互作用蛋白的酵母双杂交(Y2H)系统只能在诱饵质粒既不自动激活也不有毒的情况下使用。gydF4y2Ba
Y2H筛选gydF4y2Ba
采用Y2H筛选法确定与SVSP455相互作用的宿主细胞蛋白。首先,重组SVSP455-pGBKT7质粒和猎物质粒(牛B细胞cDNA文库)[gydF4y2Ba28gydF4y2Ba]根据制造商的建议,使用Yeastmaker™酵母转化系统2 (Clontech实验室)共同转化为Y2H Gold活性细胞。将转化后的感受细胞在30℃的DDO/X/A ar平板上培养3-5天,从DDO/X/A ar平板上摘下蓝色菌落,在30℃的QDO/X/A琼脂平板上再培养3-5天。最后,将蓝色菌落再次镀在QDO/X/A琼脂板上,以减少假阳性克隆的数量(ar板的描述见缩写列表)。同时将阴性对照(pDT7-T和pGBKT7-Lam质粒)和阳性对照(pDT7-T和pGBKT7-53质粒)共同转化为Y2H Gold感受态细胞,在DDO和DDO/X/A琼脂板上30℃培养3-5天。gydF4y2Ba
猎物质粒的抢救与分析gydF4y2Ba
使用Matchmaker™Insert Check PCR Mix (Clontech Laboratories)初步检测QDO/X/A琼脂板上生长的蓝色菌落。然后使用Easy酵母质粒分离试剂盒(Clontech实验室)从确定的蓝色菌落中分离出潜在的猎物质粒。从酵母细胞中提取3 μl的猎物质粒转化为感受态细胞(gydF4y2Ba大肠杆菌gydF4y2BaDH5α)用于质粒抢救和测序。基因片段用美国国家生物技术信息中心(NCBI)的BLAST分析,以确定宿主基因。利用UniProt数据库(gydF4y2Bahttp://www.uniprot.org/gydF4y2Ba)和SMART服务器(gydF4y2Bahttp://smart.embl-heidelberg.de/gydF4y2Ba).gydF4y2Ba
SVSP455及其猎物蛋白的表达及亚细胞共定位分析gydF4y2Ba
将SVSP455-Myc克隆到pcDNA3.1载体上,构建重组质粒pcDNA3.1-SVSP455-MycgydF4y2BaBamgydF4y2Ba你好/gydF4y2BaXhogydF4y2Ba我消化(赛默飞世尔科技;#FD0054和#FD0694)。将猎物基因片段克隆到p3×Flag-CMV载体上,构建p3×Flag-CMV-prey基因重组质粒gydF4y2Ba欣gydF4y2BadIII /gydF4y2BaXbagydF4y2BaI网站(赛默飞世尔科学公司;#FD0504和#FD0684)。用共聚焦显微镜检测SVSP455及其相互作用蛋白的表达和亚细胞定位。HEK293T细胞在6孔培养板上以5 × 10的初始密度在玻片上培养gydF4y2Ba5gydF4y2Ba随后,使用Lipofectamine™3000转染试剂将构建的携带SVSP455及其猎物基因的质粒转染或共转染到细胞中(Thermo Fisher Scientific;#L3000015)当细胞合流率达到70-90%时。转染24小时后,按照上述步骤对载玻片上的细胞进行清洗、固定、渗透和阻滞。然后用兔抗myc标签单克隆抗体(mAb)对细胞进行染色(Cell Signaling Technology, Danvers, MA, USA;#2278S)或来源于小鼠的抗国旗标签单抗(Sigma-Aldrich,圣路易斯,密苏里州,美国;#F1804)在4°C过夜。细胞用PBS洗涤三次后,用Alexa Fluor 594偶联驴抗兔或Alexa Fluor 488偶联山羊抗小鼠二抗(Life Technologies, Thermo Fisher Scientific;#A21207和#A11029),在含有3% BSA的PBS中稀释1:1000,RT下1小时。Hoechst 33342 (Life Technologies, Thermo Fisher Scientific;用#H3570)标记细胞核,然后用PBS冲洗五次。共聚焦显微镜(TCS; Leica Microsystems) was used to visualize the fluorescence with a 63× oil objective.
Co-immunoprecipitation化验gydF4y2Ba
进行免疫共沉淀(Co-IP)试验,以确定SVSP455是否与所识别的猎物蛋白结合。首先,2 × 10gydF4y2Ba6gydF4y2Ba每盘HEK293T细胞接种到直径10 cm的细胞培养皿中。pcDNA3.1-SVSP455-Myc重组质粒(10µg)和p3×Flag-CMV-prey质粒(10µg)在细胞融合率为70-90%时共转染细胞。培养48 h后,收集细胞,PB洗涤,600 μl含磷酸酶抑制剂的IP/Lysis buffer裂解(Roche;#4906845001)和蛋白酶抑制剂(Roche;#4693132001)在冰上放置30分钟。细胞裂解液在16000离心gydF4y2BaggydF4y2Ba在4°C下培养10分钟,收集上清用于Co-IP实验,该实验使用Pierce™Co-Immunoprecipitation Kit(赛默飞世尔科学公司;# 26149)。同时将空质粒(pcDNA3.1和p3×FLAG-CMV)共转染HEK293T细胞,作为阴性对照。Co-IP洗脱后的样品用于western blotting。目的蛋白检测采用兔抗myc标签抗体和抗flag标签抗体。gydF4y2Ba
双分子荧光互补法gydF4y2Ba
采用双分子荧光互补法(BiFC)研究SVSP455与其猎物蛋白在细胞中的相互作用[gydF4y2Ba29gydF4y2Ba].SVSP455及其潜在猎物基因在HindIII/SalI位点克隆到pifc - vn173载体(Thermo Fisher Scientific;#FD0504和#FD0644)。同时,将目标片段克隆到pifc - vc155载体上,用酶切酶切,构建pifc - vc155 -prey基因重组质粒(pifc - vc155 - svsp455和pifc - vc155 -prey基因)gydF4y2Ba萨尔gydF4y2Ba我/gydF4y2BaKpngydF4y2Ba赛默飞世尔科技公司;#FD0644和#FD0524)。将pifc - vc155 - svsp455 / pifc - vn173 -prey基因对和pifc - vc155 -prey基因/ pifc - vn173 - svsp455共转染HEK293T细胞。未转染的细胞作为对照。转染24 h后,用共聚焦显微镜观察到BiFC的绿色信号及其与SVSP455及其猎物蛋白的相互作用。在共聚焦实验中,HEK293T细胞用兔抗ha标记mAb (Cell Signaling Technology;#3724S)或小鼠抗旗帜标签单抗(Sigma-Aldrich;#F1804),然后在4°C过夜固定,渗透和阻塞细胞。然后用1µg/ml驴抗兔IgG (H + L)抗体标记细胞,该抗体偶联Alexa Fluor®594 (Life Technologies, Thermo Fisher Scientific;#A21207)或Alexa Fluor®594偶联山羊抗小鼠抗体(Life Technologies, Thermo Fisher Scientific; #A11005) at RT for 1 h followed by three washes with PBS. The nuclei were stained with Hoechst 33342 (Life Technologies, Thermo Fisher Scientific; #H3570).
流式细胞术gydF4y2Ba
HEK293T细胞在6孔细胞培养板中培养,初始密度为5 × 10gydF4y2Ba5gydF4y2Ba细胞/毫升。将构建的BiFC质粒pifc - vc155 - svsp455、pifc - vn173 -prey基因、pifc - vc155 -prey基因和pifc - vn173 - svsp455分别转染到细胞中。将pifc - vc155 - svsp455 / pifc - vn173 -prey基因和pifc - vc155 -prey基因/ pifc - vn173 - svsp455对共转染到细胞中。转染48 h后,用胰蛋白酶- edta (0.25%;然后在冷PBS中重悬细胞,使用Accuri™C6 Plus流式细胞仪(BD, Franklin Lakes, NJ, USA)测定转染细胞的平均荧光强度(MFI)。gydF4y2Ba
SVSP455及其相互作用蛋白的亚细胞共定位分析gydF4y2Bat . annulatagydF4y2Ba来华的细胞gydF4y2Ba
用共聚焦显微镜进一步鉴定了原生SVSP455与其猎物蛋白之间的相互作用gydF4y2Bat . annulatagydF4y2Ba来华的细胞。利用NAb™Protein A/G Spin Kit(赛默飞世尔科学公司;#89980)(数据未显示)。对于共焦实验,gydF4y2Bat . annulatagydF4y2Ba感染细胞在12孔细胞培养板的玻片上培养,初始密度为5 × 10gydF4y2Ba5gydF4y2Ba细胞/毫升。培养24 h后,用兔抗svsp455多克隆抗体和小鼠抗捕食蛋白在4℃1:200稀释过夜,固定、通透、阻滞。细胞用Alexa Fluor®594偶联驴抗兔二抗(Life Technologies, Thermo Fisher Scientific;#A21207)和Alexa Fluor®488标记山羊抗小鼠(Life Technologies, Thermo Fisher Scientific;#A11029)二抗,RT下1小时。PBS冲洗五次后,Hoechst 33342按1:2000稀释(Life Technologies, Thermo Fisher Scientific;#H3570)染色,rt孵育15分钟。图像使用共聚焦显微镜(TCS;徕卡微系统),63×油物镜。gydF4y2Ba
转染的gydF4y2Bat . annulatagydF4y2Ba来华的细胞gydF4y2Ba
的gydF4y2Bat . annulatagydF4y2Ba-感染细胞在25厘米内培养gydF4y2Ba2gydF4y2Ba-细胞培养瓶,初始密度0.5 × 10gydF4y2Ba6gydF4y2Ba细胞/毫升。转染重组质粒pcdna3.1 - svsp455 - myc(5µg)gydF4y2Bat . annulatagydF4y2Ba使用Amaxa®人t细胞核载体®试剂盒(Lonza Group AG,巴塞尔,瑞士;#VPA-1002)和Nucleofector®程序V-024(龙沙集团AG),根据制造商的说明。然后用抗寄生虫药buparvaquone (Bup)处理转染细胞(MedChemExpress, Monmouth Junction, NJ, USA;#HY-17581)在200 ng/ml浓度下转染48 h,同时以未转染的细胞和经Bup处理的细胞作为对照。然后收集细胞样本,用qPCR和western blotting鉴定目标分子。的gydF4y2Bat . annulatagydF4y2Ba-感染细胞也转染200 nM短干扰RNA (siRNA)对抗猎物基因(附加文件)gydF4y2Ba2gydF4y2Ba:表S2)。转染48 h后,用qPCR和western blotting检测细胞相关分子的表达变化。gydF4y2Ba
数据及统计分析gydF4y2Ba
使用GraphPad PRISM 9软件包(GraphPad software Inc., San Diego, CA, USA)进行统计分析。在所有数据中,使用非配对双尾学生t检验来确定组间差异的显著性。通过计算均值的标准误差来估计各组的方差。实验独立重复至少3次,各图均有代表性结果。gydF4y2Ba
结果gydF4y2Ba
SVSP455的表达模式gydF4y2Bat . annulatagydF4y2Ba来华的细胞gydF4y2Ba
根据qPCR结果(图;gydF4y2Ba1gydF4y2Ba), SVSP455 mRNA主要表达于gydF4y2Bat . annulatagydF4y2Ba裂裂期,与以往研究结果一致[gydF4y2Ba30.gydF4y2Ba,gydF4y2Ba31gydF4y2Ba].gydF4y2Ba
SVSP455的亚细胞定位gydF4y2Bat . annulatagydF4y2Baschizont-infected细胞gydF4y2Ba
共聚焦显微镜结果显示,SVSP455主要分布在细胞表面gydF4y2Bat . annulatagydF4y2Ba的分裂体和细胞质中的gydF4y2Bat . annulatagydF4y2Ba-感染细胞(图;gydF4y2Ba2gydF4y2Ba).gydF4y2Ba
饵质粒的生物信息学鉴定gydF4y2Ba
从植物的互补DNA (cDNA)中成功扩增出SVSP455基因片段gydF4y2Bat . annulatagydF4y2Ba测序后构建重组饵质粒SVSP455-pGBKT7。SVSP455的CDS区为1263 bp,编码421个氨基酸(aa),预测分子量为49 kDa。而内参基因的CDS为1293 bp,编码431 aa。扩增的SVSP455序列与内参基因的核苷酸序列和氨基酸序列的同源性分别为93.9%和90.1%。如图所示。gydF4y2Ba3.gydF4y2Ba根据SignalP-5.0的预测,SVSP455包含一个从氨基酸1到20的信号肽,但没有假定的糖基磷脂酰肌醇(GPI)锚点、核定位信号序列(nss)或跨膜结构域。gydF4y2Bahttp://www.cbs.dtu.dk/services/SignalP-5.0/gydF4y2Ba), PredGPI服务器(gydF4y2Bahttp://gpcr.biocomp.unibo.it/predgpi/pred.htmgydF4y2Ba)、NLStradamus (gydF4y2Bahttp://www.moseslab.csb.utoronto.ca/NLStradamus/gydF4y2Ba)和TMHMM服务器(gydF4y2Bahttp://www.cbs.dtu.dk/services/TMHMM/gydF4y2Ba).此外,根据SMART服务器分析,SVSP455蛋白预计含有一个范围为193至210 aa的Tash-PEST基序,一个范围为232至310个残基的内部重复1 (RPT1)结构域和一个范围为331至416 aa的FAINT结构域(gydF4y2Bahttp://smart.embl-heidelberg.de/gydF4y2Ba)和Pfam。gydF4y2Ba
猎物蛋白Y2H的筛选与分析gydF4y2Ba
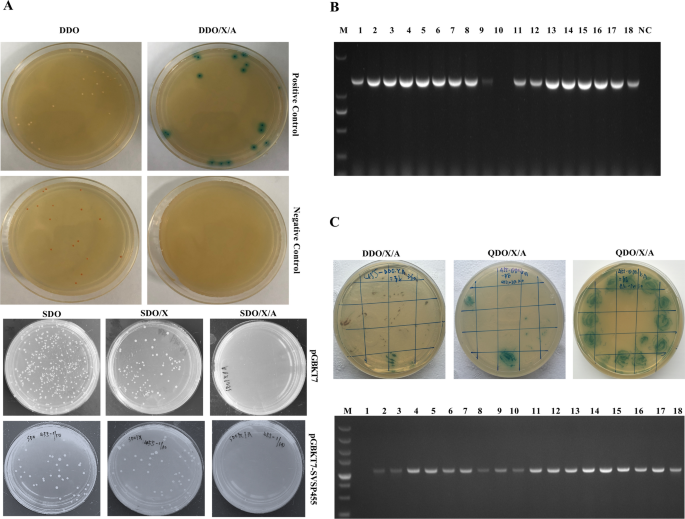
在使用Y2H系统筛选宿主细胞蛋白之前,研究了诱饵质粒的自动激活和毒性特性。如图所示。gydF4y2Ba4gydF4y2BaA,在SDO和SDO/ xar板上生长的含有诱饵质粒的菌落呈白色或苍白色,说明诱饵质粒没有自动激活。使用特异性引物进行PCR检测的结果表明,该诱饵质粒的转化效率为88.89%(图;gydF4y2Ba4gydF4y2BaB).利用Y2H系统筛选与SVSP455诱饵质粒相互作用的潜在蛋白,并通过集落PCR进行鉴定(图;gydF4y2Ba4gydF4y2BaC).筛选的猎物质粒核苷酸序列与猎物质粒具有100%的同源性gydF4y2Ba牛gydF4y2BaHSP60(登录号:KF690729.1),并匹配了HSP60的CDS区域1574到2383个核苷酸。gydF4y2Ba
利用Y2H系统筛选与SVSP455蛋白相互作用的宿主细胞蛋白。gydF4y2Ba一个gydF4y2BapGBKT7-SVSP455对Y2H金细胞的毒性和自活化分析。gydF4y2BaBgydF4y2BaPCR法测定饵质粒转化效率。从sdoar板上随机选取菌落,在50 μl的体系中,用特定的引物进行菌落PCR检测。车道:M, dl2000 DNA标记;1-18,在转染诱饵质粒的SDO板上生长的选定菌落数量;NC,阴性对照。gydF4y2BaCgydF4y2Ba与SVSP455相互作用的潜在宿主细胞蛋白Y2H筛选与鉴定。将诱饵质粒pGBKT7-SVSP455和牛B细胞猎物质粒cDNA文库共转化子培养在DDO/X/A板上,将DDO/X/A板上的蓝色菌落依次培养在QDO/X/A板上,通过两轮孵育筛选推测的猎物蛋白。以pDT7-F/R为引物,对QDO/X/A板上的所有蓝色菌落进行菌落PCR鉴定。车道:M, DL5000 DNA标记(TaKaRa;# 3428);1、阴性对照;2-18, QDO/X/A板的蓝色菌落数量。阳性对照(pGBKT7-53和pDT7-T质粒)和阴性对照(pGBKT7-Lam和pDT7-T质粒)也共同转化为Y2H Gold细胞,并在DDO和DDO/X/A板上培养。空的pGBKT7质粒作为空白对照转化为Y2H Gold感受态细胞,分别在SDO、SDO/X和SDO/X/A板上培养。缩写:cDNA,互补DNA; DDO, synthetically defined medium without tryptophan and leucine; DDO/X/A, DDO supplemented with X-α-l and aureobasidin A; QDO/X/A, DDO without adenine and histidine, supplemented with X-α-l and aureobasidin A; SDO (SD/-Trp), synthetically defined medium; SDO/X, SDO without tryptophan supplemented with X-α-l SDO/X/A, SDO without tryptophan and leucine supplemented with X-α-l and aureobasidin A; Y2H, yeast two-hybrid
焦annulatagydF4y2BaSVSP455与牛HSP60蛋白相互作用gydF4y2Ba
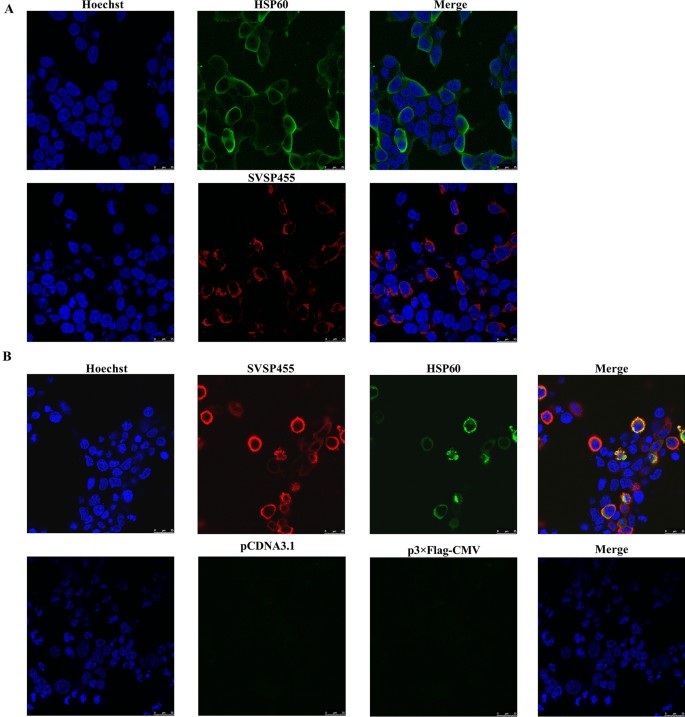
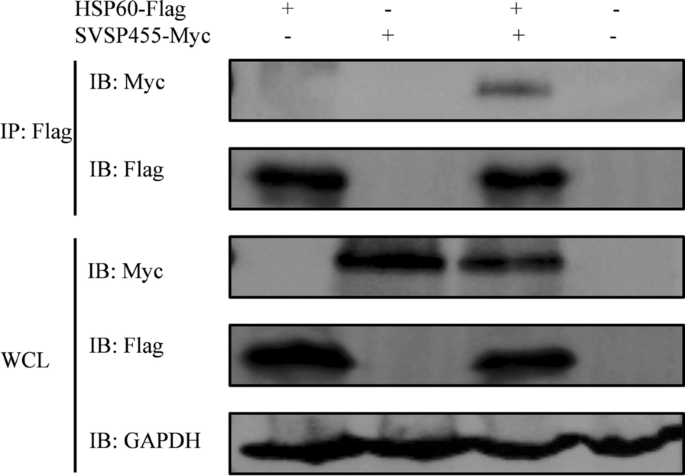
将构建的重组质粒pcDNA3.1-SVSP455-Myc和p3×Flag-CMV-HSP60分别转染或共转染HEK293T细胞。用共聚焦显微镜检测表达蛋白,结果显示myc标记的SVSP455和flag标记的HSP60在HEK293T细胞中单独表达或同时表达(图2)。gydF4y2Ba5gydF4y2BaA),两种蛋白在细胞中具有共定位特征(图。gydF4y2Ba5gydF4y2Ba此外,Co-IP实验表明,当SVSP455在HEK293T细胞中过表达时,它们与HSP60相互作用(图2)。gydF4y2Ba6gydF4y2Ba).gydF4y2Ba
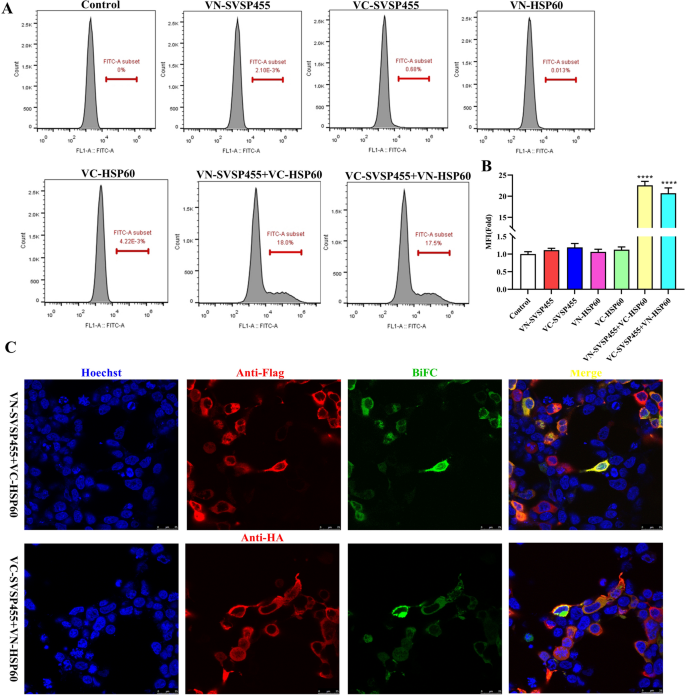
BiFC检测依赖于荧光蛋白的两个非荧光互补片段之间的连接,如绿色荧光蛋白(GFP)或黄色荧光蛋白(YFP)。只有当SVSP455与其伴侣结合时,这些蛋白质才会相互靠近,从而在活细胞中产生明亮的荧光信号。使用荧光显微镜或流式细胞术观察蛋白-蛋白相互作用[gydF4y2Ba29gydF4y2Ba].在我们的研究中,我们使用了BiFC实验来进一步确认SVSP455如何在细胞中靶向其相互作用的蛋白HSP60。流式细胞术检测到单一质粒转染的HEK293T细胞中没有荧光信号,而在VN-SVSP455/VC-HSP60-或VC-SVSP455/ vn - hsp60转染的细胞中通过BiFC检测到强信号(图2)。gydF4y2Ba7gydF4y2Ba与流式细胞术结果相似,共聚焦显微镜也显示了转染细胞中检测到的BiFC荧光信号中SVSP455和HSP60的相互作用(图2)。gydF4y2Ba7gydF4y2BaC).相互作用的蛋白对分布在HEK293T细胞的核周区(图。gydF4y2Ba7gydF4y2BaC)。gydF4y2Ba
SVSP455在细胞内直接与牛HSP60相互作用。gydF4y2Ba一个gydF4y2Ba,gydF4y2BaBgydF4y2Ba采用流式细胞术分析BiFC绿色荧光信号的MFI,结果以相对于阴性对照未转染细胞信号的MFI值表示。gydF4y2BaCgydF4y2Ba用共聚焦显微镜观察了VN-SVSP455的红色信号和相互作用对的BiFC绿色荧光信号的亚细胞共定位。比例尺:25 μm。星号表示在*处差异显著gydF4y2BaPgydF4y2Ba< 0.05, **gydF4y2BaPgydF4y2Ba< 0.01和***gydF4y2BaPgydF4y2Ba< 0.001。缩写:BiFC:双分子荧光互补;MFI:平均荧光强度gydF4y2Ba
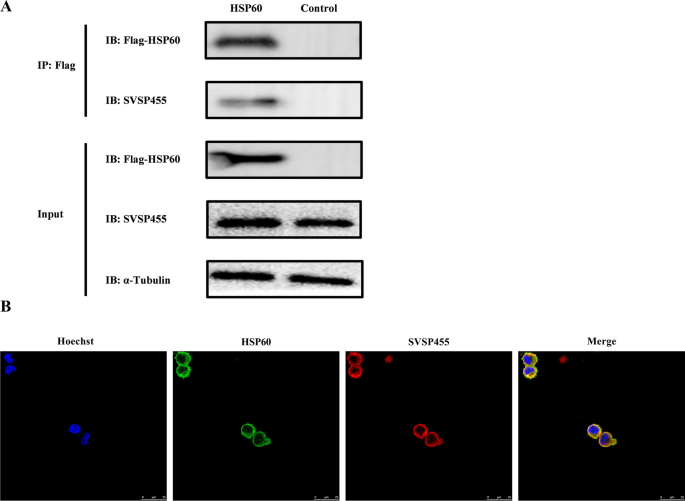
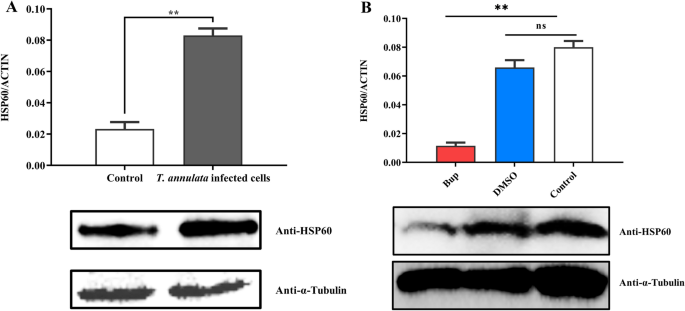
在转染了flag标记的hsp60中gydF4y2Bat . annulatagydF4y2Ba-感染细胞,HSP60也与内源性SVSP455蛋白相互作用,由Co-IP实验结果证明(图。gydF4y2Ba8gydF4y2BaA).相互作用的蛋白质对分布在的表面gydF4y2Bat . annulatagydF4y2Ba根据共聚焦显微镜结果(图;gydF4y2Ba8gydF4y2BaB).本研究的目的是探讨HSP60的表达与gydF4y2Bat . annulatagydF4y2Ba感染时,我们观察了正常和bup处理的HSP60 mRNA和蛋白水平gydF4y2Bat . annulatagydF4y2Ba-感染细胞和正常牛细胞结果显示,小鼠HSP60水平升高gydF4y2Bat . annulatagydF4y2Ba基于qPCR和western blot分析的-感染细胞(图。gydF4y2Ba9gydF4y2Ba).此外,牛HSP60基因敲除后,SVSP455的表达明显降低(图2)。gydF4y2Ba10gydF4y2Ba).gydF4y2Ba
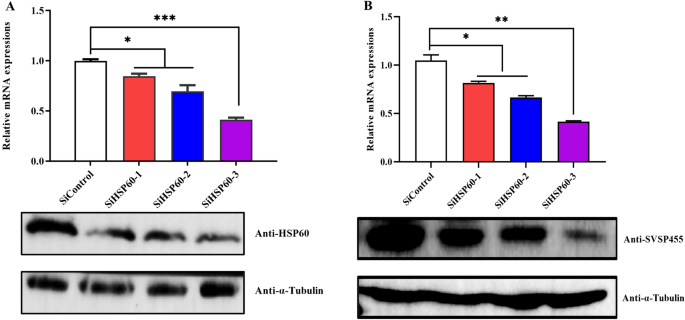
牛HSP60的表达与gydF4y2Bat . annulatagydF4y2Ba感染。gydF4y2Ba一个gydF4y2Ba牛HSP60在mRNA和蛋白水平上的表达分析gydF4y2Bat . annulatagydF4y2Ba诱导细胞和未感染的牛细胞。对照:未感染的牛细胞。gydF4y2BaBgydF4y2Ba正常和bup处理牛HSP60表达水平的比较gydF4y2Bat . annulatagydF4y2Ba使用qPCR和免疫印迹法进行细胞转化。延伸:gydF4y2Bat . annulatagydF4y2BaBup处理后的-转化细胞;控制:gydF4y2Bat . annulatagydF4y2Ba转化细胞;DMSO溶液:gydF4y2Bat . annulatagydF4y2Ba用DMSO处理的转化细胞。牛β-actin mRNA用于归一化。以小鼠抗-α-微管蛋白单克隆抗体作为加载对照。星号表示在*处差异显著gydF4y2BaPgydF4y2Ba< 0.05, * *gydF4y2BaPgydF4y2Ba< 0.01和***gydF4y2BaPgydF4y2Ba< 0.001。抗寄生虫药:布帕伐醌(Bup), DMSO:二甲基亚砜;qPCR:定量PCRgydF4y2Ba
牛HSP60正调控gydF4y2Bat . annulatagydF4y2BaSVSP455。gydF4y2Ba一个gydF4y2Ba利用qPCR和免疫印迹法鉴定sirna介导的牛HSP60沉默的有效性。SiHSP60-1、SiHSP60-2和SiHSP60-3是针对牛HSP60的三种不同的siRNAs。牛β-actin mRNA用于归一化。gydF4y2BaBgydF4y2Ba用qPCR和western blotting检测牛HSP60基因敲除后SVSP455的表达谱。gydF4y2Bat . annulatagydF4y2Baβ-actin mRNA归一化。以小鼠抗-α-微管蛋白单克隆抗体作为加载对照。星号表示*的重要性gydF4y2BaPgydF4y2Ba< 0.05, **gydF4y2BaPgydF4y2Ba< 0.01和***gydF4y2BaPgydF4y2Ba< 0.001。缩写:siRNA:小干扰RNA;qPCR:定量PCRgydF4y2Ba
的gydF4y2Bat . annulatagydF4y2BaSVSP455-HSP60轴可能参与调控细胞凋亡gydF4y2Ba
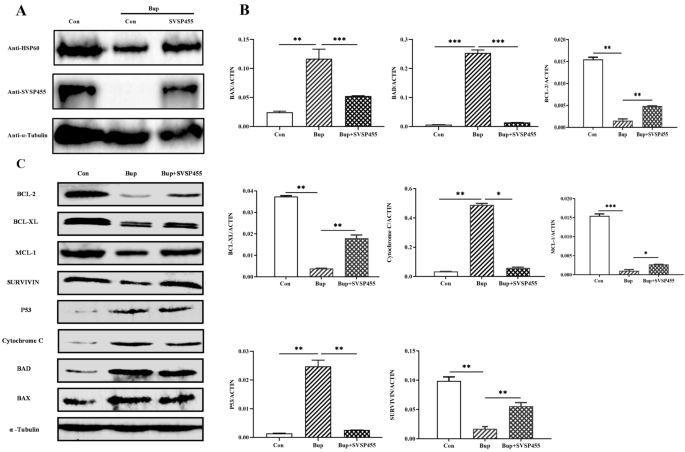
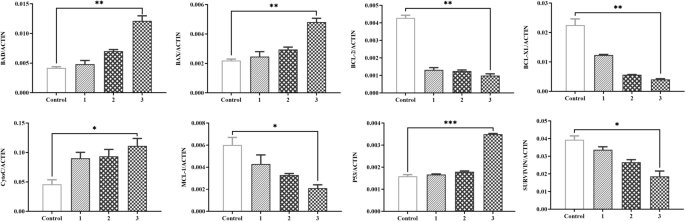
在bup处理的细胞中,SVSP455的过表达部分挽救了宿主HSP60的表达水平(图2)。gydF4y2Ba11gydF4y2BaA)和参与细胞凋亡信号通路的蛋白,包括p53, BCL-2, BCL-XL, MCL-1, SURVIVIN, BAX, BAD和细胞色素gydF4y2BacgydF4y2Ba(无花果。gydF4y2Ba11gydF4y2BaB, C).关于针对这些蛋白质的抗体的详细信息在附加文件中提供gydF4y2Ba3.gydF4y2Ba:表S3。相反,sirna介导的内源性牛HSP60的下调导致抗凋亡因子(BCL-2, BCL-XL, MCL-1和SURVIVIN)的mRNA水平明显降低,而促凋亡基因(BAX, BAD和细胞色素)的mRNA水平则明显降低gydF4y2BacgydF4y2Ba)和p53上调(图;gydF4y2Ba12gydF4y2Ba).在本研究中,通过SiRNA敲低和过表达观察到的促凋亡分子和抗凋亡分子表达的微小变化可能是由于SiRNA抗HSP60和外源性SVSP455的转染效率较低gydF4y2Bat . annulatagydF4y2Ba来华的细胞。综上所述,这些数据表明gydF4y2Bat . annulatagydF4y2BaSVSP455和HSP60gydF4y2Bat . annulatagydF4y2Ba-转化细胞调节线粒体凋亡信号通路中促凋亡和抗凋亡基因的表达,这可能为寄生物在宿主细胞中的增殖和存活提供额外的机会。gydF4y2Ba
焦annulatagydF4y2BaSVSP455部分挽救HSP60和宿主细胞凋亡相关基因的表达gydF4y2Bat . annulatagydF4y2Ba转化细胞。gydF4y2Ba一个gydF4y2Bamyc标记的SVSP455在Bup处理后部分恢复了HSP60蛋白水平。gydF4y2BaBgydF4y2Ba,gydF4y2BaCgydF4y2Bat . annulatagydF4y2BaBup处理和过表达SVSP455 + Bup处理部分挽救线粒体凋亡信号通路的宿主细胞基因表达(gydF4y2BaBgydF4y2Ba)及免疫印迹试验(gydF4y2BaCgydF4y2Ba).牛β-actin mRNA用于归一化。以小鼠抗-α-微管蛋白单克隆抗体作为加载对照。反对:控制;延伸:Buparvaquone;Bup + SVSP455:gydF4y2Bat . annulatagydF4y2Ba用myc标记的重组质粒SVSP455转染-转化细胞,用Bup处理;qPCR:定量PCR。星号表示在*处差异显著gydF4y2BaPgydF4y2Ba< 0.05, **gydF4y2BaPgydF4y2Ba< 0.01和***gydF4y2BaPgydF4y2Ba< 0.001。p参与细胞凋亡信号通路的蛋白:p53, BCL-2, BCL-XL, MCL-1, SURVIVIN, BAX, BAD和CytochromegydF4y2BacgydF4y2Ba
内源牛HSP60基因敲除后凋亡相关基因表达水平的测定gydF4y2BaTgydF4y2Ba.gydF4y2BaannulatagydF4y2Ba-转化细胞使用qPCR。sihsp60 - 1,2,3是针对牛HSP60的三种SiRNA。x轴:1-3,sihsp60 - 1,2,3;控制,SiControl。牛β-actin mRNA用于归一化。星号表示在*处差异显著gydF4y2BaPgydF4y2Ba< 0.05, **gydF4y2BaPgydF4y2Ba< 0.01和***gydF4y2BaPgydF4y2Ba< 0.001。SiHSP60:针对HSP60的小干扰RNA;qPCR:定量PCR;细胞凋亡信号通路相关基因:p53、BCL-2、BCL-XL、MCL-1、SURVIVIN、BAX、BAD和细胞色素gydF4y2BacgydF4y2Ba
讨论gydF4y2Ba
基因组和蛋白质组的数据gydF4y2Bat . annulatagydF4y2Ba可公开获取,有助于探索参与宿主-寄生虫相互作用的潜在寄生虫蛋白质[gydF4y2Ba30.gydF4y2Ba,gydF4y2Ba32gydF4y2Ba].然而,这些基因中大约一半的功能尚不清楚[gydF4y2Ba1gydF4y2Ba].在长期的进化中,转变gydF4y2Ba焦gydF4y2Ba物种(gydF4y2Bat . annulatagydF4y2Ba而且gydF4y2Bat . parvagydF4y2Ba)已经发展出复杂的机制来直接操纵宿主细胞信号通路,以类似于癌细胞的方式促进受感染细胞的不受控制的繁殖[gydF4y2Ba33gydF4y2Ba,gydF4y2Ba34gydF4y2Ba].尽管如此,研究人员还没有确定寄生虫中的哪些蛋白质在细胞转化中起关键作用及其机制。gydF4y2Ba
本研究以SVSP家族成员SVSP455蛋白为目标分子,探讨其在细胞转化中的作用。我们首先发现SVSP455主要表达于gydF4y2Bat . annulatagydF4y2Ba分裂期,表明其可能参与gydF4y2Bat . annulatagydF4y2Ba全身的发病机理。此外,共聚焦显微镜数据表明,它主要定位在分裂体表面和宿主细胞的细胞质中,这表明该蛋白在转化过程中具有潜在的作用。此外,生物信息学分析结果表明,该蛋白含有一个信号肽序列,分布在细胞质中gydF4y2Bat . annulatagydF4y2Ba这进一步支持了共聚焦显微镜的发现。gydF4y2Ba
本研究使用Y2H系统寻找与SVSP455相互作用的宿主蛋白。测序和生物信息学分析结果表明,牛HSP60蛋白可能与SVSP455互作。随后Co-IP和共聚焦显微镜检测的结果证实了HSP60-SVSP455的相互作用。综上所述,这些发现表明SVSP455在HEK293T细胞中与宿主HSP60蛋白结合。BiFC检测结果表明,牛HSP60和SVSP455之间的相互作用是直接的,并且它们在核周区共定位。更重要的是,我们还发现SVSP455与内源性HSP60相互作用gydF4y2Bat . annulatagydF4y2Ba来华的细胞。此外,HSP60的表达显著上调gydF4y2Bat . annulatagydF4y2Ba与未感染的细胞相比,Bup处理寄生虫时HSP60下调(图2)。gydF4y2Ba9gydF4y2Ba,gydF4y2Ba10gydF4y2Ba).gydF4y2Ba
HSP60被称为伴侣蛋白,主要分布在真核生物的线粒体中,与线粒体HSP70结合[gydF4y2Ba35gydF4y2Ba].根据已发表的报道,HSP60也位于外周血、细胞表面和细胞质中[gydF4y2Ba36gydF4y2Ba,gydF4y2Ba37gydF4y2Ba].该蛋白不仅是T和B淋巴细胞的抗原,也是一种toll样受体[gydF4y2Ba38gydF4y2Ba,gydF4y2Ba39gydF4y2Ba],这意味着它在免疫系统中起着至关重要的作用。在本研究中,宿主HSP60蛋白在大肠杆菌中大量表达gydF4y2Bat . annulatagydF4y2Ba-转化细胞,与癌细胞中的水平一致[gydF4y2Ba40gydF4y2Ba,gydF4y2Ba41gydF4y2Ba],提示其与细胞转化和癌变密切相关。研究表明HSP60分子调控肿瘤细胞凋亡,增强抗凋亡作用[gydF4y2Ba42gydF4y2Ba,gydF4y2Ba43gydF4y2Ba].在本研究中,我们发现gydF4y2Bat . annulatagydF4y2Ba-感染的细胞在sirna介导的敲除牛HSP60后倾向于发生凋亡。gydF4y2Ba焦gydF4y2Basp .已经进化出一种至关重要的策略,通过阻断受感染宿主细胞的凋亡来确保生存和繁殖,包括激活抗凋亡分子cFLIP和cIAPs [gydF4y2Ba17gydF4y2Ba,gydF4y2Ba44gydF4y2Ba],隔离宿主p53 [gydF4y2Ba45gydF4y2Ba和上调c-MYC [gydF4y2Ba19gydF4y2Ba].然而,我们发现过表达SVSP455在一定程度上挽救了宿主细胞凋亡信号通路中相关蛋白的表达水平,从而进一步促进了寄生虫的生存和增殖(图2)。gydF4y2Ba12gydF4y2Ba).因此,gydF4y2Bat . annulatagydF4y2BaSVSP455可能通过劫持宿主凋亡信号抑制细胞死亡。此外,HSP60是许多癌症的诊断和预后生物标志物,如肺癌、胃癌和白血病[gydF4y2Ba35gydF4y2Ba,gydF4y2Ba46gydF4y2Ba].同时,这种蛋白质可能是肿瘤治疗的重要药物靶点,包括黑素瘤细胞[gydF4y2Ba47gydF4y2Ba,gydF4y2Ba48gydF4y2Ba].因此,HSP60可能被用作一种假定的标记物或药物靶点gydF4y2Bat . annulatagydF4y2Ba感染。gydF4y2Ba
结论gydF4y2Ba
在本研究中,我们首先证明了gydF4y2Bat . annulatagydF4y2Ba分子SVSP455在体外与牛HSP60结合。此外,我们发现寄生虫蛋白SVSP455与宿主HSP60的相互作用gydF4y2Bat . annulatagydF4y2Ba-转化细胞调节线粒体凋亡信号通路中促凋亡和抗凋亡基因的表达谱。这些发现为宿主-病原体相互作用机制和治疗方法提供了关键的见解gydF4y2Ba焦gydF4y2Ba.gydF4y2Ba
数据可用性gydF4y2Ba
支持本文结论的数据集包含在本文中。gydF4y2Ba
缩写gydF4y2Ba
- BiFC:gydF4y2Ba
-
双分子荧光互补gydF4y2Ba
- Co-IP:gydF4y2Ba
-
Co-immunoprecipitationgydF4y2Ba
- DDO:gydF4y2Ba
-
合成定义了不含色氨酸和亮氨酸的培养基gydF4y2Ba
- DDO / X /:gydF4y2Ba
-
合成了不含色氨酸和亮氨酸的培养基,添加X-α-l和小黄色素AgydF4y2Ba
- HSP60:gydF4y2Ba
-
热休克蛋白60gydF4y2Ba
- QDO / X /:gydF4y2Ba
-
合成不含色氨酸、亮氨酸、腺嘌呤和组氨酸的培养基,添加X-α-l和小黄色素AgydF4y2Ba
- 存在:gydF4y2Ba
-
实时定量PCRgydF4y2Ba
- SDO (SD / -Trp):gydF4y2Ba
-
合成定义的无色氨酸培养基gydF4y2Ba
- SDO / X (SD / -Trp / X -α- l):gydF4y2Ba
-
合成定义了添加X-α-l的不含色氨酸的培养基gydF4y2Ba
- SD / -Trp / X -α- l / AbA:gydF4y2Ba
-
合成定义了添加X-α-l的不含色氨酸的培养基gydF4y2Ba
- SDO / X /:gydF4y2Ba
-
合成了不含色氨酸和亮氨酸的培养基,添加X-α-l和小黄色素AgydF4y2Ba
- siRNAi:gydF4y2Ba
-
小干扰RNAgydF4y2Ba
- SVSP:gydF4y2Ba
-
亚端粒编码可变分泌蛋白gydF4y2Ba
- Y2H:gydF4y2Ba
-
酵母2台混合动力gydF4y2Ba
参考文献gydF4y2Ba
崔蒂娜,戈蒂亚,曼DJ,席尔瓦JC。gydF4y2Ba焦gydF4y2Ba转化的牛白细胞具有癌症特征。中国生物医学工程学报。2015;31:306-14。gydF4y2Bahttps://doi.org/10.1016/j.pt.2015.04.001gydF4y2Ba.gydF4y2Ba
mohammad - ahmed GM, Hassan SM, El-Hussein AM, Salih DA。分子、血清学和寄生虫学调查gydF4y2Ba焦annulatagydF4y2Ba在苏丹北科尔多凡州。兽医寄生虫Reg种马代表2018;13:24-9。gydF4y2Bahttps://doi.org/10.1016/j.vprsr.2018.03.006gydF4y2Ba.gydF4y2Ba
El-Dakhly KM, Arafa W, Ghanem SS, Abdel-Fatah OR, Wahba AA。显微和分子检测gydF4y2Ba焦annulatagydF4y2Ba埃及牛的感染。寄生虫学杂志。2018;5:29-34。gydF4y2Ba
戈梅斯J,萨尔盖罗P, Inácio J,阿马洛A,平托J,泰特A,等。种群多样性gydF4y2Ba焦annulatagydF4y2Ba在葡萄牙。感染Genet Evol 2016; 42:14-9。gydF4y2Bahttps://doi.org/10.1016/j.meegid.2016.04.023gydF4y2Ba.gydF4y2Ba
内内V,莫里森WI。预防接种方法gydF4y2Ba焦parvagydF4y2Ba而且gydF4y2Ba焦annulatagydF4y2Ba.寄生虫学杂志,2016;38:724-34。gydF4y2Bahttps://doi.org/10.1111/pim.12388gydF4y2Ba.gydF4y2Ba
Al-Deeb MA, Muzaar SB, Abu-Zeid YA, Enan MR, Karim S.斑点热群的首次记录gydF4y2Ba立克次氏体sp。gydF4y2Ba而且gydF4y2Ba焦annulatagydF4y2Ba在gydF4y2BaHyalomma dromedariigydF4y2Ba(蜱螨亚纲:硬蜱科)阿拉伯联合酋长国的蜱。《昆虫学报》2015;98:135-9。gydF4y2Bahttps://doi.org/10.1653/024.098.0123gydF4y2Ba.gydF4y2Ba
Roy S, Bhandari V, Barman M, Kumar P, Bhanot V, Arora JS,等。群体遗传分析gydF4y2Ba焦annulatagydF4y2Ba在来自印度的疫苗中,寄生虫鉴定出有限的多样性和感染的多样性。前沿微生物。2012;11:579929。gydF4y2Bahttps://doi.org/10.3389/fmicb.2020.579929gydF4y2Ba.gydF4y2Ba
刘娟,李勇,刘安,关刚,谢娟,尹华,等。建立了一种检测和鉴别大肠杆菌的多重PCR方法gydF4y2Ba焦annulatagydF4y2Ba而且gydF4y2Ba焦sergentigydF4y2Ba在牛。寄生虫学决议2015;114:2715-21。gydF4y2Bahttps://doi.org/10.1007/s00436-015-4478-zgydF4y2Ba.gydF4y2Ba
Irvin AD, Morrison WI。免疫病理学,免疫学和免疫预防gydF4y2Ba焦gydF4y2Ba感染。进:Soulsby EJL,编辑。寄生虫感染中的免疫反应:免疫学,免疫病理学和免疫预防。卷三:原生动物。博卡拉顿:CRC出版社;1987.p . 223 - 274。gydF4y2Ba
黄志刚,黄志刚。热带灰虱病的流行病学研究(gydF4y2Ba焦annulatagydF4y2Ba牛感染)在摩洛哥的一个流行地区。兽医寄生虫。1992;44:51-65。gydF4y2Bahttps://doi.org/10.1016/0304 - 4017 (92) 90143 - wgydF4y2Ba.gydF4y2Ba
Medjkane S, Weitzman JB。细胞内的gydF4y2Ba焦gydF4y2Ba寄生虫控制宿主的新陈代谢。前沿细胞发育生物学2020;8:134。gydF4y2Bahttps://doi.org/10.3389/fcell.2020.00134gydF4y2Ba.gydF4y2Ba
Brown CG, Stagg DA, Purnell RE, Kanhai GK, Payne RC。信:牛淋巴样细胞体外感染和转化的感染颗粒gydF4y2Ba焦parvagydF4y2Ba.大自然。1973;245:101-3。gydF4y2Bahttps://doi.org/10.1038/245101a0gydF4y2Ba.gydF4y2Ba
Dobbelaere DAE, Rottenberg S。gydF4y2Ba焦gydF4y2Ba诱导白细胞转化。《微生物学》,2003;6:377-82。gydF4y2Bahttps://doi.org/10.1016/s1369 - 5274 (03) 00085 - 7gydF4y2Ba.gydF4y2Ba
Baldwin CL, Black SJ, Brown WC, Conrad PA, Goddeeris BM, Kinuthia SW,等。牛T细胞、B细胞和空细胞被原生动物寄生虫转化gydF4y2Ba焦parvagydF4y2Ba.《感染Immun》1988;56:462-7。gydF4y2Bahttps://doi.org/10.1128/iai.56.2.462-467gydF4y2Ba.gydF4y2Ba
斯普纳RL,英尼斯EA,格拉斯EJ,布朗CG。gydF4y2Ba焦annulatagydF4y2Ba而且gydF4y2Bat . parvagydF4y2Ba感染和转化不同的牛单核细胞。免疫学。1989;66:284-8。gydF4y2Ba
芝士K,威茨曼JB。宿主-寄生虫相互作用:一种亲密的表观遗传关系。中国生物医学工程学报。2015;17:1121-32。gydF4y2Bahttps://doi.org/10.1111/cmi.12471gydF4y2Ba.gydF4y2Ba
Heussler VT, Rottenberg S, Schwab R, Küenzi P, Fernandez PC, McKellar S,等。转化寄生虫劫持宿主细胞IKK信号体gydF4y2Ba焦gydF4y2Ba.科学。2002;298:1033-6。gydF4y2Bahttps://doi.org/10.1126/science.1075462gydF4y2Ba.gydF4y2Ba
Chaussepied M, Lallemand D, Moreau MF, Adamson R, Hall R, Langsley G. Jun和Fos家族成员的上调和永久JNK活性导致AP-1的组成性激活gydF4y2Ba焦gydF4y2Ba改变了白细胞。中国生物化学杂志,1998;19(4):344 - 344。gydF4y2Bahttps://doi.org/10.1016/s0166 - 6851 (98) 00070 - xgydF4y2Ba.gydF4y2Ba
Dessauge F, Hilaly S, Baumrtner M, Blumen B, Werling D, Langsley G. c-Myc激活gydF4y2Ba焦gydF4y2Ba寄生虫促进了感染b淋巴细胞的存活。致癌基因。2005;24:1075 - 83。gydF4y2Bahttps://doi.org/10.1038/sj.onc.1208314gydF4y2Ba.gydF4y2Ba
Marsolier J, Perichon M, DeBarry JD, Villoutreix BO, Chluba J, Lopez T,等。gydF4y2Ba焦gydF4y2Ba寄生虫分泌一种脯氨酸异构酶来维持宿主白细胞的转化。大自然。2015;520:378 - 82。gydF4y2Bahttps://doi.org/10.1038/nature14044gydF4y2Ba.gydF4y2Ba
Marsolier J, Perichon M, Weitzman JB, Medjkane S.分泌的寄生虫Pin1异构酶稳定宿主PKM2以重编程宿主细胞代谢。《社区生物学》2019;2:152。gydF4y2Bahttps://doi.org/10.1038/s42003-019-0386-6gydF4y2Ba.gydF4y2Ba
Seitzer U, Gerber S, Beyer D, Dobschanski J, Kullmann B, Haller D,等。裂殖体的gydF4y2Ba焦annulatagydF4y2Ba通过膜蛋白TaSP与宿主细胞的微管网络相互作用。寄生虫Res. 2010; 106:1085-102。gydF4y2Bahttps://doi.org/10.1007/s00436-010-1747-8gydF4y2Ba.gydF4y2Ba
马凯维兹,李志强,李志强。gydF4y2Ba焦annulatagydF4y2Ba表面蛋白(TaSP)是周期蛋白依赖性激酶1磷酸化的靶点gydF4y2Ba焦annulatagydF4y2Ba来华的细胞。跨界新兴Dis 2020; 1:40-55。gydF4y2Bahttps://doi.org/10.1111/tbed.13458gydF4y2Ba.gydF4y2Ba
Woods KL, Theiler R, Mühlemann M, Segiser A, Huber S, Ansari HR,等。招募EB1,微管动力学的主要调节因子,到表面gydF4y2Ba焦annulatagydF4y2Ba裂殖体。公共科学图书馆,2013;9:e1003346。gydF4y2Bahttps://doi.org/10.1371/journal.ppat.1003346gydF4y2Ba.gydF4y2Ba
Barry JD, Ginger ML, Burton P, McCulloch R.为什么寄生虫的偶然基因经常与端粒有关?寄生虫学杂志,2003;33:29-45。gydF4y2Bahttps://doi.org/10.1016/s0020 - 7519 (02) 00247 - 3gydF4y2Ba.gydF4y2Ba
Schmuckli MJ, Casanova C, Stéfanie S, Affentranger S, Parvanova I, Kang 'a S,等。表达分析gydF4y2Ba焦parvagydF4y2Ba亚端粒编码可变分泌蛋白基因家族。PLoS ONE。2009; 4: e4839。gydF4y2Bahttps://doi.org/10.1371/journal.pone.0004839gydF4y2Ba.gydF4y2Ba
Weir W, Karagenç T, Baird M, Tait A, Shiels BR。尖复体寄生虫分泌组基因的进化与多样性gydF4y2Ba焦annulatagydF4y2Ba.BMC基因组学,2010;11:42。gydF4y2Bahttps://doi.org/10.1186/1471-2164-11-42gydF4y2Ba.gydF4y2Ba
赵松,关刚,刘杰,刘安,李勇,尹华,等。与宿主蛋白相互作用的筛选与鉴定gydF4y2Ba焦annulatagydF4y2Ba半胱氨酸蛋白酶(TaCP)的酵母-双杂交系统。寄生虫病媒介。2017;10:536。gydF4y2Bahttps://doi.org/10.1186/s13071-017-2421-0gydF4y2Ba.gydF4y2Ba
Kerppola TK。双分子荧光互补(BiFC)分析作为活细胞中蛋白质相互作用的探针。生物物理学报。2008;37:465-87。gydF4y2Bahttps://doi.org/10.1146/annurev.biophys.37.032807.125842gydF4y2Ba.gydF4y2Ba
佩恩A,雷诺H,贝里曼M,墨菲L,叶芝CA,威尔W,等。宿主细胞转化寄生虫的基因组gydF4y2Ba焦annulatagydF4y2Ba相比之下,gydF4y2Bat . parvagydF4y2Ba.科学。2005;309:131-3。gydF4y2Bahttps://doi.org/10.1126/science.1110418gydF4y2Ba.gydF4y2Ba
谢尔斯BR, Langsley G, Weir W, Pain A, McKellar S, Dobbelaere DAE。通过改变宿主细胞的表型gydF4y2Ba焦annulatagydF4y2Ba而且gydF4y2Ba焦parvagydF4y2Ba:挖掘寄生虫基因组中的操纵子。寄生虫学杂志。2006;36:9-21。gydF4y2Bahttps://doi.org/10.1016/j.ijpara.2005.09.002gydF4y2Ba.gydF4y2Ba
Witschi M, Xia D, Sanderson S, Baumrtner M, Wastling JM, Dobbelaere DAE。蛋白质组学分析gydF4y2Ba焦annulatagydF4y2Ba裂殖体。中国寄生虫学杂志,2013;gydF4y2Bahttps://doi.org/10.1016/j.ijpara.2012.10.017gydF4y2Ba.gydF4y2Ba
Kinnaird JH, Weir W, Durrani Z, Pillai SS, Baird M, Shiels BR。牛淋巴肉瘤细胞系感染gydF4y2Ba焦annulatagydF4y2Ba显示宿主细胞基因表达的不可逆重构。PLoS ONE。2013; 8: e66833。gydF4y2Bahttps://doi.org/10.1371/journal.pone.0066833gydF4y2Ba.gydF4y2Ba
杜兰妮Z, Weir W, Pillai S, Kinnaird J, Shiels BR。顶端复合物寄生对活化相关宿主细胞基因表达的调节gydF4y2Ba焦annulatagydF4y2Ba.细胞微生物学。2012;14:1434-54。gydF4y2Bahttps://doi.org/10.1111/j.1462-5822.2012.01809.xgydF4y2Ba.gydF4y2Ba
吴娟,刘涛,李志强,梅青,林霞,曹山。热休克蛋白与癌症的关系。药理学杂志2017;38:226-56。gydF4y2Bahttps://doi.org/10.1016/j.tips.2016.11.009gydF4y2Ba.gydF4y2Ba
Wadhwa R, Takano S, Kaur K, Aida S, Yaguchi T, Kaul Z,等。mortalin/mtHsp70和HSP60分子相互作用的鉴定和表征。生物化学学报,2015;gydF4y2Bahttps://doi.org/10.1042/BJ20050861gydF4y2Ba.gydF4y2Ba
卡佩罗F,康威德马卡里奥E, Marasà L, Zummo G,马卡里奥AJ。Hsp60表达、肿瘤诊断和治疗的新位置、功能和前景癌症生物学杂志,2008;7(6): 801 - 9。gydF4y2Bahttps://doi.org/10.4161/cbt.7.6.6281gydF4y2Ba.gydF4y2Ba
林Lv L, Wan L, Y,张W,杨,李G, et al。抗癌药物导致人肝细胞肝癌细胞释放具有热休克蛋白的外泌体,在体外诱导有效的自然杀伤细胞抗肿瘤反应。中国生物化学杂志,2012;gydF4y2Bahttps://doi.org/10.1074/jbc.M112.340588gydF4y2Ba.gydF4y2Ba
昆塔纳FJ,科恩IR。热休克蛋白60免疫系统网络。免疫杂志2011;32:89-95。gydF4y2Bahttps://doi.org/10.1016/j.it.2010.11.001gydF4y2Ba.gydF4y2Ba
蔡永平,滕少生,吴建军。c-MYC直接调控HSP60表达诱导转化。FEBS Lett. 2008; 582:4083-8。gydF4y2Bahttps://doi.org/10.1016/j.febslet.2008.11.004gydF4y2Ba.gydF4y2Ba
林超,何鹏,徐文涛,吴敏,吴超,沈华,等。幽门螺杆菌源性热休克蛋白60通过cxcr2介导的信号通路促进血管生成。生物化学与生物物理学报。2010;397:283-9。gydF4y2Bahttps://doi.org/10.1016/j.bbrc.2010.05.101gydF4y2Ba.gydF4y2Ba
Pace A, Barone G, Lauria A, Martorana A, Piccionello AP, Pierro P,等。Hsp60,抗肿瘤治疗的新靶点:结构功能特征和前瞻性药物设计。Curr Pharm Des 2013; 19:2757-64。gydF4y2Bahttps://doi.org/10.2174/1381612811319150011gydF4y2Ba.gydF4y2Ba
高希JC, Dohi T, Kang BH, Altieri DC。Hsp60对肿瘤细胞凋亡的调控。中国生物医学工程学报。2008;gydF4y2Bahttps://doi.org/10.1074/jbc.M705904200gydF4y2Ba.gydF4y2Ba
白介素2 (IL 2)在细胞增殖中的作用gydF4y2Ba焦annulatagydF4y2Ba-感染的牛淋巴细胞寄生虫病决议1987;73:524-6。gydF4y2Bahttps://doi.org/10.1007/BF00535327gydF4y2Ba.gydF4y2Ba
Haller D, Mackiewicz M, Gerber S, Beyer D, Kullmann B, Schneider I,等。p53的细胞质隔离促进转化的白细胞存活gydF4y2Ba焦gydF4y2Ba.致癌基因。2010;29:3079 - 86。gydF4y2Bahttps://doi.org/10.1038/onc.2010.61gydF4y2Ba.gydF4y2Ba
Mittal S, Rajala MS.热休克蛋白作为肺癌的生物标志物。癌症生物学杂志2020;21:477-85。gydF4y2Bahttps://doi.org/10.1080/15384047.2020.1736482gydF4y2Ba.gydF4y2Ba
林苏T, J,赵C,陈J,苏J,程Z,等。黑素素抗黑素瘤A2058细胞抗肿瘤活性的蛋白质组学研究。电泳。2012;33:1139-52。gydF4y2Bahttps://doi.org/10.1002/elps.201100462gydF4y2Ba.gydF4y2Ba
常超,徐勇,吴超,杨勇,王超,吴超,等。硼替佐米抗肿瘤作用的免疫机制。中华免疫杂志2012;189:3209-20。gydF4y2Bahttps://doi.org/10.4049/jimmunol.1103826gydF4y2Ba.gydF4y2Ba
资金gydF4y2Ba
本研究得到973计划(2015CB150300)、国家重点研发计划(2017YFD0500403)、国家自然科学基金(31972706,31402189)、中国农业科学院兰州兽医研究所主导基金(lvi - szjj -202105)、SKLVEB孵化计划(SKLVEB2021CGQD02)的资助。gydF4y2Ba
作者信息gydF4y2Ba
作者及隶属关系gydF4y2Ba
贡献gydF4y2Ba
ZL、JL和HY构思并设计了这项研究。ZL和SZ进行实验。ZL撰写初稿。QM, AL, YL, GG组织数据库。JL, ZG和JL编辑了手稿。所有作者都对手稿和修订做出了贡献。所有作者都阅读并批准了最终的手稿。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
伦理批准并同意参与gydF4y2Ba
所有动物实验均由中国农业科学院兰州兽医研究所动物伦理委员会审核通过。gydF4y2Ba
发表同意书gydF4y2Ba
不适用。gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者宣称他们之间没有利益冲突。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Ba
伟德体育在线施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。gydF4y2Ba
补充信息gydF4y2Ba
附加文件1:表S1。gydF4y2Ba
本研究利用qPCR技术分析了目的基因的序列信息。gydF4y2Ba
附加文件2:表S2。gydF4y2Ba
针对牛HSP60的siRNA序列。gydF4y2Ba
附加文件3:表S3。gydF4y2Ba
抗体靶向宿主细胞线粒体凋亡信号通路中的关键分子。gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba.创作共用公共领域奉献弃权书(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)适用于本条所提供的资料,除非在资料的信用额度中另有说明。gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
李震,刘俊,赵寿。gydF4y2Baet al。gydF4y2Ba焦annulatagydF4y2BaSVSP455与宿主HSP60相互作用。gydF4y2Ba寄生虫向量gydF4y2Ba15gydF4y2Ba, 308(2022)。https://doi.org/10.1186/s13071-022-05427-zgydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s13071-022-05427-zgydF4y2Ba
关键字gydF4y2Ba
- 焦annulatagydF4y2Ba
- SVSP455gydF4y2Ba
- 交互gydF4y2Ba
- 转换gydF4y2Ba
- 宿主细胞凋亡gydF4y2Ba