摘要
疟疾是一种由该属成员引起的危及生命的寄生虫疾病疟原虫.耐药菌株的发展和传播疟原虫寄生虫是疟疾控制和消除规划面临的一项重大挑战。评估药物靶点的遗传多态性提高了我们对耐药性的理解,促进了药物设计。大约450和19个全基因组组合恶性疟原虫而且间日疟原虫,分别是目前可用的,并且由于单核苷酸多态性(SNP)的存在,已经发现了许多序列变异。在本文报道的研究中,我们分析了疟疾寄生虫氨酰基- trna合成酶(aaRSs)中的全局snp。我们的分析在20个细胞质中发现了3182个独特的snp恶性疟原虫aar活动。在三种晚期药物靶点的三维抑制剂结合复合物上的SNPs结构映射显示,关键的氨基酰化结构域的突变频率非常低,整个样本的突变总体发生率低,药物/底物结合区域的高度保守。与arss相反,同样是疟疾药物靶点的双氢翼酸合成酶(DHPS)显示出高发生率的耐药引起突变。我们的研究结果表明,根据全球SNP谱筛选有效的疟疾药物靶点,以评估遗传差异,以确保针对已验证靶点成功设计药物并尽早解决耐药性问题是至关重要的。
图形抽象

简介
疟疾是由疟原虫寄生虫,是一种威胁生命的疾病,在发展中国家仍然是一个重要的公共卫生问题[1].寄生虫抗药性的发展和传播使消灭疟疾变得复杂恶性疟原虫而且间日疟原虫通过耐药株的出现而转向抗疟疾药物[2].东南亚和非洲疟疾流行国家已证实存在能够逃避一线抗疟疾青蒿素类联合疗法的寄生虫,这对疾病的死而复生构成威胁[3.].为了预防这一常见但可治疗疾病导致的突发卫生事件,迫切需要验证新的药物靶点和设计新型抗疟支架[4,5].氨酰基-tRNA合成酶(aaRS)家族的酶是普遍分布的,因为它们催化同源氨基酸连接转移RNA (tRNA),对应于基于遗传密码的tRNA的反密码子三联体[6].在氨基酰基化反应中,ATP通过形成氨基酰基腺苷酸中间体来激活氨基酸,随后该中间体被连接到tRNA分子上,最终产物被运输到核糖体进行蛋白质翻译。由于aars实现蛋白质翻译的遗传密码,它们的抑制导致核糖体在蛋白质合成过程中停滞。aaRS酶是有效的疟疾药物靶点[7,8,9,10].的几种三维(3D)结构疟原虫aars可与阐明机理细节的底物和/或抑制剂配合使用[11,12,13,14,15,16,17,18].因此,抗逆转录病毒药物为开发抗疟疾药物提供了一个强有力的起始平台。
全球场分离疟原虫来自世界各地的寄生虫是了解不同种群间寄生虫基因组遗传差异的宝贵资源。单核苷酸多态性(SNP)是DNA中一个碱基位置上的基因组变异,是最常见的遗传变异,可以改变蛋白质的表面特性。疟疾基因组流行病学网络(MalariaGEN)是一个与全球研究伙伴共享的公共数据网络,它将流行病学与与疟疾寄生虫有关的人群基因组学结合起来[19].MalariaGEN提供核苷酸水平的SNP数据恶性疟原虫而且间日疟原虫从世界各地疟疾患者的临床血液样本中获得[19,20.,21,22,23].在2015年至2020年期间,在50多个国家的不同项目中,在MalariaGEN的框架内对9751个独特样本进行了测序,结果在该基因基因组中鉴定了约8,051,696个snp恶性疟原虫,以3D7应变为参考[20.,21,22].此外,在基因组中已鉴定出303,616个SNPs间日疟原虫,以Salvador 1 (Sal 1)株为参考[23].
在这项工作中,我们分析了20种细胞质中的全局非同义snp(进一步称为snp)疟原虫aar活动。我们的分析在这20个细胞质中发现了3182个独特的snp恶性疟原虫平均有159个SNPs,个体突变频率9-31%。将SNPs的结构映射到三种aars的抑制剂/底物结合的3D结构上,即恶性疟原虫lysyl (PfKRS)-,脯氨酸(PfPRS),间日疟原虫phenylalanyl (光伏FRS)-tRNA合成酶的催化结构域突变频率非常低,而底物/药物结合区域高度保守。相比之下,对另一种关键疟疾药物靶点——双氢翼酸合成酶(DHPS)的类似分析显示,尽管总体突变频率较低,但存在所有引起耐药性的突变。
药物和疫苗靶点基因组序列的内在可变性可能是设计和开发有效疗法的一个缺点,因为靶点自然具有耐药性(受损)[24,25].任何氨基酸的变化,特别是在药物靶点的活性位点,都可能引起结构特征的改变,从而改变其与药物的相互作用,并可能导致弱结合或无结合。这样的多态性会导致人群中表现出耐药性的亚群的增加。基于这项研究的结果,作者建议研究药物靶点配体/底物/抑制剂结合区域的区域和人群特异性多态性,以确保疟疾治疗设计的成功。
方法
SNP数据
从以下版本的MalariaGEN网络(www.malariagen.net/data):
Pf3k项目(2016):试验数据发布5 (www.malariagen.net/data/pf3k-5)。非同义(氨基酸突变)的变体为每20Pf-氨基酰基- trna合成酶从数据应用程序可在https://www.malariagen.net/apps/pf3k/release_3/index.html通过搜索基因id(附加文件1:表S1)。有关2640个样本的详细信息,包括国家和地点,可在ftp://ngs.sanger.ac.uk/production/pf3k/release_5/(附加文件2:表S2)。
恶性疟原虫社区项目-遗传变异目录v6.0 (www.malariagen.net/data/catalogue-genetic-variation-p-falciparum-v6.0如MalariaGEN et al., Wellcome Open Research 2021642和catalog of Genetic Variation v4.0所述(www.malariagen.net/data/catalogue-genetic-variation-p-falciparum-v4.0)。非同义(氨基酸突变)变异从数据应用程序可在https://www.malariagen.net/apps/pf/4.0/.Pf4.0和Pf6.0项目共提供了7111个独特的样品。因此,总数是唯一的恶性疟原虫本研究中收集到的snp样本有9751个(2640个来自Pf3k项目,7111个来自Pf4.0和Pf6.0项目)。对于v6.0,使用FTP站点下载可变调用格式文件(VCF)ftp://ngs.sanger.ac.uk/production/malaria/pfcommunityproject/Pf6/Pf_6_vcf/.使用BCFTools处理VCF文件(www.samtools.github.io bcftools /MacOS(苹果公司,Cupertino, CA, USA)。使用BCFTools脚本为每个染色体生成逗号分隔值(.CSV)文件ftp://ngs.sanger.ac.uk/production/malaria/pfcommunityproject/Pf6/Pf_6_vcf/About-Pf7_data.txt.通过提取“SNPEFF_AMINO_ACID_CHANGE”列,从. csv文件中提取由基因突变引起的氨基酸突变。7111个样本的详细资料,包括国家和地点,可在ftp://ngs.sanger.ac.uk/production/malaria/pfcommunityproject/Pf6/Pf_6_vcf/Pf_6samples.txt.
MalariaGEN疟原虫间日疟原虫基因组变异计划(2016)。间日疟原虫2016年5月数据发布,Pearson等人描述[23),https://www.malariagen.net/parasite/p-vivax-genome-variation(20.,21,22].的DHPS结构域的非同义(氨基酸突变)变体光伏HPPK-DHPS和3间日疟原虫aar活动(光伏基米-雷克南,光伏PRS,光伏FRS)的数据应用程序https://www.malariagen.net/apps/pvgv/index.html通过使用基因id搜索(附加文件1:表S1)。228个样本的详细资料,包括国家和地点,可在https://www.malariagen.net/parasite/p-vivax-genome-variation(附加文件2:表S2)。
序列与结构分析
三维结构从蛋白质数据库(www.rcsb.org)。序列分析使用Clustal Omega (www.ebi.ac.uk /工具/ msa / clustalo /)。PDBsum (www.ebi.ac.uk pdbsum /)进行二级结构分析。所有条形图和饼图都是用Microsoft Excel (Microsoft Corp., Redmond, WA, USA)制作的。PLIP (www.plip-tool.biotec.tu-dresden.de plip-web plip /索引)用于分析蛋白质-配体相互作用。结构观察用Pymol (www.pymol.org)。
结果与讨论
SNP谱恶性疟原虫而且间日疟原虫井下供电
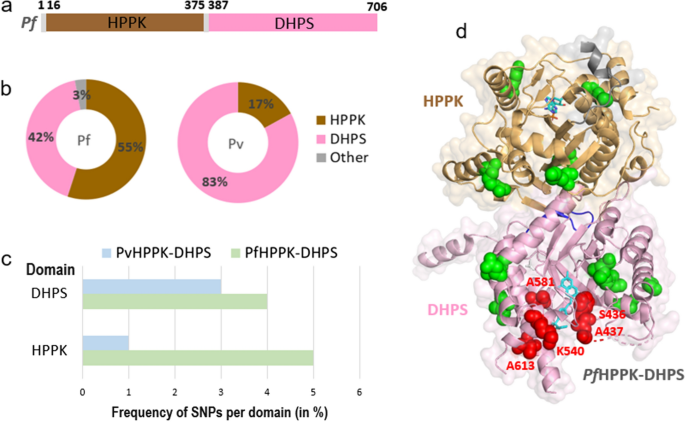
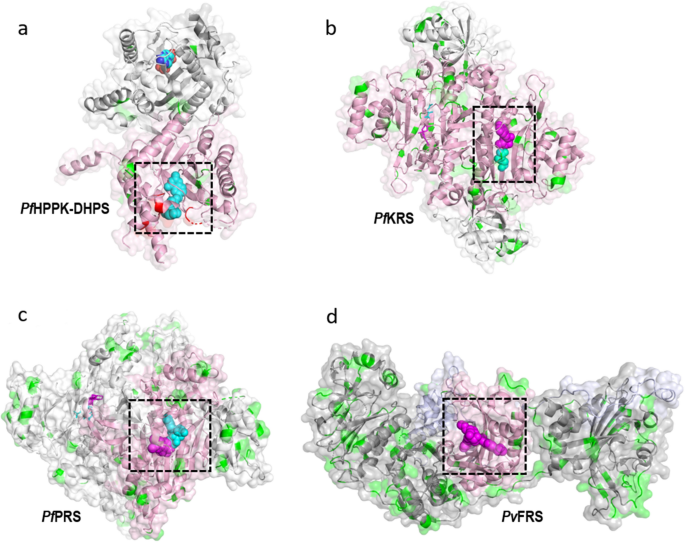
疟原虫6-羟基甲基-7,8-二氢蝶呤焦磷酸激酶-二氢蝶呤合成酶(HPPK-DHPS)是一种双功能融合酶,对叶酸的生物合成至关重要。抑制这一过程会导致dTTP耗竭,导致寄生虫DNA合成减少,最终导致其死亡[26,27,28].的DHPS域PfHPPK-DHPS被磺胺多辛(Sdx)和磺胺类化合物抑制;然而,在世界各地的田间分离研究中,Sdx抗性的出现得到了充分的记录[26,27,28].的结构P.恶性疟原虫而且间日疟原虫HPPK-DHPS可与底物/类似物配合使用(PDB ID: 6JWW和5Z79) [27,28].PfHPPK-DHPS是一种二聚体,由连接体连接HPPK和DHPS结构域。1a).我们的分析揭示了33个独特的snpPfHPPK-DHPS,总突变频率为5%,共706个残基(图2)。1b、附加文件3.:表S3)。的PfDHPS结构域本身的频率较低,只有4%,因为它的320个残基中只有14个snp(图2)。1c)。此外,光伏HPPK-DHPS含有相当于12个突变,另外还有5个突变间日疟原虫项目,其中两个是唯一的。五种突变间日疟原虫在该项目中,有4个基因位于DHPS结构域,其中3个已知是引起耐药性的突变。相似的低频率突变出现在恶性疟原虫而且间日疟原虫DHPS域(图;1c).PfDHPS结构域主要是疏水/极性/带电残基突变为疏水/极性残基。未观察到残基突变为带电残基的突变。一个特定的SNPPfDHPS结构域至少出现在一个样本中,最多出现在1892个样本中(来自MalariaGEN项目Pf3k、Pf4.0和Pf6.0的9751个独特样本中)。所有五种引起抗药性的突变恶性疟原虫(S436A/F, A437G, K540E, A581G和A613S/T)在Pf在对9751个MalariaGEN项目样本进行分析的样本中,多达1892个样本中的DHPS域。在9751个样本(26%)中,2552个样本中发现至少两种引起耐药的突变共存。此外,97个样本中同时存在3个突变,其中第三个突变(E189Q)位于HPPK结构域。snp的结构映射PfHPPK-DHPS显示在磺胺药物结合位点存在耐药突变(图2)。1D),如前所述;29].此外,这些突变在样本中的高发生率证实了Sdx耐药的相当普遍,并强调了全球SNP数据库作为了解持续耐药传播的关键的重要性。
单核苷酸多态性(SNP)谱恶性疟原虫HPPK-DHPS。一个域图恶性疟原虫HPPK-DHPS酶,其中HPPK和DHPS结构域分别为棕色和粉红色。b中HPPK和DHPS结构域氨基酸突变的百分比分布PfHPPK-DHPS(左)和光伏HPPK-DHPS(右)。c中HPPK和DHPS结构域内突变的频率百分比PfHPPK-DHPS和光伏HPPK-DHPS[(氨基酸突变总数除以结构域内残基总数)× 100]。dSNPs在三维结构上的结构映射PfHPPK-DHPS (PDB ID: 6JWW), HPPK和DHPS域显示为棕褐色和粉红色缎带,表面透明。单核苷酸多态性显示为绿色球体。DHPS域结合的磺胺噻唑(STZ)和HPPK域结合的AMP以青色棒状显示。在DHPS结构域发生突变的残基显示为红色球体。缩写:PfHPPK-DHPS,恶性疟原虫6-羟基甲基-7,8-二氢蝶呤焦磷酸酶-二氢蝶呤合酶;光伏HPPK-DHPS,间日疟原虫HPPK-DHPS;SNP,单核苷酸多态性
细胞质SNP谱恶性疟原虫氨酰合成酶
恶性疟原虫有36个aars,其中16个是细胞质的,15个是尖质体的,1个是线粒体的,4个在细胞质和尖质体之间共享定位[9,10].20细胞质疟原虫抗逆转录病毒药物是疟疾的潜在药物靶点,其中3 -赖氨酸(PfKRS)-,脯氨酸(Pf-和苯丙酰(光伏FRS)-tRNA合成酶是高度先进的靶标,因为有几种化学、结构和活性关系数据集可用于这些(附加文件)1:表S1) [11,12,13,14,15,16,17,18].我们的分析显示,这20种基因中共有3182个独特的snpPf- aars,突变频率最高见于PfARS, HRS和VRS(图。2,3.)和最低的snp频率出现在PfWRS, NRS, PRS, KRS, RRS和YRS(图。2,3.)。因此,平均SNP频率范围为9% ~ 31%,总体SNP频率平均为5%。分析间日疟原虫基因组序列显示33个snp光伏基米-雷克南,光伏PRS,光伏FRS(无花果。2)。细胞质三维结构Pf基米-雷克南,PfPRS,光伏FRS可与底物和抑制剂配合物[11,12,13,14,15,16,17,18].假设我们有这样的结构PfKRS与抑制剂cladosporin和底物结合l赖氨酸,PfPRS结合抑制halofuginone和光伏FRS与双环氮叠丁有一定的抑制作用,这些数据将有助于抗aars药物的开发。SNPs的结构作图可以揭示它们在蛋白质表面的分布和位置。有趣的是,Pf基米-雷克南和PfPRS的突变频率是最低的Pf-aaRSs(无花果。2,3.)。
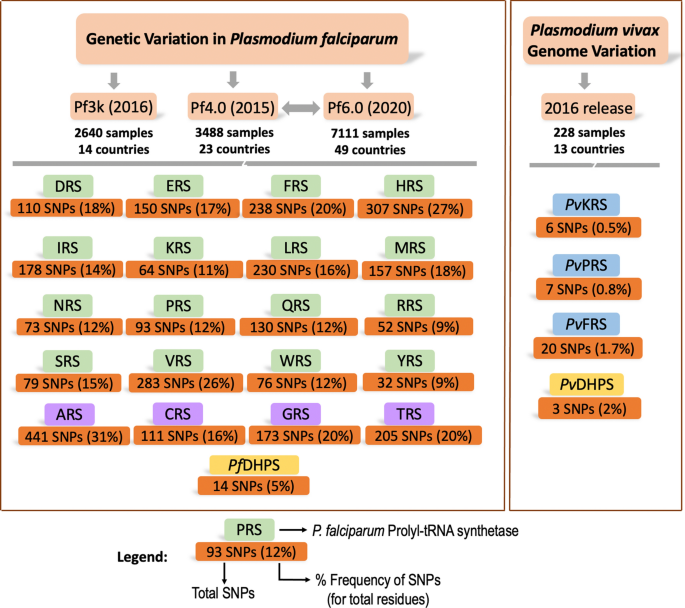
疟疾原单核苷酸多态性数据收集。的恶性疟原虫而且间日疟原虫MalariaGEN的测序项目连同收集的样本数量和在不同地点收集样本的国家数量一起列出(附加文件2:表S2)。总共有9751个独特的恶性疟原虫样本(2640个来自Pf3k项目,7111个来自Pf4.0和Pf6.0项目)。16个细胞质Pf- arss显示在绿色框中,第一个字母对应氨基酸代码(例如:脯氨酸- trna合成酶是PRS)。四个双本地化Pf- arss (ARS, GRS, TRS, CRS)以淡紫色框显示。为间日疟原虫项目,三个细胞质先进光伏- ars (KRS, PRS和FRS)显示在蓝色框中。Pf井下供电和光伏DHPS域显示在黄色框中。每种酶下面的橙色方框显示了总SNPs(氨基酸突变),括号中给出了SNPs的频率百分比[(氨基酸突变总数除以酶中总残基数)× 100]。缩写:aaRS,氨酰基- trna合成酶;DHPS,翼酸二氢合成酶;疟疾基因组流行病学网络;Pf,恶性疟原虫;光伏,间日疟原虫
20中snp的图形表示Pf -aar活动和Pf井下供电领域。一个20[16个细胞质(绿条)中的总snp;4 .双本地化(淡紫色条)]Pf-aaRSs和PfDHPS域(黄色栏)(附加文件1:表S1)。总共有9751个独特的恶性疟原虫样本(2640个来自Pf3k项目,7111个来自Pf4.0和Pf6.0项目)。b20 .氨基酸突变频率百分比Pf-aaRSs和PfDHPS结构域[(氨基酸突变总数除以酶残基总数)× 100]
细胞质SNP谱恶性疟原虫而且间日疟原虫lysyl-tRNA合成酶
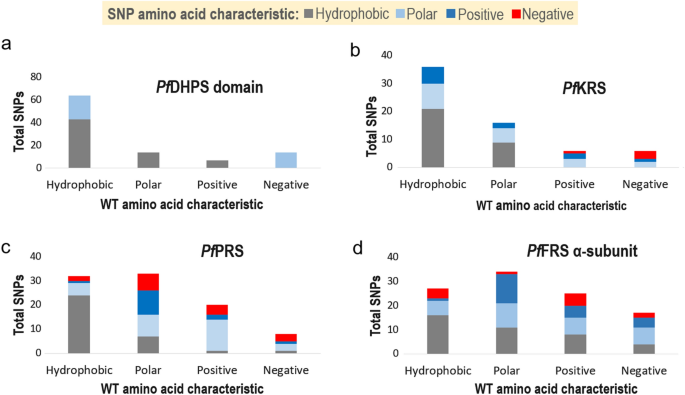
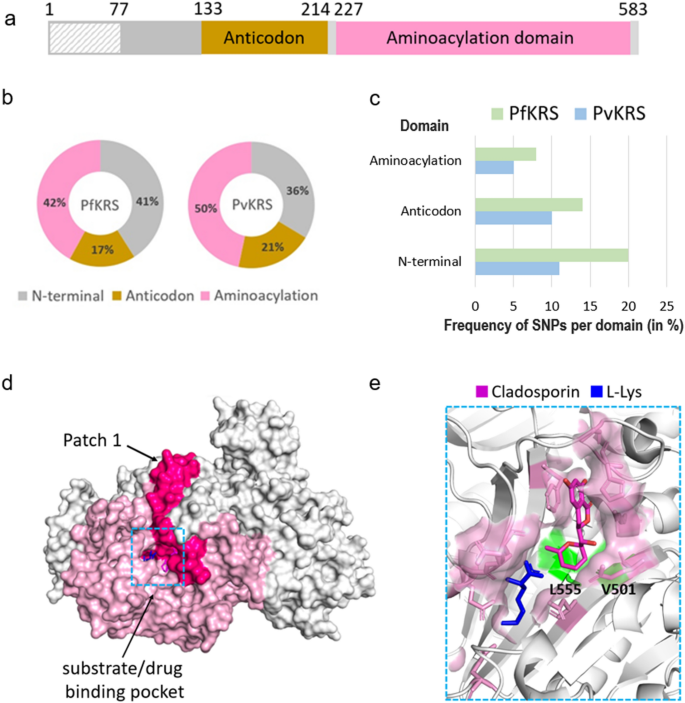
细胞质的三维结构PfKRS与抑制剂克拉多孢素(及其类似物)和淋巴瘤激酶抑制剂和底物复合体l-Lys是可用的[11,12,13,14].所测试的抑制剂,特别是克拉多孢素类似物,与人类的对应物相比,对KRS寄生虫具有选择性[11,12,13,14].PfKRS是一种具有氨基酰化结构域和反密码子结构域的同型二聚体。克拉多孢素通过模仿腺苷与底物结合而占据底物atp结合位点l-Lys与氨基酸结合位点结合[11,12,13,14,30.].我们的分析揭示了64个独特的snpPfKRS(在583个残基中),总体低突变频率为11%(图2)。2,3.;额外的文件3.:表S3)。单个SNPPfKRS发生在少量样本中,即至少在一个样本中,最多在9751个样本中的五个样本中。只有一个保守突变V78M发生在5个样本中。单个样本也只含有1个SNP,但来自冈比亚和埃塞俄比亚的两个样本分别含有2个SNP(分别为K59M和N176S,以及N286K/T和L280I),表明总体遗传变异较低。单核苷酸多态性在PfKRS由不同类型的残基组成,突变为疏水残基或极性残基(图2)。4b).有趣的是,存在几个极性到带电的突变(S3R, T46R, N286K, N355D, N422D, N441H),以及两个电荷从碱性到酸性或相反的突变(K209E, E423K)(图2)。4b;额外的文件3.:表S3)。snp的结构映射PfKRS在n端和氨基酰化结构域分别显示41%和42%的突变,其余突变在反密码子结构域(PDB ID: 4PG3)(图。5a, b).的序列比对Pf基米-雷克南和光伏KRS显示34个相应的突变光伏KRS和间日疟原虫项目鉴定了6个snp光伏KRS,其中3个是前34个中唯一的。有趣的是,紊乱残基1-77有20个突变,所以V78M发生在5个样本中,不能判断为核心或表面突变。氨基酰化结构域的总体突变频率最低(仅为8%)PfKRS和5%光伏KRS),强调催化结构域在结构上非常保守(图。5c).总体而言,~45%的突变是保守的,50%位于灵活的环。基因突变PfKRS在电荷或极性方面主要是碱性的,值得注意的是,突变的极性残基主要是天冬酰胺(图。4b)。
中snp类型的图形表示Pf井下供电,Pf基米-雷克南,PfPRS,PfFRSα亚基。一个- - - - - -d基于snp类型的分布:一个PfDHPS域PfHPPK-DHPS,bPf基米-雷克南,cPfPRS,dPfFRSα亚基。残留物分类为:疏水(甘氨酸、丙氨酸、缬氨酸、亮氨酸、异亮氨酸、脯氨酸、蛋氨酸、苯丙氨酸和色氨酸),极性(丝氨酸、苏氨酸、半胱氨酸、天冬酰胺、酪氨酸和谷氨酰胺),阳性(组氨酸、精氨酸和赖氨酸)和阴性(天冬氨酸和谷氨酸)。显示了残基突变到疏水状态(灰色条)、极性状态(浅蓝色条)或正电荷和负电荷(分别为蓝色条和红色条)的突变总数。缩写:Pf井下供电,恶性疟原虫dihydropyeroate合酶;Pf基米-雷克南,恶性疟原虫lysyl-tRNA合成酶;PfPRS,恶性疟原虫prolyl-tRNA合成酶;PfFRS,恶性疟原虫phenylalanyl-tRNA合成酶
细胞质SNP谱Pfkr。一个域图疟原虫kr。氨基酰化结构域和反密码子结构域分别以粉红色和棕色表示;n端用灰色表示;三维结构中的无序区PfKRS显示为灰色模式。bSNPs(氨基酸突变)在结构域的百分比分布PfKRS(左)和光伏基米-雷克南(右)。c中每个结构域的氨基酸突变频率百分比Pf基米-雷克南和光伏KRS[(氨基酸突变总数除以酶中残基总数)× 100]。d的结构PfKRS二聚体表面(PDB ID: 4PG3)。为简单起见,只有一个单体的氨基酰化结构域呈浅粉色。序列补丁1(氨基酸287-354),没有突变,显示为深粉色。底物/抑制剂结合袋用蓝色框表示。e近景的主要绑定口袋的PfKRS与结合抑制剂克拉多孢素(品红棒)和底物l-Lys(蓝色木棍)。结合残基PfKRS显示为粉红色的棒。位于结合袋中的两个snp, L555I和V501I,显示为绿色表面。缩写:光伏基米-雷克南,间日疟原虫lysyl-tRNA合成酶
氨基酰化结构域287-354残基(图;5d;“Patch 1”)构成了上的最长序列Pf没有突变的KRS,有趣的是涵盖了一半的克拉多孢素和l-Lys相互作用残基。这段延伸围绕着抑制剂结合袋,也包含了大多数同二聚体界面残基。只有一个隐藏的突变M277T/I存在于二聚体界面,与另一个单体的E341形成h键。突变簇(定义为在酶表面相互接近的> 3个突变)不存在Pfkr。所有的克拉多霉素和l-Lys相互作用残基是守恒的。奇怪的是,两种突变V501I和L555I出现在抑制剂结合袋的底部(图5)。5e).需要注意的是,这些突变是保守的疏水突变,并且每个突变只出现在一个样本中(分别来自毛里塔尼亚和坦桑尼亚的样本)。因此,这两种突变的频率非常低。距离结合袋5 Å以内的一个遥远SNP N286K/T似乎对结合袋的外围表面没有影响。N286K是仅有的两个有两个snp的样本中共存的突变之一。此外,在先前的研究中发现的残基F342、R559、K499和F563 [12]参与构象变化,是守恒的。在之前的研究中显示,V328和S344残基可使药物进入结合袋[11],也是保守的。最后,三种保守的II类母题疟原虫与人类的KRS [11], 276-PMMLI-281, 329-FRNE-332和557-ID-559是保守的,除了第一个基序中的一个突变M277I/T。
细胞质SNP谱恶性疟原虫而且间日疟原虫prolyl-tRNA合成酶
细胞质的三维结构PfPRS与抑制剂halofuginone的复合物可用(PDB ID: 4YDQ) [15,16,17].PfPRS是一种二聚体,由氨基酰化、编辑、反密码子和锌结合域组成(图。6一个)。PfPRS与halofuginone结合,halofuginone是一种成熟的双位点抑制剂,它与tRNA位点的3 '端和脯氨酸位点结合,而ATP类似物与ATP位点结合[15,16,17].几种卤代黄酮类类似物已被证明对寄生虫有更好的选择性和更高的治疗指数[17].此外,卤黄酮可用于协同药物联合方法,如已证明的对抗寄生虫中的PRS刚地弓形虫(31].我们的分析揭示了93个独特的snpPfPRS(在746个残基中),总体突变频率较低,为12%。(无花果。2,3.;额外的文件3.:表S3)。另有47个相应的突变光伏PRS和另外7个间日疟原虫其中,有5个项目与前47个项目相比是独特的(图2)。2,3.)。SNPs至少出现在一个样本中,最多出现在2080个样本中(总共9751个样本中)Pf其中有3个突变的发生率特别高:F72I(51个样本)、V186I(174个样本)和V36I(2080个样本)。这三个突变是保守的疏水突变,位于n端/编辑域的无序区(氨基酸1-250)。大多数样本只有一个SNP,只有173个样本同时存在两个突变,即F72I和V186I和/或V36I。单核苷酸多态性在PfPRS主要是疏水到疏水,疏水到极性和/或极性到疏水。有趣的是,与PfKRS,涉及天冬酰胺/谷氨酰胺的极性到带电突变(N109D, Q111H, N138K, Q140R, N261K, Q395K, N416D, Q700R)存在。此外,碱性电荷和酸性电荷之间的开关发生了两种突变(K92E, D561H)(图。4c)。Pf与之相比,PRS具有更高数量的非保守性突变Pf基米-雷克南(无花果。4)。snp的结构映射PfPRS显示,在氨基酰化、反密码子和锌结合结构域分别有14%、12%和11%的突变。6a, b)。光伏与之相比,PRS在催化区域有更高数量的突变PfPRS。结构域分布显示在氨酰化结构域有13个snpPfPRS,即只有5%的频率,表明高度保守的催化结构域(图。6c).相比之下,20%的snp出现在光伏PRS氨基酰化结构域。
细胞质SNP谱PfPRS。一个域图疟原虫PRS。氨基酰化、反密码子和锌结合结构域分别显示为粉红色、棕色和桃红色;编辑域显示为灰色;三维结构中的无序区PfPRS显示为灰色图案。b的结构域上氨基酸突变的百分比分布PfPRS(左)和光伏PRS(右)。c中每个结构域的氨基酸突变频率百分比PfPRS,光伏PRS[(氨基酸突变总数除以酶中残基总数)× 100]。d的结构PfPRS二聚体表面(PDB ID: 4YDQ)。为简单起见,只有一个单体的氨基酰化结构域呈浅粉色。两个没有突变的残基序列斑块(氨基酸291-368 [Patch 1]和氨基酸418-490 [Patch 2])分别以洋红色和紫粉色表示。底物/药物结合袋用蓝色方框表示。e近景的主要绑定口袋的PfPRS与抑制剂halofuginone(洋红色棒)和atp类似物(橙色棒)结合。洋红色表示的是脯氨酸和trna结合口袋,它被卤代黄酮占据。黄色表示atp模拟占用的atp绑定口袋。SNPs(绿色)位于主绑定袋的> 8 Å。缩写:光伏PRS间日疟原虫prolyl-tRNA合成酶
PfPRS在其氨基酰化区域包含两个序列延伸,没有突变(图。6d).第一个延伸(氨基酸291-368,“Patch 1”)(图;6d)只有一个保守突变,E312D,它也包括316-351残基,这些残基参与了“坍塌构象”,赋予了一个特征的不对称同二聚体界面[15)PfPRS(无花果。6d).第二个延伸(氨基酸418-490,“Patch 2”)(图。6d)只包含SNP G455A。有趣的是,这两个无突变的延伸都位于药物/底物结合口袋附近(图2)。6d).除了位于氨基酰化结构域末端连接到反密码子结构域的4个突变簇(P369S, Y375H, R376S, N498T)外,其余snp均位于氨基酸酰化结构域上PfPRS曲面大多为奇异曲面。分析表明,卤黄酮和atp类似物相互作用残基具有高度的守恒性(图2)。6e).此外,人类PRS在c端锌结合域的两个关键的锌螯合半胱氨酸残基被丝氨酸(S732)和苏氨酸(T686)所取代疟原虫(17]也是保守的。
细胞质SNP谱恶性疟原虫而且间日疟原虫phenylalanyl-tRNA合成酶
苯丙酰- trna合成酶(FRS)疟原虫作为α-和β-亚基的异源二聚体存在,它们的序列有显著差异[18].的α-亚基疟原虫FRS含有氨基酰化结构域,而β亚基含有编辑结构域(图2)。7) (18].在复合体中光伏FRS与选择性抑制剂双环氮叠丁BRD1389结合,药物结合区仅位于α-亚基,BRD1389占据底物l-Phe结合位点和辅助位点[18].我们的分析PfFRS α-亚基的575个残基中显示出103个独特的snp,总体频率为18%(附加文件)3.:表S3)。SNPs的结构映射光伏FRS α-亚基显示突变最多位于n端区域(氨基酸1-271),该区域目前结构紊乱,约25%的突变位于氨基酰化结构域(PDB ID: 7BY6)(图2)。7b, c).某一特定SNP至少出现在一个样本中,最多出现在266个样本中(总共9751个样本),特别是在大量样本中出现了3个突变:T377I(266个样本)、E50K(23个样本)和N11S(23个样本)。此外,每个样本只有一个SNP,除了来自马里、加纳和冈比亚的三个样本各有两个SNP: E28V和I469V;N53K和S81T;N151S和I469V。在PfFRS α-亚基差异较大,疏水-疏水、疏水-极性、极性-疏水、带电-疏水/极性突变频率相似。值得注意的是,不像Pf基米-雷克南和PfPRS中,极性到带电,疏水性到带电,以及电荷突变切换的频率较高PfFRS α-亚基(图;4)。的PfFRS α-亚基n端突变频率最高,在氨基酰化区突变频率为20%(图2)。7c). α-亚基氨基酰化结构域的突变中,约50%为保守突变,大部分位于环区。此外,在基因中也有51个突变光伏FRS α-亚基,另有5个突变从间日疟原虫项目,位于无序的n端。的PfFRS β-亚基没有催化结构域,有135个独特的snp, 617个残基的总频率为22%(图2)。7b, c)PfFRS β-亚基,在1 ~ 99个样本中出现单个SNP,以A35T和K617Q出现频率最高。的光伏FRS β亚基有73个突变和另外15个独特的突变间日疟原虫项目。β-亚基突变的最大数量存在于β-薄片中,而α-亚基突变通常呈环状。
细胞质SNP谱PfFRS和光伏FRS。一个α-亚基的结构域图恶性疟原虫FRS.催化(氨基酰基化)结构域和PA2结构域分别显示为粉红色和棕色;n端为灰色;三维结构中的无序区光伏FRS显示为灰色模式。β-亚基结构域图恶性疟原虫FRS.催化类结构域和编辑结构域分别为浅粉色和棕色。b氨基酸突变的百分比分布在α-和β-亚基的结构域PfFRS(左)和光伏FRS(右)。cα-和β-亚基中每个结构域的氨基酸突变频率百分比PfFRS和光伏FRS[(氨基酸突变总数除以酶中残基总数)× 100]。d的结构光伏FRS异源二聚体(PDB ID: 7BY6)。α-和β-亚基用灰色表示;α-亚基的氨基酰化结构域呈粉红色;无突变的3个残基序列斑块[α-亚基(氨基酸F313-K401;Patch 1)和β-亚基中的两个氨基酸(氨基酸D495-R549 [Patch 2]和氨基酸E567-M617 [Patch 3])分别以深粉色、洋红色和橙色显示。蓝框表示α-亚基中的底物/抑制剂结合袋。e特写视图的绑定口袋光伏FRS与抑制剂BRD1389结合(黄棒所示)。的l-Phe绑定袋和辅助部位分别用洋红色和橙色表示。ATP结合袋用蓝色表示。缩写:光伏FRS间日疟原虫phenylalanyl-tRNA合成酶
有三个序列延伸段没有突变光伏FRS在α-亚基(氨基酸313-401)中延伸最长(图。7d,“Patch 1”)和β-亚基中的两个(氨基酸495-549和氨基酸567-617)(图。7d,“补丁2”和“补丁3”)。α-亚基拉伸从一侧包围着抑制剂结合袋,也是α-和β-亚基之间二聚体界面的重要贡献者。二聚体界面残基均未见突变。无序的α-亚基n端(氨基酸1-271)可以帮助破译完整的异二聚体界面光伏而且,所有的突变都是单独分散的,表面没有明显的聚类。此外,抑制剂BRD1389相互作用残基光伏FRS显示非常高的守恒(图;7e).一个环(氨基酸443-453),位于ATP结合袋中,并“打开”以启用BRD1389 [18结合被认为是保守的。位于辅助口袋中的第二个环(氨基酸507-515)“关闭”以使结合具有一个突变(A453S;疏水性到极性),而且只在一个样本中看到(来自马拉维)。这种A-to-S突变保留了小的侧链,从而避免了任何可能阻碍配体进入的障碍。最后,结合袋附近的四个残基M310、L544、V339和G506已知对双环氮叠丁具有抗性[18],也是保守的。
经验证的arss的药物结合区域相对保守恶性疟原虫井下供电
耐药引起的DHPS结构域突变疟原虫HPPK-DHPS已得到完善[26,28,29],我们的SNP分析进一步证实了这些突变的存在Pf在大多数被分析样品中存在DHPS结构域;但是,总体突变频率为PfDHPS畴仅占4%(图;8a).相比之下,arss中的药物结合区域具有很高的保守性。在PfKRS,抑制剂cladosporin(覆盖atp结合位点)和底物l-除了两个保守突变V500I和L555I外,lys结合区域表现出高度的保守性,这两个突变都存在于cladosporin结合位点,但只出现在极少数的样本中(图5)。8b).的抑制剂halofuginone的结合区域(覆盖tRNA位点和氨基酸脯氨酸位点的3 ' - '端)PfPRS是高度保守的,最近的突变在~8 Å(图。8c).同样,抑制剂双环氮化丁BRD1389的结合区域(覆盖氨基酸苯丙氨酸位点和辅助位点)在光伏FRS高度保守,距离最近的突变在~12 Å(图。8d).对药物靶点aars的SNPs序列和结构进行评估,并与DHPS结构域进行比较(DHPS结构域的耐药突变已经已知),这对于证实aars作为成功药物靶点的前景至关重要。
字段隔离数据Pf当大多数样品中已检测到抗性突变时,DHPS结构域可用;很难评估在药物引入之前,该区域是否已经存在其他非活性位点突变[29,32].对抗疟药物的耐药性仍然是一个重大问题。最终可能会形成对寄生虫arss抑制剂的耐药性;然而,对寄生虫FRS的研究表明,在疟疾寄生虫中产生耐药性突变的趋势较低[33].通过使用药物联合方法,预期的耐药可以延迟或部分预防,其中aaRSs抑制剂可能是药物鸡尾酒的一个有前途的部分。
结论
评估经验证的抗疟药物靶点中由snp引起的遗传变异对于了解耐药性的可能性和证实其验证以实现改进的药物设计至关重要。氨酰基- trna合成酶(aaRS)是疟疾寄生虫中蛋白质合成所必需的酶,已得到验证并成为有效的抗疟疾靶标。我们的SNP分析恶性疟原虫而且间日疟原虫来自MalariaGEN的arss涉及来自50多个国家的9751个基因组序列,在20个细胞质中发现了3182个独特的snp恶性疟原虫不同aars的突变频率为9 ~ 31%。在本研究中,三种最先进的抑制剂/底物结合的细胞质aars上的snp的结构定位,即Pf基米-雷克南,PfPRS,光伏FRS在药物/底物结合区域具有很高的保守性,在关键的氨基酰化结构域整体突变频率较低,在单个样品中SNP发生率较低。相比之下,PfDHPS域PfHPPK-DHPS是另一种已确定耐药的关键寄生酶,尽管其整体SNP频率较低,但显著显示出导致耐药的突变。本研究强调了从全球数据库中筛选抗疟疾药物靶点(如针对SNPs的氨酰基- trna合成酶)对评估全球遗传多态性的重要性。了解这些差异是加强针对已验证靶点的药物设计和对抗抗疟药物耐药性的关键。
数据和材料的可用性
支持本文结论的数据集已在MalariaGEN (www.malariagen.net)。(i) [Pf3k项目(2016):试点数据发布5英寸https://www.malariagen.net/apps/pf3k/release_3/index.html] (ii) [恶性疟原虫社区项目-遗传变异目录v6.0 inftp://ngs.sanger.ac.uk/production/malaria/pfcommunityproject/Pf6/Pf_6_vcf/]和遗传变异目录v4.0 inhttps://www.malariagen.net/apps/pf/4.0/].(3) (间日疟原虫基因组变异2016年5月数据发布https://www.malariagen.net/apps/pvgv/index.html].本研究的分析材料如Excel文件可根据合理要求从通讯作者处获得。
缩写
- aar活动:
-
氨酰合成酶
- 行为:
-
以青蒿素为基础的联合疗法
- 井下供电:
-
Dihydropteroate合酶
- MalariaGEN:
-
疟疾基因组流行病学网络
- SNP:
-
单核苷酸多态性
- 对有关:
-
磺胺多辛
- tRNA:
-
转移核糖核酸
- 3 d:
-
三维
参考文献
谁。2022年疟疾。。https://www.who.int/news-room/fact-sheets/detail/malaria.2021年9月20日访问。
Shibeshi MA, Kifle ZD, Atnafie SA。抗疟药物耐药性和抗疟药物发现的新靶点。感染耐药性,2020;13:4047-60。
Balikagala B,福田N,池田M, kaaturo OT,立花SI,山内M,等。非洲存在抗青蒿素疟疾的证据。中华医学杂志,2005;
杨涛,otilie S, Istvan ES, Godinez-Macias KP, Lukens AK, Baragaña B,等。MalDA,加速疟疾药物的研发。寄生虫学杂志,2021;37:493-507。
具有新靶点的新型抗疟药物开发的最新进展。中国医药科学。2020;14:3875-89。
姚平,陈晓明,陈晓明。氨酰基trna合成酶在医学和疾病中的应用。EMBO Mol medical . 2013; 5:332-43。
Bhatt TK, Kapil C, Khan S, Jairajpuri MA, Sharma V, Santoni D,等。疟原虫中氨酰基- trna合成酶的基因组一瞥恶性疟原虫.BMC基因组学。2009;10:644。
Pham JS, Dawson KL, Jackson KE, Lim EE, Pasaje CF, Turner KE,等。氨酰基- trna合成酶作为真核寄生虫的药物靶点。中国寄生虫病杂志。2014;4:1-13。
马尼卡姆,李志刚,李志刚,李志刚。疟原虫氨酰基- trna合成酶靶向药物的研究进展恶性疟原虫.今日毒品发现。2018;23:1233-40。
王晓明,王晓明,王晓明,等。疟原虫氨酰基- trna合成酶的结构分析为抗疟药物的开发提供了新的途径。中国生物工程学报(自然科学版);
杨晓明,王晓明,王晓明,杨晓明。cladosporin抑制疟原虫赖氨酸- trna合成酶的研究进展。中国生物医学工程学报。2014;
Sharma A, Sharma M, Yogavel M, Sharma A.蛋白质翻译酶lysyltRNA合成酶为开发抗卢瓦病和血吸虫病病原体的药物提供了一个新靶点。PLoS negel Trop, 2016;10:e0005084。
张晓东,张晓东,张晓东,等。抑制恶性疟原虫通过哌啶环支架激发克拉多孢素类似物的赖氨酸- trna合成酶。ChemBioChem。2021; 22:2468 - 77。
周健,黄忠,郑林,黑智,王忠,于波,等。抑制恶性疟原虫赖氨酸- trna合成酶通过间变性淋巴瘤激酶抑制剂。核酸res 2020; 48:11566-76。
贾恩,李志刚,李志刚,李志刚。抗疟疾药物靶蛋白脯氨酸- trna合成酶的结构和功能分析。中国生物医学工程学报。2014;
Jain V, Yogavel M, Oshima Y, Kikuchi H, Touquet B, Hakimi MA,等。脯氨酸- trna合成物-卤黄酮复合物的结构为疟疾和弓形虫病药物的开发提供了基础。结构。2015;23:819-29。
贾恩V,约格维尔M,菊池H,大岛Y, Hariguchi N,松本M,等。以脯氨酸- trna合成酶为靶点,加速针对疟疾、利什曼病、弓形虫病、隐孢子虫病和球虫病的药物研发。结构。2017;25:1495 - 1505. - e6。
沙玛M,马尔霍特拉N,约格维尔M,哈洛斯K,梅利洛B,科默E,等。双环氮叠丁抑制疟原虫苯丙氨酸trna合成酶的结构基础。Nat Commun. 2021;12:343。
疟疾基因组流行病学网络。疟疾基因组流行病学调查全球网络。大自然。2008;456:732-7。
MalariaGEN。Pf3K项目:试点数据发布2015.http://www.malariagen.net/data/pf3k-3.2021年9月20日访问。
曼斯克,Miotto O, Campino S, Auburn S, Almagro-Garcia J, Maslen G,等。分析恶性疟原虫深度测序自然感染的多样性。分析恶性疟原虫深度测序自然感染的多样性。大自然。2012;487:375-9。
疟疾根,Ahouidi A, Ali M, Almagro-Garcia J, Amambua-Ngwa A, Amaratunga C,等。全球7000个恶性疟原虫基因组变异的开放数据集。威康开放决议2021;6:42。https://doi.org/10.1186/s13071-022-05422-4.
Pearson RD, Amato R, Auburn S, Miotto O, Almagro-Garcia J, Amaratunga C,等。植物局部变异和近期进化的基因组分析间日疟原虫.Nat Genet, 2016; 48:959-64。
王晓明,王晓明,王晓明,等。VAR2CSA配体结合域突变及其对胎盘疟疾疫苗的影响。国际传染病杂志2021;112:35-9。
米塔尔P, Mishra S, Kar S, Pande V, Sinha A, Sharma A.单氨基酸多态性的全球分布间日疟原虫达菲结合样畴及其对疫苗开发工作的影响。开放生物学2020;10:200180。
丁宁JG,威尔逊C,考曼AF.二氢翼酸合成酶突变是导致砜和磺胺抗性的原因恶性疟原虫.美国国家科学研究院。1997; 94:13944-9。
约格维尔M,荨麻船JE,夏尔马A,哈洛斯K,贾姆瓦尔A,查图维迪R,等。6-羟甲基-7,8-二氢蝶呤焦磷酸激酶-二氢蝶呤合酶的结构间日疟原虫揭示了耐药性。中国生物化学杂志,2018;
陈志伟,陈志伟,陈志伟,等。的结构恶性疟原虫羟甲基二氢蝶呤焦磷酸酶-二氢蝶酸合成酶揭示了耐磺胺性的基础。Febs j . 2020; 287:3273-97。
Chaturvedi R, chhibbe - goel J, Verma I, Gopinathan S, Parvez S, Sharma A.磺胺多辛-乙胺嘧啶耐药疟疾寄生虫的地理分布及结构基础。中国寄生虫学杂志。2021;51:5 5 - 25。
Khan S, Garg A, Camacho N, Van Rooyen J, Kumar Pole A, Belrhali H,等。疟原虫赖氨酸- trna合成酶的结构分析为药物开发提供了平台。中国生物医学工程学报,2013;
马尼卡姆Y,马尔霍特拉N,米什拉S, Babbar P, Dusane A, Laleu B,等。脯氨酸- trna合成酶双给药为抗感染药物的开发提供了新的思路。PLoS Pathog. 2022;18:e1010363。
布鲁克斯DR,王鹏,里德M,沃特金斯WM,西姆斯PF,海德JE。人疟原虫中羟甲基二氢蝶呤焦磷酸激酶:二氢蝶呤合成酶基因的序列变异恶性疟原虫,对磺胺多辛的抗性不同。《生物化学学报》,1994;24:3 7 - 5。
加藤N,科默E,坂田加藤T,夏尔马A,夏尔马M,等。面向多样性的合成产生新型多级抗疟抑制剂。大自然。2016;538:344-9。
确认
作者感谢印度科技部为AS提供JC Bose国家奖学金。
资金
一个也没有。
作者信息
作者及隶属关系
贡献
AS构思了这项研究。JG收集并分析了数据,并编制了数字。JG和AS撰写了最终的手稿。两位作者都阅读并批准了最终的手稿。
相应的作者
道德声明
伦理批准并同意参与
不适用。
发表同意书
不适用。
相互竞争的利益
作者宣称他们之间没有利益冲突。
额外的信息
出版商的注意
伟德体育在线施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
补充信息
附加文件1:表S1。
详细的有20个细胞质和4个双定位疟原虫氨酰基- trna合成酶和疟原虫HPPK-DHPS。
附加文件2:表S2。
在多个地点为MalariaGEN项目Pf3k、Pf4.0、Pf6.0和间日疟原虫2016年释放。
附加文件3:表S3。
来自MalariaGEN项目的SNPs和相应的氨基酸变化(Pf3k, Pf4.0, Pf6.0和间日疟原虫2016年发布)在细胞质恶性疟原虫而且间日疟原虫赖氨酸-,脯氨酸-和苯丙酰- trna合成酶和恶性疟原虫而且间日疟原虫HPPK-DHPS。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条所提供的资料,除非在资料的信用额度中另有说明。
关于本文
引用本文
吉尔,J.,夏尔马,A.疟疾寄生虫药物靶点单核苷酸多态性的基因组分析。寄生虫向量15, 309(2022)。https://doi.org/10.1186/s13071-022-05422-4
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s13071-022-05422-4
关键字
- 氨酰合成酶
- 单核苷酸多态性
- 赖氨酸,-脯氨酸和苯丙酰- trna合成酶
- 场隔离
- MalariaGEN