摘要
中东呼吸综合征冠状病毒(MERS-CoV)的持续爆发继续对全球健康构成威胁。为防止中东呼吸综合征冠状病毒在动物中传播并可能向人类溢出,建议对家畜水库物种进行疫苗接种。利用模仿自然发生的病毒传播的直接接触美洲驼挑战模型,我们测试了基于多聚体受体结合域(RBD)颗粒显示的候选疫苗的有效性。虽然MERS-CoV传播给naïve只暴露于接种过病毒的大羊驼的动物,但免疫接种诱导了强有力的病毒中和抗体反应,并在三分之一接种过疫苗的接触动物中阻止了传播。我们的探索性研究支持进一步改进基于rbd的疫苗,以防止MERS-CoV的人畜共患外溢。
主要内容
中东呼吸综合征冠状病毒与人类严重肺炎和致命疾病有关,中东地区病死率很高[1].该病毒仍然构成公共卫生关切,因为已记录了来自主要感染源单峰骆驼的持续人畜共患传播事件,以及几起与旅行有关的重大疫情[2].
单峰骆驼是主要的宿主,尽管美洲驼和羊驼等其他骆驼物种也容易感染中东呼吸综合征冠状病毒[3.,4,5,6,7,8,9,10].与人类不同,骆驼在MERS-CoV感染后会经历轻度至亚临床感染,其特征是上呼吸道复制和病毒在感染后1-2周内迅速清除[11,12].骆驼中发生的强大而及时的先天免疫反应可能在控制中东呼吸综合征冠状病毒感染和疾病发展中发挥关键作用[4].重要的是,有鼻分泌物的动物和无症状携带者会释放大量中东呼吸综合征冠状病毒[3.,5,11,12],这可能会对人类造成潜在的溢出效应。
迄今为止,缺乏针对中东呼吸综合征冠状病毒的商业疫苗和治疗方法,世界卫生组织已建议将动物疫苗接种作为控制中东呼吸综合征冠状病毒向动物和人类传播的一种策略。[13].已经在骆驼身上测试了不同的疫苗原型来对抗中东呼吸综合征冠状病毒,所有这些原型都集中在刺突(S)蛋白的全长或特定区域[5,12,14,15].该蛋白通过与宿主细胞受体二肽基肽酶-4结合来介导病毒进入[16]以及随后病毒和细胞膜的融合。刺突蛋白具有高度免疫原性,是中和抗体的主要靶点,因此是开发针对中东呼吸综合征冠状病毒和其他贝塔冠状病毒的疫苗的首选抗原[17].表达全长S蛋白的病毒载体疫苗可诱导部分免疫,在某些情况下,当暴露于中东呼吸综合征冠状病毒时,可减少单峰骆驼的鼻漏和病毒脱落[12,15].重要的是,在对血清呈阳性的动物接种一次疫苗后,观察到中和抗体(nAb)滴度增加,导致接触自然感染的骆驼后病毒RNA的排泄量最低[15].这一事实具有特殊的相关性,因为在中东发现的血清阳性骆驼的患病率很高。基于S1亚基的重组蛋白候选疫苗也被建议用于骆驼[14].三次接种基于s1的原型疫苗可使羊驼对中东呼吸综合征冠状病毒产生完全保护,并在单峰骆驼鼻内挑战后延迟和减少传染性病毒脱落3天[14].宿主物种之间保护效力的差异可能是由对疫苗的不同反应所解释的,这一点由所引起的naabs水平所证明[14].此外,为了模拟野外发生的自然传播,我们先前开发了直接接触美洲驼传播挑战模型,以证明重组s1蛋白疫苗能够阻断中东呼吸综合征冠状病毒在骆驼类中的传播[5].
在这里,我们使用相同的直接接触模型来评估病毒样颗粒疫苗在阻断MERS-CoV在美洲驼中的传播的有效性。该疫苗由表达MERS-CoV S蛋白受体结合域(RBD)的自组装多聚体蛋白支架颗粒(MPSP)组成[18].与其他多价和单体重组疫苗相比,MPSP疫苗原型允许抗原自组装成60 mer颗粒,并提供增强的免疫反应[18,19,20.].事实上,所提出的疫苗原型诱导了强烈的保护性免疫反应,减少了实验感染兔子上呼吸道和下呼吸道的MERS-CoV复制[18].由于兔子在接种中东呼吸综合征冠状病毒后不会像人类那样出现严重疾病,也不会像骆驼宿主那样出现高病毒分泌物的亚临床感染[21],本研究为在骆驼类动物中测试MPSP-RBD疫苗原型提供了理论依据。
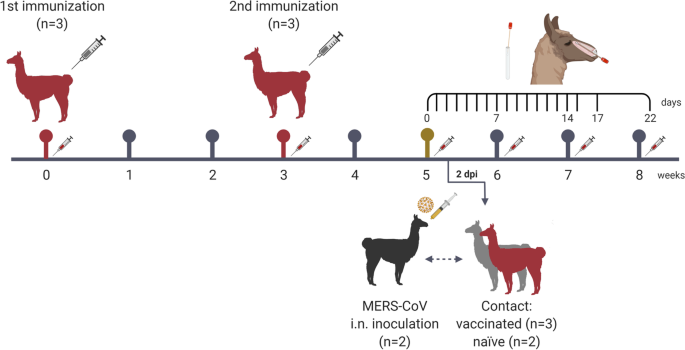
根据先前模拟野外条件测试疫苗效力的实验设计[5],一组三头大羊驼接种了两剂量的MPSP-RBD,并结合注册的佐剂(图2)。1,补充材料和方法).在进行初级和强化免疫后,接种疫苗(n= 3)和佐剂对照给药动物(n= 2)直接接触naïve大羊驼(n= 2)感染中东呼吸综合征冠状病毒(见附加图)。1).在将两组混合在一起的两天前,naïve羊驼接种了MERS-CoV Qatar15/2015株,一种分支B株被证明可以有效复制,并在骆驼骆驼之间直接接触传播[4,5].监测临床体征和体温,收集鼻拭子进行病毒学研究,如图所示。1并在补充材料和方法.
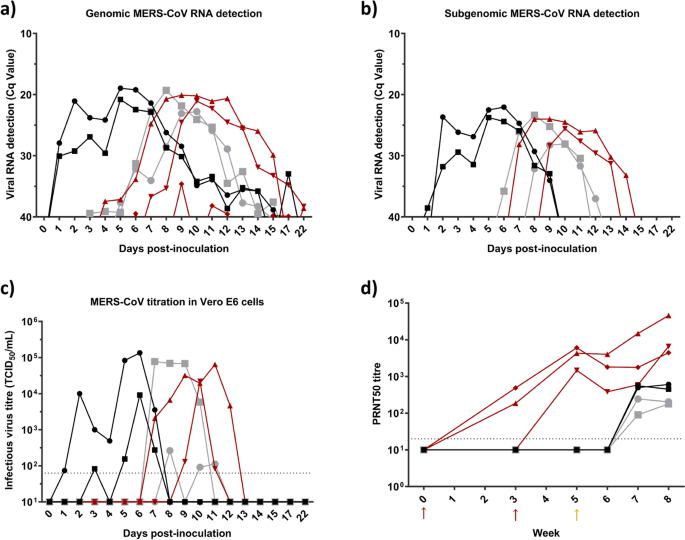
在整个研究过程中,所有动物的直肠温度保持在基础温度(37-40°C)。2a).接种的大羊驼在接种后的任何一天(dpi)均无临床症状。一种接触控制动物在5-9 dpi时出现中度鼻漏,一种接种动物在8 - 19 dpi时出现中度鼻漏(附加图)。2B和c)。如先前报道[5],接种mers - cov的大羊驼在鼻拭子中检测到基因组和亚基因组病毒RNA,持续2周(图2)。2a和b),在接种后的第一周内脱落高滴度的传染性病毒(图。2c).从感染后2周开始检测到这些动物的MERS-CoV和nab血清转化(图。2d).通过RT-qPCR和细胞培养中的病毒滴定测定,MERS-CoV在5-7 dpi时传播给所有佐剂施用的动物和三分之二的接种疫苗的接触动物(图。2a, b和c)。除了一只接种了疫苗的美洲驼外,所有动物在病毒RNA和传染性病毒脱落的持续时间和水平上都具有相似的特征(图。2a, b和c)。这些结果与先前在接种动物和naïve接触动物中获得的结果相当[5];因此,在目前的研究中观察到的个体差异可能解释了接种疫苗和对照接触动物的病毒脱落模式的微小差异。其余接种疫苗的接触美洲驼被保护免受中东呼吸综合征冠状病毒感染。在实验过程中,只在该动物的鼻拭子中检测到少量的MERS-CoV基因组RNA,证明其暴露于病毒(图2)。2a)。此外,在研究的任何时间点,在接种了疫苗的羊驼中都没有检测到亚基因组RNA,而且动物没有释放传染性病毒(图。2b和c)。此外,所有接种和接触的naïve大羊驼对MERS-CoV产生了相当的中和性体液反应(图。2d). MPSP-RBD疫苗接种诱导血清中病毒nab的高滴度,3只动物中有2只在接触mers - cov接种的大羊驼后三周内产生高滴度的传染性病毒(图。2d).因此,MPSP-RBD候选疫苗能够部分预防MERS-CoV在骆驼中的传播,在本探索性研究中接种的动物中有1/3有效。
骆驼MERS-CoV RNA与感染性病毒脱落及中和抗体的研究实验感染的大羊驼(黑色)与naïve(灰色)接触,并在接种MERS-CoV两天后接种了疫苗(红色)。基因(一个)和亚基因组(b)在接种MERS-CoV后不同时间采集的鼻拭子标本中定量检测病毒RNA。图(c)显示接种MERS-CoV后不同天数收集的鼻拭子的感染性MERS-CoV滴度。图(d)显示接种疫苗、实验接种和接触naïve羊驼中引发的针对MERS-CoV的血清中和抗体。每条线代表一种动物。虚线表示检测限。红色和黄色箭头分别表示MPSP-RBD免疫和MERS-CoV接种的2天。Cq,量化周期;中东呼吸综合征冠状病毒;PRNT50, 50%斑块减少中和滴度;TCID50, 50%组织培养感染剂量
基于mpsp显示的免疫原提供的增强免疫反应和MPSP-RBD疫苗原型对MERS-CoV的体内保护能力[18],我们评估了它在骆驼水库中抑制MERS-CoV传播的潜力。用商业佐剂配制的MPSP-RBD免疫诱发了对MERS-CoV的免疫应答,但仅在1/3的动物中阻止了传播。由于在骆驼中发现了高MERS-CoV血清流行率和再感染的证据[22],还需要进一步的研究来调查MPSP-RBD是否能增强对MERS-CoV的足够保护性免疫反应,并降低先前暴露动物的传播率。与形成三聚体构象的原型或与其他S亚基的组合相比,MPSP显示的单体RBD可能诱导较低的保护反应,使用相同佐剂和给药途径的先前候选疫苗的高效证明了这一点[5].尽管如此,MPSP-RBD预防MERS-CoV动物间传播以及最终人类外溢的能力似乎有限。
数据和材料的可用性
本研究中使用和/或分析的数据集可根据合理要求从通讯作者处获得。
缩写
- dpi:
-
接种后天数
- MERS-CoV:
-
中东呼吸综合征冠状病毒
- MPSP:
-
多聚体蛋白支架颗粒
- 小伙子:
-
中和抗体
- RBD:
-
受体结合域
- 史:
-
斯派克
参考文献
世界卫生组织(卫生组织)。中东呼吸综合征情况更新- 2021年8月。2021.(https://applications.emro.who.int/docs/WHOEMCSR451E-eng.pdf?ua=1).
Kim KH, Tandi TE, Choi JW, Moon JM, Kim MS. 2015年韩国中东呼吸综合征冠状病毒(MERS-CoV)暴发:流行病学、特征和公共卫生影响中华流行病学杂志,2017;29 (2):344 - 344 (https://www.sciencedirect.com/science/article/pii/S0195670116304431).
维格拉- alert J, van den Brand JMA, Widagdo W, Muñoz M, Raj S, Schipper D,等。家畜对中东呼吸综合征冠状病毒感染的易感性中国传染病杂志,2017;23(2):232。
Te N, Rodon J, Ballester M, Pérez M, Pailler-García L, Segalés J,等。由鼻上皮细胞产生的I型和III型ifn和炎症减弱是羊驼解决MERS-CoV感染的特征。公共科学图书馆。2021;17(5):e1009229。
Rodon J, Okba NMA, Te N, van Dieren B, Bosch B-J, Bensaid A,等。通过接种重组刺突蛋白阻断中东呼吸综合征冠状病毒在美洲驼中的传播。新兴微生物感染,2019;8(1):1593-603。
Reusken CBEM, Schilp C, Raj VS, De Bruin E, Kohl RHG, Farag EABA,等。中东呼吸综合征冠状病毒流行地区羊驼感染情况新兴感染杂志,2016;22(6):1129 (https://wwwnc.cdc.gov/eid/article/22/6/15-2113_article).
张晓东,张晓东,张晓东,等。在自然暴露的以色列大羊驼、羊驼和骆驼中发现中东呼吸综合征冠状病毒特异性抗体。同一个健康,2018;5:65-8。
李志强,李志强,李志强,等。中东呼吸综合征冠状病毒对羊驼的实验感染及复攻反应。新兴感染杂志2016;22(6):1074 - 4。
Adney DR, Bielefeldt-Ohmann H, Hartwig AE, Bowen RA。中东呼吸综合征冠状病毒在羊驼中的感染、复制和传播。新兴感染杂志,2016;22(6):1031-7。
Sabir JSM, Lam TTY, Ahmed MMM, Li L, Shen Y, Abo-Aba SEM,等。沙特阿拉伯三种骆驼冠状病毒的共循环和mers - cov的重组。科学。2016;351(6268):81 - 4。
Adney DR, van Doremalen N, Brown VR, Bushmaker T, Scott D, de Wit E,等。MERS-CoV在接种单峰骆驼上呼吸道的复制和脱落。新兴感染杂志2014;20(12):1999-2005。
Haagmans BL, van den Brand JMA, Raj VS, Volz A, Wohlsein P, Smits SL,等。一种基于正痘病毒的疫苗可减少单峰骆驼感染中东呼吸综合征冠状病毒后的病毒排泄。科学。2016;351(6268):77 - 81。
世卫组织世卫组织中东呼吸综合征冠状病毒疫苗目标产品简介,2017。(http://www.who.int/blueprint/what/research-development/MERS_CoV_TPP_15052017.pdf).
Adney RD,王玲,van Doremalen N,史伟,张勇,孔文鹏,等。佐剂中东呼吸综合征冠状病毒刺突蛋白疫苗对单峰骆驼和羊驼的疗效。病毒。2019;11:212。
Alharbi NK, Qasim I, Almasoud A, Aljami HA, Alenazi MW, Alhafufi A,等。单剂量chadox1 mers候选疫苗在单峰骆驼中的体液免疫原性和有效性。科学通报2019;9(1):16292。https://doi.org/10.1038/s41598-019-52730-4.
Raj VS, Mou H, Smits SL, Dekkers DHW, Müller MA, Dijkman R,等。二肽基肽酶4是新出现的人类冠状病毒emc的功能受体。自然科学。2013;495(7440):251-4 (http://www.ncbi.nlm.nih.gov/pubmed/23486063).
Okba NM, Raj VS, Haagmans BL.中东呼吸综合征冠状病毒疫苗:现状和新方法。2017; 23:49-58。
Okba NMA, Widjaja I, van Dieren B, Aebischer A, van Amerongen G, de Waal L,等。颗粒状多价受体结合结构域诱导针对MERS-CoV的保护性免疫反应。新兴微生物感染,2020;9(1):1080-91。https://doi.org/10.1080/22221751.2020.1760735.
埃比舍尔,魏奈克,K, König P, Franzke K, wicgersschreur PJ, Kortekaas J,等。利用正布尼亚病毒模型进行多聚体抗原显示的模块化疫苗平台的开发。疫苗。2021;9:651。
韦格斯·施鲁尔,陈志强,陈志强,等。显示裂谷热病毒糖蛋白Gn头结构域的自组装多聚体蛋白支架颗粒的疫苗疗效疫苗。2021;9:301。
Vergara-Alert J, Vidal E, Bensaid A, Segalés J.寻找新发病原体的动物模型和潜在目标物种:从中东呼吸综合征(MERS)冠状病毒中获得的经验。同一个健康,2017;3:34-40。
韩伟民,朱德伟,陈晓明,等。2014-2015年沙特阿拉伯单峰骆驼群中东呼吸综合征冠状病毒感染的纵向研究新兴微生物感染,2017;6(1):1 - 7。https://doi.org/10.1038/emi.2017.44.
确认
作者要感谢IRTA- cresa的Núria Roca和IRTA的Jordi Charles的技术支持。
资金
这项研究是作为人畜共患疾病预测和防范计划(ZAPI项目)[创新药物计划(IMI)赠款115760]的一部分进行的,得到了IMI和欧盟委员会的援助和财政支持,以及EFPIA合作伙伴的贡献。J.R.得到了VetBioNet项目(欧盟资助协议INFRA-2016-1 Nº731014)的部分支持。IRTA由CERCA方案/加泰罗尼亚Generalitat提供支助。
作者信息
作者及隶属关系
贡献
j。r。a。b。,B.L.H., J.S. conceived and designed the experiment. J.R., A.Z.M., G.C., I.C.A, B.-J.B., A.B., J.-C.A., J.V.-A., B.L.H., J.S. performed the experiments and analyzed the data. The manuscript was written by J.R. All the authors discussed the results and substantively revised the manuscript. The author(s) read and approved the final manuscript.
作者的信息
Jordi Rodon是西班牙巴塞罗那IRTA动物健康研究项目(CReSA)的博士预科研究员。他的兴趣是重新出现的具有大流行潜力的病毒性人畜共患疾病的基础和转化研究;他的研究高度致力于“同一个健康”倡议。
相应的作者
道德声明
伦理批准并同意参与
本研究由IRTA伦理和动物福利委员会(CEEA-IRTA)和加泰罗尼亚自治政府动物实验伦理委员会批准(文件编号:No。CEA-OH / 10942/1)。
发表同意书
不适用。
相互竞争的利益
作者宣称他们之间没有利益冲突。
额外的信息
出版商的注意
伟德体育在线施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.
关于本文
引用本文
罗敦,J.,米基丁,a.z.,坎特罗,G.。et al。基于rbd的中东呼吸综合征冠状病毒(MERS-CoV)颗粒疫苗对美洲驼的保护效果同一个健康展望4, 12(2022)。https://doi.org/10.1186/s42522-022-00068-9
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s42522-022-00068-9
关键字
- 动物模型
- 骆驼
- 骆驼科
- 中东呼吸综合征冠状病毒
- MERS-CoV
- 多聚体蛋白支架颗粒(MPSP)
- 受体结合域(RBD)疫苗
- 病毒传播
- 中和抗体