摘要
纳米颗粒作为一种有效的药物输送系统具有巨大的潜力。在这篇综述中,我们讨论了纳米技术给药的最新进展。为了克服基因和药物传递的问题,纳米技术近年来引起了人们的兴趣。具有不同组成和生物学特性的纳米系统已被广泛研究用于药物和基因传递应用。为了实现有效的药物传递,重要的是要了解纳米材料与生物环境的相互作用,靶向细胞表面受体,药物释放,多种药物给药,治疗药物的稳定性以及所考虑的疾病病理生物学中涉及的细胞信号的分子机制。一些抗癌药物,包括紫杉醇、阿霉素、5-氟尿嘧啶和地塞米松,已经成功地使用纳米材料配制。量子点、壳聚糖、聚乳酸/乙醇酸(PLGA)和基于PLGA的纳米颗粒也被用于在体外RNAi交付。脑癌是最难检测和治疗的恶性肿瘤之一,主要是因为成像和治疗药物难以通过血脑屏障进入大脑。抗癌药物,如洛哌丁胺和阿霉素与纳米材料结合,已被证明可以穿过完整的血脑屏障,并在大脑中以治疗浓度释放。使用纳米材料(包括基于肽的纳米管)靶向血管内皮生长因子(VEGF)受体和细胞粘附分子,如整合素、钙粘蛋白和选择素,是控制疾病进展的一种新方法。
简介
用作药物传递载体的纳米颗粒通常至少在一维上小于100纳米,由不同的可生物降解材料组成,如天然或合成聚合物、脂质或金属。纳米颗粒比较大的微分子更有效地被细胞吸收,因此可以用作有效的运输和递送系统。对于治疗应用,药物既可以集成在颗粒的基质中,也可以附着在颗粒表面。药物靶向系统应该能够控制药物进入生物环境的命运。具有不同组成和生物特性的纳米系统已被广泛研究用于药物和基因传递应用[1- - - - - -5].实现高效药物传递的有效方法是基于对纳米系统与生物环境、靶细胞群、靶细胞表面受体相互作用的理解,合理地开发纳米系统[6]、随着疾病进展而发生的细胞受体变化、药物作用机制和部位、药物滞留、多种药物给药、分子机制和疾病的病理生物学正在考虑。了解药物的障碍也很重要,例如治疗药物在活细胞环境中的稳定性。药效降低可能是由于细胞内药物的不稳定性、传递分子的多重靶向性或化学性质导致的不可用性、细胞表面受体基因组成的改变、外排泵的过度表达、随着疾病进展信号通路的改变或药物降解。例如,随着癌症的发展,过度的DNA甲基化[7导致一些抗肿瘤药物如阿霉素和顺铂失效。更好地理解摄取的机制,细胞内运输,保留,和保护细胞内的降解,需要增强胶囊治疗剂的疗效。
本文综述了纳米药物的给药方面,纳米颗粒与细胞表面受体相互作用的分子机制,生物反应和细胞信号传递,以及纳米给药系统在医学上广泛应用所需要的研究。
纳米技术给药系统的设计
纳米颗粒可用于疾病部位的靶向药物递送,以提高难溶性药物的吸收[8,9],药物靶向到特定部位,以及药物的生物利用度。非靶向和靶向给药系统的示意图比较如图所示1.几种抗癌药物,包括紫杉醇[10,11]、阿霉素[12], 5-氟尿嘧啶[13]和地塞米松[14]已经成功地使用纳米材料配制。聚乳酸/乙醇酸(PLGA)和聚乳酸(PLA)为基础的纳米颗粒被配制成胶囊地塞米松,一种具有细胞内作用位点的糖皮质激素。地塞米松是一种具有抗增殖和抗炎作用的化疗药物。药物与细胞质受体结合,随后的药物受体复合物被运送到细胞核,导致控制细胞增殖的某些基因的表达[14].这些载药纳米颗粒配方释放高剂量的药物,并在较长时间内完全抑制血管平滑肌细胞的增殖。
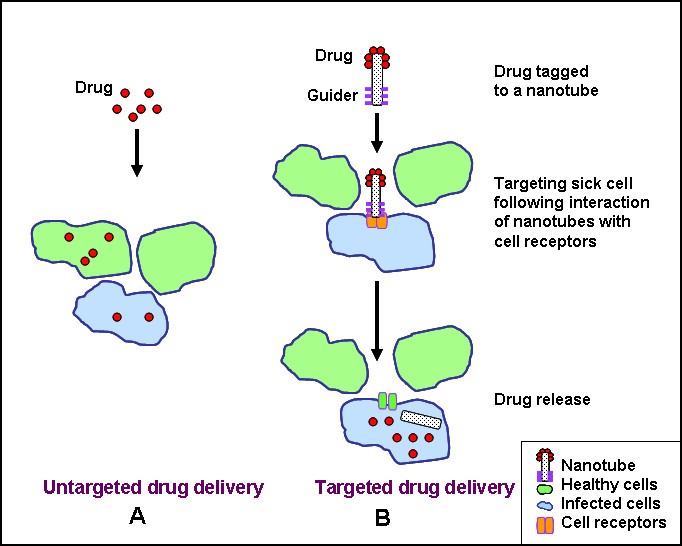
图1
胶体药物递送方式,如脂质体、胶束或纳米颗粒,已被广泛研究用于癌症治疗。药物给药系统的有效性可归因于其体积小,降低药物毒性,控制药物释放时间以及改变药物药代动力学和生物分布。化疗往往不能治愈癌症,因为一些肿瘤细胞对多种抗癌药物产生了耐药性。在大多数情况下,当癌细胞开始表达一种被称为p-糖蛋白的蛋白质时,就会产生耐药性,这种蛋白质能够在抗癌药物穿过细胞外膜时迅速将它们泵出细胞。新的研究表明,纳米颗粒可能能够在不触发p-糖蛋白泵的情况下将抗癌药物送入细胞。11,15].研究人员研究了在活的有机体内负载紫杉醇的纳米颗粒对紫杉醇耐药人结直肠肿瘤的疗效。乳化蜡纳米颗粒包裹的紫杉醇被证明可以克服人结肠腺癌细胞系(HCT-15)的耐药性。紫杉醇遇到的不溶性问题可以通过与白蛋白结合来克服。紫杉醇结合生物相容蛋白如白蛋白(Abraxane)是一种可注射的纳米悬浮液,已获批准用于治疗乳腺癌。在紫杉醇先前配方中使用的溶剂cremophorl - el会引起急性超敏反应。为了减少服用紫杉醇时过敏反应的风险,患者必须先服用类固醇和抗组胺药,并以持续数小时的缓慢输注方式给药。白蛋白与紫杉醇结合可在较短的时间内给药。因为它是无溶剂的,与溶剂相关的毒性也被消除了。在III期临床试验中,Abraxane的有效率约为含溶剂药物Taxol的2倍。
纳米颗粒介导的siRNA传递
短干扰RNA (Short interference RNA, siRNA)作为一种具有广泛应用前景的控制基因表达的有效方法正在兴起。将基于核酸的治疗转化为临床研究需要在传递系统方面取得重大进展。量子点(QD)已被用于监测RNAi的传递[16].PLGA和PLA基纳米颗粒也被用于在体外RNAi传递[17].虽然在使用各种纳米材料传递siRNA方面已经取得了一些成功,但如果没有合适的跟踪剂或标记,很难跟踪它们的传递和监测它们的转染效率。设计一种高效且自我跟踪的RNA干扰转染剂是一个很大的挑战。最近,谭等[18]合成了包覆量子点的壳聚糖纳米颗粒,并利用这种纳米材料递送人表皮生长因子受体-2 (HER2/neu) siRNA。这种新型纳米载体有助于通过壳聚糖纳米颗粒中荧光量子点的存在来监测siRNA。靶向递送HER2 siRNA到过表达HER2的SKBR3乳腺癌细胞已经通过壳聚糖/量子点纳米颗粒表面标记的HER2抗体靶向SKBR3细胞上的HER2受体[18].
用荧光标记标记纳米颗粒,如Cy-5,有助于使用荧光显微镜观察纳米管的吸收和积累。最近,霍华德等[19]使用这种纳米颗粒与BCR/ABL-1连接序列特异性siRNA结合,发现K562 (Ph(+))细胞中BCR/ABL-1白血病融合蛋白的表达降低了90%。有效的在活的有机体内经鼻给予壳聚糖/siRNA配方后,转基因EGFP小鼠细支气管上皮细胞也实现了RNA干扰。这些发现强调了这种新型壳聚糖系统在rna介导的全身和粘膜疾病治疗中的潜在应用。
癌症
用纳米颗粒靶向癌细胞
癌症是当今最具挑战性的疾病之一,而脑癌是最难检测和治疗的恶性肿瘤之一,这主要是因为成像和治疗剂难以穿过血脑屏障进入大脑。许多研究人员发现纳米颗粒有望将这些物质运送到大脑中。20.- - - - - -22].载脂蛋白E被认为介导药物通过血脑屏障的转运[23].洛哌丁胺不会穿过血脑屏障,但直接注射到大脑后会产生抗伤害作用,它被装入人血清白蛋白纳米颗粒中,并与载脂蛋白e相连接。在甩尾试验中,小鼠静脉注射这种复杂的诱导抗伤害作用。这个给药系统的功效当然取决于对脂蛋白受体的识别。Kopelman和他的同事设计了由生物定位嵌入(PEBBLE)封装的探针,在其表面携带各种独特的试剂,并执行多种功能[22].一个固定在表面的目标分子可以引导PEBBLE到达肿瘤。另一种药剂可以用来通过磁共振成像来帮助可视化目标,而第三种药剂可以连接到PEBBLE上,向附近的癌细胞输送破坏性剂量的药物或毒素。这三种功能可以在一个微小的聚合物球体中结合起来,成为对抗癌症的有力武器。另一种抗癌药物阿霉素与聚山梨酸酯包裹的纳米颗粒结合后,能够穿过完整的血脑屏障,并以治疗浓度释放到大脑中[24].智能超顺磁氧化铁颗粒缀合物可用于比报道的方法更早、更准确地靶向和定位脑肿瘤[25].已知叶酸与聚乙二醇结合可以进一步增强纳米颗粒的靶向性和细胞内摄取。因此,纳米材料作为靶向癌细胞的药物载体具有巨大的潜力。
用纳米颗粒靶向血管生成
强健的血管生成是肿瘤侵袭性生长的基础。因此,抑制血管生成的机制之一是饥饿肿瘤细胞。血管生成是通过一系列复杂的介质调节的,最近的证据表明整合素αvβ3和血管内皮生长因子(VEGFs)发挥着重要的调节作用。因此,选择性靶向αvβ3整合素和vegf是治疗多种实体肿瘤的一种新的抗血管生成策略。一种方法是在纳米颗粒上包裹肽,这些肽可以特异性结合αvβ3整合素和VEGF受体[26].已知合成的含有Arg-Gly-Asp (RGD)序列的肽与血管生成血管内皮细胞上表达的αvβ3整合素特异性结合,可能抑制肿瘤的生长和增殖。经过疏水改性后,乙二醇壳聚糖能够形成自聚集的纳米管,并已被用作RGD肽的载体,用异硫氰酸荧光素(FITC-GRGDS)标记[27].这些载有FITC-GRGDS的纳米管可能用于监测或破坏肿瘤组织周围的血管生成组织/血管。本课题组一直在研究RGDSK自组装玫瑰花结纳米管(RGDSK- rnt)的生物学反应。这些玫瑰花形纳米管是一类新颖的纳米管,具有生物学灵感,合成时天然可溶于水[28,29].这些纳米管是由鸟嘌呤-胞嘧啶基序构成的。然而,RNT的一个新特性是能够在G/C基序上接受各种功能基团,这赋予了纳米管在特定的医学或生物学应用中的功能通用性。因此,rnt可以被潜在地修饰,以靶向各种治疗分子在体内治疗癌症和炎症性疾病。
纳米系统在炎症中的应用
靶向巨噬细胞控制炎症
巨噬细胞在快速识别和清除外来颗粒方面的潜力为纳米颗粒靶向巨噬细胞提供了一种合理的方法。巨噬细胞分泌多种炎症介质的能力允许它们在许多疾病中调节炎症。因此,巨噬细胞是许多人类和动物疾病的潜在药物靶点。尽管巨噬细胞能够杀死大部分微生物,但许多微生物(刚地弓形虫,利什曼虫sp,结核分枝杆菌而且单核细胞增多性李斯特氏菌)已发展出抵抗巨噬细胞吞噬活性的潜在能力。这些病原体破坏了巨噬细胞旨在杀死它们的分子机制,并定居在修饰过的溶酶体中。因此,纳米颗粒介导的抗微生物药物输送到巨噬细胞中含有病原体的细胞内液泡中可能有助于消除细胞储存库[30.,31].该系统可用于在感染巨噬细胞的液泡中达到治疗性药物浓度,并减少与给药和促炎细胞因子释放相关的副作用。聚烷基氰基丙烯酸酯(PACA)纳米颗粒已被用作靶向抗利什曼原虫药物进入巨噬细胞的载体。这种纳米材料不诱导巨噬细胞释放白细胞介素-1 [32].因此,类似设计的纳米系统在靶向慢性疾病中的巨噬细胞感染方面非常有用。
抗真菌和抗利什曼原虫的药物两性霉素B (AmB)已与脂基纳米管络合,以开发出毒性较低的AmB配方。Gupta和Viyas [33大豆磷脂酰胆碱稳定的纳米脂质颗粒(乳质体)作为一种新的巨噬细胞靶向静脉给药系统。纳米载体介导的巨噬细胞毒素递送已被证明是在基因治疗和其他临床相关情况(如自身免疫性血液疾病、T细胞介导的自身免疫性糖尿病、类风湿关节炎、脊髓损伤、坐骨神经损伤和血管成形术后再狭窄)中摆脱不需要的巨噬细胞的强大方法。另外,具有巨噬细胞致死特性的纳米颗粒也可以被利用。利用多种巨噬细胞受体作为治疗靶点可能是颗粒纳米载体抗原递送和靶向的更好策略。
针对炎症分子
在过去的二十年中,人们发现了许多细胞粘附分子。细胞粘附分子是在细胞表面发现的糖蛋白,作为细胞与细胞之间和细胞与细胞外基质粘附的受体[34,35].这些细胞粘附分子分为四类:整合素、钙粘蛋白、选择素和免疫球蛋白超家族。这些分子是中性粒细胞和单核细胞等炎症细胞有效迁移到炎症器官和产生宿主对感染的反应所必需的。然而,有相当多的证据表明,中性粒细胞在发炎的肺部过度迁移会导致严重的组织损伤和死亡。因此,一项重大努力正在进行中,以微调中性粒细胞迁移到发炎器官。最近,对细胞粘附分子的认识取得了进展,影响了用于癌症、心脏和自身免疫性疾病的潜在治疗药物(即肽、蛋白质)的设计和开发[36- - - - - -38].这些分子在癌症等疾病中发挥着重要作用[39,40],血栓[41,42]和自身免疫性疾病,如1型糖尿病[43- - - - - -45].RGD肽被用于靶向整合素αvβ3和αvβ5,来自细胞间粘附分子-1 (ICAM-1)的肽被用于靶向αvβ2整合素。αvβ2衍生肽可靶向表达ICAM-1的细胞。环RGD肽已与紫杉醇(PTX-RGD)和阿霉素(Dox-RGD4C)结合,以改善这些药物对肿瘤细胞的特异性递送。携带人乳腺癌细胞(即MDA-MB-435)的小鼠在Dox-RGD4C治疗后存活,而所有未治疗的对照组小鼠都死于该疾病[46].该缀合物靶向血管生成过程中肿瘤血管的αvβ3和αvβ5整合素。
细胞外调节激酶(ERK)可能在多个位点调控细胞凋亡和细胞存活,包括增加p53和BAX的作用,增加caspase-3和caspase-8的活性,降低Akt活性,增加TNF-α的表达[47].我们的研究小组正在研究RGD-RNT与αvβ3整合素的相互作用,通过P38激酶跟踪细胞信号及其在人肺上皮细胞中的功能,以及牛和马中性粒细胞的迁移。Cyclo(1,12)PenITDGEATDSGC肽(cLABL肽),源于白细胞功能相关因子-1 (LFA-1) α亚基的i结构域,已知与ICAM-1结合。cLABL肽与甲氨蝶呤(MTX)缀合得到MTX-cLABL [48].因为ICAM-1在组织炎症和几种不同的癌症中上调,这种结合可能有助于将药物导向炎症和肿瘤细胞。MTX的抗炎活性是由于抑制抗炎细胞因子如(白介素-6)IL-6和(白介素-8)IL-8的产生。因此,MTX- clabl结合物的活性与MTX在抑制TNF-α刺激的人冠状动脉内皮细胞中这些细胞因子的产生方面进行了比较。MTX- clabl在抑制IL-6的产生方面比IL-8更具选择性,这与MTX相反。cLABL多肽包被的PLGA纳米颗粒也被证明能上调ICAM-1 [49].为了将药物分子输送到特定的细胞类型或用于癌症和其他疾病(心脏和自身免疫疾病)的诊断,需要利用细胞粘附分子的内化和细胞内运输机制的更详细信息。
结论
纳米药物递送系统似乎具有巨大的潜力,可以克服炎症和癌症中有效靶向细胞和分子的一些障碍。还有一种令人兴奋的可能性,即克服靶细胞的耐药问题,促进药物跨越屏障,如大脑中的屏障。然而,挑战仍然是分子靶点的精确表征,并确保这些分子仅在靶器官中表达,以防止对健康组织产生影响。其次,重要的是要了解药物一旦输送到细胞核和其他敏感细胞细胞器的命运。此外,由于纳米系统提高了药物传递的效率,剂量可能需要重新校准。尽管如此,未来仍然是令人兴奋和广阔的。
参考文献
Pison U, Welte T, Giersing M, Groneberg DA:呼吸系统疾病的纳米医学。Eu J药理学2006, 533: 341-350。10.1016 / j.ejphar.2005.12.068
brannon - pepppase L, Blanchette JQ:用于癌症治疗的纳米颗粒和靶向系统。Adv药物输送2004年,56(11):1649 - 1659。10.1016 / j.addr.2004.02.014
陈建平,王涛。纳米技术在医学实践中的应用。受伤2005, 36: s6-s13。10.1016 / j.injury.2005.10.011
横山M:纳米载体系统药物靶向。J Artif器官2005年,8(2):77 - 84。10.1007 / s10047 - 005 - 0285 - 0
Schatzlein AG:提供癌症干细胞疗法——纳米药物的作用?欧元癌症2006年,42(9):1309 - 1315。10.1016 / j.ejca.2006.01.044
格罗内伯格DA, rabe KF, Fischer A:神经肽治疗的新概念:血管活性肠多肽及其受体。Eu J药理学2006, 533: 182-194。10.1016 / j.ejphar.2005.12.055
结直肠和结肠癌中的表观遗传事件。生物化学2005, 33: 684-688。10.1042 / BST0330684
Ould-Ouali L, Noppe M, Langlois X, Willems B, Te Riele P, Timmerman P, Brewster ME, Arien A, Preat V:自组装PEG-p(CL-co-TMC)共聚物用于口服低水溶性药物:利培酮的案例研究。J控制释放2005、102(3):657 - 668。10.1016 / j.jconrel.2004.10.022
Kipp JE:固体纳米颗粒技术在肠外输送低水溶性药物中的作用。国际制药公司2004、284(2):109 - 122。10.1016 / j.ijpharm.2004.07.019
Fonseca C, Simoes S, Gaspar R:紫杉醇负载PLGA纳米颗粒:制备,物理化学表征和在体外anti-tumoral活动。J控制释放2002、83(2):273 - 286。10.1016 / s0168 - 3659 (02) 00212 - 2
Koziara JM, Whisman TR, Tseng MT, Mumper RJ:已新型紫杉醇纳米颗粒治疗耐紫杉醇人结直肠肿瘤的疗效。J控制释放2006、112(3):312 - 319。10.1016 / j.jconrel.2006.03.001
刘浩,李赫,吴杰,朴TG:在体外而且在活的有机体内阿霉素- plga缀合纳米粒抗肿瘤活性的研究。J控制释放2000年,68(3):419 - 31所示。10.1016 / s0168 - 3659 (00) 00280 - 7
Bhadra D, Bhadra S, Jain S, Jain NK:一种聚乙二醇化的树突纳米氟尿嘧啶载体。国际制药公司2003、257(2):111 - 124。10.1016 / s0378 - 5173 (03) 00132 - 7
Panyam J, Labhasetwar V:使用可生物降解纳米颗粒的细胞内受体药物的持续细胞质传递。摩尔制药2004年,1(1):77 - 84。10.1021 / mp034002c
Koziara JM, Lockman PR, Allen DD, Mumper RJ:紫杉醇纳米颗粒对脑肿瘤的潜在治疗。J控制释放2004、99(2):259 - 269。10.1016 / j.jconrel.2004.07.006
陈aa, Derfus AM, Khetani SR, Bhatia SN:量子点监测RNAi传递并改善基因沉默。核酸测定2005年,33 (22):e190。10.1093 / nar / gni188
Shinde RR, Bachmann MH, Wang Q, Kasper R, Contag CH:PEG-PLA/PLGA纳米颗粒用于体内RNAi递送。加州NSTI纳米技术;2007.
谭文文,姜松,张勇:基于量子点的纳米颗粒RNA干扰靶向沉默HER2/neu基因。生物材料2007年,28(8):1565 - 1571。10.1016 / j.biomaterials.2006.11.018
Howard KA, Rahbek UL, Liu X, Damgaard CK, Glud SZ, Andersen MØ, Hovgaard MB, Schmitz A, Nyengaard JR, Besenbacher F, Kjems J: RNA干扰在体外在体内使用一种新型壳聚糖/siRNA纳米颗粒体系。摩尔其他2006年,14(4):476 - 484。10.1016 / j.ymthe.2006.04.010
Kreuter J, Shamenkov D, Petrov V, Ramge P, Cychutek K, Koch-Brandt C, Alyautdin R:载脂蛋白介导的纳米颗粒结合药物通过血脑屏障的转运。J药物靶点2002年,10(4):317 - 325。10.1080 / 10611860290031877
Costantino L, Gandolfi F, Tosi G, Rivasi F, Vandelli MA, Forni F:肽衍生的可生物降解纳米颗粒能够穿过血脑屏障。J控制释放2005、108(1):84 - 96。10.1016 / j.jconrel.2005.07.013
Sumner JP, Kopelman R: Alexa Fluor 488作为铁传感分子及其在PEBBLE纳米传感器中的应用。分析师2005、130(4):528 - 533。10.1039 / b414189j
Michaelis K, Hoffmann MM, Dreis S, Herbert E, Alyautdin RN, Michaelis M, Kreuter J, Langer K:载脂蛋白E与白蛋白纳米颗粒的共价连接强烈促进药物进入大脑。药物学研究2006、317(3):1246 - 1253。10.1124 / jpet.105.097139
Steiniger SC, Kreuter J, Khalansky AS, Skidan IN, Bobruskin AI, Smirnova ZS, Severin SE, Uhl R, Kock M, Geiger KD, Gelperina SE:应用载阿霉素纳米颗粒化疗大鼠胶质母细胞瘤。肿瘤2004、109(5):759 - 767。10.1002 / ijc.20048
张艳,孙晨,张敏:单分散磁铁矿纳米颗粒自组装涂层的高效胞内吸收。生物医学微器件2004, 6: 33-40。10.1023 / B: BMMD.0000013363.77466.63
Li L, Wartchow CA, Danthi SN, Shen Z, Dechene N, Pease J, Choi HS, Doede T, Chu P, Ning S, Lee DY, Bednarski MD, Knox SJ:一种利用整合素拮抗剂或抗flk -1抗体包被90y标记纳米颗粒的新型抗血管生成疗法。放射肿瘤生物学2004年,58(4):1215 - 1227。
Park JH, Kwon S, Nam JO, Park RW, Chung H, Seo SB, Kim IS, Kwon IC, Jeong SY:基于含5 β -胆酸的乙二醇壳聚糖自组装纳米颗粒用于RGD肽传递。J控制释放2004、95(3):579 - 588。10.1016 / j.jconrel.2003.12.020
王晓明,王晓明,王晓明,王晓明,王晓明,等。多通道玫瑰形纳米管的自组装研究。科学过程2002, 29(4): 489 - 497。10.1073 / pnas.032527099
Fenniri H, Mathivanan P, Vidale KL, Sherman DM, Hallenga K, Wood KV, Stowell JG:螺旋玫瑰形纳米管:设计,自组装和表征。美国化学学会2001, 23(3): 374 - 374。10.1021 / ja005886l
张东,谭涛,高丽,赵伟,王鹏:高压均质法制备阿奇霉素纳米悬浮液及其理化特性研究。药物开发和制药2007年,33(5):569 - 575。10.1080 / 03639040600975147
Gaspar R, Préat V, Opperdoes FR, Roland M:聚烷基氰基丙烯酸聚合物纳米颗粒对巨噬细胞的激活:与过氧化氢产生相关的细胞内多诺瓦利什曼原虫的活性。医药研究1992年,9(6):782 - 787。10.1023 /: 1015807706530
Balland O, pto - alphandary H, Viron A, Puvion E, Andremont A, Couvreur P: ampiciUin在小鼠巨噬细胞感染中的细胞内分布鼠伤寒沙门氏菌用(3H)氨苄西林纳米颗粒处理。抗菌化疗杂志1996, 37: 105-115。10.1093 /江淮/ 37.1.105
Gupta S, Viyas SP:用于被动和主动巨噬细胞靶向的两性霉素B的开发和表征。J药物靶点2007年,15(3):206 - 217。10.1080 / 10611860701195395
Hynes RO:整合素作为血管生成调节剂的重新评价。Nat地中海2002, 8: 918-921。10.1038 / nm0902 - 918
Hynes RO, Zhao Q:细胞黏附的进化。细胞生物学2000, 24: f89-f96。10.1083 / jcb.150.2.F89
陈欣,Plasencia C, Hou Y, Neamati N:二聚体RGD肽-紫杉醇缀合物作为整合素靶向给药模型的合成及生物学评价。医学化学2005, 48: 1098-1106。10.1021 / jm049165z
黄国强,黄国强,黄国强,黄国强。RGD修饰脂质体的血管给药研究进展。Thromb Haemost2005, 29(4): 344 - 344。
Schiffelers RM, Koning GA, ten Hagen TL, Fens MH, Schraa AJ, Janssen AP, Kok RJ, Molema G, Strom G:肿瘤血管靶向脂质体阿霉素的抗肿瘤疗效。J控制Rel2003, 29(1): 1 - 5。10.1016 / s0168 - 3659 (03) 00240 - 2
李丽丽,李丽娟,李丽娟:黑素瘤细胞的黏附、迁移与通讯。色素细胞分辨率2005, 18: 150-159。10.1111 / j.1600-0749.2005.00235.x
Christofori G:改变邻居,改变行为:肿瘤进展中的细胞黏附分子介导信号。EMBO J2003, 22: 2318-2323。10.1093 / emboj / cdg228
Pancioli AM, Brott TG:血小板糖蛋白IIb/IIIa受体拮抗剂在急性缺血性卒中中的治疗潜力:科学原理和现有证据。中枢神经系统药物2004, 18: 981-988。10.2165 / 00023210-200418140-00003
Andrews RK, Berndt MC:血小板生理学与血栓形成。Thromb Res2004, 34(4): 344 - 344。10.1016 / j.thromres.2004.07.020
Anderson ME, Siahaan TJ:针对ICAM-1/LFA-1相互作用控制自身免疫性疾病:设计肽和小分子抑制剂。肽2003, 24: 487-501。10.1016 / s0196 - 9781 (03) 00083 - 4
Yusuf-Makagiansar H, Anderson ME, Yakovleva TV, Murray JS, Siahaan TJ:抑制LFA-1/ICAM-1和vra -4/VCAM-1作为炎症和自身免疫性疾病的治疗方法。医学研究2002, 22: 146-167。10.1002 / med.10001
Shimaoka M,施普林格TA:治疗性拮抗剂和β2整合素的构象调控。Curr顶级医学化学2004, 4: 1 - 4。10.2174 / 1568026043387575
王晓明,王晓明,王晓明,等:小鼠肿瘤血管内靶向药物治疗肿瘤的研究进展。科学1998, 29(4): 377 - 388。10.1126 / science.279.5349.377
庄淑娟,Schnellmann RG:细胞外信号调节激酶的促死亡作用。药物学研究2006, 29(3): 349 - 349。10.1124 / jpet.106.107367
杜ehoo AL, Anderson M, Majumdar S, Kobayashi N, Berkland C, Siahaan TJ:靶向药物传递的细胞粘附分子。药学科学2006, 35(4): 457 - 457。10.1002 / jps.20676
张楠,Berkland C:以共轭CLABL为靶向血管载体合成PLGA纳米颗粒。科学讲座,堪萨斯大学劳伦斯分校Higuchi生物科学中心;2006.
作者信息
作者及隶属关系
相应的作者
额外的信息
相互竞争的利益
作者声明他们没有相互竞争的利益。
作者的贡献
两位作者在这篇综述文章的准备工作中都做出了同样的贡献。
作者提交的图片原始文件
下面是作者提交的原始图片文件的链接。
权利和权限
开放获取本文由BioMed Central Ltd授权发布。这是一篇开放获取文章,根据创作共用归属许可协议(https://creativecommons.org/licenses/by/2.0),允许在任何媒介上不受限制地使用、传播和复制,前提是正确地引用原始作品。
关于本文
引用本文
苏瑞,s.s.,芬尼里,H.和辛格,B.纳米技术为基础的药物输送系统。J占用医学毒物2, 16(2007)。https://doi.org/10.1186/1745-6673-2-16
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/1745-6673-2-16
关键字
- 紫杉醇
- 药物输送系统
- 壳聚糖纳米粒子
- Abraxane
- 人冠状动脉内皮细胞
