摘要
背景
生酮饮食(KD)除了具有抗癫痫作用外,还有抗肿瘤和抗糖尿病的作用。它还能改善心脏功能,减轻神经损伤。然而,KD对缺血后血液灌注或组织恢复的影响尚不清楚。因此,我们观察了小鼠后肢缺血(HLI)后的血流和缺血组织恢复。
方法
C57小鼠在诱导后肢缺血前分别饲喂KD和正常饮食(ND) 2周,分别于术后0、7、21 d观察缺血肢体组织的血液灌注。
结果
KD不仅降低了缺血肢体组织的血液灌注,而且延迟了缺血后肌肉的恢复,诱发了非缺血组织的肌肉萎缩。此外,KD延迟了手术部位的伤口愈合,并加剧了缺血组织的炎症。在细胞水平上,KD通过减少葡萄糖和酮体的利用而增加脂肪酸氧化,改变了肢体组织的代谢状态。缺血后,KD进一步减少了肢体组织的糖酵解、酮分解和脂肪酸利用,而KD后的小鼠模型中酮生成略有增加。
结论
KD可能导致缺血后组织恢复受损,长时间饮食可能导致肌肉萎缩。我们的结果提示肢体缺血患者应避免生酮饮食。
介绍
生酮饮食(KD)是一种脂肪含量高、严格限制糖摄入的低碳水化合物饮食,被公认为有效的抗癫痫治疗方法。1911年,古勒普和玛丽记录了饥饿是治疗癫痫的一种方法[1].1921年晚些时候,伍迪-阿特在研究了饥饿下的代谢变化后注意到,通过饥饿或碳水化合物比例过低、脂肪比例过高的饮食,正常人体内会出现丙酮和β -羟基丁酸;因此,所谓的“生酮饮食”在20世纪20年代和30年代被广泛使用[1,2].随着癫痫新药的发现,KD成为了癫痫的最后治疗选择。此外,KD在20世纪70年代被广泛用于治疗肥胖。
酮体是在肝脏中脂肪酸的β氧化过程中产生的短链脂肪酸,通过血液循环输送到肝外组织提供能量。当身体遭遇饥饿或极端运动时,肝脏开始产生酮体,从而增加肝外组织(特别是大脑、心脏和骨骼肌)对酮的吸收和使用,以提供能量[3.].除了饥饿状态外,糖尿病、妊娠期、新生儿期和坚持低碳水化合物饮食也会出现高酮血症[4].健康成人循环总酮体浓度通常在100 - 250 μ M内,在长时间运动或禁食24小时后上升到约1 mM,在糖尿病酮症酸中毒等病理状态下可高达20 mM [5,6].
由于观察到KD具有抗癌和抗糖尿病的作用,最近出现了一个新的视角。许多研究已经报告了通过降低体重和血糖以及改善胰岛素抵抗来改善糖尿病。据报道,KD还可通过改善胰岛细胞功能来提供胰岛素促分泌作用[7].大多数研究报道KD抑制胰腺癌、胶质母细胞瘤和脑癌的肿瘤生长[8,9,10].酮体的信号传导作用的确定带来了进一步研究的广泛趋势,报告KD在非酒精性脂肪性肝病中具有显著的神经保护作用和可能的治疗作用[11,12].此外,心衰患者心功能的显著改善引起了人们的关注,提示KD可能通过提高血酮水平在心衰治疗中具有治疗价值;SGLT2抑制剂的存在进一步支持了这一发现[13,14,15].
血管生成的血液再灌注是许多生理和病理过程的基础,如缺血和炎症。心肌和肢体缺血是由病变代谢环境引起的常见糖尿病并发症,如高血糖、高血脂和高酮血症。禁食和热量限制也会增加血酮水平,并通过改变FOXO-和pcg -1相关基因的表达,改变与KD类似的身体代谢[16].热量限制饮食减少血管生成,而禁食通过改善小鼠内皮祖细胞诱导血管生成[17,18,19,20.].此外,研究发现,缺乏酮解相关酶会显著损害小鼠淋巴管生长[21].然而,酮体在血管生成过程中如何影响血管生长,以及在缺血条件下如何影响血液灌注,目前尚不清楚。后肢缺血(HLI)是研究血管再生的理想动物模型,也常用于评价缺血灌注和组织反应。因此,我们进行了本研究,以充分观察小鼠后肢缺血后的血流和缺血组织恢复。我们发现KD不仅能减少缺血肢体组织的血液灌注,还能诱导小鼠肌肉萎缩和缺血组织纤维化以及伤口愈合延迟。
材料和方法
动物和饮食
8-10周龄(体重22 - 25克)的C57BL/ 6n雄性小鼠购自Gem Pharma Tech LLC (Nanjing, Jiangsu, China),在22°C恒温的12/12小时明暗循环环境中饲养,并免费获得标准实验室饲料和自来水。将其分组饲养,分为正常饲粮(ND)组和生酮饲粮(KD)组(每组13只),分别饲喂标准饲料和生酮饲料(附资料)1:表S1,购自中国江苏协通制药有限公司),24小时免费提供食物和水。2周后,小鼠通过结扎单侧股动脉进行后肢缺血,并继续给予两种不同的饮食。手术结束后,用激光多普勒灌注成像仪对小鼠的缺血后肢血流灌注进行评估。所有动物实验程序均符合美国国家卫生研究院出版的《实验动物护理和使用指南》。85-23, 1996年修订),并由中国复旦大学中山医院动物伦理委员会审查批准。
血浆代谢参数的测定
分别使用葡萄糖计和酮计(Abbott Diabetes Care, Maidenhead, UK)测量血糖和酮水平(以β-羟基丁酸盐水平表示)。用β-羟基丁酸(β-HB)测定试剂盒(MAK041, Sigma, Kawasaki, Kanagawa)测定组织β-HB含量。组织均质于冷β-羟丁酸测定缓冲液中,4℃13000 g离心10分钟,以去除不溶性物质。
后腿缺血过程
为了建立后肢缺血模型,我们对小鼠进行了单侧股动脉结扎。经皮注射麻醉剂(4%水合氯醛)后,在左内收后肢区域做腹股沟切口。确定股动脉,在血管干末端用6-0丝结结扎,从中间开始横断。然后用间断的不可吸收缝合线闭合切口,并在术后24小时密切监测小鼠。
多普勒灌注
小鼠在体温下接受吸入性麻醉,麻醉由保暖垫维持。使用激光多普勒灌注成像仪(Periscan PIM3, Perimed, Beijing, China)评估双侧后肢。在hli后0、7、21天,评估整个肢体、腓肠肌区和后爪区灌注情况。
染色
腓肠肌组织在4%多聚甲醛中固定,脱水,石蜡包埋,然后在分级乙醇溶液和甲苯中脱水。将组织切成5 μm厚的切片,用苏木精、伊红(H&E)和马松染色。对于免疫荧光染色,切片用10%山羊血清白蛋白(Invitrogen, Waltham, Massachusetts, USA)阻塞60分钟,然后用CD31单克隆抗体(1:1500,CST)染色。
免疫印迹
从腓肠肌组织中提取总蛋白。等量的蛋白提取物用SDS-PAGE分离,转移到聚偏二氟乙烯膜上。用5%牛血清白蛋白阻断细胞膜,在4°C下分别用一抗检测过夜。随后洗涤后,将印迹与辣根过氧化物酶偶联抗兔或抗小鼠二抗在室温下孵育2小时。用化学发光反应(LuminataTM Forte, Millipore, Burlington, Massachusetts, USA)和ChemiDoc™成像系统(Bio-Rad, Hercules, CA, USA)对印迹进行观察和检测。使用Image J软件(1.50i,开源,美国)确定蛋白印迹的密度,归一化至β-肌动蛋白(1:1000,Kang Chen,无锡,中国)。
RNA的程序
从肠胃肌组织中提取总RNA使用TRIzol™试剂(#15,596,026,Invitrogen, Waltham, Massachusetts, USA)。RNA的浓度和纯度由Nanodrop (Thermo Fischer, Waltham, Massachusetts, USA)测定,1000 ng RNA以A260/A280比值为1.8-2.0进行纯化,然后使用PrimeScript™reverse Transcription Master mix (# RR036A, TaKaRa, Kusatsu, Shiga, Japan)逆转录成cDNA。逆转录聚合酶链式反应(RT- pcr)使用PrimeScript™RT Master Mix (TaKaRa,日本)进行。采用20 μL的反应体系,其中DNA模板1.6 μL, SYBR 10 μL,引物0.4 μL, ddH2O 7.6 μL。本研究中使用的引物列在附加文件中1S2:表。PCR反应周期设定为:95℃30 s, 95℃5 s, 60℃30 s,循环40次。采用2−ΔΔCT方法将荧光信号归一化为Actb。
统计分析
所有统计分析均采用Prism 7.0 (GraphPad Software, Inc., La Jolla, CA, USA)进行。连续变量用均数±均数标准误差(SEM)表示。正态分布采用Shapiro-Wilk检验确定。正常变量的差异使用学生的测试t-test(两组内)或单因素方差分析(ANOVA,三组或三组以上),使用Tukey 's多重比较检验进行事后比较。非正态资料采用Mann-Whitney U检验或Kruskal-Wallis H检验进行分析。统计学显著性定义为双尾P< 0.05 (*), * *P< 0.01(**), ***P< 0.001(* * *)。
结果
生酮饮食诱导体重减轻,并影响血液和组织中的代谢物水平
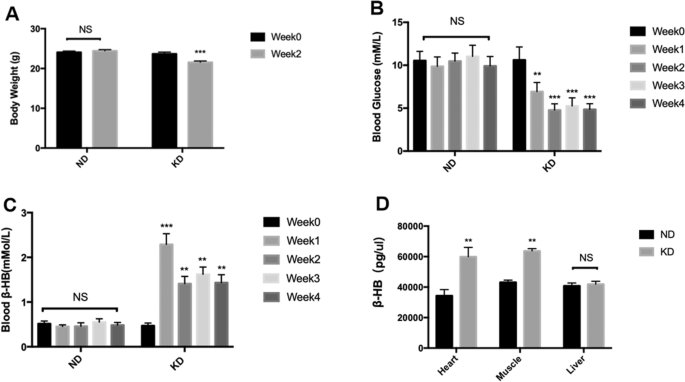
喂养2周后测量小鼠体重,发现KD组明显低于ND组(图1)。1A).在喂养4周期间,还使用葡萄糖和酮计测量随机血糖和血酮水平(以血液β-羟基丁酸盐表示)。饲喂nd的小鼠在4周内随机血糖水平无明显变化;另一方面,kd喂养的小鼠血糖在前2周逐渐下降,然后在第3周和第4周保持稳定(图4)。1B).同样,当KD组小鼠血酮水平在喂养第一周显著升高时,ND组小鼠血酮水平没有明显变化,达到2.7 mmol/L,第二周逐渐恢复到约2 mmol/L,第三、四周基本保持稳定(图4)。1C).最后用β-羟丁酸测定试剂盒测定肌肉、心脏和肝脏等不同组织中的β-羟丁酸含量,发现KD组小鼠心脏和肌肉组织中的β-羟丁酸含量升高,且心脏组织的升高幅度大于ND组小鼠。但两组肝组织β-羟基丁酸含量差异无统计学意义(图1)。1D)。
KD对慢性后肢缺血的灌注恢复和血运重建有影响
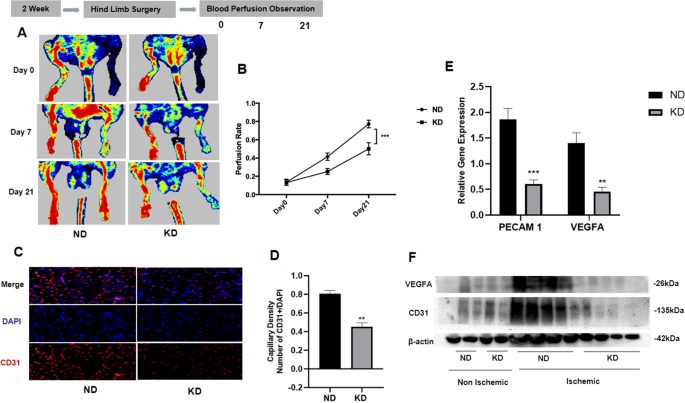
为了研究KD对慢性缺血性损伤灌注恢复能力的影响,采用小鼠缺血肢体模型,小鼠同时饲喂KD和ND。在股动脉结扎术后第0、7、21天用激光多普勒灌注成像检测灌注情况。我们观察到,与喂食ND的小鼠相比,KD减少缺血肢体的灌注信号与更明显的非灌注信号相关(图7和21天)。2A).定量计算每只小鼠缺血肢体与非缺血肢体的灌注比,发现ND组灌注比在3周点为86.2%,而KD组仅为52.4%。两组在第0天无明显差异,提示KD导致肢体循环恢复缓慢(图1)。2B).为了评估血管生成效果,测量毛细血管密度。采用免疫荧光染色,用抗cd31抗体检测后肢毛细血管密度(图。2C).显微照片显示,kd喂养的小鼠缺血肢体毛细血管密度降低(红色CD31(+)信号减少),表明血管生成减少(图。2D).这是通过CD31和血管内皮生长因子A (VEGFA)这两种组织血运重建的常用指标的western blot (WB)和定量PCR (qPCR)结果证实的[22].qPCR结果显示,与ND组相比,KD组小鼠缺血后肢组织中CD31(血小板内皮细胞粘附分子-1)和VEGFA mRNA水平均明显降低(图1)。2E).进一步的WB检测显示,缺血手术后KD小鼠后肢组织中CD31和VEGFA蛋白表达水平均较ND组小鼠明显降低,但缺血手术前KD组与ND组在肢体组织中无明显差异,提示KD减少缺血后后肢组织的血运重建(图)。2F).总的来说,这些数据表明KD阻碍了缺血后后肢组织的血运重建和血液灌注。
KD诱发肌肉萎缩
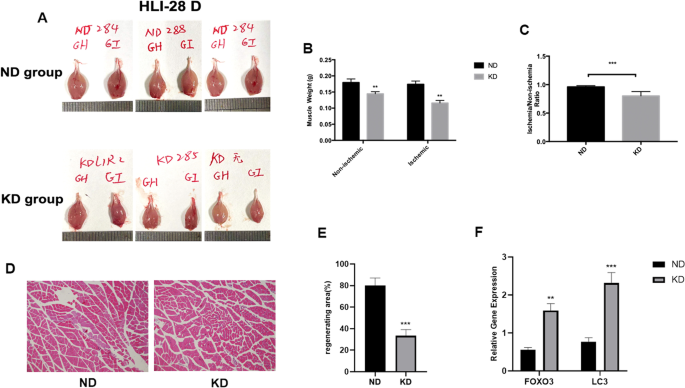
为了评估KD对后肢缺血后肌肉再生和恢复的影响,我们观察了术后28天喂食KD和ND的小鼠的腓肠肌形态,并对其双腿腓肠肌重量进行了测量。与ND组相比,KD组小鼠双腿腓肠肌明显萎缩(图1)。3.A).为了进一步证实KD小鼠的肌肉萎缩,然后评估腓肠肌质量。KD组小鼠缺血腓肠肌和外侧腓肠肌的净重量均明显低于ND组,说明KD不仅诱导缺血肢体的肌肉萎缩,还可引起非缺血肌肉萎缩(图1)。3.B).通过计算每只小鼠缺血腓肠肌重量与外侧腓肠肌重量之比,分析肌肉恢复率,发现KD小鼠的腓肠肌缺血后恢复能力较ND组小鼠有所下降(图1)。3.C).对缺血后肢腓肠肌进行H&E染色,进一步评估KD对肌肉再生能力的影响。与ND组相比,KD组小鼠缺血后肢组织中可见不规则且小的肌纤维(图1)。3.D),而根据H&E染色计算的再生面积发现,KD喂养的小鼠减少了(图5)。3.E).之前的一项研究报道KD通过肌肉萎缩相关基因诱导肌肉萎缩[33],因此我们进一步检测了肌肉萎缩相关基因FOXO3和LC3的表达水平[23在缺血肢体组织中。我们发现KD组小鼠缺血后肢组织中FOXO3和LC3基因mRNA表达水平均显著升高(图5)。3.F)与ND组小鼠相比,提示KD上调肌肉萎缩相关基因可能是我们观察到的肌肉萎缩的原因之一。
KD延迟伤口愈合,增加脚趾坏死率
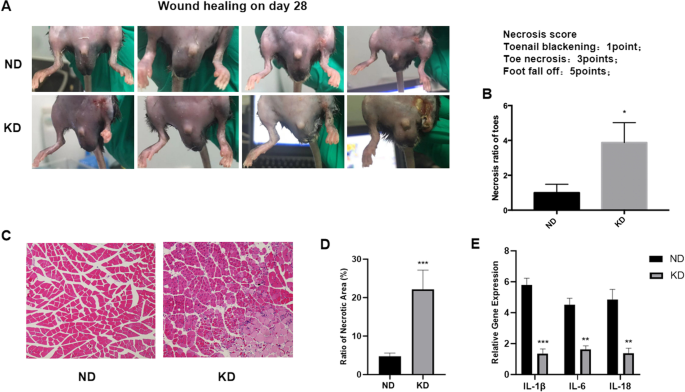
我们观察了每只小鼠手术部位的伤口愈合情况,发现ND组小鼠的手术伤口愈合速度远远快于KD组小鼠。后肢手术后28天小鼠的伤口闭合图像显示,当KD组小鼠的手术伤口出现炎症和化脓性渗出时,ND组的每只小鼠的手术伤口都完全愈合,说明KD显著延缓了伤口愈合,并引起手术部位周围的炎症(图1)。4A).观察KD小鼠足趾严重坏死,采用坏死评分(脚趾甲发黑1分,足趾坏死3分,足部脱落5分)分析两组足趾坏死比例。KD组小鼠足趾坏死率高于ND组(图1)。4B). H&E染色显示KD组缺血后肢组织中大量炎症细胞浸润,而ND组无炎症征象(图5)。4C).基于H&E染色的坏死面积比分析显示,KD组的坏死面积比明显高于ND组(图1)。4D).根据先前的研究,KD具有抗炎作用,通过降低炎症小体(NLRP3)和炎症基因的表达,如IL-β和IL-6 [24].因此,我们检测了ND组和KD组小鼠缺血后肢组织中炎症相关基因(IL-β、IL-6和IL-18)的表达水平,发现KD组小鼠缺血后肢组织中炎症相关基因的表达水平较ND组小鼠明显降低(图)。4E)。
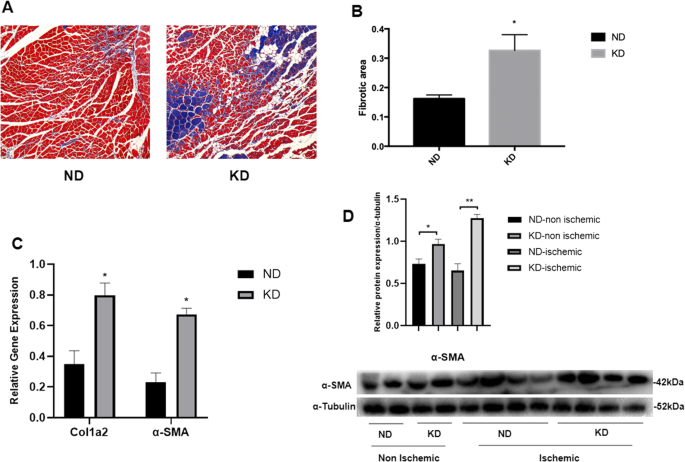
KD诱导缺血肢体组织纤维化
采用Masson染色和纤维化相关基因表达评价KD对缺血后肢体组织纤维化的影响。Masson染色图像显示,与ND组相比,KD组小鼠缺血后肢组织纤维化严重(图1)。5A)。另外,通过Masson染色对两组小鼠缺血后肢组织的纤维化面积进行分析,KD组小鼠缺血后肢组织的纤维化面积较ND组明显增加(图1)。5B).然后测定Cola2和α-SMA的基因表达水平,进一步评价纤维化。与ND组相比,KD组小鼠缺血肢体组织中Cola2和α-SMA mRNA表达水平均升高(图1)。5C)。而且,这与KD组小鼠缺血组织中α-SMA蛋白表达增加的结果一致(图1)。5D). KD组小鼠非缺血组织中α-SMA蛋白表达量较ND组小鼠略有增加,提示KD也可在无缺血条件下触发纤维化。
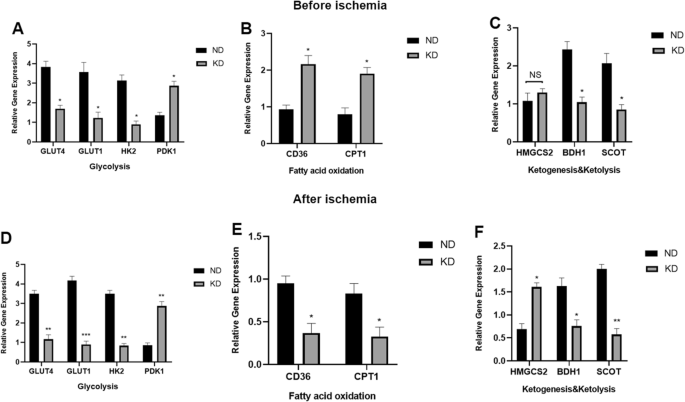
KD在遗传水平上影响缺血前后后肢组织代谢
为了了解KD对细胞的影响,我们通过检测代谢相关基因来研究后肢组织的代谢状态,包括在缺血手术前后糖酵解(以GLUT4、GLUT1、HK2和PDK1为代表)、脂肪酸氧化(以CD36和CPT1为代表)和酮体代谢(以HMGCS2、BDH1和SCOT为代表)期间存在的基因。两组小鼠缺血前后肢组织qPCR分析显示,KD通过降低GLUT4、GLUT1、HK2基因表达,增加PDK1基因表达,显著降低糖酵解(图5)。6A),而与ND小鼠相比,通过增加CD36和CPT1基因表达增加脂肪酸利用率(图1)。6B). KD小鼠中BHD1和SCOT基因表达的降低同时降低了酮生成,而以HMGCS2基因表达为代表的两组酮生成无显著差异(图1)。6C).缺血手术后第7天,对两组小鼠缺血肢体组织进行qPCR,结果显示KD进一步减少缺血后肢体组织的糖酵解(图。6D).与喂食KD的小鼠非缺血性组织中CD36和CPT1基因表达增加的结果相反(图1)。6E)缺血后,它们在肢体组织中减少,表明缺血导致脂肪氧化降低。KD对缺血组织中酮代谢的影响表现为BHD1和SCOT基因表达进一步降低,表明酮溶解进一步降低,HMGCS2基因表达增加,表明酮生成增加,这与在非缺血组织中观察到的结果也不同(图1)。6F)。
KD在蛋白质水平上影响缺血前后后肢组织代谢
进一步从缺血前后后肢组织蛋白质水平评价KD引起的代谢变化。我们进行了WB(图。7A),发现KD降低小鼠缺血前后后肢组织的葡萄糖摄取,表现为GLUT4和GLUT1,而缺血组织的葡萄糖摄取下降更为明显(图1)。7B,C).我们进一步研究了KD对糖酵解的影响,发现KD小鼠缺血前后后肢组织中糖酵解酶HK2蛋白的表达也有所下降,但缺血组织的表达下降比ND组小鼠更明显(图1)。7D)。然而,糖酵解抑制剂PDK1蛋白在KD小鼠缺血前后后肢组织中表达均增加,缺血组织中表达量高于ND组小鼠(图1)。7E).以上结果表明,无论是缺血前还是缺血后,KD都在蛋白质水平上降低了后肢组织的糖酵解,但缺血后KD的降低幅度更大。然后检测CPT1蛋白的表达,即脂肪酸的摄取,发现KD小鼠缺血前后肢组织中CPT1蛋白的表达增加,但缺血后与ND小鼠相比,CPT1蛋白的表达降低,说明KD增加了缺血前肢体组织中脂肪酸的利用,而缺血条件下则降低了对脂肪酸的利用(图1)。7F).随后检测BDH1和SCOT蛋白的表达水平,代表肢体组织的酮化。KD组小鼠手术前后肢体组织中BDH1和SCOT蛋白表达水平均下降,而缺血后肢体组织中BDH1和SCOT蛋白表达水平下降较ND组小鼠更为明显(图2)。7克,H).
讨论
本实验旨在观察KD对小鼠后肢缺血后血液灌注和组织恢复的影响。我们发现KD损伤小鼠缺血后肢组织的血管生成和血液恢复,诱发肌肉萎缩,延迟伤口愈合。在喂食KD的小鼠缺血肢体组织中还观察到炎症加重和纤维化加速。这些结果表明,KD损害缺血组织的血液恢复过程,增加缺血后组织恢复延迟的风险。它还强调了KD下肌肉萎缩的可能性。我们的结果提示肢体缺血患者可能需要避免KD。
我们发现KD喂养2周后小鼠体重显著下降。KD对减肥的作用在以前的研究中已经得到了很好的证实,并且在临床中被用作对抗肥胖的一种工具,至少在中短期内是这样[25,26].但由于生酮饮食的可维护性差,很少有临床研究显示生酮饮食对生酮饮食的长期干预,因此有必要进行进一步的研究。之前Kozue等和Evan等人报道过延长KD不影响小鼠体重[27,28],说明KD会导致体重迅速下降,但之后会逐渐恢复到最初的水平,之后甚至会增加。它的减肥效果有几种假设的机制,包括减少食欲、减少脂肪生成和增加脂肪分解、增加糖异生的代谢成本和消耗脂肪的更高代谢效率[29,30.],但KD是如何真正导致减肥的仍是未知的。虽然KD对血酮水平的影响已经确定,但已知其对血糖调节的作用可用于治疗糖尿病[31].我们发现,KD在研究开始时引起血液代谢物水平的快速变化,然后稍微恢复到初始水平,并在之后保持稳定。在临床试验中也发现血酮水平和血糖水平的波动规律[32].有趣的是,我们发现KD组小鼠肝脏中酮含量与ND组小鼠无显著差异;然而,KD小鼠的肌肉和心脏组织中的酮水平高于ND小鼠,表明KD小鼠的心脏和肌肉组织中的酮代谢增加,因为它们是已知的酮的主要消耗者。
最重要的是,我们发现KD会损害小鼠后肢缺血后的血管生成和血液恢复,这与限制热量饮食导致肿瘤血管生成减少的发现一致[18,19].先前研究报道的酮代谢对体内淋巴管形成的不可或缺的贡献表明酮不仅仅是一种代谢物[21因此,KD下的代谢状态是否影响缺血组织的血管生成需要进行研究。在我们的研究中,我们发现KD不仅减少了缺血后肢组织的血液灌注,还降低了CD31 +的数量,下调了CD31和VEGFA蛋白的表达水平,进一步表明缺血后肢组织血管生成的减少。根据KD小鼠缺血肢体组织中CD31和VEGFA表达减少的结果,我们推测内皮细胞可能在血管生成减少的过程中起主要作用;但KD对血管生成的作用机制有待进一步研究。
我们观察了缺血和非缺血小鼠肢体肌肉在KD下的肌肉萎缩,基于肌肉形状和质量的目测和显微镜观察。我们的发现与另一项研究的结果一致,该研究也报道KD诱导小鼠肌肉萎缩[33].本研究还报道了KD通过上调肌肉萎缩相关基因诱导小鼠肌肉萎缩;因此,我们进一步评估了这些基因在缺血肢体组织中的表达水平,发现KD组小鼠缺血后肢组织中FOXO3和LC3基因的mRNA表达水平均显著升高,提示KD上调肌肉萎缩相关基因可能是我们观察到的肌肉萎缩的原因之一。但是,KD在减肥过程中是否也会引起肌肉损耗,进而导致肌肉萎缩,我们的研究没有发现,因此KD诱导小鼠肌肉萎缩的原因还需要进一步的研究。
以前曾报道过限制卡路里饮食导致的伤口愈合减少[34];因此,我们评估了后肢缺血后的伤口愈合,并观察到KD延迟了小鼠的伤口愈合,同时也增加了脚趾坏死率,并在伤口部位诱导了严重的炎症。我们发现小鼠伤口愈合受损和脚趾坏死可以用KD引起的血管生成减少来解释。KD的抗炎作用是通过减少炎症体和促炎细胞因子而被先前的研究证实的[24,35].同样,我们的研究发现KD组小鼠缺血肢体组织中促炎细胞因子(IL-β、IL-6和IL-18)的基因表达量降低,进一步支持KD的抗炎作用。然而,我们发现KD小鼠伤口部位感染加重,缺血肢体组织下方炎症加速。由于研究,减少组织的促炎状态被认为是治疗那些处于长期促炎状态的疾病,如糖尿病、动脉粥样硬化、自身免疫疾病和肥胖[36].然而,维持甚至诱导组织的促炎状态以杀死病原体可能是治疗感染的关键,更不用说促炎细胞因子的消耗可能会增加感染期间的致命性[37,38,39,40].因此,KD降低促炎细胞因子被认为是我们在KD小鼠中发现的炎症和感染加重的原因,同时它也可以解释伤口愈合受损和脚趾坏死。
之前的一项研究报道KD诱导小鼠心脏纤维化[41];因此,我们通过Masson染色评价缺血肢体组织的纤维化,发现KD加速缺血后肢体组织的纤维化。随后,我们发现Cola2和α-SMA基因表达增加,随后α-SMA蛋白水平升高,进一步表明KD诱导的纤维化。KD对纤维化的影响及其潜在机制有待进一步研究。
最后,通过检测代谢酶和转运蛋白的基因和蛋白表达,研究缺血前后的代谢状况。我们发现KD在后肢组织中通过下调葡萄糖转运体(GLUT1和GLUT4)的基因和蛋白水平表达,显著降低了葡萄糖的吸收,并在缺血后进一步聚集。在HK2中也发现了同样的结果,而PDK1在基因和蛋白质水平上都被KD上调,表明KD也降低了肢体组织的糖酵解。我们还检测了CD36和CPT1的表达,发现KD在缺血前增加了肢体组织对脂肪酸的吸收,但在缺血后降低了对脂肪酸的吸收,提示缺血干扰了KD对肢体组织对脂肪酸吸收的影响。据报道,KD小鼠肌肉组织的酮解作用降低[27],因此,我们评估了KD对缺血前后肢体组织酮代谢的影响,发现KD在缺血前降低了酮分解,但不影响肢体组织酮生成,而在肢体组织缺血后,KD进一步降低了酮分解,增加了酮生成,说明缺血加速了KD对酮代谢的影响。在我们的研究中,我们发现KD增加了脂肪酸的氧化,同时降低了肢体组织对葡萄糖和酮的利用,但缺血后KD总体上降低了肢体组织的分解代谢,这表明缺血引起的缺氧加速了KD对肢体组织分解代谢的影响;此外,我们认为肢体组织能量代谢的降低可能进一步导致缺血后肢体组织恢复的受损。但常氧和低氧环境下KD改变代谢的潜在机制有待进一步研究。
限制
我们发现KD在短期内减轻了小鼠体重,但我们没有观察到KD对小鼠体重的长期影响,为了研究KD导致体重减轻的原因,还需要计算小鼠的食物摄入量或热量摄入量。我们的研究只使用了雄性小鼠,KD对小鼠的影响是否与性别有关还需要进一步的两性研究。为了研究肢体组织的代谢改变,我们使用了代谢酶的基因和蛋白表达,而它们的酶活性也很重要,需要在未来的研究中进行精确的评估。
数据可用性
在当前7项研究中生成和/或分析的数据集可根据合理要求从通讯作者处获得。
参考文献
Dhamija R, Eckert S, Wirrell E.生酮饮食。中华神经科学杂志2013;40:158-67。https://doi.org/10.1017/s0317167100013676.
Wheless JW。生酮饮食的历史。Epilepsia。2008;49(8):3 - 5。https://doi.org/10.1111/j.1528-1167.2008.01821.x.
饥饿下的燃料代谢。2006; 26:1-22。https://doi.org/10.1146/annurev.nutr.26.061505.111258.
约翰逊RH,沃尔顿JL,克雷布斯HA,威廉姆森DH。运动后酮症。《柳叶刀》杂志。1969;2:1383-5。https://doi.org/10.1016/s0140 - 6736 (69) 90931 - 3.
Koeslag JH, Noakes TD, Sloan AW。运动后酮症。杂志。1980;301:79 - 90。https://doi.org/10.1113/jphysiol.1980.sp013190.
Bolla AM, Caretto A, Laurenzi A, Scavini M, Piemonti L.低碳水化合物和生酮饮食在1型和2型糖尿病中的作用营养。2019;11:962。https://doi.org/10.3390/nu11050962.
Walsh JJ, Myette-Côté É, Neudorf H, Little JP。外源性酮补充治疗2型糖尿病的潜在疗效:一项综述。Curr Pharm Des. 2020; 26:958-69。https://doi.org/10.2174/1381612826666200203120540.
Shukla SK, Gebregiworgis T, Purohit V,等。酮体诱导的代谢重编程可减少胰腺癌恶病质。Cancer Metab. 2014年9月;18。https://doi.org/10.1186/2049-3002-2-18.勘误:Cancer Metab. 2014;22。PMID: 25228990;PMCID: PMC4165433。
Poff AM, Ari C, Arnold P, Seyfried TN, D 'Agostino DP。酮的补充降低肿瘤细胞活力和延长转移性癌症小鼠的生存。国际癌症杂志,2014;135(7):1711-20。https://doi.org/10.1002/ijc.28809.
De Feyter HM, Behar KL,饶菊,等。生酮饮食增加了RG2和9L胶质瘤中酮体的运输和氧化,而不影响肿瘤的生长。神经肿瘤防治杂志。2016;18:1079 - 87。https://doi.org/10.1093/neuonc/now088.2016年5月3日。PMID: 27142056;PMCID: PMC4933488。
郭德克L, Bates J, Vatner DF,等。乙酰辅酶a羧化酶抑制逆转NAFLD和肝脏胰岛素抵抗,但促进高甘油三酯血症在啮齿类动物。肝脏病学。2018;68:2197 - 211。https://doi.org/10.1002/hep.30097.PMID:29790582;PMCID:PMC6251774.
拉赫曼M,穆罕默德S,可汗马等。β-羟丁酸受体HCA2激活巨噬细胞的神经保护亚群。Nat Commun。2014;5:3944。https://doi.org/10.1038/ncomms4944.
Al-Zaid NS, Dashti HM, Mathew TC, Juggi JS。低碳水化合物生酮饮食增强心脏对全脑缺血的耐受性。Acta心功能杂志。2007;62:381-9。https://doi.org/10.2143/AC.62.4.2022282.
菲切特D, Zinman B, Wanner C,等。心血管风险高的2型糖尿病患者服用empagliflozin的心力衰竭结局:EMPA-REG结局®试验结果Eur Heart J. 2016; 37:1526-34。https://doi.org/10.1093/eurheartj/ehv728.Epub 2016年1月26日更正:Eur Heart J. 2016年5月14日;37(19):1535-7。PMID: 26819227;PMCID: PMC4872285。
Prattichizzo F, De Nigris V, Micheloni S, La Sala L, Ceriello A.使用SGLT2抑制剂增加酮体循环水平和心血管保护:低级别炎症是被忽视的成分吗?《糖尿病医学杂志》2018;20:2515-22。https://doi.org/10.1111/dom.13488.
Kim DH, Park MH, Ha S,等。β-羟基丁酸通过调节PGC-1α和FoxO1发挥抗炎作用,模拟热量限制。衰老。2019;11:1283 - 304。https://doi.org/10.18632/aging.101838.
Viggiano A, Meccariello R, Santoro A,等。热量限制生酮饮食减少青春期前大鼠的大脑皮层血管化。营养。2019;11:2681。https://doi.org/10.3390/nu11112681.
Mukherjee P, El-Abbadi MM, Kasperzyk JL, Ranes MK, Seyfried TN.饮食限制降低原位小鼠脑瘤模型的血管生成和生长。中华癌症杂志2002;86:1615-21。https://doi.org/10.1038/sj.bjc.6600298.
林伯强,曾志英,杨仕生,庄长波。饮食限制抑制人非小细胞肺癌异种移植瘤的生长,减少血管生成,改善肿瘤微环境。肺癌。2013;79:111-7。https://doi.org/10.1016/j.lungcan.2012.11.001.
辛波,刘春林,杨浩,等。长时间禁食改善小鼠内皮祖细胞介导的缺血血管生成。细胞物理与生物化学。2016;40:693-706。https://doi.org/10.1159/000452581.
García-Caballero M,蔡钦A,苏弗罗J,等。膳食酮体在淋巴管生长中的作用和治疗潜力。Nat金属底座。2019;1:666 - 75。https://doi.org/10.1038/s42255-019-0087-y.
Menger MM, Nalbach L, Roma LP,等。孤立胰岛的促红细胞生成素暴露可加速移植后的血运重建。Acta Diabetol。2021;58:1637-47。https://doi.org/10.1007/s00592-021-01760-4.
Mammucari C, Milan G, Romanello V,等。FoxO3在体内控制骨骼肌自噬。细胞金属底座。2007;6:458 - 71。https://doi.org/10.1016/j.cmet.2007.11.001.
尤耀华,阮建基,格兰特荣伟,等。酮代谢物β-羟基丁酸酯阻断NLRP3炎性体介导的炎症性疾病。Nat医学。2015;2:263-9。https://doi.org/10.1038/nm.3804.
Bueno NB, de Melo IS, de Oliveira SL, da Rocha AT。极低碳水化合物生酮饮食与低脂饮食长期减肥:随机对照试验的荟萃分析。中国生物医学工程学报(英文版);2013;https://doi.org/10.1017/S0007114513000548.
Cincione RI, Losavio F, Ciolli F, Valenzano A, Cibelli G, Messina G, Polito R.混合生酮饮食对超重和肥胖多囊卵巢综合征妇女的影响。《国际环境与公共卫生》,2021;18(23):12490。https://doi.org/10.3390/ijerph182312490.
清水K,齐藤H, Sumi K,等。短期和长期生酮饮食治疗和运动的加入对小鼠能量消耗器官心脏和骨骼肌的代谢基因表达有不同影响。减轻杂志2018;60:77 - 86。https://doi.org/10.1016/j.nutres.2018.09.004.
连云英,Westermark AM,张燕,等。低血糖饮食改变脂质代谢从而影响肿瘤生长。大自然。2021;599:302-7。https://doi.org/10.1038/s41586-021-04049-2.
Gibson AA, Seimon RV, Lee CM, Ayre J, Franklin J, Markovic TP, Caterson ID, Sainsbury A.生酮饮食真的能抑制食欲吗?系统回顾和荟萃分析。ob启2015;16(1):64 - 76。https://doi.org/10.1111/obr.12230.
Paoli A, Grimaldi K, Bianco A, Lodi A, Cenci L, Parmagnani A.生酮饮食和地中海饮食对静息能量消耗和呼吸比的中期影响。BMC Proc。2012。https://doi.org/10.1186/1753-6561-6-S3-P37.
小杨西,米切尔,韦斯特曼。生酮饮食治疗肥胖症和糖尿病。2019;179(12): 1734-5。https://doi.org/10.1001/jamainternmed.2019.5148.
莫雷诺B, Crujeiras AB,贝利多D, Sajoux I,卡萨努伊娃FF。两年内用极低热量生酮饮食治疗肥胖:内脏脂肪减少,疾病负担减轻。内分泌。2016;54(3):681 - 90。https://doi.org/10.1007/s12020-016-1050-2.
Nakao R, Abe T, Yamamoto S, Oishi K.生酮饮食通过减少肌肉蛋白质合成和可能激活蛋白质水解诱导小鼠骨骼肌萎缩。Sci众议员2019;9:19652。https://doi.org/10.1038/s41598-019-56166-8.
Hunt ND,李国光,朱明,等。热量限制和补食对大鼠皮肤创面愈合的影响。年龄(Dordr)。2012; 34:1453-8。https://doi.org/10.1007/s11357-011-9321-6.Epub 2011年10月27日。勘误表:年龄(Dordr)。2012年12月,34(6):1563。米勒,马歇尔(添加)。PMID: 22037865;PMCID: PMC3528375。
邓艳,谢敏,李强,徐旭,欧伟,张艳,肖华,余辉,郑艳,梁艳,蒋晨,陈刚,杜丹,郑伟,王松,龚敏,陈艳,田锐,李涛。β-羟丁酸酯靶向线粒体炎症环路缓解HFpEF。1月22日中国证监会2021号决议;128(2):232-245。https://doi.org/10.1161/CIRCRESAHA.120.317933.Epub 2020 11月12日。勘误:Circ Res. 2022年4月;130(7):e24。PMID: 33176578。
Shapouri-Moghaddam A, Mohammadian S, Vazini H, Taghadosi M, Esmaeili SA, Mardani F, Seifi B, Mohammadi A, Afshari JT, Sahebkar A.巨噬细胞的可塑性、极化和在健康和疾病中的功能。细胞物理学报,2018;233(9):6425-40。https://doi.org/10.1002/jcp.26429.
Benoit M, Desnues B, Mege JL。细菌感染中的巨噬细胞极化。J Immunol。2008;181(6):3733 - 9。https://doi.org/10.4049/jimmunol.181.6.3733.
张晓峰,张晓峰,张晓峰,等。艾滋病巨噬细胞极化:急性和慢性感染过程中抗病毒和抗炎巨噬细胞的动态界面。中华临床细胞免疫学杂志2015;6(3):333。
Bedi B, McNair NN, Förster I, Mead JR. IL-18细胞因子水平调节小鼠先天免疫反应和隐孢子虫病。真核微生物学报。2015;62(1):44-50。https://doi.org/10.1111/jeu.12164.
杨明敏,王春涛,杨淑娟,Leu chch,陈曙华,吴春林,Shiau AL. IL-6对流感病毒感染急性肺损伤的改善作用。Sci众议员2017;6(7):43829。https://doi.org/10.1038/srep43829.
徐松,陶宏,曹伟,等。生酮饮食抑制线粒体生物发生和诱导心脏纤维化。信号传导目标Ther. 2021;6:54。https://doi.org/10.1038/s41392-020-00411-4.
资金
国家自然科学基金创新课题组(81521001)、国家自然科学基金重大研究计划(91639104)、上海市教委国家杰出青年科学基金(81725002)资助。
作者信息
作者和联系
贡献
AS、JG和AS构思和设计了这项研究。AS、ZD、BL、LP、YC和LL分别进行动物和细胞培养实验。AS、XM、KH、JG对数据进行解释。AS、JG和AS撰写了手稿。JG和AS监督了这项研究。JG和AS对手稿进行了审阅和编辑。所有作者都认可了最终稿。
相应的作者
道德声明
伦理批准和同意参与
所有动物实验程序均符合美国国家卫生研究院出版的《实验动物护理和使用指南》。85-23, 1996年修订),并由中国复旦大学中山医院动物伦理委员会审查批准。
相互竞争的利益
作者没有相关的财务或非财务竞争利益需要披露。
额外的信息
出版商的注意
伟德体育在线施普林格自然对出版的地图和机构附属的管辖权要求保持中立。
补充信息
额外的文件1。
饲料成分组成及qPCR引物序列。
权利和权限
开放获取本文遵循创作共用署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),该协议允许在任何媒体或格式中使用、分享、改编、分发和复制,只要您给予原作者和来源适当的署名,提供创作共用许可协议的链接,并说明是否有更改。本文中的图片或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果材料不包含在文章的创作共用许可中,并且您的预期用途不被法律法规允许或超出了允许的用途,您将需要直接从版权所有者那里获得许可。欲查看此许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献放弃书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信用额度中另有说明。
关于这篇文章
引用这篇文章
沙拉木,A,董,Z,刘,B。et al。生酮饮食对后肢缺血小鼠的影响。减轻金属底座(Lond)1959(2022)。https://doi.org/10.1186/s12986-022-00695-z
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12986-022-00695-z
关键字
- 生酮饮食
- 后肢缺血
- 血液灌注
- 组织恢复