摘要
背景
神经祖细胞以刻板的出生顺序产生多种细胞,但只能在有限的时间内指定每种细胞类型。在果蝇胚胎,神经母细胞(神经祖细胞)通过在每次分裂中顺序表达一系列时间同一性转录因子来指定多个不同的神经元。驼背(Hb)是该系列的第一个,说明了早期出生的神经元身份。神经母细胞产生早期神经元的能力终止乙肝基因迁移到神经母细胞核层,使其难以在后代神经元中激活。这一过程背后的机制和作用因素尚不清楚。在这里,我们发现Corto是一种Trithorax/Polycomb (ETP)蛋白的增强剂,是一种新的神经母细胞能力调节剂。
方法
我们使用GAL4/UAS系统驱动Hb在神经母细胞7-1 (NB7-1)中的持续错误表达,这是一个早期能力窗口已被很好地表征的模型谱系,以研究Corto在神经母细胞能力中的作用。我们使用了免疫dna荧光原位在全胚胎中进行DNA杂交(DNA FISH)来追踪基因的位置乙肝不同发育时期神经母细胞特异性基因位点的比较corto控制胚胎的突变体。最后,我们在全胚胎中使用免疫染色来检测Corto在抑制Hb和已知靶基因腹部B (Abd-B)中的作用。
结果
我们在corto突变体,乙肝基因重新定位到神经母细胞核膜延迟,早期能力窗口延长。基因重新定位的延迟发生在乙肝转录在神经母细胞中已经终止,而不是由于转录活性延长。此外,我们发现Corto基因与polycomb group complex 1 (PRC1)的核心亚基后性梳(Psc)相互作用,以终止早期能力。Corto的缺失不会导致Hb或其Hox靶点Abd-B的抑制,特别是在神经母细胞中。
结论
这些结果表明,在神经母细胞中,Corto基因与PRC1相互作用以调节核结构重组的时间,并支持在发育过程中以逐步方式实施不同的沉默机制以调节神经元后代细胞命运基因表达的模型。
背景
在昆虫和哺乳动物中,神经祖细胞以固定的出生顺序产生不同类型的细胞[1,2,3.,4,5,6,7]。在整个发育过程中,祖细胞逐渐失去产生早期神经细胞类型的能力,因为它们获得了产生晚期神经细胞类型的能力,从而建立了有组织的组织生长。因此,祖细胞有一个有限的时间窗口,在此期间它们能够指定每种神经细胞类型[8,9,10,11,12]。如何调节能力是理解正常发育和有效利用干细胞治疗的关键,但潜在的能力调节机制尚不清楚。
果蝇神经祖细胞称为神经母细胞,是研究能力调节机制的一种易于处理的模型系统。在胚胎腹侧神经索(VNC)中,30个双侧对称的神经母细胞经历了反复的不对称分裂,产生一个较小的神经节母细胞,该母细胞再次分裂产生有丝分裂后的神经后代。在每次分裂中,神经母细胞依次表达一系列转录因子,称为时间身份因子,包括驼背(Hb)、克虏伯(Kr)、Pou结构域转录因子1和2(统称为Pdm)、Castor (Cas),它们指定后代神经元的神经身份[2,13,14,15,16,17,18]。虽然神经母细胞只短暂地表达每个时间同一性因子,但来自每个神经母细胞分裂的神经元保持时间同一性因子的活跃表达,从而在分子上标记出它们的出生时间。
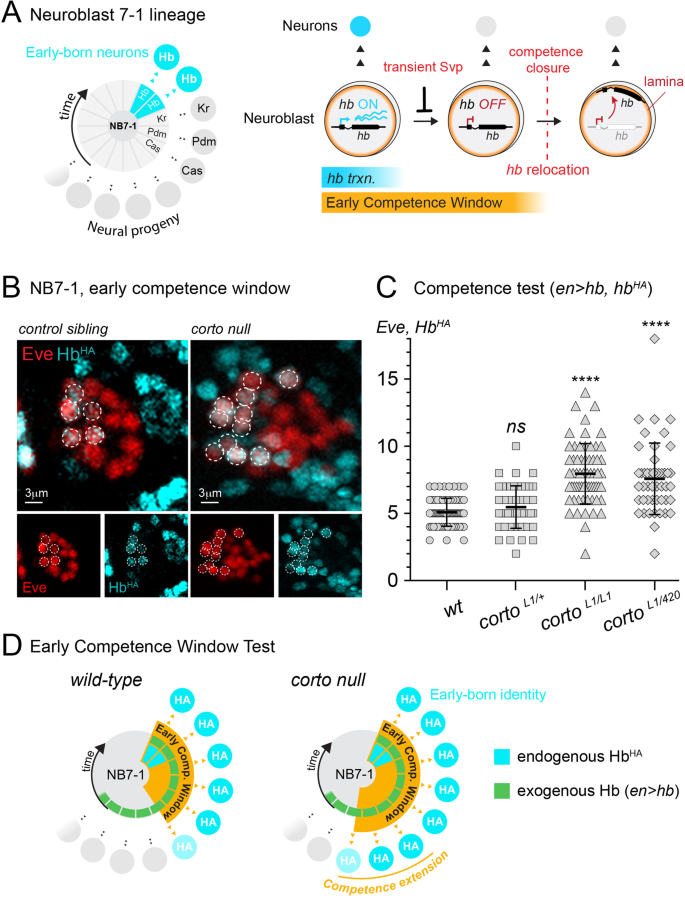
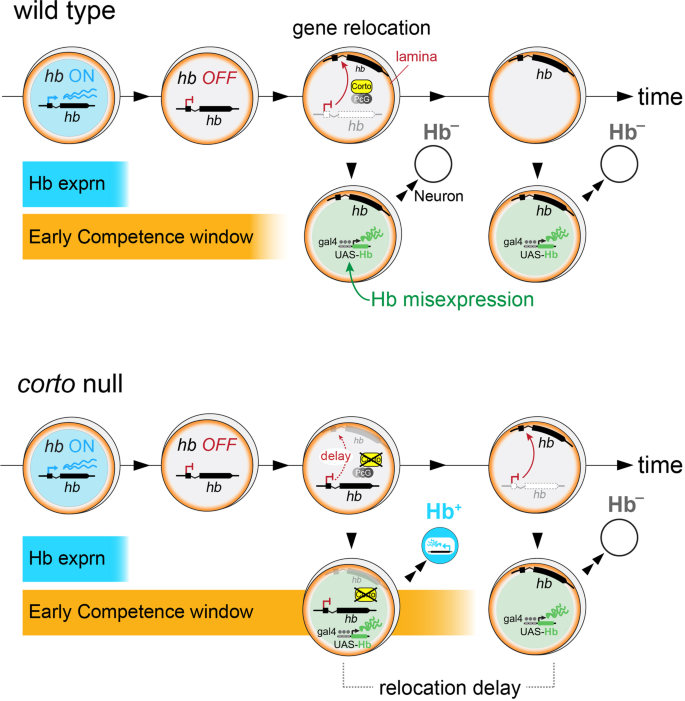
Hb是时间识别因子系列中的第一个,是一种锌指转录因子,它在多个神经母细胞谱系中指定早期出生的神经命运,类似于其哺乳动物同源物Ikaros,它促进视网膜和皮层的早期出生身份[19,20.]。在神经母细胞中,Hb仅在最初的一个或两个分裂中表达,并被其抑制因子Seven-up (Svp)的短暂表达迅速抑制[21,22]。虽然成神经细胞只是短暂地表达Hb,但它们仍然能够特异性表达乙肝-转录早期出生的神经元,然后进行几次额外的分裂乙肝在神经母细胞中受到抑制[9,11,12,23]。因此,“早期能力窗口”是神经母细胞产生早期出生神经元的潜力的一种表现,其特征是内源性的乙肝这种潜力可以通过鉴定在神经母细胞祖细胞中错误表达Hb而产生的神经子代来实验测量。在此之前,我们证明了早期能力窗口终止于乙肝基因在神经母细胞内物理地重新定位到核层[11,一个基因沉默中心[24,25]。这种向核层的运动发生在很久以后乙肝已经转录沉默,并呈现乙肝后代神经元中难以激活的基因。因此,Svp的转录抑制终止乙肝在神经母细胞内表达,物理重新定位乙肝基因到核层建立了一种遗传性沉默的基因状态,终止了早期的能力(图2)。1A)关于第二层次的机制所知甚少乙肝沉默。
早期能力窗口期延长中corto突变体。一个左, NB7-1谱系,神经后代按出生顺序顺时针排列。神经母细胞位于中心,并被分成时间段,在此期间,每个时间同一性因子都被表达。正确的,驼背(乙肝)受到Svp瞬态脉冲的转录抑制。几个部门之后乙肝基因迁移到核层,使基因在神经后代中难以激活,关闭了早期能力窗口。B具有代表性的NB7-1系早期能力测定corto突变体(cortoL1)与兄弟(杂合)对照胚胎相比。C早期能力窗口的量化(英文+哈+)。x轴显示基因型。每个数据点代表早出生(夏娃)的平均数量+哈+)来自单一NB7-1谱系的神经元。每个基因型至少有三个胚胎被量化。数据以mean±SD表示。P值表示与野生类型的比较。D原理概述corto突变能力表现型
在这里,我们确定了一个ETP蛋白Corto作为一个新的能力调节因子。失去科托会导致乙肝基因重新定位到神经母细胞核膜和延长能力,以确定早期出生的神经身份。此外,与ETP蛋白的功能一致,我们发现Corto基因与PRC1的核心亚基Psc相互作用,以终止早期能力。而polycomb (PcG)染色质因子因其在发育过程中维持其靶基因的基因抑制而闻名[26,27,28],失去Corto并不会导致抑郁乙肝在晚期成神经细胞中。总之,我们的研究结果为细胞核结构中的新调控因子和发育过程中神经祖细胞能力转变的时间提供了见解。
材料与方法
飞线
野生型(w1118),cortoL1,corto420(来自fracimdsamrique Peronnet博士的好意礼物,[29]),Psch27(布卢明顿,提单号5547),en-GAL4(铬II, [16,30.],UAS-hb(31],乙肝哈(11], UAS-corto [fracdsamrique Peronnet博士的厚礼,[29]]。果蝇在25℃的标准玉米粉和糖蜜培养基中饲养。
免疫染色和抗体
我们按照标准方案对胚胎进行免疫染色[32]。简单地说,我们将胚胎固定在用质子交换膜缓冲液(0.1 M Pipes, 1 mM MgS0)稀释的正庚烷和4%甲醛的一对一混合物中4(2 mM EGTA),并在室温下摇摇22分钟。随后取出固定液,在1:1的甲醇:庚烷混合物中剧烈摇动胚胎去卵化。去卵化的胚胎用PBS洗涤,用PBS-0.1% Tween 20 (PBT)稀释的一抗在4°C下孵育过夜。清洗后,胚胎在室温下二抗孵育1.5 h,链亲和素孵育20 min。使用的一抗有:小鼠抗eve(克隆3C10, 1:50, Developmental Studies Hybridoma Bank (DSHB)),大鼠抗ha(克隆3F10, 1:50, Sigma),兔抗lamin (1:2000, Paul Fischer博士赠送);大鼠抗worniu(#196,362,克隆5A3AD2, 1:20 00, Abcam),大鼠抗dpn(#195,172,克隆11D1CH11, 1:20 00, Abcam),小鼠抗ph3 (#14,955, 1:1000, Abcam),兔抗hb(1:20 00,克里斯多伊博士的礼物),大鼠抗zfh2(1:20 00,克里斯多伊博士的礼物),小鼠抗abdb(克隆1A2E9, 1:30, DSHB)。针对小鼠、兔子和大鼠的二抗与Alexa 488、555和647 (Thermo Fisher Scientific)结合。
Immuno-DNA鱼
DNA原位如前所述进行杂交(DNA-FISH) [11,23,33]。简单地说,将胚胎固定在新鲜制备的4%甲醛稀释的PIPES缓冲液中(60 mM KCl, 15 mM NaCl, 0.5 mM精胺,0.15 mM精胺,2mm EDTA, 0.5 mM EGTA, 15 mM PIPES pH 7.4),并在室温下与等体积的庚烷摇晃25分钟。胚胎在一比一的甲醇:庚烷溶液中剧烈摇动而去卵化。我们通过pcr扩增大约10kb的荧光探针乙肝基因组位点[11]并使用DNA FISH标签试剂盒(Thermo Fisher Scientific)。复水化后,胚胎在室温下用RNaseA (150 mg/ml)处理2 h,逐渐进入100%预杂交溶液(pHM: 50%甲酰胺;4 xssc;100 mM NaH2PO4, pH 7.0;0.1%(20岁之间)。37°C预杂交1小时后,胚胎在80°C下变性15分钟,在37°C杂交缓冲液(10%葡聚糖硫酸盐,50%去离子化甲酰胺,2XSSC, 0.5 mg/ml鲑鱼精子DNA)中稀释变性FISH探针孵育过夜。胚胎在37°C的一系列甲酰胺/0.3% CHAPS溶液中洗涤,每次洗涤甲酰胺减少。后原位杂交方案完成,胚胎随后根据标准免疫化学方案(见上文)进行免疫染色,安装在Vectashield (Vectorlabs)上,在蔡司LSM 700共聚焦显微镜上成像。附加协议细节可根据要求提供。
共焦成像
我们使用蔡司700 Axio Imager 2激光共聚焦扫描所有图像。在0.4µm步长下拍摄DNA-FISH图像,调整所有通道的针孔以使其具有相同的光学切片厚度。
量化和统计分析
我们使用Prism v8使用标准t检验。统计学意义是归类为:* * * * * < 0.01,< 0.001,* * * * < 0.0001。胚胎14-16期用于能力窗口试验。对于n代表单个神经母细胞的图表,每个基因型至少量化三个胚胎,对于n代表单个胚胎的平均值的图表,每个胚胎至少平均12个谱系。对于DNA FISH, n代表每个胚胎,图中显示了量化的FISH信号数量。图表表示用于统计分析的每个数据点,条形图表示平均值±标准差。
结果
失去科托延长了早期的能力窗口期
神经母细胞经历两种暂时分离的,不同类型的乙肝基因镇压。首先,乙肝在1 - 2个分裂后被Svp转录抑制。在第二个,几个小时和分裂后,已经转录抑制乙肝基因在物理上迁移到神经母细胞核层。这种重新定位导致可遗传的基因沉默,并使乙肝在后代神经元中难以激活的基因,从而关闭了早期能力窗口(图2)。1) (11,23]。因此,虽然成神经细胞通常产生一到两个早期出生的神经元,但它们能够产生更多的神经元,直到核结构重组终止能力。我们最近发现PcG因素在第二步中起关键作用,即终止神经母细胞的早期能力。PcG蛋白是一种染色质因子,其最著名的功能是通过两个多聚体复合物PRC1和PRC2的协同活性来调节基因抑制[26,28,34,35,36,37,38,39]。我们发现Psc是及时需要的乙肝基因重新定位到神经母细胞核膜和关闭早期能力窗口[j]。23]。
另一类蛋白质,ETP蛋白,已被证明与Trithorax和PcG复合物相互作用并调节靶基因。其中一种ETP蛋白Corto已被证明在基因上与Hox基因抑制中的PcG因子相互作用[29,40,41]并与大多数psc结合的多染色体位点共定位[42]。因此,我们假设Corto也可能在调节神经母细胞能力中起作用。为了验证这一点,我们重点研究了NB7-1,这是胚胎VNC的30个神经母细胞谱系之一,我们有标记来识别后代,并详细了解其谱系和能力的时间进展[9,11,12,16,23]。简单地说,我们利用了GAL4/UAS系统[43]并使用了十字的GAL4 (en-GAL4)驱动NB7-1在其整个谱系中强烈、持续的Hb表达(在>乙肝),并确定产生的早期出生神经元的数量,这是早期能力窗口长度的定量测量。区分内源性激活的Hb蛋白响应早期出生的身份规范和Hb蛋白错误表达UAS-hb构建了一种内源性编码细菌人工染色体(BAC)转基因,该转基因包含了乙肝基因组位点和所有的调控增强子。该BAC已被修改为包括与Hb融合的血凝素表位标签(HA),我们之前的工作表明,该BAC插入足以挽救a乙肝Null动物,并显示与本地相同的表达模式乙肝基因(11]。因此,我们能够使用HA作为内源性Hb表达的代理。我们共同染色Hb和Even跳过(Eve),这是NB7-1谱系的U运动神经元后代的标记,并量化了早期出生的神经元数量(Eve)+哈+)对持续的Hb错表达作出反应。我们注意到,在能力测定中,神经母细胞对Hb错误表达的反应程度是可变的,甚至在单个胚胎中的同源神经母细胞谱系中也是如此。因此,与特定基因型相关的早期能力窗口的长度表示为所有量化谱系的平均值。与5.1±1.0 Eve相比+哈+在野生型NB7-1中,我们发现了8.0±2.3个早生神经元cortoL1突变体(p< 0.0001)。为了控制任何可能的背景突变,我们还检查了两个独立功能等位基因缺失的跨杂合动物,cortoL1和corto420(44]并观察到一致的结果,分别产生7.6±2.7个早生神经元(p< 0.0001)。1B-D),表明早期能力窗口期延长。因此,Corto在终止中期胚胎发育的早期能力中起着重要作用。
乙肝向神经母细胞核层的迁移延迟于corto突变成神经细胞
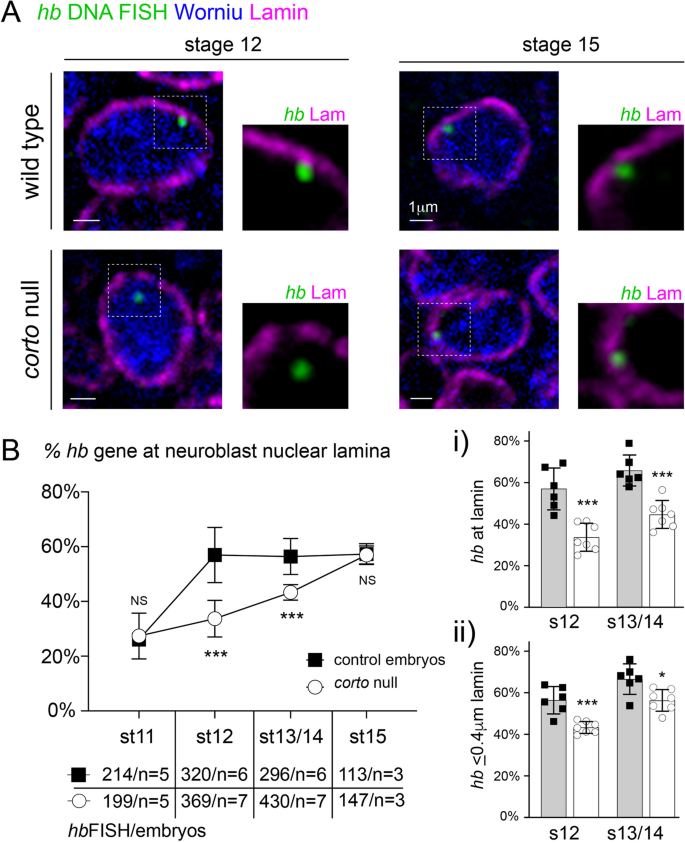
我们之前的研究表明,早期能力窗口关闭,当乙肝胚胎中期发生时基因迁移到神经母细胞核膜[j]。11,23]。因此,考虑到早期能力的扩展corto变种人,我们接下来检查乙肝基因定位corto使用在活的有机体内immuno-DNAFluorescence我n年代电联Hybridization(鱼)。胚胎与荧光DNA探针杂交,在约10kb处产生乙肝随后用Lamin Dm0(一种标记核膜的b型Lamin中间丝)和Worniu(一种神经母细胞特异性转录因子)进行免疫染色。在corto突变的神经母细胞,我们发现乙肝在胚胎发育中期(12期),野生型的核板基因位点(56.9±10.1%)明显减少,而野生型的核板基因位点(33.7±6.7%)明显减少corto−−/,P= 0.0004;13/14期:野生型为56.4 + 6.6%,野生型为43.3±2.8%corto−−/,P= 0.0006)。2A、B)。我们观察到乙肝定位于核层corto突变的神经母细胞,即使我们将FISH信号包含在靠近但不接触层(距离层蛋白≤0.4µm)的情况下也是如此(图2)。2B-ii)。有趣的是,野生型和corto随着时间的推移,突变体逐渐减少,到了15岁晚期,已经没有明显的差异了乙肝基因型间的基因-层间相关性(15期:野生型层间蛋白为57.3±3.8%,野生型为57.0±3.3%)corto−−/突变体,P=不显著)(图。2B).因此,数据表明corto突变体乙肝基因迁移到神经母细胞核膜的时间延迟。值得注意的是,我们没有观察到一个全有或全无的关联乙肝基因与核膜,甚至在11期,在早期能力窗口,~ 25%的乙肝基因位点定位于椎板。事实上,其他人的报告表明,甚至在层叠相关结构域之外的基因组区域也位于周围~ 30%的时间[45,46,47],强调了基因组的高度动态和非静态特性[48]。重要的是,我们观察到乙肝在野生型胚胎中期,与神经母细胞核膜相关的基因对神经母细胞的功能有影响corto突变体。
乙肝基因重新定位到神经母细胞核膜延迟corto突变体。一个单个z平面穿过完整12期和15期典型神经母细胞的细胞核,野生型或corto突变体(cortoL1)胚胎,选择在a的最亮的部分的位置乙肝DNA FISH信号(绿点)。免疫染色显示层蛋白(洋红色)和Worniu(泛神经母细胞,蓝色)的位置乙肝神经母细胞核三维空间内的基因座。更高的放大倍率乙肝每个FISH图像右侧显示的神经母细胞核内的基因座;为了清楚起见,没有显示Worniu。B的一部分乙肝野生型和野生型的核层位点(与核层蛋白信号像素重叠)corto发育过程中的突变胚胎神经母细胞。折线图中的每个数据点都是的平均分数乙肝多胚间板上的位点(数个)乙肝基因座和胚胎的定量(每个阶段如下)。NS,不显著。右边的条形图显示的是乙肝要么位点我)在lamin或(二)距离lamin 0.4µm内。条形图中的每个数据点代表一个胚胎。所有数据均以mean±SD表示
确认延迟在乙肝基因重新定位corto突变不是由于更普遍的神经母细胞分裂延迟,我们用泛神经母细胞标记物Deadpan (Dpn)和细胞分裂标记物phospho-histone 3 (PH3)共同染色胚胎。在12期和14期,分裂的神经母细胞数量没有差异。随着神经发生的进展,胚胎神经母细胞分裂的速度逐渐变慢corto突变体,提示神经母细胞增殖进展正常(图2)S1)。
正常Hb时间动态corto突变成神经细胞
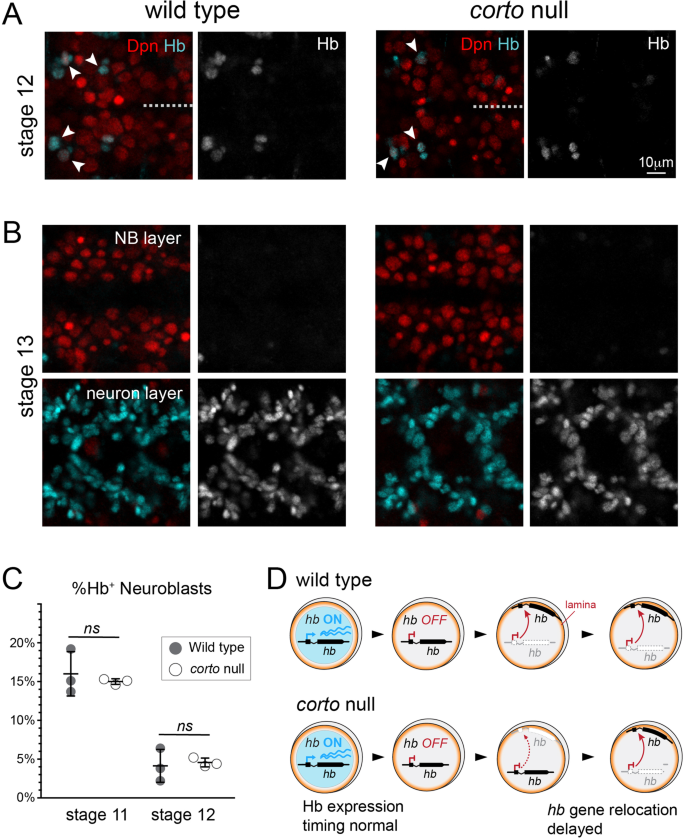
定位于核膜的基因通常处于抑制或沉默状态,而活跃转录的基因通常定位于核膜内部[49]。如果延迟乙肝在Corto突变胚胎中,基因重新定位到神经母细胞核层是由于长时间的发育乙肝在转录过程中,我们预计早期产生的神经元数量会随之增加。通过Eve的免疫染色,我们确实观察到偶尔异位的早期出生的神经元,但这种情况很少见(2 Eve)+乙肝+野生型的神经元平均2.1英寸cortoL1/420突变体)(图S2)。果蝇胚胎发育是高度定型的,允许我们使用形态学特征来比较不同基因型的阶段匹配动物,我们发现野生型和野生型之间神经母细胞中Hb抑制的时间没有质的差异corto突变体(无花果。3.到12期晚期,Hb仅在胸节段的少数神经母细胞中表达(图2)。3.A,箭头),在13期的任何神经母细胞中都检测不到,而是在胚胎更深处的神经元层中表达(图2)。3.B).在量化Hb的比例后+在11期和12期之间,当Hb在整个神经母细胞群体中迅速被抑制时,我们测量到野生型和野生型之间没有差异corto突变体,表明Hb被及时下调(图2)。3.C)进一步反对Corto作为一个强有力的角色乙肝我们发现,Corto在神经母细胞中的过表达对早期出生神经元的产生没有影响(图2)S3),与…相反乙肝的已知的转录抑制因子Svp,它在过度表达时减少早期出生神经元的数量[21]。因此,受损的人乙肝基因层重定位表型corto我们在12-14期(产卵后7-11小时,AEL)观察到的突变神经母细胞情况良好乙肝后是已经转录下调,而重新定位的表型是不是由于延长乙肝转录(在7小时AEL之前)使其留在核内部。
Psc和Corto基因相互作用限制了早期能力窗口期
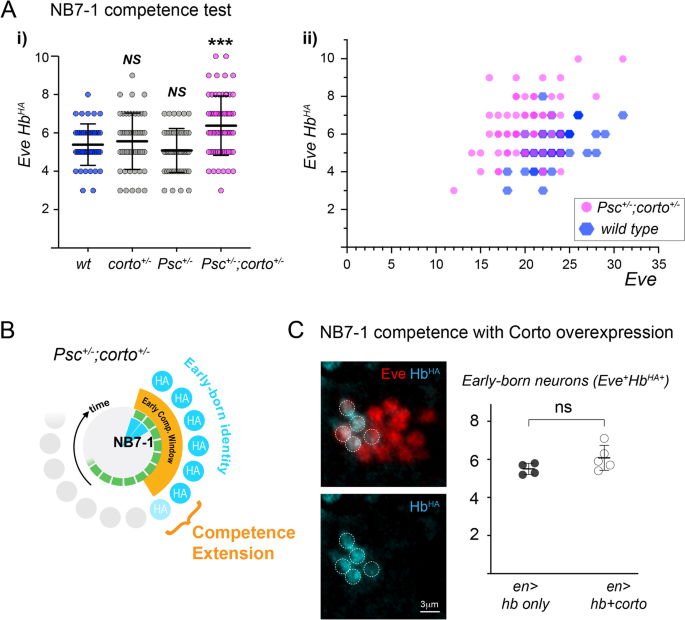
据报道,Corto与PcG染色质因子相互作用以维持基因抑制[29,40]。特别是,Corto与Psc在多丝质染色体上共享许多结合位点[40,42],它在PRC1沉默活动中起着核心作用[27]。我们通过测试跨杂合子突变胚胎的早期能力窗口,询问Corto和Psc是否在基因上相互作用以终止能力。我们检查了14-16期的胚胎,NB7-1谱系的末端,发现两者都没有Psc杂合子或corto杂合子单独具有胜任型表型(P值不显著);Psch27 /+;cortoL1 /+异杂合子动物具有较长的早期能力(图2)。4) (Psch27 /+;cortoL1 /+6.4±1.5 vs野生型5.4 + 1.1;P= 0.0004)。考虑到即使在同一胚胎内的同源神经母细胞中对Hb错误表达的反应也存在差异,我们将数据作为散点图显示,显示了相对于夏娃的早期出生神经元的数量+神经元,代表血红蛋白错表达谱系中的细胞总数(图2)。4A-ii)。Psch27 /+;cortoL1 /+总的来说,与夏娃数量相似的野生型神经母细胞相比,转杂合子神经母细胞产生的早期出生神经元的比例更高+表明在Hb错误表达水平相当的神经母细胞中,能力增加。我们注意到,在分析的阶段中,夏娃的数量+正如预期的那样,年龄较大的胚胎中细胞数量更高(14期:18.7±2.9夏娃)+14期的细胞n= 5个胚胎的68个谱系,vs第15/16期:23.0±3.6;n=来自8个胚胎的136个谱系p< 0.0001),而Eve+哈+(早期出生的)神经元与分期(14期:5.9±1.5 Eve)无关+哈+神经元vs 15/16期:5.6±1.4,无统计学意义)。这证实了所有取样的胚胎都完成了早期神经元的生成。总之,我们得出结论,Psc和Corto基因相互作用关闭能力窗口指定早期出生的神经元。
Corto和Psc基因相互作用关闭了早期能力窗口。一个i), NB7-1谱系早期能力测定比较野生型,cortoL1 /+,Psch27 /+,或cortoL1 /+Psc;27日/+transheterozygous胚胎。柱状图代表平均值±SD。的散点图野生型和cortoL1 /+Psc;27日/+数据,显示夏娃的数量+哈+(早期出生的)神经元与单个NB7-1谱系中Eve神经元总数的关系。每个数据点代表单个NB7-1谱系的能力数据,每个基因型量化为三到四个胚胎。B描述结果的圆形示意图。C有无Corto共过表达的早期能力窗测试。NB7-1谱系显示Hb和Corto共错表达en-Gal4司机,Hb染色哈(青色)和夏娃(红色)。定量显示在右边。每个数据点代表了来自单个胚胎的至少12个神经母细胞谱系的平均值。柱状图代表平均值±SD
相比之下,过度表达Corto对能力没有任何影响。野生型动物平均为5.5±0.3 Eve+哈+血红蛋白错误表达的神经元(68个半节段)n= 4个胚胎),Corto共过表达的结果无统计学差异,为6.1±0.3 Eve+哈+神经元(从n= 5个胚胎)(图。4C).如果Corto主要通过与PcG复合物的相互作用在神经母细胞中起作用,也许一个或多个PcG复合物亚基的化学计量学或活性水平是限速的。
在神经母细胞中,Corto不能维持Hb或Hox基因(腹部B)的抑制
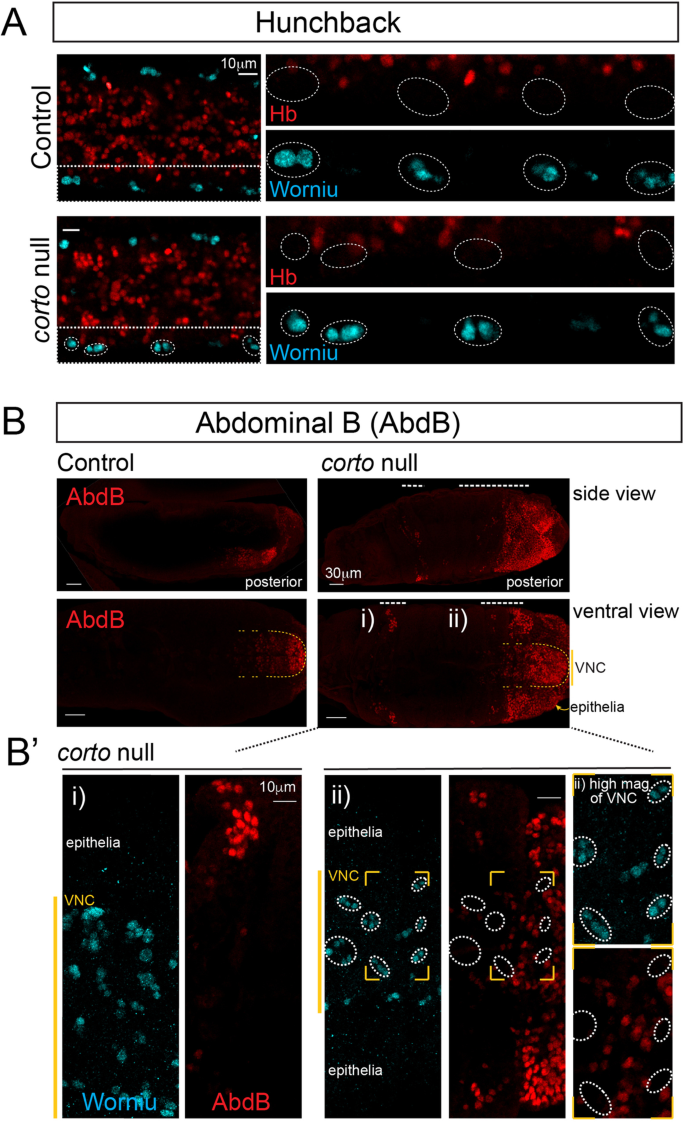
PcG因子在维持靶基因抑制中的作用已经得到了很好的研究。据报道,作为PcG的增强剂,Corto在抑制已知PcG Hox靶基因Abd-B中起着类似的作用,而Corto的缺失会导致其抑制[41]。我们最近的研究[23表明乙肝内含子区域是一个强大的PcG靶点,PRC1的缺失会损害PcG功能乙肝gene-lamina搬迁。然而,有趣的是,即使在胚胎晚期,PcG的缺失也不会导致成神经细胞的Hb下降。此外,即使是最严重的PRC1 (Psc-Su (z) 2P3C)和PRC2(母系和合子突变体)额外的性梳子,esc垫/ zyg),在晚期胚胎中未显示出任何Hb的神经母细胞抑制[23],提出了PcG因子可能在这种细胞类型的转录抑制中不起作用的可能性。因此,我们检测了晚期Hb的表达corto突变胚胎来确定Hb是否变得低表达。与PRC1突变体相似,我们也没有发现Hb在晚期神经母细胞中降低corto突变胚(图2)5A),而我们确实观察到在corto突变体,与之前的观察结果一致[41],令人惊讶的是,抑制仅限于上皮细胞,我们没有发现Abd-B在神经母细胞中抑制(图2)。5c)。综上所述(图2)。6),我们的结果表明,Corto是需要及时搬迁的乙肝基因转移到神经母细胞核层,并与PRC1基因相互作用终止早期能力。然而,它并没有起到维持的作用乙肝基因抑制,与它已知的功能不同,它在已知目标的抑制中不起作用Abd-B在神经母细胞内。
讨论
在这里,我们确定Corto作为神经母细胞早期能力的调节器果蝇胚胎。失去科托会导致乙肝神经母细胞中基因向核膜的重新定位和早期能力窗口期的延长。而在神经母细胞谱系的一个子集中发现的额外早期出生的神经元数量较少corto突变胚胎可能表明神经母细胞Hb表达偶尔延长,我们没有观察到Hb转录动力学的任何可测量的变化corto神经母细胞群体中的突变体。相比之下,在乙肝基因重新定位在神经母细胞中是稳健的,并且在治疗后大量发生乙肝基因已经被抑制,因此不是转录活动延长的结果。
在果蝇胚胎中,成神经细胞短暂地表达一系列暂时的身份因素,这些因素赋予来自每个分裂的神经元特定的特征。Hb是第一个时间身份因素,指定了早期出生的身份,其中包括内源性激活乙肝有丝分裂后神经元内的基因。在有丝分裂后神经元中直接错误表达Hb不能诱导乙肝转录(11,12]。神经元的分子特性,包括其激活和维持的能力乙肝内源性转录,必须在神经母细胞祖细胞内建立并随后遗传。因此,神经母细胞“启动”了由神经子代激活的未来转录程序。关键是,神经母细胞产生乙肝-转录早期出生的神经元不结束时乙肝是在神经母细胞内转录受到抑制,而是在几次分裂之后乙肝基因迁移到核层。在搬迁,乙肝在后代神经元内变得难以激活,从而关闭了早期能力窗口。这种遗传的沉默需要柯尔托乙肝基因重新定位到神经母细胞核膜。然而,在corto突变体只是延迟,而不是完全阻断乙肝基因逐渐增加与椎板的联系,可能是由于与其相互作用的PcG因子的补偿。与这一观点一致的是,仅仅过度表达Corto并不会缩短早期能力窗口期。
我们关注的是乙肝作为研究成神经细胞能力调节机制的模式基因,因为它是在其他多样化的早期神经元群体中唯一普遍表达的基因,但目前尚不清楚Hb本身在VNC的有丝分裂后早期神经元中起什么作用,如果有的话。rnai介导的NB7-1神经子代中Hb的下调不会改变神经元形态或影响幼虫的运动速度[50]。我们推测乙肝在有丝分裂后神经元中,是否只有一个广泛的转录程序的组成部分是由神经母细胞的核结构根据早期出生的身份规范建立的乙肝转录可能反映了其表观遗传状态,而不是这些神经元功能的要求。然而,在胚胎后的大脑中,有丝分裂后神经元中的Hb已被证明在两性二态的神经元间神经突起形态中起重要作用[51],最近的一项研究证实了Hb在幼虫Pair1神经元突触数量、连通性和行为方面的功能作用[52]。在全基因组范围内确定神经母细胞中基因-层间相互作用,并将这些层相关基因与神经母细胞能力、基因表达和神经元功能联系起来,对未来的研究具有重要意义。在此背景下,确定核结构的交互作用因子并了解其功能机制是一个需要进一步研究的关键领域。这里我们找到了科尔托,这影响乙肝基因重新定位而不影响乙肝转录动力学。
虽然Corto已被证明参与了pcg介导的沉默[40,41],我们在胚胎后期的神经母细胞中未观察到任何Hb抑制,这与我们最近对PcG的观察结果一致[23]。而PcG因子结合乙肝基因位点和必需的乙肝在神经母细胞中,基因重新定位不具有调节功能乙肝转录抑制,偏离了他们在维持靶基因抑制中的众所周知的角色。进一步支持在神经母细胞中缺乏抑制作用,过度表达Corto并没有减少早期出生的神经元数量,这与报道的Svp相反。乙肝的既定转录抑制因子[21,22]。此外,PcG和Corto已被证明是抑制PcG Hox靶基因Abd-B所必需的,并且与其他人的观察相似,我们发现Abd-B在corto突变体。然而,有趣的是,虽然我们在上皮细胞中发现了Abd-B的抑制,但我们在神经母细胞中没有观察到这种情况。也许这表明PcG/Corto在神经母细胞中具有独特的作用,通过促进其核结构的变化,这一功能独立于它们在转录抑制中的作用。需要进一步研究PcG/Corto在神经母细胞中更普遍的作用,比较基因组结构和转录调节,并了解这种活性如何影响神经母细胞的能力,以决定神经元的身份和功能。
结论
越来越多的证据表明,在动物发育过程中,基因组结构的三维组织在调节祖细胞的转录和能力状态方面发挥着重要作用[53,54]。我们已经确定了一种ETP类染色质因子Corto,作为神经母细胞能力的一种新的调节因子。Corto是需要及时搬迁的乙肝基因转移到神经母细胞核层,并与Psc基因相互作用,关闭早期能力窗口。在神经母细胞中,失去Corto不会产生影响乙肝转录动力学也不会导致Abd-B的抑制,这与它在Abd-B抑制中的已知作用不同。通过识别新的染色质能力调节因子,我们的研究结果为祖细胞能力如何被调节提供了进一步的机制见解在活的有机体内.总之,结果表明,随着神经母细胞年龄的增长,多种不同的抑制机制以循序渐进的方式依次作用,以终止神经母细胞指定早期出生的神经身份的能力。
数据和材料的可用性
没有产生数据集或新的蝇群。本手稿中使用的蝇股可从公共库存中心获得,或将根据要求提供给通讯作者。
参考文献
布罗迪T,奥登瓦尔德WF。发育中的神经系统细胞多样性:来自果蝇的时间观点。发展。2002;129(16):3763 - 70。
李建军,李建军。发育过程中的时间命运规范与神经祖细胞能力。中华神经科学杂志,2013;14(12):823-38。
Livesey FJ, Cepko CL。脊椎动物神经细胞命运的决定:来自视网膜的教训。中华神经科学杂志,2001;2(2):109-18。
等慢性和异慢性移植后雪貂视觉皮质神经元的命运。中华神经科学杂志。1988;8(3):945-74。
王晓明,王晓明。细胞类型排序:中枢神经系统干细胞的时间规范。中华神经医学杂志,2009;19(2):112-9。
Rossi AM, Fernandes VM, Desplan C.大脑发育中的时序过渡。中华神经医学杂志,2017;42(2):84 - 92。
神经系统发育:大型神经谱系的时间模式。中国生物医学工程学报,2017;27(10):394 - 4。
Cepko CL,等。脊椎动物视网膜细胞命运的决定。科学通报,1996;30(2):589-95。
Cleary MD, Doe CQ。神经母细胞能力的调节:多个时间身份因素在单个早期能力窗口内指定不同的神经元命运。基因发育,2006,20(4):429-34。
Hirabayashi Y,等。Polycomb限制了神经前体细胞的神经发生能力,促进了星象命运的转变。神经元。2009;63(5):600 - 13所示。
Kohwi M,等。发育调控的亚核基因组重组限制了果蝇的神经祖细胞能力。细胞。2013;152(2):97 - 108。
李建军,李建军。果蝇神经母细胞能力的调控。大自然。2003;425(6958):624 - 8。
Baumgardt M等。在一个谱系中,神经元亚型规范通过对立的时间前馈回路。细胞。2009;139(5):969 - 82。
布罗迪T,奥登瓦尔德WF。果蝇中枢神经系统谱系发育过程中神经母细胞基因表达的程序化转化。中国生物医学工程学报,2000;26(1):34-44。
Grosskortenhaus R等。果蝇神经母细胞时间同一性转变的调控。生态学报,2005;8(2):193-202。
Isshiki T,等。果蝇神经母细胞依次表达指定其神经元后代的时间身份的转录因子。细胞。2001;106(4):511 - 21所示。
李建军,李建军,李建军,等。Pdm和Castor指明了NB7-1谱系中晚生的运动神经元身份。基因学报,2006;20(18):2618-27。
Bahrampour S等。由时间增殖程序控制的神经谱系进展。开发单元,2017;43(3):332-348e4。
Alsio JM,等。伊卡洛斯促进了大脑皮层中早期出生的神经元命运。美国国家科学促进会。2013年,110 (8):E716-25。
Elliott J,等。Ikaros赋予小鼠视网膜祖细胞早期时间能力。神经元。2008;60(1):26 39。
Kanai MI, Okabe M, Hiromi Y. 7 -up果蝇神经母细胞时间特性的转录因子调控开关。生态学报,2005;8(2):203-13。
杨建军,杨建军,李建军,等。果蝇神经母细胞谱系中驼背的时空调节。发展。2006;133(3):429 - 37。
Lucas T,等。离散的顺式作用元件在体内调节发育时间基因-层重新定位和神经祖细胞能力。生物医学工程学报,2011;36(6):1249 - 1263。
舍韦廖夫YY,努尔明斯基DI。作为基因沉默中心的核层。现代生物学报,2011;14(1):27-38。
van Steensel B, Belmont AS。层相关结构域:与染色体结构、异染色质和基因抑制的联系。细胞。2017;169(5):780 - 91。
王晓明,王晓明,王晓明,等。多梳蛋白转录沉默的研究进展。寒泉生态学报,2014;6(11):a019331。
King IF,等等。对多梳蛋白群的分析确定了核小体模板抑制活性与体内功能之间的联系区域。中国生物医学工程学报,2009;25(5):559 - 561。
施瓦茨YB,等。果蝇多梳靶点的全基因组分析。植物学报,2006;38(6):700-5。
Lopez A等corto与Pc-G和trx-G基因相互作用,维持果蝇幼虫超胸腔表达的前边界。中国生物医学工程学报。2001;26(4):572 - 583。
Harrison DA,等。果蝇Janus激酶(JAK)的激活导致造血肿瘤和发育缺陷。中华医学杂志。1995;14(12):2857-65。
Wimmer EA等。果蝇胸椎节不依赖于双歧体的形成。科学。2000;287(5462):2476 - 9。
Rothwell w.f.a.s., W,果蝇胚胎的荧光分析。果蝇协议。2000,冷泉港:冷泉港出版社。
Bantignies F,等。果蝇远端Hox位点之间的多梳依赖调控联系。细胞。2011;144(2):214 - 26所示。
Negre N,等。果蝇发育过程中PcG蛋白的染色体分布。公共科学图书馆生物学》杂志上。4 (6): e170。2006;
李建军,李建军,李建军,等。多梳基团复合物的募集及其在细胞命运选择的动态调控中的作用。发展。2009;136(21):3531 - 42。
李建军,李建军,李建军,等。多梳群基因对abdA和AbdB同源产物的空间调控作用。发展。1992;114(2):493 - 505。
G.果蝇正确开始片段测定所需的一个基因产物。大自然。1981;293(5827):36-41。
Tolhuis B,等。黑腹果蝇PRC1和PRC2多梳染色质结合的全基因组分析。植物学报,2006;38(6):694-9。
张建军,张建军,张建军,等。果蝇Hox基因的遗传沉默分析。发展。2001;128(6):993 - 1004。
打捞J等。果蝇Corto蛋白与Polycomb-group蛋白和GAGA因子相互作用。核酸学报,2003;31(11):2873-82。
打捞J等。果蝇三胸和多梳corto增强子与细胞周期蛋白G相互作用。科学通报,2008;3(2):888。
等。ccf是一种新的果蝇基因,编码染色体因子,其突变通过有丝分裂影响进程,并与Pc-G突变相互作用。中华医学杂志。1998;17(4):1063-75。
靶向基因表达作为改变细胞命运和产生显性表型的手段。发展。1993;118(2):401 - 15所示。
Mouchel-Vielh E,等。果蝇翅膀发育过程中MP1支架蛋白参与ERK信号调控。基因工程学报,2008;13(11):1099-111。
Guelen L,等。核层相互作用图谱揭示人类染色体结构域组织。大自然。2008;453(7197):948 - 51。
Harr JC,等。染色质定向靶向核层是由染色质状态和a型核层介导的。中国生物医学工程学报,2015;33(1):393 - 393。
Zullo JM,等。核层染色质的DNA序列依赖性区隔化和沉默。细胞。2012;149(7):1474 - 87。
J类,等。单个人类细胞核层相互作用的全基因组图谱。细胞。2015;163(1):134 - 47岁。
Meister P等。线虫发育过程中组织特异性启动子的空间动态。基因发育,2010;24(8):766-82。
Hirono K,等。驼背时间转录因子建立,但不是必需的,早期出生的神经元身份维持。神经网络学报,2017;12(1):1。
Goto J,等。中间神经元树突的两性二态形成与驼背转录因子有关。中华神经科学杂志。2011;31(14):5454-9。
Lee KM, Linskens AM, Doe CQ。驼背激活有丝分裂后Pair1神经元的Bicoid,调节突触数量。bioRxiv:生物学预印本服务器。冷泉港:冷泉港实验室;2021.
李建平,李建平。核结构与神经发育和功能的表观遗传调控。神经科学。2014;264:39-50。
李建军,李建军,李建军,等。从昆虫到哺乳动物:基因组结构在神经发育中的调控。中国生物医学工程学报,2019;39(1):556 - 556。
致谢
我们感谢弗莱姆·帕隆内博士(法国国家科学研究中心)提供的科托蝇群。我们感谢Paul Fisher博士(Stonybrook University)提供的纤层蛋白抗体。我们感谢Gary Struhl博士(哥伦比亚大学)对科学的有益讨论。我们感谢纳塔莉亚·莫洛特科娃博士提供的技术援助。我们感谢dr。Tanguy Lucas和Rui galv
资金
这项工作得到了NICHD (R00HD072035和HD092381)、Rita Allen基金会和Whitehall基金会的支持。
作者信息
作者及单位
贡献
T.L.H.和M.K.设计了这项研究。t.l.h., s.p., d.t.,和MK执行实验,收集和分析数据。T.L.H.和M.K.写了手稿。所有作者都阅读并批准了最终的手稿。
相应的作者
道德声明
伦理批准并同意参与
不适用,因为本文中没有脊椎动物或人类受试者。
发表同意书
所有作者都同意这篇手稿。
相互竞争的利益
作者声明没有利益冲突。
额外的信息
出版商的注意
伟德体育在线施普林格·自然对已出版的地图和机构关系中的管辖权要求保持中立。
补充信息
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,该协议允许以任何媒介或格式使用、共享、改编、分发和复制,只要您适当地注明原作者和来源,提供知识共享许可协议的链接,并注明是否进行了更改。本文中的图像或其他第三方材料包含在文章的知识共享许可协议中,除非在材料的署名中另有说明。如果材料未包含在文章的知识共享许可中,并且您的预期用途不被法律法规允许或超过允许的用途,您将需要直接获得版权所有者的许可。如欲查阅本许可证副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域免责声明(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非在数据的信用额度中另有说明。
关于本文
引用本文
Hafer, t.l., Patra, S., Tagami, D.。et al。三胸/多梳增强剂,Corto,调节时间驼背基因重新定位与能力果蝇成神经细胞。神经系统开发17, 3(2022)。https://doi.org/10.1186/s13064-022-00159-3
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s13064-022-00159-3
关键字
- 成神经细胞的能力
- 临时身份
- 驼背
- Corto
- Polycomb
- 核板
- 核架构