- 研究文章gydF4y2Ba
- 开放获取gydF4y2Ba
- 发表:gydF4y2Ba
小脑菱形唇谱系基因的遗传缺失可通过心室区衍生祖细胞的适应性重编程刺激代偿gydF4y2Ba
神经系统发育gydF4y2Ba体积gydF4y2Ba14gydF4y2Ba,文章号:gydF4y2Ba4gydF4y2Ba(gydF4y2Ba2019gydF4y2Ba)gydF4y2Ba
摘要gydF4y2Ba
背景gydF4y2Ba
小脑是一个叶状的后脑结构,参与协调运动和认知。小脑在出生后经历了快速的生长,这是由于Sonic Hedgehog (SHH)信号依赖的ATOH1+颗粒细胞前体(GCPs)在体外颗粒细胞层(EGL)的增殖,这是产生小脑叶面化和正确数量的颗粒细胞的关键步骤。由于发育较晚,小脑特别容易受到早产和分娩周围压力的伤害。我们最近发现了发育中的小脑通过自适应重编程netin表达祖细胞(NEPs)来补充消融的GCPs的内在能力。然而,这种补偿机制是否发生在影响发育中的小脑的小鼠突变体中,并可能导致对表型的错误解释尚不清楚。gydF4y2Ba
方法gydF4y2Ba
我们使用了两种不同的方法来去除GCPs中的主要SHH信号激活因子GLI2: 1)我们的马赛克突变分析,利用时空重组控制(MASTR)技术进行删除gydF4y2BaGli2gydF4y2Ba在gcp的一小部分;2)一个gydF4y2BaAtoh1-CregydF4y2Ba转基因删除gydF4y2BaGli2gydF4y2Ba在大部分EGL中。利用遗传诱导命运图谱(Genetic Inducible Fate Mapping, GIFM)和活体成像(live imaging)分析了NEPs的行为gydF4y2BaGli2gydF4y2Ba删除。gydF4y2Ba
结果gydF4y2Ba
马赛克分析表明,SHH-GLI2信号通路对于通过维持GCPs处于未分化的增殖状态并促进其存活来生成正确的颗粒细胞池至关重要。尽管如此,失活gydF4y2BaGLI2gydF4y2Ba在胚胎中大量GCPs的减少并没有导致成人小脑大小的预期显著减小。GIFM发现NEPs确实补充了GCPsgydF4y2BaGli2gydF4y2Ba条件突变,然后扩大和部分恢复颗粒细胞的生产。此外,依赖SHH信号的NEP补偿需要gydF4y2BaGli2gydF4y2Ba,表明通路的激活物侧参与其中。gydF4y2Ba
结论gydF4y2Ba
我们证明,导致GCPs中SHH信号缺失的小鼠条件突变不足以诱导长期严重的小脑发育不良。新生儿小脑在细胞损失后通过NEPs反应再生的能力,因此在解释表型时必须考虑gydF4y2BaAtoh1-CregydF4y2Ba影响gcp的条件突变体。gydF4y2Ba
背景gydF4y2Ba
小脑(CB)由人脑中80%的神经元组成[gydF4y2Ba1gydF4y2Ba](60%的小鼠[gydF4y2Ba2gydF4y2Ba]),并参与平衡和运动协调,但也通过整个前脑的连接调节语言、推理和社会过程[gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba4gydF4y2Ba,gydF4y2Ba5gydF4y2Ba,gydF4y2Ba6gydF4y2Ba,gydF4y2Ba7gydF4y2Ba].在人类的孕晚期和婴儿阶段,以及在小鼠出生后的前2周,CB主要是由于外颗粒细胞层(EGL)中颗粒细胞前体(GCP)池的扩张[gydF4y2Ba8gydF4y2Ba,gydF4y2Ba9gydF4y2Ba,gydF4y2Ba10gydF4y2Ba].与其他大脑区域相比,脑转区发育较晚,因此对出生前后影响生长(或造成损伤)的环境和临床因素特别敏感。此外,CB发育不全和产前损伤是与自闭症相关的第二大主要因素[gydF4y2Ba11gydF4y2Ba].因此,确定调节小脑发育的基因是很重要的。许多基因是基于纯合无突变小鼠的运动缺陷,或在去除特定细胞系中的基因的条件突变体中被鉴定出来的。然而,涉及基因不发挥作用的世系的内在生长补偿机制可能会掩盖基因在小脑生长中的正常功能。gydF4y2Ba
CB由两个生发区发展而来。心室区(VZ)产生所有抑制性神经元,包括浦肯野细胞(PCs) [gydF4y2Ba12gydF4y2Ba]以及出生后在小脑皮层中扩展的巢蛋白表达祖细胞(NEPs),以产生星形胶质细胞,包括特化伯格曼神经胶质细胞和晚出生的分子层中间神经元[gydF4y2Ba13gydF4y2Ba,gydF4y2Ba14gydF4y2Ba].gydF4y2BaPtf1agydF4y2BaCregydF4y2Ba小鼠被用来删除抑制性神经元和一些神经胶质细胞中的基因[gydF4y2Ba15gydF4y2Ba].兴奋性神经元包括颗粒细胞(GCs)起源于上菱形唇[gydF4y2Ba16gydF4y2Ba,gydF4y2Ba17gydF4y2Ba,gydF4y2Ba18gydF4y2Ba].在小鼠中,EGL在胚胎日(E) 13.5和E15.5之间建立。gydF4y2BaAtoh1gydF4y2Ba-表达的GCPs在EGL中增殖和扩张,直到出生后第15天(P),以响应pc分泌的Sonic Hedgehog (SHH) [gydF4y2Ba19gydF4y2Ba,gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba21gydF4y2Ba].当GCPs成为有丝分裂后,它们沿着Bergmann胶质纤维迁移,形成内部颗粒细胞层(IGL)。有趣的是,在啮齿类动物模型中,已发现发育中的CB具有从某些损伤中恢复的非凡能力[gydF4y2Ba22gydF4y2Ba,gydF4y2Ba23gydF4y2Ba,gydF4y2Ba24gydF4y2Ba].事实上,我们最近发现,在围产期EGL因照射而急性耗竭后,增殖的小脑GCPs可以通过NEPs的适应性重编程来替代[gydF4y2Ba25gydF4y2Ba,gydF4y2Ba26gydF4y2Ba,gydF4y2Ba27gydF4y2Ba].因此,新生儿CB中的NEPs具有高度的可塑性行为。然而,NEPs是否被利用来补充发育突变体中丢失的细胞,这些突变体缺乏GCPs扩增和存活所需的关键因子,尚未得到解决。gydF4y2Ba
驱动CB发展的主要途径之一是HH信号。有三只刺猬(gydF4y2BaHhgydF4y2Ba)哺乳动物的基因gydF4y2Ba印度gydF4y2Ba(gydF4y2Ba本次事件gydF4y2Ba),gydF4y2Ba沙漠gydF4y2Ba(gydF4y2BaDhhgydF4y2Ba),gydF4y2Ba嘘gydF4y2Ba[gydF4y2Ba28gydF4y2Ba,gydF4y2Ba29gydF4y2Ba].gydF4y2Ba嘘,gydF4y2Ba最广泛表达的gydF4y2BaHhgydF4y2Ba基因,是大多数器官发育所必需的[gydF4y2Ba29gydF4y2Ba通过调节多种细胞行为,包括细胞死亡、增殖、规范和轴突引导。细胞环境(即组织、发育阶段、其他信号通路的收敛)和SHH的浓度被认为决定了细胞对SHH的特定反应。HH信号转导由受体Patched1 (PTCH1)和Smoothened (SMO)介导[gydF4y2Ba28gydF4y2Ba,gydF4y2Ba29gydF4y2Ba,gydF4y2Ba30.gydF4y2Ba].在没有HH信号的情况下,PTCH1构成性地抑制SMO活性,而HH结合则可以缓解这种抑制,部分原因是允许SMO在纤毛中积累[gydF4y2Ba31gydF4y2Ba].GLI/Ci转录因子是HH通路的效应器。在哺乳动物中,GLIs的转录激活因子(A)和抑制因子(R)功能被这三种蛋白质分开[gydF4y2Ba32gydF4y2Ba].一个普遍的规律是,高水平的HH信号可诱导GLI2激活物(GLI2gydF4y2Ba一个gydF4y2Ba),这导致转录和翻译的附加激活剂,GLI1gydF4y2Ba一个gydF4y2Ba,而配体的减少或缺失允许形成GLI3阻遏物(GLI3gydF4y2BaRgydF4y2Ba).重要的是,我们证明了这一点gydF4y2BaGli1gydF4y2Ba表达依赖于GLI2/3gydF4y2Ba一个gydF4y2Ba,因此只在接受高水平HH信号的细胞中表达[gydF4y2Ba33gydF4y2Ba,gydF4y2Ba34gydF4y2Ba].这三个gydF4y2BaGligydF4y2Ba的基因,gydF4y2Ba嘘gydF4y2Ba,gydF4y2BaSmogydF4y2Ba,gydF4y2BaPtch1gydF4y2Ba而且gydF4y2BaPtch2gydF4y2Ba都表达在CB中,除了gydF4y2BaPtch2gydF4y2Ba是CB发展所必需的[gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba21gydF4y2Ba,gydF4y2Ba35gydF4y2Ba,gydF4y2Ba36gydF4y2Ba,gydF4y2Ba37gydF4y2Ba].特别是,我们已经证明了SHH通过诱导GLI1发挥作用gydF4y2Ba一个gydF4y2Ba/ 2gydF4y2Ba一个gydF4y2Ba并主要是在出生后扩大gcp所必需的[gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba38gydF4y2Ba],而在E12.5之后,小脑不再需要Gli3 [gydF4y2Ba36gydF4y2Ba].除了SHH在生成GCs库中的关键作用外,nep的扩张以及由此产生的nep衍生的中间神经元和星形胶质细胞(星形胶质细胞和Bergmann胶质细胞)也需要SHH信号[gydF4y2Ba13gydF4y2Ba,gydF4y2Ba25gydF4y2Ba,gydF4y2Ba39gydF4y2Ba].此外,NEPs中的hh信号对于EGL损伤后NEPs的扩张、EGL的恢复和中间神经元数量的缩放至关重要[gydF4y2Ba25gydF4y2Ba].gydF4y2Ba
在这里我们报告删除gydF4y2BaGli2gydF4y2Ba在绝大多数GCPs中不足以诱发严重小脑发育不全。使用我们的master技术[gydF4y2Ba40gydF4y2Ba]在删除效果的马赛克突变分析中gydF4y2BaGli2gydF4y2Ba在分散的GCPs中,我们发现HH/ gli2信号通路对于维持GCPs处于未分化和增殖状态并促进其存活确实是必要的。然而,类似于当辐照耗尽EGL时,我们发现NEPs被利用来重新填充EGL,然后野生型祖细胞分化为GCsgydF4y2BaGli2gydF4y2Ba在大多数gcp中使用gydF4y2BaAtoh1gydF4y2Ba驱动本构Cre [gydF4y2Ba41gydF4y2Ba].我们的研究结果不仅为CB从围产期应激中恢复的不同寻常的能力提供了更多的证据,而且还揭示了在研究涉及GCP发育或生存的基因时,应考虑nep依赖的补偿gydF4y2BaAtoh1-CregydF4y2Ba转基因。gydF4y2Ba
方法gydF4y2Ba
动物gydF4y2Ba
使用以下鼠标行:gydF4y2BaGli2gydF4y2Ba液氧/液氧gydF4y2Ba[gydF4y2Ba20.gydF4y2Ba),gydF4y2BaAtoh1-CregydF4y2Ba[gydF4y2Ba41gydF4y2Ba),gydF4y2BaAtoh-FlpoER, Nestin-FlpoERgydF4y2Ba(类似于[]中所描述的转基因。gydF4y2Ba40gydF4y2Ba])和gydF4y2BaRosa26gydF4y2BaMASTR (frt-STOP-frt-GFPcre)gydF4y2Ba[gydF4y2Ba40gydF4y2Ba),gydF4y2BaAtoh1-GFPgydF4y2Ba[gydF4y2Ba42gydF4y2Ba),gydF4y2BaNes-CFPgydF4y2Ba[gydF4y2Ba43gydF4y2Ba),gydF4y2BaRosa26gydF4y2BaFRT-STOP-FRT-TDTomgydF4y2Ba(杰克逊实验室,021875)。gydF4y2Ba的gydF4y2BaAtoh-FlpoERgydF4y2BaFLPoER1 cDNA表达,[gydF4y2Ba40gydF4y2Ba]通过将其子克隆到gydF4y2BaAtoh1gydF4y2Ba表达式结构描述于[gydF4y2Ba17gydF4y2Ba].所有小鼠系都维持在近亲繁殖的瑞士韦伯斯特背景上,雌雄都被用于分析。动物被安置在12小时的明暗循环中,并自由地获得食物和水。所有实验均采用0 ~ 30岁小鼠进行。gydF4y2Ba
将他莫昔芬(Tm, Sigma-Aldrich)以20 mg/ml溶解于玉米油(Sigma-Aldrich)中。P2gydF4y2BaAtoh1-FlpoER / +;R26gydF4y2BaMASTR / +gydF4y2Ba;gydF4y2BaGli2gydF4y2Ba液氧/液氧gydF4y2BaAtoh1-FlpoER / +;R26gydF4y2BaMASTR / +gydF4y2Ba;gydF4y2BaGli2gydF4y2Ba液氧/液氧gydF4y2Ba和P0gydF4y2BaNes-FlpoER / +;R26gydF4y2BaFSF-TDTom / +gydF4y2Ba,gydF4y2BaNes-FlpoER / +;R26gydF4y2BaFSF-TDTom / +gydF4y2Ba;Atoh-GFP / +gydF4y2Ba老鼠和gydF4y2BaNestin-FlpoER / +;R26gydF4y2BaMASTR / +gydF4y2Ba;gydF4y2BaGli2gydF4y2Ba液氧/液氧gydF4y2Ba,gydF4y2BaAtoh1-Cre / +;Gli2gydF4y2Ba液氧/液氧gydF4y2Ba而且gydF4y2BaNestin-FlpoER;R26gydF4y2BaMASTR / +gydF4y2Ba;gydF4y2BaAtoh1-Cre / +;Gli2gydF4y2Ba液氧/液氧gydF4y2Ba小鼠和同窝对照组皮下注射Tm,剂量为200 μg/g。50 μg/g 5-乙基-2_-脱氧尿苷(EdU;在动物死亡前1小时通过腹腔注射(10mg /ml无菌生理盐水)给药。gydF4y2Ba
组织处理、免疫组化(IHC)和转录本检测gydF4y2Ba
对于小于P4的动物,通过冷却麻醉,并将大脑解剖出来,在4%的多聚甲醛中固定在4℃过夜。P4-30动物腹腔注射氯胺酮50 μl,经心灌流冰PBS,再加4%多聚甲醛。收集大脑,4°C浸泡在4%多聚甲醛中过夜。在最佳切割温度(OCT)化合物中对组织进行冷冻包埋,并在12 μm的Leica低温恒温器上沿旁矢状面进行切片。对于IHC,切片用以下一抗在4℃下孵育过夜:兔抗ki67 (Thermo Scientific, rm9106 - s0),小鼠抗p27 (BD Pharmigen, 610,241),兔抗pax6 (Millipore, AB2237),山羊抗gli2 (R&D System, AF3635),山羊抗sox2 (R&D System, AF2018),兔抗gfp (Life Technologies, A11122),大鼠抗gfp (Nacalai Tesque, 04402 - 84),小鼠抗neun (Millipore, MAB377)稀释于PBS中5% BSA (Sigma-Aldrich)和0.3% Triton X-100 (Fisher Scientific)。然后将切片在室温下暴露于与适当的Alexa Fluor (1:500;英杰公司)。免疫组化反应后使用商业试剂盒(Life Technologies)检测EdU。按照标准方案进行TUNEL染色和原位杂交。gydF4y2BaCregydF4y2Ba而且gydF4y2BaGli1gydF4y2Ba以cdna为模板,合成高氧蛋白标记的核糖探针。图像在DM6000徕卡显微镜上收集,并使用Photoshop软件进行处理。gydF4y2Ba
实时成像gydF4y2Ba
如前所述进行体外小脑切片培养[gydF4y2Ba25gydF4y2Ba].将P8小脑嵌入2.5%的低熔点琼脂糖中,在250 μM振动仪上进行矢状切片。切片立即被带到徕卡TCS SP8或SP5共聚焦显微镜平台。切片保存在Eagle 's基础培养基中,加入2 mM l -谷氨酰胺、0.5%葡萄糖、50 U/ml青霉素-链霉素、1xB27和1xN2补充剂,37°C和5% COgydF4y2Ba2gydF4y2Ba.每5分钟获取一组图像,持续4小时。使用Imaris软件进行细胞跟踪。采用自回归跟踪函数,光斑尺寸为6 μM,步长为7 μM。进行手动校正。gydF4y2Ba
量化和统计分析gydF4y2Ba
用ImageJ软件测量面积(mmgydF4y2Ba2gydF4y2Ba)中线附近的小脑部分。所有免疫组化染色均使用ImageJ和neuroucida Software进行细胞计数。对于每个发育阶段,每只动物分析3个切片,且≥3只动物。采用Prism软件(GraphPad)进行统计学分析,在gydF4y2BaPgydF4y2Ba< 0.05。所有统计分析均为双尾分析。对于方差相等的两组比较,由gydF4y2BaFgydF4y2Ba-test,一个未配对的学生的gydF4y2BatgydF4y2Ba使用Test。韦尔奇的修正被用于未配对gydF4y2BatgydF4y2Ba-方差不等的正态分布数据的检验。gydF4y2BaPgydF4y2Ba数值在图中显示。没有使用统计方法来预先确定样本量,但我们的样本量与该领域通常使用的样本量相似。未采用随机分组。数据收集和分析并不是无视实验条件而进行的。gydF4y2Ba
结果gydF4y2Ba
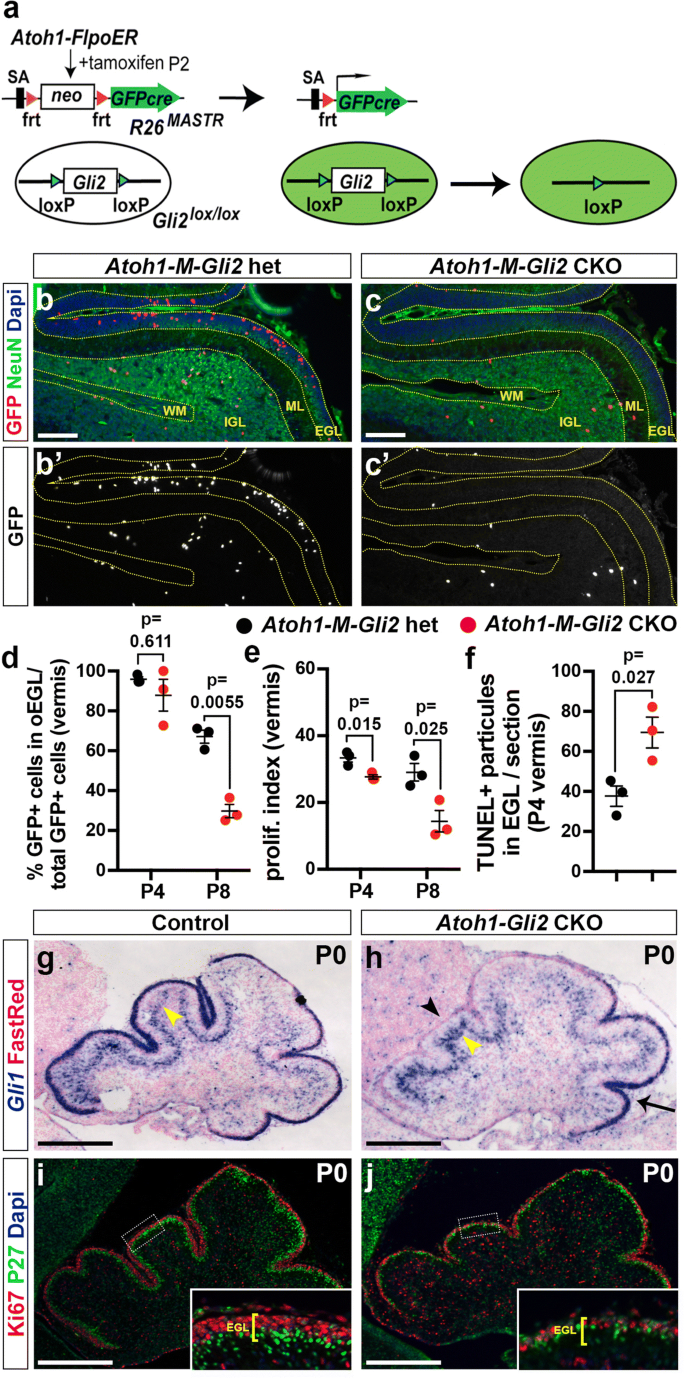
马赛克分析显示SHH-GLI2信号通路对于维持GCPs处于无分化增殖状态并促进其存活至关重要gydF4y2Ba
我们之前的研究表明,妊娠中期整个CB中大部分hh信号的丢失(gydF4y2BaNes-Gli2gydF4y2Ba条件敲除或CKO -gydF4y2BaNestin-Cre;Gli2gydF4y2Ba液氧/液氧gydF4y2Ba小鼠)导致出生时GCPs几乎完全缺乏,成年时CB也大大减少[gydF4y2Ba20.gydF4y2Ba].由于在NEPs中,出生后需要hh信号来扩展和生产中晚期出生的中间神经元和星形胶质细胞[gydF4y2Ba13gydF4y2Ba]时,有可能在gydF4y2BaNes-Gli2gydF4y2BaCKOs是由于非gcp细胞中hh信号的丢失。因此,我们采取了两种方法来测试GCPs中HH信号的细胞自主需求。首先我们使用gydF4y2BaR26gydF4y2BaFSF-GFPcregydF4y2Bamaster等位基因(gydF4y2BaR26gydF4y2BaMASTRgydF4y2Ba) [gydF4y2Ba40gydF4y2Ba]和agydF4y2BaAtoh1-FlpoERgydF4y2Ba转基因敲除gydF4y2BaGli2gydF4y2Ba在P2给他莫昔芬(Tm),并分析P4和P8未分化GFP+ GCPs(增殖外EGL中GFP+细胞/总GFP+细胞-增殖和有丝分裂后)的百分比(图3)。gydF4y2Ba1gydF4y2Baa - c)。我们确实观察到在P8的内侧CB(蚓部)中GFP+细胞的百分比显著下降gydF4y2BaAtoh1-M-Gli2gydF4y2Backo (gydF4y2BaR26gydF4y2BaMASTR / +gydF4y2Ba;gydF4y2BaAtoh1-FlpoER / +;Gli2gydF4y2Ba液氧/液氧gydF4y2Ba老鼠;gydF4y2BangydF4y2Ba= 3;)相比gydF4y2BaAtoh1-M-Gli2gydF4y2Ba异质(het)控制(gydF4y2BaR26gydF4y2BaMASTR / +gydF4y2Ba;gydF4y2BaAtoh1-FlpoER / +;Gli2gydF4y2Ba液氧/ +gydF4y2Ba老鼠;gydF4y2BangydF4y2Ba= 3)(29.79%比67.09%)(图;gydF4y2Ba1gydF4y2Bad).使用1 h的EdU脉冲,我们发现的增殖指数(#EdU+ EGL外GFP+细胞/ EGL外GFP+细胞总数)gydF4y2BaAtoh1-M-Gli2gydF4y2Ba与对照组相比,CKO GCPs显著降低(gydF4y2BangydF4y2Ba= 3;14.39%, 29.06%)(图;gydF4y2Ba1gydF4y2Bae). P4时,未分化GFP+ GCPs的百分比在两组间无显著差异gydF4y2BaAtoh1-M-Gli2gydF4y2Ba首席顾问及控制(gydF4y2BapgydF4y2Ba= 0.162)(图gydF4y2Ba1gydF4y2Bad).但是,我们观察到P4的增殖指数明显下降gydF4y2BaAtoh1-M-Gli2gydF4y2BaCKO小脑(CKO vs对照组,gydF4y2BapgydF4y2Ba= 0.015)(图gydF4y2Ba1gydF4y2Bae). P4时,Tm注射后仅2天,oEGL中GFP+细胞数量未明显减少(CKO vs对照组,gydF4y2BapgydF4y2Ba= 0.081)(附加文件gydF4y2Ba1gydF4y2Ba:图S1a)。然而,TUNEL染色显示P4时整个EGL的细胞死亡显著增加(突变体为69.44±7.76/节,对照组为37.67±5.1 /节。gydF4y2BapgydF4y2Ba= 0.027)。我们在侧侧CB(半球)中进行了相同的分析,发现了类似的结果(附加文件)gydF4y2Ba1gydF4y2Ba:图S1b-d)。这些结果表明,hh -信号通路通过GLI2在维持GCPs处于未分化状态中发挥重要作用,并促进其增殖和存活。gydF4y2Ba
HH-GLI2信号通路使GCP维持在未分化状态,促进其存活。gydF4y2Ba一个gydF4y2Bamaster方法的示意图表示。的gydF4y2BaR26gydF4y2BaMASTRgydF4y2Ba等位基因在Flp诱导缺失a时表达GFPcre融合gydF4y2BaneogydF4y2Ba(停止)磁带。当gydF4y2BaR26gydF4y2BaMASTRgydF4y2Ba等位基因和gydF4y2BaAtoh1-FlpoERgydF4y2Ba转基因与柔性基因相结合,如gydF4y2BaGli2gydF4y2Ba在P2给药3天内,bb0 98%的GFP+细胞发生loxP位点重组。突变细胞及其子代随后可通过持续表达的eGFP从gydF4y2BaR26gydF4y2Ba等位基因。gydF4y2BabgydF4y2Ba-gydF4y2BacgydF4y2Ba免疫组化(FIHC)检测P8对照组中矢状切面(小叶VII和VIII)的指示蛋白和dapigydF4y2BaR26gydF4y2BaMASTR / +gydF4y2Ba;gydF4y2BaAtoh1-FlpoER / +;Gli2gydF4y2Ba液态氧/ +gydF4y2Ba(gydF4y2BaAtoh1-M-Gli2gydF4y2Bahet,gydF4y2BabgydF4y2Ba),gydF4y2BaR26gydF4y2BaMASTR / +gydF4y2Ba;gydF4y2BaAtoh1-FlpoER / +;Gli2gydF4y2Ba液态氧/液态氧gydF4y2Ba(gydF4y2BaAtoh1-M-Gli2gydF4y2BaCKO,gydF4y2BacgydF4y2Ba)小鼠在P2处理Tm。gydF4y2BadgydF4y2Ba-gydF4y2BafgydF4y2BaP8时外EGL中GFP+细胞比例图(gydF4y2BangydF4y2Ba= 3) (gydF4y2BadgydF4y2Ba), P8的增殖指数(oEGL中所有[GFP+]细胞的% [GFP+ EdU+]细胞)(gydF4y2BangydF4y2Ba= 3) (gydF4y2BaegydF4y2Ba)和P4处每段TUNEL+粒子数(gydF4y2BangydF4y2Ba= 3) (gydF4y2BafgydF4y2Ba)gydF4y2BaAtoh1-M-Gli2gydF4y2BaHet(控制,黑色)和gydF4y2BaR26gydF4y2BaMASTR / +gydF4y2Ba;gydF4y2BaAtoh1-FlpoER / +;Gli2gydF4y2Ba液态氧/液态氧gydF4y2Ba(gydF4y2BaAtoh1-M-Gli2gydF4y2BaCKO,红色)P2处给予Tm处理的小鼠。所有的分析都在每个大脑的3个中线切片上进行。所有图形数据以均数±标准差表示,显著性采用双尾t检验。gydF4y2BaggydF4y2Ba-gydF4y2BahgydF4y2Ba的原位杂交gydF4y2BaGli1gydF4y2Ba小脑中矢状面P0上的mRNAgydF4y2BaGli2gydF4y2Ba液态氧/液态氧gydF4y2Ba(控制,gydF4y2BaggydF4y2Ba),gydF4y2BaAtoh1-Cre / +;Gli2gydF4y2Ba液态氧/液态氧gydF4y2Ba(gydF4y2BaAtoh1-Gli2gydF4y2BaCKO,gydF4y2BahgydF4y2Ba老鼠)。黑色箭头表示丢失gydF4y2BaGli1gydF4y2Ba前位突变EGL的表达,黑色箭头gydF4y2BaGli1gydF4y2Ba残留在EGL后部,黄色箭头表示gydF4y2BaGli1gydF4y2Ba柏格曼神经胶质在浦肯野细胞层(PCL)中的表达。gydF4y2Ba我gydF4y2Ba-gydF4y2BajgydF4y2BaFIHC检测小脑P0中矢状面指示蛋白和dapigydF4y2BaGli2gydF4y2Ba液态氧/液态氧gydF4y2Ba(控制,gydF4y2Ba我gydF4y2Ba),gydF4y2BaAtoh1-Cre / +;Gli2gydF4y2Ba液态氧/液态氧gydF4y2Ba(gydF4y2BaAtoh1-Gli2gydF4y2BaCKO,gydF4y2BajgydF4y2Ba老鼠)。高倍图像显示的区域由白色矩形表示,EGL的厚度由黄色括号表示。比例尺为100 μm (gydF4y2BabgydF4y2Ba-gydF4y2BacgydF4y2Ba)和500 μm (gydF4y2BaggydF4y2Ba-gydF4y2BajgydF4y2Ba)gydF4y2Ba
作为花叶突变体分析的另一种方法,我们删除了gydF4y2BaGli2gydF4y2Ba在绝大多数一般地价中(gydF4y2BaAtoh1-Cre / +;Gli2gydF4y2Ba液氧/液氧gydF4y2Ba或gydF4y2BaAtoh1-Gli2gydF4y2Backo)。与之前使用整个小脑的研究一致gydF4y2BaCregydF4y2Ba转基因和我们的镶嵌分析,在P0前蚓部gydF4y2BaAtoh1-Gli2gydF4y2Backo (gydF4y2BangydF4y2Ba= 5)始终小于对照组(gydF4y2BaGli2gydF4y2Ba液氧/液氧gydF4y2Ba), EGL大大降低(图。gydF4y2Ba1gydF4y2Bag-j)。SHH-GLI2信号缺失证实为缺失gydF4y2BaGli1gydF4y2Ba在EGL中的表达gydF4y2BaAtoh1-Gli2gydF4y2BaCKO小脑(图。gydF4y2Ba1gydF4y2Bag-h)。此外,在突变EGL中,由于不存在两个不同的EGL层,外层EGL的增殖(Ki67)和分化(P27标记内部EGL的有丝分裂后细胞)被中断。gydF4y2Ba1gydF4y2Bai j)。有趣的是,我们观察到的明显增加gydF4y2BaGli1gydF4y2Ba在浦肯野细胞层(PCL)的表达表明gydF4y2BaGli2gydF4y2Ba在EGL中诱导细胞在这一层中非自主上调hh信号(图中星号)。gydF4y2Ba1gydF4y2Bag-h)。后蚓部缺乏表型可能是由于低表达gydF4y2BaCregydF4y2Ba[gydF4y2Ba44gydF4y2Ba]在这个区域,因此低重组[gydF4y2Ba45gydF4y2Ba](附加文件gydF4y2Ba2gydF4y2Ba:图S2)。gydF4y2Ba
综上所述,这些结果证实了sh -信号通路通过GLI2促进EGL的扩张,从而确保生成正确数量的GCs的重要作用。gydF4y2Ba
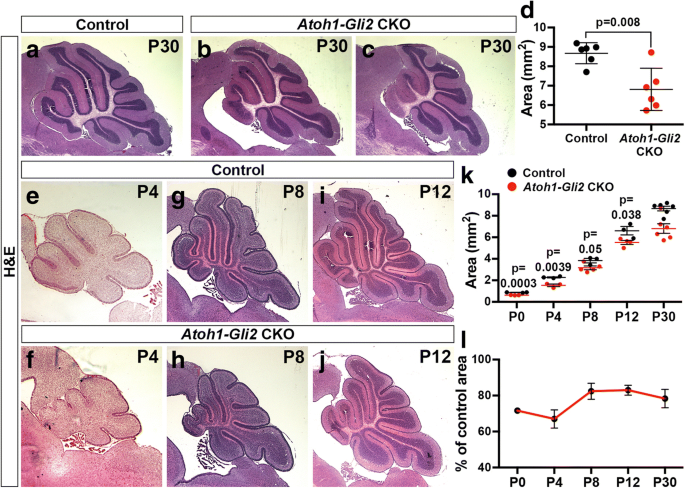
的大小gydF4y2BaAtoh1-Gli2gydF4y2BaCKO小脑在出生后逐渐恢复gydF4y2Ba
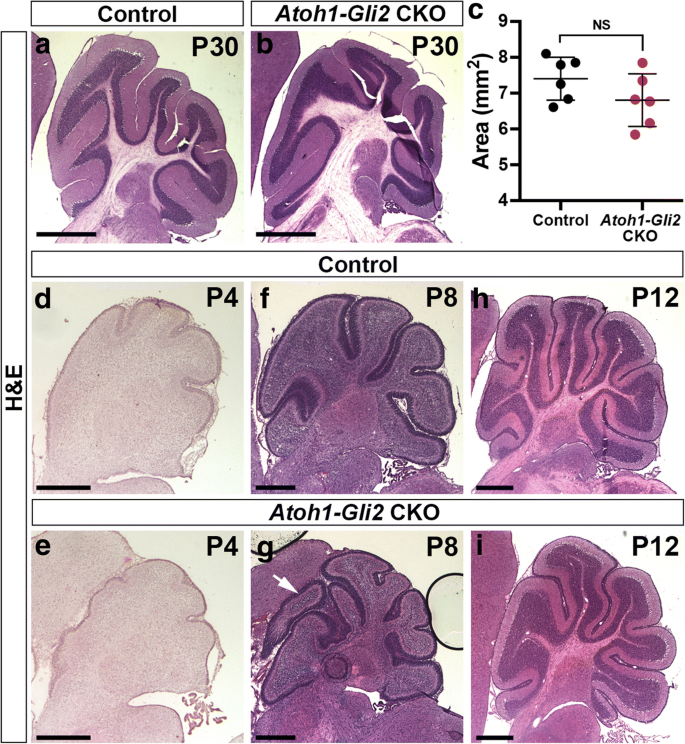
我们最近的研究表明,在出生后EGL损伤(照射)后,中旋子的大小可以恢复到正常大小的80% [gydF4y2Ba25gydF4y2Ba].以测试基因是否消融gydF4y2BaGli2gydF4y2Ba可以触发类似的恢复机制,我们分析了成人的表型(P30)gydF4y2BaAtoh1-Gli2gydF4y2BaCKO小脑。P30动物的中矢状切面面积被量化,仅显示了21.7±12.0%的减少(gydF4y2BangydF4y2Ba= 6) ingydF4y2BaAtoh-Gli2gydF4y2Ba相对于同窝对照的CKOs(图。gydF4y2Ba2gydF4y2Ba模拟)。与正常小鼠不同,我们观察到突变体小脑中线区域和IGL消耗程度存在很大的变异性,这表明一些突变体小脑比其他突变体更能恢复EGL。gydF4y2Ba2gydF4y2Ba然后,我们测量了P4、P8和P12小鼠的中矢状小脑切片面积,以确定与对照组相比,突变小鼠的生长轨迹(图2)。gydF4y2Ba2gydF4y2Bae-j)。的大小gydF4y2BaAtoh1-Gli2gydF4y2Ba在所有时间点,小脑部位的CKOs显著减少~ 20%(图。gydF4y2Ba2gydF4y2Bak-l)。因为我们的花叶突变体结果显示了类似的行为gydF4y2BaGli2gydF4y2BaCKO GCPs在半球和蚓部,我们分析了表型gydF4y2BaAtoh1-Gli2gydF4y2Ba在西半球的co。奇怪的是,与蚓部不同的是,与对照组相比,在P30时,我们没有观察到突变体半球的大小有显著减少(gydF4y2BapgydF4y2Ba= 0.152)。gydF4y2Ba3.gydF4y2Baa - c)。P4的半球矢状切面分析(gydF4y2BangydF4y2Ba= 3), p8 (gydF4y2BangydF4y2Ba= 3)和P12 (gydF4y2BangydF4y2Ba= 3)揭示了细胞结构如何恢复(图;gydF4y2Ba3.gydF4y2Bad - i)。有趣的是,蚓部gydF4y2BaAtoh1-Gli2gydF4y2BaP8的CKOs小鼠表现出明显的发育不全表型,大脑半球表现出额外的小叶(图中箭头所示)。gydF4y2Ba3.gydF4y2Bag),提出了中CB两个位置的不同补偿响应gydF4y2BaAtoh1gydF4y2Ba-gydF4y2BaGli2gydF4y2Backo。gydF4y2Ba
小脑的大小部分恢复gydF4y2BaAtoh-Gli2gydF4y2Ba随着时间的推移。gydF4y2Ba一个gydF4y2Ba-gydF4y2BacgydF4y2BaP30正中矢状切面gydF4y2BaGli2gydF4y2Ba液态氧/液态氧gydF4y2Ba(控制,gydF4y2Ba一个gydF4y2Ba),gydF4y2BaAtoh1-Cre / +;Gli2gydF4y2Ba液态氧/液态氧gydF4y2Ba(gydF4y2BaAtoh1-Gli2gydF4y2BaCKO,gydF4y2BabgydF4y2Ba-gydF4y2BacgydF4y2Ba)小脑用Hematoxilin和Eosin染色(H&E)。gydF4y2BadgydF4y2BaP30中矢状CB切面面积图gydF4y2BaGli2gydF4y2Ba液态氧/液态氧gydF4y2Ba(对照,黑色)(gydF4y2BangydF4y2Ba= 6)和gydF4y2BaAtoh1-Cre / +;Gli2gydF4y2Ba液态氧/液态氧gydF4y2Ba(gydF4y2BaAtoh1-Gli2gydF4y2BaCKO,红色)(gydF4y2BangydF4y2Ba6)老鼠。gydF4y2BaegydF4y2Ba-gydF4y2BajgydF4y2BaP4中矢状间扣切面(gydF4y2BaegydF4y2Ba-gydF4y2BafgydF4y2Ba), p8 (gydF4y2BaggydF4y2Ba-gydF4y2BahgydF4y2Ba)及P12 (gydF4y2Ba我gydF4y2Ba-gydF4y2BajgydF4y2Ba)gydF4y2BaGli2gydF4y2Ba液态氧/液态氧gydF4y2Ba(控制,gydF4y2BaegydF4y2Ba,gydF4y2BaggydF4y2Ba而且gydF4y2Ba我gydF4y2Ba),gydF4y2BaAtoh1-Cre / +;Gli2gydF4y2Ba液态氧/液态氧gydF4y2Ba(gydF4y2BaAtoh1-Gli2gydF4y2BaCKO,gydF4y2BafgydF4y2Ba,gydF4y2BahgydF4y2Ba而且gydF4y2BajgydF4y2Ba)用H&E染色的小鼠。gydF4y2BakgydF4y2Ba的3个中矢状截面的面积图gydF4y2BaGli2gydF4y2Ba液态氧/液态氧gydF4y2Ba(控制,P0:gydF4y2BangydF4y2Ba= 3, p4:gydF4y2BangydF4y2Ba= 3, p8:gydF4y2BangydF4y2Ba= 3, p12:gydF4y2BangydF4y2Ba= 3和P30:gydF4y2BangydF4y2Ba= 6)和gydF4y2BaAtoh1-Cre / +;Gli2gydF4y2Ba液态氧/液态氧gydF4y2Ba(gydF4y2BaAtoh1-Gli2gydF4y2BaCKO P0:gydF4y2BangydF4y2Ba= 3, p4:gydF4y2BangydF4y2Ba= 3, p8:gydF4y2BangydF4y2Ba= 6, p12:gydF4y2BangydF4y2Ba= 4和P30:gydF4y2BangydF4y2Ba= 6)小脑。gydF4y2BalgydF4y2Ba图中显示的3个中矢状切面面积的减少gydF4y2BaAtoh1-Gli2gydF4y2Ba小脑CKO在发育过程中占对照的百分比。所有图形数据以均数±标准差表示,显著性采用双尾t检验。比例尺代表1毫米gydF4y2Ba
大脑半球比蚓部恢复得更好gydF4y2BaAtoh1-Gli2gydF4y2BaCKO老鼠。gydF4y2Ba一个gydF4y2Ba-gydF4y2BabgydF4y2BaP30的半球形矢状切面gydF4y2BaGli2gydF4y2Ba液态氧/液态氧gydF4y2Ba(控制,gydF4y2Ba一个gydF4y2Ba),gydF4y2BaAtoh1-Cre / +;Gli2gydF4y2Ba液态氧/液态氧gydF4y2Ba(gydF4y2BaAtoh1-Gli2gydF4y2BaCKO,gydF4y2BabgydF4y2Ba)小脑血精/伊红染色(H&E)。gydF4y2BacgydF4y2BaP30半球形矢状切面面积图gydF4y2BaGli2gydF4y2Ba液态氧/液态氧gydF4y2Ba(对照,黑色)(gydF4y2BangydF4y2Ba= 6)和gydF4y2BaAtoh1-Cre / +;Gli2gydF4y2Ba液态氧/液态氧gydF4y2Ba(gydF4y2BaAtoh1-Gli2gydF4y2BaCKO,红色)(gydF4y2BangydF4y2Ba= 6) cb。(gydF4y2BadgydF4y2Ba-gydF4y2Ba我gydF4y2Ba) P4的半球矢状切面(gydF4y2BadgydF4y2Ba-gydF4y2BaegydF4y2Ba), p8 (gydF4y2BafgydF4y2Ba-gydF4y2BaggydF4y2Ba)及P12 (gydF4y2BahgydF4y2Ba-gydF4y2Ba我gydF4y2Ba)gydF4y2BaGli2gydF4y2Ba液态氧/液态氧gydF4y2Ba(控制,gydF4y2BadgydF4y2Ba,gydF4y2BafgydF4y2Ba而且gydF4y2BahgydF4y2Ba),gydF4y2BaAtoh1-Cre / +;Gli2gydF4y2Ba液态氧/液态氧gydF4y2Ba(gydF4y2BaAtoh1-Gli2gydF4y2BaCKO,gydF4y2BaegydF4y2Ba,gydF4y2BaggydF4y2Ba而且gydF4y2Ba我gydF4y2Ba)小脑H&E染色。白色箭头表示存在额外的叶叶。比例尺代表1毫米(gydF4y2Ba一个gydF4y2Ba-gydF4y2BabgydF4y2Ba)和500 μm (gydF4y2BabgydF4y2Ba-gydF4y2BacgydF4y2Ba而且gydF4y2BadgydF4y2Ba-gydF4y2Ba我gydF4y2Ba)gydF4y2Ba
总之,我们发现EGL在P0通过去除gydF4y2BaGli2gydF4y2Ba在P30时,从胚胎GCPs中提取的蛋白质不足以诱导蚓部一致的严重发育不全。这提出了一种补偿机制的可能性,允许在EGL基因耗尽后部分恢复发育中的CB。gydF4y2Ba
野生型细胞补充前EGLgydF4y2BaAtoh1gydF4y2Ba-gydF4y2BaGli2gydF4y2BackogydF4y2Ba
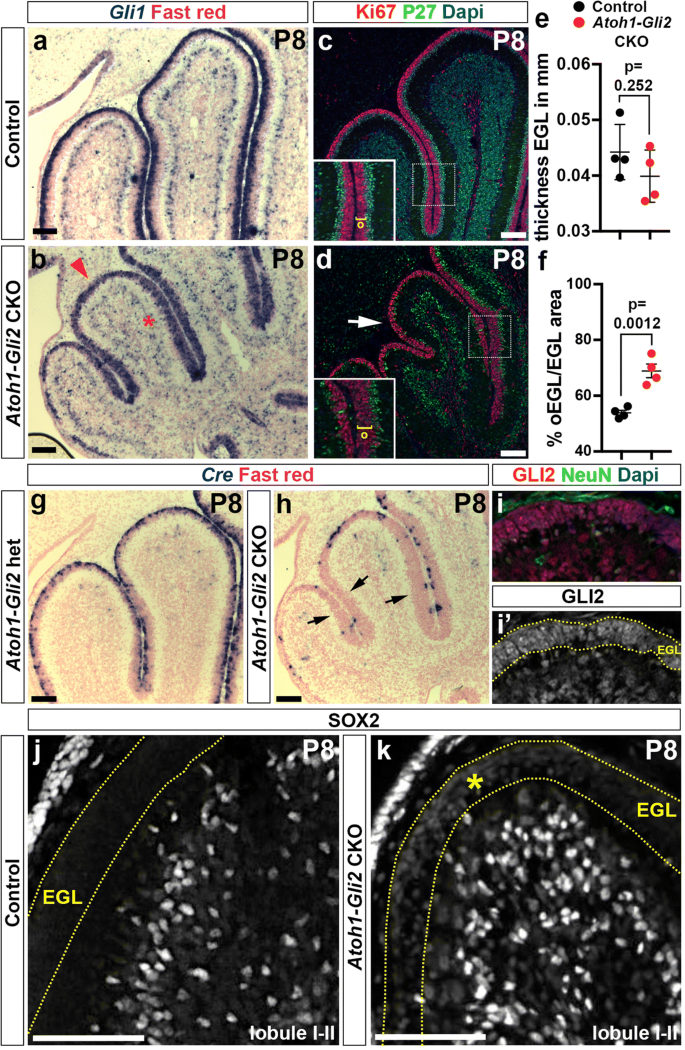
由于CB的最终尺寸很大程度上取决于EGL的膨胀,我们分析了gydF4y2BaAtoh1-Gli2gydF4y2Ba当EGL正常厚时,P8处CKO小脑。与我们之前在P1处使用辐照的研究相似[gydF4y2Ba25gydF4y2Ba],通过P8 in向EGL中补充增殖细胞gydF4y2BaAtoh1-Gli2gydF4y2BaCKO的动物。因此,我们进行了原位杂交(ISH)和分析的表达gydF4y2BaGli1gydF4y2Ba.虽然gydF4y2BaGli1gydF4y2Ba在P0的表达大大降低(图;gydF4y2Ba1gydF4y2Bah), P8的EGLgydF4y2BaAtoh1-Gli2gydF4y2Backo展出gydF4y2BaGli1gydF4y2Ba整个前EGL的表达,与对照动物和突变体后EGL观察到的表达相当(图2)。gydF4y2Ba4gydF4y2Baa - b)。另外和P0不一样,在gydF4y2BaGli1gydF4y2Ba在P8处PCL中观察到表达(图;gydF4y2Ba4gydF4y2Baa - b)。此外,gydF4y2BaGli1gydF4y2Ba增殖细胞Ki67显示,EGL中+细胞扩增。gydF4y2Ba4gydF4y2Bac - d)。我们测量了EGL的厚度,发现在对照组和对照组之间没有显著差异gydF4y2BaAtoh1-Gli2gydF4y2Backop8动物(gydF4y2BangydF4y2Ba= 4;0.044±0.0025 mm vs 0.0399±0.0023 mm)gydF4y2Ba4gydF4y2Bae).然而,我们观察到外部EGL (oEGL)的大小显著增加,与对照组相比,似乎延迟了它们的分化,这表明[oEGL/EGL面积]比值增加(gydF4y2BangydF4y2Ba= 4;68.91±2.44% vs 53.85±0.94%)(图gydF4y2Ba4gydF4y2Baf).分析gydF4y2BaCregydF4y2Ba结果显示,只有一小部分细胞在前路EGL表达gydF4y2BaCregydF4y2Ba与对照组相比(gydF4y2BaAtoh1-Cre / +;Gli2gydF4y2Ba液氧/ +gydF4y2Ba或gydF4y2BaAtoh1-Gli2gydF4y2Bahet)(无花果。gydF4y2Ba4gydF4y2Bag-h)。与EGL中野生型(WT)细胞的存在一致,在EGL中的大多数细胞中检测到GLI2蛋白(图2)。gydF4y2Ba4gydF4y2Ba我”)。有趣的是,部分获救的前EGL中的GCPs在P8处表达了低水平的干细胞标记物SOX2,这在对照动物中从未观察到(图2)。gydF4y2Ba4gydF4y2Baj - k)。有趣的是,TUNEL分析显示,与对照组相比,补充P8 EGL的细胞死亡显著增加(gydF4y2BangydF4y2Ba= 4;459.9±85.39 vs 89.52±17,73粒/ mmgydF4y2Ba2gydF4y2BaEGL)(附加文件gydF4y2Ba3.gydF4y2Ba的EGL中的一些GCPsgydF4y2BaAtoh1-Gli2gydF4y2Ba表达EGL标记的CKOsgydF4y2BaAtoh1gydF4y2Ba(ath1 - gfp染色,附加文件gydF4y2Ba3.gydF4y2Ba:图S3c)打开gydF4y2BaAtoh1-CregydF4y2Ba因为缺乏而死gydF4y2BaGli2gydF4y2Ba.因此,GCPs在EGL中的降低gydF4y2BaAtoh1-Gli2gydF4y2BaP0处的kko刺激了一个补偿过程,导致WT细胞对GCPs的补充。gydF4y2Ba
的损失gydF4y2BaGli2gydF4y2BaP0的突变GCPs由P8的野生型(WT)细胞补偿。gydF4y2Ba一个gydF4y2Ba-gydF4y2BabgydF4y2Ba原位RNA杂交分析gydF4y2BaGli1gydF4y2Ba在P8的中矢状小脑切片上gydF4y2BaGli2gydF4y2Ba液态氧/液态氧gydF4y2Ba(控制,gydF4y2Ba一个gydF4y2Ba),gydF4y2BaAtoh1-Cre / +;Gli2gydF4y2Ba液态氧/液态氧gydF4y2Ba(gydF4y2BaAtoh1-Gli2gydF4y2BaCKO,gydF4y2BabgydF4y2Ba老鼠)。红色箭头表示强者gydF4y2BaGli1gydF4y2Ba突变EGL的表达,红色星号表示正常gydF4y2BaGli1gydF4y2Ba柏格曼神经胶质在浦肯野细胞层(PCL)中的表达。gydF4y2BacgydF4y2Ba-gydF4y2BadgydF4y2Ba小鼠小脑P8中矢状面示踪蛋白和dapi的FIHC检测gydF4y2BaGli2gydF4y2Ba液态氧/液态氧gydF4y2Ba(控制,gydF4y2BacgydF4y2Ba),gydF4y2BaAtoh1-Cre / +;Gli2gydF4y2Ba液态氧/液态氧gydF4y2Ba(gydF4y2BaAtoh1-Gli2gydF4y2BaCKO,gydF4y2BabgydF4y2Ba老鼠)。高倍图像显示了在(gydF4y2BacgydF4y2Ba而且gydF4y2BadgydF4y2Ba),以黄色括号表示外层EGL (o)的厚度。在(gydF4y2BabgydF4y2Ba)表示EGL正在增殖。gydF4y2BaegydF4y2Ba而且gydF4y2BafgydF4y2BaP8处EGL的厚度比例图(gydF4y2BangydF4y2Ba= 4) (gydF4y2BaegydF4y2Ba)和P8处oEGL面积的比例(% [oEGL]面积占总[EGL]面积)(gydF4y2BangydF4y2Ba= 4) (gydF4y2BafgydF4y2Ba)gydF4y2BaGli2gydF4y2Ba液态氧/液态氧gydF4y2Ba(CTL,黑色)和gydF4y2BaAtoh1-Cre / +;Gli2gydF4y2Ba液态氧/液态氧gydF4y2Ba(gydF4y2BaAtoh1-Gli2gydF4y2BaCKO,红色)老鼠。所有的分析都在每个大脑的3个中线切片上进行。所有图形数据以均数±标准差表示,显著性采用双尾t检验。gydF4y2BaggydF4y2Ba-gydF4y2BahgydF4y2Ba的原位杂交gydF4y2BaCregydF4y2Ba小脑中矢状面P8的RNAgydF4y2BaGli2gydF4y2Ba液态氧/液态氧gydF4y2Ba(控制,gydF4y2BaggydF4y2Ba),gydF4y2BaAtoh1-Cre / +;Gli2gydF4y2Ba液态氧/液态氧gydF4y2Ba(gydF4y2BaAtoh1-Gli2gydF4y2BaCKO,gydF4y2BahgydF4y2Ba老鼠)。黑色箭头表示丢失gydF4y2BaCregydF4y2Ba在部分挽救的EGL中表达。gydF4y2Ba我gydF4y2Ba-gydF4y2BakgydF4y2Ba小鼠小脑P8中矢状面示踪蛋白和dapi的FIHC检测gydF4y2BaGli2gydF4y2Ba液态氧/液态氧gydF4y2Ba(控制,gydF4y2BajgydF4y2Ba),gydF4y2BaAtoh1-Cre / +;Gli2gydF4y2Ba液态氧/液态氧gydF4y2Ba(gydF4y2BaAtoh1-Gli2gydF4y2BaCKO,gydF4y2Ba我gydF4y2Ba而且gydF4y2BakgydF4y2Ba老鼠)。黄色虚线表示EGL,黄色星号表示突变EGL中SOX2表达水平低。比例尺为100 μmgydF4y2Ba
nep转变命运成为gcp,并产生GCsgydF4y2BaAtoh1-Gli2gydF4y2BaCKO小脑gydF4y2Ba
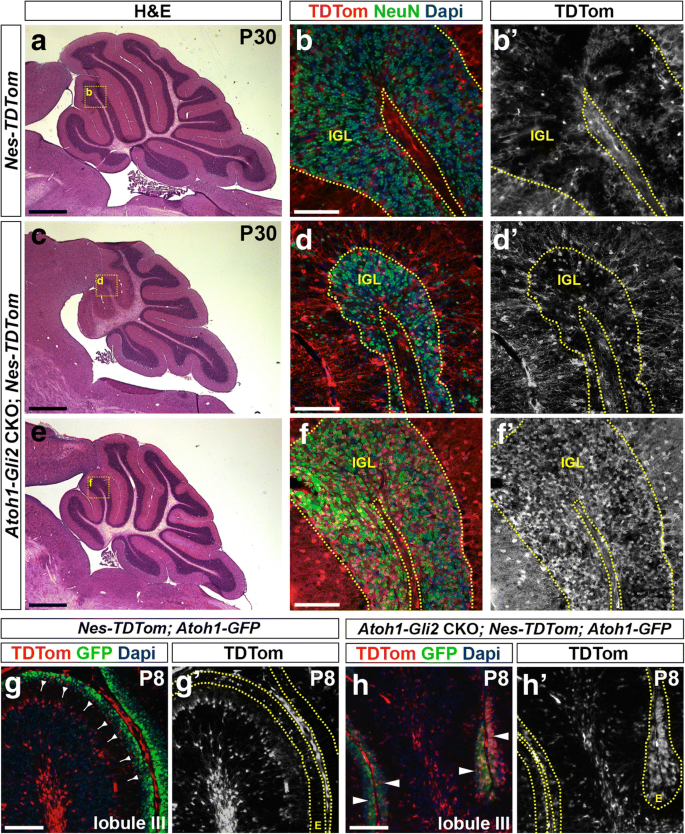
我们之前的研究表明,SOX2+ NEPs可以在损伤后迁移到EGL,然后关闭SOX2并打开gydF4y2BaAtoh1gydF4y2Ba[gydF4y2Ba25gydF4y2Ba],我们目前的结果显示,获救的EGL在P8中有一些细胞gydF4y2BaAtoh1-Gli2gydF4y2BaCKO小脑区表达低水平SOX2。因此,我们假设WT NEPs (SOX2+)能够改变自己的命运,成为gcp,并作为补偿机制的一部分补充EGLgydF4y2BaAtoh1-Gli2gydF4y2Backo。使用一个gydF4y2BaNestin-FlpoERgydF4y2Ba转基因(gydF4y2Ba40gydF4y2Ba]和Flippase (Flp)依赖性gydF4y2BaR26gydF4y2Ba我们对表达TDTom的NEPs进行了遗传诱导命运定位(GIFM)gydF4y2BaAtoh1-Gli2gydF4y2BaCKO小脑。与P30对照(gydF4y2BaNestin-FlpoER / +gydF4y2Ba;gydF4y2BaR26gydF4y2Bafrt-STOP-frt-TDTom / +gydF4y2Ba或gydF4y2BaNes-TDTomgydF4y2BaP0时给予Tm的小鼠,我们观察到许多TDTom+细胞也在IGL中表达GC标记物NeuNgydF4y2BaAtoh1-Gli2gydF4y2BaCKO突变体(gydF4y2BangydF4y2Ba= 6)(图gydF4y2Ba5gydF4y2Baf)。有趣的是,P30蚓部gydF4y2BaAtoh1-Gli2gydF4y2Ba与恢复不良的小鼠相比,恢复良好的CKOs显示nep衍生的TDTom+细胞在IGL中的贡献明显更大。gydF4y2Ba5gydF4y2BaC-d到e-f)。在分析半球时得到了类似的结果(附加文件gydF4y2Ba4gydF4y2Ba:图S4)。然而,与我们对CB大小的分析一致,与蚓部相比,半球中观察到的TDTom+细胞百分比的变动性似乎较小。对P8蚓部的分析显示其数量显著增加gydF4y2Ba巢蛋白gydF4y2BaEGL中-衍生TdTom+细胞与对照组相比(gydF4y2BangydF4y2Ba= 3;3049±713.6 vs 308.8±121 TDTom+ cells / mmgydF4y2Ba2gydF4y2BaEGL;gydF4y2BapgydF4y2Ba= 0.0193)(图gydF4y2Ba5gydF4y2Bag-h)。此外,P8 EGL中的TDTom+细胞已表达GCP标记物gydF4y2BaAtoh1gydF4y2Ba(Atoh1-GFP染色显示)(gydF4y2BangydF4y2Ba= 3;EGL中TDTom+ Atoh1-GFP+占TDTom+细胞总数的80.92±3.69 vs 1.74±1.11%;gydF4y2BapgydF4y2Ba< 0.0001)(图gydF4y2Ba5gydF4y2Bag-h)。gydF4y2Ba
巢蛋白gydF4y2Ba-表达祖细胞(NEPs)填充EGL,表达GCP标记,并产生颗粒细胞,以应对缺失gydF4y2BaGli2gydF4y2Ba在EGL。gydF4y2Ba一个gydF4y2Ba,gydF4y2BacgydF4y2Ba而且gydF4y2BaegydF4y2BaP30蚓部矢状切面H&E染色gydF4y2BaNes-FlpoER / +;R26gydF4y2BaFSF-TDTom / +gydF4y2Ba(gydF4y2BaNes-TDTom,gydF4y2Ba一个gydF4y2Ba),gydF4y2BaAtoh1-Cre / +;Gli2gydF4y2Ba液态氧/液态氧gydF4y2Ba;Nes-FlpoER / +;R26gydF4y2BaFSF-TDTom / +gydF4y2Ba(gydF4y2BaAtoh1-Gli2gydF4y2BaCKOgydF4y2Ba;Nes-TDTom,gydF4y2BacgydF4y2Ba而且gydF4y2BaegydF4y2Ba)小鼠在P0处注射Tm。gydF4y2BabgydF4y2Ba,gydF4y2BadgydF4y2Ba而且gydF4y2BafgydF4y2BaFIHC检测P30时小脑中矢状面示踪蛋白和dapi。高倍图像显示黄色矩形所示的区域(gydF4y2Ba一个gydF4y2Ba,gydF4y2BacgydF4y2Ba而且gydF4y2BaegydF4y2Ba).IGL由黄色虚线勾勒。gydF4y2BaggydF4y2Ba-gydF4y2BahgydF4y2BaFIHC检测P8中矢状小脑切片(小叶III)的指示蛋白和dapigydF4y2BaNes-FlpoER / +;R26gydF4y2BaFSF-TDTom / +gydF4y2Ba;Atoh1-GFP / +gydF4y2Ba(gydF4y2BaNes-TDTom;Atoh1-GFP,gydF4y2BaggydF4y2Ba),gydF4y2BaAtoh1-Cre / +;Gli2gydF4y2Ba液态氧/液态氧gydF4y2Ba;Nes-FlpoER / +;R26gydF4y2BaFSF-TDTom / + / +gydF4y2Ba;Atoh1-GFP / +gydF4y2Ba(gydF4y2BaAtoh1-Gli2gydF4y2BaCKOgydF4y2Ba;Nes-TDTom;Atoh1-GFP,gydF4y2BahgydF4y2Ba)小鼠在P0处注射Tm。EGL (E)由黄色虚线勾勒。向后箭头表示EGL内部的TDTom+和Atoh1-GFP-细胞。白色箭头表示EGL内部的TDTom+和Atoh1-GFP+细胞。比例尺代表1毫米(gydF4y2Ba一个gydF4y2Ba,gydF4y2BacgydF4y2Ba而且gydF4y2BaegydF4y2Ba)和100 μm (gydF4y2BabgydF4y2Ba,gydF4y2BadgydF4y2Ba,gydF4y2BafgydF4y2Ba,gydF4y2BaggydF4y2Ba而且gydF4y2BahgydF4y2Ba)gydF4y2Ba
增殖的PCL nep衍生细胞的子集迁移到IGLgydF4y2BaAtoh1-Gli2gydF4y2BaCKO小脑gydF4y2Ba
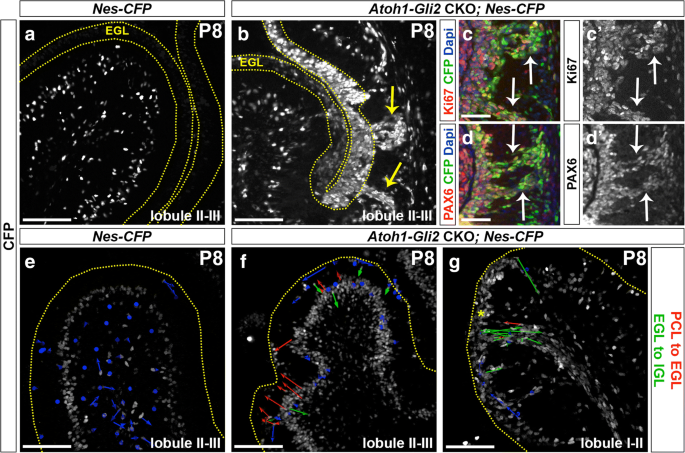
接下来,我们用a分析了nep的行为gydF4y2BaNes-CFPgydF4y2Ba记者专线[gydF4y2Ba43gydF4y2Ba].与我们的GIFM实验一致,与对照动物不同(gydF4y2BaNes-CFPgydF4y2Ba的EGLgydF4y2BaAtoh1-Gli2gydF4y2Backo表达了高水平的CFP(图。gydF4y2Ba6gydF4y2Baa - b)。令人惊讶的是,在IGL和EGL之间的小叶3中看到了CFP+细胞流,而在对照组中不存在。gydF4y2Ba6gydF4y2BaA-b)或在辐照小鼠中[gydF4y2Ba25gydF4y2Ba].有趣的是,流中的一些细胞表达了增殖因子Ki67以及GCP/GC标记物PAX6(图5)。gydF4y2Ba6gydF4y2Bac-d)表明nep来源的细胞子集不能留在EGL中,因此迁移回小脑皮层。为了验证这一想法,我们对P8进行了实时成像gydF4y2BaNes-CFPgydF4y2Ba对照和小脑切片培养gydF4y2BaAtoh1-Gli2gydF4y2Backo (gydF4y2BaAtoh-Gli2gydF4y2BaCKO;gydF4y2BaNes-CFPgydF4y2Ba).引人注目的是,通过在成像的约6小时内跟踪单个细胞的运动,我们观察到Nes-CFP+细胞从PCL主动迁移到EGL的切片gydF4y2BaAtoh-Gli2gydF4y2BaCKO小脑而非对照组小鼠P8(图。gydF4y2Ba6gydF4y2Bae-f和附加文件5:视频S1和附加文件gydF4y2Ba6gydF4y2Ba:视频S2)。突变体中的CFP+细胞层也显得更厚,表明nep数量增加。有趣的是,在含有CFP+细胞流的区域,大多数被追踪的细胞从EGL向IGL相反方向移动(图2)。gydF4y2Ba6gydF4y2Bag和附加文件gydF4y2Ba7gydF4y2Ba:视频S3)。因此,我们的活体成像实验提供了证据,证明位于PCL的NEPs会扩张,然后迁移以补充EGL,以响应gcp特异性的损失gydF4y2BaGli2gydF4y2Ba.此外,nep衍生细胞的一个子集不能整合到EGL中,并向小脑皮层迁移。gydF4y2Ba
PCL NEPs迁移到EGL,增殖nep衍生的gcp样细胞子集以流的形式迁移回小脑皮层。gydF4y2Ba一个gydF4y2Ba-gydF4y2BabgydF4y2BaFIHC检测P8小脑中矢状面(小叶II-III) CFP蛋白gydF4y2BaNes-CFP / +gydF4y2Ba(gydF4y2BaNes-CFP,gydF4y2Ba一个gydF4y2Ba),gydF4y2BaAtoh1-Cre / +;Gli2gydF4y2Ba液态氧/液态氧gydF4y2Ba;Nes-CFP / +gydF4y2Ba(gydF4y2BaAtoh1-Gli2gydF4y2BaCKOgydF4y2Ba;Nes-CFP,gydF4y2BabgydF4y2Ba老鼠)。EGL由黄色虚线表示,黄色箭头表示流。gydF4y2Bac - dgydF4y2Ba高倍FIHC检测P8中矢状小脑区CFP+流的指示蛋白和dapigydF4y2BaAtoh1-Cre / +;Gli2gydF4y2Ba液态氧/液态氧gydF4y2Ba;Nes-CFP / +gydF4y2Ba(gydF4y2BaAtoh1-Gli2gydF4y2BaCKOgydF4y2Ba;Nes-CFPgydF4y2Ba老鼠)。白色箭头表示CFP与所示蛋白共定位。gydF4y2BaegydF4y2Ba-gydF4y2BaggydF4y2Ba在蚓部矢状切片培养(小叶II-III,gydF4y2BaegydF4y2Ba而且gydF4y2BafgydF4y2Ba小叶I-II,gydF4y2BaggydF4y2Ba)的P8gydF4y2BaNes-CFP / +gydF4y2Ba(gydF4y2BaNes-CFP,gydF4y2BaegydF4y2Ba),gydF4y2BaAtoh1-Cre / +;Gli2gydF4y2Ba液态氧/液态氧gydF4y2Ba;Nes-CFP / +gydF4y2Ba(gydF4y2BaAtoh1-Gli2gydF4y2BaCKOgydF4y2Ba;Nes-CFP,gydF4y2BafgydF4y2Ba而且gydF4y2BaggydF4y2Ba)小鼠在成像6小时内显示CFP+细胞移位。箭头颜色代码如下所示(红色箭头表示从PCL移动到EGL的nep,绿色箭头表示从EGL移动到IGL的nep)。EGL的上边缘由黄色虚线表示。比例尺为100 μm (gydF4y2Ba一个gydF4y2Ba-gydF4y2BabgydF4y2Ba而且gydF4y2BaegydF4y2Ba-gydF4y2BaggydF4y2Ba)和50 μm (gydF4y2BacgydF4y2Ba-gydF4y2BadgydF4y2Ba)gydF4y2Ba
附加文件5:视频S1。gydF4y2BaP8 WT小脑无明显NEPs向EGL运动。P8蚓部(小叶2/3)矢状切片上原生CFP荧光的检测gydF4y2BaNes-CFP / +gydF4y2Ba显示CFP+细胞移位的小鼠。每5分钟采集一次图像堆栈,持续4小时。(MOV 3481 kb)gydF4y2Ba
Gli2gydF4y2BaNEPs中的CKO抑制EGL的恢复gydF4y2BaAtoh1gydF4y2Ba-gydF4y2BaGli2gydF4y2BackogydF4y2Ba
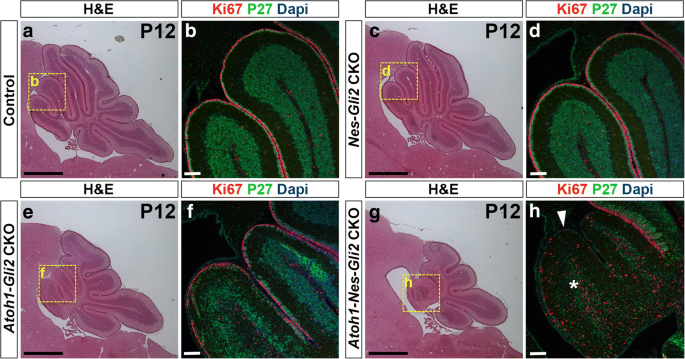
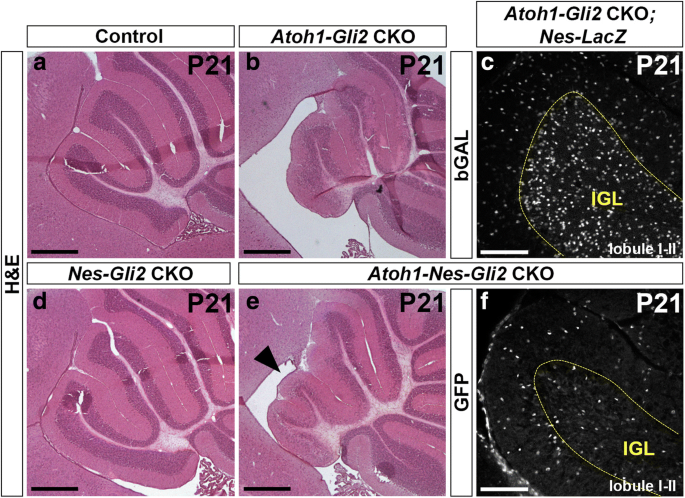
因为我们之前已经证明了SHH信号(gydF4y2BaSmogydF4y2Ba)在NEPs中对辐照后CB的回收是必要的,我们测试了是否gydF4y2BaGli2gydF4y2Ba在这个过程中起作用。我们生成了4种不同基因型的同窝仔,在P0时给予Tm,并分析了每种基因型(gydF4y2BangydF4y2Ba= 3) P8, P12和P21:gydF4y2BaGli2gydF4y2Ba液氧/液氧gydF4y2BaWT(对照)小鼠,gydF4y2BaNestin-FlpoER / +;R26gydF4y2BaMASTR / +gydF4y2Ba;gydF4y2BaGli2gydF4y2Ba液氧/液氧gydF4y2Ba单(gydF4y2BaNes-Gli2gydF4y2Ba缺乏CKOs突变体gydF4y2BaGli2gydF4y2Ba棉结),gydF4y2BaAtoh1-Cre / +;Gli2gydF4y2Ba液氧/液氧gydF4y2Ba单(gydF4y2BaAtoh1-Gli2gydF4y2Backo缺乏gydF4y2BaGli2gydF4y2Ba前gcp)和gydF4y2BaNestin-FlpoER / +;R26gydF4y2BaMASTR / +gydF4y2Ba;gydF4y2BaAtoh1-Cre / +;Gli2gydF4y2Ba液氧/液氧gydF4y2Ba双(gydF4y2BaAtoh1-Nes-Gli2gydF4y2Backo缺乏gydF4y2BaGli2gydF4y2BaNEPs和GCPs)突变体。我们没有观察到任何明显的表型gydF4y2BaNes-Gli2gydF4y2Ba与对照组相比,各阶段的cko(图2)gydF4y2Ba7gydF4y2Bac-d到a-b,附加文件gydF4y2Ba8gydF4y2Ba:图S5c-d ~ a-b和图gydF4y2Ba8gydF4y2Ba然而,H&E染色显示双突变体的前CB减少(gydF4y2BaAtoh1-Nes-Gli2gydF4y2Ba相对于gydF4y2BaAtoh1-Gli2gydF4y2BaP8和P12的cco值(对比图;gydF4y2Ba7gydF4y2Bae到g和附加文件gydF4y2Ba8gydF4y2Ba:图S5e至g)。分析外EGL中增殖的GCPs (Ki67+)以及内EGL和IGL中有丝分裂后的GCs (P27+)两个阶段的情况表明,在gydF4y2BaAtoh1-Nes-Gli2gydF4y2BaCKO与gydF4y2BaAtoh1-Gli2gydF4y2BaCKO小脑和那个gydF4y2BaAtoh1-Nes-Gli2gydF4y2BaCKO动物未能形成适当的P27+内EGL和IGL(对比图2)。gydF4y2Ba7gydF4y2Baf到h和附加文件gydF4y2Ba8gydF4y2Ba:图S5f至h). GFP+的命运分析gydF4y2Ba巢蛋白gydF4y2Ba-表达P21的细胞gydF4y2BaAtoh1-Nes-Gli2gydF4y2Ba使用flp介导的ckogydF4y2BaR26gydF4y2Ba表达核β半乳糖苷酶(Bgal)的报告基因(gydF4y2BaR26gydF4y2Bafrt-STOP-frt-lacZ / +gydF4y2Ba)揭示了不同于gydF4y2BaAtoh1-Gli2gydF4y2Ba其中的ckogydF4y2Ba巢蛋白gydF4y2Ba-衍生的GCs填充IGL(图。gydF4y2Ba5gydF4y2Baf和gydF4y2Ba8gydF4y2Bac),gydF4y2BaGli2gydF4y2Ba突变体gydF4y2Ba巢蛋白gydF4y2Ba-源性细胞在IGL中的分布较差(图;gydF4y2Ba8gydF4y2Baf).双突变体IGL中少数GFP+细胞可能是中间神经元或星形胶质细胞。gydF4y2Ba
失活的gydF4y2BaGli2gydF4y2Ba在这两个gydF4y2Ba巢蛋白-gydF4y2Ba而且gydF4y2BaAtoh1gydF4y2Ba与缺乏CB的小鼠相比,-表达细胞抑制CB的恢复gydF4y2BaGli2gydF4y2Ba只有在EGL中。gydF4y2Ba一个gydF4y2Ba,gydF4y2BacgydF4y2Ba,gydF4y2BaegydF4y2Ba而且gydF4y2BaggydF4y2BaP12小脑蚓矢状切面的H&EgydF4y2BaGli2gydF4y2Ba液氧/液氧gydF4y2Ba(控制,gydF4y2Ba一个gydF4y2Ba),gydF4y2BaNes-FlpoER / +;R26gydF4y2BaMASTR / +gydF4y2Ba;Gli2gydF4y2Ba液氧/液氧gydF4y2Ba(gydF4y2BaNes-Gli2gydF4y2BaCKO,gydF4y2BacgydF4y2Ba),gydF4y2BaAtoh1-Cre / +;Gli2gydF4y2Ba液氧/液氧gydF4y2Ba(gydF4y2BaAtoh1-Gli2gydF4y2BaCKO,gydF4y2BaegydF4y2Ba),gydF4y2BaAtoh1-Cre / +;Nes-FlpoER / +;R26gydF4y2BaMASTR / +gydF4y2Ba;Gli2gydF4y2Ba液氧/液氧gydF4y2Ba(gydF4y2BaAtoh1-Nes-Gli2gydF4y2BaCKO,gydF4y2BaggydF4y2Ba)小鼠在P0处注射Tm。注意失活gydF4y2BaGli2gydF4y2Ba只有在gydF4y2Ba巢蛋白gydF4y2Ba-表达细胞对CB在P12时的发育没有重大影响。然而,失活gydF4y2BaGli2gydF4y2Ba在gydF4y2Ba巢蛋白gydF4y2Ba-表达细胞抑制补偿机制时gydF4y2BaGli2gydF4y2Ba在gcp中被移除(gydF4y2BaggydF4y2Ba相比gydF4y2BaegydF4y2Ba).gydF4y2BabgydF4y2Ba,gydF4y2BadgydF4y2Ba,gydF4y2BafgydF4y2Ba而且gydF4y2BahgydF4y2Ba高倍放大(如在(gydF4y2Ba一个gydF4y2Ba,gydF4y2BacgydF4y2Ba,gydF4y2BaegydF4y2Ba而且gydF4y2BaggydF4y2Ba) P12的前蚓部gydF4y2BaGli2gydF4y2Ba液氧/液氧gydF4y2Ba(gydF4y2BabgydF4y2Ba),gydF4y2BaNes-FlpoER / +;R26gydF4y2BaMASTR / +gydF4y2Ba;Gli2gydF4y2Ba液氧/液氧gydF4y2Ba(gydF4y2BaNes-Gli2gydF4y2BaCKO,gydF4y2BadgydF4y2Ba),gydF4y2BaAtoh1-Cre / +;Gli2gydF4y2Ba液氧/液氧gydF4y2Ba(gydF4y2BaAtoh1-Gli2gydF4y2BaCKO,gydF4y2BafgydF4y2Ba),gydF4y2BaAtoh1-Cre / +;Nes-FlpoER / +;R26gydF4y2BaMASTR / +gydF4y2Ba;Gli2gydF4y2Ba液氧/液氧gydF4y2Ba(gydF4y2BaAtoh1-Nes-Gli2gydF4y2BaCKO,gydF4y2BahgydF4y2Ba)小脑用指示蛋白和dapi染色。白色箭头和白色星号分别表示中EGL和IGL的丢失gydF4y2BaAtoh1-Nes-Gli2gydF4y2BaCKO。比例尺代表1毫米(gydF4y2Ba一个gydF4y2Ba,gydF4y2BacgydF4y2Ba,gydF4y2BaegydF4y2Ba而且gydF4y2BaggydF4y2Ba)和100 μm (gydF4y2BabgydF4y2Ba,gydF4y2BadgydF4y2Ba,gydF4y2BafgydF4y2Ba而且gydF4y2BahgydF4y2Ba)gydF4y2Ba
nep来源的细胞未能在P21时填充IGL。gydF4y2Ba一个gydF4y2Ba,gydF4y2BabgydF4y2Ba,gydF4y2BadgydF4y2Ba而且gydF4y2BaegydF4y2BaP21小脑前蚓矢状面H&E染色gydF4y2BaGli2gydF4y2Ba液氧/液氧gydF4y2Ba(控制,gydF4y2Ba一个gydF4y2Ba),gydF4y2BaAtoh1-Cre / +;Gli2gydF4y2Ba液氧/液氧gydF4y2Ba(gydF4y2BaAtoh1-Gli2gydF4y2BaCKO,gydF4y2BabgydF4y2Ba),gydF4y2BaNes-FlpoER / +;R26gydF4y2BaMASTR / +gydF4y2Ba;Gli2gydF4y2Ba液氧/液氧gydF4y2Ba(gydF4y2BaNes-Gli2gydF4y2BaCKO,gydF4y2BadgydF4y2Ba),gydF4y2BaAtoh1-Cre / +;Nes-FlpoER / +;R26gydF4y2BaMASTR / +gydF4y2Ba;Gli2gydF4y2Ba液氧/液氧gydF4y2Ba(gydF4y2BaAtoh1-Nes-Gli2gydF4y2BaCKO,gydF4y2BaegydF4y2Ba)小鼠在P0处注射Tm。注意失活gydF4y2BaGli2gydF4y2Ba在gydF4y2Ba巢蛋白gydF4y2Ba表达细胞抑制前蚓部的补偿机制(图中黑色箭头所示)gydF4y2BaegydF4y2Ba).gydF4y2BacgydF4y2Ba而且gydF4y2BafgydF4y2BaFIHC检测P21中矢状小脑切片(小叶I-II)的指示蛋白gydF4y2BaAtoh1-Cre / +;Gli2gydF4y2Ba液氧/液氧gydF4y2Ba;gydF4y2BaNes-FlpoER / +;R26gydF4y2BaFSF-LacZ / +gydF4y2Ba(gydF4y2BaAtoh1-Gli2gydF4y2BaCKOgydF4y2Ba;Nes-LacZgydF4y2Ba,gydF4y2BacgydF4y2Ba),gydF4y2BaAtoh1-Cre / +;Nes-FlpoER / +;R26gydF4y2BaMASTR / +gydF4y2Ba;Gli2gydF4y2Ba液氧/液氧gydF4y2Ba(gydF4y2BaAtoh1-Nes-Gli2gydF4y2BaCKO,gydF4y2BafgydF4y2Ba)小鼠在P0处注射Tm。黄色虚线表示IGL。比例尺为500 μm (gydF4y2Ba一个gydF4y2Ba,gydF4y2BabgydF4y2Ba,gydF4y2BadgydF4y2Ba而且gydF4y2BaegydF4y2Ba)和100 μm (gydF4y2BacgydF4y2Ba而且gydF4y2BafgydF4y2Ba)gydF4y2Ba
这些结果表明,shh信号通过GLI2在nep介导的小脑GCPs损失恢复过程中起着至关重要的作用。gydF4y2Ba
讨论gydF4y2Ba
在本研究中,我们开发了一种条件突变策略来删除gydF4y2BaGli2gydF4y2Ba(编码SHH信号的主要效应因子的基因)在小脑前的大多数GCPs中使用gydF4y2BaAtoh1-CregydF4y2Ba在许多研究中使用的转基因(例如[gydF4y2Ba41gydF4y2Ba,gydF4y2Ba45gydF4y2Ba,gydF4y2Ba46gydF4y2Ba,gydF4y2Ba47gydF4y2Ba,gydF4y2Ba48gydF4y2Ba,gydF4y2Ba49gydF4y2Ba,gydF4y2Ba50gydF4y2Ba,gydF4y2Ba51gydF4y2Ba,gydF4y2Ba52gydF4y2Ba])。虽然我们使用马赛克分析显示,SHH-GLI2信号通路通过促进GCP活力和增殖,对生成正确的GCs池至关重要gydF4y2BaGli2gydF4y2Ba在EGL中使用该转基因不足以在大多数突变体中诱导成人小脑严重发育不全。我们发现,虽然GCP池大大减少gydF4y2BaAtoh1-Gli2gydF4y2Ba新生儿时,它随后由细胞机制补充,其中包括WT NEPs的适应性重编程,使其成为GCPs。重要的是,由于转基因在许多新生成的gcp中没有启动,EGL恢复并生成GCs。罕见的gcp从不表达gydF4y2BaCregydF4y2Ba如果它们能比正常情况下进行更多轮的细胞分裂,也有助于GCPs的补充。gydF4y2Ba
本研究和之前的研究提出了一个问题,是什么信号诱导位于PCL中的nep改变命运,成为gcp。先前的研究表明,当辐照在P2-3处杀死大多数GCPs时,NEPs有助于EGL的补充[gydF4y2Ba25gydF4y2Ba].因此有可能在gydF4y2BaAtoh1-Gli2gydF4y2Ba突变体,与我们观察到的细胞死亡相关的信号触发nep改变它们的命运并产生GCPs。另一种机制是EGL的消耗导致浦肯野细胞信号的改变,这可能是因为产生的颗粒细胞减少了兴奋性输入。反过来,SHH可能优先聚集在浦肯野细胞的细胞体中,靠近NEPs,从而增加HH对NEPs的信号传递[gydF4y2Ba25gydF4y2Ba].与GCs在调节NEP行为中的作用相一致gydF4y2BaAtoh1-CregydF4y2Ba转基因基因首先在GCPs的E13.5处表达[gydF4y2Ba45gydF4y2Ba],但EGL的补充gydF4y2BaAtoh1-Gli2gydF4y2BaCKOs仅发生在EGL耗尽后几天,当IGL通常首次显现时(P3-P4)。因此,对于不仅改变GCP增殖和存活,而且改变GCs分化相关基因的条件突变体,应考虑NEPs可能参与补偿过程。gydF4y2Ba
这是可以预料到的gydF4y2BaAtoh1-SmogydF4y2Backo会有类似的表型gydF4y2BaAtoh1-Gli2gydF4y2Ba考虑到这两种基因都是SHH信号传递所必需的。然而,gydF4y2BaAtoh1-CreER / +;SmogydF4y2BaloxP /ΔgydF4y2Ba其中一个等位基因的小鼠gydF4y2Ba平和gydF4y2Ba基因在种系中被删除,而floxed等位基因的删除依赖于他莫昔芬(Tm)的使用,患有严重的小脑发育不良[gydF4y2Ba13gydF4y2Ba].对于这种突变体的表型,一种可能的解释是NEPs的重编程gydF4y2BaSmogydF4y2Ba杂合突变体部分受损,因为HH信号对于PCL NEPs的扩展及其向EGL的迁移至关重要[gydF4y2Ba25gydF4y2Ba].此外,由于Tm降低了EGL消耗后小脑的恢复[gydF4y2Ba25gydF4y2Ba], NEPs中较低水平的SMO蛋白和给药Tm的结合gydF4y2BaAtoh1-CreER / +;SmogydF4y2BaloxP /ΔgydF4y2Ba小鼠可能会钝化NEPs的反应gydF4y2BaSmogydF4y2Ba依赖性EGL耗竭导致严重发育不良。gydF4y2Ba
我们观察到在疣状发育不全的大变异性gydF4y2BaAtoh1-Gli2gydF4y2BaCKO成年,表明只有部分突变小脑可以有效恢复。复苏的可变性可能是因为经济复苏的程度gydF4y2BaAtoh1gydF4y2Ba-gydF4y2BaCregydF4y2Ba在新形成的WT GCPs中,转基因基因被打开的程度在小鼠之间有所不同。由于损失gydF4y2BaGli2gydF4y2Ba导致细胞死亡,TUNEL染色观察到P8的EGLgydF4y2BaAtoh1-Gli2gydF4y2Ba小脑CKO与gydF4y2BaGli2gydF4y2Ba在一些新的野生型GCPs中P6之后被删除,这些GCPs要么来自NEPs,要么来自以前没有表达的稀有GCPsgydF4y2BaAtoh1-CregydF4y2Ba.此外,我们的实验表明,一些进入EGL并打开PAX6的NEPs在有丝分裂后并关闭Nes-CFP之前迁移回IGL。我们假设一些nep衍生的GCPs经历了缺失gydF4y2BaGli2gydF4y2Ba进入EGL后存活,但无法完全重编程进入gcp。一个有趣的基因可能无法正常启动gydF4y2Ba趋化因子受体CxcR4gydF4y2Ba由于SDF1通过CXCR4脑膜信号表达,维持EGL外GCPs,增强sh依赖增殖[gydF4y2Ba53gydF4y2Ba].此外,SHH-GLI1信号通路诱导转录gydF4y2Ba趋化因子受体Cxcr4gydF4y2Ba而且gydF4y2BaCxcr7gydF4y2Ba[gydF4y2Ba54gydF4y2Ba].我们建议gydF4y2BaAtoh1-Gli2gydF4y2Bapcl衍生NEPs的一个子集kos在进入EGL后表达CRE,随后GLI2蛋白的缺失减少CXCR4,导致增殖的gcp样细胞迁移回小脑皮层。由此可见,小脑在不同程度上的生长gydF4y2BaAtoh1-Gli2gydF4y2Ba的数量可能导致ckogydF4y2BaAtoh1-CregydF4y2Ba在GCPs中诱导P4,以及由此导致的细胞死亡和过早迁移的平衡。gydF4y2Ba
小脑沿着中外侧轴大致分为一个中央蚓和两个外侧半球[gydF4y2Ba19gydF4y2Ba].尽管从P0的EGL耗竭中恢复发生在两个区域gydF4y2BaAtoh1-Gli2gydF4y2Ba相对而言,经济复苏在半球更为强劲。奇怪的是,大脑半球gydF4y2BaAtoh1-Gli2gydF4y2Backo在P8处表现出额外的褶皱(图中箭头所示)。gydF4y2Ba3.gydF4y2BaG),表明沿中横向轴有不同的恢复响应。蚓部和半球在分子和功能上是截然不同的[gydF4y2Ba19gydF4y2Ba,gydF4y2Ba55gydF4y2Ba],且半球GCPs对高水平sh信号的敏感性高于蚓部[gydF4y2Ba55gydF4y2Ba].我们认为EGL中半球nep衍生的GCPs保持了更高水平的SHH信号,因此比蚓部中的GCPs扩张得更快更有效。gydF4y2Ba
结论gydF4y2Ba
在本研究中,我们表明,在解释任何涉及EGL细胞增殖/分化和生存的基因被破坏的突变表型时,必须考虑NEPs补偿出生后小脑损伤的能力。这尤其适用于gydF4y2BaAtoh1-CregydF4y2Ba本研究中使用的转基因[gydF4y2Ba41gydF4y2Ba]生成条件突变体。一旦NEPs存在,GCPs损失的补偿最有可能发生在出生后所需的基因上。最后,我们的发现提出了一个问题,即类似的恢复现象是否发生在大脑的其他区域,取决于所使用的转基因可能会使突变表型的解释复杂化。gydF4y2Ba
缩写gydF4y2Ba
- 答:gydF4y2Ba
-
激活剂gydF4y2Ba
- CB:gydF4y2Ba
-
小脑gydF4y2Ba
- 置信区间:gydF4y2Ba
-
尺骨中断gydF4y2Ba
- CKO:gydF4y2Ba
-
条件敲除gydF4y2Ba
- DhhgydF4y2Ba:gydF4y2Ba
-
沙漠刺猬gydF4y2Ba
- EGL:gydF4y2Ba
-
外部颗粒层gydF4y2Ba
- 质量:gydF4y2Ba
-
颗粒细胞前体gydF4y2Ba
- 绿色荧光蛋白:gydF4y2Ba
-
绿色荧光蛋白gydF4y2Ba
- GIFM:gydF4y2Ba
-
遗传诱导命运图谱gydF4y2Ba
- het:gydF4y2Ba
-
杂合的gydF4y2Ba
- HH:gydF4y2Ba
-
刺猬gydF4y2Ba
- IGL:gydF4y2Ba
-
内部颗粒细胞层gydF4y2Ba
- 包含IHC:gydF4y2Ba
-
免疫组织化学gydF4y2Ba
- 本次事件gydF4y2Ba:gydF4y2Ba
-
印度的刺猬gydF4y2Ba
- 伊什:gydF4y2Ba
-
原位杂交gydF4y2Ba
- MASTR:gydF4y2Ba
-
重组时空控制的花叶突变体分析gydF4y2Ba
- ML:gydF4y2Ba
-
分子层gydF4y2Ba
- 棉结:gydF4y2Ba
-
Nestin-expressing祖gydF4y2Ba
- 病人:gydF4y2Ba
-
产后一天gydF4y2Ba
- PC:gydF4y2Ba
-
浦肯野细胞gydF4y2Ba
- PCL:gydF4y2Ba
-
浦肯野细胞层gydF4y2Ba
- PTCH1:gydF4y2Ba
-
Patched1gydF4y2Ba
- 接待员:gydF4y2Ba
-
抑制因子gydF4y2Ba
- 嘘:gydF4y2Ba
-
声波刺猬gydF4y2Ba
- SMO:gydF4y2Ba
-
平和gydF4y2Ba
- TDTom:gydF4y2Ba
-
DsRed的串联二聚衍生物gydF4y2Ba
- Tm:gydF4y2Ba
-
它莫西芬gydF4y2Ba
- TUNEL:gydF4y2Ba
-
末端脱氧核苷酸转移酶dUTP缺口末端标记gydF4y2Ba
- 登陆:gydF4y2Ba
-
心室区gydF4y2Ba
- WT:gydF4y2Ba
-
野生型gydF4y2Ba
参考文献gydF4y2Ba
阿泽维多FA,卡瓦略LR,格林伯格LT,法菲尔JM,法拉帝RE,莱特RE,等。相同数量的神经元细胞和非神经元细胞使人类大脑成为等距放大的灵长类大脑。中华神经外科杂志,2009;26(5):532 - 532。gydF4y2Ba
赫库拉诺- houzel S, Mota B, Lent R.啮齿动物大脑的细胞缩放规则。中国科学院学报(自然科学版),2006;29(3):344 - 344。gydF4y2Ba
认知过程中的小脑:儿童的辅助研究。小脑。2007;6(3):237 - 41。gydF4y2Ba
Tomlinson SP, Davis NJ, Bracewell RM。非运动性小脑功能的脑刺激研究:系统综述。神经科学,2013;37(5):766-89。gydF4y2Ba
伊藤:通过小脑内部模型控制精神活动。神经科学,2008;9(4):304-13。gydF4y2Ba
Buckner RL。小脑和认知功能:25年的解剖学和神经影像学的见解。神经元。2013;80(3):807 - 15所示。gydF4y2Ba
斯特里克PL,丹姆RP,菲兹JA。小脑和非运动功能。神经科学,2009;32:413-34。gydF4y2Ba
Altman J,拜耳公司。小脑系统的发育与它的进化、结构和功能有关。博卡拉顿:CRC出版社;1997.gydF4y2Ba
拉基奇P,西德曼RL。人小脑皮层层的组织发生,特别是解剖板。中华神经外科杂志,2000,19(4):349 - 349。gydF4y2Ba
杜宾,桑兹。人类大脑的定量生长与发育。阿奇迪斯。1973;48(10):757-67。gydF4y2Ba
王晓峰,王晓峰,王晓峰。小脑、敏感期与自闭症的关系。神经元。2014;83(3):518 - 32。gydF4y2Ba
星野M,中村S,森K,川内T,寺尾M,西村YV,等。Ptf1a, bHLH转录基因,定义gaba能神经元命运在小脑。神经元。2005;47(2):201 - 13所示。gydF4y2Ba
Fleming JT, He W, Hao C, Ketova T, Pan FC, Wright CC,等。浦肯野神经元作为空间和功能上不同的小脑前体的中央调节器。生物工程学报。2013;27(3):278-92。gydF4y2Ba
Parmigiani E, Leto K, Rolando C, Figueres-Onate M, Lopez-Mascaraque L, Buffo A,等。星形胶质样小脑祖细胞沿中间神经元和胶质谱系的异质性和双重性。中华神经科学杂志,2015;35(19):7388-402。gydF4y2Ba
川口Y,库珀B,甘农M,雷M,麦克唐纳RJ,赖特CV。转录调节因子Ptf1a在肠祖细胞转化为胰腺祖细胞中的作用。植物学报,2002;32(1):128-34。gydF4y2Ba
温盖特RJ,哈顿我。菱形唇在鸟类小脑发育中的作用。发展。1999;126(20):4395 - 404。gydF4y2Ba
Machold R, Fishell G. Math1在小脑菱形唇神经祖细胞的时间离散池中表达。神经元。2005;(1):48 17-24。gydF4y2Ba
Wang VY, Rose MF, Zoghbi HY. Math1表达重新定义了菱形唇形衍生物,并揭示了脑干和小脑内的新谱系。神经元。2005;(1):48 31-43。gydF4y2Ba
Sillitoe RV, Joyner AL.形态、分子密码和电路产生了小脑的三维复杂性。细胞发育生物学,2007;23:549-77。gydF4y2Ba
Corrales JD, Blaess S, Mahoney EM, Joyner AL.超音hedgehog信号水平调控小脑叶理的复杂性。发展。2006;133(9):1811 - 21所示。gydF4y2Ba
Lewis PM, Gritli-Linde A, Smeyne R, Kottmann A, McMahon AP.超音hedgehog信号是颗粒神经元前体扩张和小鼠小脑模式化所必需的。生物工程学报,2004;27(2):393-410。gydF4y2Ba
博恩MC,兰黛JM。新生儿氢化可的松对大鼠小脑发育的影响:自放射和光镜研究。神经科学,1978;1:250-66。gydF4y2Ba
Heine VM, Rowitch DH。刺猬信号通过11betahsd2依赖机制在糖皮质激素诱导的小鼠新生儿脑损伤中发挥保护作用。中国临床医学杂志。2009;29(2):366 - 366。gydF4y2Ba
李国强,李国强。婴儿小脑x射线照射的早期效应:外部颗粒层的抽取和重建。神经科学。1969;24:196-216。gydF4y2Ba
Wojcinski A, Lawton AK, Bayin NS, Lao Z, Stephen DN, Joyner AL.巢estin(+)祖细胞适应性重编程对损伤后小脑颗粒细胞补充的影响。神经科学,2017;20(10):1361-70。gydF4y2Ba
杨晓明,王晓明,王晓明,马格诺。产后小脑损伤后神经发生的研究。国际发展神经科学杂志2018;67:33-6。gydF4y2Ba
Jaeger BN, Jessberger S.意外帮助修复小脑。神经科学,2017;20(10):1319-21。gydF4y2Ba
英厄姆PW,麦克马洪AP.动物发育中的刺猬信号:范式和原则。基因工程学报2001;15(23):3059-87。gydF4y2Ba
王志强,王志强,王志强,等。基因开发,2008;22(18):2454-72。gydF4y2Ba
早产儿的神经发育结果。神经医学杂志,2008;21(2):123-8。gydF4y2Ba
Goetz SC, Anderson KV。初生纤毛:脊椎动物发育过程中的信号中枢。科学通报。2010;11(5):331-44。gydF4y2Ba
傅希洛,乔伊纳,费希尔。形态原到丝裂原:刺猬信号在脊椎动物神经发育中的多重作用。神经科学。2006;7(10):772-83。gydF4y2Ba
Bai CB, Auerbach W, Lee JS, Stephen D, Joyner AL. Gli2,而不是Gli1,是初始Shh信号通路和Shh通路异位激活所必需的。发展。2002;129(20):4753 - 61。gydF4y2Ba
Bai CB, Stephen D, Joyner AL.所有由hedgehog基因构建的小鼠腹侧脊髓模式都依赖于glii,并涉及Gli3的激活器功能。科学通报。2004;6(1):103-15。gydF4y2Ba
李Y,米勒HL,拉塞尔HR,博伊德K,柯伦T,麦金农PJ。Patched2在patched1杂合小鼠中调节肿瘤发生。癌症决议2006;66(14):6964-71。gydF4y2Ba
Blaess S, Stephen D, Joyner AL. Gli3通过整合Shh和Fgf8信号来协调顶盖和小脑的三维模式和生长。发展。2008;135(12):2093 - 103。gydF4y2Ba
杨志军,Ellis T, Markant SL, Read TA, Kessler JD, Bourboulas M,等。髓母细胞瘤可由缺失修补的谱系限制祖细胞或干细胞引起。中国癌症杂志,2008;14(2):135-45。gydF4y2Ba
郭庆林,郭庆林,郭丽娟,王晓明。超音hedgehog基因在小脑发育过程中的作用。发展。2004;131(22):5581 - 90。gydF4y2Ba
De Luca A, Parmigiani E, Tosatto G, Martire S, Hoshino M, Buffo A,等。外源超音hedgehog基因在小脑发育过程中调节gaba能中间神经元池。小脑。2015;14(2):72 - 85。gydF4y2Ba
老Z, Raju GP,白CB, Joyner AL. MASTR:一种利用条件柔性等位基因重组的小鼠镶嵌突变分析技术。中国科学通报,2012;2(2):386-96。gydF4y2Ba
马泰V, Pauley S, Kaing S, Rowitch D, Beisel KW, Morris K,等。神经g1缺失小鼠内耳感觉上皮变小与毛细胞周期提早退出有关。生物技术学报,2005;34(3):344 - 344。gydF4y2Ba
李志强,李志强,陈建平,等。在发育中的转基因小鼠神经系统中math1驱动的GFP表达基因表达谱。2003;3(4):389-95。gydF4y2Ba
Mignone JL, Kukekov V, Chiang AS, Steindler D, Enikolopov G.巢蛋白- gfp转基因小鼠神经干和祖细胞的研究。中华神经外科杂志,2004;29(3):344 - 344。gydF4y2Ba
肖磊,李志强,李志强,李志强,等。获得颗粒神经元前体身份是形成shh诱导的成神经管细胞瘤的祖细胞能力的关键决定因素。中国癌症杂志,2008;14(2):123-34。gydF4y2Ba
Orvis GD, Hartzell AL, Smith JB, Barraza LH, Wilson SL, Szulc KU,等。嵌固的同源盒基因在多个细胞系中是协调连续形成的裂缝和小脑的生长所必需的。中国生物医学工程学报。2012;36(1):344 - 344。gydF4y2Ba
刘峰,刘志强,刘志强,刘志强,等。组蛋白去甲基化酶Kdm6b调节分化小脑颗粒神经元的成熟基因表达程序。分子细胞神经科学,2018;87:4-17。gydF4y2Ba
中村T,上山T, Ninoyu Y,坂口H, Choijookhuu N, Hishikawa Y,等。Rac-Mid1信号通路在小脑内侧发育中的新作用。发展。2017;144(10):1863 - 75。gydF4y2Ba
潘n, Jahan I, Lee JE, Fritzsch B.条件性Neurod1缺失小鼠小脑缺陷与有效的Tg (Atoh1-cre)重组和Neurod1分化所需的颗粒细胞相关。中国生物医学工程学报,2009;37(3):407-28。gydF4y2Ba
康斯坦丁,温赖特。MicroRNAs通过Gli2促进小脑颗粒细胞的扩张。小脑。2015;14(6):688 - 98。gydF4y2Ba
Lorenz A, Deutschmann M, Ahlfeld J, Prix C, Koch A, Smits R,等。颗粒神经元前体Wnt信号的组成性激活后小脑皮层发育的严重改变。分子生物学杂志,2011;31(16):3326-38。gydF4y2Ba
Julian E, Hallahan AR, Wainwright BJ。RBP-J在颗粒神经元祖细胞发育和外生发层hedgehog途径激活引发的成神经管细胞瘤中不是必需的。神经发展。2010;5:27。gydF4y2Ba
赵强,赵志强,王志强,王志强,等。叉头转录因子FoxM1调节有丝分裂进入并防止小脑颗粒神经元前体纺锤体缺陷。分子生物学杂志,2007;27(23):8259-70。gydF4y2Ba
Klein RS, Rubin JB, Gibson HD, DeHaan EN, Alvarez-Hernandez X, Segal RA,等。SDF-1 α诱导趋化,增强声波刺猬诱导的小脑颗粒细胞增殖。发展。2001;128(11):1971 - 81。gydF4y2Ba
Inaguma S, Riku M, Ito H, Tsunoda T, Ikeda H, Kasai K. GLI1调控CXCR4/CXCR7信号通路促进乳腺癌细胞的迁移和转移Oncotarget。2015;6(32):33648 - 57。gydF4y2Ba
Tan IL, Wojcinski A, Rallapalli H, Lao Z, Sanghrajka RM, Stephen D,等。侧小脑对高音hedgehog信号和成神经管细胞瘤的形成优先敏感。中国科学(d辑),2018,26(3):349 - 349。gydF4y2Ba
致谢gydF4y2Ba
我们感谢实验室过去和现在的成员在我们研究过程中进行的有益讨论。gydF4y2Ba
资金gydF4y2Ba
这项工作得到了MSKCC脑肿瘤中心和Philippe基金会(给A.W)的资助,以及NIH (R37 MH085726和R01 NS092096给A.L.J和F32 NS086163给a.k.l)和国家癌症研究所癌症中心支持赠款(P30 CA008748-48)的支持。gydF4y2Ba
数据和材料的可用性gydF4y2Ba
所有小鼠系均可从乔伊纳实验室或杰克逊实验室获得。为本研究生成或分析的所有数据都包含在这篇发表的文章中。gydF4y2Ba
作者信息gydF4y2Ba
作者及隶属关系gydF4y2Ba
贡献gydF4y2Ba
AW和ALJ构思了这个项目;AW、AKL和ALJ设计了研究;AW、MM、AKL和DNS进行实验;AW, MM, AKL和ALJ对数据进行了分析,所有作者都对数据进行了讨论;AW和ALJ撰写了所有作者的稿件。所有作者都阅读并批准了最终的手稿。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
伦理批准并同意参与gydF4y2Ba
所有的动物实验都是根据由纪念斯隆凯特琳癌症中心机构动物护理和使用委员会批准的规程(07-01-001)进行的。gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者宣称他们之间没有利益冲突。gydF4y2Ba
出版商的注意gydF4y2Ba
伟德体育在线施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。gydF4y2Ba
附加文件gydF4y2Ba
附加文件1:gydF4y2Ba
图S1。gydF4y2Ba与蚓部相似,sh - gli2将GCP维持在未分化状态,并促进它们在半球的生存。(a) P4时外EGL中GFP+细胞数量图(gydF4y2BangydF4y2Ba= 3)和P8 (gydF4y2BangydF4y2Ba的两个半球和蚓部gydF4y2BaR26gydF4y2BaMASTR / +gydF4y2Ba;gydF4y2BaAtoh1-FlpoER / +;Gli2gydF4y2Ba液态氧/ +gydF4y2Ba(gydF4y2BaAtoh1-M-Gli2gydF4y2Ba黑色)和gydF4y2BaR26gydF4y2BaMASTR / +gydF4y2Ba;gydF4y2BaAtoh1-FlpoER / +;Gli2gydF4y2Ba液态氧/液态氧gydF4y2Ba(gydF4y2BaAtoh1-M-Gli2gydF4y2BaCKO,红色)P2处给予Tm处理的小鼠。(b-d) P8时外(o) EGL中CFP+细胞比例图(gydF4y2BangydF4y2Ba= 3) (b), P8处的增殖指数(oEGL中所有[GFP+]细胞的% [GFP+ EdU+]细胞)(gydF4y2BangydF4y2Ba= 3) (c)和P4处每段TUNEL+粒子数(gydF4y2BangydF4y2Ba= 3) (d)在大脑半球gydF4y2BaR26gydF4y2BaMASTR / +gydF4y2Ba;gydF4y2BaAtoh1-FlpoER / +;Gli2gydF4y2Ba液态氧/ +gydF4y2Ba(gydF4y2BaAtoh1-M-Gli2gydF4y2Ba黑色)和gydF4y2BaR26gydF4y2BaMASTR / +gydF4y2Ba;gydF4y2BaAtoh1-FlpoER / +;Gli2gydF4y2Ba液态氧/液态氧gydF4y2Ba(gydF4y2BaAtoh1-M-Gli2gydF4y2BaCKO,红色)P2处给予Tm处理的小鼠。所有的分析都在每个区域和每个大脑的3个切片上进行。所有图形数据以均数±标准差表示,显著性采用双尾法确定。(JPG 238kb)gydF4y2Ba
附加文件2:gydF4y2Ba
图S2。gydF4y2BaGLI2蛋白在P0中丢失gydF4y2BaAtoh1-Gli2gydF4y2BaCKO EGL。(a和d)原位杂交gydF4y2BaCregydF4y2Ba小脑中矢状面P0上的mRNAgydF4y2BaGli2gydF4y2Ba液态氧/液态氧gydF4y2Ba(对照,a)和gydF4y2BaAtoh1-Cre / +;Gli2gydF4y2Ba液态氧/液态氧gydF4y2Ba(gydF4y2BaAtoh1-Gli2gydF4y2BaCKO, d)老鼠。黑色箭头表示缺乏gydF4y2BaCregydF4y2Ba在鼻梁最后部的表达。(b-c和e-f) FIHC检测P0中GLI2蛋白和dapi在指示区域(如a和d中黑色方块所示)gydF4y2BaGli2gydF4y2Ba液态氧/液态氧gydF4y2Ba(对照,b-c)和gydF4y2BaAtoh1-Cre / +;Gli2gydF4y2Ba液态氧/液态氧gydF4y2Ba(gydF4y2BaAtoh1-Gli2gydF4y2BaCKO, e-f) CB。e中的黄色箭头和F中的白色箭头分别表示EGL中GLI2蛋白的缺失和存在。比例尺分别为1mm (a、d)和100 μm (b、c、e、f)。(JPG 1811 kb)gydF4y2Ba
附加文件3:gydF4y2Ba
图S3。gydF4y2Ba获救的EGL仍然显示细胞死亡增加。(a-b) P8正中矢状切片的TUNEL和dapi检测gydF4y2BaGli2gydF4y2Ba液态氧/液态氧gydF4y2Ba(控制)和gydF4y2BaAtoh1-Cre / +;Gli2gydF4y2Ba液态氧/液态氧gydF4y2Ba(gydF4y2BaAtoh1-Gli2gydF4y2BaCKO) CB。白色箭头表示存在EGL (b)。(c)每毫米TUNEL+粒子数量的图表gydF4y2Ba2gydF4y2Ba的资料(gydF4y2BangydF4y2Ba= 4)在P8的蚓部(小叶I至V)gydF4y2BaGli2gydF4y2Ba液态氧/液态氧gydF4y2Ba(控制,黑色)和gydF4y2BaAtoh1-Cre / +;Gli2gydF4y2Ba液态氧/液态氧gydF4y2Ba(gydF4y2BaAtoh1-Gli2gydF4y2BaCKO,红色)CB。所有的分析都在每个区域和每个大脑的3个切片上进行。所有图形数据以均数±标准差表示,显著性采用双尾检验。(d)检测天然绿色荧光蛋白的荧光和原位杂交gydF4y2BaCregydF4y2BaP8中矢状切面(小叶II-III)上的mRNAgydF4y2BaAtoh1-Cre / +;Gli2gydF4y2Ba液态氧/液态氧gydF4y2Ba;Atoh1-GFP / +gydF4y2Ba(gydF4y2BaAtoh1-Gli2gydF4y2BaCKOgydF4y2Ba;Atoh1-GFPgydF4y2Ba)鼠标。黄色虚线表示EGL,黑色箭头表示ATOH1-GFP+/gydF4y2BaCre +gydF4y2Ba细胞gydF4y2Ba.gydF4y2Ba比例尺代表100 μm (a和b)和10 μm (d)。gydF4y2Ba
附加文件4:gydF4y2Ba
图S4。gydF4y2Ba巢蛋白gydF4y2Ba-表达祖细胞(NEPs)分化为颗粒神经元,以响应丧失gydF4y2BaGli2gydF4y2Ba在两个半球。(a和c) P30半球形矢状面H&E染色gydF4y2BaNes-FlpoER / +;R26gydF4y2BaFSF-TDTom / +gydF4y2Ba(gydF4y2BaNes-TDTom,gydF4y2Ba一)和gydF4y2BaAtoh1-Cre / +;Gli2gydF4y2Ba液态氧/液态氧gydF4y2Ba;Nes-FlpoER / +;R26gydF4y2BaFSF-TDTom / +gydF4y2Ba(gydF4y2BaAtoh1-Gli2gydF4y2BaCKOgydF4y2Ba;Nes-TDTom,gydF4y2Bac)小鼠P0处注射Tm。(b和d) P30时,FIHC检测半球矢状小脑切片上的指示蛋白和dapi。高倍图像显示(a和c)中黄色矩形所示区域。黄色虚线表示IGL。比例尺代表1mm (a和c)和100 μm (b和d)。gydF4y2Ba
附加文件6:gydF4y2Ba
视频S2。gydF4y2BaPCL nep迁移到EGLgydF4y2BaAtoh1-Gli2gydF4y2BaCKO CB在P8。P8蚓部(小叶2/3)矢状切片上原生CFP荧光的检测gydF4y2BaAtoh1-Cre / +;Gli2gydF4y2Ba液氧/液氧gydF4y2Ba;Nes-CFP / +gydF4y2Ba(gydF4y2BaAtoh1-Gli2gydF4y2BaCKOgydF4y2Ba;Nes-CFPgydF4y2Ba)显示CFP+细胞移位的小鼠。图像堆栈每5?4?h的最小值。(MOV 1740 kb)gydF4y2Ba
附加文件7:gydF4y2Ba
视频S3。gydF4y2Banep衍生细胞的一个子集从EGL迁移到IGLgydF4y2BaAtoh1-Gli2gydF4y2BaCKO CB在P8。P8蚓部(小叶1/2)矢状切片上原生CFP荧光的检测gydF4y2BaAtoh1-Cre / +;Gli2gydF4y2Ba液氧/液氧gydF4y2Ba;Nes-CFP / +gydF4y2Ba(gydF4y2BaAtoh1-Gli2gydF4y2BaCKOgydF4y2Ba;Nes-CFPgydF4y2Ba)显示CFP+细胞移位的小鼠。图像堆栈每5?4?h的最小值。(MOV 6450 kb)gydF4y2Ba
附加文件8:gydF4y2Ba
图S5。gydF4y2Ba失活的gydF4y2BaGli2gydF4y2Ba在这两个gydF4y2Ba巢蛋白gydF4y2Ba而且gydF4y2BaAtoh1gydF4y2Ba表达细胞抑制了CB的恢复。(a, c, e, g) P8小脑蚓矢状面H&E染色gydF4y2BaGli2gydF4y2Ba液氧/液氧gydF4y2Ba(控制),gydF4y2BaNes-FlpoER / +;R26gydF4y2BaMASTR / +gydF4y2Ba;Gli2gydF4y2Ba液氧/液氧gydF4y2Ba(gydF4y2BaNes-Gli2gydF4y2BaCKO c),gydF4y2BaAtoh1-Cre / +;Gli2gydF4y2Ba液氧/液氧gydF4y2Ba(gydF4y2BaAtoh1-Gli2gydF4y2BaCKO, e),和gydF4y2BaAtoh1-Cre / +;Nes-FlpoER / +;R26gydF4y2BaMASTR / +gydF4y2Ba;Gli2gydF4y2Ba液氧/液氧gydF4y2Ba(gydF4y2BaAtoh1-Nes-Gli2gydF4y2BaCKO, g)小鼠在P0处注射Tm。注意失活gydF4y2BaGli2gydF4y2Ba只有在gydF4y2Ba巢蛋白gydF4y2Ba-表达细胞在P8没有主要影响。然而,失活gydF4y2BaGli2gydF4y2Ba在gydF4y2Ba巢蛋白gydF4y2Ba-表达细胞抑制了补偿机制(g与e相比)。(b, d, f和h) P8前蚓部特写(如a, c, e和g中黄色方块所示)gydF4y2BaGli2gydF4y2Ba液氧/液氧gydF4y2Ba(b),gydF4y2BaNes-FlpoER / +;R26gydF4y2BaMASTR / +gydF4y2Ba;Gli2gydF4y2Ba液氧/液氧gydF4y2Ba(gydF4y2BaNes-Gli2gydF4y2BaCKO d),gydF4y2BaAtoh1-Cre / +;Gli2gydF4y2Ba液氧/液氧gydF4y2Ba(gydF4y2BaAtoh1-Gli2gydF4y2BaCKO, f),和gydF4y2BaAtoh1-Cre / +;Nes-FlpoER / +;R26gydF4y2BaMASTR / +gydF4y2Ba;Gli2gydF4y2Ba液氧/液氧gydF4y2Ba(gydF4y2BaAtoh1-Nes-Gli2gydF4y2BaCKO, h)小脑用指示蛋白和dapi染色。白色箭头和白色星号分别表示肺中EGL和IGL的缺失gydF4y2BaAtoh1-Nes-Gli2gydF4y2BaCKO。比例尺代表1毫米(a, c, e和g)和100 μm (b, d, f和h)。gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文根据创作共用属性4.0国际许可协议(gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba),允许在任何媒介上不受限制地使用、分发和复制,前提是您对原作者和来源给予适当的赞扬,提供到创作共用许可证的链接,并注明是否进行了更改。创作共用公共领域奉献弃权书(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)除另有说明外,适用于本条所提供的资料。gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
Wojcinski, A. Morabito, M. Lawton, a.kgydF4y2Baet al。gydF4y2Ba小脑菱形唇谱系基因的遗传缺失可通过心室区衍生祖细胞的适应性重编程刺激代偿。gydF4y2Ba神经系统开发gydF4y2Ba14gydF4y2Ba, 4(2019)。https://doi.org/10.1186/s13064-019-0128-ygydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s13064-019-0128-ygydF4y2Ba
关键字gydF4y2Ba
- 小脑gydF4y2Ba
- 嘘的信号gydF4y2Ba
- GLI2gydF4y2Ba
- Nestin-expressing祖细胞gydF4y2Ba
- 神经发生gydF4y2Ba
- Atoh1-CregydF4y2Ba
- 再生gydF4y2Ba