摘要
在发育中的中枢神经系统中,神经发生包括神经前体细胞的诱导、增殖及其随后分化为成熟神经元的过程。外部和内部线索以精确的时间和空间方式协调神经发生。在过去的20年里,斑马鱼被证明是研究胚胎神经发生的优秀模式生物。最近,这种脊椎动物也成为研究成人神经发生和神经再生的模型。在此,我们综述了斑马鱼在神经发育和成人神经发生中的贡献。
背景
神经发生描述了未分化的神经前体细胞生成成熟的功能神经元的过程。神经发生的第一步是神经祖细胞的诱导和一个扩大祖细胞池的细胞分裂阶段。这是一个序列的规范承诺祖细胞,并分化为有丝分裂后神经元。这些步骤中的每一个都在空间和时间上被精心安排,以产生多种神经元和胶质细胞类型,最终将填充成熟的中枢神经系统(CNS)。斑马鱼作为脊椎动物的模式生物已被用于神经发生的各个方面的大量研究。与小鼠和果蝇类似,斑马鱼可以用于基因分析。与哺乳动物相比,鱼类幼虫的发育发生在外部,这使得斑马鱼的中枢神经系统可用于实验操作。此外,高速和高分辨率显微镜等光学方法以及新兴光遗传学领域的新操作工具都可以应用于这种模式生物。因此,遗传学、胚胎学和最先进的光学技术的独特结合使斑马鱼成为研究神经发生的独特脊椎动物模式生物。
到目前为止,大多数研究都集中在胚胎阶段的神经发生。然而,最近的研究表明,成熟的斑马鱼大脑也可以作为研究成人神经发生的有价值的模型。事实上,早在20世纪60年代,第一个实验就表明,成年哺乳动物大脑的海马体和嗅球中诞生了新的神经元现场3.H]-新合成DNA的胸苷标记[1,2].然而,成年哺乳动物大脑中的神经发生却花了20多年的时间才被广泛接受。3.- - - - - -7].在啮齿动物和非人类灵长类动物中,新神经元的形成在两个区域特别明显,端脑的脑室下区(SVZ)和粒下区(SGZ)。然而,在SGZ和SVZ之外的几个大脑区域也同样报道了神经发生[8],例如基底前脑[9],纹状体[10,11],杏仁核[12]、黑质[13]、皮层下白质[14],以及最近的下丘脑[15- - - - - -17].此外,人类大脑似乎在成年状态下形成神经元[18- - - - - -22].然而,成人大脑中来自SGZ的嗅球神经元神经发生的证据仍有争议[23,24].
与哺乳动物相比,硬骨鱼如斑马鱼表现出更大的增殖潜力[25- - - - - -27].在成年斑马鱼大脑的离散区域中检测到多达16个不同的增殖区域,包括相当于哺乳动物SVZ和SGZ的区域[26- - - - - -30.].在成年斑马鱼的大脑中,每30分钟就有大约6000个细胞诞生,约占估计的10个细胞的0.06%7斑马鱼的大脑细胞[31].这种广泛的神经源性活动使斑马鱼成为研究成人神经发生的有吸引力的模型。
本文综述了斑马鱼发育和成人期神经发生的研究进展。
早期的神经发生
外部因素的神经诱导
脊椎动物神经系统发育的第一步是神经外胚层的规范。这一过程被称为“神经诱导”,在胚胎发育早期开始。在原肠胚形成初期,正在形成的中胚层渐开线与上覆的外胚层接触[32- - - - - -34].这种推测的中胚层在局部分泌重要因子来诱导或抑制外胚层的神经诱导。
在过去的几年里,已经取得的重要进展表明,脊椎动物神经诱导依赖于外部信号因子之间的复杂相互作用,如骨形态发生蛋白(BMP)、无翼整合(Wnt)和成纤维细胞生长因子(Fgf)家族成员[35,36]和内在转录因子程序,其中最重要的是SRY-box含有基因B1 (SoxB1)家族的成员[37- - - - - -39].根据研究中描述的“默认模型”非洲爪蟾蜍时,外胚层内的细胞有分化为神经组织的倾向[40].BMPs的腹侧分泌,特别是BMP2、4和7,通过诱导表皮命运而阻断神经诱导[41,42].BMP拮抗剂如Noggin和Chordin早期在背侧前组织区产生,随后形成Spemann组织,对应于鱼类的盾构组织。这些分泌的蛋白质允许在背侧外胚层中建立神经命运,并允许神经板的形成[32,33,42,43].然而,在极少数情况下,低水平的BMP需要维持脑区室,如在神经板期保护端脑命运[44].事实证明,BMP信号的抑制是获得“神经板”命运所必需的,但还不够。45].额外的分泌分子,如来自前内胚层的Cerberus [46]或胚皮边缘的Fgfs [47- - - - - -49]来诱导完整的神经功能。事实上,Fgf信号已被证明可诱导独立于BMP抑制的后神经外胚层命运[50,51].
内在因素决定了神经元的命运
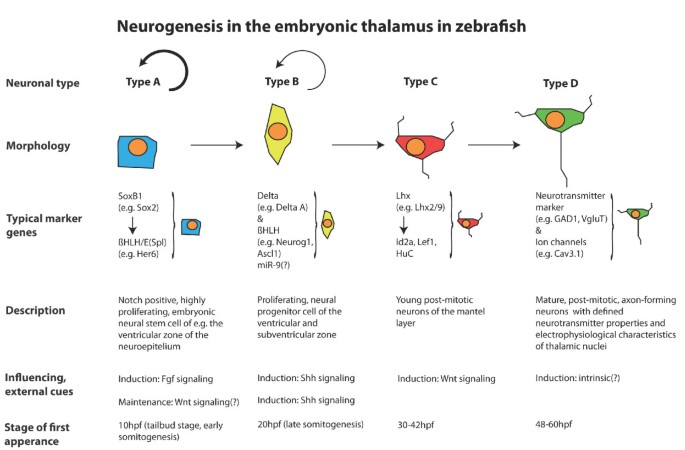
最近的数据表明,sry盒的成员含有基因B1(SoxB1)基因家族是这个“默认程序”的转录基础SoxB1基因对于脊椎动物胚胎外胚层进入A型神经外胚层谱系的规范很重要[38,39)(图1).
神经外胚层是由SoxB1家庭(52- - - - - -56].到目前为止,以下成员SoxB1斑马鱼的特征是:sox1(一个/b),2,3.,19(一个/b).所有这些都是在囊胚期诱导的,并且是指定神经外胚层命运所必需的[57,58].事实上,sox2可在胚胎的神经祖细胞以及成年斑马鱼大脑的神经干细胞中找到[29,30.,58,59].与Pou2/Oct4结合,Sox2激活神经元分化的抑制因子,如hesx1而且her3[58,60].因此,在脊椎动物谱系中,Sox2是维持神经祖细胞特性和功能所需的最重要因素之一[61- - - - - -63].在微分之前,SoxB1无论是在未成熟神经元中,还是在有丝分裂后终末神经元中,成员都被下调,从而不再表达[39,64].此外,在成年斑马鱼的大脑中,SoxB1成员标记静止和增殖胶质细胞以及幼年神经元。
然而,我们不能将外在因素与内在因素完全分开。在斑马鱼中,表达的是SoxB1家庭成员sox3取决于胚皮边缘的早期Fgf信号[50],进而调节早期BMPs的表达,如BMP2和7 [58].总之,这表明在抑制BMP信号和激活Fgf信号的同时,SoxB1成员是维持斑马鱼胚胎早期原肠形成阶段神经干细胞库的重要因素。
从神经板到神经管
一旦指定,神经外胚层形成神经板,斑马鱼的假分层上皮结构。在鱼类的早期生长发育过程中,神经板聚合形成神经龙骨,最终在背侧中线融合形成神经棒。从前部开始,新生神经龙骨中的细胞在胚胎中线开始极化。最近的一项研究表明,结构蛋白如Pard3和Rab11a的中线极化发生在神经棒的细胞互指过程中[65].这些蛋白包括Occludens带蛋白ZO-1、aPKC在顶端的定位,Numb和Lgl2在基底外侧的定位,以及随后在内侧神经棒的镜像对称细胞分裂导致其管腔(神经腔)的形成,神经腔将产生脑室,对扩大神经祖细胞池很重要[66- - - - - -68].
在神经形成的过程中,斑马鱼与其他脊椎动物不同:它没有立即将神经板折叠成有腔的管状,而是先形成一个坚实的神经龙骨。然而,在神经板形成神经龙骨的过程中,斑马鱼细胞的拓扑排列与其他脊椎动物相似。在所谓的“次级神经形成”中,鱼的神经棒膨胀并形成脊椎动物的典型管。因此,尽管存在差异,鱼类和哺乳动物的神经形成导致在每种情况下形成高度相似的结构,即神经管[69].
在管腔形成后,我们发现神经管中不对称分裂的细胞数量不断增加。分裂祖细胞亚细胞膜结构域的不对称遗传与子细胞的不对称命运密切相关[70].一个更顶端衍生的子细胞成为神经元,而一个更基部的子细胞补充顶端祖细胞池。提示Notch信号通路对命运决定很重要:基部自我更新子细胞表现出较高的Notch活性,而顶端分化子细胞表现出较低的Notch活性[71].Notch信号的方向性涉及到pard3依赖的Mindbomb的不对称定位。
分裂的神经元祖细胞从神经上皮的根尖侧向脑膜侧移动,这一过程被称为“互动核迁移”(在[72])。细胞在根尖侧分裂,在基底区分化。在斑马鱼视网膜上的实验表明,如果迁移速度加快,细胞在基底区停留的时间过长,祖细胞就会过早地退出细胞周期。这导致早生的投射神经元增加,而晚生的中间神经元减少[73].因此,神经上皮细胞顶端-基底极性的建立对中枢神经系统的成熟至关重要。
由bHLH因子启动神经发生,分裂E增强子(Spl)亚家族
斑马鱼神经板中神经发生的开始在原肠形成晚期通过前神经基因的表达变得明显[74].第一批脑前基因表达编码转录因子,如bHLH基因neurogenin1(neurog1;[75,76])和achaete-scute1(asc1,图1) [77].这些基因的转录并非无处不在,而是局限于B型前脑膜簇的细胞簇[75],由此产生初级神经元网络的核[78].
在这个阶段,仍然可以找到大SoxB1阳性的,非神经源性的区域,分离第一个神经前簇(综述于[79])。在早期神经发生期间,这些结构域将逐步被招募到它们的神经命运中。E(Spl)家族成员,Her/Hes基因,是转录靶点SoxB1,也就是说,her3[58],并在非神经源性区域的大多数域以各种组合表达,如other多毛的基因her5,her6,her9,her11[80,81].异位表达她/他基因会导致基因的下调neurog1表达,而功能丧失实验显示增加neurog1表达式。
的功能多毛的例如,Her5基因在中脑-后脑边界(MHB)形成过程中已被深入研究[79,82].MHB的祖细胞池位于中脑腹侧簇和前菱形膜的假定神经元之间。在神经发生开始时,该祖细胞池的细胞在MHB结构域内产生分化细胞[80].这个祖细胞池被标记为her5而且her11这些E(Spl)因子的表达和联合阻塞表明它们在共表达域有部分冗余[83- - - - - -85].这两种因素都阻断了一些神经基因的表达,如neurog1,ascl1a和周期蛋白依赖性激酶抑制剂,但它们的直接转录靶点仍然未知。
总之,SoxB1/毛发依赖的神经发生的主动抑制是扩大细胞池的关键机制。空间控制的下调多毛的基因活性定义了斑马鱼胚胎神经板内的祖细胞池。
根据它们对主动Notch信号的依赖程度,多毛的基因可分为两个科[86].的表达式她的上面提到的基因,她3,她5,她6,她9而且her11独立于Notch信号[83,87].这与其他毛因子的重要作用形成对比,例如her4.在每个簇中,表达较高水平的前神经基因的细胞被选为“成神经细胞”进行进一步的承诺和分化,同时同时维持它们的邻居作为增殖神经前体,可用于后一轮的成神经细胞选择[88].这一“横向抑制”过程依赖于前体中notch依赖的Her4信号通路,以及邻近神经母细胞中bHLH转录因子Delta的表达[89,90].Her4是维持胚胎中的神经祖细胞命运以及后期神经干细胞命运所必需的[91- - - - - -93]her4 -阳性增殖神经前体可在脑前簇内发现,并通过侧抑制在神经元与胶质命运的选择中发挥重要作用[89].
早期神经板前后模式
发育生物学中最引人注目的问题之一是位置信息如何沿前后轴分配,特别是在神经外胚层中。在神经诱导后,祖细胞表现为前神经板命运,随后通过来自胚胎尾部区域的信号转化为更后的特征[94,95].在斑马鱼中推测的后验信号包括Wnt、Fgf和Nodal蛋白,以及维甲酸[96,97].Wnt蛋白可能是作用于形成神经板原基的最早的模式信号。斑马鱼突变体无头(高密度脂蛋白),masterblind(mbl)携带基因编码突变tcf3而且axin1,并表现出严重的前模式缺损[98- - - - - -One hundred.].在这些胚胎中,前脑和眼胚轴减少或缺失,中脑向前扩张至神经管尖端。最近的研究表明,在非轴向中胚层表达的Wnt8对后脑命运的习得很重要[101].与此一致的是,Wnt8是诱导后脑表达的必要条件gbx1[102].为了建立wnt梯度,必须从最前面的神经结构释放一个抵消信号。前神经边界(ANB)确实通过释放分泌的卷曲相关蛋白(sFRP) Wnt拮抗剂,如TLC [103,104].因此,分级的Wnt活动在神经板内启动AP模式。在这最初的模式步骤之后,进一步的机制维持和完善神经管中的区域特征,例如,前脑和中脑之间的局部边界的形成[105].这些边界通常是共定位的,神经管内的局部组织中心沿着AP轴从前到后传递特定的位置信息[106,107].
这些局部信号中心之一是中间脑组织者(MDO),它建立在丘脑内边界,即丘脑内限制带[108].MDO的特点是嘘表达式[109- - - - - -112]并协调斑马鱼间脑丘脑复合体的发育[113].嘘作为该组织者的主要信号,并需要的浓度依赖诱导neurog1而且ascl1,导致脊椎动物丘脑核的形成[81,114].
在神经管内,另一个特征明显的组织中心是位于菱形脑峡部的MHB组织(在[115,116])。MHB能够通过分泌主要信号Fgf8以非自主的方式诱导细胞命运[117,118].
最初,其他信号传导因子,如典型Wnt蛋白Wnt1、Wnt3、Wnt3a和Wnt10b,在整个前脑和中脑广泛表达,直到它们的表达仅限于MDO、MHB和背中线[119,120].Wnts不能引起与主要信号Shh和Fgf8相比较的诱导效应。然而,Wnt信号的阻断导致局部组织中心的缺乏[120,121].因此,Wnt信号活动是许多局部大脑组织者上游的共同主题[113].
斑马鱼的丘脑——控制神经发生的一个例子
脊椎动物神经发生在胸神经簇内,具有高度的时间和空间精度,具有神经元分化和广泛的神经元迁移的刻板模式[122,123].神经元簇内有丝分裂活跃的神经元前体的动态模式被描述为“神经遗传梯度”[124].在丘脑中,神经元从后向前分化的进程呈现出这样的神经遗传梯度[108].最近,我们可以证明这种机制用于指导发育中的尾侧间脑(即丘脑)的神经发生[81].丘脑原基最初是非神经源性的区域。来自MDO的Shh决定丘脑的神经源性程序通过诱导脯神经基因,如neurog1.然而,神经发生并不会在丘脑复合体中Shh表达诱导后立即开始,而是首先被抑制[81].E(Spl)因子阳性结构域分离脑前簇。这些结构域表现出延迟分化,仅在发育后期才逐渐成为神经源性的(在[79])。丘脑复合体中的神经发生受E(Spl)因子Her6调控[81].的广泛表达her6在前神经板中,神经g1介导的神经发生细胞可自主抑制。随后的后前退变her6表达是伴随着上调的deltaA而且neurog1在神经管的心室和室下区细胞中先前表达的her6.Her6回归的机制尚不清楚;然而,最近提出了不同的解释。首先,Shh被认为影响E(Spl)因子的稳定性,如Her6的鼠类同源物Hes1 [125],这就可以解释her6在MDO附近的表达式。其次,据报道,microRNAs在祖细胞向有丝分裂后神经元的发展过程中发挥着重要作用[126].事实上,microRNA-9通过抑制祖细胞标记物Her6和有丝分裂后标记物Elavl3(以前称为HuC)来定义一种中间的矛盾状态。因此,miR-9在胚胎发育后期促进祖细胞向细胞周期退出的转变[127],使神经系统在这个阶段产生更多的神经元[128].事实上,Her6从后向前的动态回归后来反映在诱导neurog1表达和生成C型,有丝分裂后丘脑神经元标记物等Id2a lhx2b lhx9而且HuC[129)(图1).这些转录因子以确定的神经递质特性协调D型神经元的后续成熟。因此,在胚胎CNS内调节神经发生梯度的一个关键机制是由Her/Hes蛋白的局部失活介导的空间控制神经发生的去抑制过程。
成年神经发生
成年斑马鱼端脑的神经发生
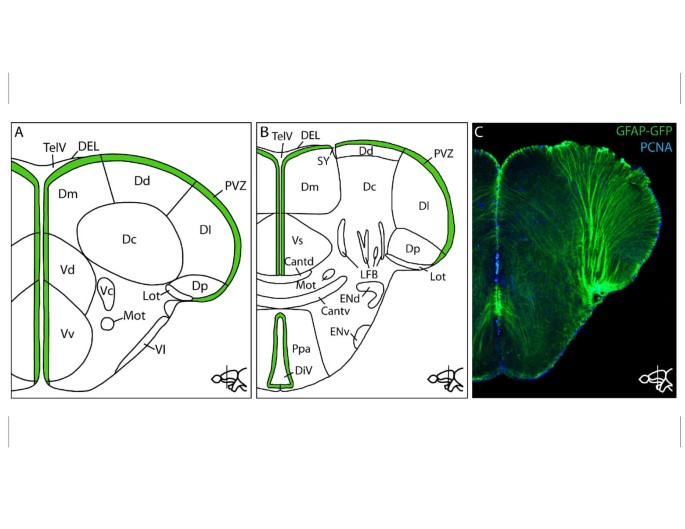
哺乳动物的端脑由神经管外翻发育。相比之下,硬骨鱼的端脑是向外折叠(外翻)形成的,因此增生性的室周带不仅出现在内部,而且还覆盖了端脑的外表面[130- - - - - -133](见图2).增殖区形成干细胞生态位结构不同的离散区域[134].哺乳动物的脑室表面覆盖着一层上皮,即室管膜或室管膜层[135- - - - - -138].在斑马鱼中,室管膜层局限于端脑室的顶部和增殖带的背外侧区域(D和Dm;参见图2) [134].其他增生区无室管膜层。在这方面,斑马鱼干细胞生态位的细胞环境更类似于爬行动物和鸟类干细胞生态位的室管膜碎片衬里(在[139])。增殖区域也因纤毛细胞类型的存在而不同。D, Vd, Dm和Dl区域(图2)中含有多纤毛细胞,而心室腔内的干细胞则不含纤毛[134].此外,增殖是沿端脑的尾侧轴调节的:虽然在端脑吻侧水平的整个室周区都能检测到细胞增殖,但增殖仅限于端脑尾部更多区域的不同亚域[134].
成年斑马鱼端脑解剖图。前(一个)和后(B)斑马鱼端脑,表明不同的解剖亚域。增生性室周带以绿色表示。原理图由[191].C放射状神经胶质细胞有很长的突起,一直延伸到脑膜表面。GFP免疫染色Tg(GFAP绿色荧光蛋白)线标记了成年斑马鱼端脑中的放射状神经胶质细胞。切片与增殖标记物PCNA(增殖细胞核抗原)共同染色,以区分PCNA阴性的I型细胞和PCNA阳性的II型细胞(描述于[30.])。腹:前合肋,背部;Cantv:前合部,腹侧部;Dc:端脑背侧中心区(D);Dd: D背侧区;DEL:室管膜背衬;DiV:间脑室;Dl: D侧区;Dm: D内侧区;Dp: D后区; Lot: lateral olfactory tract; ENd: entopeduncular nucleus, dorsal part; ENv: entopeduncular nucleus, ventral part; LFB: lateral forebrain bundle; Mot: medial olfactory tract; Ppa: anterior part of parvocellular preoptic nucleus; PVZ: periventricular zone; SY: sulcus ypsiloniformis; TelV: telencephalic ventricle; Vc: ventral nucleus of the ventral telencephalic area (V); Vd: dorsal nucleus of V; Vl: lateral nucleus of V; Vp: postcommissural nucleus of V; Vs: supracommisural nucleus of V; Vv: ventral nucleus of V.
增殖区形成新细胞的速度也不同[26].增殖最多的区域位于内侧姑息下(Vv) [26,30.,140].与其他增殖区相比,这一区域几乎完全由溴脱氧尿苷阳性(BrdU)、S100钙结合蛋白β阴性(S100β)、非缘毛细胞组成,神经元形成了生态位的深层。与其他干细胞壁龛相比,这个区域没有静止细胞[30.,134].此外,只有Vv最背侧的细胞表达S100β。该区域与哺乳动物的SVZ区同源,主要产生通过吻侧迁移流迁移到嗅球的神经元[26,27,141- - - - - -143].然而,与哺乳动物不同的是,这一区域也产生位于邻近实质的神经元[26,141].在其他心室区域的增殖率较低,在背侧端脑区(Dp)的后区水平有所升高,相当于哺乳动物海马的SGZ [25,27].在组织实质中也发现了一些增殖细胞[26,144].标记分析表明,这些实质细胞正在分裂少突胶质细胞前体细胞(OPCs),这些细胞既能自我繁殖,也能产生成熟的少突胶质细胞[144].
成年斑马鱼神经发生的关键细胞是放射状神经胶质细胞。这些细胞的细胞体位于心室附近,它们有很长的突起,一直延伸到端脑的脑膜表面,在那里它们的端脚在血管壁上或在脑膜表面本身[59,134].
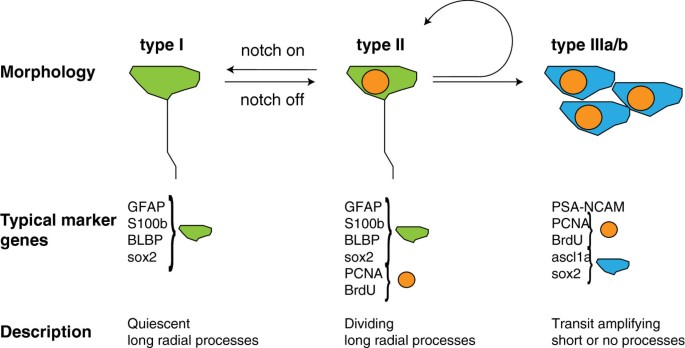
成年斑马鱼端脑中的放射状胶质细胞增殖,除了自我更新外,还能产生新的神经元[145].在发育中的哺乳动物端脑中也观察到放射状胶质细胞,在那里它们充当胚胎神经干细胞。哺乳动物的放射状胶质细胞在出生后不久消失,产生室管膜细胞和星形胶质细胞,其中一些细胞在SVZ和SGZ中保留干细胞潜能[146- - - - - -148].因此,成年斑马鱼似乎保留了胚胎时期的特征。事实上,成年斑马鱼径向神经胶质细胞表达的基因与胚胎细胞相似,如胶质酸性纤维蛋白(GFAP)、S100β和脑脂结合蛋白(BLBP) [26,59,149,150].通过增殖标志物的表达,如PCNA,或通过检测胸苷类似物BrdU的合并,可以区分两类径向胶质细胞:处于静止状态的细胞(I型细胞,BrdU−,PCNA−,GFAP+, S100β+, BLBP+)和缓慢循环的细胞(II型细胞,BrdU+, PCNA+, GFAP+, S100β+, BLBP+)。此外,她/他基因,比如her3,her4,her5,her6,her8a,her15,通常是静止而不是活跃增殖的放射状神经胶质细胞[93,140].大多数放射状胶质细胞处于静息状态。II型细胞产生继续增殖的神经母细胞(III型细胞),打开神经标记基因,如PSA-NCAM还有前神经基因ascl1,并最终进入口侧移流或离开室周区向更深的实质移动。增殖的II型干细胞可以对称分裂产生自我更新,也可以不对称分裂产生III型细胞[145].增殖干细胞和静息干细胞的相对比例可以通过干扰Notch信号来改变:Notch通路的激活促使干细胞进入静止状态,这表明细胞之间的串扰控制着静止干细胞群的维持[151)(图3.).因此,成人神经干细胞的维持似乎采用了与胚胎中所见相似的机制,其中notch介导的侧向抑制维持了胚胎神经干细胞库,用于以后产生神经元,如次级运动神经元[152].在心室周围区域(图中的Vv)2),但在背侧增殖区,Fgf信号是细胞增殖的调节因子[140].这突出了端脑腹侧和背侧干细胞生态位的差异,并指出Fgf信号是腹侧增殖区较高增殖率的潜在原因。
放射状神经胶质细胞的长突起被认为是新生神经元迁移出心室区的支架[59,149,150].然而,大多数新生神经元似乎位于脑室周下区域[92],表明大多数新生神经元不会像鱼类胚胎大脑中许多类型的新生神经元那样迁移到脑膜表面[129]或mouse [153].干细胞壁龛的细胞结构比图中概述的更为复杂3..例如,除了S100β/谷氨酰胺合成酶(GS)/GFAP/芳香化酶b阳性外,在背侧和背外侧区域也发现了S100β/GS/芳香化酶b阳性但GFAP阴性的细胞比例较小[30.,140].此外,电子显微镜研究[134]检测了细胞形态和标记物表达不同的其他细胞类型。IIa型细胞在[134]具有比放射状神经胶质细胞更短的过程(I型和II型细胞由[30.]),并与干细胞生态位附近的血管接触[134].这表明存在其他可能参与神经发生的细胞类型,或直接通过特化祖细胞,或间接通过促进生态位的结构。
成年斑马鱼大脑中的其他神经源性部位
虽然对成人端脑的干细胞壁龛进行了最密集的研究,但一些研究也报道了大脑中的其他增殖区域。小脑显示高度丰富的神经发生[27].分裂的小脑神经祖细胞表达nestin, Sox2, Meis同源box 2 (Meis)和Musashi同源体1 (果蝇) (Msi1)。它们还表现出神经上皮特性,如ZO-1、β-catenin、γ-tubulin和蛋白激酶C (aPKC)的表达[29].这些分裂细胞不表达放射状胶质标记。然而,小脑生态位也含有表达GFAP、波形蛋白和BLBP的放射状胶质样细胞。这些细胞似乎充当迁移祖细胞的支架,而不是干细胞本身.在脑室周围Vv中发现,Fgf信号是小脑干细胞活性的重要调节因子。用热休克诱导的显性阴性Fgf受体阻断Fgf信号,导致增殖细胞显著减少[29].
另一个神经源性部位位于中脑和后脑之间的边界[86].这个区域表示her5:绿色荧光蛋白在MHB的心室形成限制性簇的细胞中的转基因。这些her5:绿色荧光蛋白阳性细胞具有神经干细胞的几个一般特征。的子总体her5:绿色荧光蛋白细胞周期缓慢,表达干细胞标记物GFAP、BLBP、Sox2和Musashi,可分化为神经元和胶质细胞[86].her5:绿色荧光蛋白-表达细胞类似于端脑生态位的II型细胞。然而,存在中间快速增殖细胞类型的证据,如哺乳动物干细胞壁龛的过境放大细胞或斑马鱼大脑端脑壁龛的III型细胞。
在成年斑马鱼的视顶盖中,增殖细胞存在于PGZ的内侧、外侧和尾缘[25,27,154- - - - - -156].这些区域的增殖细胞表达神经祖细胞标志物PCNA, Sox2, Msi1 [157- - - - - -159].这些细胞不表达胶质标记。然而,它们表现出神经上皮的特征,如ZO-1、γ-微管蛋白和aPKC的表达[73,160].BrdU谱系追踪显示,这些细胞可分化为谷氨酸能或gaba能神经元、少突胶质细胞和放射状胶质细胞,因此代表了一个多能祖细胞池[156,161- - - - - -163].与小脑干细胞生态位的结构相似,表达胶质标记(GFAP, BLBP, S100β)的非分裂放射状胶质样细胞位于增殖的神经上皮样祖细胞附近。此外,在PGZ更深的层可以检测到增殖的放射状胶质样细胞[156].
虽然与端脑壁龛相比,这些干细胞壁龛的分析更有限,但结果表明,斑马鱼大脑中不同干细胞壁龛的结构有显著差异,这可能反映了这些位点的神经发生潜力的差异。
成人大脑的再生
哺乳动物大脑的再生能力非常有限。哺乳动物大脑大部分区域的局部环境似乎不适合新形成的神经元的长期生存。164,165].相比之下,斑马鱼具有非凡的损伤器官再生能力,包括中枢神经系统[166- - - - - -170].斑马鱼再生轴突[171]和损伤后功能完全恢复的整个神经元组合[28,172- - - - - -180].
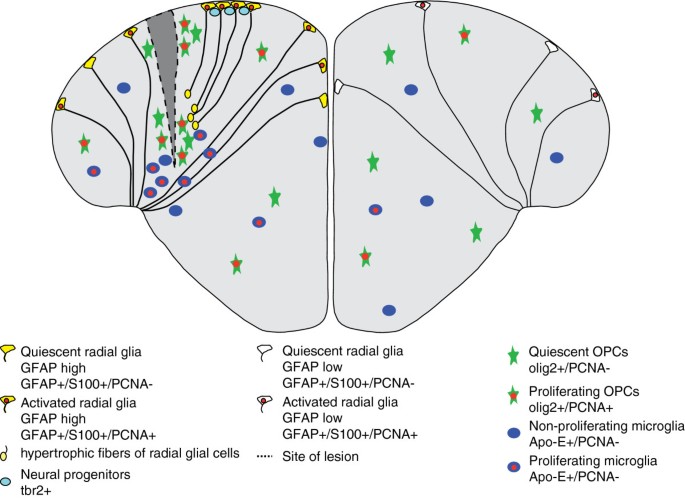
用针刺伤端脑后,沿整个心室表面刺激神经发生(图4),在受伤后3天内,会有更多II型干细胞表达增殖标记物PCNA [179].这种增殖反应仅限于受损半球,并至少持续14天[92,179].在构成性神经发生期间,新生神经元主要集中在脑室下区,与此相反,受损大脑中的新生神经元会长途迁移到受损组织区域,并分化为成熟神经元[92,180].确切地说,在病变远端,哪些远程信号介导了室周干细胞区增殖的增加,这一点仍不清楚。趋化因子信号通路通过Cxcr5可能在这一过程中发挥作用[181].也不清楚为什么这种激活仍然局限于受损的半球[179],即使内侧端脑的增殖区仅被狭窄的心室间隙隔开。
刺伤损伤的再生反应。注射针引起的病变在被刺穿的半球的脑室周围区域引起增殖反应。少突胶质细胞和小胶质细胞聚集在病变部位。胶质标记物GFAP和增殖标记物PCNA在病变半球上调。的数量T-box脑基因2阳性(Tbr2 +)细胞在损伤时增加[179].30天后,伤口完全愈合,没有神经胶质疤痕的痕迹。示意图显示通过内侧端脑的横切面。
在损伤部位也可检测到一些增殖,损伤后迅速充满了血细胞。然而,这些增殖细胞大多是参与清除细胞碎片的小胶质细胞[92,179,180].此外,OPCs在病变部位聚集。这些opc只在有限的范围内增殖,因此,它们中的大多数似乎是从邻近地区迁移过来的[179].小胶质细胞和OPCs在病变部位的聚集是短暂的[179].在斑马鱼的大脑中没有疤痕形成,而在受伤的哺乳动物神经组织中可以看到[92,179,180].在哺乳动物中,胶质疤痕被认为是机械和生化屏障,可阻止新轴突的生长或细胞迁移到病变部位[182].在受伤后三周,心室区的增殖率已恢复到未受伤大脑的基线,受损组织已完全恢复,没有任何创伤影响的残留迹象[179,180].有趣的是,响应损伤的构成性和反应性神经发生的分子机制似乎不同:反应性神经发生依赖于锌指转录因子gata3,该因子在未受伤的大脑中不表达[183,184].
一个基本的问题是,为什么鱼具有再生成年神经组织的非凡能力。斑马鱼在成年期也会生长,产生新的神经元,这些神经元需要被纳入现有的神经元回路中,这表明这为损伤神经组织的修复创造了有利的生理条件。在成年鱼小脑病变中,受损细胞似乎通过凋亡而被清除[185].相反,在受伤的哺乳动物神经组织中,坏死细胞死亡是主要的[186,187].坏死比凋亡引发的炎症反应更强烈,逐渐导致神经细胞的丢失和瘢痕形成[188].因此,细胞死亡模式的差异可能是导致鱼类损伤后神经组织异常恢复的因素之一。哺乳动物中抑制神经发生的少突胶质细胞标记物Olig2 [189,在受伤的哺乳动物神经组织中大量上调。相比之下,在斑马鱼的端脑中,olig2: EGFP-表达细胞在病变部位短暂累积[179].最近有研究表明,炎症信号在斑马鱼的端脑中触发反应性神经发生,这表明硬骨鱼和哺乳动物大脑的再生反应存在另一个根本差异[190].核心问题是,我们能否从斑马鱼身上了解到,例如,伤疤的形成是如何被抑制的,以及斑马鱼神经组织具有非凡可塑性的原因是什么。最重要的是,一个紧迫的挑战将是利用从鱼大脑中获得的知识来调节受伤人脑中干细胞、神经元、神经胶质细胞和免疫细胞的行为。
结论
胚胎和成人的调节级联在功能神经元形成的事件顺序上有相似之处。然而,组织设置是根本不同的。在胚胎中,神经元来源于神经外胚层上皮,其结构层次越来越复杂。相比之下,成人神经元主要来源于神经胶质细胞,需要整合到预先存在的、功能齐全的组织中。此外,在修复的情况下,除了成熟组织的复杂性之外,免疫反应、细胞死亡都是有助于成功恢复结构和功能的因素。这可能解释了在级联反应中不同基因调控因子的使用。阐明这些特定的差异将提供更多的见解,以了解神经发生是如何在胚胎和成人介导的。详细的知识将使我们能够开发工具,可能用于增加神经干细胞的神经源性潜力,就其进行神经元测定和分化的能力而言。在未来,这些见解可能会成为设计治疗策略的基础,最终允许激活静止祖细胞,并成功地将其纳入哺乳动物大脑的功能性神经元回路中。
缩写
- 美:
-
神经前界
- 记者:
-
前后
- BLBP:
-
脑脂结合蛋白
- 骨形态发生蛋白:
-
骨形态发生蛋白
- BrdU:
-
溴脱氧尿苷
- 中枢神经系统:
-
中枢神经系统
- Fgf:
-
成纤维细胞生长因子
- GFAP:
-
胶质酸性纤维蛋白
- 工具:
-
卡尔斯鲁厄理工学院
- MDO:
-
Mid-diencephalic组织者
- MHB:
-
Midbrain-hindbrain边界
- OPC:
-
少突胶质细胞前体细胞
- PCNA:
-
增殖细胞核抗原
- sFRP:
-
分泌卷曲相关蛋白
- SGZ:
-
Subgranular区
- SVZ:
-
Subventricular区
- Wnt:
-
Wingless-integrated。
参考文献
陈建平,张志刚,张志刚:大鼠出生后海马神经发生的自放射学和组织学证据。中华神经医学杂志,2004,24(3):319-335。10.1002 / cne.901240303。
出生后神经发生的自放射学和组织学研究。前前脑的细胞增殖和迁移,特别涉及嗅球中持续的神经发生。中华神经医学杂志,2003,27(3):344 - 344。10.1002 / cne.901370404。
Lois C, Alvarez-Buylla A:在成年哺乳动物前脑中增殖的脑室下区细胞可以分化为神经元和胶质细胞。美国国家科学研究院。1993, 90: 2074-2077。10.1073 / pnas.90.5.2074。
Gage FH, Coates PW, Palmer TD, Kuhn HG, Fisher LJ, Suhonen JO, Peterson DA, Suhr ST, Ray J:成人神经祖细胞移植到成人大脑的生存和分化。美国国家科学研究院。1995, 32(3): 377 - 382。10.1073 / pnas.92.25.11879。
Kuhn HG, dickins - anson H, Gage FH:成年大鼠齿状回的神经发生:与年龄相关的神经元祖细胞增殖减少。神经科学杂志,1996,16:2027-2033。
Eriksson PS, Perfilieva E, Björk-Eriksson T, Alborn AM, Nordborg C, Peterson DA, Gage FH:成人海马区的神经发生。中华医学杂志,1998,4:1313-1317。10.1038/3305。
Kukekov VG, Laywell ED, Suslov O, Davies K, Scheffler B, Thomas LB, O 'Brien TF, Kusakabe M, Steindler DA:具有相似特性的多能干细胞/祖细胞来自成人大脑的两个神经源性区域。中华神经医学杂志,1999,29(3):344 -344。10.1006 / exnr.1999.7028。
成人神经发生在哺乳动物中有多普遍?神经科学进展。2007,8:481-488。10.1038 / nrn2147。
Palmer TD, Ray J, Gage fgf -2反应神经元祖细胞存在于成年啮齿动物大脑的增殖区和静止区。中华神经科学杂志,1995,6:474-486。10.1006 / mcne.1995.1035。
penea V, Bingaman KD, Wiegand SJ, Luskin MB:成年大鼠侧脑室输注脑源性神经营养因子可导致纹状体、中隔、丘脑和下丘脑实质产生新的神经元。神经科学杂志,2001,21:6706-6717。
Reynolds BA, Weiss S:从成年哺乳动物中枢神经系统的分离细胞中产生神经元和星形胶质细胞。科学通报,1998,25(3):357 - 357。10.1126 / science.1553558。
Rivers LE, Young KM, Rizzi M, Jamen F, Psachoulia K, Wade A, Kessaris N, Richardson WD: PDGFRA/NG2胶质细胞在成年小鼠中产生髓鞘少突胶质细胞和梨状投射神经元。神经科学,2008,11:1392-1401。10.1038 / nn.2220。
Lie DC, Dziewczapolski G, Willhoite AR, Kaspar BK, Shults CW, Gage FH:成人黑质含有具有神经源性潜能的祖细胞。中华神经科学杂志,2002,22:639- 649。
李志刚,李志刚,李志刚,李志刚,李志刚,李志刚,李志刚,李志刚,李志刚,李志刚,李志刚,李志刚,李志刚:脑皮层下白质中多潜能神经祖细胞的分离与鉴定。中华医学杂志,2003,9:439-447。10.1038 / nm837。
Kokoeva MV, Yin H, Flier JS:成年小鼠下丘脑神经发生:能量平衡的潜在作用。科学通报,2005,30(3):349 - 349。10.1126 / science.1115360。
Migaud M, Batailler M, Segura S, Duittoz A, Franceschini I, Pillon D:哺乳动物大脑中成人神经发生的新位点:下丘脑和经典神经发生带之间的比较研究。中华神经科学杂志,2010,32:2042-2052。10.1111 / j.1460-9568.2010.07521.x。
Lee DA, bedon JL, Pak T, Wang H, Song J, Miranda-Angulo A, Takiar V, Charubhumi V, Balordi F, Takebayashi H, Aja S, Ford E, Fishell G, Blackshaw S:下丘脑中隆起的坦尼细胞形成饮食反应性神经源性生态位。中国神经科学,2012,15:700-702。10.1038 / nn.3079。
Quiñones-Hinojosa A, Sanai N, Soriano-Navarro M, Gonzalez-Perez O, Mirzadeh Z, Gil-Perotin S, Romero-Rodriguez R, Berger MS, Garcia-Verdugo JM, Alvarez-Buylla A:成人脑室下区的细胞组成和细胞结构:神经干细胞的生态位。中华神经医学杂志,2006,29(4):344 - 344。10.1002 / cne.20798。
Boldrini M, Underwood MD, Hen R, Rosoklija GB, Dwork AJ, John Mann J, Arango V:抗抑郁药增加人海马中的神经祖细胞。神经心理药理学杂志,2009,34:2376-2389。10.1038 / npp.2009.75。
Vaysse L, Labie C, Canolle B, Jozan S, Béduer A, Arnauduc F, Vieu C, Sol JC, Loubinoux I:来自颞叶的成人祖细胞:神经元细胞的另一种来源。中华脑科学杂志,2012,26:1636-1645。10.3109 / 02699052.2012.700084。
Sanai N, Tramontin AD, Quiñones-Hinojosa A, Barbaro NM, Gupta N, Kunwar S, Lawton MT, McDermott MW, Parsa AT, Manuel-García Verdugo J, Berger MS, Alvarez-Buylla A:成人大脑中独特的星形胶质细胞带含有神经干细胞,但缺乏链迁移。自然科学进展,2004,29(4):344 - 344。10.1038 / nature02301。
Curtis MA, Kam M, Nannmark U, Anderson MF, Axell MZ, Wikkelso C, Holtås S, Van Roon-Mom WMC, Björk-Eriksson T, Nordborg C, Frisén J, Dragunow M, Faull RLM, Eriksson PS:人类神经母细胞通过侧脑室延伸迁移到嗅球。科学通报,2007,32(3):344 - 344。10.1126 / science.1136281。
Bergmann O, Liebl J, Bernard S, Alkass K, Yeung MSY, Steier P, Kutschera W, Johnson L, Landén M, Druid H, Spalding KL, Frisén J:人类嗅球神经元的年龄。神经科学学报,2012,34(4):344 - 344。10.1016 / j.neuron.2012.03.030。
人类成人嗅球神经发生?新奇是上策。神经科学学报,2012,34(4):595-596。10.1016 / j.neuron.2012.05.005。
Zupanc GKH, Hinsch K, Gage FH:成年斑马鱼大脑中新细胞的增殖、迁移、神经元分化和长期生存。中华神经医学杂志,2005,29(3):344 - 344。10.1002 / cne.20571。
Adolf B, Chapouton P, Lam CS, Topp S, Tannhäuser B, Strähle U, Götz M, Bally-Cuif L:斑马鱼端脑成体神经发生的保守性和获得性特征。中国生物工程学报,2006,29(3):344 - 344。10.1016 / j.ydbio.2006.03.023。
Grandel H, Kaslin J, Ganz J, Wenzel I, Brand M:成年斑马鱼大脑中的神经干细胞和神经发生:起源,增殖动力学,迁移和细胞命运。生物工程学报,2006,29(3):344 - 344。10.1016 / j.ydbio.2006.03.040。
Zupanc GKH, Zupanc MM:损伤大脑的新神经元:成年硬骨鱼神经元再生的机制。中华医学杂志,2006,(1):1 -2。10.2217 / 17460751.1.2.207。
Kaslin J, Ganz J, Geffarth M, Grandel H, Hans S, Brand M:成年斑马鱼小脑干细胞:一种新型干细胞生态位的启动和维持。神经科学杂志,2009,29:6142-6153。10.1523 / jneurosci.0072 - 09.2009。
März M, Chapouton P, Diotel N, Vaillant C, Hesl B, Takamiya M, Lam CS, Kah O, Bally-Cuif L, Strähle U:斑马鱼成年端脑室区祖细胞亚型的异质性。神经胶质学报,2010,38(3):344 - 344。
Hinsch K, Zupanc GKH:成年斑马鱼大脑中新神经元的生成和长期持久性:定量分析。神经科学学报,2007,29(3):349 - 349。10.1016 / j.neuroscience.2007.01.071。
Doniach T, Musci TJ:非洲爪蟾前后神经模式的诱导:定量机制的证据。机械工程学报,2004,29(3):344 - 344。10.1016 / 0925 - 4773(95) 00457 - 2。
Lumsden A, Krumlauf R:脊椎动物神经轴的图案。科学通报,1996,29(4):457 - 457。10.1126 / science.274.5290.1109。
Spemann H, Mangold H:通过植入不同物种的组织者诱导胚胎原基。1923.中华流行病学杂志,2001,45:13-38。
Streit A, Berliner AJ, Papanayotou C, Sirulnik A, Stern CD:原肠胚形成前FGF信号的神经诱导启动。自然科学,2000,30(4):344 - 344。10.1038 / 35017617。
Wilson SI, Rydström A, Trimborn T, Willert K, Nusse R, Jessell TM, Edlund T: Wnt信号在鸡胚神经和表皮命运调控中的地位。自然科学,2001,411:325-330。10.1038 / 35077115。
Avilion AA, Nicolis SK, Pevny LH, Perez L, Vivian N, Lovell-Badge R:小鼠早期发育的多能细胞谱系依赖于SOX2功能。基因开发,2003,17:126-140。10.1101 / gad.224503。
Streit A, Sockanathan S, Pérez L, Rex M, Scotting PJ, Sharpe PT, Lovell-Badge R, Stern CD:防止神经诱导能力丧失:HGF/SF, L5和socks -2。发展,1997,124:1191-1202。
Sasai Y:识别缺失的环节:连接脊椎动物胚胎神经诱导和初级神经发生的基因。神经学报,1998,21:455-458。10.1016 / s0896 - 6273(00) 80554 - 1。
Weinstein DC, hemmatia - brivanlou A:神经诱导。中国生物医学工程学报,1999,15:411-433。10.1146 / annurev.cellbio.15.1.411。
Sasai Y, De Robertis EM:脊椎动物胚胎的外胚层模式。中国生物医学工程学报,1997,27(3):344 - 344。10.1006 / dbio.1996.8445。
Wilson PA, Lagna G, Suzuki A, hemmatii - brivanlou A:非洲爪蟾外胚BMP4及其信号传感器Smad1的浓度依赖模式。发展。1997,124:3177-3184。
Wessely O, Agius E, Oelgeschläger M, Pera EM, De Robertis EM:没有中胚层的神经诱导:在非洲爪蟾囊胚期分泌BMP拮抗剂的β-catenin依赖性表达。生物工程学报,2001,34(3):344 - 344。10.1006 / dbio.2001.0258。
Bielen H, Houart C: BMP信号通过抑制眼同构及其cxcr4依赖的形态发生来保护端脑命运。生物工程学报,2012,23:812-22。
Stern CD:神经诱导:自“默认模型”以来10年。中国生物医学工程杂志,2006,18:692-697。10.1016 / j.ceb.2006.09.002。
Bouwmeester T, Kim S, Sasai Y, Lu B, De Robertis EM: Cerberus是一种在Spemann组织者前内胚层表达的诱导脑分泌因子。自然科学学报,1996,27(3):366 - 366。10.1038 / 382595 a0。
Lamb TM、Harland RM:成纤维细胞生长因子(Fibroblast growth factor)是一种直接的神经诱导因子,与脑蛋白结合形成前后神经模式。发展。1995,121:3627-3636。
李志刚,李志刚,李志刚:FGF在全鸡胚培养中的神经诱导作用。中国生物工程学报,1998,19(4):344 - 344。10.1006 / dbio.1998.8903。
Storey KG, Goriely A, Sargent CM, Brown JM, Burns HD, Abud HM, Heath JK: FGF诱导鸡胚早期后神经组织。《发展》,1998,25(4):473-484。
杨晓明,张晓明,张晓明,张晓明,等:Fgf信号通路诱导后神经外胚层形成与Bmp信号通路无关。科学通报,2004,31(3):357 - 357。10.1002 / dvdy.20244。
Londin ER, Niemiec J, Sirotkin HI: Chordin, FGF信号,和中胚层因子在斑马鱼神经诱导中的合作。生物工程学报,2005,29(3):344 - 344。10.1016 / j.ydbio.2004.11.016。
彭泽尔,陈勇,陈志强,陈志强,陈志强:非洲爪蟾神经特异性转录因子xSOX3的鉴定及早期胚胎表达。中国生物医学工程学报,1997,26(4):457 - 457。
Rex M, Uwanogho DA, Orme A, Scotting PJ, Sharpe PT: cSox21在鸡中枢神经系统胚胎发育过程中表现出复杂的动态转录模式。机械工程学报,1997,26(3):357 - 357。10.1016 / s0925 - 4773(97) 00086 - 5。
Wood HB, Episkopou V:小鼠Sox1, Sox2和Sox3基因从原肠胚形成前到躯体早期的比较表达。机械开发,1999,86:197-201。10.1016 / s0925 - 4773(99) 00116 - 1。
张c, Basta T, Jensen ED, Klymkowsky MW: β-catenin/ vegt调控的早期合子基因Xnr5是SOX3调控的直接靶点。科学进展,2003,30(4):357 - 357。10.1242 / dev.00798。
张c, Basta T, Hernandez-Lagunas L, Simpson P, Stemple DL, Artinger KB, Klymkowsky MW:母源b1型SOXs抑制对非洲爪蟾和斑马鱼生殖层形成的调控作用。生物工程学报,2004,29(3):344 - 344。10.1016 / j.ydbio.2004.05.019。
Dee CT, Hirst CS, Shih Y-H, Tripathi VB, Patient RK, Scotting PJ: Sox3调控斑马鱼外表皮神经命运和分化。中国生物工程学报,2008,29(3):344 - 344。10.1016 / j.ydbio.2008.05.542。
Okuda Y, Ogura E, Kondoh, Kamachi Y:在早期斑马鱼胚胎中B1 SOX坐标细胞规范与模式和形态发生。公共科学学报,2010,6:e1000936-10.1371/journal.pgen.1000936。
Lam CS, März M, Strähle U: gfap和nestin报告系揭示了成年斑马鱼大脑中神经祖细胞的特征。生物工程学报,2009,38(3):344 - 344。10.1002 / dvdy.21853。
Reim G, Brand M: POU结构域蛋白Spg/Pou2/Oct4对脊椎动物背腹轴形成和外胚乳的母系控制。发展,2006,133:2757-2770。10.1242 / dev.02391。
Bani-Yaghoub M, Tremblay RG, Lei JX, Zhang D, Zurakowski B, Sandhu JK, Smith B, Ribecco-Lutkiewicz M, Kennedy J, Walker PR, Sikorska M: Sox2在小鼠新皮层发育中的作用。中国生物医学工程学报,2006,29(3):344 - 344。10.1016 / j.ydbio.2006.03.007。
Taranova OV, Magness ST, Fagan BM, Wu Y, Surzenko N, Hutton SR, Pevny LH: SOX2是视网膜神经祖细胞能力的剂量依赖调节因子。基因开发,2006,20:1187-1202。10.1101 / gad.1407906。
Favaro R, Valotta M, Ferri ALM, Latorre E, Mariani J, Giachino C, Lancini C, Tosetti V, Ottolenghi S, Taylor V, Nicolis SK:海马发育和神经干细胞维持需要sox2依赖的Shh调节。神经科学学报,2009,12:1248-1256。10.1038 / nn.2397。
杨晓明,杨晓明,杨晓明,杨晓明。Sox1-3活性对脊椎动物神经发生的抑制作用。中华神经科学杂志,2003,6:1162-1168。10.1038 / nn1131。
Buckley CE, Ren X, Ward LC, Girdler GC, Araya C, Green MJ, Clark BS, Link BA, Clarke JDW:斑马鱼神经棒中镜像对称微管组装和细胞相互作用驱动管腔形成。生物工程学报,2012,32:30-44。10.1038 / emboj.2012.305。
极化细胞分裂在斑马鱼神经管形成中的作用。神经生物学杂志,2009,19:134-138。10.1016 / j.conb.2009.04.010。
Tawk M, Araya C, Lyons DA, Reugels AM, Girdler GC, Bayley PR, Hyde DR, Tada M, Clarke JDW:调节神经上皮形态发生的镜像对称细胞分裂。自然科学学报,2007,44(3):344 - 344。10.1038 / nature05722。
杨霞,邹娟,魏鑫:神经上皮顶端基极性的逐步成熟对脊椎动物神经形成至关重要。神经科学杂志,2009,29:11426-11440。10.1523 / jneurosci.1880 - 09.2009。
Papan C, Campos-Ortega JA:斑马鱼脊髓发育中的区域特异性细胞克隆。生物工程学报,1999,29(3):344 - 344。10.1007 / s004270050237。
Alexandre P, Reugels AM, Barker D, Blanc E, Clarke JDW:斑马鱼神经管不对称分裂中神经元来自更顶端的子细胞。中华神经科学杂志,2010,13:673-679。10.1038 / nn.2547。
董卓,杨宁,杨淑艳,郭珊珊:系内定向Notch信号通路调控不对称分裂径向胶质细胞的自我更新和分化。神经科学学报,2012,34(4):344 - 344。10.1016 / j.neuron.2012.01.031。
Baye LM, Link BA:视网膜发育过程中的核迁移。大脑决议,2008,1192:29-36。
王志刚,王志刚,王志刚。核迁移对神经发生的影响。细胞学报,2008,34(4):344 - 344。10.1016 / j.cell.2008.07.017。
A:神经发生和神经元同一性的规范。结果生物技术学报,2002,30(4):357 - 357。
blater P, Fischer N, Gradwohl G, Guillemot F, Strähle U:斑马鱼胚胎中神经原素1的活性受局部线索控制。发展。1997,124:4557-4569。
Korzh V, Strähle U:前神经,前感觉,抗胶质:神经原素的许多方面。神经科学进展,2002,25:603-605。10.1016 / s0166 - 2236(02) 02275 - 0。
Allende ML, Weinberg ES:在独眼虫突变体的胚胎大脑中,两个斑马鱼achaete- sculg同源基因(ash)的表达模式发生改变。中国生物医学工程学报,2004,26(4):457 - 457。10.1006 / dbio.1994.1334。
Wilson SW, Ross LS, Parrett T, Easter SS:胚胎斑马鱼Brachydanio rerio大脑中轴突束的简单支架的发展。《科学进展》,1990,30(4):344 - 344。
张志刚,张志刚,张志刚,张志刚,张志刚,等:胚胎期和成年期脑内神经祖细胞池的E(Spl)因子鉴定。神经科学学报,2008,29(2):366 - 366。10.1016 / j.brainresbull.2007.10.032。
Tallafuss A, Adolf B, Bally-Cuif L:前脑/中脑边界神经元簇大小的选择性控制通过来自弦前板的信号。计算机科学进展,2003,27(3):344 - 344。10.1002 / dvdy.10329。
Scholpp S, Delogu A, Gilthorpe J, Peukert D, Schindler S, Lumsden A: Her6调节丘脑中的神经遗传梯度和神经元同一性。美国国家科学研究院。2009, 26(3): 379 - 379。
Chapouton P, Godinho L:神经发生。方法细胞生物学杂志,2010,100:73-126。
Geling A, Itoh M, Tallafuss A, Chapouton P, Tannhäuser B, Kuwada JY, Chitnis AB, Bally-Cuif L: bHLH转录因子Her5与中脑-后脑边界神经发生的区域抑制有关。发展,2003,130:1591-1604。10.1242 / dev.00375。
Geling A, Plessy C, Rastegar S, Strähle U, Bally-Cuif L: Her5作为一种前模式因子,阻断Notch上游的neurogenin1和coe2表达,抑制中脑-后脑边界的神经发生。发展。2004,131:1993-2006。10.1242 / dev.01093。
Ninkovic J, Tallafuss A, Leucht C, Topczewski J, Tannhäuser B, Solnica-Krezel L, Bally-Cuif L:一种新的毛发/E(spl)基因对的联合和剂量依赖性活性对斑马鱼中脑-后脑边界神经发生的抑制。《科学进展》,2005,32(3):344 - 344。
Chapouton P, Adolf B, Leucht C, Tannhäuser B, Ryu S, Driever W, Bally-Cuif L: Her5表达揭示了成体斑马鱼中脑中的神经干细胞池。发展。2006,133:4293-4303。10.1242 / dev.02573。
Hans S, Scheer N, Riedl I, Weizsäcker VE, Blader P, Campos-Ortega JA: her3,毛- e (spl)家族的斑马鱼成员,被Notch信号抑制。科学进展。2004,31(3):349 - 349。10.1242 / dev.01167。
Blader P, Plessy C, Strähle U:具有时空差异活动的多种调控元件控制斑马鱼胚胎初级神经元中神经源蛋白1的表达。机械工程学报,2003,29(3):344 - 344。10.1016 / s0925 - 4773(02) 00413 - 6。
王晓明,王晓明,王晓明,王晓明,王晓明。斑马鱼原始神经发生过程中多delta基因与侧抑制的关系。发展,1998,125:359-370。
陈志伟,陈志伟,陈志伟,等:斑马鱼脊髓发育过程中Delta-Notch信号通路的研究进展。中国生物医学工程学报,2001,1:13-10.1186/1471- 213x -13。
Takke C, Dornseifer P, Weizsäcker VE, Campos-Ortega JA: her4是果蝇神经源性基因E(spl)的斑马鱼同源物,是NOTCH信号的靶标。发展,1999,126:1811-1821。
Kroehne V, Freudenreich D, Hans S, Kaslin J, Brand M:成年斑马鱼脑再生的神经源性放射状胶质细胞型祖细胞。发展,2011,138:4831-4841。10.1242 / dev.072587。
Chapouton P, Webb KJ, Stigloher C, Alunni A, Adolf B, Hesl B, Topp S, Kremmer E, Bally-Cuif L:成年斑马鱼大脑神经祖细胞和神经发生域中毛发/增强子的表达。中华神经医学杂志,2011,29(3):344 - 344。10.1002 / cne.22599。
niuwkoop PD, Nigtevecht GV:外胚层外植体在尿管前脊索碎片影响下的神经激活和转化。中华胚胎科学杂志,2004,23(2):366 - 366。
Foley AC, Skromne I, Stern CD:协调前脑诱导和模式的不同模型:低母细胞的双重作用。发展,2000,127:3839-3854。
威尔逊SW,布兰德M,艾森JS:斑马鱼中枢神经系统模式。结果神经网络学报,2002,30(4):344 - 344。
王志强,王志强:端脑的诱导和背腹侧模式。神经科学学报,2000,28:641-651。10.1016 / s0896 - 6273(00) 00171 - 9。
金春春,田田,李志刚,姜东,陈志刚,陈志刚,陈志刚,陈志刚,陈志刚,陈志刚:Headless/Tcf3抑制因子在脊椎动物头部形成中的作用。自然科学,2000,37(4):344 - 344。10.1038 / 35038097。
Heisenberg CP, Brand M, Jiang YJ, Warga RM, Beuchle D, Van Eeden FJ, Furutani-Seiki M, Granato M, Haffter P, Hammerschmidt M, Kane DA, Kelsh RN, Mullins MC, Odenthal J, Nusslein-Volhard C:斑马鱼前脑发育相关基因。《发展与发展》,1996,23(4):344 - 344。
Heisenberg CP, Houart C, takuchi M, Rauch GJ, Young N, Coutinho P, Masai I, Caneparo L, Concha ML, Geisler R, Dale TC, Wilson SW, Stemple DL:斑马鱼Masterblind/Axin1中gsk3结合域的突变导致端脑和眼睛向间脑的命运转化。基因工程学报,2001,15:1427-1434。10.1101 / gad.194301。
Rhinn M, Lun K, Luz M, Werner M, Brand M:通过Wnt8信号介导的神经外胚层整体后化定位中脑-后脑边界组织者。《科学进展》,2005,32(3):344 - 344。10.1242 / dev.01685。
Rhinn M, Lun K, Ahrendt R, Geffarth M, Brand M:斑马鱼gbx1细化中脑-后脑边界边界,介导Wnt8后化信号。神经科学进展,2009,4:12-10.1186/1749-8104- 412。
Houart C, Westerfield M, Wilson SW:在斑马鱼原肠形成过程中,前脑有一小部分前部细胞。自然科学,1998,39(3):344 - 344。10.1038/35853。
胡art C, Caneparo L, Heisenberg C, Barth K,竹内M, Wilson S: Wnt信号局部拮抗在原肠形成过程中端脑的建立。神经科学学报,2002,34(3):344 - 344。10.1016 / s0896 - 6273(02) 00751 - 1。
Scholpp S, Lohs C, Brand M: Engrailed和Fgf8协同作用维持间脑和中脑的边界。《科学进展》,2003,30(3):344 - 344。10.1242 / dev.00683。
凯克尔,卢姆斯登,A:脊椎动物大脑发育中的间隔及其边界。中华神经科学杂志,2005,6:553-564。10.1038 / nrn1702。
Dahmann C, Oates AC, Brand M:组织发育中的边界形成和维持。植物学报,2011,12:43-55。
Scholpp S, Lumsden A:建造新房:丘脑的发育。神经科学,2010,33:373-380。10.1016 / j.tins.2010.05.003。
Kobayashi D, Kobayashi M, Matsumoto K, Ogura T, Nakafuku M, Shimamura K:神经板的早期细分定义了感应信号的不同能力。发展,2002,129:83-93。
Kiecker C, Lumsden A:来自ZLI的Hedgehog信号调控间脑区域特征。神经科学,2004,7:1242-1249。10.1038 / nn1338。
维埃拉C, Garda A-L, Shimamura K, Martinez S: Shh诱导鸡胚丘脑发育。中国生物医学工程学报,2005,34(4):359 -363。10.1016 / j.ydbio.2005.05.031。
Scholpp S, Wolf O, Brand M, Lumsden A:斑马鱼丘脑内限制带的刺猬信号协调间脑的模式。发展,2006,133:855-864。10.1242 / dev.02248。
Hagemann AIH, Scholpp S:三个兄弟的故事——Shh, Wnt和Fgf在丘脑发育过程中。前沿神经科学,2012,6:76-
郑y, Dolson DK, Waclaw RR, Matise MP, Sussel L, Campbell K, Kaestner KH, Epstein DJ:超音hedgehog基因在调节丘脑中间神经元身份中的时空需求。发展,2011,138:531-541。10.1242 / dev.058917。
W型肠,L型肠:神经板图:峡部组织器的上游和下游。中华神经科学杂志,2001,2:99-108。10.1038 / 35053516。
Raible F, Brand M: Divide et impera -中脑-后脑边界及其组织者。神经科学进展,2004,27:727-734。10.1016 / j.tins.2004.10.003。
Reifers F, Böhli H, Walsh EC, Crossley PH, Stainier DY, Brand M: Fgf8在斑马鱼小脑(ace)突变体中发生突变,是维持中脑-后脑边界发育和体细胞发生所必需的。发展,1998,125:2381-2395。
Chi CL, Martinez S, Wurst W, Martin GR:峡部组织者信号FGF8在中脑和小脑的细胞存活中是必需的。科学进展,2003,30(4):344 - 344。10.1242 / dev.00487。
Lekven AC, Buckles GR, Kostakis N, Moon RT: Wnt1和wnt10b在斑马鱼中脑-后脑边界具有冗余功能。中国生物医学工程学报,2003,29(3):344 - 344。10.1016 / s0012 - 1606(02) 00044 - 1。
Mattes B, Weber S, Peres J, Chen Q, Davidson G, Houart C, Scholpp S: Wnt3和Wnt3a是尾侧前脑中间脑组织者的诱导所必需的。神经系统工程学报,2012,29(4):344 - 344。
Buckles GR, Thorpe CJ, Ramel M-C, Lekven AC:组合Wnt控制斑马鱼中脑-后脑边界形成。机械开发,2004,21:437-447。10.1016 / j.mod.2004.03.026。
王晓峰,王晓峰,王晓峰。无脊椎动物和脊椎动物神经发生的变化:同一主题的变化?《科学》,1996,18:1-10。10.1002 / (SICI) 1520 - 6408 (1996) 18:1 < 1:: AID-DVG1 > 3.0.CO;二维。
Bertrand N, Castro DS, Guillemot F:脯神经基因与神经细胞类型的规范。中华神经科学杂志,2002,3:517-530。10.1038 / nrn874。
Bayer SA, Altman J:视前区的发育:其神经元的起源时间和位置、迁移路线和沉降模式。中华神经医学杂志,1997,26(3):357 - 357。10.1002 / cne.902650106。
Wall DS, Mears AJ, McNeill B, Mazerolle C, Thurig S, Wang Y, Kageyama R, Wallace VA:视网膜祖细胞增殖依赖于Notch-independent Sonic hedgehog/Hes1活性。中国生物医学工程学报,2009,34(4):344 - 344。10.1083 / jcb.200805155。
杨晓明,杨晓明,杨晓明:MicroRNAs在脑发育和生理中的应用。神经生物学杂志,2009,19:461-470。10.1016 / j.conb.2009.09.006。
Coolen M, Thieffry D, Drivenes O, Becker TS, Bally-Cuif L: miR-9通过直接抑制拮抗因子控制神经发生的时间。应用物理学报,2012,29(3):344 - 344。10.1016 / j.devcel.2012.03.003。
Lyons DA, Guy AT, Clarke JDW:在完整的脊椎动物大脑中通过多轮分裂来监测神经祖细胞的命运。《科学进展》,2003,30(4):344 - 344。10.1242 / dev.00569。
Peukert D, Weber S, Lumsden A, Scholpp S: Lhx2和Lhx9通过调节Wnt信号来决定末梢前脑的神经元分化和共分。公共科学图书馆,2011,9:e1001218-10.1371/journal.pbio.1001218。
Wullimann MF, Mueller T: telostean和哺乳动物的前脑对比:从基因到行为的证据。中华神经医学杂志,2004,29(3):344 - 344。10.1002 / cne.20183。
Broglio C, Gómez A, Durán E, Ocaña FM, Jiménez-Moya F, Rodríguez F, Salas C:一种常见前脑脊椎动物计划的特征:放光鳍类鱼类空间、时间和情感记忆的专门的pallial区域。《科学通报》,2005,26(3):457 - 457。10.1016 / j.brainresbull.2005.03.021。
Mueller T, Wullimann MF:远端骨前脑解剖学的进化解释。神经科学进展,2009,34(4):344 - 344。10.1159 / 000229011。
Folgueira M, Bayley P, Navratilova P, Becker TS, Wilson SW, Clarke JD:外翻硬骨鱼端脑发育基础的形态发生。神经系统工程学报,2012,29(4):344 - 344。
Lindsey BW, Darabie A, Tropepe V:成年斑马鱼前脑中神经源性室周带的细胞组成。中华神经医学杂志,2012,29(3):344 - 344。10.1002 / cne.23065。
Morshead CM, Reynolds BA, Craig CG, McBurney MW, Staines WA, Morassutti D, Weiss S, Van der Kooy D:成年哺乳动物前脑中的神经干细胞:相对静止的室管膜下细胞亚群。神经科学学报,1994,13:1071-1082。10.1016 / 0896 - 6273(94) 90046 - 9。
刘志刚,刘志刚,刘志刚,刘志刚,刘志刚,等,Frisén成年哺乳动物中枢神经系统神经干细胞的鉴定。细胞科学,1999,36(4):344 - 344。10.1016 / s0092 - 8674(00) 80956 - 3。
seabberg RM, Van der Kooy D:成年啮齿动物神经源区:脑室室管膜下含有神经干细胞,但齿状回含有限制性祖细胞。中华神经科学杂志,2002,22(3):344 - 344。
段旭,康娥,刘春春,明桂林,宋华:成人脑神经干细胞的发育。神经生物学杂志,2008,18:108-115。10.1016 / j.conb.2008.04.001。
García-Verdugo JM, Ferrón S,火焰N, colado L, Desfilis E,字体E:成年脊椎动物的增殖心室区:使用爬行动物,鸟类和哺乳动物的比较研究。科学通报,2002,29(3):344 - 344。10.1016 / s0361 - 9230(01) 00769 - 9。
甘兹J,郭志刚,郭志刚,郭志刚。斑马鱼端脑成体神经祖细胞Fgf依赖性的研究。神经胶质杂志,2010,58:1345-1363。
Kishimoto N, Alfaro-Cervello C, Shimizu K, Asakawa K, Urasaki A, Nonaka S, Kawakami K, Garcia-Verdugo JM, Sawamoto K:成年斑马鱼神经元前体从端脑心室区迁移到嗅球。中华神经医学杂志,2011,29(3):349 - 349。10.1002 / cne.22722。
伯德CA, Brunjes PC:成年斑马鱼嗅球添加新细胞。清华大学学报(自然科学版),1998,29(4):344 - 344。10.1111 / j.1749-6632.1998.tb10582.x。
伯德CA, Brunjes PC:成年斑马鱼嗅球的神经发生。神经科学,2001,10:793-801。10.1016 / s0306 - 4522(01) 00215 - 9。
März M, Schmidt R, Rastegar S, Strähle U:转录因子Olig2在成年斑马鱼端脑增殖细胞中的表达。系统工程学报,2010,39(3):336- 349。10.1002 / dvdy.22455。
Rothenaigner I, Krecsmarik M, Hayes JA, Bahn B, Lepier A, Fortin G, Götz M, Jagasia R, Bally-Cuif L:通过不同病毒载体克隆分析鉴定成年斑马鱼端脑中的真正神经干细胞,并表征其分裂特性和命运。《科学进展》,2011,38(4):459- 469。10.1242 / dev.058156。
Alvarez-Buylla A, García-Verdugo JM, Tramontin AD:神经干细胞谱系的统一假设。中华神经科学杂志2001,2:287-293。10.1038 / 35067582。
张志刚,张志刚。成人脑室下区的神经发生。神经科学杂志,2002,22:629-634。
Doetsch F:神经干细胞的胶质特性。中华神经科学杂志,2003,6:1127-1134。10.1038 / nn1144。
Zupanc GKH, Clint SC, Takimoto N, Hughes ATL, Wellbrock UM, Meissner D:成年硬骨鱼(Apteronotus leptorhynchus)小脑再生过程中小胶质细胞/巨噬细胞的时空分布。神经科学进展,2003,26(3):344 - 344。10.1159 / 000071958。
Pellegrini E, Mouriec K, Anglade I, Menuet A, Page YLE, Gueguen M, Marmignon NE:斑马鱼前脑室层芳香化酶阳性放射状胶质细胞作为祖细胞的鉴定。中华神经外科杂志,2007,27(3):344 - 344。
Chapouton P, Skupien P, Hesl B, Coolen M, Moore JC, Madelaine R, Kremmer E, Faus-Kessler T, Blader P, Lawson ND, Bally-Cuif L: Notch活性水平控制成人神经干细胞静止和招募之间的平衡。神经科学杂志,2010,30:7961-7974。10.1523 / jneurosci.6170 - 09.2010。
Itoh M, Kim C-H, Palardy G, Oda T, Jiang Y-J, Maust D, Yeo S-Y, Lorick K, Wright GJ, Ariza-McNaughton L, Weissman AM, Lewis J, Chandrasekharappa SC, Chitnis AB: Mind bomb是一种泛素连接酶,对于Delta有效激活Notch信号至关重要。生物工程学报,2003,4:67-82。10.1016 / s1534 - 5807(02) 00409 - 4。
王晓峰,王晓峰,王晓峰,王晓峰,等:大脑皮层早期发育的两种径向迁移模式。中华神经科学杂志,2001,4:143-150。10.1038/83967。
Marcus RC, Delaney CL, Easter SS:胚胎和成年斑马鱼(Danio rerio)视觉系统的神经发生。中华神经科学杂志,1999,16:417-424。10.1017 / S095252389916303X。
张志刚,张志刚,张志刚:非哺乳类脊椎动物脑细胞增殖、神经发生和再生研究。中国生物医学工程学报,2008,29(3):344 - 344。10.1098 / rstb.2006.2015。
伊藤Y,田中H,冈本H,大岛T:成年斑马鱼视顶盖神经干细胞及其子代的特征。生物工程学报,2010,38(4):344 - 344。10.1016 / j.ydbio.2010.03.008。
Bravo R, Macdonald-Bravo H:细胞周期中存在两种细胞周期蛋白/增殖细胞核抗原:与DNA复制位点相关。中国生物医学工程学报,2007,29(4):457 - 457。10.1083 / jcb.105.4.1549。
Ferri ALM, Cavallaro M, Braida D, Di Cristofano A, Canta A, Vezzani A, Ottolenghi S, Pandolfi PP, Sala M, DeBiasi S, Nicolis SK: Sox2缺乏导致成年小鼠大脑神经退行性变和神经发生受损。发展,2004,131:3805-3819。10.1242 / dev.01204。
Kaneko Y, Sakakibara S, Imai T, Suzuki A, Nakamura Y, Sawamoto K, Ogawa Y, Toyama Y, Miyata T, Okano H: Musashi1:包括神经干细胞在内的CNS祖细胞的进化保守标记。神经科学进展,2000,22:139-153。10.1159 / 000017435。
Oteíza P, Köppen M, Concha ML, Heisenberg C-P:斑马鱼侧性器官的起源和形成。科学进展,2008,34(4):457 - 457。10.1242 / dev.022228。
Higashijima S-I, Mandel G, Fetcho JR:胚胎和幼虫斑马鱼中前瞻性谷氨酸能、glycinergic和gaba能神经元的分布。中华神经外科杂志,2004,29(4):344 - 344。10.1002 / cne.20278。
Marusich MF, Furneaux HM, Henion PD, Weston JA: Hu神经元蛋白在增殖的神经源性细胞中表达。中华神经病学杂志,2004,25:344 - 344。10.1002 / neu.480250206。
Mueller T, Wullimann MF: BrdU-, neuroD (nrd)-和hu -研究揭示了胚胎后斑马鱼前脑不寻常的非心室神经发生。机械工程学报,2002,29(3):344 - 344。10.1016 / s0925 - 4773(02) 00194 - 6。
Arvidsson A, Collin T, Kirik D, Kokaia Z, Lindvall O:脑卒中后脑内源性前体神经元的替换。中华医学杂志,2002,8:963-970。10.1038 / nm747。
陈娟,陈建平,陈建平。成年小鼠皮质脊髓运动神经元延伸脊髓投射的神经发生。美国国家科学研究院。2004, 21(3): 457 - 457。10.1073 / pnas.0406795101。
Diep CQ, Ma D, Deo RC, Holm TM, Naylor RW, Arora N, Wingert RA, Bollig F, Djordjevic G, Lichman B, Zhu H, Ikenaga T, Ono F, Englert C, Cowan CA, Hukriede NA, Handin RI, Davidson AJ:斑马鱼肾再生成人肾元祖细胞的鉴定。自然科学进展,2011,37(4):344 - 344。10.1038 / nature09669。
辛格SP,霍尔德韦JE, Poss KD:从新生成骨细胞再生切断斑马鱼鳍射线。生物工程学报,2012,29(3):349 - 349。10.1016 / j.devcel.2012.03.006。
Lien C-L, Harrison MR, Tuan T-L, Starnes VA:心脏修复和再生:来自斑马鱼研究的最新见解。创伤修复与再生。2012,20:638-646。10.1111 / j.1524 - 475 x.2012.00814.x。
Kuscha V, Frazer SL, Dias TB, Hibi M, Becker T, Becker CG:成年斑马鱼脊髓背腹侧结构域损伤诱导的中间神经元细胞类型的生成。中华神经医学杂志,2012,29(4):344 - 344。10.1002 / cne.23115。
贝克尔CG,贝克尔T:成年斑马鱼作为成功中枢神经系统再生的模型。神经外科杂志,2008,26:71-80。
Becker T, Wullimann MF, Becker CG, Bernhardt RR, Schachner M:成年斑马鱼脊髓横断后轴突再生。中华神经医学杂志,1997,37(3):377 - 395。10.1002 / (SICI) 1096 - 9861 (19970127) 377:4 < 577:: AID-CNE8 > 3.0.CO; 2 - #。
卡梅隆·达:成年斑马鱼损伤视网膜的细胞增殖和神经发生。神经科学学报,2000,17:789-797。10.1017 / S0952523800175121。
Reimer MM, Sörensen I, Kuscha V, Frank RE, Liu C, Becker CG, Becker T:成年斑马鱼运动神经元再生。神经科学杂志,2008,28:8510-8516。10.1523 / jneurosci.1189 - 08.2008。
大脑和脊髓中的再生过程。刘国强。2004,19(3):1 - 4。
Zupanc GK, Ott R:成年硬骨鱼小脑损伤后的细胞增殖:新细胞产生的时间、过程、来源和类型。中华神经科学杂志,1999,30(3):344 - 344。10.1006 / exnr.1999.7182。
Clint SC, Zupanc GK:成年硬骨鱼小脑中的神经元再生,Apteronotus leptorhynchus:径向神经胶质对迁移的年轻细胞的引导。大脑资源开发,2001,30:15-23。10.1016 / s0165 - 3806(01) 00193 - 6。
Zupanc GKH:硬骨鱼大脑中的成年神经发生和神经元再生。中国生物医学工程学报,2008,32(3):357- 357。10.1016 / j.jphysparis.2008.10.007。
Ayari B, El Hachimi KH, Yanicostas C, Landoulsi A, Soussi-Yanicostas N: Prokineticin 2表达与损伤成年斑马鱼端脑神经修复相关。2010.2010, 27: 959-972。
März M, Schmidt R, Rastegar S, Strähle U:成年斑马鱼端脑刺伤后的再生反应。中国机械工程,2011,30(4):344 - 344。10.1002 / dvdy.22710。
鲍姆加,李志强,杨志强,Götz M,李志强J:斑马鱼端脑刺伤后反应性胶质细胞增生的比较分析。神经胶质,2012,60:343-357。10.1002 / glia.22269。
Kizil C, Dudczig S, Kyritsis N, Machate A, Blaesche J, Kroehne V, Brand M:趋化因子受体cxcr5调节成年斑马鱼大脑的再生神经发生反应。神经系统工程学报,2012,27(1):67 - 67。
sofronview MV:反应性星形胶质增生和胶质瘢痕形成的分子解剖。神经科学进展,2009,32:638-647。10.1016 / j.tins.2009.08.002。
Kizil C, Kyritsis N, Dudczig S, Kroehne V, Freudenreich D, Kaslin J, Brand M:神经祖细胞再生神经发生需要损伤诱导的Gata3表达。电子学报,2012,23:1230-1237。10.1016 / j.devcel.2012.10.014。
Strähle U, Schmidt R:组织再生的通用程序?。生物工程学报,2012,29(3):344 - 344。10.1016 / j.devcel.2012.11.009。
Zupanc GK, Kompass KS, Horschke I, Ott R, Schwarz H:成年硬骨鱼小脑损伤后的细胞凋亡。中华神经医学杂志,1998,22(3):344 - 344。10.1006 / exnr.1998.6853。
Vajda FJE:神经保护和神经变性疾病。临床神经科学杂志,2002,9:4-8。10.1054 / jocn.2001.1027。
刘AKF,陈娟,陈娟,尹晓敏,陈娟:缺血、外伤性脑损伤和癫痫中神经元的死亡与不死亡:应激激活信号通路和凋亡通路的研究进展。神经生物学进展,2003,29(3):344 - 344。10.1016 / s0301 - 0082(03) 00005 - 4。
张震,郭志刚,张志刚:大鼠脊髓损伤后进行性坏死的实验分析:炎症反应的病因学作用。中华神经科学杂志,1997,33(3):344 - 344。10.1006 / exnr.1996.6355。
Buffo A, Vosko MR, Ertürk D, Hamann GF, Jucker M, Rowitch D, Götz M:转录因子Olig2在脑损伤中的表达模式:神经元修复的意义。中国科学院学报,2005,29(3):349 - 349。10.1073 / pnas.0506535102。
Kyritsis N, Kizil C, Zocher S, Kroehne V, Kaslin J, Freudenreich D, Iltzsche A, Brand M:急性炎症启动成年斑马鱼大脑的再生反应。科学通报,2012,29(4):344 - 344。
吴丽曼,吴志强,李志强:斑马鱼大脑的神经解剖学:一种拓扑图集。1996,北京:北京大学,1- 4。
确认
我们要感谢Corinne Houart(伦敦国王学院),Thomas Dickmeis和Sepand Rastegar(都是KIT), Martin März (Max-Planck-Institut für molekulare Biomedizin, Münster),以及Scholpp小组对手稿的宝贵意见。RS和US由欧盟IP ZF Health和亥姆霍兹协会提供支持,SS由DFG Emmy Noether奖学金847/2提供支持。
作者信息
作者及隶属关系
相应的作者
额外的信息
相互竞争的利益
作者宣称他们之间没有利益冲突。
作者的贡献
SS总结了胚胎中的神经发生,而RS和US侧重于成人中的神经发生。所有作者都阅读并批准了最终的手稿。
权利和权限
开放获取本文由BioMed Central Ltd授权发布。这是一篇开放获取文章,根据创作共用归属许可协议(https://creativecommons.org/licenses/by/2.0),允许在任何媒介上不受限制地使用、传播和复制,前提是正确地引用原始作品。
关于本文
引用本文
施密特,R, Strähle, U. & Scholpp, S.斑马鱼的神经发生-从胚胎到成年。神经系统开发8, 3(2013)。https://doi.org/10.1186/1749-8104-8-3
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/1749-8104-8-3
关键字
- 干细胞生态位
- 神经板
- 成年斑马鱼
- 新生的神经元
- 神经诱导