摘要
背景
小脑具有由不同长度的裂缝分开的叶组成的引人注目的形态。由于哺乳动物的叶叶可能是一个广阔的平台,小脑的感觉-运动回路的前后组织是在这个平台上建立起来的,因此了解这种复杂形态是如何产生的很重要。
结果
利用遗传诱导命运图谱、高分辨率细胞分析和小鼠突变研究的结合,我们证明了叶理形成的关键事件是在每个裂缝的基础区域获得独特的细胞结构。我们称这些区域为“锚定中心”。我们发现,当小脑外表面光滑时,锚定中心的第一个表现是颗粒细胞前体的增殖和向内增厚的增加,这可能导致浦肯野细胞层的轻微内陷。此后,锚定中心内的颗粒细胞前体沿着形成裂缝的轴线明显拉长。当小脑外表面开始向内折叠时,伯格曼胶质纤维呈扇形向未成熟裂隙的基部辐射。一旦锚定中心形成,叶的生长似乎以一种自我维持的方式进行,由颗粒细胞沿着伯格曼胶质纤维迁移驱动。最后,通过分析一个小脑叶化突变体(十字的2),我们证明了改变锚定中心形成的时间会导致周围叶叶形状和大小的可预测变化。
结论
我们提出了一个新的细胞模型的初始形成的小脑裂缝与颗粒细胞提供驱动的物理力量。锚定中心出现的精确时间以及随后锚定中心内颗粒细胞和伯格曼胶质纤维的协调作用决定了叶叶的形状。
背景
小脑(Cb)是一种形态独特的大脑结构,由一组由裂隙分隔的叶状结构组成。最近的证据表明,除了在协调本体感觉-运动加工中发挥良好的作用外,脑后皮层还参与高阶功能,包括认知、情感和语言处理[1,2].对于叶叶在进化过程中被引入到Cb的一个简单解释是,叶叶是增加表面积的一种手段,从而适应细胞数量的增加,这反过来又促进了更复杂功能电路的获得[3.].然而,越来越多的证据表明folia在组织Cb电路中扮演了一个平台的角色。电路测绘和生理学研究已经证明了特定感觉运动任务对某些folia的特异性[4,5].例如,所有脊髓小脑苔藓纤维传入只投射到蚓部的I-V和VIII小叶/前IX小叶[4,5].此外,当传入事件进入Cb时,胚胎Cb沿前-后(AP)轴以空间受限模式表达许多基因,并且有实验证据表明,后来的裂缝模式反映了Cb内攀爬纤维响应的分子空间信息[6克ydF4y2Ba].有趣的是,最近一项关于鲨鱼的Cb叶状结构的研究发现,叶状结构的程度与不同物种表现出的行为的复杂性之间有更好的相关性,而不是与它们的系统发育有关。7].考虑到电路的组织与叶叶有关,了解叶叶的形状、大小和数量在Cb发育过程中是如何调节的是至关重要的。
所有的哺乳动物都有类似的十个叶叶的基本模式在内侧的Cb(蚓),这表明叶叶可能是由遗传决定的[8- - - - - -11].每个叶面有三个离散的细胞层,围绕着白质和深核:一个厚的内部颗粒层(IGL)包含颗粒细胞(gcs)和高尔基细胞,一个单层的浦肯野细胞(Pc)和伯格曼胶质细胞(Bg)细胞体,一个细胞稀疏分子层包含gc轴突(平行纤维),Pc树突,Bg纤维,篮状和星状细胞。我们最近发现,pc分泌的Sonic hedgehog基因(Shh)通过影响gc前体(gcp)的增殖来调节叶叶的数量[12,13].然而,决定叶叶形状和大小的基因尚不清楚。
关于机械力是如何诱发裂缝形成的,有几种建议[9,14- - - - - -16].一个有趣的说法是,一部分pc通过位于裂缝底部的pc轴突将皮层固定在潜在的白质上[9].另外,gcp的不同增殖速率,在裂缝的基部增殖速率最高,被认为是叶叶出生后生长阶段的基础[14].然而,在裂缝形成的胚胎阶段,不同的Pc形态或不同的gcp增殖的证据尚未报道。
作为鉴定将Cb分裂成不同的folia的关键细胞事件的第一步,我们已经鉴定了三种主要Cb细胞类型在裂缝初始形成过程中经历的一系列可重复的细胞变化。我们还通过分析小鼠Cb叶理突变体证明了这些细胞变化的时间决定了叶理形状。我们提出了一种Cb叶理模型,其中gcp行为的变化驱动由pc、gcs和Bg组成的每个裂缝底部的“锚定中心”的形成,然后在gcs和Bg的协调作用下,通过一个自我维持的过程继续叶理生长。
结果
当裂片向外生长时,每个裂片的底部是固定的
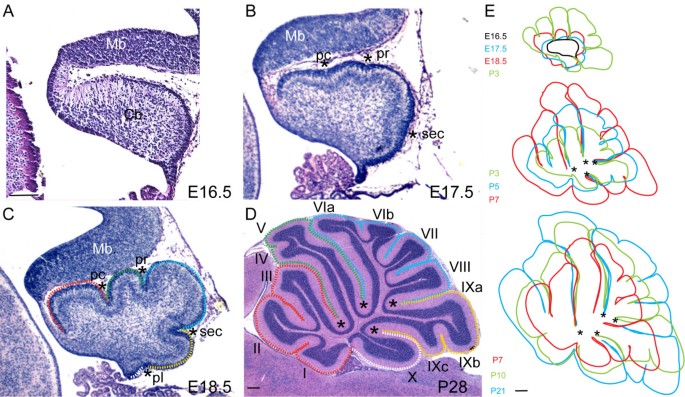
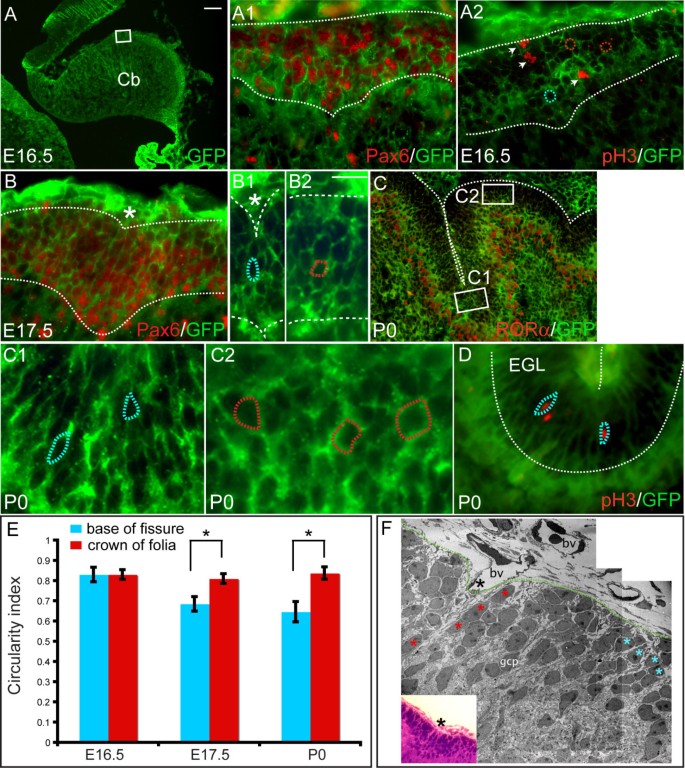
如果叶理的开始依赖于Pc锚点,那么每个裂缝的底部应该相对于Cb的核心固定,而叶理应该在锚点之间凸起。为了确定是否存在这种情况,我们在胚胎期(E)16.5和出生后(P)21之间的阶段叠加了小鼠蚓部正中矢状面切片的轮廓图(见材料和方法)。在近交的瑞士韦伯斯特(SW)小鼠胚胎中,在E16.5时发现小鼠小脑蚓原基的外表面是光滑的(图5)1).然而,到了E17.5,表面已经被三个轻微的凹痕所分割,代表了四个主要裂缝中的三个:顶前裂缝、初级裂缝和次级裂缝(图5)1 b星号)。在E18.5,第四主裂缝(后外侧)也很明显,其他裂缝更深(图5)1 c星号)。所有哺乳动物的5个主要裂片,以及主裂片之间的形状,在E18.5就很明显了。从前到后分别称为前基底叶、前鼻叶、中央叶、后叶和下叶(图2)1) [9].
小脑叶理是通过锚定裂缝的基部和叶叶的延长来完成的。(a, b)在E16.5处,Cb蚓原基是一个光滑的结构(a),在E17.5 (b)处,它被三个裂缝(星号)分成四个裂片。(c)在E18.5,四个主要裂缝(星号)和五个主要裂片(虚线)是明显的。基底叶分为前基底叶(红色轮廓)、前嗅觉叶(绿色轮廓)、中央叶(蓝色轮廓)、后叶(黄色轮廓)和下叶(白色轮廓)。(d)成虫有10个从主裂片发育而来的小叶,在(c, d)中用彩色轮廓标记(I-X,主裂片用星号标记)。(e)从E16.5到P21的中线蚓迹的叠加显示,叶的生长是延长的,而裂缝的基部基本上是固定的。Mb,中脑;Cb,小脑;电脑,preculminate;公关,主要;秒,二级;后外侧裂。比例尺:(a-c) 300 μm;(d) 500 μm;(e) 600 μm。
其他裂隙(非主裂隙)在SW小鼠中依次将主叶分成小叶,直到P7。前基底叶在SW小鼠P0处首先被一个非主裂分开,产生小叶I/II和III [8,17].在一些小鼠品系中,一个额外的浅裂缝随后将小叶I与小叶II分开,但这在SW小鼠中很少见到。在大多数小鼠品系中,在前嗅叶形成额外的部分裂缝,将IV小叶和V小叶部分分开,并且在大多数SW小鼠中P5观察到这一点(数据未显示)。当锥体前裂分隔第七小叶和第八小叶时,在P1可见中央小叶的第一次细分(数据未显示)。到P3,中央叶被后上裂进一步细分为第六小叶和第七小叶(数据未显示)。在大多数菌株中,小叶VI进一步被裂缝细分,形成VIa和VIb亚小叶,这在SW小鼠的P5处可见(数据未显示)。在某些小鼠品系中,后叶被细分为IXa、IXb和IXc小叶。在SW小鼠中,产生IXb和IXc的裂缝首先在P3出现,而IXa和IXb之间的裂缝从未出现(数据未显示)。小鼠的下叶没有进一步分裂,被称为小叶X(图2)1 d).
通过对叶理过程中连续时间的Cb表面图像进行叠加,我们发现每个裂缝的底部确实保持在一个相对固定的位置,并且叶理向外生长(图1)1 e).在P7之后,裂缝底部的位置有轻微的向外移动,可能是白质和皮层扩张的结果,特别是在中央和后叶。我们的结果与裂缝作为Cb片理锚的基础一致。
浦肯野细胞层的折叠可以预测裂缝的位置
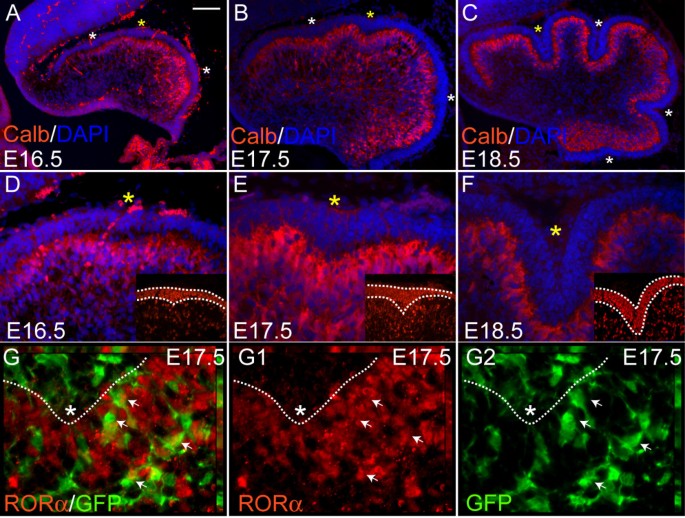
由于有人认为,脑皮层中最大的细胞、皮质唯一的输出细胞pc负责固定主要裂缝的基部,我们推断pc的组织和/或形态的变化可能先于裂缝的形成[9].为了可视化叶理形成过程中Pc的形态,我们在叶理形成前(E16.5)和叶理形成过程中(E17.5和E18.5)对Pc标记Calbindin进行矢状面Cb切片染色[18].抗calbindin免疫染色检测到E16.5沿AP轴呈弥漫性多层相似形状的pc(图5)2).引人注目的是,在E16.5, Pc多层膜略微向内折叠(图5)2 a, d在E17.5处三个主要裂缝形成的地点(图5)2 b, e).到E18.5,所有四个主裂缝都可见(图5)2 c f).有趣的是,Pc多层的内翻与抗pax6免疫染色检测到的外颗粒层(EGL)中gcps向内积聚的部位是互补的(插图见图)2 d-f).
浦肯野细胞层折叠表明了每个主裂缝底部的未来位置。(,维)在E16.5时,小鼠Cb表面光滑,但抗钙结合蛋白免疫染色(红色)显示,在可能形成裂缝的区域(星号)有多层pc和内陷。黄色星号表示(d, e, f)中所示的裂缝。B, c, e, f)在E17.5 (b, e)和E18.5 (c, f), Pc层和外表面同时内翻(叶状)。抗pax6免疫染色显示,在E16.5和E17.5的Pc层内翻上方,EGL中有gcps的积累(见(d, e)),而在E18.5, EGL在叶基部和叶顶的厚度相似(见(f))。(g-g2)R26-CreER;R26R-eYFP动物,Cre在前体中普遍表达。在E12.5注射他莫昔芬后Cre内质网转运到细胞核,在那里它重新组合了在R26-eYFP轨迹。E17.5 Cb的矢状面切片显示,一些命运定位细胞(绿色)与抗rorα(红色)共定位,因此是pc。有标记的细胞(白色箭头)有圆形细胞体,轴突向不同方向延伸。比例尺:(a-c) 100 μm;(d-f) 40 μm;(g-g2) 15 μm。
由于P18裂缝底部周围的pc已经被发现将它们的树突指向裂缝底部,我们很好奇在E16.5-E18.5裂缝出现的地方,单个pc的形态是否不同[19].我们利用基于CreER/loxP的遗传诱导命运定位(GIFM)方法来标记细胞并可视化细胞体及其过程[20.].我们使用了R26-CreER(Y Cheng和AL Joyner,准备中)与表达增强黄色荧光蛋白(eYFP;R26-eYFP),并通过在E12.5时给予他莫昔芬诱导所有小脑细胞类型的Cre活性(图2) [21].在E16.5和E17.5, EGL以及Cb较深层中检测到标记细胞(YFP阳性)(图5)2 g-g2,数据未显示)。双免疫染色细胞的抗绿色荧光蛋白(GFP)和Pc核标记物抗rorα鉴定的命运映射的Pc(图2 g-g2) [22].在Cb皮层的较深层,RORα阳性的标记细胞具有小而圆的胞体和向各个方向延伸的突起(图2)2 g-g2(白色箭头)。与之前的报道一致,未成熟的pc具有大量随机定向的突起,而且新生裂缝中的pc具有与随机定向过程相同的形态学(图2)2 g-g2) [9,23,24].综上所述,与EGL中gcp的积累相关的Pc多层的折叠,而不是单个Pc形态的变化,先于Cb外表面的裂缝形成。
浦肯野细胞成熟与裂隙延长同步
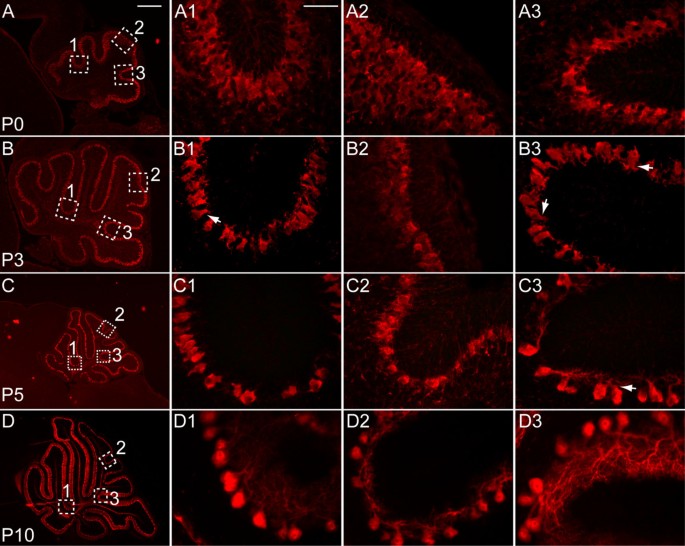
由于大部分Cb细胞的成熟发生在叶面化时期,这就提出了这两个过程是否相关的问题。在大鼠Cb中,发现位于前叶(I-V)和后叶(IX-X)的Pcs比中央叶的Pcs成熟得早[25].与小鼠的时间相似,小鼠蚓前叶和后小叶的pc在P7时也更为成熟[26].为了确定Pc的发育是否与裂缝生长同步进行,我们构建了主裂缝中Pc的发育曲线,并将其与后来形成的非主裂缝进行了比较,从P0到P21,使用抗calbindin免疫染色来可视化Pc(图1)3.,数据未显示)。我们根据细胞体大小的增加和树突的发育来判断Pc的成熟。最初,每个Pc的单个顶茎树突表现为顶端膨大,然后树突向外延伸,形成大量成熟的树突分枝[9].P0时,除中央叶pc外,蚓部pc胞体小,顶端膨大,无明显树突,组织为2 ~ 3个细胞厚层。相比之下,中央叶的pc缺乏顶端肿胀,组织成4至6个细胞厚的层(图2)3 a-a3).在主裂缝形成过程中,基部与其他部位的pc成熟度无明显差异。到P3时,主裂缝中的pc已排列成单层结构(图3)3 b1, b3,数据未显示),细胞体尺寸增大,形成单个顶茎树突(图2)3.,箭头3 b1, b3).奇怪的是,次生裂缝是四个主要裂缝之一(位于小叶VIII和小叶IX之间)的基部和侧面的pc比其他地方的pc更成熟,因为它们具有最大的细胞体,并且已经开始形成初级树突分支(图1)3 b3箭头)。
岩石的成熟是伴随着裂缝的形成。(一)在P0,抗calbindin免疫染色(红色)显示pc在整个Cb中呈多层组织。在主裂隙(a1、a3)和非主裂隙(a2)中,pc同样发育不全,体小,无明显树突。(b)在P3中,主裂缝(b1, b3)中的pc呈单层排列,具有不同的细胞体和顶端树突(b1,箭头),而在非主裂缝(b2)中,pc仍呈多层排列。次生裂缝中含有Cb中最成熟的pc,在顶茎树突上开始形成树枝状分支(b3,箭头)。(c)P5时Calbindin染色更强烈、更均匀。在所有主裂缝中,Pc体的大小都增加了,树突分支开始形成(c1,箭头)。在次生裂隙(c3)中,pc比其他主裂隙成熟,表现出更多更长的树枝状分支(c3,箭头)。非主裂缝中的pc被组织成一个单层(c2)。(d)在P10时,在所有裂隙中,pc中二级和三级树突状分支的数量继续增加,分支本身的长度也继续增加:(d1)顶前裂隙;(d2)锥体前裂;(d3)次生裂隙。比例尺:(a、b) 300 μm;(c, d) 600 μm;(a1-a3, b1-b3, c1-c3, d1-d3) 100 μm。
与P3主裂隙中的pc不同,P2开始形成的后上非主裂隙中的pc呈多层分布,胞体较小,无顶端树突(图2)3 b2).在P5时,抗calbindin免疫染色在所有裂隙中更均匀,更强,可能反映了Pc分化的进展(图5)3 c-c3).在这一阶段的所有主裂缝中(图2)3 c1, c3), Pc体体积增大,初生树突明显。与P3相似,最成熟的树突分布在次生裂隙中,因为它们具有复杂的次生和三级树突分支(图2)3 c3箭头)。在P5不太成熟的后上裂隙中,Pc单层已经形成(图2)3 c2).P10时,后上裂内的树突状分支延长,二级和三级树突状分支数量增加(图2)3 d2).所有裂隙中的pc在P10之后继续详细说明其二级和三级树突分支的数量(图2)3 d-d3,数据未显示)。综上所述,裂缝内Pc的发育与裂缝的成熟是同步进行的,尽管次级裂缝内Pc的发育从P0到P10左右比其他主裂缝更早,这表明Pc的成熟与裂缝的形成之间没有因果关系。
新出现裂缝中的颗粒细胞前体比其他颗粒细胞前体有丝分裂指数短,并以内向内陷的形式积累
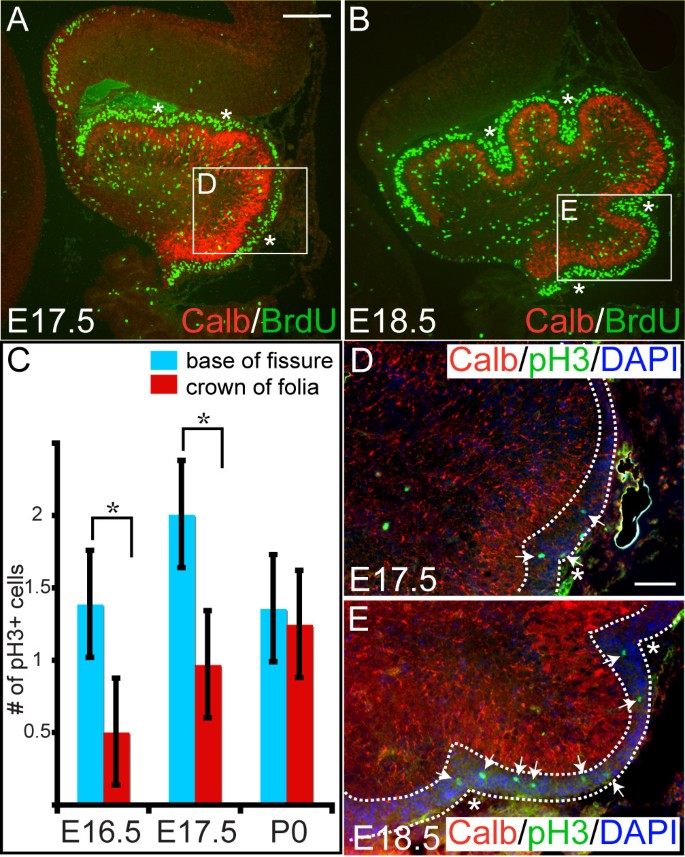
不像Pcs和Bg在脑室层出生,然后径向迁移形成Pc层,当gcps在小鼠E12.5和E15.5之间离开脑室层(斜唇)时,它们在Cb表面迁移形成EGL并继续增殖直到大约P16 [27].一旦gcs进入有丝分裂后,它们就会穿过分子层,越过Pc层,形成IGL。我们早在E16.5就发现了EGL中gcps的一个明显特征,即在Cb外表面第一次折叠的前一天,EGL呈v形增厚,特别是在前三个主要裂缝将出现的位置(图5)2 a, d).这些地点的全球杀伤人员数目增加的一个可能机制是扩散速度加快。因此,我们使用细胞周期不同阶段的标记物检测了Cb叶化开始时gcp的增殖情况。为了在E17.5和E18.5标记gcps处于DNA复制期(S期),在分析胚胎Cb前约20分钟给予溴脱氧尿苷(BrdU)(图5)4 a、b).这导致大约26%的细胞在EGL中被标记,并且在E17.5或E18.5时,在叶底或叶顶含有BrdU的细胞数量没有明显差异(图5)4 a、b).
新生裂隙中的gcp有丝分裂指数比其他gcp短。(a, b)E17.5 (a)和E18.5 (b)胚胎的内侧矢状面经BrdU处理约20分钟。抗BrdU(绿色)免疫染色显示整个EGL中均匀的BrdU掺入(星号表示将形成裂缝的位置)。(c)定量EGL较厚区域(蓝条)与中间较薄区域(红条)中pH3阳性gcps的数量。柱高表示每个数据集的平均值,误差柱表示标准误差。星号表示两个地区在统计上有显著差异(pE16.5 < 0.001;pE17.5 < 0.0001)。(d)在E16.5(数据未显示)和E17.5的抗ph3免疫染色表明,有丝分裂中未来将形成裂缝的区域(虚线之间的区域)比其他区域有更多的gcps。(e)到E18.5, ph3阳性细胞均匀分布在整个EGL中(虚线之间)。用Anti-Calbindin标记Pc层。箭头表示EGL中pH3阳性细胞。比例尺:(a、b) 100 μm;(d, e) 50 μm。
为了标记比S期更短的细胞周期,使用抗磷酸组蛋白3免疫染色标记G2/有丝分裂期的细胞核。与整个EGL AP轴上看似均匀的BrdU标记相反,pH3阳性gcps的定量(图2)4摄氏度)显示pH3阳性gcps更常出现在前三个主要裂缝出现的位置,而在E16.5和E17.5(图5)4 c, d箭头;数据未显示)。然而,在E18.5时,这些裂缝的情况并非如此,pH3阳性gcps在整个EGL的分布中没有显示出显着差异(图2)4 c, e箭头;数据未显示)。这一结果表明,在裂缝形成初期,由于细胞周期较短,出现裂缝区域的gcps比其他gcps更频繁地短暂分裂。此外,可能是由于脊髓皮层的阻力小于其上的基底层,gcps向内内陷,从而产生裂缝基部的第一个形态学表现。到E18.5,基部EGL的宽度仅略厚于主裂缝的顶部,这与我们观察到的裂缝基部细胞不再具有明显更高的有丝分裂指数一致(图5)2f和4b).此外,在后期非主裂缝建立过程中,发现gcps在后来形成裂缝的地方积聚,表明这一过程对所有小脑裂缝都是保守的(数据未显示)。
颗粒细胞的前体细胞形态和组织在新生裂缝的基部是明显的
在许多模型系统中,细胞形状的变化被认为是形成沟槽或内陷的驱动力[28].由于在E16.5到E18.5之间,裂缝底部pc的形状和方向没有明显的差异(图5)2),我们询问gcp形态的变化是否伴随着裂缝的初始形成(图2)5).我们通过检测转基因小鼠中GFP的表达来表征gcp细胞体的形状,这些转基因小鼠普遍表达细胞膜定位的GFP (CAG: GPI-eGFP) [29].为了量化细胞形态的差异,我们测定了圆度指数(ci;数字5 e)的GFP+ gcps在E16.5前三个新出现的裂缝(内陷内)中的含量(图5)5, a1), E17.5(图5 b-b2)和P0(图5 c, d)与牙冠裂隙间的GCPS比较[30.].通过抗gfp和抗pax6 (gcp标记)或抗rorα (Pc标记)的双重免疫染色,鉴定出叶冠处最外层的5层细胞层和裂孔基部的7层细胞层为EGL(图2)5a1 b c).在E16.5,当Cb外表面光滑时,整个中线蚓部AP轴的增生gcps呈圆形(图5)5 a2, e;叶冠处Ci = 0.830,裂隙未来基部Ci = 0.8) [31].在E17.5,当外表面开始内陷时,这些新出现裂缝中的gcps明显不那么圆(图2)5 b1, e;ci = 0.685)比裂缝中点处的gcps大(图2)5 b2, e;Ci = 0.810;p< 0.0001)。此外,在E17.5,裂缝底部gcs的延伸轴均匀平行于裂缝。相比之下,叶冠处的gcps纵轴没有优先取向(图2)5 b2,数据未显示)。在P0处,三个主裂缝基底的gcp形状差异(图2)5 c、e;ci = 0.646)和冠(图5 d, e;Ci = 0.837)更为明显(p< 0.0001)。此外,我们发现在E17.5和P0时,由于抗ph3标记阳性,延长的gcps具有有丝分裂性(图3)5 d,数据未显示)。
锚定中心的形成涉及到gcp形状的变化。的矢状面CAG: GPI-eGFP转基因小鼠标记细胞膜。(a-a2)在E16.5,抗gfp免疫染色显示圆形gcps遍布EGL的AP轴。(a1)抗pax6(红色)和抗gfp(绿色)免疫染色证实最外层的细胞是gcps。(a2)抗ph3和抗gfp免疫染色显示圆形gcps正在增殖(箭头)。a中的白色方框表示a1, a2中的区域。(b-b2)在E17.5,抗gfp和抗pax6免疫染色显示新出现的锚定中心的gcps延长(蓝色虚线),而邻近区域的gcps更圆(红色虚线)(b2)。星号表示裂缝。(c-c2)gcp形态差异在P0处裂隙中更为明显。细长的gcps(蓝色虚线)位于裂缝底部,看起来有组织;它们的纵轴与裂缝的平面对齐。在叶顶,gcp是圆形的,组织较少(红色虚线)。(d)抗- ph3免疫染色显示裂缝底部的gcps在P0处增生。(e)gcps的圆度指数(裂隙底部为蓝色,叶冠为红色)。柱高表示每个数据集的平均值,误差柱表示标准误差。星号表示在每组数据中,裂隙底部与叶面顶部的ci在统计上有显著差异(p< 0.0001)。(f)E17.5出现的主锚定中心的电子显微照片证实,位于裂缝(红色星号)的gcp被拉长并组织在平行于裂缝(黑色星号)的平面上。位于裂缝之间的Gcps更圆(蓝色星号)。插图是同一区域的亮场图像。白色虚线表示EGL。b,血管;Gcp,颗粒细胞前体。比例尺:(a) 100 μm;(c) 50 μm;(a1, a2, b, d) 15 μm;(b1, b2, c1, c2) 10 μm。
为了进一步表征新兴裂缝中的gcps,并证实我们在CAG: GPI-eGFP我们用电子显微镜分析了E17.5的矢状面切片(图5)5 f).位于裂隙底部的gcps明显拉长(ci = 0.65),纵轴与裂隙平行(图2)5 f).相比之下,距离裂缝基部5至7个细胞的gcps更圆(ci = 0.78),它们的轴线没有一致的排列(图2)5 f).有趣的是,在这两个位置之间发现的gcps在细胞形状方面具有中间表型(ci = 0.76),但它们缺乏纵轴的有组织取向。因此,gcp细胞体伸长和由于增殖增加而向内积聚的gcp是裂缝出现的明显标志,这些细胞变化可能驱动Pc层向内折叠。因此,我们将经历这些独特形态发生变化的整个区域定义为每个裂缝的“锚定中心”。
颗粒细胞分化的开始与小脑叶化同时发生
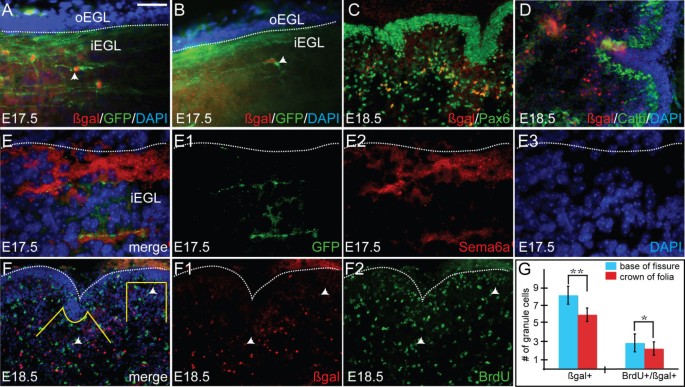
接下来,我们探讨了gcps从EGL到IGL的迁移和分化是否与叶叶其他部分的裂隙不同。Gcps只在外层EGL (oEGL)增殖,然后在开始分化时转移到内层EGL (iEGL)。IGL内的有丝分裂后gcs沿内侧/外侧轴延伸平行纤维,并沿着一条平行纤维进行核易位,然后沿着径向过程延伸并沿着Bg纤维下降,经过Pcs形成IGL [9,32,33].gc平行纤维构成了分子层的一部分。Anti-p27/Kip1和anti-NeuN用于标记iEGL中的分化gcs及其向IGL迁移的过程(附加文件)1).使用这些标记最早可以检测到弥漫性IGL层是在P1(附加文件)1, a1).正如已经报道的那样,我们发现在P3和P21之间分析的所有阶段,IGL在裂隙底部比侧面薄,在叶冠处最厚,但在P1处没有(附加文件)1 b-b2 c-c2,而资料未列明)[9].
由于在P1之前(即主裂缝出现期间)gc分化的缺乏可能是由于缺乏p27/NeuN的表达而不是gc分化的缺乏,因此我们使用GIFM标记有丝分裂后的gc,而不依赖于gc标记基因的表达时间。鉴于所有gcps都表达转录因子Math1,我们使用aMath1-CreER转基因系结合有丝分裂后神经元报告等位基因(Tau-lox-STOP-myrGFP-nlacZ),并在E15.5时给予他莫昔芬诱导胚胎gcp的Cre活性(图5)6克ydF4y2Ba) [34,35].的τ当神经元开始分化时,报告等位基因启动膜定位GFP和核lacZ (nlacZ)的永久表达。在E17.5的冠状切片显示,在EGL中都有标记的gcs (GFP/nlacZ双阳性),基于它们位于EGL外三到五层细胞层以下的位置,并标记有信号蛋白6a (Sema6a),信号蛋白6a是gcs发生核切向迁移的标记(图5)6a b e-e3),以及更深的位置(图1)6a b e-e3) [36,37].E18.5矢状面抗pax6和抗gfp的双重免疫组化证实,所有标记的细胞都是gcs(图5)6摄氏度).nlacZ和myrGFP联合免疫染色显示,iEGL内的gcs具有圆形细胞体和平行纤维(图2)6箭头)。在Cb的较深层,iEGL下方,一些gcs具有平行于Cb表面的细长细胞体和下降的径向纤维(图2)6 b箭头)。此外,我们发现不同AP位置的gc体及其平行纤维的形态和取向没有明显差异,这表明在叶面裂隙基部和叶冠处的gc分化过程相似。到E18.5,标记为E16.5的gcps后代可以在Pcs(抗calbindin阳性细胞;数字6 d),与我们使用anti-p27/Kip1或NeuN在P1处检测到的稀疏EGL一致(附加文件1,数据未显示)。
颗粒细胞的分化与小脑叶化同时发生。Math1-CreER;Tau-STOP-myrGFP-IRES-nLacZ在E15.5时给予动物他莫昔芬。永久myrGFP和核LacZ一旦细胞进入有丝分裂后,表达就开始了。Gcps (DAPI阳性)在oEGL中增殖。(a, b)E17.5 Cb的日冕切片显示,命运映射的gcs(红色)位于EGL的内层(iEGL)。(a)标记的gcs(箭头)胞体圆形,轴突伸长(平行纤维);绿色)。(b)在iEGL以下的层中,可以看到一些颗粒细胞的90°细长的细胞体旋转(箭头),以及正在发育的下降的径向纤维。(c)抗pax6(绿色)和抗βgal(红色)双免疫染色证实命运定位细胞为颗粒细胞。(d)抗calbindin(绿色)和抗βgal(红色)双重免疫染色显示在Pc层下方发现了命运定位细胞。(e-e3)在E17.5,命运定位细胞对Sema6a呈阳性,Sema6a是一种经小叶迁移颗粒细胞的标记物。虚线表示oEGL和iEGL之间的边界。(f-f2)抗brdu和抗β - gal的双重免疫染色显示,gcs在裂隙基部的分化率略高于叶冠。(f)中的黄线描绘了BrdU/βgal阳性细胞计数的区域。箭头表示BrdU/βgal阳性gcs。(g)条形图描述了裂缝底部(蓝条)和叶冠(红条)BrdU/βgal阳性gcs的定量。柱高表示每个数据集的平均值,误差柱表示标准误差。星号表示在每组数据中,裂隙底部与叶面顶部的统计差异显著(pβgal < 0.006;pBrdU/βgal < 0.05)。比例尺:(a、b) 50 μm;(c, d, f) 100 μm;(e) 25 μm。
为了确定gcps分化是否同时发生在裂隙基部和叶冠处,我们使用GIFM在E15.5用他莫昔芬标记gcps,然后在E16.5进行BrdU脉冲,并在E18.5进行中矢状面Cb切片分析(图5)6 f-f2).在前三个裂口基部与相邻叶冠处进行抗β半乳糖苷酶(anti-βgal)标记的细胞定量分析显示,gcs在E16.5时在两个位置都有分化(图5)6克).有趣的是,我们在裂缝底部发现了更多分化的gcs(在iEGL的10微米区域内平均= 8.18个细胞;数字6克)比叶冠处多(叶冠上10微米区域内平均有6个细胞;p< 0.006;数字6克).抗β - gal和抗brdu双阳性gcs的定量显示,在裂缝底部E16.5处出生的分化gcs数量有增加的趋势(在iEGL 10微米区域内平均= 2.85个细胞);数字6克)与叶冠(平均= 2.22个细胞在10微米区域的iEGL;p< 0.05;数字6克).此外,我们发现双阳性(BrdU/βgal) gcs仅在蚓体的大部分内侧部分(中线80-100 μm范围内)出现,其中三个主裂缝最长,为E18.5。综上所述,gcs早在E17.5就在最内侧的Cb开始分化程序,与第一次观察到叶理的位置一致,并且优先在新出现的裂缝的底部。
伯格曼神经胶质纤维从裂缝底部的单一中心点呈扇形散开
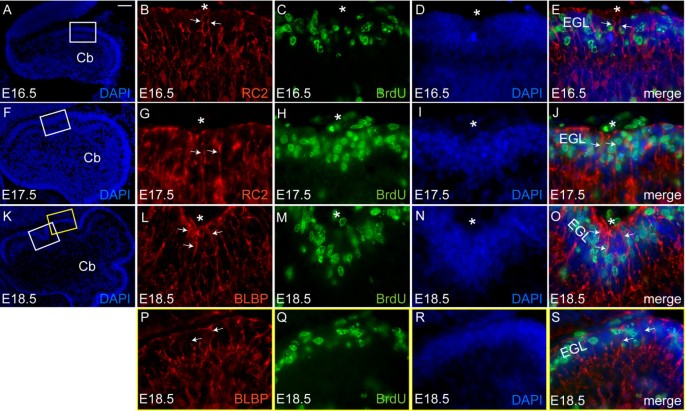
每个Bg细胞将一根纤维投射到脑脊液表面,形成一种称为胶质终足的特殊结构,与基底膜一起维持脑脊液的完整性。9,38,39].此外,Bg为Pc枝晶生长和gc迁移提供了一个支架[9,40- - - - - -43].因此,Bg纤维可能有助于裂缝的出现或成熟。为了研究Bg是否在锚定中心中发挥了这样的作用,我们使用了抗rc2、抗脑脂结合蛋白(抗blbp)和抗胶质纤维酸性蛋白(抗gfap)免疫染色来观察Bg纤维从E16.5到P14的方向(图5)7,而资料未列明)[44- - - - - -47].
Bg纤维在锚定中心会聚。(安妮)E16.5 Cb正中矢状面抗rc2(红色)和抗brdu(绿色)免疫染色。(b)位于锚定中心(星号)周围的Bg纤维(箭头)垂直于Cb的外表面。(f j)E17.5 Cb正中矢状面抗rc2(红色)和抗brdu(绿色)免疫染色显示,在裂缝形成开始时,Bg纤维(箭头)保持彼此平行。(钴)E18.5 Cb正中矢状面裂隙基部(l-o)和叶冠(p-s)的抗blbp(红色)和抗brdu(绿色)免疫染色显示Bg纤维的独特取向(箭头)。(l)锚定中心的Bg纤维(箭头)从一个点(星号)呈扇形散开。(p)相反,叶冠处的Bg纤维(箭头)保持垂直于Cb的顶面排列。Cb,小脑;EGL,外颗粒层。比例尺:(a、f、k) 100 μm;(b-e, g-j, p-s) 15 μm。
为了确定Bg纤维的方向与锚定中心的最初表现(gcps的积累和Pc层的内陷)有关,我们对Bg和gcps或Pc进行了双重标记。为了标记gcps,我们利用20分钟的BrdU脉冲来识别EGL(对照实验中抗pax6阳性)的增殖层;参见附加文件2).在E16.5和E17.5,抗rc2免疫染色显示Bg纤维相互平行,垂直于Cb外表面,即使在gcps积聚和Pc层内陷的新裂缝中也是如此(图5)7 j).有趣的是,在E18.5时(图5)7钴),抗blbp免疫染色显示,新出现的主裂缝周围的Bg将其纤维投射到裂缝底部的一个点(图2)7 l星号)。相比之下,其余的Bg纤维几乎彼此平行,并垂直于Cb的基底表面排列(图2)7 p).在后期阶段,这种Bg纤维在裂缝底部和侧面的特殊组织更加明显(数据未显示)。我们的分析表明,在新出现的裂缝底部周围的Bg纤维的胶质末梢形成了一个中心,纤维从那里呈扇形散开。这表明Bg纤维并不参与裂缝的初始形成,而是在锚定中心的功能中发挥重要作用,引导裂缝底部的gcs以半圆的方式迁移。此外,这种向外扩散的gcs可以解释裂缝底部较薄的IGL。
当两个锚定中心形成的时间发生了变化,这是蚯蚓叶状结构变化的基础Engrailed2突变体
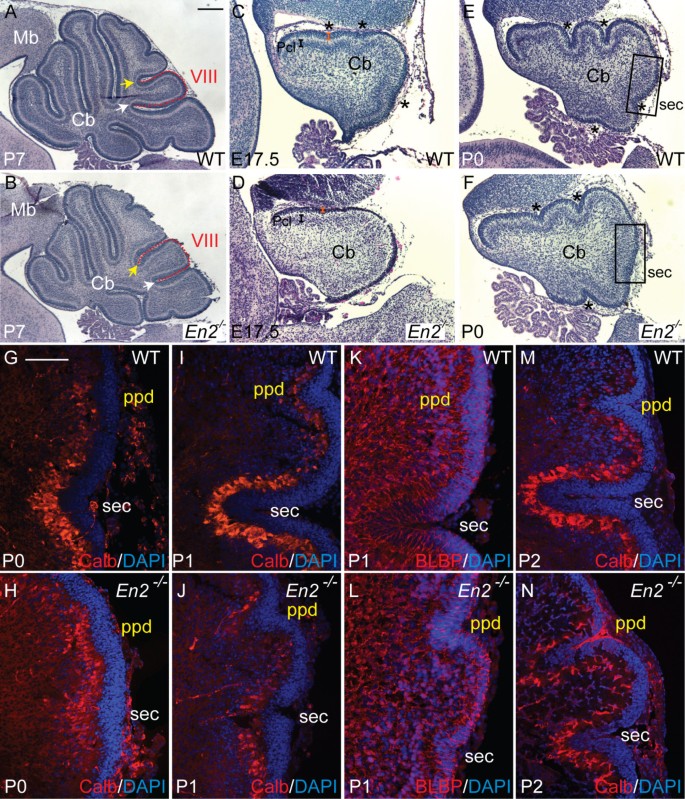
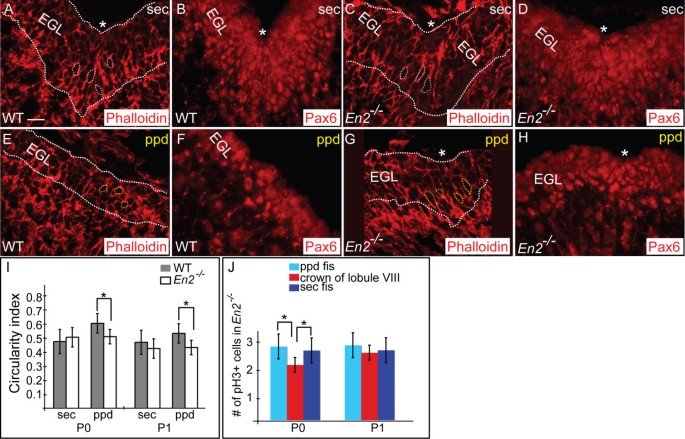
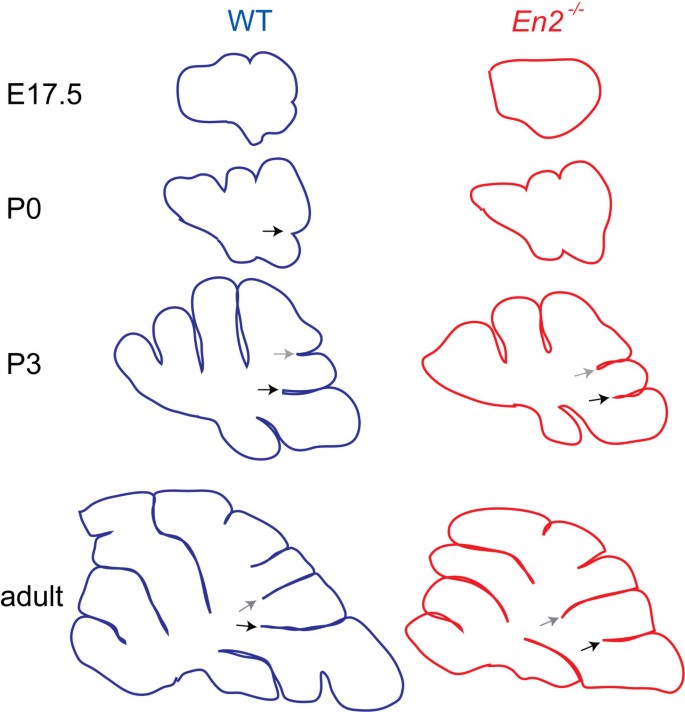
我们的研究结果表明,pc、gcps和Bg纤维的不同行为的精确协调产生了锚定中心,作为每个裂缝的基础。通过外推,每个锚定中心形成的位置和时间应该决定叶叶的形状和组织。为了验证这一假设,我们检查了一个具有改变的叶面模式的小鼠突变体,以确定导致裂缝产生的关键细胞事件的时间和/或位置的变化是否与叶面缺陷相一致。我们选择分析缺乏编码同源盒转录因子Engrailed2 (En2)基因的小鼠,因为在线虫中En2继发主裂(通常将中央肺叶与后肺叶分开)后移,使得中央肺叶的第VIII小叶与后肺叶的第IX小叶相连,而不是与中央肺叶的第VI/VII小叶相连[48].此外,继发性和前锥体裂缝的相对长度颠倒(图2)8 a、b) [48- - - - - -52].特异性和可复制的变化,仅在一个叶片En2-/-突变体提供了机会来研究围绕小叶VIII周围的两个锚定中心的形成,以及其他产生正常叶叶的中心。因此,我们研究了蚯蚓叶化表型是否在En2突变与围绕小叶VIII的次级和前锥体锚定中心的时间和/或位置的改变有关。
在En2突变体,两个锚定中心形成的时间被改变了。(一)P7野生型(WT) Cb正中矢状面显示正常的叶状结构。(b)的CbEn2P7突变体显示蚓叶发育缺陷。小叶VIII(红色轮廓)与小叶IX而不是与小叶VI/VII相关,次级裂缝(白色箭头)比WT浅,锥体前裂缝(黄色箭头)比WT长。(c, d)E17.5 WT正中矢状面切片En2突变体Cb显示,只有在WT中,Pcl内陷在将形成四个主要裂缝中的三个的区域(黑色星号)。橙色括号表示野生型Cb中较厚的EGL。黑色括号分隔了Pcl。(e)在P0处的WT - Cb矢状面显示了四个主裂缝(黑色星号)。(f)在an的P0矢状切面上En2突变体Cb,只有三个浅主裂缝(黑色星号)明显;继发裂隙未见。(g-l)WT (g, i, m)的抗calbindin免疫染色(红色)和DAPI染色(蓝色)En2(h, j, n)突变体Cb在P0 (g, h), P1 (i, j)和P2 (m, n)处表现出继发性(sec)裂缝形成延迟和前锥体(ppd)裂缝过早形成。P1内侧矢状面WT (k)和En2抗blbp免疫染色的突变体(l)胚胎显示Bg纤维在继发性和锥体前裂中指向一个锚定中心。比例尺:(a, b,) 25 μm;(c-f) 100 μm;(g-n) 50 μm。
在17.5欧元,总尺寸En2突变体Cb减少,Cb表面光滑,不再有3个主裂隙,EGL比正常薄(图2)8 c, d),这与我们之前记录的一般出生后叶化延迟和突变成人Cb大小的整体减小一致[50].此外,我们发现在E17.5时,的Pc层En2突变体缺乏内陷(数据未显示),没有gcps积累的迹象。观察到弱钙结合蛋白免疫染色En2突变可能进一步反映了Pc成熟的普遍发育延迟(数据未显示)。有趣的是,到P0时,除次级裂缝外,所有主裂缝都清晰可见En2突变体(图8 e, f).然而,Pc层已经开始折叠,gcp向内积聚,在那里预计会形成次级裂缝。此外,尽管裂缝的整体形成延迟En2突变体时,Pc层已经开始内翻,gcps在原锥体裂形成区域的P0处积聚,比野生型小鼠早几个小时(图2)8 g h).在P1处锥体前裂En2突变体比新形成的继发裂缝深,而野生型小鼠的继发裂缝比锥体前裂缝深得多(图2)8 i, j).此外,在次级裂缝中发现了pcEn2P1突变体比正常突变体体积更小,成熟度更低,而在锥体前裂中发现的Pcs比在野生型锥体前裂中发现的Pcs更成熟(图2)8 i, j).到P2时,锥体前裂继续延长En2突变体比野生型小鼠多,继发裂缝比正常小鼠短(图2)8 m, n).此外,Bg纤维组织时间的改变与裂缝形成的改变有关En2突变体(图8 k, l,数据未显示)。直到P1En2当前锥体和继发性裂缝形成时,Bg纤维从两个锚定中心呈扇形散开(图2)8 k, l).与前锥体和次级锚定中心形成时间的明显改变相一致En2突变体,在P0和P1的gcps出现的继发性裂缝En2突变体在裂隙之间比gcps更长,但略低于正常(野生型:ci = 0.55 at P0 ci = 0.52 at P1)9,我,数据未显示);En2突变体:在P0处ci = 0.59,在P1处ci = 0.599 c,我,数据未显示),突变体前锥体裂锚定中心的gcps更拉长(ci = 0.59, ci = 0.5;数字9克,我在P0处ci = 0.71,在P1处ci = 0.62,p< 0.0009;数字9 e,我,数据未显示)。此外,在P0En2pH3阳性gcps的突变体定量(图9 j)显示pH3阳性gcps更常见于新出现的继发性和锥体前裂缝,其次见于这两个裂缝之间的小叶冠。我们的结果表明,在前锥体和次级锚定中心En2与同一野生型裂缝相比,Pcs、gcps和Bg纤维的形态发生行为的正常过程与原锥体裂缝的过早形成和次生裂缝的延迟形成一致。锚定中心形成时间的改变随后导致VIII小叶的明显后移。
突变体中两个改变锚定中心的Gcps表现出与WT相同的协调变化。(a, c, e, g)Phalloidin染色(红色)显示p2wt矢状切片的gcp形态(a, e)和En2突变小鼠(c, g)。在P0时,在WT继发性裂缝(a)中,gcps比锥体前裂缝(e)区域的gcps更长(ci = 0.55) (ci = 0.71)。相反,在En2突变体,继发性(c)和前锥体(g)裂缝的GCPS同样拉长。(b, d, f, h)白色虚线勾勒出EGL,根据邻近切片的抗pax6免疫染色描述EGL的厚度。星号表示裂缝的底部。(我)gcps的Ci(灰色为WT,白色为突变体)。柱高表示每个数据集的平均值,误差柱表示标准误差。星号表示在每组数据中,裂隙底部和叶冠之间有统计学上的显著差异(pP0 < 0.0009;pP1 < 0.0002)。(j)抗- ph3免疫染色显示,在有丝分裂中,前锥体和继发性裂区比叶冠区有丝分裂中有更多的gcps。柱状图描述了与中间叶冠(红色条)相比,锥体前裂(浅蓝色条)和次级裂(深蓝色条)中pH3阳性gcps的数量。柱高表示每个数据集的平均值,误差柱表示标准误差。星号表示两个地区在统计上有显著差异(p锥体前裂的P0 < 0.004;p继发裂隙< 0.05 (P0)。标尺:15 μm。
讨论
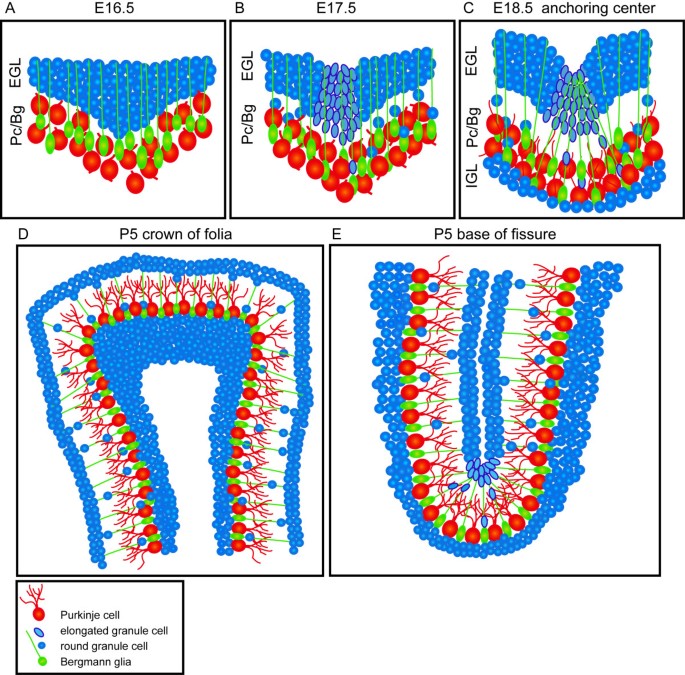
总的来说,我们的分析为小脑叶裂缝的形成和生长提供了一个新的模型10).蚓部出现裂缝的第一个迹象是由于增殖增加而向内积聚gcps。最可能的结果是,Pc层在gcp积累的节点处向内折叠。随后,积聚中的gcps将其细胞形状从圆形变为更细长,并沿着裂缝的轴线排列。当小脑外表面开始向内折叠时,Bg纤维聚集在裂缝的底部。最后,gcps在新出现的裂缝中优先分化。根据gcps、Pcs和Bg纤维标记物的染色,这三种细胞类型也发生了相同的协调形态变化,这些变化发生在裂缝出现的地方,并成为半球裂缝的基础3.).因此,我们建议称这些区域为叶理过程的“锚定中心”。此外,一旦锚定中心建立,我们认为叶叶的向外延长是由一种自我维持的方法驱动的,这种方法涉及gcp增殖和Bg纤维有丝分裂后gcs的定向迁移。最后,叶的大小和形状在很大程度上取决于每个锚定中心形成的时间和位置。
锚定中心的建立与颗粒细胞前体细胞增殖增加和细胞形状改变有关
对大鼠和小鼠的研究表明,为了进行叶面化,需要gcp增殖。例如,在实验中使用辐照减少出生后大鼠Cb中的gcp,或通过基因工程减少小鼠Shh信号通路成分突变导致的gcp增殖,导致EGL过早消耗和不成熟(不太复杂)的叶状模式[13,53].相反,由于甲状腺功能减退导致的大鼠EGL中gcps的长时间增殖或由于Shh信号过多导致的转基因小鼠中gcps的长时间增殖导致额外叶叶的形成[13,54].然而,从这些研究中尚不清楚gcp增殖是否驱动Cb叶状形成的开始。
我们的研究表明,在Shh被Pcs表达之前,gcps有丝分裂指数的增加和相关的EGL向内增厚是E16.5裂缝形成的第一个迹象。此外,先前的研究表明,一旦Shh在E17.5表达,虽然它是gcps的关键丝裂原,但没有证据表明Shh信号在锚定中心更高[12,13,55,56].出现裂缝的gcps的第二个独特特征是其细胞体在E17.5平行于裂缝的伸长。值得注意的是,神经祖细胞在分裂时被拉长是不寻常的。由于细胞不表达Tau (Tau- myrgfp),并且延伸轴与迁移的gcs的轴呈90°,因此延长的细胞不太可能已经开始迁移。相反,这种gcp细胞形状的变化可以驱动裂缝的形成,因为在其他系统中已经证明细胞形状的变化先于凹槽的形成。例如,细胞形状的伸长驱动细胞中形态发生沟的形成果蝇眼视盘和鸟类神经板底部的神经上皮细胞变成楔形,使神经管弯曲[57,58].此外,细胞分裂平面和细胞形状变化之间的密切联系已被证明是斑马鱼神经管形成所必需的[59,60].这就提出了一个问题,除了细胞形状的改变外,定向细胞分裂是否在锚定中心的裂缝形成中起作用。
裂缝基部gcps的形态变化限制表明,内在的遗传模式程序在裂缝基部(锚定中心)的gcps与其他gcps之间产生了差异。先前的一项对小鸡的研究表明,在叶冠上发现的gcps与在裂隙底部发现的gcps在遗传上不同,因为后者特异性表达含有同源盒的转录因子Tlx-3 [61].然而,小鼠的同源性Tlx-3(Rnx)在空间上并不局限于裂缝的基部,而是局限于P0的中央和后叶的gcps [62[AS和ALJ,未发表的观察结果]。因此,是否有普遍的分子因素负责协调导致局部gcp形状改变和增殖增加的细胞事件,它们尚未被确定。基因表达研究比较锚定中心内的gcps与Cb其余部分的gcps,将为识别这些关键因素提供一种可能的方法。
在锚定中心的建立过程中,Pc层的折叠与gcp向内积累是一致的
除了裂缝形成的E16.5处gcp向内聚集外,我们还观察到Pc层在同一时间和位置的互补内折叠。然而,与gcps不同的是,pc直到出生后才在裂缝底部呈现出独特的细胞形状或方向。因此,gcps的向内积聚很可能是Pc层褶皱的驱动力,也可能是裂缝形成本身的驱动力。
EGL在Cb表面形成内陷而不是外溢,这一事实提出了一个问题,即gcp是否主动向内推动,或者Cb内部的力是否决定了细胞积聚的轮廓。涉及机械力的一个可能的解释是,与由基底层和室管膜细胞层组成的外表面相比,脑皮层具有更小的内在力阻力,因此,gcps采用阻力最小的路径。一个有吸引力的假设是,gcps和Pcs的变化可能是耦合的,即Pcs的一个子集分泌一种尚未被识别的局部因子,该因子增加gcp增殖并诱导细胞伸长,而gcps的这些变化随后产生Pc层的内向折叠,随后是Cb的外表面。我们的研究首次证明,Pc层和gcp行为的协调变化是Cb外表面将形成裂缝的第一个细胞标志。
伯格曼胶质纤维取向和独特的颗粒细胞迁移产生功能性锚定中心,驱动叶片的生长
我们的研究表明,经过gcps的积累和延伸,在E18.5处,Bg纤维在裂缝底部特异性重组成扇形是建立起一个功能锚定中心的最终过程。随着Cb表面的叶状变化,我们发现围绕锚定中心的Bg纤维从平行组织向锚定中心的平顶表面辐射,类似于轮毂向外辐射的辐条。有可能这种Bg纤维的重排,类似于拉紧钱包的绳子,涉及到Bg固有的一个活跃过程。另外,Bg纤维的重排可能是小脑表面裂缝形成的机械结果,这是由gcps的延伸(我们的研究)或Pc轴突的限制所驱动的[9].
由于Bg纤维是gcs从EGL向IGL迁移的轨迹,因此裂缝底部Bg纤维的扇形组织可能会引导锚定中心周围的gcs分散到整个裂缝底部,从而产生裂缝底部观察到的更薄的IGL[2]。39,41].我们建议,一旦锚定中心建立起来,其余的叶片生长以自我维持的方式进行。由于裂缝底部的gcps必须比其他地方的gcps填充更大的IGL面积,因此裂缝的底部预计不会向外扩张。此外,在叶冠处会发生相反的情况,在那里gcp合并到较小的IGL区域,从而导致向外生长和叶冠处较厚的IGL。沿着裂缝两侧的gcp直接穿过分子层迁移,因此,应该扩大叶叶的长度。Bg作为功能锚定中心的关键组成部分的重要性最近被一个突变体所表明,其中Bg由于异位表达而未能成熟Sox4[63].虽然在这些突变体中有gcps的局部积累,并伴有Pc层的内陷,但裂缝的成熟并没有进行。
锚定中心形成时间的改变导致叶片形状的可预测变化
我们对裂缝形成的分析En2突变体不仅为我们提出的决定锚定中心形成的细胞事件序列提供了证据,而且重要的是,它还揭示了锚定中心形成的时间在决定叶叶形状方面起着关键作用(图2)11).我们发现,所有与锚定中心形成相关的gcps、Pc层和Bg纤维的变化都是在锥体前(非主)裂缝中过早开始的,而在次级(主)裂缝中,这些变化明显延迟En2突变体(图11).我们在En2突变表明存在一个形态发生时钟,它通常控制着直接形成锚定中心的遗传和细胞事件的时间。这个形态发生时钟必须确保与锚定中心形成相关的细胞行为在正确的时间发生。看来是损失了En2扰乱这种形态发生时钟,导致前锥体和继发性裂缝形成时间的畸变。这导致中间小叶VIII的大小、形状和位置发生改变。目前尚不清楚En2特异性地影响负责产生小叶VIII的锚定中心的pc,而这反过来又不能为gcps的增殖和伸长提供局部因素,和/或是否En2直接调节gcp或Bg行为。细胞类型特异性消融En2可以用来进一步剖析它在每种细胞类型中的作用。
结论
我们的发现统一并扩大了提出的叶面发育模型,包括在裂缝的初始形成和随后的叶面生长中多种不同的细胞行为的同步。因此,我们认为裂缝的基部是Cb的遗传和形态不同的区域,不仅锚定裂缝的基部,而且还驱动小叶向外生长。此外,每个锚定中心形成的位置和时间都必须精确调节,以产生正常的叶叶模式。我们认为,每个物种中叶阵列的程度为组织生物体中功能回路的范围提供了部分基础。此外,可以想象,在进化过程中,通过在特定位置增加额外的锚定中心来平衡gcp增殖的增加,叶子的数量可以增加。然后,通过改变锚定中心形成的时间,每个叶子的独特形状就会进化。最后,事实是En2突变体裂缝形成的时间和位置是不耦合的,这表明进化上保守的遗传信息决定了锚定中心应该在哪里形成功能,而不依赖于控制pc、gcps和Bg何时响应这些信息并执行锚定中心形成的过程。
材料与方法
鼠标线
所有的动物研究都是在近亲繁殖的SW小鼠中进行的,根据纽约大学医学院和纪念斯隆-凯特琳癌症中心的机构指南,按照IACUC批准的动物方案进行。在几乎所有被分析的SW小鼠中,大部分前叶I和II被融合,而小叶IV和V被裂缝部分分离。VIa和b小叶,以及IXa、b和c小叶始终存在。检测到堵塞的那一天被指定为E0.5。他的出生日期被定为P0。成人被指定为P28或以上。用于转基因细胞形状分析CAG: GPI-eGFP使用小鼠[29].Tau-loxP-STOP-loxP-myrGFP-IRES-nLacZ(τ)报告小鼠的基因分型如下[35].Math1-CreER小鼠按描述进行基因分型[34].对于基因分型En2引物分别为p32(5′-TCGGGGGAAGAAGTGTCCAATGTCC-3′)、neoTGAp2(5′-ATCGCCTTCTTGACGAGTTCTTCTGAG-3′)和En2p31(5′-GGGCCTGTACAACCATTCCACCACG-3′)[49].p31和p32引物扩增野生型条带。
命运映射
双半合子雄性(Math1-CreER;Tau-loxP-STOP-loxP-myrGFP-IRES-nLacZ)与SW雌鼠(5 ~ 6周龄;Taconic, Hudson, NY, USA)产生双半合子胚胎。他莫昔芬(T-5648, Sigma, St. Louis, MO, USA)溶于玉米油(Sigma C-8267)中,终浓度为20mg /ml。雌鼠中午用动物喂养针(Fine Science Tools, Corston, UK)灌胃他莫昔芬,剂量为E15.5(每40 g体重4 mg)。双半合子雄性(R26-CreER;R26-loxP-STOP-loxP-eYFP)与SW雌鼠(5 ~ 6周龄;产生双半合子胚胎。雌性于中午按E12.5 (1-2 mg / 40 g体重)给予他莫昔芬,并在E16.5/17.5进行分析。将解剖的脑组织在4°C的4%多聚甲醛(PFA)中浸泡固定20分钟,在15%和30%蔗糖中冷冻保护,包埋在OCT (Tissue-Tek, Sakura Finetechnical, Japan)中,并在10 μm处切片。
组织学和免疫荧光免疫组织化学
对于P8以上小鼠的组织学和免疫荧光免疫组织化学,在4% PFA心内灌注后解剖大脑,然后在4℃下浸泡固定在4% PFA中过夜。然后对组织进行石蜡包埋处理,并在7 μm处切片。为了一致性,从蚓部分析的切片被限制在最内侧100-200 μm。
采用间接免疫荧光法进行免疫组化,采用标准染色程序,使用以下抗体:兔抗blbp (1:20 00;Milipore, Billerica, MA, USA),小鼠抗brdu (1:500;Becton Dickinson, Franklin Lakes, NJ, USA),小鼠抗calbindin (1:4000;swwant, belizona,瑞士),小鼠抗neun (1:10 00;Chemicon, Temecula, CA, USA),大鼠抗gfp (1:5 000;Nacalai Technique,京都,日本),兔抗gfp (1:5 000;Invitrogen Corporation, Carlsbad, CA, USA), rabbit anti-PH3 (1:500;Cell Signaling Technology, Beverly, MA, USA), anti-βgal (1:500;Biogenesis, Raleigh, NC, USA), rabbit anti-Pax6 (1:30 00;小鼠抗gfap (1:500; Chemicon), TRITC-Phalloidin (1:2,000; Sigma), goat anti-Sema6a (1:200; R&D Systems, Minneapolis, MN, USA). Sections were mounted in Vecta Shield with DAPI (Vector Laboratories, Burlingame, CA, USA) and examined with a fluorescent microscope (DM6000, Leica, Nussloch, Germany; Axio Observer, Zeiss, Germany). Fluorescent images for Figure2 g-g2采用蔡司观察仪(Zeiss Observer)和apoome设置采集1.5 μm光学切片,并用Adobe Photoshop进行处理。正交分析证实了两种标记的共表达。
在E16.5、E17.5、E18.5、P3、P5、P7、P10和P21位置对蚓部中线矢状切片进行Cb示影,采用1倍放大的解剖显微镜(MZ16FA, Leica)对苏木精和伊红切片进行拍照,然后使用Adobe Illustrator (CS2)对最外表面进行仔细的轮廓绘制,然后将轮廓叠加在一起。
溴脱氧尿苷染色及细胞增殖定量
在处死前20分钟,腹腔注射100 μg BrdU/g体重,测定其增殖情况。为了量化E17.5和E18.5时brdu阳性细胞的百分比,我们从3个胚胎的最内侧100-200 μm处计算每个胚胎40-50个7 μm切片(EGL) (DAPI阳性细胞)的细胞总数,以此来计算brdu阳性细胞的百分比。为了确定EGL中pH3阳性细胞的分布,在E16.5, E17.5和E18.5时,计算每个裂隙基部相对于叶面和叶冠的pH3阳性细胞的数量。裂口的底部被认为是裂口最内陷的部分。然后根据每个区域颗粒细胞前体总数中ph3阳性细胞的数量计算ph3阳性细胞的百分比。通过DAPI染色计数各区域的gcps总数。叶冠在E16.5有100 ~ 200个核,在E17.5有120 ~ 276个核,在E18.5有100 ~ 280个核。裂缝基部在E16.5处有80 ~ 90个核,在E17.5处有100 ~ 144个核,在E18.5处有100 ~ 150个核。每个胚胎期(E16.5-E18.5),取3个大脑最内侧连续切片(7 μm厚)45 ~ 60个pH3阳性细胞进行定量。为En2在每个阶段的25-30个最内侧连续切片(7 μm厚)上进行pH3阳性细胞的定量。在E18.5时,选取7 ~ 8个最内侧矢状面连续冷冻切片(12 μm厚)进行BrdU和βgal双阳性细胞的定量。来自多个胚胎的细胞测量数据被汇集到数据集中。我们定义了裂缝底部的区域,其中阳性细胞被计数为裂缝中最内陷的部分,以及EGL下方10 μm深的扇形区域(见图2)。6 f).我们定义了裂缝顶部的区域,其中阳性细胞计数与裂缝底部的EGL长度相同,但位于相邻小叶的顶部,并在其下方10 μm深的矩形(图中黄色部分)6 f).
的形态学
我们使用美国国立卫生研究院(NIH)的ImageJ软件追踪细胞轮廓并测量细胞周长[64].只有当细胞的轮廓和形态清晰可见时,才选择细胞进行定量。圆度由ImageJ计算为面积(a)与周长(P)的归一化比值,比值为1表示一个圆(圆度= 4πA/P)2).通过执行这些计算,圆度指数区分具有圆形形态的细胞和具有较长形态的细胞。
为了量化裂孔底部和裂孔顶部gcps的形状,我们对裂孔中矢状面Cb切片进行了高倍成像CAG: GPI-eGFPE16.5, E17.5和P0转基因小鼠。为了定量,我们从3个胚胎的最中间300 μm处取40-50个切片(7-10 μm厚)。基于抗pax6和抗gfp双免疫染色,我们确定叶冠处的5个细胞厚层和裂缝底部的7个细胞厚层是EGL,并将我们的测量限制在这一层。来自多个胚胎的细胞测量数据被汇集到数据集中。样本大小如下:3个胚胎在E16.5时获得光滑的Cb, 60个细胞沿Cb的AP轴分布,45个细胞位于EGL聚集区域;裂隙基部在E17.5,来自3个胚胎的63个细胞;17.5岁时,裂片的顶部有3个胚胎的70个细胞;P0处裂隙基部有3个胚胎116个细胞;3个胚胎的125个细胞在P0的裂片的冠部。为En2我们计算了小脑皮层最外层5个细胞厚层的圆度指数。样本量为:P0时的次生裂和前锥体裂,3个胚胎20 ~ 30个细胞;P1,来自3个胚胎的30-35个细胞。使用unpaired比较圆度指标值t测试。
电子显微镜
用4% PFA灌注E17.5胚胎,然后用3%多聚甲醛、1%戊二醛、4%蔗糖、0.1%氯化钙浸泡固定20.1 M乙酸钠缓冲液(pH 7.4)中添加2.5% DMSO。去除Cb,再次在4°C下在4% PFA中浸泡固定2小时,然后在室温下用1%四氧化锇后固定1.5小时,然后以标准方式处理并包埋在Embed 812 (EMS, Hatfield, PA, USA)中。取1 μm半薄切片,1%甲苯胺蓝染色,评价保存质量。超薄切片(60 nm)使用徕卡超切割UCT切割,放在前移涂层铜网格上,并按标准方法用醋酸铀酰和柠檬酸铅染色。染色网格在Philips CM-12电子显微镜下检查,并用Gatan 1k × 1k数码相机拍摄。
参考文献
Schmahmann JD:小脑疾病:共济失调、思维障碍和小脑认知情感综合征。中华神经病学杂志,2004,16:367-378。
张建军,张建军,张建军,张建军,张建军,张建军,张建军。儿童小脑畸形的认知和情感发育障碍。中国生物医学工程学报,2007,25(3):369 - 369。10.1093 /大脑/ awm201。
Welker WI:小脑皮质叶状和裂隙的意义。小脑叶是感觉运动整合的基本单位。中国生物医学工程学报,2009,28(2):387 - 391。
形态学、分子密码和电路产生小脑的三维复杂性。中国生物医学工程学报,2007,23(3):549-577。10.1146 / annurev.cellbio.23.090506.123237。
小脑系统发育的细胞和基因调控。中国生物医学工程学报,2004,32(2):391 - 391。10.1016 / j.pneurobio.2004.03.004。
Chedotal A, Bloch-Gallego E, Sotelo C:胚胎小脑包含引导下橄榄轴突发育的地形线索。发展,1997,24:861-870。
李建军,李建军,李建军,张建军。鲨鱼和全头动物的脑组织和小脑叶状结构的变化。神经科学进展。2007,32(1):1 -3。10.1159 / 000100037。
Larsell O:《从单孔目动物到类人猿小脑的比较解剖学和组织学》,1970,明尼阿波利斯,明尼苏达州:明尼苏达大学出版社
Altman J, Bayer SA:小脑系统的发展及其进化,结构和功能。1997,纽约:CRC出版社
雷蒙,王志强,王志强,《脊椎动物神经系统的组织学研究》。编辑:Azoulay L. 1911,巴黎:Maloine, 2:
Ramon y, Cajal S:神经系统组织学。1995,牛津:牛津大学出版社
Corrales JD, Rocco GL, Blaess S, Guo Q Q, Joyner AL: Gli基因在小脑发育中的空间模式。发展,2004,31(1):5581-5590。10.1242 / dev.01438。
Corrales JD, Blaess S, Mahoney EM, Joyner AL:超音hedgehog基因信号水平调控小脑叶面发育的复杂性。发展,2006,33(3):1811-1821。10.1242 / dev.02351。
发育中的小鼠小脑的细胞动力学。2外颗粒层在旋转过程中的作用。中国生物医学工程学报,2009,23(3):343- 349。10.1016 / 0006 - 8993(70) 90061 - 2。
hadara MA, Nooreddin MA:小鼠出生后小脑蚓部发育的定量研究。中国生物医学工程学报,2009,32(2):444 - 444。10.1002 / cne.901280209。
Van Essen DC:中枢神经系统形态发生和紧密布线的张力理论。自然科学,1997,38(5):313-318。10.1038 / 385313 a0。
Inouye M, Oda SI:小鼠小脑叶型的菌株特异性变异。中华神经科杂志,1998,19(3):357-362。10.1002 / cne.901900209。
Celio MR: Calbindin D-28K和小白蛋白在大鼠神经系统中的表达。神经科学学报,1994,35(3):357 - 357。10.1016 / 0306 - 4522 (90) 90091 - h。
王志强,王志强。小脑蚓部攀爬纤维神经支配的差异成熟。中华神经科学杂志,2004,24(4):326 - 332。10.1523 / jneurosci.5610 - 03.2004。
张建军,张建军,张建军,等。小鼠基因诱导命运定位:建立遗传谱系和定义神经系统遗传神经解剖学。开发与应用,2006,35(5):2376-2385。10.1002 / dvdy.20884。
Srinivas S, Watanabe T, Lin CS, William CM, Tanabe Y, Jessell TM, Costantini F:将EYFP和ECFP靶向插入ROSA26位点产生的Cre报告菌株。中国生物医学工程学报,2001,31(1):1-4。
Hamilton BA, Frankel WN, Kerrebrock AW, Hawkins TL, FitzHugh W, Kusumi K, Russell LB, Mueller KL, van Berkel V, Birren BW:错开小鼠核激素受体rorα的破坏。自然科学,1996,37(3):736-739。10.1038 / 379736 a0。
大鼠小脑浦肯野细胞的早期树突状发育。利用轴突示踪技术对脑内神经系统的光电子显微镜研究在体外”片。中国生物医学工程学报,2001,25(4):391 - 391。10.1016 / 0165 - 3806(91) 90213 - 3。
McKay BE, Turner RW:大鼠小脑浦肯野细胞的生理和形态发育。中国生物医学工程学报,2009,35(4):829- 829。10.1113 / jphysiol.2005.089383。
出生后神经发生的放射自显影和组织学研究。3.大鼠小脑微神经元产生和分化的时间测定。[J]中国生物医学工程学报,2009,32(3):559 - 559。10.1002 / cne.901360303。
Jankowski J, Holst MI, Liebig C, Oberdick J, Baader SL: engrail -2负调控围产期浦肯野细胞分化的发生。[J]中国生物医学工程学报,2004,32(2):387 - 391。10.1002 / cne.20059。
Miale I, Sidman RL:小鼠小脑组织发生的放射自显影分析。中国生物医学工程学报,2004,22(4):379 - 379。10.1016 / 0014 - 4886(61) 90055 - 3。
瘦素M:原肠形成运动:逻辑和具体细节。软件学报,2005,(8):305-320。10.1016 / j.devcel.2005.02.007。
Rhee JM, Pirity MK, Lackan CS, Long JZ, Kondoh G, Takeda J, Hadjantonakis AK:在活的有机体内脂质修饰gfp变体融合体在胚胎干细胞和小鼠中的成像和差异定位。创世记,2006,44:202-218。10.1002 / dvg.20203。
张建军,张建军,张建军,张建军,张建军,张建军,张建军。基于细胞形态变化的心脏形态功能调控。科学通报,2007,35 (5):553 - 571 /journal.pbio.0050053。
杨建军,张建军,张建军,等。Pax6基因的表达及其在小脑系统发育中的作用。发展,1999,26:3585-3596。
王亚勇,邹碧海燕:小脑发育的遗传调控。中华神经科学杂志,2001,(2):484-491。10.1038 / 35081558。
王晓明,王晓明,王晓明,等。小脑外颗粒层细胞切向迁移的模式和速度。中华神经科学杂志,2001,21:527-540。
Machold R, Fishell G: Math1在小脑菱形唇神经祖细胞的时间离散池中表达。神经学报,2005,48:17-24。10.1016 / j.neuron.2005.08.028。
李建军,李建军,李建军,李建军,李建军,李建军,李建军,李建军,李建军,李建军。科学通报,2005,32 (3):559 - 571 /journal.pbio.0030159。
周丽丽,张建军,张建军,张建军,等。一种新型昆虫信号蛋白的克隆与表达[j] .中国生物医学工程学报,1997,9(4):559 - 561。10.1006 / mcne.1997.0607。
陈建军,陈建军,陈建军,陈建军,陈建军,陈建军,陈建军,陈建军,陈建军。中华神经科学杂志,2005,8:1516-1524。10.1038 / nn1555。
刘建军,刘建军,刘建军,张建军,张建军。植物小脑叶化的实验研究。1 .新生儿用6-羟多巴胺治疗大鼠小脑裂隙缺损的定性形态学分析。[J]中华神经科杂志,1997,23(3):751-769。10.1002 / cne.902030412。
Rakic P:大脑发育过程中神经元-胶质细胞的相互作用。神经科学进展,1981,4:184-187。10.1016 / 0166 - 2236(81) 90060 - 6。
Rakic P, Sidman RL:韦弗突变小鼠小脑皮质颗粒细胞缺陷的发育异常序列。中国生物医学工程学报,2003,22(2):393 - 398。10.1002 / cne.901520202。
Hatten ME, Mason CA:神经胶质引导的神经元迁移机制在体外和在活的有机体内。实验学报,1990,46:907-916。10.1007 / BF01939383。
高WQ, Hatten ME:韦氏颗粒细胞前体植入野生型小脑皮层修复神经元分化。科学,1993,26:367-369。10.1126 / science.8469990。
罗金野细胞树突生长与伯格曼神经胶质排列一致。中国生物医学工程学报,2005,51(1):229-234。10.1002 / glia.20200。
冯丽丽,张晓明,张晓明,等。脑脂结合蛋白(BLBP)在哺乳动物中枢神经系统发育中的表达。神经学报,1994,12:895-908。10.1016 / 0896 - 6273(94) 90341 - 7。
冯丽,张海涛,张海涛。脑脂质结合蛋白基因在神经胶质细胞中的转录调控机制。发展。1995,21(1):1719-1730。
Landry CF, Ivy GO, Brown IR:原位杂交分析大鼠脑胶质纤维酸性蛋白mRNA的发育表达。中华神经科学杂志,1990,25(4):394 - 398。10.1002 / jnr.490250207。
张建军,张建军,张建军,等。小鼠中枢神经系统中神经胶质细胞和相关细胞的组织。基于一种新的单克隆抗体标记的分析。神经科学学报。1990,36:121-144。10.1016 / 0306 - 4522(90) 90356 - 9。
Joyner AL, Martin GR:小鼠En-1和En-2基因序列同源果蝇嵌入基因:胚胎发生过程中的表达。基因工程学报,1998,1(1):29-38。10.1101 / gad.1.1.29。
Joyner AL, Herrup K, Auerbach BA, Davis CA, Rossant J: En-2同型框靶向缺失小鼠的细微小脑表型。科学通报,1991,25(1):1239-1243。10.1126 / science.1672471。
milen K, Wurst W, Herrup K, Joyner AL:两个小鼠Engrailed-2突变体的胚胎小脑发育异常和出生后叶形成模式。发展。1994,12:695-706。
Kuemerle B, Zanjani H, Joyner AL, Herrup K: Engrailed-2突变小鼠的模式畸形和细胞损失表明在小脑发育过程中有两个独立的模式事件。中华神经科学杂志,1997,17(3):781 - 789。
sgaer SK, Lao Z, Villanueva MP, Berenshteyn F, Stephen D, Turnbull RK, Joyner AL:基于对编码蛋白差异敏感性的顶盖和小脑功能相关区域的遗传细分。发展,2007,34(4):2325-2335。10.1242 / dev.000620。
张建军,张建军,张建军,等。大鼠小脑小叶化的定量分析。中国生物医学工程学报,1998,32(3):369 - 369。10.1002 / (SICI) 1096 - 9861 (19980928) 399:3 < 306:: AID-CNE2 > 3.0.CO; 2 - 4。
Lauder JM, Altman J, Krebs H:早期甲状腺功能减退和亢进对小脑叶化的影响。中国生物医学工程学报,2004,25(3):344 - 344。10.1016 / 0006 - 8993(74) 90511 - 3。
Lewis PM, Gritli-Linde A, Smeyne R, Kottmann A, McMahon AP: Sonic hedgehog信号是小鼠小脑颗粒神经元前体扩张和模式形成所必需的。中国生物医学工程学报,2004,27(2):393-410。10.1016 / j.ydbio.2004.03.007。
Wallace VA: purkinje细胞衍生的Sonic hedgehog基因调节发育中的小鼠小脑颗粒神经元前体细胞的增殖。中华生物医学杂志,1999,9:445-448。10.1016 / s0960 - 9822 (99) 80195 - x。
沃尔夫T,准备DF:开始的模式形成果蝇复眼:形态发生沟和第二次有丝分裂波。发展,1991,13:841-850。
Schoenwolf GC, Franks MV:鸟类神经板弯曲过程中细胞形态变化的定量分析。生物医学工程学报,2004,25(5):557 - 557。10.1016 / 0012 - 1606(84) 90284 - 7。
龚莹,莫春华,李春华。斑马鱼原肠胚形成过程中细胞极性信号的调控。自然科学,2004,43(3):689-693。10.1038 / nature02796。
Tawk M, Araya C, Lyons DA, Reugels AM, Girdler GC, Bayley PR, Hyde DR, Tada M, Clarke JD:镜像对称细胞分裂协调神经上皮形态发生。自然科学,2007,44(4):797-800。10.1038 / nature05722。
罗根C, Millar C, Bharadia V, Rouleau K:小鸡小脑皮层Tlx-3表达的开始与裂缝形态发育和描绘后横向边界相关。[J]中国生物医学工程学报,2002,32(4):559 - 561。10.1002 / cne.10234。
Shirasawa S, Arata A, Onimaru H, Roth KA, Brown GA, Horning S, Arata S, Okumura K, Sasazuki T, Korsmeyer SJ: Rnx缺乏导致先天性中央性低通气。中国生物医学工程学报,2000,24(4):779 - 779。10.1038/73516。
Hoser M, Baader SL, Bosi MR, Ihmer A, Wegner M, Sock E:中枢神经系统中Sox4的神经胶质表达延长导致小脑结构缺陷和共济失调。中华神经科学杂志,2007,27:5495-5505。10.1523 / jneurosci.1384 - 07.2007。
ImageJ。http://rsb.info.nih.gov/ij/
致谢
我们特别感谢Charles Levine、Sandra Blaess博士、Roy Sillitoe博士、Praveen Raju博士和Emilie league博士提出的有见地的评论和讨论,以及Alice Liang博士获得的电子显微镜数据。我们感谢Sylvia Arber博士、Gordon Fishell博士和Anna-Katerina Hadjantonakis博士τ记者老鼠,Math1-CreER老鼠,CAG: GPI-eGFP分别是转基因小鼠。我们要感谢尚塔尔·拉肯帮助我们培育CAG: GPI-eGFP转基因小鼠。我们非常感谢罗威娜·特恩布尔提供的技术援助En2突变体。
作者信息
作者及单位
相应的作者
额外的信息
相互竞争的利益
提交人声明他们没有相互竞争的利益。
作者的贡献
AS和ALJ设计了实验,AS完成了所有的实验。手稿由AS和ALJ撰写。AS和ALJ阅读并批准了最终的手稿。
电子补充资料
13064 _2007_30_moesm1_esm.tiff
附加文件1:最初是一个漫射层,IGL在每个裂缝的底部保持最薄。所提供的数据代表了出生后早期小脑IGL的标记。(一)抗neun染色显示P1处有一个组织松散的IGL,位于叶底和叶顶。(a1)(A)中所示区域的更高放大倍数。(b)到P3, IGL表现为一个明显的层,在裂缝底部最薄(b1),在裂片顶部最厚(b2)。(c)抗p27染色显示P7处IGL组织致密。裂孔底部(c1)的IGL比裂孔两侧薄得多,裂孔顶部(c2)的IGL最厚。p27在iEGL和IGL中标记有丝分裂后颗粒细胞。比例尺:(a、a1) 100 μm (b、c) 300 μm。(b1, b2, c1, c2) 75 μm。(tiff 6mb)
13064 _2007_30_moesm2_esm.tiff
附加文件2:在Cb皮层的最外层,BrdU阳性细胞为颗粒细胞前体。所提供的数据代表了BrdU和Pax6的标记,并表明BrdU的20分钟脉冲标记了EGL中的颗粒细胞前体。的内侧矢状切面(一)E16.5,(b)E17.5和(一部)E18.5胚胎用BrdU处理约20分钟。抗BrdU(绿色)和抗pax6(红色)的双重免疫染色显示BrdU在整个EGL中均匀掺入。比例尺:(a, c) 50 μm;(b, d, e) 15 μm。(tiff 1mb)
13064 _2007_30_moesm3_esm.tiff
附加文件3:gcps、Pcs和Bg纤维在半球新生裂隙中的形态变化与蚓部相同。所提供的数据代表了不同细胞类型的标记,以突出半球gcps, Pcs和Bg纤维的形态学变化。矢状面(模拟)E17.5和(情况)E18.5半球染色gcp、Pc和Bg纤维标记物。(a, e) DAPI染色显示右侧Cb表面光滑。抗calbindin (b, f)和抗pax6 (c, g)免疫染色显示Pc层内陷,gcps在可能形成裂隙的区域聚集。(d) E17.5时CAG:谷歌价格指数::GFP在新出现的锚定中心,侧切面显示圆形和更细长的GCPS。(h) E18.5侧切片抗blbp(红色)和抗brdu(绿色)免疫染色显示Bg纤维保持平行,因为外表面仍然光滑。比例尺:(a-c, e-g) 100 μm;(d, h) 15 μm。(tiff 2mb)
权利和权限
本文由BioMed Central Ltd.授权发表。这是一篇开放获取的文章,遵循知识共享署名许可(http://creativecommons.org/licenses/by/2.0),允许在任何媒体上不受限制地使用、分发和复制,前提是正确引用原创作品。
关于本文
引用本文
苏达罗夫,A,乔伊纳,A.L.小脑形态发生:叶理模式是由多细胞锚定中心精心安排的。神经系统开发2, 26(2007)。https://doi.org/10.1186/1749-8104-2-26
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/1749-8104-2-26
关键字
- 外颗粒层
- 瑞士韦氏鼠
- 裂缝的形成
- 颗粒细胞前体
- 循环索引