摘要
背景
炎症性肠病(IBD)是一种常见的缓解性慢性疾病,目前尚无令人满意的治疗方法。本研究旨在探讨α7烟碱乙酰胆碱受体(α7nAChR)的保护作用,并探讨其作用机制。
方法
分析了α7nAChR在溃疡性结肠炎和克罗恩病患者肠组织中的表达和分布。研究了迷走神经兴奋对实验性结肠炎的影响。以3%右旋糖酐硫酸钠(DSS)诱导C57BL/6小鼠结肠炎模型。治疗组腹腔注射α7nAChR激动剂PNU-282987。
结果
我们的结果显示,α7nAChR在结肠炎和克罗恩病肠道组织中表达明显升高,且主要表达在巨噬细胞和中性粒细胞中,在疾病状态下广泛浸润。α7nAChR激动剂治疗可有效改善dss诱导的疾病状态,包括体重减轻、大便一致、出血、结肠缩短和结肠组织学损伤。α7nAChR激动剂通过抑制多种促炎因子如IL6、TNFα和IL1β的分泌发挥抗炎作用,并通过阻断DSS诱导的NF-κB和MAPK信号通路的过度激活来抑制炎症细胞的结肠浸润。在机制上,α7nAChR的激活减少了结肠炎肠道中浸润的M1巨噬细胞的数量,抑制了巨噬细胞的吞噬能力,这些巨噬细胞在LPS刺激下被激活。
结论
因此,α7nAChR激动剂通过阻断炎性M1巨噬细胞的激活来改善dss诱导的结肠炎小鼠的结肠病理和炎症。
简介
炎性肠病(IBD)是一组结肠和小肠的慢性炎症性疾病。IBD的发病率在西方国家逐渐增加,对新型治疗干预措施的需求很高。有两种主要类型的IBD,溃疡性结肠炎(UC),它局限于结肠粘膜,和克罗恩病(CD),它可以影响胃肠道的任何部分(Sales-Campos2017).IBD的病理特征包括胃肠道慢性炎症;长时间的炎症会导致胃肠道损伤,表现为粘膜损伤、体重减轻、大便稠度改变、血便和结肠缩短(Basso2014).虽然IBD的病理机制尚不完全清楚,但人们普遍认为该病的发病机制是由环境因素、遗传特异性和肠道菌群作用共同引起的粘膜免疫反应功能障碍的结果(Ng2013).
最近的研究表明,神经系统和免疫系统相互作用以控制免疫止血(Colling等。2021).神经内分泌系统通过释放激素和神经递质向免疫系统发出信号,这些激素和神经递质通过这些受体调节细胞活动。免疫细胞表达各种类型的激素或神经递质受体。乙酰胆碱(乙酰胆碱,乙酰胆碱)是第一个被发现的神经递质,是一种存在于神经元或非神经元组织许多部位的多功能分子。最近的报道表明,乙酰胆碱神经可以通过胆碱能抗炎通路(CAP)调节免疫反应和控制炎症(Wedn et al.)。2021;阿伦2022).在此过程中,α7亚型的烟碱乙酰胆碱受体(α7nAChRs)在控制免疫功能和促炎反应中发挥关键作用。α7nAChRs是Cys-loop受体家族的阳离子通道。作为中枢神经系统中最丰富的nAChRs之一,α7nAChRs有助于认知功能、感觉信息处理、注意力、工作记忆和奖励途径(Zanetti2016).除神经元细胞外,α7nAChR在多种免疫细胞中广泛表达,包括巨噬细胞、树突状细胞、淋巴细胞、中性粒细胞、肠细胞、内皮细胞和小胶质细胞。CAP的激活可以阻断流氓炎症反应,并治疗许多疾病,包括危及生命的败血症,类风湿性关节炎,炎症介导的肾损伤,以及呼吸道炎症性疾病,如哮喘和慢性阻塞性肺病。在一些研究中,胆碱能受体拮抗肽亚群和α7nAChR敲除小鼠增强了小鼠巨噬细胞炎症因子的分泌,加重了小鼠肠道炎症。有趣的是,肠道迷走神经刺激的抗炎作用与脾脏和T细胞无关(Wang et al。2002;Matteoli等人。2014).然而,CAP在肠道炎症,特别是IBD中的功能作用仍有待明确。
肠道巨噬细胞是维持组织完整性的关键组成部分,因为它们可以区分无害的抗原和潜在的病原体,以维持肠道免疫稳态,而toll样受体(TLRs)的激活在这一过程中起着关键作用。肠道细菌释放的LPS对TLR4的异常激活导致多种类型的促炎分子的分泌,包括TNF-α和IL-6,并已被发现与IBD的发病机制发展相关(Fonseca-Camarillo)2009;气2019).阻断tlr4相关核因子κB (NF-κB)和丝裂原活化蛋白激酶(MAPK)通路的激活或恢复巨噬细胞从m1型促炎表型向m1型抗炎表型的极化均可缓解实验性结肠炎(Tang2019).已有研究证实,α7nAChR在巨噬细胞、树突状细胞等抗原提呈细胞中有较高水平的表达。因此,调控巨噬细胞CAP活化是否对IBD有治疗作用是一个值得关注的问题。
根据先前的报道,肠道炎症会触发迷走神经介导的回路,从而激活与炎症肠道相连的迷走运动神经元。这一发现提供了直接的神经解剖学证据,证明肠道中存在迷走神经介导的CAP反射(Cailotto2012).然而,CAP活化对IBD治疗的影响仍存在争议。一些报道表明,CAP在治疗IBD (Bonaz2017),而其他报告显示,CAP不应成为IBD抗炎治疗的主要目标(Shifrin2017).为了解决这个问题,在我们的研究中,我们旨在通过dss诱导的实验性结肠炎小鼠模型来评估CAP激活对肠道炎症的治疗作用。此外,本文还将描述这一过程的分子机制。
材料与方法
人体临床样本
受试者从中国上海同济医院转诊进行结肠镜检查的患者中招募。对3例UC患者和3例CD患者的乙状结肠活检标本进行了评估。3例正常粘膜患者(对照组)取活检标本。根据国内对IBD诊断和治疗的共识,诊断患者为UC和CD。内镜及影像学与UC、CD的特征一致,病理活检证实。手术标本(包括肠段及病变附近淋巴结)经病理证实为UC、CD,年龄18 ~ 60岁,临床资料齐全。正常对照组的结肠活检标本取自乙状结肠扭转患者手术切除后的肠道。本研究获得所有研究对象的书面知情同意,并获得同济大学人类研究伦理委员会的批准。
实验动物
雄性C57BL/6小鼠,6 - 8周龄,体重22-25 g,来自南京大学模型动物研究中心。这些小鼠被安置在正常的实验室条件下,并在特定的无病原体标准下保持在25°C的受控温度下,具有昼夜光照/黑暗周期,并自由获得小鼠食物和水。所有研究均由南京大学动物保护与使用委员会进行。
结肠炎的诱导和治疗
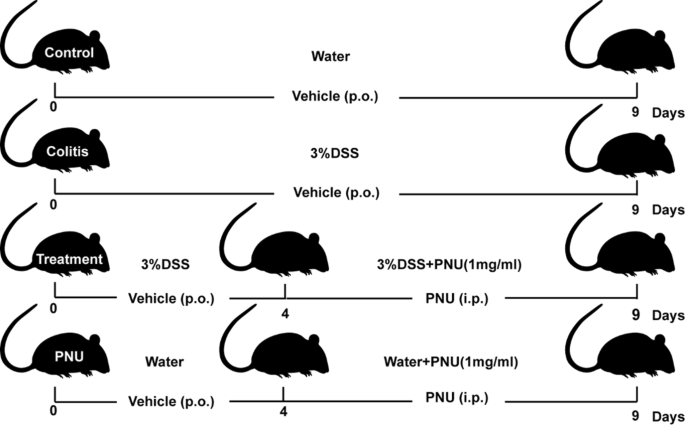
为了评估α7nAChR受体兴奋剂对结肠炎的保护作用,我们建立了实验性慢性结肠炎小鼠模型,方法是按照先前描述的方案(salams - campos . s),给予小鼠含3.0% (w/v) DSS(葡聚糖硫酸钠盐,分子量36 ~ 50 kDa, MP Biomedicals, LLC, SA)的免费水2017).PNU-282987是一种选择性α7nAChR激动剂。PNU-282987在生理盐水中稀释,每天腹腔注射,剂量为10mg /kg,根据该小组之前进行的剂量反应实验。体内实验分为四组,每组6只。健康对照组给予无菌水9 d,模拟对照组给予PNU-282987(无菌水+ PNU) 1 mg/ml。结肠炎组给予含3% DSS的水9天。治疗组给予含3% dss水9天,第4天开始腹腔注射PNU-282987 (#HY-12560A, MCE)(图。1).9 d后处死各组小鼠,收集结肠组织供进一步研究。
疾病临床评分、结肠长度、组织病理学、Masson及PAS分析
使用疾病临床评分描述标准,dss诱导的小鼠结肠炎评分为疾病活动指数(DAI) (Wirtz2007).DAI评价标准为体重减轻严重程度、大便稠度改变和出血。体重减轻百分比为0、1 - 5、5-10和10-20的分别为0、1、2、3和4。在大便一致性方面,0分为正常,2分为稀便,4分为腹泻。出血分为无血0分,隐血2分,大出血4分。然后,将这些分数相加,并除以3,计算出0-4的DAI分数。小鼠死后从盲肠到肛门取整个结肠并测量结肠长度(Zhang2016).结肠标本在4%多聚甲醛中固定,然后进行标准组织学检查和固定包埋。固定组织切片,取5 μm厚切片,用苏木精-伊红染色(H&E)进行显微分析。此外,进行马松三色染色来测量组织纤维化。采用周期性酸-希夫染色(PAS)检测杯状细胞。
免疫组织化学
麻醉后处死小鼠,用PBS清洗结肠组织。结肠组织用4%多聚甲醛固定,石蜡包埋。以5 μm厚度连续切纵切片,脱蜡再水化。用正常BSA血清在温度下孵育1小时,阻断了切片的非特异性免疫反应,切片用F4/80 (#GB113373, Servicebio,中国武汉)、Ly6G (#GB11229, Servicebio,中国武汉)、CD68 (#GB113150, Servicebio,中国武汉)、CD16 (#GB14026, Servicebio,中国武汉)、α7nAChR (ab216485, Abcam,英国剑桥)、p-P65(#3033,细胞信号技术,MA,美国)和p-STAT3 (Tyr705, #9145,细胞信号技术,MA,美国)抗体(1:100)在4°C下过夜,然后根据制造商的说明使用链霉亲和素过氧化物酶试剂盒进行处理。切片用H&E反染。作为对照,部分切片用PBS代替一抗孵育(Wang2015).由两名独立的研究人员评估蛋白质的表达,这些研究人员在× 400倍放大下的染色强度表示。
细胞培养及处理
小鼠RAW264.7单核细胞用Dulbecco 's改良Eagle 's培养基(DMEM) (Gibco, Grand Island, NY, USA)培养,添加10% (v/v)胎牛血清(Gibco), 37℃,5% CO加湿培养箱2.细胞用PNU282987(10、50或100 μmol/L)预孵育10 min后,用脂多糖(LPS) (100 ng/mL, LPS, Sigma, Louis, MO, USA)攻毒12 h。细胞实验分为三组,对照组无LPS或PNU, LPS组用LPS处理,最后一组用10/50/100 PNU处理。
RNA提取和实时PCR
使用制造商描述的Vazyme生物技术(中国南京)试剂提取小鼠结肠组织总RNA。随后,根据制造商的说明,使用试剂盒(Takara, Beijing, China)反转录1微克总RNA。内控基因为管家基因β-肌动蛋白。靶基因的小鼠mRNA引物序列列于表中1.以cDNA为样本,采用Power SYBR Green PCR Master Mix和ABI Viia 7检测系统进行实时PCR,检测体积为20 μl。用比较ΔCt法计算各研究基因的相对mRNA表达量,计算公式2−ΔΔCt.
免疫印迹
结肠样本在含1%磷酸酶和蛋白酶抑制剂鸡尾酒的RIPA裂解缓冲液中均质(Sigma-Aldrich, St. Louis, MO, USA)。将混合匀浆离心(12,000×g, 15 min, 4°C),收集上清液。采用比色法测定蛋白质浓度。将上清液与5 × SDS/PAGE样品缓冲液混合。等量的蛋白质(20 μg)用10% SDS/PAGE凝胶分离,然后转移到PVDF膜(Merck Millipore)。然后,将膜在5% BSA缓冲液中阻塞1.5 h,并在4℃下与针对IKBα (#4812, Cell Signaling Technology, MA, USA)、p-IKBα (#2859, Cell Signaling Technology, MA, USA)、p-P65 (#3033, Cell Signaling Technology, MA, USA)、p-ERK (Thr202/Tyr204, #4370, Cell Signaling Technology, MA, USA)、p-JNK (Thr183/Tyr185, #9255, Cell Signaling Technology, MA, USA)、p-P38 (#4511, Cell Signaling Technology, MA, USA)和GAPDH (BS60630, USA)的特异性一级抗体孵育过夜。生物世界技术公司,MN,美国)稀释1:000(细胞信号技术,MA,美国)。用TBST洗涤三次后,用二抗(Cell Signaling Technology, USA)培养膜。为了使条带可视化,所有的膜都用固定化western化学发光HRP衬底(Millipore, USA)孵育所需的时间。比较各组Western blot蛋白信号带与家政基因GAPDH信号带的相对密度。
免疫荧光染色
为了评估NF-κB p65亚基在细胞内的位置,RAW264.7细胞在无菌盖片上培养。规定处理后,将4%的甲醛在室温PBS中稀释10 min,在PBS中洗涤三次。然后,在5%正常血清0.25% Triton X-100的PBS中,室温下阻断细胞1小时。接下来,将细胞与anti-NF-κB p65 (1:200, #8242, Cell Signaling Technology, MA, USA)在4℃下孵育过夜。在PBS中冲洗3次,每次5分钟后,用Alexa Fluor 488标记的山羊抗兔二抗(1:1000,Abcam, ab150077)在室温黑暗中孵育30分钟,再在PBS中洗涤3次(Huang2019).进行HOECHST染色以观察细胞核。最后,将封面卡瓦安装好,并用Leica TCS-SP2共聚焦扫描显微镜(Leica, Heidelberg, Germany)观察图像。采用Image-Pro Plus 6.0软件检测核内NF-κB荧光强度,每实验组3个野区。
探讨M1与M2巨噬细胞比值分析。结肠组织用4%多聚甲醛(PFA)固定,石蜡包埋,二甲苯脱蜡,乙醇梯度脱水,去离子水清洗。在PBS中用BSA(5%)阻断30分钟后,切片在4°C下与CD68和CD163抗体(1:100;Servicebio,湖北,中国),用PBS冲洗15分钟,再用二抗在室温下孵育30分钟。二抗孵育后,用DAPI溶液在黑暗条件下染色细胞核。最后,使用Olympus FV3000共聚焦激光扫描显微镜(Olympus, Japan, FV3000)检查染色的细胞核。CD68+代表M1巨噬细胞,CD68+和CD163+为M2巨噬细胞。
吞噬活性测定
采用吞噬绿法测定RAW264.7细胞的吞噬活性大肠杆菌(Abcam ab235900)。对于共聚焦激光扫描显微镜,细胞培养在六孔板。加入5 μL大肠杆菌将浆液注入所有井中。立即将培养皿移回培养箱37℃孵育3小时,用冷PBS洗涤3次以停止吞噬,用新鲜制备的4% PFA固定10分钟。在室温下用DAPI (Beyotime, Shanghai, China)染色5分钟。使用Olympus FV3000共聚焦激光扫描显微镜(Olympus, Japan, FV3000)对细胞进行成像。
流式细胞术分析时,用绿色孵育后收集细胞大肠杆菌然后用冰冷的PBS冲洗三次以停止吞噬作用(Zhao et al。2020).细胞重悬于1.0 × 10的PBS中6用于流式细胞术(BD FACSCalibur)分析的每毫升细胞。
统计分析
所有数据均以至少三个独立实验的平均值±标准差表示。当分布为正态分布且存在齐次方差时,采用参数单尾未配对Student 's t检验,对三个或三个以上组进行方差分析。P值≤0.05为有统计学意义。所有分析均使用GraphPad Prism 7.0软件(San Diego, CA, usa, version 6.07)进行。
结果
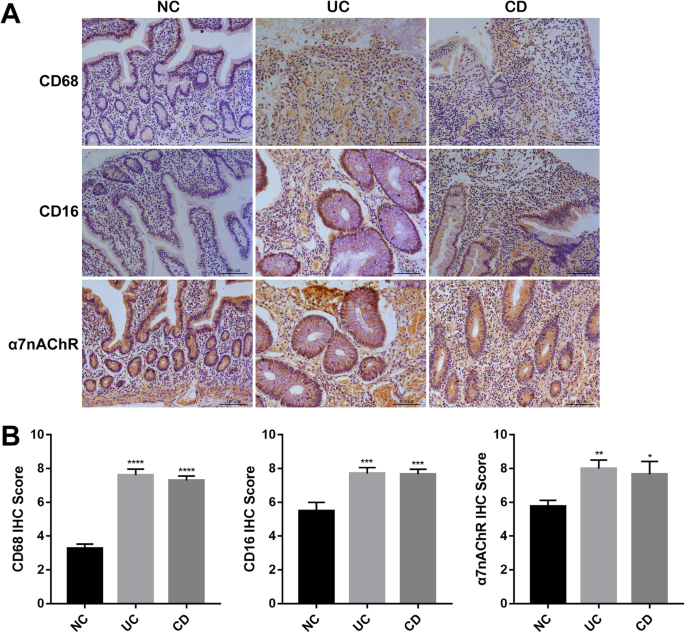
在人UC和CD结肠组织中观察到α7nAChR表达增加和炎症细胞浸润增强
为了评估α7nAChR信号通路是否参与临床IBD的发病和发展,我们通过免疫组化染色(IHC)比较了正常个体和UC、CD患者的结肠组织。如图所示。1A和B,通过分析CD68 +巨噬细胞和CD16 +中性粒细胞在肠道内浸润的频率,我们注意到CD或UC患者中CD68 +和CD16 +细胞的数量明显高于健康对照组。测量其组织分布,我们发现,与正常人不同,浸润的免疫细胞主要位于肠粘膜上皮附近。CD或UC患者浸润的炎症细胞组织分布较广,包括粘膜层、粘膜下层和肌肉层。值得注意的是,通过免疫病理染色,我们还观察到,与正常组织相比,CD和UC患者中α7nAChR的表达水平明显升高(图。1A和B),这表明α 7nachr介导的CAP可能参与了IBD的病理发展。
体内给予α7nAChR激动剂可改善实验性DSS结肠炎
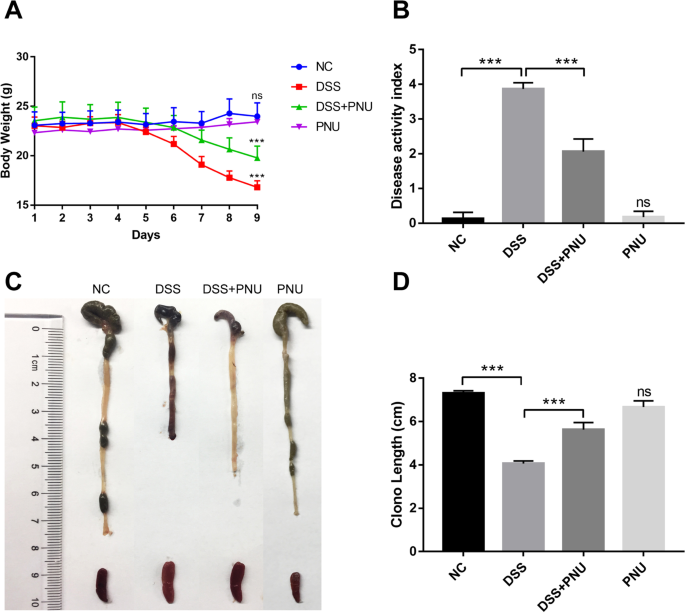
为了研究CAP对IBD的保护作用,采用dss诱导的实验性结肠炎小鼠模型,如图所示。2.3.0% DSS组小鼠出现结肠炎症状,与对照组相比,DSS组小鼠出现严重腹泻,并伴有广泛疾病,表现为体重减轻,临床活动评分增强,结肠长度缩短,观察期内出现明显的结肠炎症状。α7nAChR激动剂PNU-282987在体内治疗结肠炎小鼠可显著缓解dss诱导的结肠炎。通过动物体重减轻和结肠长度评估,结肠炎的全身病理体征明显减弱(图2)。3.A),同时伴有腹泻严重程度、大便稠度和出血的改善,并结合结肠炎的临床活动评分。与实验组和模拟处理对照组相比,总DAI显著降低(图2)。3.B).结肠长度是结肠炎症严重程度的间接和可重复的替代品。与水控制动物相比,DSS刺激小鼠的结肠长度显著缩短(图2)。3.C和D),给予PNU-282987显著逆转dss诱导的结肠缩短(图。3.C、D)。脾脏重量差异无统计学意义。同时,仅使用PNU-282987对小鼠结直肠组织没有影响(图2)。3.).这些结果表明,在体内用PNU激活CAP可以明显缓解实验性结肠炎的症状。
α7nAChR活化可减轻实验性结肠炎的结肠组织病理改变
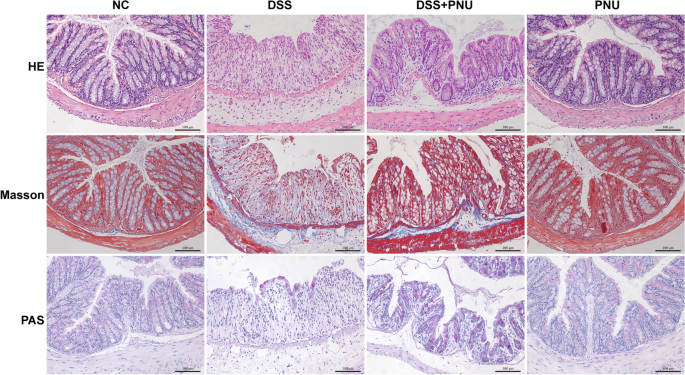
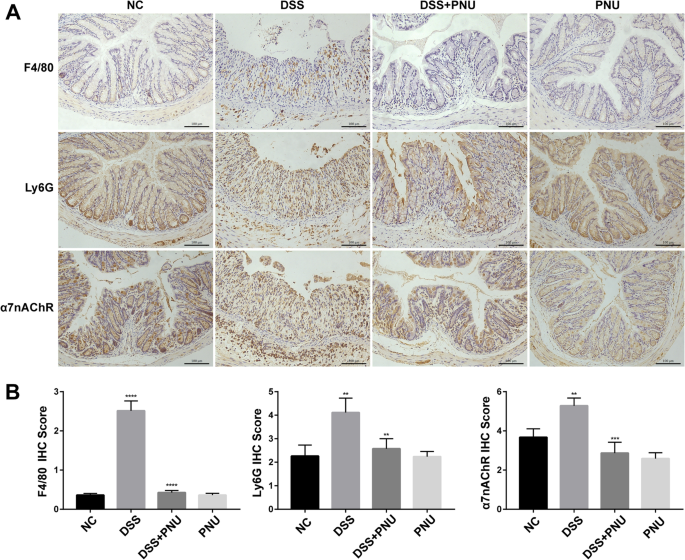
在观察到PNU-282987在体内治疗可以显著缓解实验性结肠炎的临床特征的基础上,我们接下来评估了相关的组织病理学改变。行H&E、Masson、PAS染色,观察组织病理学变化。正如预期的那样,与健康对照组相比,疾病模型组出现了明显的固有层组织学异常和明显的肠道结构病理改变(图2)。4),炎症细胞大量堆积,单核和多形核白细胞同时存在,纤维化增加,肠黏膜破坏,肌层增厚,上皮溃疡,隐窝丢失和杯状细胞耗损,肠结构丢失(图。4).在小鼠体内给药α7nAChR激动剂PNU-282987可显著减少结肠纤维化,并伴有结肠结构的恢复和再上皮化。这种改善之后,杯状细胞的正常形态恢复(图2)。4).α7nAChR激动剂PNU-282987处理后,炎症细胞浸润明显减少,免疫组化检测f4 /80阳性染色的巨噬细胞和ly6g阳性染色的中性粒细胞数量与实验组比较(图。5α7nAChR在结肠组织中的表达模式也被检测。如图所示。5结肠炎实验组α 7nachr阳性细胞强度明显高于正常对照组。PNU-282987处理显著降低了结肠组织中α7nAChR的表达,因为免疫组化染色观察到α7nAChR阳性细胞数量增加(图2)。5A和B)。
α7nAChR激活抑制dss诱导的结肠炎小鼠结肠NF-κB和MAPK通路激活
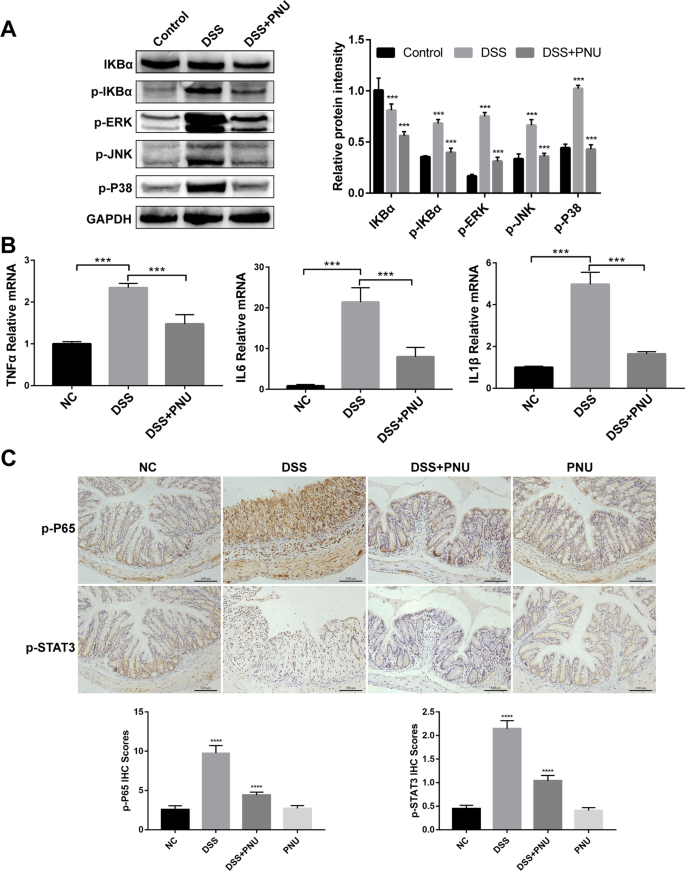
基于α7nAChR激动剂pnu282987治疗可能抑制dss诱导的结肠炎症反应的发现,为了解决潜在的机制,接下来评估了两个关键信号通路,NF-κB和MAPK,这两个信号通路在结肠炎的发病机制中发挥作用,并被报道参与CAP的生物活性(Yang2015).通过Western blot分析结肠组织,我们发现pnu282987处理显著下调了磷酸化形式的IκB (p-IκBα)水平和NF-κB信号通路的激活,MAPK通路的激活也被抑制(图2)。6A). DSS处理触发了ERK、JNK和P38蛋白的磷酸化,与DSS或对照组相比,PNU-282987处理后的磷酸化明显缓解(图。6一个)。
PNU激动剂对dss诱导的结肠炎MAPK和NF-κB信号通路激活及促炎因子mRNA表达的影响用3% DSS诱导实验性结肠炎。一个提取结肠组织总蛋白,用特异性IKBα、p-IKBα、p-ERK、p-JNK和p-P38抗体Western blot检测NF-κB和MAPK信号蛋白的表达。以管家基因GAPDH作为蛋白质负荷对照;B提取小鼠结肠mRNA, RT-qPCR检测TNFα、IL6和IL1β mRNA丰度。将各处理小鼠细胞因子mRNA表达水平归一化至对照小鼠水平,设为1。数据以平均值±标准差表示;* p < 0.05, ** p < 0.01, *** p < 0.001;C采用免疫组化法检测NF-κB和p-STAT3的表达水平。比例尺:100 μm
通过RT-qPCR进一步分析这些促炎细胞因子在结肠中的mRNA表达水平。在dss诱导的结肠炎小鼠中,TNF-α、IL-6和IL-1β的表达显著上调,而PNU-282987治疗显著降低了这种上调(图2)。6B).我们还通过免疫组化染色(IHC)检测肠组织中p-P65和p-STAT3的表达。结果显示,PNU-282987治疗后,实验性结肠炎中p-P65和p-STAT3表达的增加被明显阻断(图。6C).这些数据表明PNU治疗能够调节肠道炎症浸润,改善组织结构,在dss诱导的结肠炎中,组织结构被破坏。
体外α7nAChR激活可减轻tlr4介导的巨噬细胞炎症
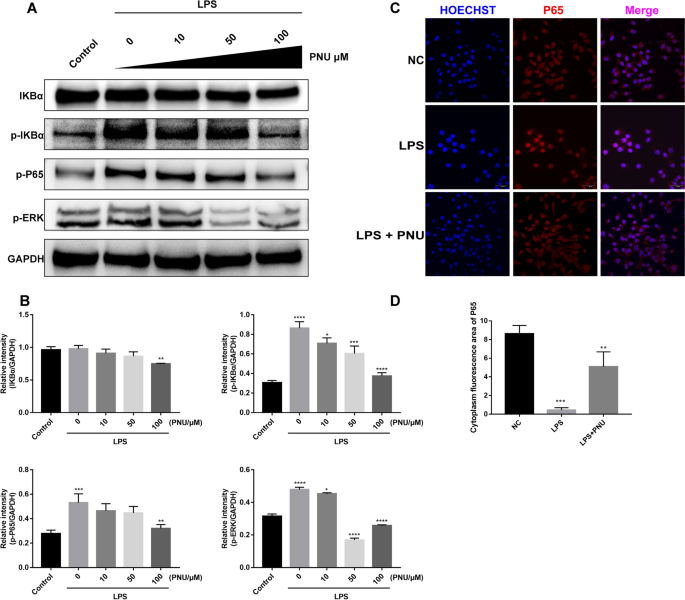
为了阐明α7nAChR激活在炎症调节中的机制,在LPS攻击前,将RAW264.7细胞预暴露于特异性α7nAChR激动剂pnu282987,并评估炎症相关通路,包括NF-κB p-p65, p-IκBα和p-ERK。我们的结果显示,LPS单独处理组NF-κB p-p65、p-IκBα和p-ERK蛋白水平显著下调,而PNU-282987预处理组则显著降低。当PNU-282987浓度增加时,观察到剂量依赖性效应。7p65的免疫荧光染色显示LPS诱导p65核易位,PNU-282987预处理逆转了这一作用(图5)。7综上所述,这些结果表明阻断NF-κB信号通路激活可能是pnu -282987介导的抗炎作用的重要机制。
α7nAChR的激活降低了dss诱导的结肠炎小鼠结肠中M1/M2的比值
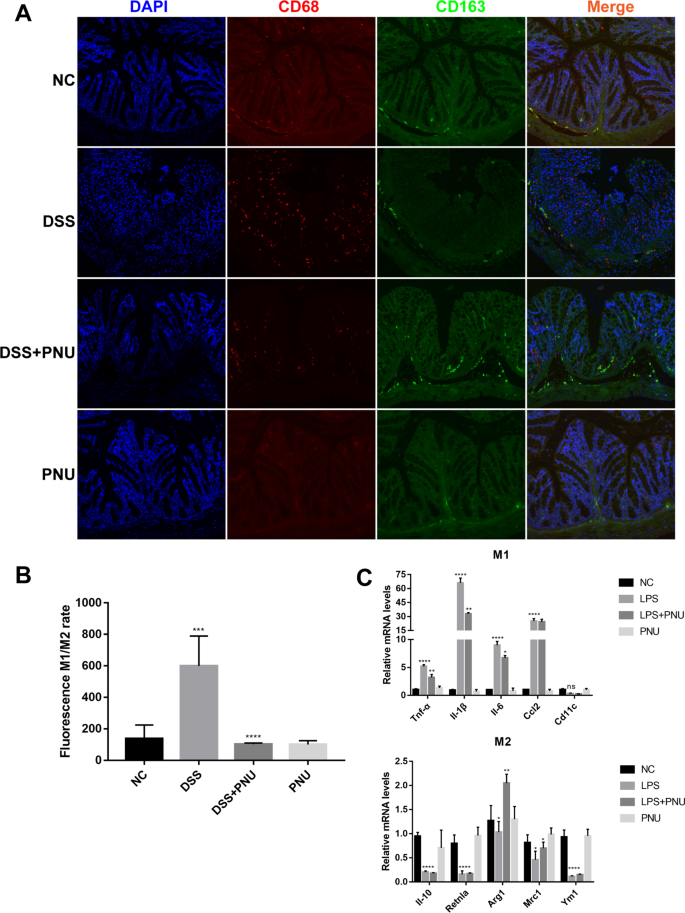
在研究了α7nAChR激活抑制dss诱导的结肠炎的潜在机制后,我们进一步探索了PNU-282987对结肠炎巨噬细胞功能的调节作用,并评估了结肠炎巨噬细胞M1和M2表型的变化。通过免疫荧光染色分析结肠组织,我们发现PNU-282987处理显著降低了M1/M2巨噬细胞的比例,M1巨噬细胞减少。在PNU-282987处理后,我们检测到CD68的数量显著下降+M1巨噬细胞与结肠炎模型组比较,而CD68+CD163+M2巨噬细胞没有变化,M1/M2巨噬细胞整体比值明显下降(图。8A和B)。
RT-qPCR进一步证实了这一结果。分析M1和M2巨噬细胞相关标志物的转录表达表明,lps处理的RAW264.7巨噬细胞中M1相关细胞因子和趋化因子,包括TNF-α、IL-6、IL-1β和Ccl2的表达显著增加,而pnu282987处理显著逆转了这些作用(图2)。8C)。同时,我们注意到PNU-282987处理后M2巨噬细胞Arg1-和mrc1相关标志物的表达水平升高(图。8C).这些数据表明PNU-282987治疗可调节肠道巨噬细胞的激活类型,并显著抑制M1促炎巨噬细胞的产生。
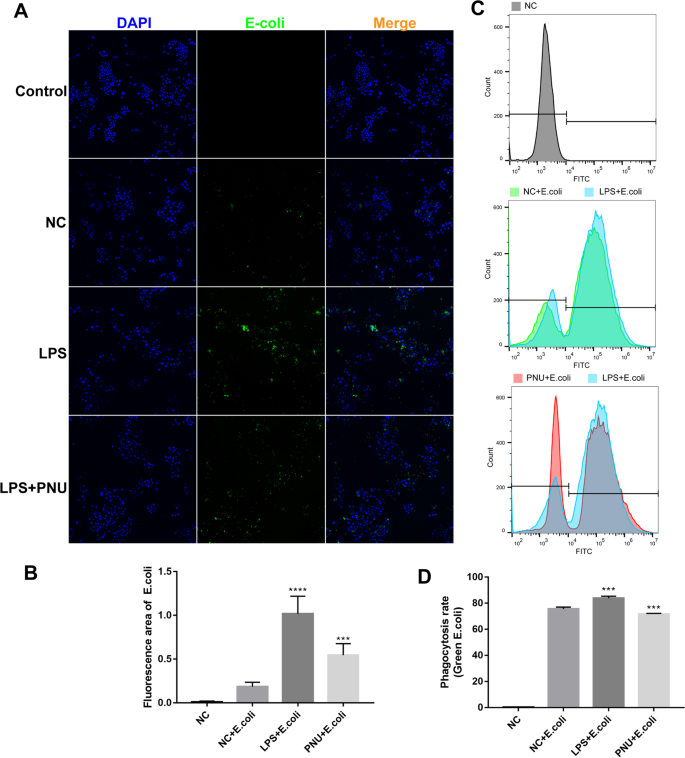
选择性激动剂PNU-282987抑制lps诱导的RAW264.7细胞巨噬细胞吞噬
为了澄清,α7nAChR的激活可能影响巨噬细胞的吞噬作用。用α7nAChR激动剂PNU-282987处理lps诱导的RAW264.7细胞,用PNU-282987检测巨噬细胞吞噬能力大肠杆菌.我们的免疫荧光结果显示,lps诱导的巨噬细胞吞噬作用显著增加,但PNU-282987处理后明显降低(图。9流式细胞术也证实了这些数据。α7nAChR的活化降低了小鼠的吞噬能力大肠杆菌巨噬细胞(图;9这些结果表明,PNU-282987治疗可以抑制巨噬细胞吞噬的激活,并可能抑制促炎巨噬细胞的活性。具体的生物学意义有待进一步探讨。
讨论
IBD被认为是一种复发性和长期性肠道疾病,由慢性炎症和组织破坏引起,原因是炎症的各种信号通路的异常激活和多种类型的促炎分子的过表达(Park2017).最近的一项研究表明,胃肠道炎症与神经元疾病之间有直接的相关性。在目前的研究中,α7nAChR激活在IBD病理发展的调节中起着至关重要的作用。我们的研究表明,选择性α7nAChR激动剂PNU-282987治疗可以缓解dss诱导的结肠炎小鼠模型的肠道炎症,表现为改善急性结肠损伤和恢复DAI评分。在体内使用PNU-282987治疗能够在组织病理学水平上减少隐窝、杯状细胞的损失和粘膜损伤;由此可见α7nAChR激动剂对小鼠结肠炎模型的治疗作用。
中枢神经系统与免疫系统动态合作,通过体液和神经通路调节炎症。特别是,迷走神经中的主要神经递质乙酰胆碱(ACh)依赖于α7nAChRs,并可能通过胆碱能抗炎途径影响免疫反应的结果,这代表了一种重要的稳态调节机制,用于感知和控制身体对炎症刺激的反应(Xie2020).α7nAChRs不仅在神经细胞上表达,而且在各种类型的免疫细胞上表达,可感知乙酰胆碱(ACh)并介导抗炎作用。此外,越来越多的证据表明,脑肠轴在IBD患者炎症的发病机制中起着重要作用(Mogilevski2019).α7nAChRs参与肠道炎症的病理发展是首次在迷走神经切开术小鼠模型中报道的,并且发现迷走神经切开术增加了TNBS或DSS诱导的急性结肠炎小鼠模型中结肠炎结肠组织的DAI、宏观和组织学评分、MPO活性和促炎细胞因子水平(Ghia2006).我们的研究提供了直接的实验证据,表明选择性α7nAChR激动剂PNU-282987激活胆碱能抗炎途径可以缓解dss诱导的结肠炎小鼠模型的肠道炎症。
免疫细胞(如单核细胞和中性粒细胞)招募到肠道上皮有助于实验性IBD的发病机制。在我们的研究中,我们证明了与实验结肠炎模型组相比,PNU-282987治疗显著减少了浸润的巨噬细胞和中性粒细胞的数量,这是基于F4/80和Ly6G染色确定的。此外,我们观察到结肠炎小鼠模型组乙酰胆碱受体(α7nAChR)的表达显著增加,这表明胆碱能抗炎途径的激活似乎是维持免疫稳态和保护炎症诱导的组织损伤的重要自我保护途径。
多种促炎因子的大量激活,包括TNF-α, IL-1β和IL-6,已被发现参与结肠炎的病理发展,在此过程中,多种信号通路的激活(Tracey2002),如NF-κB、MAPK、COX-2、Jak/Stat等,调控本病的病理发展(Liu2005).小鼠中TNF-α受体或IL-6的缺乏导致DSS暴露后炎症不那么严重,这表明这些分子和相关信号通路在结肠炎的发病机制中起着关键作用(Popivanova2008).已发现刺激颈椎迷走神经可抑制炎症因子的释放。在lps诱导的脓毒性腹膜炎小鼠模型中,直接刺激颈椎迷走神经可显著降低血清、心脏和肝脏中TNF-α等促炎因子的表达水平,提示其具有抗炎和免疫调节功能(Westerloo2005).在我们的研究中,我们证实了这一发现,我们的研究结果表明,PNU-282987激活α7nAChR可显著下调多种促炎因子的表达,包括TNF-α、IL-6和IL-1β。
巨噬细胞是宿主防御的第一道防线,对维持肠道免疫稳态很重要。巨噬细胞能有效区分无害抗原和危险病原体,维持口服耐受性。从M1到M2表型的巨噬细胞极化和NF-κB和MAPK通路的异常激活已被发现有助于IBD的病理发展。一些研究发现,巨噬细胞的极化从m1型促炎表型恢复到抗炎表型可以缓解实验性结肠炎(Qi2019).另有研究报道,一些治疗性化合物在实验性结肠炎中表现出较强的抗炎作用,主要依赖于对巨噬细胞NF-κB和MAPK通路激活的调控。由于IBD的异质性,一些临床研究也报道了巨噬细胞特异性NF-κB激活动态可以将IBD患者分为不同表型的组,并可能有助于确定对治疗的反应(Tang)。因此,在维持巨噬细胞抗炎表型的同时,阻断NF-κB和MAPK信号通路的异常激活在预防和治疗IBD中具有关键作用。先前的报道表明,通过抑制Jak2/STAT3/Socs3信号通路,刺激巨噬细胞中的α7nAChR可减少核因子κB (NF-κB)的核转运(Jonge2005).这为中央胆碱能受体参与抗炎途径提供了强有力的证据。在我们的研究中,我们证实了pnu282987激活α7nAChR胆碱能受体显著下调了lps诱导的巨噬细胞NF-κB和MAPK通路的激活。同样,我们的数据还显示,在dss诱导的小鼠结肠炎中,p-IKBα、p-P65、p-ERK、p-JNK和p-P38的表达显著增加。PNU-282987在dss诱导的实验性结肠炎小鼠中显著降低p-IKBα, p-P65, p-ERK, p-JNK和p-P38的表达。最后,我们也验证了PNU-282987对巨噬细胞功能的影响。结果显示,PNU-282987治疗显著降低M1促炎巨噬细胞的积累和M1/M2比值。结合在体外实验表明,PNU-282987可抑制LPS诱导的巨噬细胞吞噬能力下降,提示PNU-282987可能通过减少M1巨噬细胞、抑制促炎巨噬细胞功能来改善IBD。
结论
我们目前的研究表明,PNU-282987可以改善dss诱导的急性结肠炎小鼠模型的病理性肠道损伤,并且在α7nAChR激动剂PNU-282987治疗后,观察到宏观和组织学损伤的整体改善。PNU-282987抗炎作用可能依赖于NF-κB和MAPK信号通路。我们证实,胆碱能抗炎途径的激活在IBD的治疗中具有很好的潜力,这为这种疾病的未来治疗方案提供了一个关键的方法。
数据和材料的可用性
通讯作者可根据要求提供支持本研究结果的数据。
缩写
- 帽子:
-
胆碱能抗炎途径
- CD:
-
克罗恩氏病
- 戴:
-
疾病活动指数
- DMEM:
-
杜尔贝科改良的鹰牌中号
- 决策支持系统:
-
右旋糖酐硫酸钠
- ):
-
苏木精和伊红
- 炎症性肠病:
-
炎症性肠病
- MAPK:
-
丝裂原活化蛋白激酶
- 小额信贷机构:
-
荧光强度中值
- NK:
-
自然杀伤细胞
- 不是:
-
周期性酸-希夫染色
- TLR:
-
toll样受体
- 加州大学:
-
溃疡性结肠炎
- 炎症性肠病:
-
炎症性肠病
- 哦:
-
乙酰胆碱
- α7乙酰胆:
-
α7亚型烟碱乙酰胆碱受体
- NF -κB:
-
核因子κB
参考文献
人类胆碱能抗炎途径:最新综述和未来方向。中国生物医学工程学报(自然科学版)。
低音部PJ。遗传易感性、肠道菌群和宿主免疫反应在炎症性肠病病因中的关系中华医学杂志,2014;47(9):727-64。
Bonaz B, Sinniger V, Pellissier S.迷走神经刺激:一种新的有前途的治疗炎症性肠病的工具。中华临床医学杂志,2017;28(1):46-63。
神经解剖学证据证明肠中存在迷走抗炎反射。神经胃肠杂志,2012;24(2):191-200。
Colling ME, Tourdot BE, Kanthi Y.炎症,感染和静脉血栓栓塞。第2021号决议;128(12):2017-36。
Fonseca-Camarillo GC。慢性特发性溃疡性结肠炎患者和对照组直肠黏膜中IL-6和tnf - α基因的表达《胃肠病学杂志》2009;74(4):334-74。
图我。迷走神经:在小鼠模型中与炎症性肠病相关的一种强直性抑制影响。胃肠病学。2006;131(4):1122 - 52。
黄丽。焦磷-甲酯介导的光动力治疗诱导RAW264.7巨噬细胞凋亡并抑制lps诱导的炎症反应。光电诊断。2019;25:48 - 56。
德容格WJD。迷走神经的刺激通过激活Jak2-STAT3信号通路来减弱巨噬细胞的激活。中华免疫杂志2005;6(8):844-51。
金太瓦。从连翘花中分离出的木脂素koreanaside A抗lps诱导的巨噬细胞激活和dss诱导的结肠炎小鼠的抗炎机制:AP-1的关键作用细胞。2019;8(10):1163。
刘ZG。TNF信号转导的分子机制及其以外。细胞科学,2005;15(1):24-31。
Matteoli G, Gomez-Pinilla PJ, Nemethova A, Giovangiulio M, Cailotto C, Bree SV, Michel K, Tracey KJ, Schemann M, Boesmans W.一种独立于脾脏的迷走抗炎通路调节肠肌层巨噬细胞。肠道。2014;63(6):938 - 48。
综述文章:自主神经系统在IBD发病机制和治疗中的作用。中国药理学杂志,2019;50(7):720-37。
炎症性肠病的地理变异与环境危险因素。肠道。2013;62(4):630 - 79。
公园JH。IBD免疫发病机制:炎症分子的综合综述。《汽车科学》,2017;16(4):416-26。
在小鼠中阻断tnf - α可以减少与慢性结肠炎相关的结直肠癌的发生。中华临床医学杂志。2008;29(2):344 - 344。
uhrf1介导的tnf - α基因甲基化控制实验性结肠炎类似炎症性肠病的促炎巨噬细胞。中华免疫杂志2019;203(11):3045-53。
糖皮质激素短期治疗后实验性结肠炎的改善及其与不同调节标志物诱导的关系。免疫学。2017;150(1):115 - 26所示。
胆碱能抗炎途径不有助于新型吲哚林氨基甲酸酯预防溃疡性结肠炎。神经免疫药物学杂志,2017;12(3):484-91。
唐勇。实验性结肠炎中催产素系统通过调节巨噬细胞极化来缓解肠道炎症。中国生物医学工程杂志2019;33(18):1977-92。
特蕾西KJ。炎症反射。自然。2002;420(6917):853 - 62。
α 7nachr促进大鼠坐骨神经挤压伤早期轴突再生。Mol Biol杂志2015;42(3):603-12。
王红,余敏,Ochani M, Amella CA, Tanovic M, Susarla S,李建华,王辉,杨红,Ulloa L.烟碱乙酰胆碱受体α7亚基是炎症的重要调节因子。大自然。2002;421(6921):384 - 8。
Wedn AM, El-Bassossy HM, Eid AH, El-Mas MM.通过胆碱能抗炎途径调节子痫前期:治疗角度。中国生物化学杂志。2021;19(3):344 - 344。
Westerloo DJV。胆碱能抗炎途径调节脓毒性腹膜炎的宿主反应。中华流行病学杂志,2005;19(12):339 - 339。
化学诱导小鼠肠道炎症模型。物理学报。2007;2(3):541-7。
谢华。α - 7烟碱乙酰胆碱受体激动剂对抗肥胖、糖尿病和炎症的治疗潜力。Rev Endocr Metab Disord. 2020;21(4): 431-47。
杨YH。乙酰胆碱在RAW264.7细胞中通过alpha7 nAChR-JAK2/STAT3途径抑制lps诱导的MMP-9的产生和细胞迁移。细胞物理与生物化学,2015;36(5):2025-63。
α 7烟碱受体在人细胞因子刺激的自然杀伤细胞(NK)中的表达和功能作用。中国生物化学杂志,2016;291(32):16541-52。
咖啡酸改善结肠炎与小鼠肠道菌群中Akkermansia数量增加有关。Oncotarget。2016;7(22):31790 - 9。
赵晨,王勇,苏震,蒲伟,王慧。PM2.5可溶性提取物呼吸暴露破坏黏膜屏障功能,促进实验性哮喘的发展。科学与环境。2020;730:139145。
确认
一个也没有。
资金
基金资助:宁夏回族自治区科技发展重点项目(No. 2017BN04)、中央高校基本科研业务费专项(No. 0214- 14380523,0214 -14380509)、江苏省自然科学基金(No. 2017BN04);国家自然科学基金(no . 82070912, 81773326, 82100677)资助。
作者信息
作者及隶属关系
贡献
WYP和ZZS设计并执行实验,分析数据并起草手稿。CZ、LLW、QYC、SFZ和RRW进行了部分体外实验。JW, SYZ和HWW构思了项目,设计了实验,分析了数据并撰写了手稿。所有作者都阅读并批准了最终的手稿。
相应的作者
道德声明
伦理批准并同意参与
本研究经同济大学人类研究伦理委员会批准,并获得所有研究对象的书面知情同意。
发表同意书
不适用。
相互竞争的利益
没有公开的利益冲突。
额外的信息
出版商的注意
伟德体育在线施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.
关于本文
引用本文
普,W,苏,Z,瓦兹尔,J。et al。α7烟碱乙酰胆碱受体活化对实验性结肠炎的保护作用及其机制。摩尔地中海28, 104(2022)。https://doi.org/10.1186/s10020-022-00532-2
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s10020-022-00532-2
关键字
- 炎症性肠病
- α7乙酰胆
- NF -κB
- MAPK
- 胆碱能抗炎途径