摘要
自利妥昔单抗首次被批准用于非霍奇金淋巴瘤的治疗以来,基于抗体的治疗已经重振了癌症治疗的世界。针对癌症抗原的单克隆抗体由于缺乏抗体特异性和肿瘤环境的复杂性等原因影响了抗体的疗效,仅在少数几种癌症类型中获得成功。多特异性抗体是一类很有前途的抗癌药物,可以针对多种肿瘤抗原更精确有效地根除肿瘤细胞。他们可能会克服这些限制,并已经改变了一些恶性肿瘤的治疗前景,如B细胞急性淋巴细胞白血病。临床前研究和早期临床试验表明,这种方法可能是一种有效的策略,即使是实体瘤。本文综述了用于治疗实体瘤恶性肿瘤的双特异性抗体和三特异性抗体疗法的发展,并强调了它们在未来治疗中的潜力。
背景
在美国,癌症仍然是第二大死亡原因,肺癌是癌症死亡的主要原因,其次是女性乳腺癌和男性前列腺癌(Siegel2017).在过去的几十年里,新的靶向治疗对所有癌症的5年相对总生存率的显著改善做出了贡献,最突出的是造血和淋巴系统恶性肿瘤(Siegel2017).这场革命的一个组成部分是20世纪70年代单克隆抗体的开发。利妥昔单抗是一种针对B细胞表面发现的cd20抗原的基因工程嵌合抗体,是1997年美国食品和药物管理局批准用于治疗非霍奇金淋巴瘤(Leget和Czuczman淋巴瘤)的首个单克隆抗体1998;怀特等人。2000).从那时起,单克隆抗体用于癌症治疗已经发展到针对不同分子,并扩大了实体瘤以及恶性血液病的治疗选择。尽管在各种癌症中具有良好的耐受性和疗效,但这些药物作为单一疗法很少有效,并且存在一些局限性。交替分子通路的激活,肿瘤环境中的获得性变化,以及单克隆抗体对其靶标的次优接合只是一些缺陷(Fousek和Ahmed2015).最近基于蛋白质工程改进的创新已经导致结合抗体产生协同效应(Henricks et al。2015;Binyamin等人。2006);开发带有基因工程Fc受体的抗体,以实现更高的效应功能,如抗体依赖的细胞毒性(Binyamin等。2006);以及产生能够结合多个靶标的双特异性和三特异性抗体(Segal et al.)。1999;默滕斯等人。2001).2018年2月对Pub-Med的搜索显示,有2744篇关于双特异性抗体的文章,其中1784篇提到了癌症。与三特异性抗体类似,一项搜索发现37篇文章中有25篇提到了癌症。
历史回顾
使用具有多个结合位点的分子来增强其生物学功能的概念实际上可以追溯到1961年,当时来自不同多克隆血清的两个抗原结合片段结合形成双特异性分子(Nisonoff和Rivers)1961).20世纪70年代和80年代,两种不同抗原特异性单克隆抗体的化学偶联技术和两种产生抗体的杂交瘤细胞系(四瘤)的融合技术将双特异性抗体的生产提高到了一个新的水平(Staerz等。1985;Karpovsky等人。1984;佩雷斯等人。1985).尽管其中一些原始形式对某些恶性肿瘤表现出明显的活性,但绝大多数的治疗风险指数很低。随着基因工程的快速发展,在过去的20年里,多特异性抗体的生产有了显著的增加,目前有120多种描述的形式正在临床使用或正在临床试验中进行评估(Spiess et al。2015).尽管大多数多特异性抗体的早期开发主要针对血液系统恶性肿瘤,但在临床开发中有几个分子是针对非血液系统癌症的。我们的综述集中在针对实体瘤的双特异性和三特异性抗体的临床发展。
多特异性单克隆抗体的优缺点
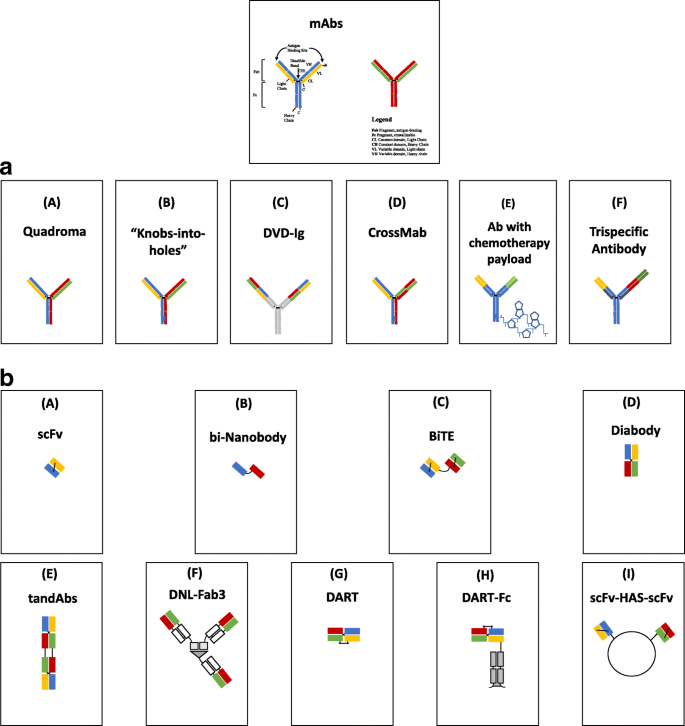
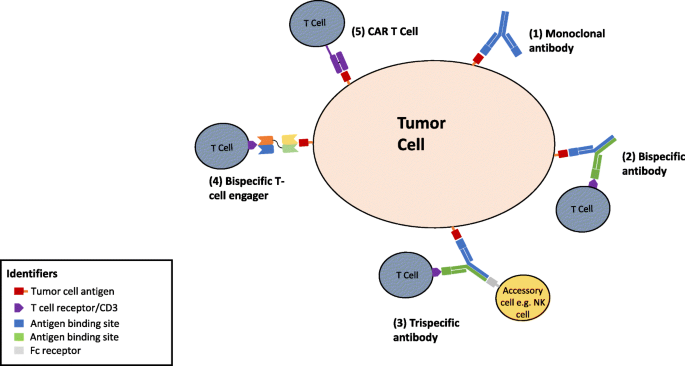
多特异性单克隆抗体(PsMabs)是一种基因工程蛋白,可以同时结合两种或两种以上不同类型的表位(图2)。1 a, b而且2)(范等。2015;Zhang等。2017).与单克隆抗体相比,它们有几个优点(图。2)因为他们可以:1)将特异性多克隆免疫细胞(如T细胞和NK细胞)重定向到肿瘤细胞,增强肿瘤杀伤;2)同时阻断发病机制中具有独特或重叠功能的两条不同通路;3)通过与两种不同的细胞表面抗原相互作用,而不是一种抗原,潜在地增加结合特异性;4)与用于联合治疗的多种单基抗体相比,或与CAR-T细胞的生产相比,在开发和生产方面降低成本。多特异性抗体的优缺点见表1.
一个: IgG样双特异性抗体和三特异性抗体的一些形式。(一个通过结合两种不同单克隆抗体的轻链和重链,产生针对不同肿瘤抗原的两个抗原结合位点。Catumaxomab (B)两条具有工程CH3结构域的抗体链,在一条重链上形成一个“旋钮”,在另一条重链上形成一个“洞”,以促进异源二聚。这只允许特定的重链配对,以减少错配。(C)两种单克隆抗体的可变结构域融合形成双特异性抗体(D)将一条重链的CH1结构域与相应轻链的常数结构域进行交叉单抗交换,以实现更好的轻链配对(E)双特异性抗体,具有两个独特的抗原结合位点和固定结构域上的化疗有效载荷(F三特异性抗体与肿瘤细胞上的三种不同配体结合。b:双特异性抗体片段和融合蛋白的一些形式。(一个一个轻链的可变区域与一个重链片段的可变区域的组合是抗原结合的基本元素。(B)双纳米体-两个不同的单变量重链结构域的组合,能够结合不同的肿瘤抗原。(CBiTE-来自不同抗体的串联单链可变片段,由柔性肽链连接。(DDiabody -由两条链组成的二价分子,每个链包含一个可变轻链和可变重链域,来自相同或不同的抗体。(E) tandAb -两对可变轻链和可变重链结构域连接在一个多肽链上,形成一个四价tandAb。(FDNL-Fab3 -三价双特异性抗体,由三个Fab片段组成,利用环磷酸腺苷(cAMP)依赖蛋白激酶A (PKA)的调节亚基和A激酶锚定蛋白(AKAP)的锚定结构域之间的特异性相互作用连接。(GDART -由一个分子的可变重链衍生的两条多肽链连接到另一个分子的可变轻链。(H) DART-Fc -具有Fc片段的dart,旨在延长血清保留时间。(我scFv-HAS-scFV-两个单链可变片段通过修改的二聚结构域结合
PsMab格式
能够结合两种不同抗原的双特异性抗体是最常用的PsMabs。从最初的实验生产BsMabs (Holliger和Winter1993),产品经历了重大的转变(Brinkmann和Kontermann2017),并已被证明在癌症诊断、成像和治疗方面有用。第一代BsMabs与较新分子的差异列于表中2.目前使用的多特异性抗体的成分范围从完整的抗体结构到片段,结构的创建仅受到分子化学家的视野、专利规则、物理化学约束和临床应用的限制。目前生产的一些BsMab包括双特异性小分子抗体偶联物、化学异质偶联物和涉及重组DNA技术的蛋白质基因工程(Spiess等)。2015;布林克曼和康特曼2017).研究最多的结构如图所示。1a和b.一般来说,这些双特异性抗体分为两大类:带有Fc区域的IgG样双特异性抗体,因此保留Fc介导的效应功能,以及完全依赖其抗原结合能力来发挥治疗作用的非IgG样抗体。这两个类之间的区别在Table中突出显示3..Fc介导的效应功能包括抗体依赖的细胞介导毒性(ADCC)、抗体依赖的细胞吞噬作用(ADCP)、补体依赖的细胞毒性,以及分子与新生儿Fc受体(FcRn)的结合(FcRn保护IgG免于降解并增加分子半衰期)(Fan等。2015).
在过去,igg样BsAbs是通过化学偶联或杂交瘤技术产生的。这些都是繁琐、耗时的过程,除了预期的双特异性抗体外,还会通过不同重链和轻链的随机组装产生无功能分子(Staerz et al。1985).利用重组DNA技术可以改善这些缺点。例如,双特异性四价分子,如双可变结构域免疫球蛋白(DVD-Ig),现在可以通过自然存在的连接物结合两个靶点结合单克隆抗体,并通过先进的重组DNA技术优化活性分子的产量来生产(Spiess等。2015).抗原同时结合双可变结构域免疫球蛋白(vd - ig)中的所有可变结构域提供了更高的特异性结合能力,可用于靶向低丰度蛋白,如细胞因子(Sedykh et al.)。2018),并可能降低药物的使用频率。
重组技术还通过结合来自两种不同单克隆抗体的单链可变片段来生成小片段分子,形成大小从50到60 kDa的双价双特异性“抗体”(Kontermann2012).其中一些例子是双特异性T细胞接合子(BiTE),串联单链可变片段(taFvs), diabodies (Dbs),单链diabodies (scDbs)和三体。由于其体积小,这些基于scFV的抗体片段具有较高的肿瘤特异性和肿瘤穿透性。然而,它们的小体积也限制了血清半衰期,这可能会限制疗效并增加成本,因为需要重复给药(Zhang等。2017).通过将这些抗体片段与白蛋白或与白蛋白结合的蛋白质融合,血清半衰期可以延长五到六倍(Sedykh et al。2018).其他方法,如聚乙二醇化,Fc片段融合,和多聚化也正在探索以延长抗体血清半衰期(Fan等。2015).表中列出了IgG样双特异性抗体和双特异性抗体片段的主要优缺点3..
BiTE值得特别提及,因为其中一个结合位点被设计成将效应细胞(t细胞或NK细胞)引入肿瘤细胞附近以增强抗肿瘤作用(图2)。2).这种功能导致相对于其他双特异性格式和单克隆抗体更有效的肿瘤细胞裂解(Yang等。2016).在t细胞中,结合的目标位点通常是CD3。白细胞与靶细胞的双特异性结合模拟了激活白细胞对抗靶细胞的作用(Offner等。2006).双特异性抗体可以利用非hla限制性白细胞而无需体外扩增,这种功能在1985年被描述,但直到最近才被利用(Staerz et al.)。1985).这种方法的另一个优点是对邻近细胞的旁观者效应,这可能在靶表位异质表达的肿瘤中有价值(Ross等。2017).最近,在一项观察t细胞依赖性双特异性抗体在人HER2乳腺癌小鼠模型中的生物分布的研究中注意到,对白细胞的结合亲和力可以决定双特异性抗体/白细胞组合是否能够到达目标位点或被困在淋巴器官中(Mandikian等人)。2018).因此,对双特异性抗体的阴性研究可能部分原因是由于分布不佳而缺乏靶细胞参与。
diabody格式具有由两个连接子连接的两个不同抗体的可变结构域,比BiTEs更具稳定性,但连接子限制了抗原结合位点的流动性,限制了抗原识别(Fan等。2015).DART双特异性抗体是通过改造两个Fv片段,使可变重链部分相互交换而产生的,比BITEs更大,并表现出更好的血清稳定性(Zhang等。2017).Dock-and-Lock (DNL)重组方法(图;1 b)使用双特异性抗体片段创建多价性和多功能性(Rossi等。2006).在缺乏共刺激模型或IL-2预激活T细胞的情况下,这些后来的形式,如BiTE、双亲和重靶向抗体(DART)抗体、串联双胞体似乎可以有效地消除表达其肿瘤相关抗原(TAA)的靶标(Zhukovsky等人)。2016).
PsMab在临床应用
目前,只有一种双特异性抗体被批准用于癌症治疗。Catumaxomab是首个进入临床的双特异性抗体,于2009年被欧盟批准用于恶性腹水(Seimetz2009).Catumaxomab是一种三功能抗体,由大鼠-小鼠方细胞产生,与细胞毒性T细胞上的CD3抗原和上皮细胞粘附分子(EpCAM)有亲和性,EpCAM是一种与恶性腹水和积液相关的1型跨膜糖蛋白,在大多数上皮性癌症上表达(Linke等。2010;Seimetz2011).该批准是基于研究表明腹腔注射Catumaxomab在改善恶性腹水症状和体征以及减少穿刺术需求方面的疗效(Heiss等。2010;弗兰普顿2012).在一项前瞻性随机试验中也注意到,与上皮性癌症相关的恶性腹水患者的总生存期呈积极趋势(Heiss等。2010;弗兰普顿2012),在铂难治性上皮性卵巢癌中有明显的活性(Baumann等。2011).在包括上皮性卵巢癌和转移性乳腺癌在内的妇科肿瘤继发恶性腹水患者的门诊环境中,该药物被认为是安全的。2015).尽管Catumaxomab显示出了很好的效果,但由于财务原因,它在2014年被撤出市场。其批准随后于2017年撤回(No Title。https://neovii.com/neovii-completes-marketing-authorisation-withdrawal-of-removab-in-the-european-union/留言。).
双特异性抗体Blinatumomab于2014年12月被美国FDA批准用于治疗急性b细胞急性淋巴细胞白血病(ALL)。Blinatumomab是一种新型的双特异性T细胞接合剂,结合CD19(抗原在B细胞系的所有阶段表达)和CD3 T细胞受体复合物的位点,导致T细胞增殖和激活,导致靶细胞(淋巴母细胞)凋亡。与catumaxomab使用具有Fc区域的大型igg样双特异性抗体不同,blinatumomab是由两个单链可变片段(scFv)融合而成,通过肽连接器以灵活的方式连接(Newman和Benani2016).它已被证明可在B细胞恶性肿瘤患者中诱导持久缓解,并在费城染色体阴性复发或难治性B前体ALL成年患者的II期试验后迅速获得批准,43%(189人中有81人)的患者达到了完全血液学缓解的主要终点(Topp等人)。2014).随后的一项多机构3期试验评估了blinatumomab与重度预处理b细胞前体ALL的标准护理化疗的关系,证实该药物在这些患者中具有良好的活性,并改善了预后,包括总生存率和无进展生存率(Kantarjian et al.)。2017).
其他制剂,包括开发中的制剂
这些工程抗体的临床成功开创了治疗各种实体肿瘤恶性肿瘤新药的快速发展阶段。许多在调节细胞生长、细胞分化、细胞迁移和细胞死亡途径中不可或缺的酪氨酸激酶受体是大多数这些分子的主要靶点(Yu等。2017;Kalyankrishna和Grandis2006;Loibl和Gianni2017;Ooi等。2004;Shinojima等人。2003).这里重点列出了一些例子,表中列出了正在进行的临床试验的详细记录4.
放射
放射免疫闪烁术(RIS)和放射免疫治疗(RIT)利用肿瘤抗原的抗体特异性,结合合适的放射性同位素发射的辐射来成像恶性肿瘤(RIS),用于诊断和治疗目的。通过静脉注射放射性抗体,并分布到肿瘤细胞的抗原结合位点,在那里放射性核素将杀伤肿瘤剂量传递到肿瘤块(Larson等。2015).RIT允许同时将辐射剂量传递到多个分散的部位,这使得它能够有效地杀死已经转移到多个器官的肿瘤(Yang等。2016).传统上,RIT已被证明对血液系统恶性肿瘤有效,如非霍奇金淋巴瘤,其特征是比实体肿瘤恶性肿瘤更具有放射敏感性(Song和sgoros2011).实体肿瘤恶性肿瘤需要较高的辐射剂量来诱导肿瘤细胞凋亡,导致对放射敏感区域如肾脏、肺和骨髓的不良反应增加。然而,腔室内RIT、在RIT基础上加化疗和使用alpha发射器正被用于提高毒性较小的实体肿瘤RIT的治疗指数(Larson等。2015).常规放射免疫治疗的一个局限性是非靶正常组织的辐射暴露时间长,肿瘤与正常组织的辐射吸收剂量比差。预靶向放射免疫治疗(PRIT)的发展,首先允许肿瘤特异性抗体分布到肿瘤抗原部位,然后给药一种对肿瘤抗体具有高亲和力的小型放射性剂,限制了辐射在非靶标部位的积累(Larson等。2015).除了为肿瘤抗原和促进肿瘤细胞死亡的放射性物质提供高特异性结合位点外,还设计和使用了几种双特异性抗体作为RIT的预靶点。一种靶向上皮糖蛋白−1抗原(EGP-1或TROP-2)和组胺琥珀酰甘氨酸(HSG)的三价双特异性抗体TF12,与黄体素177标记肽一起用于前列腺癌PRIT时,在小鼠临床前研究中显示出有效的靶向性和通透性(van Rij等。2014).有许多正在进行的临床试验研究双特异性抗体在实体瘤RIT中的作用。结直肠癌[NCT00185081], [NCT02587247], [NCT000860860], HER2阴性乳腺癌[NCT01730612],肺癌[NCT01221675] (No Title。clinicaltrials.gov留言。).
靶向癌胚抗原(CEA)
试验正在研究CD3与肿瘤抗原CEA联合的双特异性靶向性,CEA在胃肠道恶性肿瘤、非小细胞肺癌(NSCLC)、乳腺癌、子宫癌和膀胱癌中高度表达[NCT02324257], [NCT01284231] (No Title)。clinicaltrials.gov留言。).CEA也被用作DNL TF2抗体的靶点,其二价结合CEA和单价结合肽半抗原组胺琥珀酰甘氨酸(HSG)。与上述TF12格式类似,TF2抗体首先与CEA结合,然后给予携带放射性核素的HSG肽,可用于肿瘤成像或向肿瘤细胞传递辐射[NCT00895323], [NCT01730612], [NCT01221675] (No Title)。clinicaltrials.gov留言。).最近的一项研究比较了使用TF2和Ga-IMP-288的预靶向免疫pet与常规免疫pet18FDG PET比免疫PET更敏感18FDG PET (67% vs 31%)用于原位小鼠模型结肠肝病变的检测(Foubert等。2018).
靶向MET和EGFR
受体酪氨酸激酶MET是非小细胞肺癌(NSCLC)中最常见的失调癌基因之一,MET基因扩增已被证明是癌症对EGFR抑制剂产生耐药性的主要机制(Bean等。2007).仅针对MET的III期研究未能显示NSCLC的临床获益(Baldacci等。2017),但使用双特异性抗体对MET和EGFR进行双重靶向是有希望的(Tang等。2008;Castoldi等人。2013),目前正在NSCLC中探索[NCT02609776](无标题。clinicaltrials.gov留言。)和其他实体肿瘤[NCT02221882](无标题。clinicaltrials.gov留言。).然而,其他研究如MEHGAN研究提供了明确的临床证据,驳斥了这一假设(Fayette et al。2016).
EGFRvIII是EGFR的重排变体,在多形性胶质母细胞瘤(GBM)中经常表达,与不良预后相关,也在乳腺癌和肺癌中发现,最近发现在胶质瘤干细胞系中表达(Emlet等。2014).在体内,一种结合CD3和EGFRvIII的双scfv已在患有EGFRvIII脑内肿瘤的小鼠中显示出疗效、特异性和效力,并可能在这种高度致命和难以治疗的恶性肿瘤中具有前景(Gedeon等。2013).Engeneic公司设计的另一种靶向EGFR的新方法是细菌衍生的纳米细胞,表面包裹有双特异性抗体,可以与化疗(如阿霉素或mRNA)包装在一起。双特异性抗体涂层允许特异性的某些肿瘤抗原,如EGFR和限制毒性正常细胞。化疗或mRNA有效载荷被直接释放到肿瘤细胞中,增加了治疗剂的效力(Shah等。2016).有几项I期试验研究了这些分子在EGFR阳性的CNS肿瘤和实体肿瘤中的疗效[NCT02766699, NCT02687386](无标题。clinicaltrials.gov留言。).
针对EpCAM
除了上面描述的catumaxomab,许多其他靶向EpCAM的分子已经在临床试验中进行了探索。体外研究表明,结合CD3并靶向EpCAM的Solitomab (MT110)增加了多种EpCAM阳性卵巢癌和子宫内膜癌细胞系(包括卵巢癌肉瘤和原发性子宫浆液性乳头状癌)中肿瘤细胞对细胞毒性T细胞死亡的敏感性。2016;English等人。2014).2015年完成了一项开放标签多中心剂量递增一期研究,但结果尚未发表[NCT00635596](无标题。clinicaltrials.gov留言。).
针对HER 2
Ertumaxomab是一种靶向HER/neu、CD3和Fc受体的三功能双特异性药物,在I期转移性乳腺癌患者的临床试验中,放射学证实了临床反应和安全性,II期的早期结果也很有希望(Haense等。2016;视图等。2008).然而,II期临床试验因资金原因被主办方终止。一项I/II期临床试验目前正在招募患者,以研究MCLA-128在HER2阳性乳腺癌和其他恶性实体瘤中双特异性靶向HER2和HER3的潜在影响[NCT02912949] (No Title)。clinicaltrials.gov留言。).另一项I期试验正在评估人源抗体ZW25 [NCT02892123]在HER 2阳性乳腺癌中HER 2细胞外区域的双特异性靶向。clinicaltrials.gov留言。).虽然HER2已被证明是乳腺癌的有效靶点,但临床前研究表明,在转移性去势抵抗性前列腺癌中靶向HER2和CD3 T细胞可能是一种有效的策略(Vaishampayan等人)。2015).
靶向粘蛋白-1 (muc1)
muc1是一种存在于许多腺癌表面的膜蛋白,在抑制p53肿瘤抑制基因中起作用(Wei et al。2007;Kwak等人。2010).以前针对正常组织Muc1的单克隆抗体治疗是无效的,但最近针对肿瘤Muc1的进展在单克隆抗体研究和CAR-T细胞定向治疗中有希望(Danielczyk等。2006;波西等人。2016).在异种移植模型中,MUC-1和CD16双特异性靶向介导NK细胞毒性细胞靶向肿瘤细胞已显示出有效的肿瘤抑制(Li等。2018).一种新型PD-1抑制剂诱导的细胞因子诱导的杀伤细胞(CIKs)与抗muc 1和抗CD3双特异性抗体混合,目前正在多项临床试验中研究,用于治疗晚期实体肿瘤[NCT03540199]、[NCT03524261]、[NCT03501056]、[NCT03524274]、[NCT03509298] (No Title)。clinicaltrials.gov留言。).该双特异性抗体与肿瘤细胞CIK上的CD3和MUC1结合,使CIK与肿瘤细胞交联,促进有效的肿瘤细胞裂解。
靶向前列腺特异性膜抗原(PSMA)
PSMA主要在前列腺癌细胞和大多数实体瘤的新生血管中表达,是前列腺癌患者的共同靶点(Rajasekaran2005).在临床前小鼠研究中,一种针对PSMA的双特异性diabdidy联合抗CD3抗体可降低前列腺特异性抗原水平,抑制肿瘤生长并延长生存期(Bühler等。2008).
针对免疫检查点分子
最近报道了一种同时阻断免疫检查点分子的有趣策略,如细胞毒性t淋巴细胞抗原-4 (CTLA4)或程序性死亡-1 (PD-1)或其配体(PD-L1)和转化生长因子-β (TGF-β),后者使用双功能抗体配体陷阱介导免疫耐受(Ravi et al.)。2018).其中一种新型DART双特异性抗体FS118同时抑制两种检查点分子,PDL-1和淋巴细胞激活基因3蛋白(LAG3),目前正在晚期实体瘤恶性患者中进行I期试验[NCT03440437] (No Title)。clinicaltrials.gov留言。).这些药物可能潜在地提高检查点抑制在各种实体肿瘤中的疗效,传统上单一治疗受到限制。
Bi和三特异性T细胞和自然杀伤细胞接合物
在免疫治疗中利用自然杀伤细胞的创新技术引入了双特异性杀伤细胞接合器(BiKEs)和三特异性杀伤细胞接合器(TriKEs)的概念。bike是由对抗cd16(自然杀伤细胞上的抗原)的单链可变片段(Fv)和对抗肿瘤相关抗原(Rezvani和Rouce)的单链可变片段(Fv)融合而成2015).TriKEs是对抗CD16的单链Fv和两种肿瘤相关抗原的组合。这些分子通过CD 16直接触发NK细胞活化,放大NK细胞的细胞溶解活性和针对各种肿瘤细胞抗原靶点的细胞因子产生(Gleason等。2012).这些药物目前正在进行临床前研究,安全性仍然是一个问题,可能会引发细胞因子级联(Tay等。2016).
靶向其他肿瘤相关抗原
在单克隆抗体定向治疗中研究过的其他肿瘤相关抗原目前正在研究用于双特异性治疗。其中一些有希望的靶抗原不仅是肿瘤标志物,而且是肿瘤细胞存活和增殖所必需的分子。例如,一种针对黑色素瘤相关硫酸软骨素蛋白聚糖(MCSP)和针对死亡受体5 (DR5, TRAIL-R2)的双特异性抗体可以选择性和有效地杀死黑色素瘤细胞。这种方法可能对那些对单克隆抗体治疗有耐药性的患者有益(He et al。2016).除了靶向T细胞上的共刺激分子CD28外,单链双特异性形式rM28也靶向黑素瘤相关蛋白聚糖重组,显示肿瘤细胞的杀伤不需要额外的TCR/ CD3刺激(Grosse-Hovest等。2003).P- Cadherin是一种细胞间黏附分子,在各种实体肿瘤中表达上调,过表达与乳腺癌、卵巢癌、子宫内膜癌、结直肠癌、肝内胆管癌和胰腺癌的不良预后有关。针对P- Cadherin和CD3的DART抗体的临床前研究显示,在小鼠体内和体外实体瘤均显著消退(Fisher等。2018).辉瑞目前正在对表达非小细胞肺癌、CRC和三阴性乳腺癌(TNBC)的P-Cadherin患者进行该分子PF-06671008的剂量递增研究[NCT02659631](无标题)。clinicaltrials.gov留言。).血管内皮生长因子(VEGF)和血管生成素-2 (ang2)在肿瘤血管生成和逃逸中都是必不可少的,目前正在以各种双特异性组合形式进行研究[NCT03035253], [NCT03292783], [NCT02665416], NCT03030287] (No Title)。clinicaltrials.gov留言。).
同时靶向多种抗原
尽管大多数多特异性抗体具有两个结合位点(双特异性),但也有许多新分子具有三个或四个结合位点。例如,Castoldi等人。,最近开发了一种四价Fc含抗体(四抗),针对HER1, HER3, c-MET和IGF1R,在临床前模型中具有增强的抗肿瘤作用(Castoldi等。2016).
PsMab治疗的其他新应用
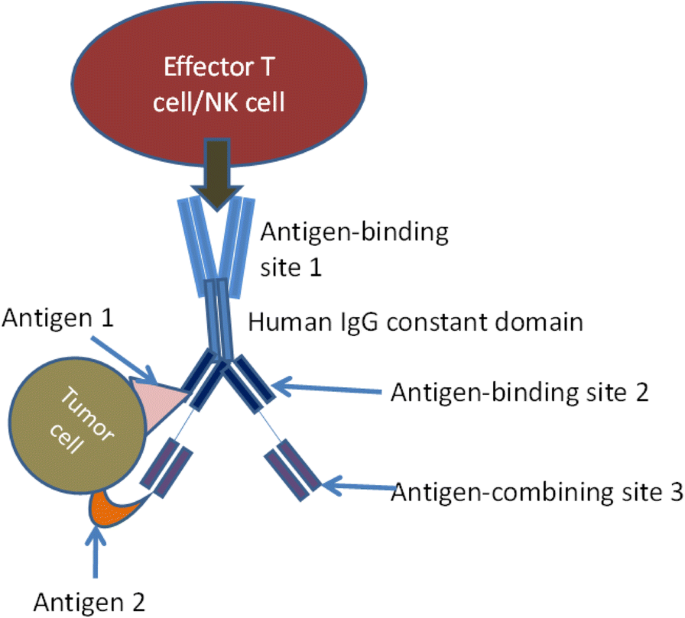
新方法如何简化治疗的另一个例子是最近的一项临床前研究,该研究证明了通过体外注射工程mRNA诱导体内产生双特异性抗体来消除大肿瘤(Holzinger et al。2016).如果适用于人类,免疫疗法的高成本可以降低到更传统药物的水平。另一种增强抗肿瘤作用的有趣方法是使用带有IL-15交联剂的三特异性抗体,可增强NK活性和抗肿瘤活性(Schmohl等。2016).如果该结构物被证明是非免疫原性的,并且具有足够的药物样特性,允许其在开发过程中向前发展,那么该制剂可能为适当的肿瘤提供有吸引力的治疗方法。典型的三特异性抗体的结构如图所示。3.).
嵌合抗原受体过继T细胞疗法
抗体定向治疗的进展同时促进了另一种形式的免疫治疗,CAR-T细胞治疗的发展。虽然深入讨论这个令人兴奋的话题超出了这篇文章的范围,因为这篇文章的重点是多特异性抗体,但我们在这里对这个话题进行了简要的回顾,并比较了两种形式的免疫治疗。CAR-T细胞疗法包括从患者体内移除T细胞,并通过基因转移进行体外修饰,使特异性受体通过抗体衍生的结合域靶向肿瘤细胞表达。一旦T细胞经过基因改造以表达嵌合抗原受体,它们就会被注入患者体内直接杀死癌细胞(图2)。2Caruana等。2014).目前,CAR -t细胞疗法在血液系统恶性肿瘤的治疗中显示出显著的抗肿瘤活性。Tisagenlecleucel是一种靶向CD19 B-细胞的CAR - t细胞疗法,于2017年8月获得FDA批准,用于治疗难治性或复发性B细胞前体急性淋巴细胞白血病儿童患者(Mullard2017).多种CAR-T药物目前正处于临床开发的晚期,用于各种血液系统恶性肿瘤(Gauthier和Yakoub-Agha)2017).相比之下,CAR - t细胞治疗实体肿瘤的成功却受到限制,因为肿瘤微环境复杂,很难找到合适的靶抗原(Gauthier and Yakoub-Agha)2017;Zeltsman等人。2017).毒性和成本也是CAR-T细胞治疗的主要问题,在各种论坛上正在积极讨论(Gauthier和Yakoub-Agha)2017;Abbasi2017).多特异性抗体可能在许多方面优于CAR-T细胞治疗,两种策略之间的主要差异列在表中5).
虽然单克隆抗体治疗和CAR - T细胞都是抗原特异性免疫治疗,但目前CAR - T细胞必须为每个患者单独制造,导致生产成本很高。尽管如此,CAR - t细胞表现出的一些特性可能使它们比抗体导向的肿瘤治疗更有优势。基因工程受体允许CAR - t细胞识别低抗原表达的肿瘤细胞并直接裂解肿瘤细胞,而经典单克隆抗体需要高密度的肿瘤抗原来触发ADCC或补体级联(Caruana et al.)。2014;Gauthier和Yakoub-Agha2017).多特异性抗体的新结构也允许增强与靶标的结合,在临床前模型中,与单克隆抗体相比,其抗癌活性显著增强(Mazor等。2017).CAR-T细胞疗法的另一个显著优势是,与单克隆抗体不同,T细胞可以自然地外渗并在组织内的内皮屏障之间移动,单克隆抗体受其大小的限制。虽然旧的双特异性结构具有与单克隆抗体相同的缺点,但较新的形式可以比经典的免疫球蛋白更小,允许更好的分布,但通常具有较短的血浆半衰期(Brinkmann和Kontermann2017).就活性持续时间而言,基因工程CAR-T细胞的有限数据表明,如果建立了记忆池,这些细胞可能能够在体内扩张,并导致对治疗的延长反应(Caruana等。2014).这是否是一种长期的优势尚不清楚,因为在血液学研究中已经注意到缺乏靶标表位的肿瘤复发。相反,大多数工程抗体的半衰期很短,需要多次剂量才能确保有效治疗,但在一些较新的结构中,也通过添加FC成分或对分子进行化学修饰来临时调整。
结论
基于抗体的癌症定向治疗是一个令人兴奋和迅速发展的领域。单克隆抗体(如利妥昔单抗)的引入彻底改变了癌症治疗,并让位于双特异性和三特异性抗体的创造,这些抗体比它们的前辈工作得更精确和有效。目前批准的双特异性抗体疗法blinatumomab和catumaxomab已显示出提高癌症患者亚群的生存率和生活质量。目前正在临床试验中评估多种药物,同时正在确定最佳结构和治疗算法,以使效益-风险比最大化。同时针对检查点分子和癌症特异性抗原的新方法在临床前模型中似乎很有前景,并可能改变癌症治疗的前景(Junttila等。2014;Hong等人。2018).
在对肿瘤生物学及其复杂微环境的理解中,仍然缺少一些生物学参数。随着癌症研究不断攀升到新的高度,工程多特异性抗体很可能在肿瘤治疗中发挥重要作用。
缩写
- ADCC:
-
抗体依赖细胞介导的细胞毒性
- CA:
-
癌抗原
- 汽车:
-
嵌合抗原受体
- CD:
-
分化簇
- 东航:
-
癌胚抗原
- 背景:
-
脱氧核糖核酸
- 博士:
-
死亡受体
- 表皮生长因子:
-
表皮生长因子
- 表皮生长因子受体:
-
表皮生长因子受体
- 舰队指挥官:
-
片段可结晶的
- 食品药品监督管理局:
-
食品和药物管理局
- 她:
-
人上皮生长因子受体
- HLA:
-
人白细胞抗原
- IGF1R:
-
胰岛素生长因子1受体
- IL:
-
白介素
- 满足:
-
间充质-上皮过渡因子
- 信使rna:
-
信使核糖核酸
- 英国:
-
国家临床试验
- NK:
-
自然杀伤细胞
- TRAIL-R:
-
肿瘤坏死因子相关凋亡诱导配体受体
参考文献
在FDA批准文件中,又一名CAR-T疗法患者死亡。《美国医学协会杂志》上。2017; 317:2271。
李国强,李志强,等。met驱动的EGFR酪氨酸激酶抑制剂耐药的EGFR突变NSCLC患者的结果Oncotarget。2017;8:105103-14。https://doi.org/10.18632/oncotarget.21707.
鲍曼K, Pfisterer J,温伯杰P,等。三功能双特异性抗体Catumaxomab腹腔内治疗铂耐药上皮性卵巢癌患者:AGO研究组IIa期研究妇科杂志,2011;123:27-32。https://doi.org/10.1016/j.ygyno.2011.06.004.
黄志强,李志强,李志强,等。在获得性对吉非替尼或厄洛替尼耐药的EGFR突变肺肿瘤中,无论有无T790M突变,都会发生MET扩增。自然科学进展,2007;26(3):344 - 344。https://doi.org/10.1073/pnas.0710370104.
贝龙S,布莱克J,英格尔DP,等。Solitomab是一种EpCAM/CD3双特异性抗体构建物(BiTE),在体外对原发性子宫浆液性乳头状癌细胞株具有高度活性。中华妇产科杂志。2016;214:99.e1-8。https://doi.org/10.1016/j.ajog.2015.08.011.
李国强,李国强。用工程单克隆抗体治疗癌症。《癌症杂志》2006;1:47 - 57。
布林克曼U, Kontermann RE.双特异性抗体的制备。马伯。2017; 9:182 - 212。
Bühler P, Wolf P, Gierschner D,等。一种针对前列腺特异性膜抗原和CD3的双特异性diabdidy诱导t细胞介导的前列腺癌细胞裂解。中华癌症杂志,2008;57:43-52。https://doi.org/10.1007/s00262-007-0348-6.
Caruana I, Diaconu I, Dotti G.从单克隆抗体到嵌合抗原受体用于治疗人类恶性肿瘤。谢明·翁科。2014;41:661-6。
王志强,王志强,等。一种新的EGFR/met双特异性抗体阻断了由EGFR抑制抗性诱导的肿瘤促进表型效应,并具有强大的抗肿瘤活性。致癌基因。2013;32:5593 - 601。https://doi.org/10.1038/onc.2013.245.
王晓明,王晓明,王晓明,等。TetraMabs:同时靶向四种致癌受体酪氨酸激酶抑制异质性肿瘤细胞群中的肿瘤生长。蛋白质工程学报,2016;29:467-75。https://doi.org/10.1093/protein/gzw037.
李志强,李志强,李志强,等。PankoMab:新一代抗肿瘤MUC1抗体。癌症免疫。2006;55:1337-47。https://doi.org/10.1007/s00262-006-0135-9.
李志强,李志强,李志强,等。靶向由EGF受体变体III定义的胶质母细胞瘤癌症干细胞群。癌症决议2014;74:1238-49。https://doi.org/10.1158/0008-5472.CAN-13-1407.
李志强,李志强,李志强,等。Solitomab是一种上皮细胞粘附分子/CD3双特异性抗体(BiTE),在体外对原发性化疗耐药卵巢癌细胞系和体外新鲜肿瘤细胞具有高度活性。癌症。2014;121(3):403 - 12所示。https://doi.org/10.1002/cncr.29062.
范刚,王震,郝敏,李娟。双特异性抗体及其应用。中华血液病杂志,2015;8:414。https://doi.org/10.1186/s13045-015-0227-0.
费耶特J, Wirth L, Oprean C,等。Duligotuzumab (MEHD7945A)与西妥昔单抗治疗头颈部鳞状细胞癌的随机II期研究(MEHGAN研究)。Front Oncol, 2016;6:232。https://doi.org/10.3389/fonc.2016.00232.
费希尔TS,胡珀AT,卢卡斯J,等。一种cd3双特异性分子靶向p -钙粘蛋白,证明T细胞介导的小鼠实体肿瘤消退。中国生物医学工程杂志,2018;https://doi.org/10.1007/s00262-017-2081-0.
福伯特F, Gourard S,赛-莫雷尔C, Cherel M, faire - chauvet A, Gldenberg d。Oncotarget。2018;9:27502-13。
t细胞治疗实体性恶性肿瘤的进展。临床癌症决议2015;21:3384-92。
弗兰普顿我。Catumaxomab:恶性腹水。药。2012;72:1399 - 410。https://doi.org/10.2165/11209040-000000000-00000.
Gauthier J, Yakoub-Agha I.嵌合抗原受体t细胞治疗恶性血液病和实体瘤:迄今为止的临床数据,目前的局限性和前景。中国医学杂志,2017;65:93-102。
Gedeon PC, Choi BD, Hodges TR,等。egfrviii靶向的双特异性t细胞接合物克服了胶质母细胞瘤护理标准的限制。《临床药典》2013;6:375-86。
格里森MK, Verneris MR, Todhunter DA,等。双特异性和三特异性杀伤细胞接合子通过CD16信号直接激活人类NK细胞,并诱导细胞毒性和细胞因子的产生。中华癌症杂志2012;11:2674-84。https://doi.org/10.1158/1535-7163.MCT-12-0692.
葛洛斯-霍韦斯特L,哈特拉普I,马尔万W,等。一种重组双特异性单链抗体诱导靶向的超激动性cd28刺激和肿瘤细胞杀伤。中华免疫杂志2003;33:1334-40。https://doi.org/10.1002/eji.200323322.
李志强,李志强,李志强,等。三功能抗Her2 ×抗CD3抗体ertumaxomab在晚期实体瘤患者中的I期试验BMC癌症,2016;16:420。https://doi.org/10.1186/s12885-016-2449-0.
He Y, Hendriks D, van Ginkel R,等。使用针对MCSP和TRAIL受体-2/死亡受体-5的双特异性抗体,黑素瘤定向的细胞凋亡激活。J Invest Dermatol. 2016; 136:541-4。https://doi.org/10.1016/j.jid.2015.11.009.
王晓明,王晓明,王晓明,等。三功能抗体catumaxomab用于治疗上皮性癌引起的恶性腹水:前瞻性随机II/III期试验的结果国际癌症杂志,2010;127:2209-21。https://doi.org/10.1002/ijc.25423.
Henricks LM, Schellens JH, Huitema AD, Beijnen JH。单克隆抗体组合在临床肿瘤学中的应用。癌症治疗Rev. 2015; 41:859-67。https://doi.org/10.1016/j.ctrv.2015.10.008.
Holliger P, Winter G.工程双特异性抗体。生物技术,1993;4:446-9。https://doi.org/10.1016/0958 - 1669 (93) 90010 - t.
霍尔辛格A,巴登M,阿布肯H.不断增长的世界的CAR - T细胞试验:一个系统的回顾。癌症免疫,2016;65:1433-50。
洪瑞,周勇,田霞,等。选择性抑制IDO1, d -1-甲基色氨酸(D-1MT),通过增强免疫细胞活性,有效提高EpCAM/ cd3双特异性BiTE抗体MT110对IDO1乳腺癌的疗效。国际免疫药监学杂志2018;54:118-24。https://doi.org/10.1016/j.intimp.2017.10.008.
李志强,李志强,等。靶向HER2并激活T细胞的双特异性抗体的抗肿瘤功效。癌症决议2014;74:5561-71。https://doi.org/10.1158/0008-5472.CAN-13-3622-T.
头颈癌中表皮生长因子受体生物学研究。中华临床医学杂志。2006;24:2666-72。https://doi.org/10.1200/JCO.2005.04.8306.
Kantarjian H, Stein A, Gökbuget N,等。Blinatumomab与化疗治疗晚期急性淋巴细胞白血病的比较。中华医学杂志。2017;36:836 - 47。https://doi.org/10.1056/NEJMoa1609783.
Karpovsky B, Titus JA, Stephany DA, Segal DM.利用含有抗靶细胞和抗fc γ受体抗体的异交联聚合体生产靶向特异性效应细胞。中华临床医学杂志,2004;https://doi.org/10.1084/jem.160.6.1686.
Kontermann RE.双特异性抗体的双靶向策略。马伯。2012; 4:182 - 97。
张志强,李志强,等。晚期妇科肿瘤相关恶性腹水的Catumaxomab门诊腹腔内治疗。肿瘤学家。2015;20:1333-41。https://doi.org/10.1634/theoncologist.2015-0076.
郭晓燕,刘永杰,张晓娟,等(2010)间变性淋巴瘤激酶在非小细胞肺癌中的抑制作用。
拉尔森SM,卡拉斯基略JA,张NKV,按OW。人类肿瘤的放射免疫治疗。癌症杂志。2015;15:347-60。
Leget GA, Czuczman ms使用美罗华,fda批准的新抗体。《中国科学》1998;10:548-51。
李勇,周超,李娟,等。基于单结构域的双特异性抗体muc1 -bi- 1及其人源形式muc1 -bi-2在muc1阳性肿瘤细胞中诱导强效癌细胞杀伤。PLoS One, 2018;13:e0191024。https://doi.org/10.1371/journal.pone.0191024.
Linke R, Klein A, Seimetz D. Catumaxomab:临床开发及未来发展方向。马伯。2010; 2:129-36。https://doi.org/10.4161/mabs.2.2.11221.
Loibl S, Gianni L., her2阳性乳腺癌。《柳叶刀》杂志。2017;389:2415-29。
李志强,李志强,李志强,等。T细胞依赖性双特异性抗体的相对靶标亲和性决定实体肿瘤小鼠模型中的生物分布。Mol Cancer Ther, 2018, 2017。https://doi.org/10.1158/1535-7163.MCT-17-0657.
杨春梅,杨春华,等。通过调节双特异性抗体结合亲和力和格式价,增强肿瘤靶向选择性。科学通报2017;7:40098。https://doi.org/10.1038/srep40098.
Mertens N, Schoonjans R, Willems A,等(2001)重组双特异性和三特异性抗体衍生物。生物医学用途化合物生产的新前沿,卷1:195 - 208。doi:https://doi.org/10.1007/0-306-46885-9_12.
FDA批准首个CAR - T疗法。中国医药杂志,2017;16:6 9。
纽曼MJ,贝纳尼DJ。一种新型免疫疗法blinatumomab综述。中国医药杂志。2016;22:639-45。https://doi.org/10.1177/1078155215618770.
不同特异性的单价抗体片段的混合重组。生物化学。1961;93:460-2。
无标题。https://neovii.com/neovii-completes-marketing-authorisation-withdrawal-of-removab-in-the-european-union/.2018年7月5日访问。
无标题。https://clinicaltrials.gov/.2018年7月20日访问。
李志强,李志强,李志强,等。在MHC i类阴性肿瘤细胞上构建双特异性单链抗体诱导规则细胞溶解T细胞突触。中华免疫杂志2006;43:763-71。https://doi.org/10.1016/j.molimm.2005.03.007.
黄岩,武hana T,李X,等。结直肠癌中HER-2和EGFR蛋白过表达和基因扩增:免疫组织化学和荧光原位杂交研究《现代病理学》2004;17:895-904。https://doi.org/10.1038/modpathol.3800137.
李国强,李国强,等。结合抗靶细胞抗体的抗t3特异性靶向细胞毒性T细胞。大自然。1985;316:354-6。https://doi.org/10.1038/316354a0.
Posey AD, Schwab RD, Boesteanu AC,等。靶向膜粘蛋白MUC1的癌症相关tn -糖型的工程CAR - T细胞控制腺癌。免疫力。2016;44:1444-54。https://doi.org/10.1016/j.immuni.2016.05.014.
前列腺特异性膜抗原是多功能蛋白吗?癌症。2015;121(3):403 - 12所示。https://doi.org/10.1002/cncr.29062.
王志强,王志强,等。双功能免疫检查点靶向抗体配体陷阱,同时使TGFβ失效,增强癌症免疫治疗的疗效。Nat Commun. 2018;9:741。https://doi.org/10.1038/s41467-017-02696-6.
Rezvani K, Rouce RH。自然杀伤细胞免疫疗法在癌症治疗中的应用。前沿免疫。2015;6:578。
罗斯,谢尔曼,麦克尔罗伊,等。双特异性T细胞接合器(BiTE®)抗体构建可以介导旁观者肿瘤细胞杀伤。PLoS One. 2017;12:e0183390。https://doi.org/10.1371/journal.pone.0183390.
Rossi EA, Goldenberg DM, Cardillo TM,等。通过锁定法制成的用于癌症靶向的固定组合的稳定系留多功能结构。自然科学进展,2006;23(3):344 - 344。https://doi.org/10.1073/pnas.0600982103.
李志强,李志强,李志强,等。通过基因插入修饰的IL-15交联剂增强ADCC和NK细胞对抗癌双特异性抗体的激活。Mol Ther, 2016; 24:1312-22。https://doi.org/10.1038/mt.2016.88.
Sedykh SE, Prinz VV, Buneva VN, Nevinsky GA。双特异性抗体:设计,治疗,前景。药物与健康杂志,2018;12:195-208。
Segal DM, Weiner GJ, Weiner LM。癌症治疗中的双特异性抗体。中华免疫杂志1999;11:558-62。
Seimetz D. Catumaxomab (Removab):从临床前开发到批准之路中国生物医学杂志2009;32(2):344 - 344。
用于癌症治疗的新型单克隆抗体:三功能抗体catumaxomab (Removab®)。中华癌症杂志2011;2:309-16。
Shah MY, Ferrajoli A, Sood AK等。microRNA治疗癌症-一个新兴的概念。EBioMedicine。2016; 12:34-42。
肖志刚,王志刚,王志刚,等。表皮生长因子受体在多形性胶质母细胞瘤患者中的预后价值。癌症决议2003;63:6962-70。https://doi.org/10.1158/0008-5472.can-04-1337.
Siegel R.癌症统计,2017。癌症杂志2017;67:7-30。https://doi.org/10.3322/caac.21387.
宋海涛,宋志强,李志强。实体瘤放射免疫治疗的研究进展。Curr Drug Deliv. 2011; 8:26-44。https://doi.org/10.2174/156720111793663651.
间谍C,翟Q,卡特PJ。双特异性抗体的替代分子形式和治疗应用。中华免疫杂志2015;67:95-106。
斯泰尔兹UD,神奈川O,贝文MJ。混合抗体可以靶向T细胞攻击的部位。大自然。1985;314:628-31。https://doi.org/10.1038/314628a0.
唐智,杜锐,姜松,等。双MET-EGFR联合抑制t790m - egfr介导的厄洛替尼耐药肺癌中华肿瘤学杂志,2008;https://doi.org/10.1038/sj.bjc.6604559.
Tay SS, Carol H, Biro M. TriKEs和BiKEs在癌症免疫治疗高速公路上加入CARs。Hum Vaccines Immunother. 2016; 12:2790-6。
Topp MS, Gökbuget N, Zugmaier G,等。抗cd19双特异性T细胞接触剂blinatumomab的II期试验显示,复发或难治性b前体急性淋巴细胞白血病患者的血液学和分子缓解。中华临床杂志。2014;32:4134-40。https://doi.org/10.1200/JCO.2014.56.3247.
王晓东,王晓东,王晓东,等。抗cd3 x抗her2双特异性抗体在转移性去势抵抗性前列腺癌患者中的i期研究。前列腺癌。2015;https://doi.org/10.1155/2015/285193.
范里杰,傅林克,高登堡,等。用抗trop - 2xanti - hsg双特异性抗体和(177)lu标记肽对前列腺癌进行预靶向放射免疫治疗。癌症生物放射药物。2014;29:323-9。https://doi.org/10.1089/cbr.2014.1660.
查看FT, Gmbh FB, Biotech F,等(2008)三功能抗体Ertumaxomab治疗曲妥珠单抗治疗进展后转移性乳腺癌的II期研究。ClinicaltrialsGov 1/1/2008-12/1/2009。
魏晓霞,徐红,郭晓东,等。人粘蛋白1抑制肿瘤抑制基因p53转录的研究。癌症决议2007;67:1853-8。https://doi.org/10.1158/0008-5472.CAN-06-3063.
怀特CA,伯尔费恩JR,格里洛-洛佩兹AJ。抗体靶向免疫疗法治疗非霍奇金淋巴瘤。生物技术。2000;1:303-12。https://doi.org/10.2174/1389201003378889.
杨峰,文伟,秦伟。双特异性抗体作为新概念和治疗策略的发展平台。中国药理学杂志,2016;18:48。https://doi.org/10.3390/ijms18010048.
于珊,李安,刘强,等。实体瘤双特异性抗体的研究进展。中华血液学杂志,2017;10:457。https://doi.org/10.1186/s13045-017-0522-z.
张志刚,张志刚,张志刚,等。CAR - t细胞治疗肺癌和恶性胸膜间皮瘤。翻译res 2017; 187:1-10。
张旭,杨勇,范东,熊东。双特异性抗体的研制及其在肿瘤免疫逃逸中的应用。《血液学杂志》2017;6:12。
茹科夫斯基EA,莫尔斯RJ,鼠MV。双特异性抗体和CARs:利用T细胞重定向的广义免疫疗法。Curr Opin immune . 2016; 40:24-35。
资金
详情见经费部分。
数据和材料的可用性
文中提到的所有引用都在“引用部分”中列出,并附有可用的标识符。正在进行的临床试验通过clinicaltrials.gov获得,并按NCT编号列出。
作者信息
作者及隶属关系
贡献
所有作者对这份手稿的贡献相同。所有作者均已阅读并批准最终稿。
相应的作者
道德声明
伦理批准并同意参与
不适用。
发表同意书
不适用。
相互竞争的利益
作者宣称他们之间没有利益冲突。
出版商的注意
伟德体育在线施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
权利和权限
开放获取本文根据创作共用属性4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),允许在任何媒介上不受限制地使用、分发和复制,前提是您对原作者和来源给予适当的赞扬,提供到创作共用许可证的链接,并注明是否进行了更改。创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)除另有说明外,适用于本条所提供的资料。
关于本文
引用本文
朗西,K.,布德曼,d.r.,约翰,V。et al。双特异性抗体和三特异性抗体-实体肿瘤治疗的下一个大事件。摩尔地中海24, 50(2018)。https://doi.org/10.1186/s10020-018-0051-4
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s10020-018-0051-4
关键字
- 双特异性抗体
- Trispecific抗体
- 免疫疗法
- 固体肿瘤