- 研究文章gydF4y2Ba
- 开放获取gydF4y2Ba
- 发表:gydF4y2Ba
一个正反馈调节回路,SA-gydF4y2BaAtNAPgydF4y2Ba-gydF4y2BaSAG202 / SARD1gydF4y2Ba-gydF4y2BaICS1gydF4y2Ba-SA,在SA生物合成中参与叶片衰老,但不参与防御反应gydF4y2Ba
分子园艺gydF4y2Ba体积gydF4y2Ba2gydF4y2Ba,文章号:gydF4y2Ba15gydF4y2Ba(gydF4y2Ba2022gydF4y2Ba)gydF4y2Ba
摘要gydF4y2Ba
水杨酸(Salicylic acid, SA)是调节植物防御反应和叶片衰老的重要激素。因此,有必要了解调控SA生物合成基因的上游因子。SAG202/SARD1是关键的调节因子gydF4y2Ba等chorisate合成酶1gydF4y2Ba(gydF4y2BaICS1gydF4y2Ba)在防御反应中的诱导和SA生物合成。叶片衰老过程中SA生物合成的调控机制尚不清楚。在这里,我们表明AtNAP,衰老特异性NAC家族转录因子,直接调控衰老相关基因命名gydF4y2BaSAG202gydF4y2Ba如酵母单杂交和gydF4y2Ba在足底gydF4y2Ba化验。可诱导的过度表达gydF4y2BaAtNAPgydF4y2Ba而且gydF4y2BaSAG202gydF4y2Ba导致高水平的SA和叶片早衰。的个体敲除突变体gydF4y2Basag202gydF4y2Ba而且gydF4y2Baics1gydF4y2Ba显著降低SA水平,显着延迟叶片衰老表型。此外,SA正反馈调节gydF4y2BaAtNAPgydF4y2Ba而且gydF4y2BaSAG202gydF4y2Ba.我们的研究发现了一个独特的正反馈调节回路,SA-gydF4y2BaAtNAPgydF4y2Ba-gydF4y2BaSAG202gydF4y2Ba-gydF4y2BaICS1gydF4y2Ba-SA,其作用是控制与叶片衰老相关的SA生物合成,而不是防御反应。gydF4y2Ba
核心gydF4y2Ba
一个独特的正反馈调节回路,SA-gydF4y2BaAtNAPgydF4y2Ba-gydF4y2BaSAG202 / SARD1gydF4y2Ba-gydF4y2BaICS1gydF4y2Ba-SA在拟南芥中通过调控SA生物合成调控叶片衰老。尽管作为循环的一部分,gydF4y2BaSAG202 / SARD1gydF4y2Ba-gydF4y2BaICS1gydF4y2Ba-SA是由防御反应共享的,整个循环对病原体的攻击没有反应。gydF4y2Ba
基因和登录号gydF4y2Ba
本文的序列数据可在GenBank/EMBL数据库中找到,登录号如下:gydF4y2BaSAG202gydF4y2Ba,gydF4y2BaSARD1gydF4y2Ba), at4g10500 (gydF4y2BaS3HgydF4y2Ba),电话1g69490 (gydF4y2BaAtNAPgydF4y2Ba), at1g74710 (gydF4y2BaICS1gydF4y2Ba), at1g18870 (gydF4y2BaICS2gydF4y2Ba), at5g26920 (gydF4y2BaCBP60ggydF4y2Ba)及AT3G18780 (gydF4y2BaActin2gydF4y2Ba,gydF4y2BaACT2gydF4y2Ba).gydF4y2Ba
简介gydF4y2Ba
水杨酸(SA, 2-羟基苯甲酸)在植物生长和生理过程的许多方面如防御反应、产热、种子萌发、开花和衰老的调节中起着关键作用(Raskin,gydF4y2Ba1992gydF4y2Ba;Rivas-San Vicente和Plasencia,gydF4y2Ba2011gydF4y2Ba).一般认为植物中SA的生物合成途径有两条:等chorismate (IC)途径和苯丙氨酸氨解酶(PAL)途径(Métraux,gydF4y2Ba2002gydF4y2Ba;Chen等人,gydF4y2Ba2009 bgydF4y2Ba).在拟南芥中,IC通路参与了病原菌和紫外光诱导的大部分SA生成(Garcion et al.,gydF4y2Ba2008gydF4y2Ba;Dempsey等人,gydF4y2Ba2011gydF4y2Ba).虽然两个基因,即gydF4y2Ba等chorisate合成酶1gydF4y2Ba(gydF4y2BaICS1gydF4y2Ba),gydF4y2BaICS2,gydF4y2Ba参与IC通路中的等chorisate合成,gydF4y2BaICS1gydF4y2Ba约占病原体或紫外线反应产生的等chorisate总量的90% (Surplus et al.,gydF4y2Ba1998gydF4y2Ba;Wildermuth等人,gydF4y2Ba2001gydF4y2Ba;Garcion等人,gydF4y2Ba2008gydF4y2Ba).已知SA水平随着叶片衰老的进展而增加(Morris et al.,gydF4y2Ba2000gydF4y2Ba;Zhang等人,gydF4y2Ba2013gydF4y2Ba;Zhang等人,gydF4y2Ba2017 bgydF4y2Ba);然而,IC通路是否在叶片衰老过程中起作用尚不清楚。gydF4y2Ba
SA生物合成的调控以及SA信号在对抗病原体的局部和全身获得性抗性(LAR和SAR)反应中的作用已被深入研究(Shirasu等人,gydF4y2Ba1997gydF4y2Ba;Dangl,gydF4y2Ba1998gydF4y2Ba;沙,gydF4y2Ba2003gydF4y2Ba).乙烯不敏感3 (EIN3)和EIN3样1 (EIL1)抑制gydF4y2BaICS1gydF4y2Ba负向调节SA生物合成(Chen et al.,gydF4y2Ba2009年,一个gydF4y2Ba),以及两个密切相关的转录因子calmodulin binding protein 60g (CBP60g)和systemic acquired resistance deficient 1 (SARD1)结合在cdna启动子的核心序列5'GAAATTTTGG3 '上gydF4y2BaICS1gydF4y2Ba正向调节sar相关SA的产生(Zhang et al.,gydF4y2Ba2010年,一个gydF4y2Ba).基因表达谱显示,5'GAAATT3 '基序在SARD1和CBP60g假定靶基因的启动子中显着过度代表(Truman和Glazebrook,gydF4y2Ba2012gydF4y2Ba).SARD1和CBP60g在功能上部分冗余(Zhang et al.,gydF4y2Ba2010 bgydF4y2Ba;Wang等人,gydF4y2Ba2011gydF4y2Ba).调控表达的上游因子gydF4y2BaSARD1gydF4y2Ba而且gydF4y2BaCBP60ggydF4y2Ba但目前尚不清楚叶片衰老过程中SA生物合成的调控机制。gydF4y2Ba
叶片衰老是一种基因编程的细胞自杀过程,伴随着细胞消耗过程中释放的营养物质被动员到活跃的生长区域、种子或树干(Gan和Amasino,gydF4y2Ba1997gydF4y2Ba;Guo等人,gydF4y2Ba2021gydF4y2Ba).衰老的调控相当复杂,它涉及数千个与衰老相关的基因的激活(gydF4y2Ba凹陷gydF4y2Bas)和/或许多衰老下调基因失活(Guo et al.,gydF4y2Ba2004gydF4y2Ba;郭和甘,gydF4y2Ba2012gydF4y2Ba).tf已被证明在调节中具有关键作用gydF4y2Ba凹陷gydF4y2Ba表达与叶片衰老。例如,gydF4y2BaAtNAPgydF4y2Ba是NAC家族的一个TF基因,它是叶片衰老的主要调控因子gydF4y2BaatnapgydF4y2Banull突变体显示叶片衰老延迟10天,而其在幼叶中的诱导表达容易导致早熟衰老(Guo和Gan,gydF4y2Ba2006gydF4y2Ba).NAP在小麦叶片衰老中的作用已得到证实(Uauy et al.,gydF4y2Ba2006gydF4y2Ba)、玉米(Zhang et al.,gydF4y2Ba2012 bgydF4y2Ba)、大米(Liang et al.,gydF4y2Ba2014gydF4y2Ba)、棉花(Fan et al.,gydF4y2Ba2015gydF4y2Ba),桃子(李等,,gydF4y2Ba2016gydF4y2Ba)、卷心菜(Li et al.,gydF4y2Ba2021gydF4y2Ba).gydF4y2Ba午睡gydF4y2Ba对玫瑰花瓣的衰老也有重要作用(Zou etal .,gydF4y2Ba2021gydF4y2Ba)和拟南芥果实(Kou et al.,gydF4y2Ba2012gydF4y2Ba).的直接靶基因gydF4y2BaAtNAPgydF4y2Ba对理解叶片衰老调控的分子回路具有重要意义。已知AtNAP TF直接与蛋白的启动子结合gydF4y2BaSAG113gydF4y2Ba激活衰老特异性和高尔基定位蛋白磷酸酶2C基因的表达来促进衰老(Zhang和Gan,gydF4y2Ba2012gydF4y2Ba;Zhang等人,gydF4y2Ba2012年,一个gydF4y2Ba).在拟南芥、水稻中,TF也与细胞分裂素氧化酶基因的启动子物理结合(Hu et al.,gydF4y2Ba2021gydF4y2Ba)和玫瑰(Zou et al.,gydF4y2Ba2021gydF4y2Ba)来降解延缓衰老的细胞分裂素,从而促进衰老过程。gydF4y2Ba
在这里,我们报道了一种名为衰老上调基因gydF4y2BaSAG202gydF4y2Ba(At1G73805)是一种直接靶基因gydF4y2BaAtNAPgydF4y2Ba;序列分析表明gydF4y2BaSAG202gydF4y2Ba等于gydF4y2BaSARD1gydF4y2Ba.AtNAP在物理上与启动子区结合gydF4y2BaSAG202gydF4y2Ba,但不绑定gydF4y2BaCBP60ggydF4y2Ba,gydF4y2BaSAG202gydF4y2Ba的启动子区域结合gydF4y2BaICS1gydF4y2Ba(但不gydF4y2BaICS2gydF4y2Ba),这是酵母单杂交实验的结果。淘汰赛的gydF4y2BaSAG202gydF4y2Ba而且gydF4y2BaICS1gydF4y2BaSA水平较低,叶片衰老显著延迟,而诱导过表达gydF4y2BaSAG202gydF4y2Ba导致高水平的SA和叶片过早衰老。定量PCR分析进一步表明,SA水平升高可反馈上调gydF4y2BaAtNAPgydF4y2Ba而且gydF4y2BaSAG202gydF4y2Ba.这些发现表明存在一个独特的由SA-组成的反馈调控环路gydF4y2BaAtNAPgydF4y2Ba-gydF4y2BaSAG202gydF4y2Ba-gydF4y2BaICS1gydF4y2Ba-通过调节SA生物合成来控制拟南芥叶片衰老的SA。gydF4y2Ba
结果gydF4y2Ba
SAG202gydF4y2Ba在叶片衰老过程中是否上调gydF4y2Ba
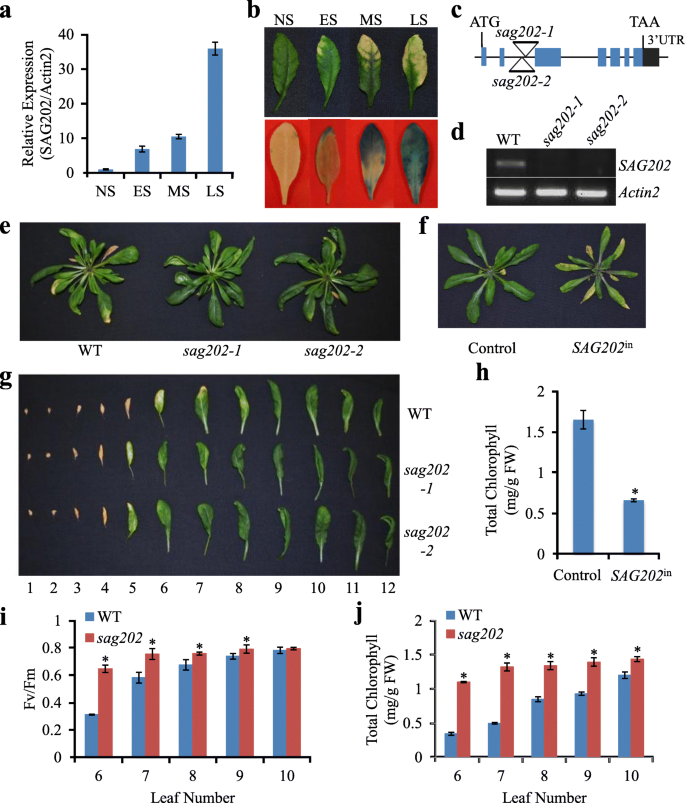
SAG202gydF4y2Ba(At1G73805)最初是在我们分析拟南芥叶片衰老转录组时发现的(Guo et al.,gydF4y2Ba2004gydF4y2Ba),后来被报道为gydF4y2BaSARD1gydF4y2Ba(Zhang等,gydF4y2Ba2010 bgydF4y2Ba;Wang等人,gydF4y2Ba2011gydF4y2Ba)(以下gydF4y2BaSAG202gydF4y2Ba使用)。转录水平gydF4y2BaSAG202gydF4y2Ba利用qPCR技术对不同衰老阶段叶片进行检测(图;gydF4y2Ba1gydF4y2Baa).进一步研究的表达模式gydF4y2BaSAG202gydF4y2Ba,gydF4y2Ba格斯gydF4y2Ba报告基因被融合到该基因2.2 kb区域的3 '端gydF4y2BaSAG202gydF4y2Ba启动子(PgydF4y2BaSAG202gydF4y2Ba).莲座叶GUS染色模式的研究gydF4y2BaSAG202gydF4y2Ba格斯gydF4y2Ba转基因拟南芥表明gydF4y2BaSAG202gydF4y2Ba在衰老叶片中表达得非常特异性(图;gydF4y2Ba1gydF4y2Bab)。gydF4y2Ba
的表型和分子分析gydF4y2BaSAG202gydF4y2Ba在拟南芥。(gydF4y2Ba一个gydF4y2Ba) qPCR分析gydF4y2BaSAG202gydF4y2Ba/gydF4y2BaSARD1gydF4y2Ba在不同发育阶段的野生型叶片中。NS,完全扩张的非衰老期;ES,早期衰老阶段(黄变< 25%);MS,衰老中期(~ 50%黄变);LS,衰老后期(> 75%发黄)。相对表达水平计算和归一化gydF4y2Ba肌动蛋白2gydF4y2Ba(gydF4y2BaACT2gydF4y2Ba)记录。误差条表示三个生物重复序列的SD。(gydF4y2BabgydF4y2Ba)对第五叶进行GUS染色gydF4y2BaPgydF4y2BaSAG202gydF4y2Ba-gydF4y2Ba格斯gydF4y2Ba不同衰老阶段的转基因植物。(gydF4y2BacgydF4y2Ba)两个细胞的T-DNA插入位置图gydF4y2Basag202gydF4y2Ba突变体。(gydF4y2BadgydF4y2Ba)的表达gydF4y2BaSAG202gydF4y2BaRT-PCR结果显示,在C突变体中被敲除。(gydF4y2BaegydF4y2Ba)年龄匹配35 DAG WT和gydF4y2Basag202gydF4y2Ba零突变体。DAG,发芽后几天。(gydF4y2BafgydF4y2Ba)早熟叶衰老gydF4y2BaSAG202gydF4y2Ba-诱导表达系(gydF4y2BaSAG202gydF4y2Ba在gydF4y2Ba或8004/7001)(照片拍摄于DEX诱导后4天)。(gydF4y2BaggydF4y2Bae中年龄匹配的35 DAG植株叶片脱落(从最老叶为1,最小叶为12,从下起计数)。(gydF4y2BahgydF4y2Ba)对照(仅含pTA7001)第5和第6叶的叶绿素含量gydF4y2BaSAG202gydF4y2Ba在gydF4y2Ba行。(gydF4y2Ba我gydF4y2Ba,gydF4y2BajgydF4y2Ba)叶绿素含量及gydF4y2BaFgydF4y2BavgydF4y2Ba/gydF4y2BaFgydF4y2Ba毫克ydF4y2Ba对野生型35 DAG植株年龄匹配的第6 ~ 10个莲座叶进行了分析gydF4y2Basag202gydF4y2Ba突变体。误差条表示三个生物重复序列的SD。*gydF4y2BaPgydF4y2Ba< 0.05采用Student 's t检验gydF4y2Ba
叶的衰老明显延迟gydF4y2Basag202gydF4y2Ba敲除突变体并过早地加速进入gydF4y2BaSAG202gydF4y2Ba诱导过表达线gydF4y2Ba
即两条T-DNA线gydF4y2Basag202-1gydF4y2Ba(SALK_052422)和gydF4y2Basag202-2gydF4y2Ba(SALK_138476C)(图。gydF4y2Ba1gydF4y2BaC)在…gydF4y2BaSAG202gydF4y2Ba被击倒(图。gydF4y2Ba1gydF4y2BaD),被用来调查的作用gydF4y2BaSAG202gydF4y2Ba在叶片衰老过程中。与野生型(WT)相比,两个敲除系在叶片衰老表型上表现出显著的延迟(图2)。gydF4y2Ba1gydF4y2Bae, g,和补充图。gydF4y2BaS1gydF4y2Ba)和生理上(图。gydF4y2Ba1gydF4y2Bai, j).因为两个基因敲除系具有相同的表型,只是gydF4y2Basag202-1gydF4y2Ba在接下来的实验中被使用,并被称为gydF4y2Basag202gydF4y2Ba为了简单起见。gydF4y2Ba
的作用gydF4y2BaSAG202gydF4y2Ba同时研究了地塞米松(DEX)诱导的pTA7001和pGL8004的功能获得系对叶片衰老的影响。pTA7001(对照)提供重组转录因子(TF) GAL4的本构表达gydF4y2Ba双相障碍gydF4y2Bavp16gydF4y2Ba广告gydF4y2Ba-GR,在转基因植物(Guo和Gan,gydF4y2Ba2006gydF4y2Ba).在pGL8004构造中,gydF4y2BaSAG202gydF4y2Ba由一个启动子驱动,该启动子包含6个串联的GAL4上游激活序列副本。当DEX(一种合成糖皮质激素)与GR结合并引起构象变化时,VP16能够激活转录gydF4y2BaSAG202gydF4y2Ba同时含有pTA7001和pGL8004的植物(gydF4y2BaSAG202gydF4y2Ba在gydF4y2Ba).如图所示。gydF4y2Ba1gydF4y2Baf和h, 30 μM DEX处理20日龄未衰老植株,导致叶片早熟衰老gydF4y2BaSAG202gydF4y2Ba在gydF4y2Ba线,但不是在控制线。qPCR分析表明gydF4y2BaSAG202gydF4y2Ba被强烈地诱导gydF4y2BaSAG202gydF4y2Ba在gydF4y2Ba而不是在对照线(图。gydF4y2Ba2gydF4y2Baf)。gydF4y2Ba
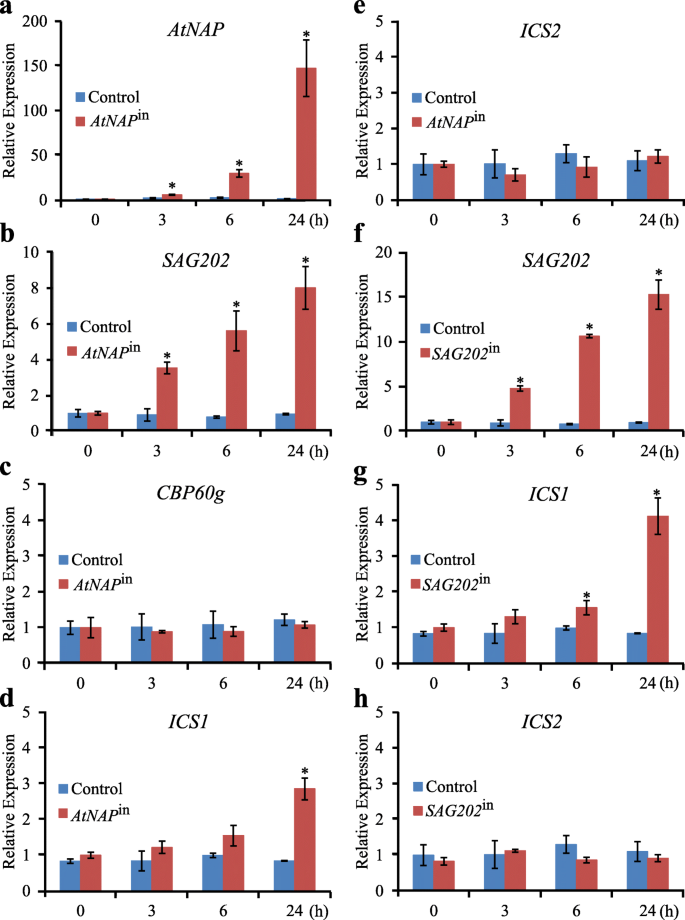
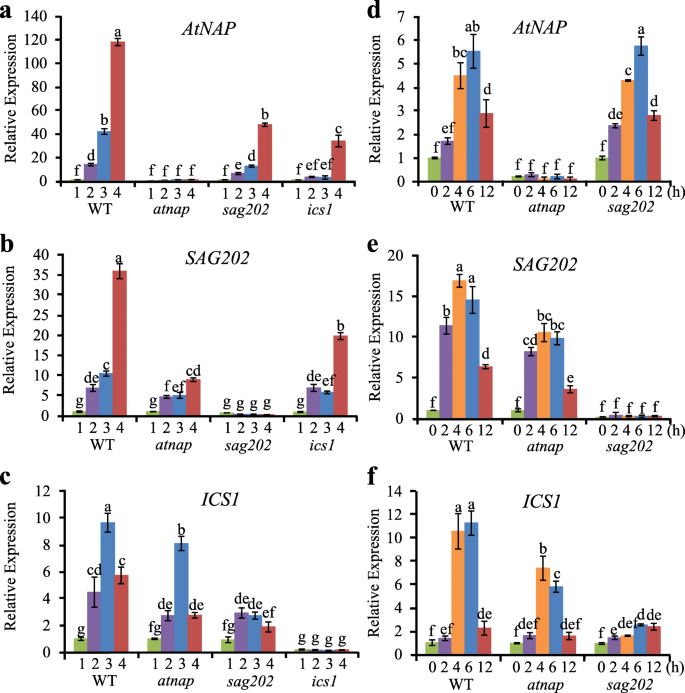
化学诱导基因表达的qPCR分析gydF4y2BaAtNAPgydF4y2Ba或gydF4y2BaSAG202gydF4y2Ba.(gydF4y2Ba一个gydF4y2Ba-gydF4y2BaegydF4y2Ba的转录水平gydF4y2BaAtNAPgydF4y2Ba,gydF4y2BaSAG202gydF4y2Ba/gydF4y2BaSARD1gydF4y2Ba,gydF4y2BaCBP60ggydF4y2Ba,gydF4y2BaICS1gydF4y2Ba而且gydF4y2BaICS2gydF4y2Ba在AtNAP诱导器中(gydF4y2BaAtNAPgydF4y2Ba在gydF4y2Ba)和对照组在DEX处理后0 h、3 h、6 h和24 h。(gydF4y2BafgydF4y2Ba-gydF4y2BahgydF4y2Ba的转录水平gydF4y2BaSAG202gydF4y2Ba,gydF4y2BaICS1gydF4y2Ba而且gydF4y2BaICS2gydF4y2Ba在gydF4y2BaSAG202gydF4y2Ba在gydF4y2BaDEX处理后0 h、3 h、6 h、24 h和对照组。相对表达水平计算和归一化gydF4y2Ba肌动蛋白2gydF4y2Ba(gydF4y2BaACT2gydF4y2Ba)记录。误差条表示三个生物重复序列的SD。*gydF4y2BaPgydF4y2Ba< 0.05采用Student 's t检验gydF4y2Ba
SAG202gydF4y2Ba(但不gydF4y2BaCBP60ggydF4y2Ba),gydF4y2BaICS1gydF4y2Ba(但不gydF4y2BaICS2gydF4y2Ba)与gydF4y2BaAtNAPgydF4y2Ba
AtNAPgydF4y2Ba是在衰老过程中上调的NAC家族TF,其dex诱导表达系(gydF4y2BaAtNAPgydF4y2Ba在gydF4y2Ba)是现成的(Guo和Gan,gydF4y2Ba2006gydF4y2Ba).DEX处理后,表达gydF4y2BaAtNAPgydF4y2Ba显著地诱发了gydF4y2BaAtNAPgydF4y2Ba在gydF4y2Ba而对照植株中则没有。gydF4y2Ba2gydF4y2Baa). qPCR分析显示gydF4y2BaSAG202gydF4y2Ba而且gydF4y2BaICS1gydF4y2Ba也被诱导(图;gydF4y2Ba2gydF4y2BaB, d,但是gydF4y2BaCBP60ggydF4y2Ba,一种密切相关的基因gydF4y2BaSAG202gydF4y2Ba,gydF4y2BaICS2gydF4y2Ba未被诱导(图;gydF4y2Ba2gydF4y2Bac, e)。gydF4y2BaICS1gydF4y2Ba表达与诱导共诱导gydF4y2BaSAG202gydF4y2Ba在gydF4y2BaSAG202gydF4y2Ba在gydF4y2Ba而未诱导ICS2的表达(图2)。gydF4y2Ba2gydF4y2Bag h)。gydF4y2Ba
AtNAP TF物理结合到的启动子区域gydF4y2BaSAG202gydF4y2Ba(但不gydF4y2BaCBP60ggydF4y2Ba)在酵母细胞和gydF4y2Ba在足底gydF4y2Ba
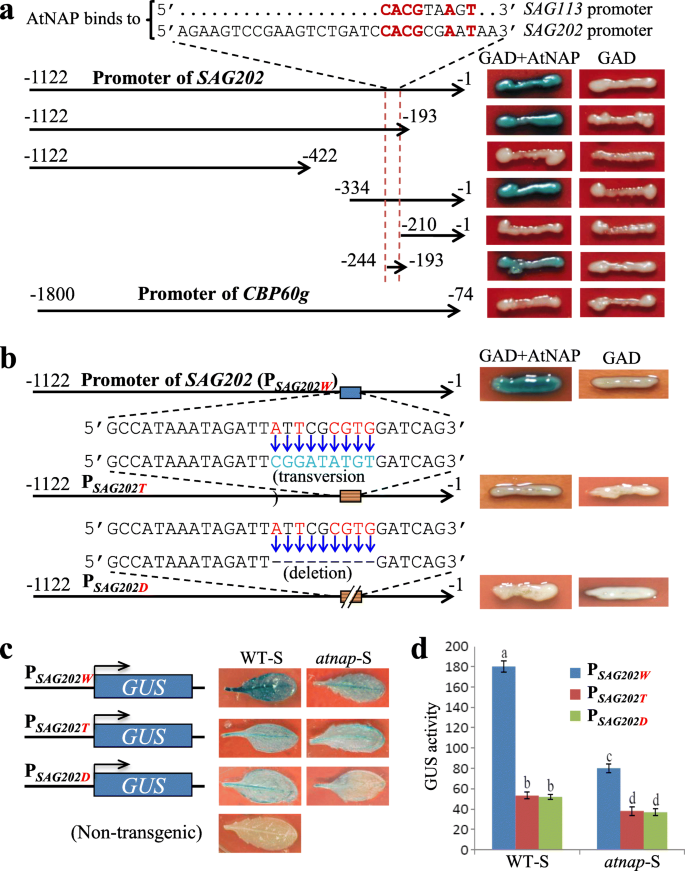
以上共归纳gydF4y2BaSAG202gydF4y2Ba与gydF4y2BaAtNAPgydF4y2Ba提高了gydF4y2BaSAG202gydF4y2Ba的直接靶基因gydF4y2BaAtNAPgydF4y2Ba.为了测试这一点,我们进行了酵母单杂交实验,其中一系列截断的启动子片段gydF4y2BaSAG202gydF4y2Ba(无花果。gydF4y2Ba3.gydF4y2BaA)在A面前被克隆gydF4y2BaLacZgydF4y2Ba报告基因作为启动子诱饵,形成各种报告结构;的gydF4y2BaAtNAPgydF4y2Ba编码序列与酵母GAL4激活域(GAD)融合形成效应子GAD- atnap结构(Zhang和Gan,gydF4y2Ba2012gydF4y2Ba).AtNAP TF能够物理绑定到的特定区域gydF4y2BaSAG202gydF4y2Ba含有5'CACGcgAaT3 '的启动子,与9-bp非常相似gydF4y2BaAtNAPgydF4y2Ba的启动子中的核心结合序列5'CACGtaAgT3 '(小写的核苷酸是可变的)gydF4y2BaSAG113gydF4y2Ba(张,甘,gydF4y2Ba2012gydF4y2Ba)(图。gydF4y2Ba3.gydF4y2Baa).相比之下,AtNAP TF不与的启动子结合gydF4y2BaCBP60ggydF4y2Ba(无花果。gydF4y2Ba3.gydF4y2Baa). AtNAP TF与图序5'CACGcgAaT3 '的结合gydF4y2BaSAG202gydF4y2Ba启动子(PgydF4y2BaSAG202gydF4y2Ba序列的转位和缺失突变体证实:突变时,AtNAP TF不能再与启动子结合(图2)。gydF4y2Ba3.gydF4y2Bab)。gydF4y2Ba
绑定的gydF4y2BaAtNAPgydF4y2Ba到gydF4y2BaSAG202gydF4y2Ba酵母中的启动子截断和突变体gydF4y2Ba在足底gydF4y2Ba.(gydF4y2Ba一个gydF4y2Ba绑定AtNAP到gydF4y2BaSAG202gydF4y2Ba酵母单杂交试验显示启动子截断。的gydF4y2BaLacZgydF4y2Ba报告基因驱动多种多样gydF4y2BaSAG202gydF4y2Ba启动子截断用于测试GAD-AtNAP融合蛋白的结合能力。红色虚线表示高度保守的9 bp(红色字母)AtNAP结合位点的启动子序列gydF4y2BaSAG113gydF4y2Ba(张和甘,gydF4y2Ba2012gydF4y2Ba).翻译起始点的直接上游bp编号为−1。的gydF4y2BaCBP60ggydF4y2Ba启动子(长度1727 bp)也被检测。(gydF4y2BabgydF4y2BaAtNAP绑定失败gydF4y2BaSAG202gydF4y2Ba在酵母细胞中包含反转突变或缺失基序序列的启动子。(gydF4y2BacgydF4y2Ba转基因拟南芥(WT或gydF4y2BaannapgydF4y2Ba突变背景)庇护PgydF4y2BaSAG202WgydF4y2Ba-gydF4y2Ba格斯gydF4y2Ba(gydF4y2BaWgydF4y2Ba为WT), PgydF4y2BaSAG202TgydF4y2Ba-gydF4y2Ba格斯gydF4y2Ba(gydF4y2BaTgydF4y2Ba颠换;启动子包含的转化突变显示在(gydF4y2BabgydF4y2Ba)或PgydF4y2BaSAG202DgydF4y2Ba-gydF4y2Ba格斯gydF4y2Ba(gydF4y2BaDgydF4y2Ba删除;启动子包含缺失突变,如(gydF4y2BabgydF4y2Ba))。(gydF4y2BadgydF4y2Ba) GUS酶活性(表示为nmol甲基伞形酮产生mingydF4y2Ba−1gydF4y2Ba毫克gydF4y2Ba−1gydF4y2Ba转基因植物衰老叶片的蛋白质),见(gydF4y2BacgydF4y2Ba).数据为五个样本的平均值±标准差。重要的(gydF4y2BaPgydF4y2Ba> 0.05)均值之间的差异用不同的字母表示。采用方差分析和LSD检验gydF4y2Ba
AtNAP TF与PgydF4y2BaSAG202gydF4y2Ba被进一步检查gydF4y2Ba在足底gydF4y2Ba.PgydF4y2BaSAG202WgydF4y2Ba(野生型启动子)及其突变体(PgydF4y2BaSAG202TgydF4y2Ba)或缺失突变(PgydF4y2BaSAG202DgydF4y2Ba)如图所示。gydF4y2Ba3.gydF4y2BaB被融合了gydF4y2Ba格斯gydF4y2Ba并转化为WT或gydF4y2BaatnapgydF4y2Ba空的背景。衰老叶片中的GUS活性(WT-S或gydF4y2BaatnapgydF4y2Ba-S)通过组织化学染色和酶促试验分析,结果表明,WT衰老叶片中任一启动子基序突变的GUS活性均降低至P的30%以下gydF4y2BaSAGWgydF4y2Ba-gydF4y2Ba格斯gydF4y2Ba植物和GUS的活动gydF4y2BaatnapgydF4y2Ba在WT背景下,空背景的活动小于45%(图2)。gydF4y2Ba3.gydF4y2Bac, d)。这些数据进一步支持了AtNAP TF物理上绑定到该基序的5'CACGcgAaT3 'gydF4y2BaSAG202gydF4y2Ba启动子来指导基因表达gydF4y2Ba在足底gydF4y2Ba.gydF4y2Ba
的启动子与SAG202 TF物理结合gydF4y2BaICS1gydF4y2Ba(但不gydF4y2BaICS2gydF4y2Ba)在酵母细胞和gydF4y2Ba在足底gydF4y2Ba
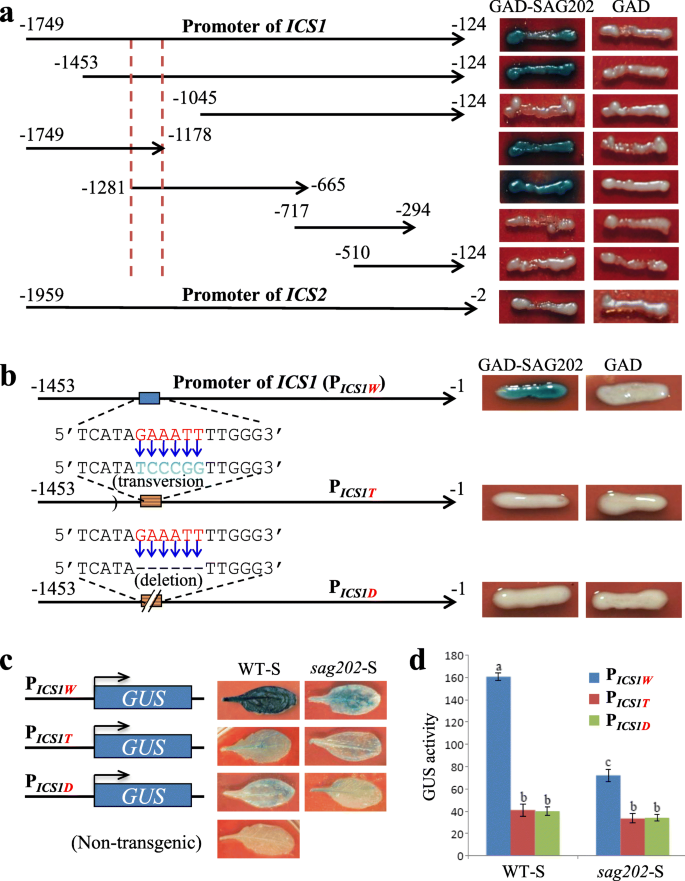
研究SAG202 TF是否与gydF4y2BaICS1gydF4y2Ba启动子、各种gydF4y2BaICS1gydF4y2Ba使用酵母单杂交系统验证了SAG202 TF确实能够与酵母启动子的104bp区域(−1178 ~−1281)结合gydF4y2BaICS1gydF4y2Ba.的1958-bp启动子gydF4y2BaICS2gydF4y2Ba(−2 ~−1959)也被用于酵母单杂交实验,结果表明SAG202 TF与酵母之间没有物理相互作用gydF4y2BaICS2gydF4y2Ba启动子(无花果。gydF4y2Ba4gydF4y2Baa). 104 bp区域含有一个6 bp基序5'GAAATT3 ',被认为是蛋白的结合位点gydF4y2BaSAG202gydF4y2Ba.为了验证这一点,gydF4y2BaICS1gydF4y2Ba在酵母单杂交实验中使用了带有反转或缺失突变的启动子,这些突变取消了SAG202与酵母单杂交的结合gydF4y2BaICS1gydF4y2Ba酵母细胞中的启动子变体(图;gydF4y2Ba4gydF4y2Bab).涉及使用的进一步分析gydF4y2BaICS1gydF4y2Ba启动子具有或不具有转位或缺失突变的指导作用gydF4y2Ba格斯gydF4y2BaWT和gydF4y2Basag202gydF4y2Ba空背景显示SAG202也与5'GAAATT3 '发生物理相互作用。gydF4y2Ba独联体gydF4y2Ba元素gydF4y2BaICS1gydF4y2Ba启动子gydF4y2Ba在足底gydF4y2Ba(无花果。gydF4y2Ba4gydF4y2Bac, d)。gydF4y2Ba
绑定的gydF4y2BaSAG202gydF4y2Ba到gydF4y2BaICS1gydF4y2Ba酵母中的启动子截断和突变体gydF4y2Ba在足底gydF4y2Ba.(gydF4y2Ba一个gydF4y2Ba)绑定gydF4y2BaSAG202gydF4y2Ba到gydF4y2BaICS1gydF4y2Ba启动子截断。的gydF4y2BaLacZgydF4y2Ba报告基因驱动多种多样gydF4y2BaICS1gydF4y2Ba启动子截断法检测GAD-SAG202融合蛋白的结合能力。红色虚线表示104 bp的启动子区域gydF4y2BaSAG202gydF4y2Ba绑定序列。的gydF4y2BaICS2gydF4y2Ba启动子长度为1626 bp。(gydF4y2BabgydF4y2BaSAG202绑定失败gydF4y2BaICS1gydF4y2Ba该启动子在酵母细胞的104 bp区域内包含反转突变或缺失GAAATT序列(红色字母)。(gydF4y2BacgydF4y2Ba转基因拟南芥(WT或gydF4y2Basag202gydF4y2Ba突变背景)庇护PgydF4y2BaICS1WgydF4y2Ba-gydF4y2Ba格斯gydF4y2Ba(gydF4y2BaWgydF4y2Ba为WT), PgydF4y2BaICS1TgydF4y2Ba-gydF4y2Ba格斯gydF4y2Ba(gydF4y2BaTgydF4y2Ba颠换;启动子包含中所示的转化突变gydF4y2BabgydF4y2Ba)或PgydF4y2BaICS1DgydF4y2Ba-gydF4y2Ba格斯gydF4y2Ba(gydF4y2BaDgydF4y2Ba删除;启动子包含缺失突变,如gydF4y2BabgydF4y2Ba).(gydF4y2BadgydF4y2Ba) GUS酶活性(表示为nmol甲基伞形酮产生mingydF4y2Ba−1gydF4y2Ba毫克gydF4y2Ba−1gydF4y2Ba所示转基因植物衰老叶片的蛋白质)gydF4y2BacgydF4y2Ba.数据为五个样本的平均值±标准差。重要的(gydF4y2BaPgydF4y2Ba> 0.05)均值之间的差异用不同的字母表示。采用方差分析和LSD检验gydF4y2Ba
这两个gydF4y2BaAtNAPgydF4y2Ba而且gydF4y2BaSAG202gydF4y2Ba受到SA的正向调控gydF4y2Ba
上述数据揭示了一条由gydF4y2BaAtNAPgydF4y2Ba-gydF4y2BaSAG202gydF4y2Ba-gydF4y2BaICS1gydF4y2Ba在叶片衰老过程中产生SA。如果是这样的话,敲除上游基因应该会影响其下游基因的表达。因此,我们用qPCR分析了这些基因在WT中的表达水平,gydF4y2BaatnapgydF4y2Ba,gydF4y2Basag202gydF4y2Ba而且gydF4y2Baics1gydF4y2Ba不同衰老阶段的零突变体(图。gydF4y2Ba5gydF4y2Baa - c)。不出所料,两者的转录水平都很高gydF4y2BaSAG202gydF4y2Ba而且gydF4y2BaICS1gydF4y2Ba都显著减少了gydF4y2BaAtNAPgydF4y2Ba(无花果。gydF4y2Ba5gydF4y2Bab, c);类似地,gydF4y2BaICS1gydF4y2Ba表达水平显著降低gydF4y2Basag202gydF4y2Ba突变体(无花果。gydF4y2Ba5gydF4y2Bac).的表达水平gydF4y2BaCBP60ggydF4y2Ba而且gydF4y2BaICS2gydF4y2Ba在任何突变背景下,这两个调控链之外的基因都没有改变(补充图SgydF4y2Ba2gydF4y2Ba).gydF4y2Ba
转录水平的qPCR分析gydF4y2BaAtNAPgydF4y2Ba,gydF4y2BaSAG202gydF4y2Ba,gydF4y2BaICS1gydF4y2Ba不同突变体在衰老过程中或SA处理后。(gydF4y2Ba一个gydF4y2Ba-gydF4y2BacgydF4y2Ba)转录水平gydF4y2BaAtNAPgydF4y2Ba,gydF4y2BaSAG202gydF4y2Ba而且gydF4y2BaICS1gydF4y2Ba在WT叶中,gydF4y2BaatnapgydF4y2Ba,gydF4y2Basag202gydF4y2Ba而且gydF4y2Baics1gydF4y2Ba不同衰老阶段的零突变体(1,NS;2、ES;3、女士;4、LS如图图例所示。gydF4y2Ba1gydF4y2Ba一个)。gydF4y2BadgydF4y2Ba-gydF4y2BafgydF4y2Ba)转录水平gydF4y2BaAtNAPgydF4y2Ba,gydF4y2BaSAG202gydF4y2Ba而且gydF4y2BaICS1gydF4y2Ba在WT的NS叶中,gydF4y2BaatnapgydF4y2Ba而且gydF4y2Basag202gydF4y2Ba5 mM SA处理后的时间点突变体为零。相对表达水平计算和归一化gydF4y2Ba肌动蛋白2gydF4y2Ba(gydF4y2BaACT2gydF4y2Ba)记录。误差条表示三个生物重复序列的SD。重要的(gydF4y2BaPgydF4y2Ba平均值之间的差异以Tukey 's HSD检验的不同字母表示gydF4y2Ba
有趣的是,表达水平gydF4y2BaAtNAPgydF4y2Ba在这两种gydF4y2Basag202gydF4y2Ba或gydF4y2Baics1gydF4y2Ba缺失突变体减少(图;gydF4y2Ba5gydF4y2BaA),和的转录水平gydF4y2BaSAG202gydF4y2Ba在中衰期(MS)叶片中gydF4y2Baics1gydF4y2Ba背景也降低了(图;gydF4y2Ba5gydF4y2Bab).这些数据提示调控链的最终产物SA可能对这些基因进行反馈调控。为了验证这一假设,我们分析了gydF4y2BaAtNAPgydF4y2Ba,gydF4y2BaSAG202gydF4y2Ba,gydF4y2BaICS1gydF4y2Ba在WT,gydF4y2BaatnapgydF4y2Ba而且gydF4y2Basag202gydF4y2BaSA处理后的突变体。gydF4y2BaAtNAPgydF4y2Ba(无花果。gydF4y2Ba5gydF4y2Bad)和gydF4y2BaSAG202gydF4y2Ba(无花果。gydF4y2Ba5gydF4y2Bae) SA显著诱导gydF4y2BaICS1gydF4y2Ba在gydF4y2Basag202gydF4y2Ba无效突变体不显著(图。gydF4y2Ba5gydF4y2BaF),暗示gydF4y2BaAtNAPgydF4y2Ba而且gydF4y2BaSAG202gydF4y2Ba受SA正向反馈调节。gydF4y2Ba
游离SA水平降低gydF4y2BaatnapgydF4y2Ba而且gydF4y2Basag202gydF4y2Ba变种人被提升了gydF4y2BaAtNAPgydF4y2Ba在gydF4y2Ba而且gydF4y2BaSAG202gydF4y2Ba在gydF4y2Ba行gydF4y2Ba
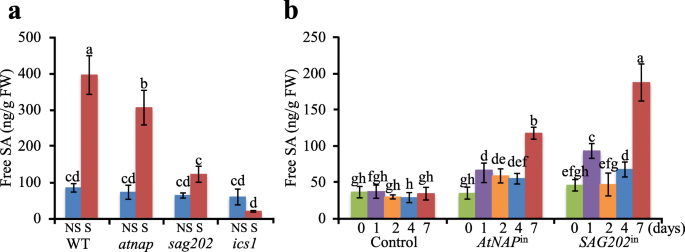
WT完全膨大的未衰老叶(NS)和衰老叶(S)中游离SA含量gydF4y2BaatnapgydF4y2Ba,gydF4y2Basag202gydF4y2Ba而且gydF4y2Baics1gydF4y2Ba采用LC-MS/MS对突变体进行定量分析。在这些无效突变体中,衰老叶片中的SA水平显著降低,但在任何植物的非衰老叶片中都保持不变(图2)。gydF4y2Ba6gydF4y2Ba一个)。gydF4y2Ba
WT中游离SA含量的LC-MS/MS分析gydF4y2BaatnapgydF4y2Ba,gydF4y2Basag202gydF4y2Ba,gydF4y2Baics1gydF4y2Ba零突变体,gydF4y2BaAtNAPgydF4y2Ba在gydF4y2Ba而且gydF4y2BaSAG202gydF4y2Ba在gydF4y2Ba行。(gydF4y2Ba一个gydF4y2Ba) WT的NS和S(~ 50%黄化)叶中游离SA含量,gydF4y2BaatnapgydF4y2Ba,gydF4y2Basag202gydF4y2Ba而且gydF4y2Baics1gydF4y2Ba分别突变体。(gydF4y2BabgydF4y2Ba)幼叶中游离SA含量gydF4y2BaAtNAPgydF4y2Ba可诱导线(gydF4y2BaAtNAPgydF4y2Ba在gydF4y2Ba),gydF4y2BaSAG202gydF4y2Ba可诱导线(gydF4y2BaSAG202gydF4y2Ba在gydF4y2Ba)在DEX诱导后0、1、2、4、7天。误差条表示三个生物重复序列的SD。重要的(gydF4y2BaPgydF4y2Ba平均值之间的差异以Tukey 's HSD检验的不同字母表示gydF4y2Ba
诱导表达的叶片游离SA水平gydF4y2BaAtNAPgydF4y2Ba(gydF4y2BaAtNAPgydF4y2Ba在gydF4y2Ba)或gydF4y2BaSAG202gydF4y2Ba(gydF4y2BaSAG202gydF4y2Ba在gydF4y2Ba)也进行了量化。如图所示。gydF4y2Ba6gydF4y2Bab, DEX诱导后第1天SA水平明显升高。gydF4y2Ba
的gydF4y2BaSAG202-ICS1gydF4y2Ba-SA调控链在叶片衰老和防御反应之间共享gydF4y2Ba
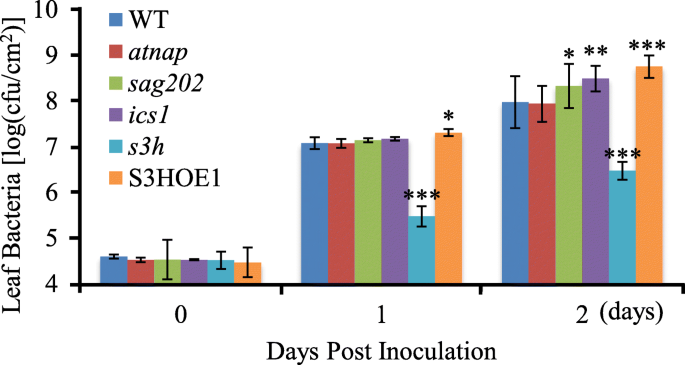
我们的研究表明,由SA-组成的正反馈调控环gydF4y2BaAtNAPgydF4y2Ba-gydF4y2BaSAG202gydF4y2Ba-gydF4y2BaICS1gydF4y2Ba-SA在叶片衰老过程中起作用gydF4y2BaSAG202gydF4y2Ba-gydF4y2BaICS1gydF4y2Ba节点在植物防御反应中起作用(Wildermuth等人,gydF4y2Ba2001gydF4y2Ba;Zhang等人,gydF4y2Ba2010 bgydF4y2Ba;Wang等人,gydF4y2Ba2011gydF4y2Ba).调查是否gydF4y2BaAtNAPgydF4y2Ba也有抗病作用,我们接种成熟的不衰老的叶片gydF4y2BaatnapgydF4y2Ba,gydF4y2Basag202gydF4y2Ba,gydF4y2Baics1gydF4y2Ba突变体和WT与gydF4y2Ba两gydF4y2Bapv。并在番茄DC3000中发现了病原菌的抗性gydF4y2BaatnapgydF4y2Ba与WT相比,突变体无明显变化gydF4y2Basag202gydF4y2Ba而且gydF4y2Baics1gydF4y2Ba突变体变得更容易受到病原体感染(图;gydF4y2Ba7gydF4y2Ba).这些数据有力地表明gydF4y2BaSAG202gydF4y2Ba-gydF4y2BaICS1gydF4y2Ba-SA调控链由叶片衰老和防御反应以及上游组分共享gydF4y2BaAtNAPgydF4y2Ba似乎是叶片衰老的特异性(图。gydF4y2Ba8gydF4y2Ba).gydF4y2Ba
的增长gydF4y2Ba丁香草pv。gydF4y2BaWT番茄叶片中的DC3000gydF4y2BaatnapgydF4y2Ba,gydF4y2Basag202gydF4y2Ba,gydF4y2Baics1gydF4y2Ba,gydF4y2Bas3hgydF4y2Ba零突变体和S3HOE1转基因植物。分别在接种后0、1、2天测定每平方厘米叶面积的集落形成单位数(cfu)。误差条表示三个生物重复序列的SD。*、**、***表示gydF4y2BaPgydF4y2Ba< 0.05,gydF4y2BaPgydF4y2Ba< 0.01,gydF4y2BaPgydF4y2Ba分别< 0.001。使用学生t检验。的gydF4y2Bas3hgydF4y2Ba零突变体(抗感染)和S3HOE1转基因植物(易感感染)(Zhang et al.,gydF4y2Ba2013gydF4y2Ba),以作比较gydF4y2Ba
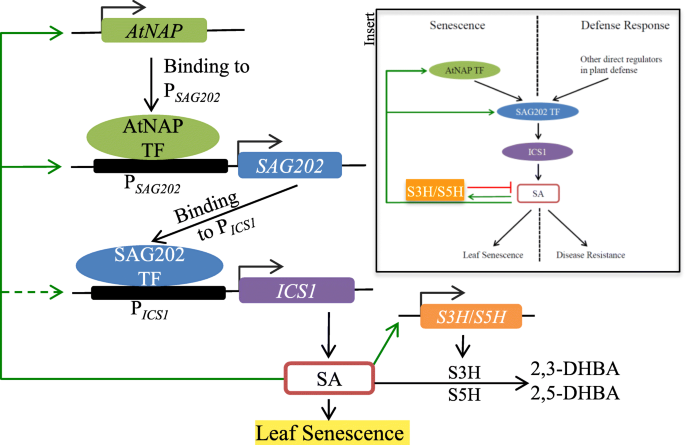
一个SA-的工作模型gydF4y2BaAtNAPgydF4y2Ba-gydF4y2BaSAG202gydF4y2Ba-gydF4y2BaICS1gydF4y2Ba-SA在拟南芥叶片衰老中的正反馈环路及其在防御反应中的收敛/发散。在叶片衰老开始和衰老过程中,AtNAP TF与叶片衰老启动子结合gydF4y2BaSAG202gydF4y2Ba指导靶基因表达。随后,SAG202 TF激活其直接靶基因gydF4y2BaICS1gydF4y2Ba它参与了SA的生物合成。产生的SA反过来反馈上调这两者gydF4y2BaAtNAPgydF4y2Ba而且gydF4y2BaSAG202gydF4y2Ba.当SA水平增加到阈值时,gydF4y2BaS3HgydF4y2Ba(编码SA 3-羟化酶)和gydF4y2BaS5HgydF4y2Ba诱导,以防止SA的过度积累(Zhang et al.,gydF4y2Ba2013gydF4y2Ba;Zhang等人,gydF4y2Ba2017 bgydF4y2Ba).过高的SA水平会引起过敏反应(HR),如快速细胞死亡。叶片衰老是一个缓慢的程序性细胞死亡过程,使蛋白质和其他大分子降解释放的营养物质循环到活跃的生长区域或储存器官。gydF4y2Ba插入gydF4y2Ba:关于新发现的SA-,显示叶片衰老与防御反应之间的收敛和发散关系的图表gydF4y2BaAtNAPgydF4y2Ba-gydF4y2BaSAG202gydF4y2Ba-gydF4y2BaICS1gydF4y2Ba-SA调控回路。SA -gydF4y2BaAtNAPgydF4y2Ba-gydF4y2BaSAG202gydF4y2Ba-gydF4y2BaICS1gydF4y2Ba-SA反馈回路在叶片衰老过程中被激活以调节内源性SA水平,但在防御反应中不被激活。在循环的防御反应部分,gydF4y2BaSAG202gydF4y2Ba-gydF4y2BaICS1gydF4y2Ba-SA被激活gydF4y2Ba
讨论gydF4y2Ba
由于SA在植物防御中的重要作用,已经进行了许多研究来破译其在植物中的生物合成和信号(Shirasu et al.,gydF4y2Ba1997gydF4y2Ba;Dangl,gydF4y2Ba1998gydF4y2Ba;傅等,gydF4y2Ba2012gydF4y2Ba).在植物中产生SA有两种途径:一种是苯丙氨酸,另一种是经等chorisate (IC)产生(Dempsey et al.,gydF4y2Ba2011gydF4y2Ba).在拟南芥中,IC通路主要作用于防御反应过程中SA的积累gydF4y2Ba等chorisate合成酶1gydF4y2Ba(gydF4y2BaICS1gydF4y2Ba)在这种积累中起主要作用(Wildermuth等,gydF4y2Ba2001gydF4y2Ba).IC通路似乎在拟南芥叶片衰老过程中占主导地位,这是因为在拟南芥叶片衰老过程中SA水平的升高gydF4y2Baics1gydF4y2Ba均小于WT的5%(图;gydF4y2Ba6gydF4y2Baa).进一步的研究表明SARD1和CBP60g与的启动子结合gydF4y2BaICS1gydF4y2Ba调节该基因的表达(Zhang et al.,gydF4y2Ba2010 bgydF4y2Ba;Wang等人,gydF4y2Ba2011gydF4y2Ba).哪些tf监管gydF4y2BaSARD1gydF4y2Ba(和CBP60g)是未知的。我们的研究通过确定AtNAP(一个NAC家族的TF)作为一种直接的上游调控因子来解决这个问题gydF4y2BaSARD1gydF4y2Ba(无花果。gydF4y2Ba8gydF4y2Ba);这至少得到了三条证据的支持:(i)酵母单杂交实验表明,AtNAP可以物理结合到酵母的启动子区域gydF4y2BaSAG202gydF4y2Ba(相同的gydF4y2BaSARD1gydF4y2Ba),其中包含一个高度保守的序列,AtNAP与之结合。gydF4y2Ba3.gydF4y2Baa, b), (ii) AtNAP与植物中SAG202启动子的9 bp基序结合(图2)。gydF4y2Ba3.gydF4y2BaC, d),和(iii)gydF4y2BaSAG202gydF4y2Ba是共诱发的gydF4y2BaAtNAPgydF4y2Ba是化学诱导的(图;gydF4y2Ba2gydF4y2Bab)。有趣的是,gydF4y2BaCBP60ggydF4y2Ba的近亲gydF4y2BaSAG202,gydF4y2Ba不太可能被直接监管gydF4y2BaAtNAPgydF4y2Ba因为AtNAP不能与基因的启动子区结合gydF4y2BaCBP60ggydF4y2Ba(无花果。gydF4y2Ba3.gydF4y2BaA)和that。gydF4y2BaCBP60ggydF4y2Ba是不是共诱发的gydF4y2BaAtNAPgydF4y2Ba(补充图SgydF4y2Ba2gydF4y2Ba).除了揭露gydF4y2BaAtNAPgydF4y2Ba-gydF4y2BaSAG202gydF4y2BaChain,我们还提供了新的证据gydF4y2BaSAG202gydF4y2Ba的启动子在物理上结合gydF4y2BaICS1gydF4y2Ba(但不gydF4y2BaICS2gydF4y2Ba),这与我们的酵母单杂交实验结果(图;gydF4y2Ba4gydF4y2BaA, b), bygydF4y2Ba在足底gydF4y2Ba分析(图。gydF4y2Ba4gydF4y2BaC, d),并通过归纳的表达式gydF4y2BaICS1gydF4y2Ba(无花果。gydF4y2Ba2gydF4y2BaD, g,但不是gydF4y2BaICS2gydF4y2Ba(无花果。gydF4y2Ba2gydF4y2BaE, h)通过化学活化gydF4y2BaAtNAPgydF4y2Ba或gydF4y2BaSAG202gydF4y2Ba.SAG202 TF/SARD1之前已经被证明可以直接调节gydF4y2BaICS1gydF4y2Ba使用染色质免疫沉淀(ChIP),电泳迁移率漂移试验(EMSA)和启动子序列分析(Zhang等人,gydF4y2Ba2010 bgydF4y2Ba;杜鲁门和Glazebrook,gydF4y2Ba2012gydF4y2Ba).这些数据揭示了一个独特的调控链,由gydF4y2BaAtNAPgydF4y2Ba-gydF4y2BaSAG202gydF4y2Ba-gydF4y2BaICS1gydF4y2Ba(无花果。gydF4y2Ba8gydF4y2Ba),极大地促进了我们对SA生物合成的分子调控机制的理解。gydF4y2Ba
已知SA在衰老叶片中含量高于未衰老叶片,SA在拟南芥叶片衰老调控中起重要作用(Morris et al.,gydF4y2Ba2000gydF4y2Ba;Zhang等人,gydF4y2Ba2013gydF4y2Ba;Zhang等人,gydF4y2Ba2017 bgydF4y2Ba;Yu等人,gydF4y2Ba2021gydF4y2Ba).gydF4y2BaSARD1gydF4y2Ba-gydF4y2BaICS1gydF4y2Ba被证明有助于防御反应期间SA的产生(Wildermuth等人,gydF4y2Ba2001gydF4y2Ba;Zhang等人,gydF4y2Ba2010 bgydF4y2Ba;Wang等人,gydF4y2Ba2011gydF4y2Ba),但是否与上游部分一起gydF4y2BaAtNAPgydF4y2Ba其在叶片衰老过程中的作用和功能尚不清楚。这项研究提供了几行证据,表明调控链在叶片衰老中起作用。第一个证据来自于对链中单个基因转录水平的qPCR分析。如图所示。gydF4y2Ba2gydF4y2BaA-d,表达水平gydF4y2BaAtNAPgydF4y2Ba,gydF4y2BaSAG202gydF4y2Ba而且gydF4y2BaICS1gydF4y2Ba都在化学诱导下上调gydF4y2BaAtNAPgydF4y2Ba.第二项证据来自于对各自零突变体衰老叶片中SA水平的定量分析。当敲除调控链的单个基因时,衰老叶片中的SA水平均显著降低(图2)。gydF4y2Ba6gydF4y2Baa).需要注意的是,在衰老叶片中仍有~ 30%的SAgydF4y2Basag202gydF4y2Ba和~ 75%gydF4y2BaatnapgydF4y2Ba(无花果。gydF4y2Ba6gydF4y2BaA),这可能是因为gydF4y2BaICS2gydF4y2Ba在衰老过程中上调(图SgydF4y2Ba2gydF4y2Ba)和/或gydF4y2BaICS1gydF4y2Ba它被逆行信号蛋白WHIRLY1激活(Lin et al.,gydF4y2Ba2020gydF4y2Ba)和衰老相关的转录因子,如WRKY75, WRKY51, WRKY28, WRKY55和WRKY46,这些转录因子已被证明直接与蛋白的启动子结合gydF4y2BaICS1gydF4y2Ba(Guo等,gydF4y2Ba2017gydF4y2Ba;Zhang等人,gydF4y2Ba2017年,一个gydF4y2Ba;田等人,gydF4y2Ba2020gydF4y2Ba;Wang等人,gydF4y2Ba2020gydF4y2Ba).gydF4y2Ba
如果两者都没有gydF4y2BaSAG202gydF4y2Ba或gydF4y2BaICS1gydF4y2Ba的转录水平gydF4y2BaAtNAPgydF4y2Ba在衰老叶,特别是晚衰老叶(LS)中显著降低(图2)。gydF4y2Ba5gydF4y2Baa).同样,的表达水平gydF4y2BaSAG202gydF4y2Ba在gydF4y2Baics1gydF4y2Ba空背景也减少了(图。gydF4y2Ba5gydF4y2Bab).这些数据表明,调控链的最终产物SA可能正向反馈调控gydF4y2BaAtNAPgydF4y2Ba而且gydF4y2BaSAG202gydF4y2Ba如图所示。gydF4y2Ba8gydF4y2Ba.外源SA显著提高了植物的光合速率,这一反馈调控得到了支持gydF4y2BaAtNAPgydF4y2Ba转录水平gydF4y2Basag202gydF4y2Ba突变体(和WT)(图;gydF4y2Ba5gydF4y2Bad).在没有gydF4y2BaAtNAPgydF4y2Ba外源SA能高度诱导gydF4y2BaSAG202gydF4y2Ba表达式(无花果。gydF4y2Ba5gydF4y2Bae),表明SA可能存在正反馈调节gydF4y2BaSAG202gydF4y2Ba除了gydF4y2BaAtNAPgydF4y2Ba.相比之下,在没有的情况下gydF4y2BaSAG202gydF4y2Ba,gydF4y2BaICS1gydF4y2Ba外源性SA未显著改变表达水平(图。gydF4y2Ba5gydF4y2BaF),表明gydF4y2BaICS1gydF4y2Ba不可能被SA调节为正反馈。gydF4y2Ba
先前的研究表明SA在叶片衰老中起着重要作用(Morris et al.,gydF4y2Ba2000gydF4y2Ba;甘,gydF4y2Ba2010gydF4y2Ba;Zhang等人,gydF4y2Ba2013gydF4y2Ba;Zhang等人,gydF4y2Ba2017 bgydF4y2Ba).例如,与未衰老的叶片相比,衰老叶片中SA的水平更高,在细菌或拟南芥来源的SA降解酶过表达的NahG或S3HOE植物中,叶片衰老延迟,并且在胁迫下叶片衰老加速gydF4y2Bas3hgydF4y2BaSA过度积累的空白植物(Zhang et al.,gydF4y2Ba2013gydF4y2Ba).在本研究中,我们发现当调控环中的任何一个基因被敲除时,内源性SA水平显著降低(图2)。gydF4y2Ba5gydF4y2Baa),叶片寿命大大延长(图。gydF4y2Ba1gydF4y2Baa-b,补充图SgydF4y2Ba1gydF4y2Ba).相反,当gydF4y2BaAtNAPgydF4y2Ba而且gydF4y2BaSAG202gydF4y2Ba单独的化学诱导,内源性SA水平升高(图。gydF4y2Ba6gydF4y2Bab)植株叶片呈现早熟性衰老(图;gydF4y2Ba1gydF4y2Baf, h).这些数据强化了SA促进叶片衰老的作用。gydF4y2Ba
的共享监管链gydF4y2BaSAG202gydF4y2Ba/gydF4y2BaSARD1gydF4y2Ba-gydF4y2BaICS1gydF4y2Ba-SA是由不同的线索引发的,并受到不同程度的SA积累的调节(见图)。gydF4y2Ba8gydF4y2Ba).上游调节器gydF4y2BaSAG202gydF4y2Ba在抗病性尚不清楚的过程中,在叶片衰老过程中,gydF4y2BaSAG202gydF4y2Ba受AtNAP TF调控。gydF4y2BaCBP60ggydF4y2Ba,密切相关的家庭成员gydF4y2BaSAG202gydF4y2Ba,不受AtNAP TF直接调控;然而,gydF4y2BaCBP60ggydF4y2Ba也可能在叶片衰老中起作用,因为其表达谱显示了与衰老相关的升高(补充图SgydF4y2Ba2gydF4y2Ba).在防御反应中,两者都有gydF4y2BaCBP60ggydF4y2Ba而且gydF4y2BaSAG202gydF4y2Ba参与SA的诱导;病原体感染后,局部叶片SA水平升高到很高水平,导致细胞自杀死亡(Raskin,gydF4y2Ba1992gydF4y2Ba;Zhang等人,gydF4y2Ba2010 bgydF4y2Ba).然而,在年龄依赖的叶片衰老中,衰老叶片中的SA水平上调至非衰老叶片的4倍左右(Morris et al.,gydF4y2Ba2000gydF4y2Ba;Zhang等人,gydF4y2Ba2013gydF4y2Ba;Zhang等人,gydF4y2Ba2017 bgydF4y2Ba),导致缓慢而缓慢的程序性细胞死亡(PCD),这是将衰老过程中释放的营养物质重新调动到活跃的生长组织或储存器官,如种子和树干(Gan和Amasino,gydF4y2Ba1997gydF4y2Ba).gydF4y2Ba
的意义是另一个区别gydF4y2BaICS1gydF4y2Ba在抗病性和叶片衰老之间产生SA。在衰老叶片中几乎检测不到SA水平gydF4y2Baics1gydF4y2Ba突变体,甚至低于非衰老叶的水平(图。gydF4y2Ba6gydF4y2Baa).这可以解释为gydF4y2BaICS1gydF4y2Ba对衰老的拟南芥叶片中几乎所有SA的产生都有贡献。然而,在植物防御反应中,仍有SA的产生gydF4y2Baics1gydF4y2Ba突变体,说明还有其他基因,比如gydF4y2BaICS2gydF4y2Ba(Garcion et al.,gydF4y2Ba2008gydF4y2Ba)或其他SA生物合成途径,如PAL途径(Dempsey et al.,gydF4y2Ba2011gydF4y2Ba)在SA生物合成中的作用。在叶片衰老过程中,除了SA合成代谢的调控外,SA的水平还受到SA分解代谢的调控。研究表明SA诱导SA 3-羟化酶(S3H)和SA 5-羟化酶(S5H),分别将SA转化为其非活性形式2,3- dhba和2,5- dhba,构成SA在叶片衰老过程中的负反馈调控,防止SA过度积累(Zhang et al.,gydF4y2Ba2013gydF4y2Ba;Zhang等人,gydF4y2Ba2017 bgydF4y2Ba).gydF4y2Ba
材料与方法gydF4y2Ba
植物材料和生长条件gydF4y2Ba
拟南芥gydF4y2Ba本研究采用哥伦比亚生态型。的gydF4y2BaatnapgydF4y2Ba敲除突变体gydF4y2BaAtNAPgydF4y2Ba-诱导表达系(Guo和Gan,gydF4y2Ba2006gydF4y2Ba)和两条T-DNA插入线(SALK_052422和SALK_128476C,来自ABRC)都在Columbia背景中。每gydF4y2Bahttp://signal.salk.edu/tdnaprimers.2.htmlgydF4y2Ba,采用基于pcr的方法鉴定纯合T-DNA插入突变体。T-DNA左缘引物G2325 (LBb1.3)和基因特异性引物G3832和G3833gydF4y2Basag202-1gydF4y2Ba(SALK_052422)和G3809和G3810gydF4y2Basag202-2gydF4y2Ba(SALK_128476C),被使用。本研究使用纯合子植物进行T-DNA插入。本研究中使用的所有引物均列在补充表S中gydF4y2Ba1gydF4y2Ba.gydF4y2Ba
种子的灭菌和生长如前所述(Guo和Gan,gydF4y2Ba2006gydF4y2Ba).突变体、转基因植物和WT并排生长。gydF4y2Ba
质粒构建gydF4y2Ba
对于PgydF4y2BaSAG202gydF4y2Ba格斯gydF4y2Baconstruct (pGL8002),一个21201 bp的启动子片段gydF4y2BaSAG202gydF4y2Ba(At1G73805)用引物G3830和G3831从拟南芥基因组DNA中扩增,克隆至pGEM-T easy vector载体(Promega, Madison, USA),测序,用酶切酶切gydF4y2BaPst我gydF4y2Ba而且gydF4y2Ba甲我gydF4y2Ba插入到pBI211中形成pGL8002。gydF4y2Ba
生成dex诱导物gydF4y2BaSAG202gydF4y2Ba过表达结构(pGL8004),全长1357 bp的CDSgydF4y2BaSAG202gydF4y2Ba用引物G3828和G3829 PCR扩增拟南芥cDNA,连接到pGEM-T易载体上,测序,用gydF4y2Ba后第三gydF4y2Ba(Klenow补上)和gydF4y2BaPst我gydF4y2Ba,克隆到可诱导二元载体pGL1152 (Guo和Gan,gydF4y2Ba2006gydF4y2Ba)用gydF4y2BaSpe我gydF4y2Ba(Klenow补上)和gydF4y2BaPst我gydF4y2Ba形成pGL8004。gydF4y2Ba
酵母单杂交检测相关构建物:pGL3175(用于在酵母中产生GAD-AtNAP融合蛋白)如前所述(Zhang和Gan,gydF4y2Ba2012gydF4y2Ba).为了构建pGL8040(用于在酵母中产生GAD-SAG202融合蛋白),我们进行了研究gydF4y2BaSAG202gydF4y2Ba用引物G4020和G3992从拟南芥cDNA中扩增出编码序列,连接到pGEM-T易载体上,测序,用酶切酶切gydF4y2BaHindIIIgydF4y2Ba而且gydF4y2BaXhoIgydF4y2Ba,并克隆到pJG4-5中(Lin et al.,gydF4y2Ba2007gydF4y2Ba),组成pGL8040。来构造PgydF4y2BaSAG202gydF4y2Ba-LacZgydF4y2Ba,gydF4y2BaPgydF4y2BaICS1gydF4y2Ba-LacZgydF4y2Ba报告基因,1122-bpgydF4y2BaSAG202gydF4y2Ba启动子(PgydF4y2BaSAG202gydF4y2Ba)区域及1625bpgydF4y2BaICS1gydF4y2Ba启动子区gydF4y2BaICS1gydF4y2Ba)是从拟南芥基因组DNA中扩增出来的。所用引物对为G3967和G3918gydF4y2BaSAG202gydF4y2Ba, G3993和G3994gydF4y2BaPgydF4y2BaICS1gydF4y2Ba.将扩增的片段连接到pGEM-T易载体上,测序,然后用gydF4y2BaEcoR I- sal IgydF4y2Ba而且gydF4y2BaEcoR I- xho IgydF4y2Ba,并克隆到pLacZi-2 μ中(Lin et al.,gydF4y2Ba2007gydF4y2Ba)用gydF4y2BaEcoRI-XhoIgydF4y2Ba分别形成pGL8017和pGL8036。其他gydF4y2BaLacZgydF4y2Ba报告基因质粒含有各种截断gydF4y2BaSAG202gydF4y2Ba,gydF4y2BaICS1gydF4y2Ba,gydF4y2BaCBP60ggydF4y2Ba而且gydF4y2BaICS2gydF4y2Ba启动子区域同样使用补充表S中列出的引物构建gydF4y2Ba1gydF4y2Ba.gydF4y2Ba
组织化学GUS染色,叶绿素测定,和gydF4y2Ba阵线/ FmgydF4y2Ba分析gydF4y2Ba
组织化学GUS染色,叶绿素测定,gydF4y2BaFgydF4y2BavgydF4y2Ba/ FgydF4y2Ba毫克ydF4y2Ba如前所述(Zhang和Gan,gydF4y2Ba2012gydF4y2Ba;侯等人,gydF4y2Ba2013gydF4y2Ba).gydF4y2Ba
转录本qPCR分析gydF4y2Ba
拟南芥叶片总RNA提取和实时PCR分析根据(Hou et al.,gydF4y2Ba2013gydF4y2Ba).3 μg总RNA(用RNase-free DNase处理;New England Biolabs, USA), 42°C, mv -逆转录酶(Promega, USA) (Hu et al.,gydF4y2Ba2021gydF4y2Ba).qPCR时,每个稀释样品(40倍)取1 μL作为模板,25 μL反应。所有qPCR反应均在Bio-Rad IQ-5热循环仪上进行,退火温度约为55℃。循环阈值由IQ-5 Bio-Rad软件确定,假设引物效率为100% (Hu et al.,gydF4y2Ba2021gydF4y2Ba).定量RT-PCR所用引物见补充表SgydF4y2Ba1gydF4y2Ba.每个cDNA样本和引物对组合进行三次重复。gydF4y2Ba
植物转化gydF4y2Ba
将二进制向量中的各种构造转换为gydF4y2Ba根癌土壤杆菌gydF4y2Ba菌株ABI1随后被用于通过花浸法转化Col-0 (Clough和Bent,gydF4y2Ba1998gydF4y2Ba).每个转基因选择了大约30个耐药T1转基因株系;表型分析在T2代或高级代中进行。所有实验均采用纯合子植株。gydF4y2Ba
地塞米松(DEX)治疗gydF4y2Ba
按照Guo和Gan的描述进行糖皮质激素治疗(gydF4y2Ba2006gydF4y2Ba).30μgydF4y2Ba毫克ydF4y2Ba将塞米松(DEX)喷洒两次(每天一次)到盆栽中生长2周的植株上。照片是在最后一次喷洒后2天拍摄的。gydF4y2Ba
SA处理与化学诱导基因表达gydF4y2Ba
WT Col-0植物,gydF4y2BaatnapgydF4y2Ba而且gydF4y2Basag202gydF4y2Ba0.005% Silwet L-77加或不加5 mM SA喷洒突变植株(均为20日龄)。如前所述进行糖皮质激素治疗(Guo和Gan,gydF4y2Ba2006gydF4y2Ba).用含有0.005% Silwet L-77的30 μM地塞米松(DEX,一种合成糖皮质激素)喷洒20 d的植物。在喷施后不同时间点分别采集每株植株的第5、6、7朵莲座叶(从下起计数)进行RNA提取。gydF4y2Ba
酵母单杂交试验gydF4y2Ba
酵母单杂交试验如前所述(Zhang和Gan,gydF4y2Ba2012gydF4y2Ba).pGL3175 (gydF4y2BaGAD-AtNAPgydF4y2Ba融合基因)与不同的基因共转化gydF4y2BaLacZgydF4y2Ba对象的不同长度的报告器构造gydF4y2BaSAG202gydF4y2Ba而且gydF4y2BaICS1gydF4y2Ba启动子片段进入酵母菌株EGY48。类似地,pGL8040 (thegydF4y2BaGAD-SAG202gydF4y2Ba融合基因)与不同的基因共转化gydF4y2BaLacZgydF4y2Ba对象的不同长度的报告器构造gydF4y2BaICS1gydF4y2Ba启动子片段进入酵母染色EGY48。在含有5-溴-4-氯-3-吲哚基-β- d -半乳糖吡喃苷(X-Gal)的合适脱落板上培养转化产物,使其呈蓝色。gydF4y2Ba
SA量化gydF4y2Ba
未衰老叶和中衰老叶(0.1 ~ 0.3 g WT),gydF4y2BaatnapgydF4y2Ba,gydF4y2Basag202gydF4y2Ba,gydF4y2Baics1gydF4y2Ba,和叶子(0.1-0.3 g)gydF4y2BaAtNAPgydF4y2Ba在gydF4y2Ba行,gydF4y2BaSAG202gydF4y2Ba在gydF4y2Ba使用LC-MS /MS收集化学诱导后不同时间点的游离SA谱线和对照谱线,并对其进行分析(Zhang et al.,gydF4y2Ba2013gydF4y2Ba).gydF4y2Ba
细菌生长试验gydF4y2Ba
细菌菌株gydF4y2Ba美国专利商标局gydF4y2BaDC3000悬浮液在无菌水中(ODgydF4y2Ba600gydF4y2Ba= 0.002),用无针注射器注入4周龄植株第6、7叶。为了测定接种叶片中细菌的生长情况,分别在接种后不久(0d)、1d或2d收集叶片样品。细菌接种剂制备、注射器注射和细菌病原体计数均按照之前描述进行(Katagiri et al.,gydF4y2Ba2002gydF4y2Ba).gydF4y2Ba
数据和材料的可用性gydF4y2Ba
数据和材料将根据合理要求提供。gydF4y2Ba
缩写gydF4y2Ba
- :gydF4y2Ba
-
拟南芥gydF4y2Ba
- 敏捷:gydF4y2Ba
-
地塞米松gydF4y2Ba
- EIL1:gydF4y2Ba
-
EIN3-like 1gydF4y2Ba
- EIN3:gydF4y2Ba
-
乙烯不敏感3gydF4y2Ba
- 迦得:gydF4y2Ba
-
GAL4激活域gydF4y2Ba
- 集成电路:gydF4y2Ba
-
isochorismategydF4y2Ba
- ICS1:gydF4y2Ba
-
等chorisate合成酶1gydF4y2Ba
- 政治:gydF4y2Ba
-
局部获得性耐药gydF4y2Ba
- 南京:gydF4y2Ba
-
NgydF4y2BaAM(没有顶端分生组织,牵牛花),ATgydF4y2Ba一个gydF4y2BaF1-2 (gydF4y2Ba拟南芥gydF4y2Ba激活因子),以及gydF4y2BaCgydF4y2BaUC2(杯状子叶,拟南芥)gydF4y2Ba
- 质/女士:gydF4y2Ba
-
液相色谱串联质谱gydF4y2Ba
- 小睡:gydF4y2Ba
-
nac样,由AP3/P1激活gydF4y2Ba
- 美国专利商标局:gydF4y2Ba
-
两gydF4y2Bapv。gydF4y2Ba番茄gydF4y2Ba
- S3H:gydF4y2Ba
-
SA 3-hydroxylasegydF4y2Ba
- S5H:gydF4y2Ba
-
SA 5-hydroxylasegydF4y2Ba
- 山:gydF4y2Ba
-
水杨酸gydF4y2Ba
- SARD1:gydF4y2Ba
-
全身性获得性抵抗不足1gydF4y2Ba
- 减少:gydF4y2Ba
-
senescence-associated基因gydF4y2Ba
- 特别行政区:gydF4y2Ba
-
全身获得性耐药性gydF4y2Ba
- TF:gydF4y2Ba
-
转录因子gydF4y2Ba
参考文献gydF4y2Ba
陈华,薛林,Chintamanani S, Germain H,林华,崔华,等。乙烯不敏感3和乙烯不敏感3- like1在拟南芥中抑制水杨酸诱导的缺陷2表达,负向调节植物先天免疫。植物学报。2009a;21(8): 2527-40。gydF4y2Bahttps://doi.org/10.1105/tpc.108.065193gydF4y2Ba.gydF4y2Ba
陈志,郑志,黄军,赖志,范斌。植物水杨酸生物合成的研究进展。植物信号行为研究。2009b;4(6): 493-6。gydF4y2Bahttps://doi.org/10.4161/psb.4.6.8392gydF4y2Ba.gydF4y2Ba
刘志刚,张志刚,张志刚。农杆菌介导拟南芥转化的一种简化方法。植物学报,1998;16(6):735-43。gydF4y2Bahttps://doi.org/10.1046/j.1365-313x.1998.00343.xgydF4y2Ba.gydF4y2Ba
植物只是对病原体说不。大自然。1998;394(6693):525 - 7。gydF4y2Bahttps://doi.org/10.1038/28958gydF4y2Ba.gydF4y2Ba
Dempsey DMA, Vlot AC, Wildermuth MC, Klessig DF。水杨酸的生物合成与代谢。拟南芥书刊。2011;2011:e0156。gydF4y2Bahttps://doi.org/10.1199/tab.0156gydF4y2Ba.gydF4y2Ba
范凯,毕碧娜,甘山,李峰,袁松,倪敏,等。一个新的NAP成员ghhnap参与了陆地棉的叶片衰老。中国生物医学工程学报,2015;26(3):344 - 344。gydF4y2Bahttps://doi.org/10.1093/jxb/erv240gydF4y2Ba.gydF4y2Ba
付志强,闫s,萨利赫A,王伟,卢布J,奥卡N,等。NPR3和NPR4是植物免疫信号水杨酸的受体。大自然。2012;486(7402):228 - 32。gydF4y2Bahttps://doi.org/10.1038/nature11162gydF4y2Ba.gydF4y2Ba
氮化镓s。衰老的荷尔蒙调节。进:Davies PJ,编辑。植物激素:生物合成,信号转导,行动!施普林格:纽约;2010.p . 597 - 617。gydF4y2Bahttps://doi.org/10.1007/978-1-4020-2686-7_26gydF4y2Ba.gydF4y2Ba
甘S, Amasino RM。理解衰老。叶片衰老的分子遗传调控与调控。植物科学进展。1997;32(2):313-9。gydF4y2Bahttps://doi.org/10.1104/pp.113.2.313gydF4y2Ba.gydF4y2Ba
贾锡安,罗曼A, Lamodière E,卡提诺J,布卡拉A,杜曼P,等。拟南芥ISOCHORISMATE SYNTHASE2基因的鉴定及生物学功能。植物科学进展。2008;37(3):344 - 344。gydF4y2Bahttps://doi.org/10.1104/pp.108.119420gydF4y2Ba.gydF4y2Ba
郭鹏,李忠,黄鹏,李波,方松,褚杰,等。转录因子WRKY75、水杨酸和活性氧组成的三重扩增环加速了叶片衰老。植物学报。2017;29(11):2854-70。gydF4y2Bahttps://doi.org/10.1105/tpc.17.00438gydF4y2Ba.gydF4y2Ba
郭艳,甘山。AtNAP是NAC家族转录因子,在叶片衰老中起重要作用。植物学报,2006;46(4):601-12。gydF4y2Bahttps://doi.org/10.1111/j.1365-313X.2006.02723.xgydF4y2Ba.gydF4y2Ba
郭毅,甘珊珊。叶片衰老与27种促衰老激素、病理和环境胁迫处理诱导基因表达谱的趋同与分化。植物细胞环境学报。2012;35(3):644-55。gydF4y2Bahttps://doi.org/10.1111/j.1365-3040.2011.02442.xgydF4y2Ba.gydF4y2Ba
郭艳,蔡智,甘山。拟南芥叶片衰老的转录组研究。植物细胞环境。2004;27(5):521-49。gydF4y2Bahttps://doi.org/10.1111/j.1365-3040.2003.01158.xgydF4y2Ba.gydF4y2Ba
郭艳,任刚,张凯,李忠,苗勇,郭慧。叶片衰老过程、调控与应用。生物化学学报。2021;1(1):5。gydF4y2Bahttps://doi.org/10.1186/s43897-021-00006-9gydF4y2Ba.gydF4y2Ba
侯凯,吴伟,甘SS. SAUR36是一个小的生长素up RNA基因,参与促进拟南芥叶片衰老。中国生物医学工程学报,2013;29(2):344 - 344。gydF4y2Bahttps://doi.org/10.1104/pp.112.212787gydF4y2Ba.gydF4y2Ba
胡勇,刘波,任宏,陈林,Watkins CB,甘善善。叶片衰老促进转录因子AtNAP激活其直接靶基因细胞分裂素氧化酶3,通过降解细胞分裂素促进衰老过程。高分子学报。2021;1(1):12。gydF4y2Bahttps://doi.org/10.1186/s43897-021-00017-6gydF4y2Ba.gydF4y2Ba
Katagiri F, Thilmony R, He SY。的gydF4y2Ba拟南芥gydF4y2Ba-gydF4y2Ba两gydF4y2Ba交互。拟南芥图书。2002;1:e0039。gydF4y2Bahttps://doi.org/10.1199/tab.0039gydF4y2Ba.gydF4y2Ba
Kou X, Watkins CB, Gan S-S。gydF4y2Ba拟南芥AtNAPgydF4y2Ba调节果实衰老。中国机械工程学报,2012;29(4):489 - 497。gydF4y2Bahttps://doi.org/10.1093/jxb/ers266gydF4y2Ba.gydF4y2Ba
李峰,李娟,钱敏,韩敏,曹林,刘华,等。桃NAP转录因子基因的鉴定及其在发育和衰老过程中在营养器官和生殖器官中的表达特征。前沿植物学报2016;7:1791。gydF4y2Bahttps://doi.org/10.3389/fpls.2016.00147gydF4y2Ba.gydF4y2Ba
李勇,刘凯,袁林,曹林,王涛,甘松,等。大白菜采后叶片衰老过程中BrNAP基因的克隆及功能分析。园艺学报。2021;48:60-72。gydF4y2Bahttps://doi.org/10.16420/j.issn.0513-353x.2020-0295gydF4y2Ba.gydF4y2Ba
梁超,王勇,朱勇,唐杰,胡波,刘林,等。OsNAP通过调节脱落酸的生物合成,直接针对水稻衰老相关基因,将脱落酸与叶片衰老联系起来。中国科学:自然科学(英文版),2014;29(3):344 - 344。gydF4y2Bahttps://doi.org/10.1073/pnas.1321568111gydF4y2Ba.gydF4y2Ba
林瑞,丁玲,王华,王辉。拟南芥转座酶转录因子对光信号通路的调控。科学。2007;318(5854):1302 - 5。gydF4y2Bahttps://doi.org/10.1126/science.1146281gydF4y2Ba.gydF4y2Ba
林伟,张华,黄东,申克东,蔡东,吴波,等。双定位WHIRLY1通过异chorismate SYNTHASE1、苯丙氨酸氨LYASE1和s -腺苷-l -蛋氨酸依赖的METHYLTRANSFERASE1的协同作用影响水杨酸的生物合成。植物科学进展。2020;44(4):344 - 344。gydF4y2Bahttps://doi.org/10.1104/pp.20.00964gydF4y2Ba.gydF4y2Ba
Metraux JP。水杨酸生物合成研究的最新突破。植物科学进展,2002;7(8):334 - 34。gydF4y2Bahttps://doi.org/10.1016/s1360 - 1385 (02) 02313 - 0gydF4y2Ba.gydF4y2Ba
Morris K, MacKerness SA, Page T, John CF, Murphy AM, Carr JP,等。水杨酸在叶片衰老过程中调控基因表达。植物学报,2000;23(5):677-85。gydF4y2Bahttps://doi.org/10.1046/j.1365-313x.2000.00836.xgydF4y2Ba.gydF4y2Ba
水杨酸在植物中的作用。植物化学学报。1992;43(1):439-63。gydF4y2Bahttps://doi.org/10.1146/annurev.pp.43.060192.002255gydF4y2Ba.gydF4y2Ba
rias - san Vicente M, Plasencia J.防御之外的水杨酸:它在植物生长发育中的作用。中国机械工程学报,2011;36(10):339 - 344。gydF4y2Bahttps://doi.org/10.1093/jxb/err031gydF4y2Ba.gydF4y2Ba
植物防御中的水杨酸环。植物学报,2003;6(4):365-71。gydF4y2Bahttps://doi.org/10.1016/s1369 - 5266 (03) 00058 - xgydF4y2Ba.gydF4y2Ba
Shirasu K, Nakajima H, Rajasekhar VK, Dixon RA, Lamb C.水杨酸增强了一种激动剂依赖的增益控制,放大了防御机制激活中的病原体信号。植物学报。1997;9(2):261-70。gydF4y2Bahttps://doi.org/10.1105/tpc.9.2.261gydF4y2Ba.gydF4y2Ba
盈余SL,乔丹BR,墨菲AM,卡尔JP,托马斯B,马克内斯SA-H。紫外线b诱导拟南芥的反应:水杨酸和活性氧在编码光合作用和酸性致病相关蛋白转录本调控中的作用。植物学报,1998;21(7):685-94。gydF4y2Bahttps://doi.org/10.1046/j.1365-3040.1998.00325.xgydF4y2Ba.gydF4y2Ba
刘马田T, L, Y,徐D,陈问李g .拟南芥的红光对于细长HYPOCOTYL3整合时代,光信号负调控叶片衰老。植物科学进展。2020;32(5):1574-88。gydF4y2Bahttps://doi.org/10.1105/tpc.20.00021gydF4y2Ba.gydF4y2Ba
Truman W, Glazebrook J.共表达分析确定了CBP60g和SARD1调控的假定靶点。中国生物医学工程学报。2012;12(1):216。gydF4y2Bahttps://doi.org/10.1186/1471-2229-12-216gydF4y2Ba.gydF4y2Ba
Uauy C, Distelfeld A, Fahima T, Blechl A, Dubcovsky J.一个调控衰老的NAC基因提高了小麦籽粒蛋白质、锌和铁含量。科学。2006;314(5803):1298 - 301。gydF4y2Bahttps://doi.org/10.1126/science.1133649gydF4y2Ba.gydF4y2Ba
王玲,津田K,楚门W,佐藤M,阮吕,Katagiri F,等。CBP60g和SARD1在水杨酸信号传导中起部分冗余的关键作用。植物学报,2011;36(6):344 - 344。gydF4y2Bahttps://doi.org/10.1111/j.1365-313X.2011.04655.xgydF4y2Ba.gydF4y2Ba
王勇,崔旭,杨波,徐松,魏旭,赵鹏,等。WRKY55转录因子通过调控拟南芥活性氧和水杨酸生物合成相关基因的转录,正向调控叶片衰老和防御反应。发展。2020;147年。gydF4y2Bahttps://doi.org/10.1242/dev.189647gydF4y2Ba.gydF4y2Ba
Wildermuth MC, Dewdney J, Wu G, Ausubel FM。植物防御中,水杨酸的合成需要异chorisate合成酶。大自然。2001;414(6863):562 - 5。gydF4y2Bahttps://doi.org/10.1038/35107108gydF4y2Ba.gydF4y2Ba
于旭,徐勇,闫松。水杨酸和乙烯协同促进叶片衰老。中国生物医学工程学报,2011;29(5):529 - 529。gydF4y2Bahttps://doi.org/10.1111/jipb.13074gydF4y2Ba.gydF4y2Ba
张凯,甘珊珊。脱落酸- atnap转录因子- sag113蛋白磷酸酶2C调控链对衰老拟南芥叶片脱水的控制植物科学进展。2012;gydF4y2Bahttps://doi.org/10.1104/pp.111.190876gydF4y2Ba.gydF4y2Ba
张凯,夏霞,张勇,甘珊珊。aba调控的高尔基定位蛋白磷酸酶控制拟南芥叶片衰老过程中的水分流失。植物学报(自然科学版);2011;30(4):366 - 366。gydF4y2Bahttps://doi.org/10.1111/j.1365-313X.2011.04821.xgydF4y2Ba.gydF4y2Ba
张凯,Halitschke R,尹超,刘成杰,甘松松。水杨酸3-羟化酶通过介导水杨酸分解代谢调节拟南芥叶片寿命。中国科学院学报(自然科学版),2013;gydF4y2Bahttps://doi.org/10.1073/pnas.1302702110gydF4y2Ba.gydF4y2Ba
张松,李超,王锐,陈勇,舒松,黄锐,等。拟南芥线粒体蛋白酶FtSH4通过调控wrky依赖的水杨酸积累和信号通路参与叶片衰老。植物科学进展。2017a;173(4): 2294-307。gydF4y2Bahttps://doi.org/10.1104/pp.16.00008gydF4y2Ba.gydF4y2Ba
张颖,曹颖,邵强,王玲,王辉,李娟,等。ZmNAP基因对玉米抗衰老及产量性状的调控作用河南农业科学,2012b; 41:19-24。gydF4y2Ba
张勇,赵磊,赵娟,李勇,王娟,郭锐,等。S5H/DMR6编码水杨酸5羟化酶,调节水杨酸稳态。植物学报。2017b; 175:1082-93。gydF4y2Bahttps://doi.org/10.1104/pp.17.00695gydF4y2Ba.gydF4y2Ba
张勇,徐松,丁鹏,王东,程奕婷,何俊,等。植物特异转录因子家族的两个成员对水杨酸合成和系统获得性抗性的控制。中国科学(d辑:自然科学),2010,26(3):344 - 344。gydF4y2Bahttps://doi.org/10.1073/pnas.1005225107gydF4y2Ba.gydF4y2Ba
张勇,徐松,丁鹏,王东,程奕婷,何俊,等。植物特异转录因子家族的两个成员对水杨酸合成和系统获得性抗性的控制。自然科学进展,2010;26(3):344 - 344。gydF4y2Bahttps://doi.org/10.1073/pnas.1005225107gydF4y2Ba.gydF4y2Ba
邹娟,Lü P,姜丽,刘凯,张涛,陈杰,等。RhNAP转录因子通过调节细胞分裂素分解代谢调控玫瑰花瓣脱水耐性和衰老。高分子学报。2021;1(1):13。gydF4y2Bahttps://doi.org/10.1186/s43897-021-00016-7gydF4y2Ba.gydF4y2Ba
确认gydF4y2Ba
我们感谢Richard Amasino博士(威斯康星大学麦迪逊分校)对手稿早期版本的批判性阅读。James Giovannoni和Alan Collmer(康奈尔大学)进行有益的讨论。gydF4y2Ba
资金gydF4y2Ba
本研究得到了美国国家科学基金会(NSF)拨款MCB-0445596,能源部(DOE)拨款DE-FG02-02ER15341和康奈尔大学(S.G.)的支持。B.L.和Y.H.均获中国学者联谊会奖学金资助。gydF4y2Ba
作者信息gydF4y2Ba
作者及隶属关系gydF4y2Ba
贡献gydF4y2Ba
s.g.构想了这个项目,s.g.和y.w.设计了这个项目。Y. W.、B. L.和Y. H.进行了实验。S. G.和Y. W.撰写了手稿。所有作者都阅读并批准了最终的手稿。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
伦理批准并同意参与gydF4y2Ba
不适用。gydF4y2Ba
发表同意书gydF4y2Ba
所有作者特此同意出版该作品。gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者声明没有相互竞争的经济利益。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Ba
伟德体育在线施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。gydF4y2Ba
补充信息gydF4y2Ba
附加文件1:gydF4y2Ba
补充图S1。gydF4y2Baatnap、sag202/sard1和ics1缺失突变体叶片衰老延迟表型;gydF4y2Ba补充图S2。gydF4y2Ba不同衰老阶段WT、atnap、sag202和ics1突变体叶片CBP60g和ICS2转录水平的qPCR分析gydF4y2Ba补充表S1。gydF4y2Ba本研究使用的引物。gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba.创作共用公共领域奉献弃权书(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)适用于本条所提供的资料,除非在资料的信用额度中另有说明。gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
王勇,刘斌,胡勇。gydF4y2Baet al。gydF4y2Ba一个正反馈调节回路,SA-gydF4y2BaAtNAPgydF4y2Ba-gydF4y2BaSAG202 / SARD1gydF4y2Ba-gydF4y2BaICS1gydF4y2Ba-SA,在SA生物合成中参与叶片衰老,但不参与防御反应。gydF4y2Ba摩尔园艺gydF4y2Ba2gydF4y2Ba, 15(2022)。https://doi.org/10.1186/s43897-022-00036-xgydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s43897-022-00036-xgydF4y2Ba
关键字gydF4y2Ba
- 老化gydF4y2Ba
- 生物压力gydF4y2Ba
- 反馈调节gydF4y2Ba
- 叶寿命gydF4y2Ba
- 水杨酸gydF4y2Ba
- 衰老相关基因(gydF4y2Ba凹陷gydF4y2Ba)gydF4y2Ba