摘要
类胡萝卜素是合成的类异戊二烯代谢物新创在所有的光合生物中。类胡萝卜素在植物的光合作用、光保护、色素沉着、植物激素合成和信号传递等方面具有多种功能。它们作为合成维生素A的前体和膳食抗氧化剂对人类也至关重要。类胡萝卜素对植物和人类的重要作用促使我们对类胡萝卜素代谢和调节的理解取得了重大进展。类胡萝卜素代谢产物的新调控因子和新作用不断被发现。本文综述了类胡萝卜素代谢的研究现状,重点介绍了类胡萝卜素积累的内在调控和多维调控的研究进展。我们还讨论了类胡萝卜素的功能演变,农业和园艺应用,以及未来研究的一些关键领域。
简介
类胡萝卜素是一类对生命至关重要的类异戊二烯代谢物。包括植物、藻类和蓝藻在内的所有光合生物都合成类胡萝卜素,作为生存所必需的色素。在植物中,类胡萝卜素是光合作用和光保护所必需的。它们作为光收集色素和光系统的结构成分起着关键作用。类胡萝卜素还为植物激素脱落酸(ABA)和独脚金内酯(SLs)的生物合成提供前体。此外,类胡萝卜素衍生物可作为响应环境和发育线索的信号分子,或作为植物生长的调节剂。许多花、果实和根中大量积累的类胡萝卜素使其呈现鲜艳的橙色、黄色或红色,具有重要的生态和农学价值。
类胡萝卜素除了在植物中的基本作用外,对人类的营养和健康也至关重要。维生素A原类胡萝卜素,如β-胡萝卜素和α-胡萝卜素,是维生素A的前体,对眼睛和免疫系统至关重要。维生素A缺乏可导致严重后果,包括失明和死亡,影响着全球约三分之一的学龄前儿童(https://news.un.org/en/story/2018/05/1008782).膳食中的类胡萝卜素作为抗氧化剂有助于降低各种慢性疾病的风险,如癌症和心血管疾病(Eggersdorfer和Wyss2018).此外,叶黄素和玉米黄质作为黄斑色素在减少年龄相关眼病的发病方面很重要(Sauer等。2019).人们为提高营养价值和健康效益的粮食作物中的类胡萝卜素水平做出了巨大努力(Wurtzel et al。2012;朱利亚诺2017;郑等。2020).
由于类胡萝卜素对植物和人类的重要性,类胡萝卜素在植物中的代谢已被深入研究(Nisar等。2015;Rodriguez-Concepcion等人。2018;Sun等人。2018;•伍兹2019).类胡萝卜素的生物合成途径已经建立,并在许多植物物种中被广泛探索。近年来,类胡萝卜素代谢的调控已经引起了广泛的关注(Stanley和Yuan2019;Luan等人。2020;孙和李2020;Liang等。2021).类胡萝卜素降解和稳定储存已成为关注的另一个领域,因为作物中的最终类胡萝卜素含量是生物合成、转化和储存的净结果(Cazzonelli和Pogson)2010;袁等。2015 b;Sun等人。2018;Hermanns等人。2020;Liang等。2021;Torres-Montilla和Rodriguez-Concepcion2021).而类胡萝卜素衍生的植物激素ABA和SLs已被广泛研究(Finkelstein2013;Chen等。2020),在信号和调节植物生长发育中的其他类胡萝卜素成为类胡萝卜素领域的一个令人兴奋的研究领域(Hou et al。2016;达历山德罗和哈沃2019;Felemban等人。2019;莫雷诺等人。2021).在这篇综述中,我们重点介绍了类胡萝卜素代谢的现状,并重点介绍了我们在多个水平上对类胡萝卜素代谢的内在调控的最新进展。此外,我们还讨论了类胡萝卜素的功能演化、农业和园艺应用,以及进一步了解类胡萝卜素在植物中的代谢和功能的机会和方向。
类胡萝卜素代谢途径和酶
植物类胡萝卜素的核心生物合成途径
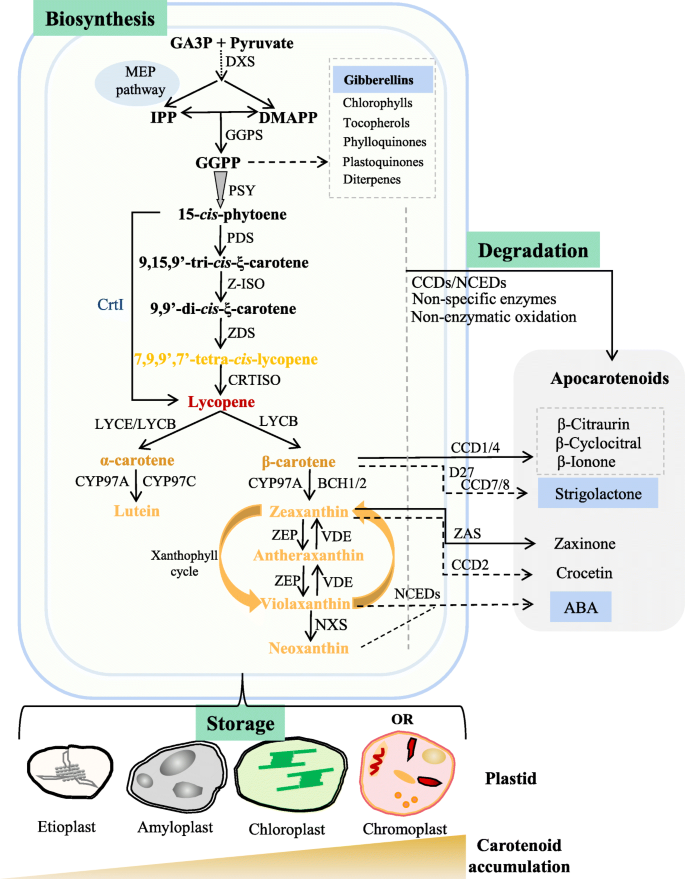
植物类胡萝卜素主要是四萜类化合物和合成的新创在几乎所有种类的质体中(Sun et al。2018;李等人,2016).类胡萝卜素的生物合成开始于通过质体定位的甲基赤藓糖醇4-磷酸(MEP)途径合成C5基本结构单元异戊烯基焦磷酸盐(IPP)及其烯丙基异构体二甲基烯丙基焦磷酸盐(DMAPP)。1).1-脱氧-d -木酮糖5-磷酸合成酶(DXS)被认为是MEP途径中的主要限速酶(Estevez et al。2001).三个IPP单元连续缩合到DMAPP,通过GGPP合成酶(GGPPS)生成C20前体香叶酰香叶酰焦磷酸(GGPP)。植物基因组通常包含多个具有多个细胞区室的GGPPS副本,其中一种或两种异构体似乎对细胞功能所需的大多数GGPP的产生很重要(Barja et al。2021;巴尔贾和罗德里格斯-康塞普西翁2021).GGPPS与各种GGPP消耗酶之间的直接相互作用允许引导GGPP产生类胡萝卜素、赤霉素、叶绿素、生育酚、叶醌、塑醌或其他二萜(Ruiz-Sola et al.)。2016;Zhou等。2017;巴尔贾和罗德里格斯-康塞普西翁2021)(图。1).
植物类胡萝卜素在质体中的代谢途径示意图。类胡萝卜素生物合成利用质体MEP途径提供C5前体代谢产物IPP和DMAPP。类胡萝卜素生物合成途径的第一步涉及两个C的缩合20.GGPPs转换成C40一类类胡萝卜素生物合成的主要限速酶PSY催化的类胡萝卜素。类胡萝卜素降解包括由CCDs和nced、非特异性酶和非酶氧化产生的各种类胡萝卜素,包括植物激素ABA和独脚金内酯。植物激素用蓝色突出显示。不同质体具有不同的储存能力,在叶绿体中积累很少的类胡萝卜素,在染色体中积累大量的类胡萝卜素。OR是唯一已知的善意的质体生物发生的调节因子。MEP,甲基赤藓糖醇4-磷酸;GA3P,甘油醛3-磷酸;IPP,异戊二磷酸;DMAPP,二磷酸二甲基烯丙基;GGPP,香叶基二磷酸香叶基;DXS, 1-脱氧-d -木酮糖5-磷酸合成酶;GGPPS, GGPP合成酶;PSY, phytoene synthase;PDS,植物烯去饱和酶; Z-ISO, ζ-carotene isomerase; ZDS, ζ-carotene desaturase; CrtISO, carotenoid isomerase; CrtI, bacterial phytoene desaturase; LCYE, lycopene ε-cyclase; LCYB, lycopene β-cyclase; BCH, β-carotene hydroxylase; CYP97A, cytochrome P450 carotene β-hydroxylase; CYP97C, cytochrome P450 carotene ε-hydroxylase; ZEP, zeaxanthin epoxidase; VDE, violaxanthin de-epoxidase; NXS, neoxanthin synthase; CCD, carotenoid cleavage dioxygenase; NCED, 9-独联体-epoxycarotenoid加双氧酶;ZAS,扎辛酮合成酶;ABA,脱落酸;或者,橙色蛋白
核心类胡萝卜素生物合成途径包括缩合、去饱和/异构化、羟基化、氧化和环氧化等步骤,以生成各种胡萝卜素和叶黄素(Nisar等。2015;Rodriguez-Concepcion等人。2018;Sun等人。2020年,一个).植烯合成酶(PSY)是特定类胡萝卜素生物合成途径中第一个参与的酶,它催化两个GGPP分子的缩合生成第一个类胡萝卜素15-独联体八氢番茄红素(无花果。1).PSY被认为是类胡萝卜素生物合成的主要限速酶(Cazzonelli和Pogson2010;尼萨尔等人。2015;Sun等人。2018).其活性在引导代谢通量进入通路中起关键作用(Maass et al.)。2009;Rodriguez-Villalon等人。2009),极大地影响类胡萝卜素含量(Paine et al.;2005).小组通常在植物基因组中作为一个小家族存在,最多有三个成员。PSY异构体在植物中表现出组织特异性的表达模式,并进化出不同的生化性质和酶活性(Fraser et al。2000;曹等。2019).15 -独联体然后依次去饱和和异构化生成红色的全-反式细菌中,ζ-胡萝卜素去饱和酶(PDS)、ζ-胡萝卜素去饱和酶(ZISO)、ζ-胡萝卜素去饱和酶(ZDS)和类胡萝卜素异构酶(CRTISO)催化的番茄红素,而不是单一的植物素去饱和酶CrtI (Sandmann2021).植物中的多酶步骤能够产生各种独联体-胡萝卜素在调节叶片和质体发育中的信号作用(Avendano-Vazquez et al.)2014;Cazzonelli等人。2020).所有-的后续环化反式-番茄红素通过番茄红素ε-环化酶(LCYE)和/或番茄红素β-环化酶(LCYB)分别在β-β和β-ε分支中形成对称的橙色β-和α-胡萝卜素。这两个分支之间的分子协同作用调节了分支的通量,并影响下游类胡萝卜素的产生(Harjes等。2008).
四种类胡萝卜素羟化酶,包括两种非血红素β-环羟化酶(BCH1和BCH2)和两种细胞色素P450型羟化酶(CYP97A和CYP97C),分别催化α-和β-胡萝卜素羟化生成黄色叶黄素和玉米黄质(图2)。1).β-β分支的玉米黄质被玉米黄质环氧化酶催化生成紫黄质,并被紫黄质去环氧化酶(VDE)还原。这种相互转换,称为叶黄素循环,代表了在高光强下保护植物的关键机制(Jahns和Holzwarth2012).特征较少的新黄质合成酶(NXS)催化新黄质的形成(Neuman等。2014;佩罗等人。2020),总结出核心生物合成途径(Nisar et al.;2015;Rodriguez-Concepcion等人。2018;Sun等人。2020年,一个).
随着新酶或具有新功能的酶的进化,红辣椒中的双功能酶辣椒素/吸收素合酶(CCS)产生了一系列物种特异性的类胡萝卜素,如辣椒素和吸收素(甜椒)及虎百合(百合lancifolium),以及鸡眼花瓣中的虾青素(阿多尼斯sp)。合成的类胡萝卜素也经常通过酯化改性来增强类胡萝卜素的积累和稳定性(Berry等。2019;Watkins和Pogson2020)或通过糖基化来增加流动性(Diretto等。2019).
类胡萝卜素降解途径
类胡萝卜素作为具有共轭双键的碳氢化合物分子是不稳定的。它们在细胞中持续降解,有时降解速率很高(Beisel等。2010).酶和非酶氧化裂解都参与类胡萝卜素的降解(图。1),在植物中产生多种类胡萝卜素,包括植物激素、色素、挥发物、生长调节剂和信号分子(Sun et al.。2020年,一个;Liang等。2021;莫雷诺等人。2021).类胡萝卜素经历特定的酶氧化分解,这是由一种称为类胡萝卜素裂解加氧酶(CCO)的酶家族催化的(Ahrazem等人。2016;贝尔特兰和斯坦吉2016;Liang等。2018;达尔等人。2020).植物CCO家族由9-组成独联体-环氧类胡萝卜素双加氧酶(NCEDs)和类胡萝卜素裂解双加氧酶(CCDs)。CCDs被分为几个亚家族CCD1, CCD2, CCD4, CCD7, CCD8和新发现的扎辛酮合成酶(ZAS)1990CCD10 (Wang et al.;2019;Ablazov等。2020;Zhong等。2020).CCOs在具有底物特异性的特定位点切割类胡萝卜素,因此决定了类胡萝卜素降解产物的类型。
植物激素ABA和SL的合成需要两组CCOs。nced专门切割9-独联体-紫黄素和9-独联体-新黄质形成黄硫素,这是生产ABA的第一步(Schwartz等。1997;Tan等人。2003).CCD7和CCD8依次裂解9-独联体-β-胡萝卜素生产卡拉内酯用于SL生物合成(Alder et al.;2012).近年来,SL生物合成途径已被很好地阐明(Jia et al。2018;Fiorilli等人。2019;莫雷诺等人。2021).
各种其他ccd负向调节类胡萝卜素含量或参与植物中的挥发性和颜色形成(Ahrazem等。2016;贝尔特兰和斯坦吉2016;Liang等。2018;达尔等人。2020).CCD1定位于质体外,并在不同的双键位置切割广泛的类胡萝卜素(Vogel等。2008).在某些情况下,其表达与挥发物的产生和类胡萝卜素水平有关(Auldridge等。2006;Dutta等人。2021).CCD4还具有广泛的底物特异性,并影响各种植物的类胡萝卜素含量和色素沉着(Ohmiya等。2006;Falchi等人。2013;Gonzalez-Jorge等人。2013;郑等。2019;Gao等。2021).CCD2在番红花中有限,并切割玉米黄质用于藏红花番红花素的生产(Frusciante et al。2014;Ahrazem等人。2016).最近的工作确定了糖基转移酶和特定的ABC转运蛋白参与西红花苷的合成和运输(Demurtas等。2019;Diretto等人。2019;López等。2021).CCD10在一些植物物种中被鉴定出来,编码一种独特的CCD,促进玉米对磷酸盐饥饿的耐受性(Zhong等。2020)。
在调节植物生长发育、共生和植物防御食草动物方面,更多具有植物激素样功能的类人素已被阐明(Moreno等。2021).它们包括β-环香橼醛、β-环天牛酸、β-欧诺酮、氯安内酯和α-欧诺酮,这些分子来自β-胡萝卜素或α-胡萝卜素的降解(Wei等。2011;达历山德罗等人。2018;狄金森等人。2019;村田等人。2019)以及从紫黄素裂解得到的二羧酸类鳀鱼(Jia et al.;2019 b).最近的研究发现了一个新的CCD亚家族ZAS,在大多数陆地植物中常见,它在调节植物生长以及独脚金内酯和ABA的生物合成中裂解玉米黄质产生扎辛酮(Wang et al.)。2019;Ablazov等。2020).虽然一些类夹竹桃素作为信号分子,但其他如凤尾鱼和扎辛酮通过与激素相互作用来实现其功能(Moreno等。2021).
除了ccd介导的特异性裂解外,类胡萝卜素降解还由非特异性酶(包括脂氧合酶和过氧化物酶)和光化学氧化进行(Sun等。2020年,一个).类胡萝卜素的非特异性氧化导致随机裂解产生非特异性类胡萝卜素产物。最近的研究强调了非特异性酶和非酶氧化在水果成熟和谷物收获后贮藏过程中对类胡萝卜素的降解和类胡萝卜素的产生的重要贡献(Schaub等。2017;Gao等。2019).植物中许多类胡萝卜素的进一步分解代谢仍有待完全阐明。最近一项关于类胡萝卜素解毒机制的研究揭示了植物类胡萝卜素的代谢(Koschmieder et al。2021).
类胡萝卜素在质体中的积累和储存
质体和类胡萝卜素积累
质体是类胡萝卜素生物合成和储存的主要场所。不同类型的质体积累类胡萝卜素的能力和能力显著不同,从叶绿体中很少的类胡萝卜素到染色质中大量的类胡萝卜素(Li等。2016;Sun等人。2018)(图。1).黄成体在深色生长的组织中发现,主要积聚叶黄素和紫黄素(Park等。2002).类胡萝卜素和叶绿素前体积聚在膜性结构的层状体(PLB)中,以确保光照时向叶绿体的过渡(Park等。2002;Pipitone等人。2021).黄植体中类胡萝卜素水平极低可能是光敏色素相互作用因子(PIFs)抑制的速率限制酶PSY低表达和活性的结果(Toledo-Ortiz等人)。2010),并以不活跃的形式与PLB相关(Welsch等。2000).类似地,一种负责叶绿素生物合成的光依赖性原叶绿素氧化还原酶(lor)最近被发现以非活性形式存在于黄植体的PLB膜中(Floris和Kuhlbrandt)2021).在去黄化过程中,光被激活小组而且LPOR用于光合作用的色素的合成与一起独联体-胡萝卜素衍生类胡萝卜素信号(Cazzonelli et al.;2020)等,以启动叶绿体的发育。
淀粉质体在种子、根和块茎中储存淀粉颗粒。淀粉质体主要在包膜中积累各种叶黄素,如叶黄素、玉米黄质和紫黄素(Lopez等)。2008年,一个).淀粉体作为储存淀粉的质体,通常会积累有限数量的类胡萝卜素(Wurtzel等。2012).许多因素,如低生物合成能力、缺乏脂蛋白隔离亚结构、主要用于淀粉合成的碳通量,都可能限制类胡萝卜素的生物合成、积累和/或在淀粉体中的稳定存储(Li等。2016;Sun等人。2018).然而,淀粉体有可能积累相对高水平的类胡萝卜素,正如许多转基因研究所记录的那样(Paine等。2005;Diretto等人。2007;Bai等人。2016;莫蒂默等人。2016).由于许多淀粉类作物的类胡萝卜素含量较低,因此在这些作物中丰富和稳定储存类胡萝卜素,特别是维生素原A类胡萝卜素,对于改善人类营养和健康非常重要(朱利亚诺2017;Sun等人。2018;郑等。2020).
叶绿体是光合作用的场所。类胡萝卜素在光合作用和光保护中起着不可或缺的作用。类胡萝卜素主要为叶黄素、β-胡萝卜素、紫黄素和新黄素,在叶绿体中以相对较高的丰度积累,但颜色通常被叶绿素所掩盖。类囊体膜和光收集复合物是类胡萝卜素分子的主要庇护所(Ruiz-Sola和Rodriguez-Concepcion)2012),但类胡萝卜素如何从主要包膜的生物合成位置传递到这些位点仍然未知。最近,一种叶绿体Sec14-like 1 (CPSFL1)蛋白被报道与类胡萝卜素结合并转运衣藻(García-Cerdán等。2020).本研究提出了类胡萝卜素代谢产物在叶绿体中易位的可能性。
在园艺作物的许多彩色器官中,染色体是储存多种和大量类胡萝卜素的主要部位(Egea等。2010;李与元2013;袁等。2015 b;Sun等人。2018;Ohmiya等人。2019;Sadali等人。2019;Hermanns等人。2020).染色体质体可以来源于成熟过程中的叶绿体,如番茄,也可以来源于非光合组织中的前质体和淀粉体(Li等。2001;霍纳等人。2007;Egea等。2011).染色体含有类胡萝卜素隔离亚结构,这些亚结构在不同的物种和组织中是不同的,有时甚至在同一组织中共存(Schweiggert和Carle2017).这些隔离亚结构的多样性,包括球状、晶体状、膜质、纤维状和管状,可能是由积累的类胡萝卜素的水平和种类所决定的,反之亦然(Hermanns等。2020;温等人。2020).
调节染色体形成的基因
虽然在许多蔬菜和水果中经常观察到染色体,但控制染色体生物发生和复制的基因却鲜为人知。的橙色(或)基因是唯一已知的善意的质体生物发生的调节因子。的功能获得等位基因或是导致橙乳、花椰菜和甜瓜果实中β-胡萝卜素大量积累的原因(Lu et al。2006;Tzuri等人。2015),也明显存在于胡萝卜和甘薯中(Ellison et al。2018;Gemenet等。2020;Coe等人。2021).尽管野生型OR调节PSY蛋白的稳定性(Zhou et al.;2015 b;Park等人。2016;Welsch等人。2018),类胡萝卜素的高水平积累在或突变不是由于生物合成活性(Li et al。2001;李等人。2006;Chayut等人。2015;Chayut等人。2017).相反,它是染色体生物发生的直接结果(Lu et al。2006;洛佩兹等人。2008 b;李等人。2012;袁等。2015年,一个;Chayut等人。2017;Yazdani等人。2019).Co-expression的小组和或启动染色体生物发生的功能获得等位基因显著提高了拟南芥种子中维生素原A和总类胡萝卜素的含量和稳定性(Sun等。2021),显示了调节染色体储存库形成以及类胡萝卜素富集和种子稳定储存的生物合成活性的有效性。
细胞中染色体的数量和大小对其合成和储存类胡萝卜素的能力至关重要。近年来,人们发现染色体复制采用了叶绿体的二元分裂机制(Sun et al。2020 b).的功能获得等位基因或促进染色体的生物发生,只有一个或两个大的染色体存在于每个受影响的细胞(Li等。2001;Chayut等人。2017).在甜瓜中发现的OR的自然变体,OR他的被发现与叶绿体3 (ARC3)的积累和复制特异性相互作用,并与ARC6的Paralog (PARC6)竞争抑制染色体复制(Sun et al.;2020 b).这种抑制和限制可以通过增加其他质体分裂因子如质体分裂1 (plastid division 1, PDV1)的表达来放松,从而导致染色体数量的增加或他的植物(Sun等。2020 b).此外,野生型OR被发现通过与转录因子TCP14相互作用来介导黄化拟南芥子叶中的叶绿体生物发生(Sun et al.;2019),并通过与叶绿体内膜(TIC)上的几个Translocons相互作用,调节前蛋白的输入,促进质体前蛋白转运的后期(Yuan等。2021).OR代表了质体发育中的多功能调节因子(Zhou et al。2011;D'Andrea等人。2018;Sun等人。2019;Chayut等人。2021;Chen等。2021;金等人。2021)以及类胡萝卜素的生物合成和积累(Kim等。2018;Feder等人。2019;奥索里奥2019;Miyagishima2020).
转录调控因子已被确定影响类胡萝卜素在染色体中的积累,但大多数因素也是与果实成熟相关的一般调控因子(Stanley和Yuan2019;孙和李2020).RCP2是一种四肽重复蛋白,最近被证明可以充分调节猴花中类胡萝卜素积累的染色体发育(Stanley等。2020).但是,它是发育相关调控因子还是染色体特异性调控因子还有待进一步研究。最近,有报道称,叶片组织中光合能力的丧失和类胡萝卜素积累的增强导致叶绿体向叶绿体转变(Llorente等。2020),揭示了染色体形成的机制基础。此外,叶绿体相关蛋白降解蛋白水解途径中的泛素E3连接酶SP1同源物被证明可以通过质体蛋白导入机制的重构来促进叶绿体向染色体的转变(Ling等。2021).在过去几年里,有关染色体形成的知识不断增加(Torres-Montilla和Rodriguez-Concepcion)2021),显然,高水平类胡萝卜素积累的染色体生物发生的性质需要进一步探索。
类胡萝卜素代谢的分级调节
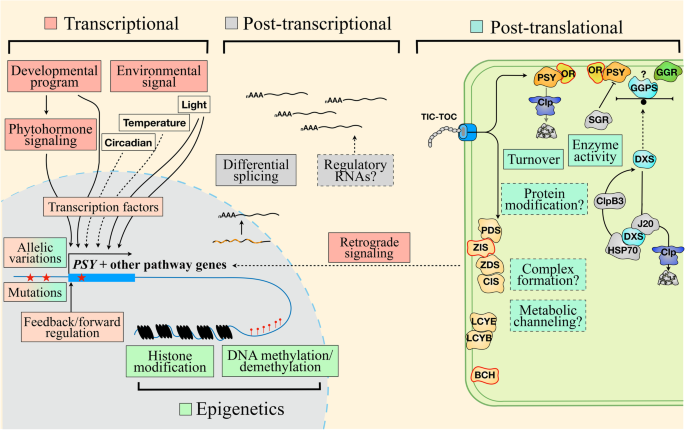
类胡萝卜素在绿色组织中对植物的生命至关重要,在作物的其他器官中以不同的数量和成分积累,在严格的调控和微调下合成,以响应环境和发育线索。在我们对类胡萝卜素生物合成的调控机制的理解方面取得了重大进展。包括转录、转录后和翻译后调控以及表观遗传控制在内的多层调控参与了通路活性的调节(Ruiz-Sola和Rodriguez-Concepcion)2012;Luan等人。2020;孙和李2020),其内容见图2.类胡萝卜素降解调控的信息也正在出现(Watkins和Pogson2020;Liang等。2021).对产生胡萝卜素的调节机制的研究强调了与其他细胞过程交联的复杂性,在此不作综述。
转录调控
转录调控一直是理解胡萝卜素发生调控的重点。转录调控是类胡萝卜素生物合成的首要调控机制(Ruiz-Sola和Rodriguez-Concepcion)2012;孙和李2020).它是类胡萝卜素在园艺作物中巨大多样性的主要贡献者(Yuan et al。2015 b;Ohmiya等人。2019;Hermanns等人。2020).通过转录因子、突变、自然变异、反馈和前馈等途径结构基因表达的调节都可以影响植物中的胡萝卜素发生(图2)。2).
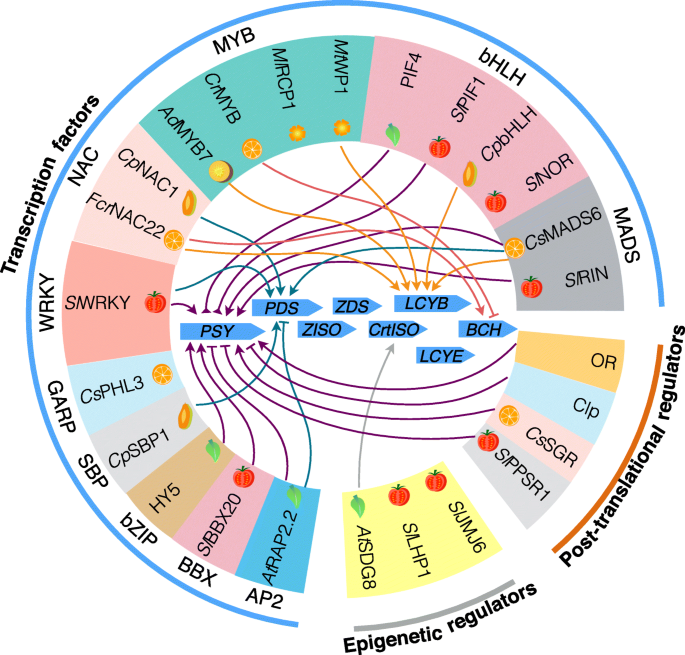
转录因子是调节胡萝卜素基因转录的中心。最近的研究发现并验证了转录因子或调控因子在植物物种中直接转录激活或抑制类胡萝卜素结构基因的表达(Stanley和Yuan2019;Hermanns等人。2020;孙和李2020).其他的胡萝卜素转录因子也不断被发现(孟等。2020;龚等。2021;Lu等人。2021 b;朱等。2021年,一个).这些转录因子通过转录调节单个或多个通路基因(图。3.).而研究的转录因子已被证明直接结合类胡萝卜素代谢途径基因的启动子,无论它们是否善意的调节类胡萝卜素代谢的调节因子及其在同一作物物种间或物种内的作用仍有待充分的文献记载。此外,许多转录因子是参与植物生长发育多个过程的一般调控因子。有些可能间接影响类胡萝卜素代谢(Stanley和Yuan2019).
一些已知的转录因子,翻译后调控因子,和表观遗传调控因子,调节胡萝卜素通路基因或PSY蛋白的表达。表明它们直接作用于叶片、富含类胡萝卜素的果实和花等不同器官的通路基因或PSY蛋白。这些转录因子由转录因子家族聚类。MYB,成髓细胞病转录因子家族;Rcp1,还原类胡萝卜素色素1;Wp1,白色花瓣1;NAC、NAM、ATAF、CUC转录因子;WRKY, WRKYGQK基序转录因子;Phl3,磷酸盐饥饿反应因子like3;鳞状细胞启动子结合蛋白1; HY5, ELONGATED HYPOCOTYL5; BBX, B-box transcription factors; RAP2.2, APETALA2/ethylene response factor-type transcription factor 2.2; PIF, PHYTOCHROME-INTERACTING FACTORS; bHLH, basic Helix-Loop-Helix transcription factors; NOR, NON-RIPENING transcription factor; MADS, MADS-box containing transcription factors; RIN, RIPENING INHIBITOR; OR, ORANGE protein; Clp, Clp protease; SGR, STAY GREEN; PPSR1, Plastid Protein Sensing RING E3 ligase 1; JMJ6, Jumonji C-terminal (JmjC) domain-containing demethylase 6; LHP1, LIKE HETEROCHROMATIN PROTEIN1; SDG8, SET DOMAIN GROUP 8. At,拟南芥;Sl,茄属植物lycopersicum、西红柿;Cp,番木瓜L。木瓜;计算机科学,素类,甜橙;铬、柑橘网状、柑桔;广告,猕猴桃deliciosa猕猴桃;毫升,Mimulus lewisiimonkeyflower;太,Medicago truncatula
已知环境和发育信号调节类胡萝卜素代谢(Dhami和Cazzonelli2020;孙和李2020)(图。2).然而,这些信号是如何在转录因子水平上收敛的还不清楚。光是调节光合组织和胡萝卜根中类胡萝卜素结构基因表达的最重要的线索(Llorente等。2017;昆乌略亚和斯坦格2021).PIFs和ELONGATED HYPOCOTYL5 (HY5)是光形态建成的关键拮抗调控因子,可直接调控小组在去黄化过程中,在对阴影和温度的响应中,将光信号与小组转录(Toledo-Ortiz等。2010;Toledo-Ortiz等人。2014;bu - torrent等人。2015;Wang等。2021 b).有趣的是,许多光形态建成和光接受基因也出现在黑暗中调节类胡萝卜素的生物合成和胡萝卜贮藏根的发育(Quian-Ulloa和strange2021).最近研究表明FcrNAC22在金桔果实中介导红光诱导的胡萝卜素发生(Gong等。2021).此外,光触发光异构化独联体-胡萝卜素影响胡萝卜素发生(Park et al.;2002;Cazzonelli等人。2020).除了光,其他环境因素,如温度、昼夜节律和营养状况也可能影响类胡萝卜素的积累(Dhami和Cazzonelli2020).柑橘磷酸盐饥饿反应因子CsPHL3直接结合到LCYB1启动子负向调节类胡萝卜素代谢,与植物营养状况建立联系(Lu等。2021年,一个).然而,环境信号在激活胡萝卜素基因表达方面仍有很多未知之处。
发育信号似乎是类胡萝卜素基因在水果和花的转录调节的主要决定因素(Sun和Li2020).在许多情况下,类胡萝卜素的生物合成与几个上游生物合成基因的转录上调和下游基因的转录下调有关(Ronen等。1999;Chayut等人。2015)或改变一些关键基因的表达,如PSY1而且dx辣椒(Berry et al。2019),LCYB而且BCH在红肉木瓜(Zhou et al。2019),LCYB在猕猴桃中(Ampomah-Dwamena et al。2019).在花的发育过程中,已经发现了几种转录因子来调节类胡萝卜素色素,如MYB激活剂WHITE PETAL1m . truncatula降低了猴花中的类胡萝卜素色素1 (RCP1) (Sagawa等。2016;孟等。2019).RIN作为番茄果实成熟的主要调控因子,直接调控番茄果实成熟SlPSY1表达式(Martel et al.;2011).这些研究提供了发育信号和胡萝卜素基因表达之间的联系。发育信号也调节植物激素的产生。在水果成熟过程中,一个整合了发育和植物激素信号的复杂网络介导了胡萝卜素的生成(Liu et al。2015;孙和李2020).然而,发育信号通路中的许多元素仍然缺失。
此外,结构基因和调控因子的突变可以影响它们在mRNA和/或蛋白质水平上的表达,从而导致特定类胡萝卜素在植物中积累,特别是在园艺作物中。一个典型的例子就是各种颜色的番茄。黄色、橘色、橙色和橙红色的番茄果实积累了不同的主要类胡萝卜素,这是由途径基因突变引起的,包括PSY1, CrtISO, LCYE,或CYCB弗赖和格里尔森1993;Ronen等人。1999;Ronen等人。2000;艾萨克森等人。2002).的错义突变LCYB影响酶蛋白水平似乎是西瓜中番茄红素积累的原因(Zhang et al。2020).突变Z-ISO或齐柏林飞艇产生黄色和橙色果实的“Pinalate”甜橙(素类)、甜瓜、大白菜和胡椒(Galpaz et al。2013;Zhang等。2015;罗德里戈等人。2019;Lee等人。2021).
一些关键结构或调控基因的自然变异也会影响胡萝卜素生成途径的活性和类胡萝卜素最终产物的积累。的自然变异是众所周知的例子李阳疯狂英语β-胡萝卜素羟化酶(crtRB1)影响玉米籽粒中β-胡萝卜素水平(Harjes et al。2008;Yan等人。2010)以及甜玉米(Baseggio et al。2020)。红辣椒的颜色变化与dx而且PSY1辣椒素酯化(Berry等人。2019).结构基因的等位变异改变其转录物的丰度/活性,并调节特定类胡萝卜素的积累。启动子的自然变异CCD4b1被发现与微分紧密相关CCD4bβ-柑橘尿酸在柑橘皮中的表达、积累和颜色变化(Zheng et al。2019).
此外,反馈和前馈调节还提供了另一种控制。通过用细菌去饱和酶(crtI)中过度表达橘子而且古金深红番茄的突变体,在CRTISO和染色体特异性的番茄红素环化酶CYCB,分别发现代谢物改变引起的负反馈调节PSY1的前馈控制CYCB表达(Enfissi et al.;2017).反馈回路是代谢通路调控的重要组成部分。一个感知、连接和协调最终产物积累与初始转录和转录后机制的闭合回路形成了反馈调节的基础,并维持通量以确保植物中的类胡萝卜素稳态(Kachanovsky等)。2012;Fantini等人。2013;阿兰戈等人。2014;赖特等人。2014;辛普森等人。2018;Koschmieder等人。2021).
翻译后调节
与对转录调控机制的了解相比,对植物中胡萝卜素发生的转录后和翻译后调控的了解较少。活细胞中类胡萝卜素的产生是对各种信号和刺激作出反应的动态过程。翻译后和转录后调控,如差异剪接(Alvarez et al., 2016)或调控rna提供了额外的调控层,以调节类胡萝卜素酶的活性和微调类胡萝卜素的产生(Sun和Li2020)(图。2).翻译后调控包括蛋白质-蛋白质相互作用和通过多酶复合物的代谢通道等机制(Ruiz-Sola和Rodriguez-Concepcion)2012;尼萨尔等人。2015;孙和李2020).
近年来,通过蛋白质-蛋白质相互作用对胡萝卜素酶的翻译后调控有了越来越多的认识。类胡萝卜素生成酶与分子伴侣和Clp蛋白酶的相互作用调节了途径酶的功能形态,严格控制了其类胡萝卜素生物合成的蛋白稳态。例如,DXS酶活性和蛋白酶稳态在翻译后被调节,以响应质体的生理状态。DXS的非活性形式被dnaj样蛋白J20识别并传递给Hsp70伴侣蛋白,后者与Hsp100/ClpC1相互作用并通过Clp蛋白酶复合物降解,与Hsp100/ClpB3相互作用以激活(Pulido等。2013;普利多等人。2016;羊驼等。2017).类似地,PSY酶蛋白水平和蛋白平衡在翻译后调节胡萝卜素的发生。PSY在物理上与OR伴侣结合以获得活性,并与Hsp100/ClpC1识别的Clp蛋白酶结合以进行降解(Li等。2012;Zhou等。2015 b;Park等人。2016;Chayut等人。2017;D'Andrea等人。2018;Welsch等人。2018).有趣的是,最近的一项研究报道,质体蛋白感应环E3连接酶1 (PPSR1)与PSY1相互作用,并可能泛素化细胞质中的PSY1前体,以影响番茄果实中叶绿体PSY1蛋白的稳定水平,以促进胡萝卜素的生成(Wang等。2020 b).研究还发现,在番茄和柑橘中,PSY的活性受其相互作用伙伴STAY GREEN(一种参与叶绿素降解的镁脱盐酶)的调控(Luo et al.;2013;朱等。2021 b)(图。3.).
酶复合物的形成在影响代谢通量和亚细胞器定位方面很重要。通过GGPPS与PSY或3,3 v β-胡萝卜素羟化酶与4,4 o β-胡萝卜素加氧酶的酶融合,代谢通量分别有效地指向胡萝卜素的生成和虾青素的产生(Camagna等。2019;Nogueira等。2019),表明酶复合物在促进类胡萝卜素生物合成中的重要性。尽管提出了多种假定复合体(Ruiz-Sola和Rodriguez-Concepcion)2012),在活的有机体内在胡萝卜素发生过程中存在酶复合物的证据仅被报道,只有少数酶被证明存在于大型蛋白质复合物中(Lopez等。2008年,一个).
翻译后修饰(PTM)能够快速调节蛋白质功能,以响应代谢和环境变化。因此,它是一种普遍存在的蛋白质活性修饰机制。叶绿体中有许多已确定的PTM类型,包括磷酸化、赖氨酸乙酰化、赖氨酸甲基化、酪氨酸硝化、s -亚硝基化、谷胱甘肽酰化、素酰化和糖基化,而磷酸化是许多光系统蛋白质的翻译后修饰被充分研究(Grabsztunowicz et al.)。2017).PTMs可以调节一些类异戊二烯前体生物合成酶(Hemmerlin2013).几种类胡萝卜素生物合成酶也通过PhosPhAt预测了磷酸化位点(Durek等。2010).然而,这些pms及其在胡萝卜素发生中的作用仍需要在未来的实验中得到证实。
胡萝卜素发生的表观遗传调控
胡萝卜素发生表观遗传调控的发现扩大了我们对类胡萝卜素代谢调控的理解,尽管这仍然是类胡萝卜素研究中研究较少的领域。不同的表观遗传机制,如组蛋白修饰和DNA甲基化和去甲基化,增加了对胡萝卜素发生的另一层调控(Anwar等。2021)(图。2).一个著名的组蛋白修饰的胡萝卜素发生的调节因子是SDG8,一种组蛋白赖氨酸甲基转移酶,特异性地调节胡萝卜素的表达CrtISO通过维持组蛋白H3赖氨酸K4三甲基化(H3K4me3)标记CRTISO启动子和基因体(Cazzonelli等。2009).其他组蛋白修饰剂包括组蛋白赖氨酸去甲基酶JMJ6,异染色质蛋白1b (LHP1)和组蛋白变体H2A。Z被发现调节PSY1和/或其他胡萝卜素基因在番茄果实成熟过程中的表达(Li等。2020;Liang等。2020;袁等。2021)(图。3.).
DNA甲基化和去甲基化已被证明直接或间接地改变类胡萝卜素水平。由于DNA去甲基化控制果实成熟(Zhong等。2013;Lang等人。2017),胡萝卜素的调控可能是果实成熟过程中受影响的过程之一。TAGL1是一种番茄果实成熟调节剂,其DNA甲基化强度降低PSY1表达和减少胡萝卜素生成(Liu et al.;2020).去甲基化酶的突变sldml2导致启动子的DNA甲基化升高Psy1 z-iso ZDS,CrtISO并减少包括胡萝卜素生成在内的成熟过程(Lang et al。2017).DNA甲基化改变了R2R3-MYB转录因子在靶基因上的结合(Wang等。2020年,一个).转录起始位点周围的基因组区域的低甲基化CaPSY1, CaPDS, CaRIN而且CaNCED1已被证明在辣椒果实成熟过程中调节其转录丰度以影响胡萝卜素的生成(Xiao et al。2020).
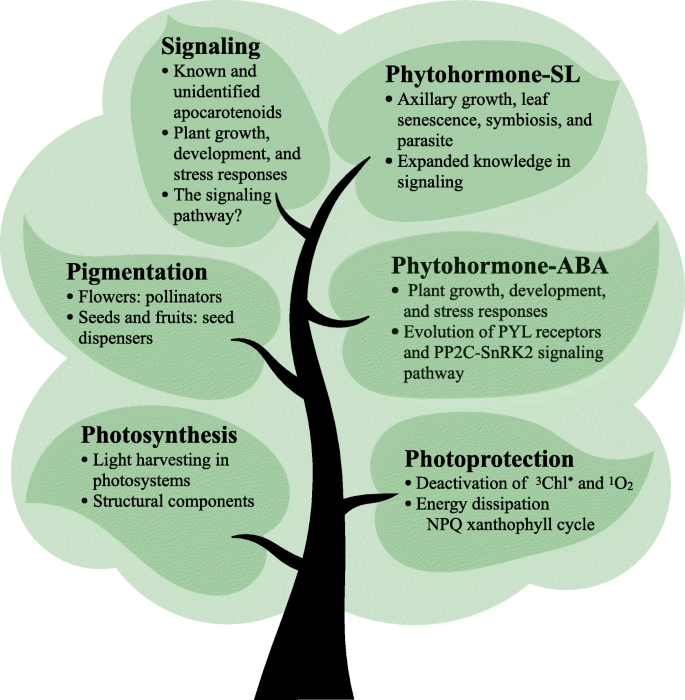
类胡萝卜素的功能进化
类胡萝卜素在光合作用中的辅助作用还是中心作用?
类胡萝卜素的生物合成与光合作用共同进化,以提供具有特定功能作用的代谢物(Takaichi2011;Sandmann2021)(图。4).类胡萝卜素吸收光能,并将其转移到光谱450-550 nm范围内的叶绿素中,这是叶绿素不吸收的范围(Hashimoto等。2016).因此,类胡萝卜素扩大了包括植物和藻类在内的光营养生物光合作用的光波长范围。
从进化的角度来看,类胡萝卜素已经出现在反应中心,与古代光合细菌的细菌叶绿素有关(Cardona等。2019).在不同系统发育类群的进化过程中,类胡萝卜素生物合成基因的横向转移在类胡萝卜素和光合作用之间建立了新的联系(Sandmann2021).在蓝藻中,分别参与植物素和ζ-胡萝卜素去饱和的CrtP和CrtQ开始在去饱和反应中使用氧化的塑醌作为辅因子(Breitenbach et al.)。2013).类胡萝卜素生物合成途径的这种变化将类胡萝卜素去饱和步骤与光合电子传递联系起来,为胡萝卜素生成对光合作用的适应提供了一种短期机制。
在陆地植物中,叶黄素、β-胡萝卜素、紫黄质和新黄质是典型的类胡萝卜素,也是叶绿体中含量最多的类胡萝卜素(Al-Babili和Beyer2005;Ruiz-Sola和Rodriguez-Concepcion2012).在绿色植物中,光收集复合物(LHCs)是叶绿素、类胡萝卜素和蛋白质的组装(Liu et al。2004;潘等人。2011;潘等人。2020).类胡萝卜素在lhc中起着稳定结构的额外作用。由于能量的运输和转换最终涉及叶绿素,传统上认为叶绿素起主导作用,而类胡萝卜素是“辅助”色素(Collini2019).
类胡萝卜素和叶绿素之间能量转移的时间尺度可以快到几十飞秒(Meneghin et al。2018;儿子等人。2020).光收集装置的复杂性也给揭示类胡萝卜素在光合作用中的内在作用带来了挑战。近年来,随着结构生物学和超快检测技术的应用,类胡萝卜素的作用被重新考虑,从“附属”到“中心”(Collini2019).通过量子化学评价,类胡萝卜素到叶绿素的能量转移被发现是连贯的,而不是松散的相互作用(Ghosh等。2017;Meneghin等人。2018).LHCII中的叶黄素分子已被确定为控制激发能量流的关键发色团(Son等。2019).这些研究指出类胡萝卜素在光收集中起着核心作用,而不是辅助作用。
除了光合复合物结合外,类胡萝卜素还在类囊体膜系统的形成和动力学中发挥结构作用,并调节类囊体膜的流动性(Havaux和Gruszecki)1993;Havaux1998;Bykowski等人。2021).此外,叶黄素类胡萝卜素被发现发挥“胶水”分子的作用,以稳定蓝藻中的叶绿素生物合成(Proctor等。2020).由于蓝藻是叶绿体的原核起源,类胡萝卜素的这种功能可能发生在叶绿体中,有待进一步研究。
光保护:保护植物
类胡萝卜素具有重要的光保护功能,以适应不断变化的光环境。已知它们可以使三态叶绿素和单态氧失活,以及耗散多余的光能,以防止光系统II的lhc的光合装置的光损伤(Frank和Cogdell)1996;jans和Holzwarth2012)(图。4).β-胡萝卜素存在于所有生物光系统的核心,可猝灭单线态氧(Telfer2005;Umena等人。2011;秦等。2015),尽管最近的一项研究表明,其他类胡萝卜素可以取代它(Xu et al。2020).叶黄素存在于外周LHC中(Qin et al。2015).天线系统已经发生了巨大的进化变化,不仅捕获和转移光能,而且还耗散激发能在陆地植物(Ruban和Murchie2012).
非光化学叶绿素荧光猝灭(non-光化学叶绿素荧光猝灭,NPQ)是光系统II将多余光能耗散为热量的最快速有效的机制,涉及紫黄质转化为玉米黄质(Niyogi and Truong2013;默奇和鲁班2020).紫黄质、花药黄质和玉米黄质的周期性相互转化,也称为叶黄素循环(图2)。1),作为一种能量耗散策略存在于绿藻和陆地植物中,从而减少活性氧的产生(Jahns和Holzwarth2012).在陆地植物中,玉米黄质在NPQ中起着核心作用,因为过量吸收的光能的猝灭经历了从叶绿素到叶绿素-玉米黄质异质二聚体的能量转移,然后才消散为热量(Holt et al.)。2005;Ahn等人。2008).玉米黄质的存在已被证明会影响天线系统LHCII与PsbS的相互作用,这在NPQ中对光保护至关重要(Wilk等。2013;Sacharz等人。2017).
色素沉着:与传粉者和播种者共同进化
许多开花植物依靠传粉者来促进繁殖过程。花和传粉者之间的相互作用是花性状多样化和物种形成的主要驱动力(Kay和Sargent2009;袁等。2013).色素沉着是吸引特定传粉者的重要特征,自然传粉者对花朵的色素沉着有明显的偏好(Shang等。2011).在模型系统中Mimulus lewisii,较低的花瓣含有两个由类胡萝卜素着色的黄色脊,由RCP1和RCP2调节(Sagawa etal .。2016;斯坦利等人。2020).这种色素沉着模式专门作为大黄蜂传粉者的花蜜向导(欧文和布拉德肖2011).蜜蜂和蜂鸟花性状的最新研究授粉的姐妹种耧斗菜进一步表明进化的性状套件的重要性,包括类胡萝卜素颜色性状与传粉者(爱德华兹等。2021).生物技术和进化基因组学的结合为理解花色素的进化动态和传粉者吸引机制提供了必要的方法(Frachon等。2021).
一些种子积累了大量鲜艳的类胡萝卜素,这在视觉上吸引了种子分发者,如鸟类。例如,红色类胡萝卜素中的黄青素海桐tobira种子作为引诱剂,鸟类吃种子并散布它们(Fujiwara等。2002).类胡萝卜素有助于水果的鲜艳颜色,这是一个明显的视觉信号,鼓励种子分发动物发现和消费。研究表明,果实颜色的发生在很大程度上与系统发育无关;相反,它是由非生物因素和与种子传播者的相互作用形成的(Valenta等。2018).此外,类胡萝卜素裂解产物(如β-腺苷酮和6-甲基-5-庚烯-2-酮)和其他挥发物的释放表明了水果的成熟,也吸引了种子分散生物(Dudareva等人)。2006;高夫和克利2006)
类胡萝卜素衍生经典激素:ABA
脱落酸(ABA)是一种类胡萝卜素衍生激素,已被广泛研究,并调节植物的许多生理活动,包括气孔运动、种子萌发、根发育和叶片衰老以及对非生物和生物胁迫的响应(Finkelstein2013;Chen等。2020)(图。4).ABA可以在几种蓝藻和藻类中检测到。然而,只有在绿藻中,常见的底物为9 ' -独联体在高等植物中可以检测到ABA生物合成的-新黄质(Giossi等。2020).
ABA被PYR/PYL受体家族感知(Park et al.;2009;卡特勒等人。2010).大多数藻类基因组不编码pyl样蛋白,只有少数例外。这些PYL样蛋白具有PP2C活性,但独立于ABA,这可能代表了PYL的祖先功能(de Vries et al.)。2018;Cheng等人。2019).同时,aba介导的PP2C-SnRK2信号级联通过PYL的微调导致脱落酸感知的配体独立起源是陆地植物征服可变胁迫的关键进化标志(Blázquez等。2020).
类胡萝卜素衍生的新激素:独脚金内酯
独脚金内酯(SLs)是另一类类胡萝卜素衍生的植物激素,最初发现促进与丛枝菌根真菌的共生相互作用(秋山等。2005).作为一类新的植物激素,SLs在陆生植物中发挥着调节腋下芽生长、叶片衰老和根系结构等多种功能(Gomez-Roldan et al.)。2008;Al-Babili和Bouwmeester2015;Bürger和乔里2020;莫雷诺等人。2021)(图。4).从植物中的类胡萝卜素合成SLs主要涉及一个核心途径,包括胡萝卜素异构酶(DWARF27)、CCD7、CCD8和细胞色素P450酶(MAX1) (Alder et al.)。2012;Abe等人。2014;Abuauf等。2018).在一些叶生藻类和Physcomitrella金属盘,也可以鉴定出SLs,但没有发现CCD8的同源物(Proust et al。2011;Delaux等人。2012),提出了植物进化祖先中SL生物合成的替代途径(Waters等。2017).
密集的努力有助于对SL如何通过受体触发下游反应的机制理解(Waters等。2017;莫雷诺等人。2021).转录抑制因子D53和SL受体D14之间的物理相互作用将信号感知和基因表达联系起来(Jiang等。2013;Zhou等。2013).D14作为SLs的受体,其结构要求相对宽松,可能是D14样蛋白家族逐渐新功能化的结果(Waters et al。2017).D14具有裂解SLs的水解酶活性和SL感知能力,这在植物激素受体中并不常见。最近的一项研究描述了D14双重功能的顺序作用,即D14在信号感知后通过水解裂解使生物活性SLs失活(Seto等。2019).
类夹心素信号:它是如何工作的?
植物在进化过程中吸收了类胡萝卜素作为信号或调节器(Wang et al。2021年,一个).除了ABA和SLs外,一系列已知和未识别的类夹心素作为信号分子或调节分子影响植物生长发育和应对环境压力,尽管大量类夹心素的作用仍然未知(Hou et al.。2016;达历山德罗和哈沃2019;Havaux2020;莫雷诺等人。2021)(图。4).β-环柠檬醛是一种挥发性类胡萝卜素,来源于β-胡萝卜素的非酶或酶氧化,作为响应非生物应激的信号(Ramel et al。2012;Shumbe等人。2014).它也是一种保守的根生长调节剂(Dickinson et al。2019),并通过与DXS的辅因子结合位点结合,沿着抑制DXS活性增强对食草动物的抗性(Mitra等。2021).从玉米黄质中分离出来的扎辛酮是一种分布在许多植物中的新型生长调节剂(Mi等。2018;Wang等。2019;Ablazov等。2020).从β-胡萝卜素中提取的凤尾鱼是一种新的信号分子,通过调节生长素分布来调节锚根的发育(Jia et al。2019年,一个;贾等。2021).此外,还有一些独联体-胡萝卜素衍生的未知类胡萝卜素信号介导植物叶片和质体发育(Avendano-Vazquez等。2014;Alagoz等人。2018;Cazzonelli等人。2020;Escobar-Tovar等人。2021;莫雷诺等人。2021).
要完全理解类夹竹桃素信号的一个关键问题是:细胞如何感知这些信号?在成功分离到独脚金内酯和ABA受体后,可能存在更多的类末梢胡萝卜素受体。在哺乳动物细胞中,已证明视黄醇受体可以结合β-夹心胡萝卜素(Eroglu2012;哈里森和夸德罗2018).事实上,仅仅是三种氨基酸的突变就可以将植物卡瑞金受体转变为独脚金内酯受体(Arellano-Saab et al.)。2021),这暗示了类胡萝卜素受体的灵活性。类胡萝卜素衍生激素受体是否也能识别其他类胡萝卜素分子,有待进一步研究。随着高精度蛋白质结构的可用性(Jumper等。2021)中,类胡萝卜素信号分子与潜在受体蛋白的分子对接可能提供一些线索。
类胡萝卜素信号的一种方式是类胡萝卜素代谢途径的反馈调节(Kachanovsky等。2012),尽管其机制尚不清楚。RNA结构可以作为配体结合方式蛋白质翻译的开关(de Jesus et al。2021).其相对较小的体积和较高的迁移率使其成为直接调节蛋白质表达的RNA结合配体的良好候选。这种依赖于夹心素的RNA开关是否是一种普遍机制,还有待进一步研究。
园艺和农业应用
由于类胡萝卜素是重要的营养物质和植物营养素,人们已作出重大努力来生产富含类胡萝卜素的作物(朱利亚诺2017;郑等。2020).代谢工程方法的进步和创新将促进生产更有营养的作物(Wurtzel2019;Irfan等人。2021).类胡萝卜素途径经过修饰的作物也有可能在园艺和农业应用中开发新的和/或改良品种。类胡萝卜素为植物器官提供颜色。改变类胡萝卜素的含量和组成可以使作物产生新的颜色,扩大作物多样性。由于类胡萝卜素是植物激素ABA和独脚金内酯生物合成的前体,操纵通路基因可以产生耐受胁迫的植物和/或改变植物结构。例子包括CRISPR/ cas9介导的突变CCD8在番茄中产生对飞虱的宿主抗性,飞虱是一组对作物造成严重损害的植物寄生虫(Bari et al。2019),以及过度表达LCYB2以提高甘薯的抗非生物胁迫能力(Kang等。2018).此外,CCD7而且Z-ISO水稻中的突变体已被证明可以提高分蘖数和产量(Liu et al。2013;Zhou等。2021)和敲除CCD8改变葡萄藤的茎结构(Ren et al.;2020).
对途径基因和调控基因的调控也可以改善其他一些理想的园艺和农艺性状。异源表达GGPPS使植物快速生长,早开花,植物种子产量更高(塔塔等。2016).的或作为类胡萝卜素生物合成PSY的主要翻译后调节因子的基因是一种伴侣蛋白(Zhou et al.;2015年,一个;Park等人。2016;Chayut等人。2017;Welsch等人。2018).它的过表达促进了转基因番茄的早开花、坐果和种子生产(Yazdani等。2019),并增强甘薯植物的耐热性(Kim等。2021).的表达LCYB还发现促进烟草植物更快生长、提早开花和增加生物量(Moreno等。2020)和延长番茄果实的保质期(Diretto et al。2020).这些工作表明,类胡萝卜素代谢途径和调控基因的遗传操作在园艺和农业应用中具有巨大的潜力。
结论和未来研究的重点领域
在对类胡萝卜素代谢和调控的认识以及类胡萝卜素代谢产物在植物生长发育中的新功能方面取得了重大进展。技术的快速进步也使更多的作物系统得以利用,以揭示共同和独特的调控机制。这些将类胡萝卜素研究带入了一个黄金时代。然而,在今后的类胡萝卜素研究中仍有许多悬而未决的问题。
类胡萝卜素代谢的内在调控因子的鉴定和验证仍然是类胡萝卜素研究的重点领域。虽然一些转录因子和调控因子已被证明可以调节类胡萝卜素代谢途径基因或酶的表达,但是否存在差距善意的调节剂,它们是否在植物物种中起作用,或者它们在调节类胡萝卜素代谢中的作用模式。
环境信号和发育信号共同调控类胡萝卜素基因表达,从而影响类胡萝卜素代谢。关于信号通路是什么或这些信号如何控制胡萝卜素的生成,还有很多未知的地方。
胡萝卜素酶被认为形成酶复合物,有效地推动代谢通量通过途径。然而,缺乏酶复合物的确凿证据。揭示类胡萝卜素生物合成酶复合物并了解其组装也将是未来的高要求。
由于类胡萝卜素是必需的光合色素,植物绿色组织中类胡萝卜素的合成必须与叶绿素的合成严格控制,以实现最佳的光合作用和叶绿体发育。这两种生物合成途径是如何协调调控的,或者共同的调控因子是什么,需要进一步研究。
最近发现的类胡萝卜素衍生的类胡萝卜素信号扩展了目前对植物信号的认识。需要回答的一些基本问题包括:许多未知的类胡萝卜素信号分子的身份是什么?类胡萝卜素信号的感知机制是什么?发育和/或环境信号是如何触发类末梢素信号的?
由于染色体是类胡萝卜素积累的细胞器,因此在许多园艺植物中,染色体发育对于类胡萝卜素的高水平积累至关重要。的功能获得等位基因或虽然已知能触发染色体形成,但染色体生物发生的性质尚不清楚,无论是质体生物学还是主要粮食作物中类胡萝卜素的富集都需要进一步探索。
类胡萝卜素是必需的营养物质,对健康很重要。类胡萝卜素生物强化作物仍然是类胡萝卜素研究的主要焦点。更好地理解类胡萝卜素代谢和染色体形成的调控机制和酶动力学将指导类胡萝卜素的常规育种和遗传工程。酶动力学知识将指导更强大的胡萝卜素原酶的定向进化,而快速进化的基因编辑技术将使作物代谢途径的优化和重新设计成为可能。由于类胡萝卜素在植物器官中的生物合成、降解和质体中的稳定积累共同决定了类胡萝卜素在植物器官中的水平,多靶点工程将为主要作物类胡萝卜素的生物强化提供更有效和精确的途径。随着工具箱中增加更多的遗传工具和策略,可以开发出更多的黄金作物,以改善人类的营养和健康。此外,还可以对作物进行一些理想的园艺和农艺性状改良,以增强农业系统的抗灾能力。
数据和材料的可用性
不适用。
缩写
- 阿坝:
-
脱落酸
- ARC3:
-
叶绿体的积累和复制
- BBX:
-
B-box转录因子
- bHLH:
-
基本的Helix-Loop-Helix转录因子
- CCD:
-
类胡萝卜素裂解双加氧酶
- CCO:
-
类胡萝卜素裂解加氧酶
- CCS技术:
-
辣椒红/辣椒红素合酶
- 中电控股:
-
Clp蛋白酶
- CRISPR:
-
成簇规则间隔短回文重复
- CRTISO:
-
类胡萝卜素异构酶
- DMAPP:
-
dimethylallyl焦磷酸
- dx:
-
1-脱氧-d -木酮糖5-磷酸合成酶
- GGPP:
-
geranylgeranyl二磷酸
- HY5:
-
延长的下胚轴5
- IPP:
-
isopentenyl焦磷酸
- JMJ6:
-
Jumonji c端(JmjC)结构域去甲基酶6
- LCYB:
-
番茄红素β检测环化酶
- LCYE:
-
番茄红素ε检测环化酶
- 大型强子对撞机:
-
聚光复合物
- LHP1:
-
像异染色质蛋白
- 麦斯:
-
含有转录因子的MADSbox
- MAX1:
-
腋窝生长多1
- MYB:
-
成髓细胞病转录因子家族
- 南京:
-
NAM, ATAF和CUC转录因子
- nc:
-
9-cis-epoxycarotenoid加双氧酶
- 也没有:
-
非成熟转录因子
- NPQ:
-
non-photochemical淬火
- nx:
-
neoxanthin合酶
- 或者:
-
橙色的蛋白质
- PDS:
-
八氢番茄红素desaturase
- PDV1:
-
质体1部
- PHL3:
-
磷酸盐饥饿反应因子如3
- 进行通信:
-
PHYTOCHROME-INTERACTING因素
- 拉钮:
-
原片层体
- 小组:
-
八氢番茄红素合成酶
- PP2C:
-
蛋白质磷酸酶2c
- PPSR1:
-
质体蛋白感应环E3连接酶1
- 铝:
-
转译后的修改
- 所有:
-
PYR1-LIKE
- PYR:
-
PYRABACTIN阻力
- RAP2.2:
-
APETALA2/乙烯反应因子型转录因子
- RCP1&2:
-
减少类胡萝卜素色素1和2
- RIN:
-
成熟抑制剂
- SGR:
-
住环保旅馆
- SDG8:
-
设置域组8
- SBP1:
-
鳞状细胞启动子结合蛋白1
- SL:
-
strigolactone
- TAGL1:
-
番茄状的
- VDE:
-
黄质de-epoxidase
- WP1:
-
白色PETAL1
- WRKY:
-
含有WRKYGQK基序的转录因子
- 咱:
-
zaxinone合酶
- ZDS:
-
ζ-胡萝卜素desaturase
- ZISO:
-
ζ-胡萝卜素异构酶
参考文献
阿部S,佐藤A,田中K,木木T,麻美K,太田S,等。拟南芥中卡拉内酯被MAX1转化为卡拉内酯酸,其甲酯可直接与AtD14相互作用。中国自然科学(英文版),2014;https://doi.org/10.1073/pnas.1410801111.
Ablazov A, Mi J, Jamil M,贾鹏鹏,王建勇,冯强,等。夹竹桃素类扎辛酮是拟南芥根中独脚金内酯和脱落酸生物合成的正向调节因子。植物科学进展2020;11:578。https://doi.org/10.3389/fpls.2020.00578.
胡晓明,刘志刚,刘志刚,等。拟南芥DWARF27基因编码全反式/9-顺式-β-胡萝卜素异构酶,由生长素、脱落酸和磷酸盐缺乏诱导。植物科学通报2018;https://doi.org/10.1146/annurev-arplant-043014-114759.
安志强,陈志强,陈志强,等。植物天线蛋白中调节光收集的电荷转移状态的结构。科学。2008;320:794-7。https://doi.org/10.1126/science.1154800.
Ahrazem O, Gomez-Gomez L, Rodrigo MJ, Avalos J, Limon MC.微生物和光合生物的类胡萝卜素切割加氧酶的特征和功能。中国生物化学杂志,2016;https://doi.org/10.3390/ijms17111781.
Akiyama K, Matsuzaki K, Hayashi H.植物倍半萜烯诱导丛枝菌根真菌菌丝分枝。大自然。2005;435:824-7。https://doi.org/10.1038/nature03608.
阿拉戈兹,纳亚克P,达米N,卡佐内利CI。顺式胡萝卜素在植物中的生物合成、进化和调控:新型信号代谢产物的出现。生物化学学报。2018;654:172-84。https://doi.org/10.1016/j.abb.2018.07.014.
Al-Babili S, Beyer P.黄金大米——上路五年——还剩五年?植物科学进展,2005;https://doi.org/10.1016/j.tplants.2005.10.006.
李国强,李国强。独脚金内酯,一种新的类胡萝卜素衍生植物激素。植物学报,2015;https://doi.org/10.1146/annurev-arplant-043014-114759.
Alder A, Jamil M, Marzorati M, Bruno M, Vermathen M, Bigler P,等。从-胡萝卜素到卡拉内酯的过程,卡拉内酯是一种类似独脚内酯的植物激素。科学。2012;335:1348-51。https://doi.org/10.1126/science.1218094.
Álvarez D, Voß B, Maass D, Wüst F, Schaub P, Beyer P, Welsch R.植物素合酶剪接变异5' utr介导翻译调控胡萝卜素发生。中国生物医学工程学报,2016;29(4):344 - 344。https://doi.org/10.1104/pp.16.01262
Ampomah-Dwamena C, Thrimawithana AH, Dejnoprat S, Lewis D, Espley RV, Allan AC.猕猴桃(猕猴桃)R2R3-MYB转录因子调节叶绿素和类胡萝卜素积累。新植物,2019;221:309-25。https://doi.org/10.1111/nph.15362.
Anwar S, Brenya E, Alagoz Y, Cazzonelli CI。植物发育过程中胡萝卜素发生的表观遗传控制。植物科学2021;40:23-48。https://doi.org/10.1080/07352689.2020.1866829.
黄志刚,朱丹,黄志刚,黄志刚,等。胡萝卜素羟化酶活性对胡萝卜中α-胡萝卜素和类胡萝卜素含量的影响。植物学报。2014;26:2223-33。https://doi.org/10.1105/tpc.113.122127.
阿雷兰诺-萨博A, Bunsick M, Al Galib H,赵w, Schuetz S, Bradley JM,等。三种突变将植物卡瑞金受体转化为独脚金内酯受体。118.美国国立自然科学研究院,2021;https://doi.org/10.1073/pnas.2103175118.
Auldridge ME, Block A, Vogel JT, Dabney-Smith C, Mila I, Bouzayen M,等。拟南芥类胡萝卜素裂解双加氧酶家族的三个成员的特征表明了这种多功能酶家族的不同作用。植物学报,2006;https://doi.org/10.1111/j.1365-313X.2006.02666.x.
Avendano-Vazquez AO, Cordoba E, Llamas E, San Roman C, Nisar N, De la Torre S,等。拟南芥中ζ -胡萝卜素去饱和酶突变体中产生的一种未特征的伪胡萝卜素衍生信号调控叶片发育以及叶绿体和核基因的表达。植物学报。2014;26:2524-37。https://doi.org/10.1105/tpc.114.123349.
白春华,王志强,王志强,等。水稻胚乳中类胡萝卜素生物合成和积累的瓶颈受到前体产物平衡的影响。中国生物工程学报,2016;14(3):366 - 366。https://doi.org/10.1111/pbi.12373.
Bari VK, Nassar JA, kin SM, Gal-On A, Ron M, Britt A,等。CRISPR/ cas9介导的番茄类胡萝卜素裂解双加氧酶8突变对寄生杂草埃及菲利班切(Phelipanche aegyptiaca)具有抗性。科学代表2019;9:11438。https://doi.org/10.1038/s41598-019-47893-z.
Barja MV, Ezquerro M, Beretta S, Diretto G, Florez-Sarasa I, Feixes E,等。几种香叶酰香叶酰二磷酸合成酶异构体为番茄类胡萝卜素的生物合成提供了代谢底物。新叶绿醇,2021。https://doi.org/10.1111/nph.17283.
Barja MV, Rodriguez-Concepcion M.植物香叶基香叶基二磷酸合成酶:每个(基因)家族都有一个故事。aBIOTECH。2021:1-10。https://doi.org/10.1007/s42994-021-00050-5.
马志刚,马志刚,张志刚,等。鲜玉米粒中类胡萝卜素的自然变异受甜玉米中不常见变异的控制。植物基因组。2020;13:e20008。https://doi.org/10.1002/tpg2.20008.
Beisel KG, Jahnke S, Hofmann D, Koppchen S, Schurr U, Matsubara S.利用14CO2脉冲追踪标记揭示拟南芥成熟叶片中胡萝卜素和叶绿素a的持续翻转。植物科学学报。2010;52(2):388 - 388。https://doi.org/10.1104/pp.109.151647.
王志刚,王志刚。一种新的类胡萝卜素衍生途径。亚细胞生物化学,2016;79:239-72。https://doi.org/10.1007/978-3-319-39126-7_9.
Berry HM, Rickett DV, Baxter CJ, Enfissi EMA, Fraser PD。红辣椒果实中类胡萝卜素的合成与分离及其对颜色强度性状的影响。中国机械工程学报,2019;https://doi.org/10.1093/jxb/erz086.
Blázquez MA, Nelson DC, Weijers D.植物激素反应途径的进化。植物生物学,2020;71:327-53。https://doi.org/10.1146/annurev-arplant-050718-100309.
布- torrent J, tolado - ortiz G, Ortiz-Alcaide M, Cifuentes-Esquivel N, Halliday KJ, Martinez-Garcia JF,等。遮荫对类胡萝卜素生物合成的调控依赖于特定的拮抗转录因子和辅助因子亚群。中国生物医学工程学报,2015;https://doi.org/10.1104/pp.15.00552.
张志刚,张志刚,张志刚,等。CrtO类胡萝卜素酮酮酶对蓝细菌PCC 6803的催化性能及反应机理。清华大学学报(自然科学版),2013;https://doi.org/10.1016/j.abb.2012.11.003.
Bürger M, Chory J.直尾金内酯信号的多种模型。植物科学进展(英文版);https://doi.org/10.1016/j.tplants.2019.12.009.
Bykowski M, Mazur R, Wojtowicz J, Suski S, Garstka M, Mostowska A,等。太硬而不能折叠:类囊体流动性的类胡萝卜素依赖性降低阻碍了叶绿体颗粒的形成。植物物理学报。2021;185:210-27。https://doi.org/10.1093/plphys/kiaa009.
Camagna M, Grundmann A, Bar C, Koschmieder J, Beyer P, Welsch R.酶融合消除胡萝卜素发生过程中香叶酰香叶酰二磷酸的竞争。植物学报。2019;179:1013-27。https://doi.org/10.1104/pp.18.01026.
曹华,罗华,袁华,马eissa, Thannhauser TW, Welsch R,等。邻近的芳香族氨基酸组合控制番茄植烯合酶的活性差异。植物学报。2019;30(2):388 - 388。https://doi.org/10.1104/pp.19.00384.
Cardona T, Sanchez-Baracaldo P, Rutherford AW, Larkum AW。光系统II的太古宙早期起源。地球生物学。2019;17:127-50。https://doi.org/10.1111/gbi.12322.
Cazzonelli CI, Cuttriss AJ, Cossetto SB, Pye W, Crisp P, Whelan J,等。染色质修饰组蛋白甲基转移酶SDG8对拟南芥类胡萝卜素组成和芽分枝的调控。植物细胞。2009;21:39-53。https://doi.org/10.1105/tpc.108.063131.
曹建平,李建平,李建平,等。一种顺式胡萝卜素衍生的类胡萝卜素调节黄体和叶绿体的发育。Elife。2020;9:e45310。https://doi.org/10.7554/eLife.45310.
Cazzonelli CI, Pogson BJ。源-汇:植物中类胡萝卜素生物合成的调控。植物科学进展,2010;15:266-74。https://doi.org/10.1016/j.tplants.2010.02.003.
张晓东,张晓东,张晓东,张晓东,等。橙色蛋白控制类胡萝卜素通量的独特机制。植物学报。2017;173:376-89https://doi.org/10.1104/pp.16.01256.
张晓燕,王晓燕,张晓燕,等。大量分离转录组分析揭示了甜瓜果实中与橙色等位基因变异和果实β -胡萝卜素积累相关的代谢和细胞过程。BMC植物生物学2015;15:274。https://doi.org/10.1186/s12870-015-0661-8.
奈查ut,袁华,Saar Y,郑勇,孙涛,周旭,等。比较转录组分析揭示了甜瓜果实中类胡萝卜素的产生和质体的发育。Hortic Res. 2021; 8:12 2。https://doi.org/10.1038/s41438-021-00547-6.
陈凯,李国军,Bressan RA,宋晓平,朱建科,赵艳。植物脱落酸动态、信号转导及其功能。中国生物医学工程学报。2020;62:25-54。https://doi.org/10.1111/jipb.12899.
陈文伟,王强,曹天杰,陆松。UBC19是拟南芥ORANGE核定位的新相互作用蛋白。植物信号行为。2021;16:1964847。https://doi.org/10.1080/15592324.2021.1964847.
程胜,鲜伟,付勇,Marin B, Keller J,吴涛,等。陆生接合线虫科的基因组研究为陆生植物进化提供了新的视角。Cell. 2019; 179:1057-1067 e1014。https://doi.org/10.1016/j.cell.2019.10.019.
王晓燕,王晓燕,王晓燕,等。胡萝卜素羟化酶基因对胡萝卜类胡萝卜素积累的影响[J]。理论应用,2021;134:3351-62。https://doi.org/10.1007/s00122-021-03901-3.
光合作用中的类胡萝卜素:“辅助”色素的复仇。化学2019;5:494-5。https://doi.org/10.1016/j.chempr.2019.02.013.
卡特勒SR,罗德里格斯PL,芬克尔斯坦RR,艾布拉姆斯SR.脱落酸:核心信号网络的出现。植物学报,2010;https://doi.org/10.1146/annurev-arplant-042809-112122.
D'Alessandro S, Havaux M.感知光系统II中的β -胡萝卜素氧化以掌握植物的胁迫耐受性。新植物,2019;223:1776-83。https://doi.org/10.1111/nph.15924.
D'Alessandro S, Ksas B, Havaux M.解码β -环切蛋白介导的逆行信号,揭示植物对光氧化胁迫耐受的解毒反应的作用。植物学报。2018;30:2495-511。https://doi.org/10.1105/tpc.18.00578.
D'Andrea L, Simon-Moya M, Llorente B, Llamas E, Marro M, Loza-Alvarez P,等。干扰Clp蛋白酶破坏番茄果实成熟过程中类胡萝卜素的积累。中国机械工程学报,2018;https://doi.org/10.1093/jxb/erx491.
de Jesus V, Qureshi NS, Warhaut S, Bains JK, Dietz MS, Heilemann M,等。核糖体开关:核糖体开关需要rprotein作为调制器来调节翻译。Nat Commun. 2021; 12:1-7。https://doi.org/10.1038/s41467-021-25024-5.
德弗里斯J,柯蒂斯BA,古尔德SB,阿奇博尔德JM。陆生植物胚芽胁迫信号在藻类祖细胞中进化。中国科学院学报(自然科学版),2018;https://doi.org/10.1073/pnas.1719230115.
Delaux PM, Xie X, Timme RE, Puech-Pages V, Dunand C, Lecompte E,等。绿色谱系中独脚金内酯的起源。新植物,2012;195:857-71。https://doi.org/10.1111/j.1469-8137.2012.04209.x.
德穆塔斯OC, de Brito FR, Diretto G, Ferrante P, Frusciante S, Pietrella M,等。ABCC转运蛋白介导藏红花柱头中Crocins的液泡积累。植物细胞。2019;31:27 9 - 804。https://doi.org/10.1105/tpc.19.00193.
Dhami N, Cazzonelli CI。环境对叶片类胡萝卜素代谢的影响。植物生长规律,2020:1-23。https://doi.org/10.1007/s10725-020-00661-w.
杜丽娟,王丽娟,王丽娟。植物类胡萝卜素解理加氧酶在植物发育和代谢中的作用。基因组学杂志,2020;19:1-9。https://doi.org/10.1093/bfgp/elz037.
张晓东,刘建平,张晓明,等。β-环柠檬醛对植物根系生长的调控作用。中国科学院学报(自然科学版)2019;116:10563-7https://doi.org/10.1073/pnas.1821445116.
张志刚,张志刚,张志刚,等。UGT709G1:一种新的尿苷二磷酸糖基转移酶,参与了藏红花中藏红花素前体picrocrocin的生物合成。新植物,2019;24:725 - 40。https://doi.org/10.1111/nph.16079.
王志强,王志强,王志强,等。控制番茄果实中的β-胡萝卜素水平可增加ABA含量,延长保质期。中国生物工程学报(英文版);2008;https://doi.org/10.1111/pbi.13283.
Diretto G, Welsch R, Tavazza R, Mourgues F, Pizzichini D, Beyer P,等。β -胡萝卜素羟化酶的沉默增加了马铃薯块茎中的总类胡萝卜素和β -胡萝卜素水平。BMC植物生物学。2007;7:11。https://doi.org/10.1186/1471-2229-7-11.
杜达雷娃N, Negre F, Nagegowda DA, Orlova I.植物挥发物:最新进展和未来展望。植物科学,2006;25:17 - 40。https://doi.org/10.1080/07352680600899973.
杜瑞克,史密,赫泽勒伍德,琼斯,麦克莱恩,纳格尔,等。PhosPhAt:拟南芥磷酸化位点数据库。一个更新。核酸工程学报,2010;38:D828-34。https://doi.org/10.1093/nar/gkp810.
Dutta S, Muthusamy V, Chhabra R, Baveja A, Zunjare RU, Mondal TK,等。低表达类胡萝卜素切割双加氧酶1 (ccd1)基因可提高玉米贮藏过程中维生素原a的保留。Mol Gen Genomics, 2021; 299:141 - 53。https://doi.org/10.1007/s00438-020-01734-1.
爱德华兹MB,崔gp, Derieg NJ, Min Y, Diana AC, Hodges SA,等。耧斗菜(耧斗菜)蜂和蜂鸟传粉姐妹种花性状的遗传结构。bioRxiv。2021.https://doi.org/10.1101/2021.04.12.439277.
Egea I, Barsan C, Bian W, Purgatto E, Latche A, Chervin C,等。染色体分化:现状与展望。中国生物医学工程学报,2010;https://doi.org/10.1093/pcp/pcq136.
张志刚,张志刚,张志刚,张志刚,等。番茄果实叶绿体到染色体的转变:分离质体中类胡萝卜素和叶绿素的光谱共聚焦显微镜分析和完整活组织上的延时记录。Ann Bot. 2011; 108:291-7。https://doi.org/10.1093/aob/mcr140.
类胡萝卜素在人类营养与健康中的作用。生物化学,2018;652:18-26。https://doi.org/10.1016/j.abb.2018.06.001.
Ellison S, Luby C, Corak K, Coe K, Senalik D, Iorizzo M,等。关联分析揭示了Or基因在胡萝卜类胡萝卜素存在和驯化中的重要性。遗传学。2018;210:1-12。https://doi.org/10.1534/genetics.118.301299.
Enfissi EM, Nogueira M, Bramley PM, Fraser PD。番茄果实类胡萝卜素形成的调控。植物J. 2017; 89:774-88。https://doi.org/10.1111/tpj.13428.
Eroglu A. apocotenoids调节视黄醇受体:俄亥俄州立大学;2012.
Escobar-Tovar L, Sierra J, Hernandez-Munoz A, McQuinn RP, Mathioni S, Cordoba E,等。反卷积的夹竹桃素介导的逆行信号网络调节质体翻译和叶片发育。植物J. 2021; 105:1582-99。https://doi.org/10.1111/tpj.15134.
Estevez JM, Cantero A, Reindl A, Reichler S, Leon P. 1-脱氧- d -木酮糖-5-磷酸合酶,植物可塑性类异戊二烯生物合成的限制酶。生物化学学报。2001;276:22901-9。https://doi.org/10.1074/jbc.M100854200.
范志刚,李志刚,李志刚,等。作用于单一基因的三种不同的突变机制支撑了桃子黄色果肉的起源。植物学报(英文版);2013;https://doi.org/10.1111/tpj.12283.
范蒂尼E, Falcone G, Frusciante S, Giliberto L, Giuliano G.通过病毒诱导的基因沉默解剖番茄红素生物合成。中国生物医学工程学报,2013;https://doi.org/10.1104/pp.113.224733.
Feder A, Chayut N, Gur A, Freiman Z, Tzuri G, Meir A,等。胡萝卜素代谢通量在类胡萝卜素积累和染色体分化中的作用:从甜瓜果实的经验教训。植物科学学报2019;10:1250。https://doi.org/10.3389/fpls.2019.01250.
杨晓明,王晓明,张晓明,王晓明,等。植物生长发育与逆境响应的相关研究。中国植物科学,2019;10:1168。https://doi.org/10.3389/fpls.2019.01168.
脱落酸的合成与反应。拟南芥书刊。2013;11:e0166。https://doi.org/10.1199/tab.0166.
费orilli V,王建勇,Bonfante P, Lanfranco L, Al-Babili S.夹竹桃类植物:丛枝菌根共生的新、旧介质。前沿植物学报2019;10:1186。https://doi.org/10.3389/fpls.2019.01186.
高志伟,李志刚,李志刚,等。高等植物黄芪质体细胞膜分子景观研究。植物学报。2021;7:514-23。https://doi.org/10.1038/s41477-021-00896-z.
Frachon L, Stirling SA, Schiestl FP, Dudareva N.结合生物技术和进化理解授粉昆虫吸引机制。中国生物工程学报,2018;https://doi.org/10.1016/j.copbio.2021.06.004.
Frank HA, Cogdell RJ。光合作用中的类胡萝卜素。光化学与生物化学。1996;https://doi.org/10.1111/j.1751-1097.1996.tb03022.x.
弗雷泽警察局,舒赫W,布拉姆利总理。番茄(Lycopersicon esculentum)叶绿体植物素合成酶的部分纯化及生化性质。足底。2000;211:361-9。https://doi.org/10.1007/s004250000293.
通过测序、互补和共抑制对番茄正常和突变型植烯合酶基因的鉴定和遗传分析。植物分子生物学杂志1993;22:589-602。https://doi.org/10.1007/BF00047400.
Frusciante S, Diretto G, Bruno M, Ferrante P, Pietrella M, Prado-Cabrero A,等。新型类胡萝卜素裂解双加氧酶催化藏红花番红花素生物合成的第一步。中国科学院学报(自然科学版),2014;https://doi.org/10.1073/pnas.1404629111.
Fujiwara Y, Hashimoto K, Manabe K, Maoka T.海麻籽黄质A1, A2, A3, B, C和D结构的研究。四面体杂志,2002;43:4385-8。https://doi.org/10.1016/s0040 - 4039 (02) 00779 - 7.
Galpaz N, Burger Y, Lavee T, Tzuri G, Sherman A, Melamed T,等。EMS诱导甜瓜CRTISO基因突变的遗传和化学特征。生物化学学报。2013;539:117-25。https://doi.org/10.1016/j.abb.2013.08.006.
李高J,杨年代,唐K, G,高X,刘B, et al。GmCCD4控制大豆类胡萝卜素含量。中国生物工程学报,2017;19(2):344 - 344。https://doi.org/10.1111/pbi.13506.
高林,刚达一,孙华,马强,鲍凯,铁曼DM,等。番茄泛基因组揭示了新的基因和一种罕见的调节水果味道的等位基因。Nat Genet, 2019; 51:1044-51。https://doi.org/10.1038/s41588-019-0410-2.
García-Cerdán JG, Schmid EM, Takeuchi T, McRae I, McDonald KL, Yordduangjun N,等。叶绿体sec14样1 (CPSFL1)对叶绿体的正常发育至关重要,并影响衣藻类胡萝卜素的积累。中国科学院学报(自然科学版)2020;117:12452-63。https://doi.org/10.1073/pnas.1916948117.
Gemenet DC, da Silva Pereira G, De Boeck B, Wood JC, Mollinari M, Olukolu BA,等。数量性状位点和差异基因表达分析揭示了六倍体甘薯β -胡萝卜素和淀粉负相关的遗传基础Lam。]。理论应用,2020;133:23-36。https://doi.org/10.1007/s00122-019-03437-7.
高希S,主教MM,罗肖利JD,拉方丹AM,弗兰克HA,贝克WF。环绕素-叶绿素a蛋白中激发能量传递的相干和非相干机制。物理化学学报,2017;8:463-9。https://doi.org/10.1021/acs.jpclett.6b02881.
新黄质对植物和藻类的光保护作用。分子。2020;25:4617。https://doi.org/10.3390/molecules25204617.
作物植物的生物强化:许多矿工的淘金热。中国生物科技,2017;44:169-80。https://doi.org/10.1016/j.copbio.2017.02.001.
高夫SA, Klee HJ。植物挥发性化合物:健康和营养价值的感官线索?科学。2006;311:815-9。https://doi.org/10.1016/j.foodchem.2021.131234.
Gomez-Roldan V, Fermas S, Brewer PB, puch - pages V, Dun EA, pilot JP,等。独脚金内酯抑制枝条分枝。大自然。2008;455:189 - 94。https://doi.org/10.1038/nature07271.
龚健,曾勇,孟强,管勇,李超,杨华,等。红光诱导金桔果实变色是由于FcrNAC22调节的类胡萝卜素代谢增加。J Exp Bot. 2021。https://doi.org/10.1093/jxb/erab283.
张志强,张志强,张志强,等。类胡萝卜素切割双氧酶4是拟南芥种子β-胡萝卜素含量的负调节因子。植物学报。2013;25:48 - 26。https://doi.org/10.1105/tpc.113.119677.
王晓明,王晓明,王晓明,等。叶绿体翻译后基因修饰的研究进展。植物科学,2017;8:240。https://doi.org/10.3389/fpls.2017.00240.
Harjes CE, Rocheford TR, Bai L, Brutnell TP, Kandianis CB, Sowinski SG,等。番茄红素环化酶的自然遗传变异用于玉米生物强化。科学。2008;319:330-3。https://doi.org/10.1126/science.1150255.
Harrison EH, Quadro L.类夹心素:在哺乳动物中的新兴角色。2018; 38:153-72。https://doi.org/10.1146/annurev-nutr-082117-051841.
桥本,浦上C,科格戴尔,RJ。类胡萝卜素和光合作用。亚细胞生物化学,2016;79:111-39。https://doi.org/10.1007/978-3-319-39126-7_4.
类胡萝卜素在叶绿体中的膜稳定剂。植物科学进展1998;3:147-51。https://doi.org/10.1016/s1360 - 1385 (98) 01200 - x.
哈aux M. β -环柠檬醛及其衍生物:服务于多种生物学功能的新兴分子信号。植物物理与生物化学。2020;155:35-41。https://doi.org/10.1016/j.plaphy.2020.07.032.
Havaux M, Gruszecki WI。在含有高或低水平类胡萝卜素玉米黄质的马铃薯叶片中,热和光诱导的叶绿素a荧光变化:玉米黄质对类囊体膜流动性的调节作用的迹象。光化学。1993;58:6 7 - 14。https://doi.org/10.1111/j.1751-1097.1993.tb04940.x.
类异戊二烯前体生物合成中调节植物酶的翻译后事件和修饰。植物科学通报2013;203:41-54。https://doi.org/10.1016/j.plantsci.2012.12.008.
周晓霞,徐强,李丽玲,李晓霞,李晓明。园艺植物类胡萝卜素积累的研究进展。植物学报2020;6:343-60。https://doi.org/10.1016/j.hpj.2020.10.002.
霍特,李雪峰,李雪峰,李雪峰,李雪峰。类胡萝卜素阳离子的形成及其对光合光捕获的调控。科学。2005;307:433-6。https://doi.org/10.1126/science.1105833.
Horner HT, Healy RA, Ren G, Fritz D, Klyne A, Seames C,等。在观赏烟草花蜜发育过程中,淀粉体到染色体的转化为花蜜提供了糖,为保护提供了抗氧化剂。学报学报。2007;94:12-24。https://doi.org/10.3732/ajb.94.1.12.
侯X, Rivers J, Leon P, McQuinn RP, Pogson BJ。植物中夹竹桃素信号的合成与功能。植物科学进展(英文版);https://doi.org/10.1016/j.tplants.2016.06.001.
Irfan M, Chavez B, Rizzo P, D 'Auria JC, Moghe GD。植物特化代谢的进化辅助工程。aBIOTECH。2021.https://doi.org/10.1007/s42994-021-00052-3.
艾萨克森,罗宁·G,扎米尔·D,赫施伯格橘子从番茄中发现了一种类胡萝卜素异构酶,对植物中b-胡萝卜素和叶黄素的产生至关重要。《植物科学》2002;14:33 - 42。https://doi.org/10.1105/tpc.010303.
叶黄素和叶黄素在光系统光保护中的作用。生物化学学报,2012;https://doi.org/10.1016/j.bbabio.2011.04.012.
贾鹏平,李志强,李志强,等。类胡萝卜素与独脚金内酯。中国生物医学工程学报,2018;49(2):369 - 369。https://doi.org/10.1093/jxb/erx476.
贾克平,Dickinson AJ,米J,崔刚,肖tt, Kharbatia NM,等。鳀鱼素是拟南芥锚根形成所需的类胡萝卜素衍生的调节代谢物。科学通报。2019a;5:eaaw6787。https://doi.org/10.1126/sciadv.aaw6787.
贾克平,李春,李春梅,李志强,等。直尾金内酯生物合成与信号转导。独脚内酯-生物应用。2019b: 1-45。https://doi.org/10.1007/978-3-030-12153-2_1.
贾克平,米J, Ablazov A, Ali S,杨杨,Balakrishna A,等。异凤尾鱼烯是一种抑制拟南芥初生根生长的内源性代谢产物。植物J. 2021;10:15271。https://doi.org/10.1111/tpj.15271.
蒋玲,刘旭,熊刚,刘华,陈峰,王玲,等。DWARF 53在水稻中作为独脚金内酯信号的抑制因子。大自然。2013;504:401-5。https://doi.org/10.1038/nature12870.
Jumper J, Evans R, Pritzel A, Green T, figfignov M, Ronneberger O,等。高度准确的蛋白质结构预测AlphaFold。大自然。2021;596:583-9。https://doi.org/10.1038/s41586-021-03819-2.
Kachanovsky DE, Filler S, Isaacson T, Hirschberg J.番茄颜色突变的发生与顺式类胡萝卜素对植物烯合酶1表达的调控有关。自然科学学报(英文版)2012;https://doi.org/10.1073/pnas.1214808109.
康春,何松,翟红,李瑞,赵宁,刘强。转基因拟南芥中甘薯生长素反应因子基因IbARF5参与类胡萝卜素的生物合成和耐盐耐旱。植物科学,2018;9:1307。https://doi.org/10.3389/fpls.2018.01307.
柯凯。动物授粉在植物物种形成中的作用:整合生态学、地理学和遗传学。生态学报。2009;40:637-56。https://doi.org/10.1146/annurev.ecolsys.110308.120310.
金海生,池春春,李佳杰,金雪,朴sc,郭SS.柑橘:调节边缘土地类胡萝卜素稳态和提高植物对环境胁迫耐受性的靶基因。中国机械工程学报,2018;29(4):339 - 344。https://doi.org/10.1093/jxb/ery023.
金雪,李佳杰,朴秀,林玉华,朴伟,金海杰,等。带金snp的橙色基因的过表达增强甘薯类胡萝卜素的积累和耐热性。抗氧化剂(巴塞尔)。2021; 10:51。https://doi.org/10.3390/antiox10010051.
Koschmieder J, Wüst F, Schaub P, Álvarez D, Trautmann D, Krischke M,等。植物类胡萝卜素代谢利用防御机制对抗活性羰基和异种生物。植物物理学报。2021;185:331-51。https://doi.org/10.1093/plphys/kiaa033.
郎铮,王勇,唐凯,唐东,Datsenka T,程杰,等。DNA去甲基化在番茄果实成熟诱导基因激活和成熟抑制基因抑制中的关键作用。中国科学院学报(自然科学版),2017;https://doi.org/10.1073/pnas.1705233114.
李雪雪,张世杰,郑洪波,李雪雪,文katesh J,李俊华,等。玉米黄质环氧化酶突变导致辣椒果实呈橙色并改变类胡萝卜素含量。植物J. 2021。https://doi.org/10.1111/tpj.15264.
Li L, Paolillo DJ, Parthasarathy MV, Dimuzio EM, Garvin DF。一种新的基因突变导致花椰菜中β -胡萝卜素积累的异常模式(芸苔属植物oleraceavar。葡萄孢属).植物学报2001;26: 59 - 67。https://doi.org/10.1046/j.1365-313x.2001.01008.x.
李玲,杨勇,徐强,王志强,王志强,等。Or基因增强了马铃薯块茎收获后贮藏过程中类胡萝卜素的积累和稳定性。植物学报。2012;5:39 - 52。https://doi.org/10.1093/mp/ssr099.
李玲,袁慧。染色体生物发生与类胡萝卜素积累。生物化学学报,2013;https://doi.org/10.1016/j.abb.2013.07.002.
李玲,袁宏,曾勇,徐强。质体与类胡萝卜素积累。类胡萝卜素,2016:273-93。施普林格。https://doi.org/10.1007/978-3-319-39126-7_10.
李勇,李文杰,李文杰,李文杰,等。拟南芥籽粒含油量对种子结构、光照和植物间变异的影响。植物化学。2006;67:904-15。https://doi.org/10.1016/j.phytochem.2006.02.015.
李震,姜刚,刘旭,丁旭,张东,王旭,等。组蛋白去甲基化酶SlJMJ6通过去除番茄成熟相关基因H3K27的甲基化来促进果实成熟。New Phytol. 2020; 227:1138-56。https://doi.org/10.1111/nph.16590.
梁明明,何玉军,刘德民,姜建国。天然和工程生物中类胡萝卜素降解和类胡萝卜素产生的调控。生物科技,2021;41:513-34。https://doi.org/10.1080/07388551.2021.1873242.
梁明明,朱军,蒋建国。类胡萝卜素的生物合成及相关基因从细菌到植物的切割。食品科学。2018;58:2314-33。https://doi.org/10.1080/10408398.2017.1322552.
梁强,邓华,李勇,刘震,舒鹏,付锐,等。Like Heterochromatin Protein 1b通过调控番茄成熟相关基因H3K27me3水平抑制果实成熟。New Phytol. 2020; 227:485-97。https://doi.org/10.1111/nph.16550.
凌琴,奈莎丽,苏菲,周勇,黄波,曾勇,等。叶绿体相关蛋白降解途径控制着番茄叶绿体发育和果实成熟。植物学报。2021;7:655-66。https://doi.org/10.1038/s41477-021-00916-y.
刘刚,李超,余辉,陶鹏,袁林,叶健,等。GREEN STRIPE编码甲基化番茄AGAMOUS-LIKE 1,调控果实叶绿体发育和Chl合成。New Phytol. 2020; 228:302-17。https://doi.org/10.1111/nph.16705.
刘杰,Novero M, Charnikhova T, Ferrandino A, Schubert A, Ruyter-Spira C,等。类胡萝卜素裂解双加氧酶7在豆科植物模型中调节植物生长、繁殖、衰老和确定结瘤。中国科学(d辑),2013;https://doi.org/10.1093/jxb/ert056.
刘玲,邵志,张敏,王强。番茄类胡萝卜素代谢的调控。植物学报。2015;8:28-39。https://doi.org/10.1016/j.molp.2014.11.006.
刘震,闫华,王凯,匡涛,张静,桂林,等。菠菜主要光收集复合物的晶体结构在2.72 Å分辨率。大自然。2004;428:287 - 92。https://doi.org/10.1038/nature02373.
Llamas E, Pulido P, rodrigez - concepcion M.拟南芥中质体基因表达和Clp蛋白酶活性的干扰引发叶绿体未折叠蛋白反应以恢复蛋白质稳态。PLoS Genet, 2017;13:e1007022。https://doi.org/10.1371/journal.pgen.1007022.
Llorente B, Martinez-Garcia JF, Stange C, Rodriguez-Concepcion M.照明色彩:光对类胡萝卜素生物合成和积累的调节。植物学报,2017;37:49-55。https://doi.org/10.1016/j.pbi.2017.03.011.
Llorente B, Torres-Montilla S, Morelli L, Florez-Sarasa I, Matus JT, Ezquerro M,等。将叶片叶绿体合成为富含类胡萝卜素的质体揭示了天然叶绿体发育的机制基础。中国科学院学报(自然科学版)2020;117:21796-803https://doi.org/10.1073/pnas.2004405117.
Lopez AB, Van Eck J, Conlin BJ, Paolillo DJ, O'Neill J, Li L.花椰菜的效应或转基因马铃薯块茎类胡萝卜素积累和染色体形成的转基因研究。计算机应用技术学报,2008a; 39: 413 - 424。https://doi.org/10.1093/jxb/erm299.
杨艳,李丽娟,杨艳。植物烯去饱和酶是一种存在于质体膜的大型蛋白复合物。植物学报。2008b; 133:190-8。https://doi.org/10.1111/j.1399-3054.2008.01058.x.
López AJ, Frusciante S, Niza E, Ahrazem O, Rubio-Moraga Á, Diretto G,等。一种来自藏红花(Crocus sativus L.)家族的新的糖基转移酶UGT91P3负责藏红花中藏红花苷的最后糖化步骤。国际分子化学杂志2021;https://doi.org/10.3390/ijms22168815.
吕淑娟,范艾克J,周X, Lopex AB, O'Halloran DM, Cosman KM,等。花椰菜或基因编码一种DnaJ半胱氨酸丰富结构域蛋白,该蛋白介导高水平的b-胡萝卜素积累。《植物科学》,2006;18:3594-605。https://doi.org/10.1105/tpc.106.046417.
卢松,叶静,朱凯,张勇,张敏,徐强,等。柑橘磷酸盐饥饿反应因子CsPHL3负向调控类胡萝卜素代谢。植物细胞物理。2021a。https://doi.org/10.1093/pcp/pcab007.
卢松,叶静,朱凯,张勇,张敏,徐强,等。果实成熟相关转录因子CsMADS5正向调控柑橘类胡萝卜素的生物合成。J Exp Bot. 2021b; 72:3028-43。https://doi.org/10.1093/jxb/erab045.
栾奕婷,付小明,陆普杰,Grierson D,徐佳杰。决定类胡萝卜素在植物种类和品种中差异积累的分子机制。植物科学2020;39:125-39。https://doi.org/10.1080/07352689.2020.1768350.
罗震,张娟,李娟,杨超,王涛,欧阳波,等。在番茄成熟过程中,一种STAY-GREEN蛋白SlSGR1通过与SlPSY1直接相互作用调节番茄红素和β -胡萝卜素的积累。新植物,2013;198:442-52。https://doi.org/10.1111/nph.12175.
Maass D, Arango J, Wast F, Beyer P, Welsch R.植物烯合酶蛋白水平升高引起拟南芥和胡萝卜根类胡萝卜素晶体形成。PLoS ONE。2009; 4: e6373。https://doi.org/10.1371/journal.pone.0006373.
马蒂尔,傅雷巴洛夫,李国强,李国强。番茄MADS-box转录因子成熟抑制因子以无色非成熟依赖的方式与多个成熟过程中的启动子相互作用。植物物理学报。2011;157:1568-79。https://doi.org/10.1104/pp.111.181107.
Meneghin E, Volpato A, Cupellini L, Bolzonello L, Jurinovich S, Mascoli V,等。类胡萝卜素到叶绿素能量转移的一致性。Nat Commun. 2018;9:3160。https://doi.org/10.1038/s41467-018-05596-5.
孟N,魏勇,高勇,于凯,程杰,李晓宇,等。葡萄类胡萝卜素裂解双加氧酶4b的转录表达及调控特性。植物科学进展2020;11:483。https://doi.org/10.3389/fpls.2020.00483.
孟杨,王震,王勇,王超,朱波,刘华,等。MYB激活剂WHITE PETAL1与MtTT8和MtWD40-1联合调控截断紫花苜蓿类胡萝卜素衍生花色素沉着植物细胞。2019;31:2751-67。https://doi.org/10.1105/tpc.19.00480.
米娟,贾鹏平,王建勇,Al-Babili S.植物类罗汉素的快速LC-MS定性和定量分析。《肛肠化学学报》2018;1035:87-95https://doi.org/10.1016/j.aca.2018.07.002.
Mitra S, Estrada-Tejedor R, Volke DC, Phillips MA, Gershenzon J, Wright LP。拟南芥草食动物诱导β-环柠檬醛对质体类异戊二烯途径的负调控。118.美国国立自然科学研究院,2021;https://doi.org/10.1073/pnas.2008747118.
Miyagishima SY。一种协调核转录和质体代谢和增殖的多功能调制器。Mol Plant, 2020; 13:820-2。https://doi.org/10.1016/j.molp.2020.05.008.
莫雷诺JC,米J,阿格拉瓦尔S, Kossler S, Tureckova V, Tarkowska D,等。一种胡萝卜素基因的表达可以通过重新设计植物结构和提高烟草的光合效率来实现更快的生物量生产。植物J. 2020; 103:1967-84。https://doi.org/10.1111/tpj.14909.
杨晓明,杨晓明,杨晓明,等。植物类胡萝卜素的逆行信号与种间交流。植物J. 2021; 105:351-75。https://doi.org/10.1111/tpj.15102.
Mortimer CL, Misawa N, Ducreux L, Campbell R, Bramley PM, Taylor M,等。马铃薯生物合成高价值类酮胡萝卜素的产物稳定性和分离机制。中国生物技术学报,2016;14(2):344 - 344。https://doi.org/10.1111/pbi.12365.
村田M,中井Y,川津K,石中M, Kajiwara H,阿部H,等。草内酯是一种类胡萝卜素代谢产物,是一种潜在的草食动物抗性内源性诱导剂。植物物理学报。2019;179:1822-33。https://doi.org/10.1104/pp.18.00837.
王志刚,王志刚。植物动态非光化学猝灭:分子机制与生产力。植物J. 2020; 101:885-96。https://doi.org/10.1111/tpj.14601.
Neuman H, Galpaz N, Cunningham FX Jr, Zamir D, Hirschberg J.番茄突变nxd1揭示了新黄质生物合成所必需的基因,并证明紫黄质是脱落酸生物合成的充分前体。植物J. 2014; 78:80-93。https://doi.org/10.1111/tpj.12451.
李林,吕松,李志刚,李志刚。植物类胡萝卜素代谢。植物学报。2015;8:68-82。https://doi.org/10.1016/j.molp.2014.12.007.
Niyogi KK, Truong TB。在产氧光合作用中调节光捕获的柔性非光化学猝灭机制的进化。中国植物学报,2013;16(3):337 - 344。https://doi.org/10.1016/j.pbi.2013.03.011.
Nogueira M, Enfissi EMA, Welsch R, Beyer P, Zurbriggen MD, Fraser PD。虾青素形成融合酶的构建及其在微生物和植物宿主中的特征:工程类酮胡萝卜素的新工具。Metab Eng. 2019; 52:243-52。https://doi.org/10.1016/j.ymben.2018.12.006.
大宫A,加藤M,岛田T,西岛K,岸本S,永田M.园艺作物类胡萝卜素积累的分子基础。张志强,2019;29(1):1 - 5。https://doi.org/10.2503/hortj.UTD-R003.
Ohmiya A, Kishimoto S, Aida R, Yoshioka S, Sumitomo K.类胡萝卜素裂解双加氧酶(CmCCD4a)有助于菊花花瓣白色的形成。植物物理学报。2006;42:1193 - 201。https://doi.org/10.1104/pp.106.087130.
奥索里奥CE。橙色基因在类胡萝卜素积累中的作用:操纵染色体走向有色的未来。前沿植物学报2019;10:1235。https://doi.org/10.3389/fpls.2019.01235.
欧文CR,布拉德肖HD。影响绒拟Mimulus lewisii传粉媒介选择的诱导突变。节肢动物与植物互动。2011;5:235-44。https://doi.org/10.1007/s11829-011-9133-8.
潘恩JA, Shipton CA, Chaggar S, Howells RM, Kennedy MJ, Vernon G,等。通过增加原维生素A含量来提高黄金大米的营养价值。生物技术学报。2005;23:482-7。https://doi.org/10.1038/nbt1082.
潘旭,曹鹏,苏旭,刘震,李敏。捕光配合物I和II的结构分析与比较。生物物理学报。2020;1861:148038。https://doi.org/10.1016/j.bbabio.2019.06.010.
潘旭,李明,万涛,王磊,贾超,侯忠,等。菠菜光收集复合物CP29能量调节的结构研究。分子生物学杂志,2011;18:309-15。https://doi.org/10.1038/nsmb.2008.
Park H, Kreunen SS, Cuttriss AJ, DellaPenna D, Pogson BJ。类胡萝卜素异构酶的鉴定为类胡萝卜素的生物合成、前板层体形成和光形态建成提供了新的见解。《植物科学》2002;14:21 - 32。https://doi.org/10.1105/tpc.010302.
朴山,金海生,郑玉杰,金世胜,池春春,王忠,等。橙色蛋白在甘薯中具有稳定植烯合酶的作用。科学通报2016;6:33563。https://doi.org/10.1038/srep33563.
朴雪云,冯鹏,西村,杨永杰,李志强,赵颖,等。脱落酸通过START蛋白的PYR/PYL家族抑制2C型蛋白磷酸酶。科学。2009;324:1068 - 71。https://doi.org/10.1126/science.1173041.
彭文杰,李志强,李志强,等。abscisacid - ent4在顺式紫黄质和顺式新黄质的合成中都有重要作用。植物物理学报。2020;184:1303-16。https://doi.org/10.1104/pp.20.00947.
Pipitone R, Eicke S, Pfister B, Glauser G, Falconet D, Uwizeye C,等。一项多方面的分析揭示了拟南芥去黄化过程中叶绿体生物发生的两个不同阶段。Elife。2021;10:e62709。https://doi.org/10.7554/eLife.62709.
Proctor MS, Pazdernik M, Jackson PJ, Pilny J, Martin EC, Dickman MJ,等。叶黄素类胡萝卜素稳定蓝藻叶绿素合成酶与lhc样蛋白HliD的关联。生物化学学报,2020;47:4021 - 36。https://doi.org/10.1042/BCJ20200561.
Proust H, Hoffmann B, Xie X, Yoneyama K, Schaefer DG, Yoneyama K,等。独脚金内酯在小立碗藓中调节原丝体分支,并作为群体感应信号。发展。2011;138:1531-9。https://doi.org/10.1242/dev.058495.
Pulido P, Llamas E, Llorente B, Ventura S, Wright LP, Rodriguez-Concepcion M.拟南芥基质Clp蛋白酶重折叠或降解质体异戊二烯类途径第一酶的命运PLoS Genet, 2016;12:e1005824。https://doi.org/10.1371/journal.pgen.1005824.
Pulido P, Toledo-Ortiz G, Phillips MA, Wright LP, Rodriguez-Concepcion M.拟南芥j蛋白J20为蛋白质质量控制提供了质体类异丙二烯途径的第一种酶。植物学报。2013;25:4183-94。https://doi.org/10.1105/tpc.113.113001.
秦霞,王伟,常丽,陈杰,王鹏,张杰,等。虹吸类海洋绿藻苔藓中PSI-LHCI超配合物及其亚配合物的分离与表征。Photosynth res 2015; 123:61-76。https://doi.org/10.1007/s11120-014-0039-z.
植物类胡萝卜素的生物合成和质体发育:光的作用。国际分子化学杂志,2021;22:1184。https://doi.org/10.3390/ijms22031184.
Ramel F, Birtic S, Ginies C, Soubigou-Taconnat L, Triantaphylides C, Havaux M.类胡萝卜素氧化产物是介导植物单线态氧基因反应的胁迫信号。中国科学院学报(自然科学版)2012;https://doi.org/10.1073/pnas.1115982109.
任超,郭勇,孔杰,Lecourieux F,戴智,李松,等。在葡萄中敲除VvCCD8基因会影响枝条的分枝。BMC植物生物学2020;20:1-8。https://doi.org/10.1186/s12870-020-2263-3.
王志强,王志强,王志强,Alós E, Alquézar B,王志强,等。ζ-胡萝卜素异构酶(Z-ISO)的突变等位基因与“Pinalate”甜橙突变体的黄色色素有关,并揭示了其在水果胡萝卜素发生中的作用的新见解。BMC植物生物学2019;19:1-16。https://doi.org/10.1186/s12870-019-2078-2.
Rodriguez-Concepcion M, Avalos J, Bonet ML, Boronat A, Gomez-Gomez L, Hornero-Mendez D,等。类胡萝卜素的全球视角:代谢、生物技术以及对营养和健康的益处。Prog血脂res 2018; 70:62-93。https://doi.org/10.1016/j.plipres.2018.04.004.
Rodriguez-Villalon A, Gas E, Rodriguez-Concepcion M.植烯合酶活性控制深色拟南芥幼苗中类胡萝卜素的生物合成及其代谢前体的供应。植物J. 2009; 60:424-35。https://doi.org/10.1111/j.1365-313X.2009.03966.x.
罗宁,李志强,李志强,等。植物染色体中β -胡萝卜素形成途径的研究进展。自然科学学报,2000;97:11102-7。https://doi.org/10.1073/pnas.190177497.
Ronen G, Cohen M, Zamir D, Hirschberg J.番茄果实发育过程中类胡萝卜素生物合成的调控:番茄红素epsilon-cyclase基因在成熟过程中表达下调,在突变Delta中表达升高。植物学报,1999;17:341-51。https://doi.org/10.1046/j.1365-313x.1999.00381.x.
Ruban AV, Murchie EH。评估非光化学叶绿素荧光猝灭的光保护效果:一种新方法。中国生物工程学报(自然科学版)2012;https://doi.org/10.1016/j.bbabio.2012.03.026.
Ruiz-Sola MA, Barja MV, Manzano D, Llorente B, Schipper B, Beekwilder J,等。一个拟南芥基因编码两个差异靶向香叶酰二磷酸合酶异构体。植物学报。2016;172:1393-402。https://doi.org/10.1104/pp.16.01392.
Ruiz-Sola MA, Rodriguez-Concepcion M.拟南芥类胡萝卜素生物合成:一个丰富多彩的途径。拟南芥图书。2012;10:e0158。https://doi.org/10.1199/tab.0158.
Sacharz J, Giovagnetti V, Ungerer P, Mastroianni G, Ruban AV.叶黄素循环影响PsbS与捕光复合体II的可逆相互作用以控制非光化学猝灭。植物学报。2017;3:16225。https://doi.org/10.1038/nplants.2016.225.
萨达利NM,索登RG,凌Q,贾维斯RP。植物中染色体和其他质体的分化。植物细胞报告2019;38:803-18。https://doi.org/10.1007/s00299-019-02420-2.
佐川JM,李志勇,阿方丹,刘灿,袁玉伟。一种R2R3-MYB转录因子调控桃茉莉花类胡萝卜素色素沉着。新植物,2016;209:1049-57。https://doi.org/10.1111/nph.13647.
类胡萝卜素生物合成的多样性和起源:向植物光合作用共同进化的历史。新叶绿醇,2021。https://doi.org/10.1111/nph.17655.
李志刚,李志刚。眼类胡萝卜素在健康与疾病中的作用。2019; 39:95-120。https://doi.org/10.1146/annurev-nutr-082018-124555.
肖波,李志强,李志强,等。非酶降解β-胡萝卜素(维生素原a生物强化)作物植物。农业食品化学,2017。https://doi.org/10.1021/acs.jafc.7b01693.
Schwartz SH, Tan BC, Gage DA, Zeevaart JA, McCarty DR.玉米VP14对类胡萝卜素的特异性氧化裂解。科学。1997;276:1872-4。https://doi.org/10.1126/science.276.5320.1872.
Schweiggert R, Carle R.类胡萝卜素在植物和动物食品中的沉积及其对生物利用度的影响。食品科学。2017;57:1807-30。https://doi.org/10.1080/10408398.2015.1012756.
Seto Y, yassui R, Kameoka H, Tamiru M,曹m, Terauchi R,等。独脚金内酯的感知和水解酶受体DWARF14的失活。Nat Commun. 2019;10:191。https://doi.org/10.1038/s41467-018-08124-7.
尚勇,陈文杰,陈志强,等。莲属植物色素排列模式的分子基础及其对传粉者吸引的影响。新植物,2011;189:602-15。https://doi.org/10.1111/j.1469-8137.2010.03498.x.
Shumbe L, Bott R, Havaux M. Dihydroactinidiolide,一种高光诱导β -胡萝卜素衍生物,可调节拟南芥的基因表达和光驯化。植物学报。2014;7:1248-51。https://doi.org/10.1093/mp/ssu028.
Simpson K, Fuentes P, Quiroz-Iturra LF, Flores-Ortiz C, Contreras R, Handford M,等。阐明盐胁迫和脱落酸诱导胡萝卜植物烯合酶2的表达。中国机械工程学报。2018;49:413 - 26。https://doi.org/10.1093/jxb/ery207.
Son M, pinola A, Bassi R, schau - cohen GS。超宽频带二维电子光谱揭示了LHCII在可见光谱中的能量流路径:EPJ会议网络:EDP科学;2019.p。09034。https://doi.org/10.1051/epjconf/201920509034
Son M, Pinnola A, Gordon SC, Bassi R, schau - cohen GS。膜纳米圆盘中光收集复合物II中叶绿素到类胡萝卜素能量耗散转移的观察。Nat Commun. 2020; 11:1-8。https://doi.org/10.1038/s41467-020-15074-6.
李鸿章,袁耀文。植物类胡萝卜素生物合成的转录调控:调控因子太多,共识太少。前沿植物学报2019;10:1017。https://doi.org/10.3389/fpls.2019.01017.
李国忠,丁斌,孙伟,牟峰,希尔C,陈松,等。四肽重复蛋白调控猴花类胡萝卜素生物合成和染色体发育。植物细胞。2020;32:1536-55。https://doi.org/10.1105/tpc.19.00755.
孙涛,李林。走向“黄金”时代:植物类胡萝卜素积累调控的研究现状。植物科学通报2020;https://doi.org/10.1016/j.plantsci.2019.110331.
孙涛,李林。类胡萝卜素的生物合成、降解和储存途径。植物和食物类胡萝卜素:施普林格;2020 a。3-23页。
孙涛,袁宏,曹华,Yazdani M, Tadmor Y, Li L.植物类胡萝卜素代谢:质体的作用。Mol Plant, 2018; 11:58-74。https://doi.org/10.1016/j.molp.2017.09.010.
孙涛,袁华,陈晨,Kadirjan-Kalbach DK, Mazourek M, Osteryoung KW,等。OR (His)是OR的天然变体,可与质体分裂因子ARC3特异相互作用,调节染色体数量和类胡萝卜素积累。植物学报。2020b; 13:864-78。https://doi.org/10.1016/j.molp.2020.03.007.
孙涛,周峰,黄晓强,陈卫文,孔明梅,周芳芳,等。ORANGE通过与TCP14相互作用抑制黄化拟南芥子叶叶绿体的生物生成。植物学报。2019;31:2996-3014。https://doi.org/10.1105/tpc.18.00290.
孙涛,朱强,魏震,欧文斯,费斯涛,金华,等。多策略工程极大地提高了拟南芥种子中维生素原A类胡萝卜素的积累和稳定性。aBIOTECH。2021; 2:191 - 214。https://doi.org/10.1007/s42994-021-00046-1.
类胡萝卜素在藻类中的分布、生物合成和功能。3月药品,2011;9:1101-18。https://doi.org/10.3390/md9061101.
谭bc, Joseph LM,邓文伟,刘林,李庆宝,Cline K,等。拟南芥9-顺式环氧类胡萝卜素双加氧酶基因家族的分子特征。植物学报(英文版);2003;https://doi.org/10.1046/j.1365-313x.2003.01786.x.
塔塔SK,郑杰,金玉华,崔志勇,郑志勇,李ij,等。叶绿体定位香叶基焦磷酸合成酶的异源表达使植物生长快、开花早和种子产量增加。植物学报,2016;14:29-39。https://doi.org/10.1111/pbi.12333.
特尔弗:光线太亮了?β-胡萝卜素如何保护光系统II反应中心。光化学与生物工程学报,2005;4(4):366 - 366。https://doi.org/10.1039/B507888C.
toleduardo - ortiz G, Huq E, Rodriguez-Concepcion M.光敏色素相互作用因子对植物素合成酶基因表达和类胡萝卜素生物合成的直接调控。中国科学院学报(自然科学版)2010;https://doi.org/10.1073/pnas.0914428107.
托莱多- ortiz G, Johansson H, Lee KP, bu - torrent J, Stewart K, Steel G,等。HY5-PIF调节模块协调光合基因转录的光和温度控制。PLoS Genet, 2014;10:e1004416。https://doi.org/10.1371/journal.pgen.1004416.
Torres-Montilla S, Rodriguez-Concepcion M.在植物细胞中为类胡萝卜素腾出额外空间:生物强化的新机会。Prog血脂Res. 2021;84:101128。https://doi.org/10.1016/j.plipres.2021.101128.
周晓东,周晓东,周晓东,陈晓明,等。cor中的一个“金色”SNP控制着甜瓜(C ucumis melo)的果肉颜色。植物学报(英文版);2015;https://doi.org/10.1111/tpj.12814.
杨春华,沈俊杰,张晓明,张晓明。含氧光系统晶体结构的研究进展。大自然。2011;473:55-U65。https://doi.org/10.1038/nature09913.
张文杰,张文杰,张文杰,等。果实颜色的进化:系统发育,非生物因素和互惠者的作用。科学通报2018;8:1-8。https://doi.org/10.1038/s41598-018-32604-x.
傅志刚,陈志刚,李志刚。类胡萝卜素裂解双加氧酶1酶具有广泛的底物特异性,可在两个不同的键位上裂解多种类胡萝卜素。中国生物医学工程学报。2008;https://doi.org/10.1074/jbc.M710106200.
王波,罗强,李勇,尹林,周宁,李霞,等。R2R3-MYB转录因子识别目标DNA的结构研究。核酸Res. 2020a;48:46 - 71。https://doi.org/10.1093/nar/gkz1081.
王建勇,Haider I, Jamil M, Fiorilli V, Saito Y, Mi J,等。夹竹桃素类代谢物扎辛酮调节水稻生长和独脚金内酯的生物合成。Nat Commun. 2019;10:810。https://doi.org/10.1038/s41467-019-08461-1.
王建勇,林鹏云,Al-Babili S.类夹竹桃素植物生长调节剂的合成和进化。细胞发育生物学,2021a: 3-11。爱思唯尔。https://doi.org/10.1016/j.semcdb.2020.07.007.
王萍,王勇,王伟,陈涛,田松,秦刚。植物素合成酶1前体泛素化对番茄类胡萝卜素生物合成的调控。社区生物学。2020b; 3:30 30。https://doi.org/10.1038/s42003-020-01474-3.
王伟,王鹏,李霞,王勇,田松,秦刚,转录因子SlHY5在转录和翻译水平上调控番茄果实成熟。Hortic Res. 2021b;8:83。https://doi.org/10.1038/s41438-021-00523-0.
沃特斯MT,古贾尔C,班尼特T,纳尔逊DC。独脚金内酯信号转导与进化。植物生物学,2017;68:291-322。https://doi.org/10.1146/annurev-arplant-042916-040925.
沃特金斯JL, Pogson BJ。类胡萝卜素生物强化的研究展望。植物科学进展2020;25:501-12。https://doi.org/10.1016/j.tplants.2019.12.021.
魏森,李旭,徐楠,李霞,Zebarjadi,等。过表达AtCCD1的拟南芥中β -ionone释放的增强减少了十字花科跳蚤甲虫在体内的取食损伤。环境昆虫学报。2011;40:1622-30。https://doi.org/10.1603/EN11088.
王晓燕,王晓燕,王晓燕,等。光形态建成过程中类胡萝卜素合成关键酶——植烯合酶的调控与活化。足底。2000;211:846-54。https://doi.org/10.1007/s004250000352.
韦希R,周旭,袁华,Alvarez D,孙涛,Schlossarek D,等。Clp蛋白酶和OR直接控制拟南芥类胡萝卜素合成的关键酶Phytoene Synthase的蛋白平衡。植物学报。2018;11:49 - 62。https://doi.org/10.1016/j.molp.2017.11.003.
文X,海勒A,王凯,韩强,倪颖,Carle R,等。黄、橙、红酸浆果实成熟过程中胡萝卜素发生和染色体发育。足底。2020;251:1-14。https://doi.org/10.1007/s00425-020-03383-5.
Wilk L, Grunwald M,廖p - n, Walla PJ, Kühlbrandt W.非光化学猝灭中主要光收集复合物II与PsbS的直接相互作用。中国科学院学报(自然科学版),2013;https://doi.org/10.1073/pnas.1205561110.
Wright LP, Rohwer JM, Ghirardo A, Hammerbacher A, ortizz - alcaide M, Raguschke B,等。脱氧木糖糖5-磷酸合酶通过甲基赤藓糖醇4-磷酸途径控制拟南芥的通量。中国生物医学工程学报。2014;https://doi.org/10.1104/pp.114.245191.
通过类胡萝卜素和合成生物学改变形式和功能。植物学报。2019;179:830-43。https://doi.org/10.1104/pp.18.01122.
Wurtzel ET, Cuttriss A, Vallabhaneni R.玉米原维生素A类胡萝卜素,当前资源和未来代谢工程挑战。中国植物科学,2012;3:29。https://doi.org/10.3389/fpls.2012.00029.
肖凯,陈娟,何强,王勇,沈宏,孙琳。DNA甲基化参与辣椒果实成熟调控并与植物激素相互作用。J Exp Bot 2020; 71:1928-42。https://doi.org/10.1093/jxb/eraa003.
徐萍,Chukhutsina VU, Nawrocki WJ, Schansker G, Bielczynski LW, Lu Y,等。没有β-胡萝卜素的光合作用。Elife。2020;9:e58984。https://doi.org/10.7554/eLife.58984.
闫娟,Kandianis CB, Harjes CE,白林,Kim EH,杨旭,等。玉米crtRB1的罕见遗传变异可能会增加玉米籽粒中的β -胡萝卜素。Nat Genet, 2010; 42:322-7。https://doi.org/10.1038/ng.551.
孙泽,袁红,曾松,孙泽,等。异位表达ORANGE促进番茄类胡萝卜素积累和果实发育。中国生物工程学报,2019;17:33-49。https://doi.org/10.1111/pbi.12945.
袁宏,Owsiany K, Sheeja TE,周X, Rodriguez C,李杨,等。在拟南芥中,橙蛋白中的单氨基酸替代促进类胡萝卜素过度积累。植物物理学报。2015a; 169:421-31。https://doi.org/10.1104/pp.15.00971.
袁浩,Pawlowski EG,杨毅,孙涛,Thannhauser TW, Mazourek M,等。拟南芥ORANGE蛋白通过与Tic蛋白相互作用调节质体前蛋白的输入。J Exp Bot, 2021; 72:1059-72。https://doi.org/10.1093/jxb/eraa528.
袁慧,张娟,纳吉斯瓦然D,李林。园艺作物类胡萝卜素代谢与调控。Hortic Res. 2015b;2:15036。https://doi.org/10.1038/hortres.2015.36.
袁玉文,Byers KJ, Bradshaw HD Jr.花传粉昆虫特异性的遗传控制。植物学报,2013;16:422-8。https://doi.org/10.1016/j.pbi.2013.05.004.
张洁,孙辉,郭松,任勇,李敏,王杰,等。番茄红素-环化酶蛋白丰度降低有助于驯化西瓜红肉。植物物理学报。2020;183:1171-83。https://doi.org/10.1104/pp.19.01409.
张娟,袁红,费志,鲍森毕军,张玲,李玲。橙头大白菜分子特征及转录组分析。学报)。足底。2015;241:1381 - 94。https://doi.org/10.1007/s00425-015-2262-z.
郑晓霞,王晓霞,王晓霞,等。类胡萝卜素生物强化在植物中的应用。生物化学学报。2020;1865:158664。https://doi.org/10.1016/j.bbalip.2020.158664.
郑旭,朱凯,孙强,张伟,王旭,曹辉,等。CCD4启动子的自然变异支持柑橘皮红色的物种特异性进化。植物学报。2019;12:1294-307。https://doi.org/10.1016/j.molp.2019.04.014.
钟升,费震,陈玉林,郑勇,黄明,Vrebalov J,等。番茄果实发育的单碱基分辨率甲基组揭示了与成熟相关的表观基因组修饰。中国生物工程学报,2013;https://doi.org/10.1038/nbt.2462.
钟勇,潘旭,王锐,徐洁,郭洁,杨涛,等。ZmCCD10a编码一种独特的类胡萝卜素裂解双加氧酶,增强植物对低磷的耐受性。植物物理学报。2020;184:374-92。https://doi.org/10.1104/pp.20.00378.
周东,沈勇,周鹏,法蒂玛,林杰,岳俊,等。木瓜CpbHLH1/2在木瓜果实成熟过程中调控类胡萝卜素合成相关基因。Hortic Res. 2019;6:80。https://doi.org/10.1038/s41438-019-0162-2.
周峰,林强,朱林,任勇,周凯,沙贝克,等。D14-SCF(D3)依赖的D53降解调节独脚金内酯信号。大自然。2013;504:406-10。https://doi.org/10.1038/nature12878.
周峰,王春英,Gutensohn M,姜林,张鹏,张东,等。香叶酰香叶酰二磷酸合成酶的募集蛋白控制水稻叶绿素生物合成的代谢通量。中国科学院学报(自然科学版),2017;https://doi.org/10.1073/pnas.1705689114.
周华,杨敏,赵林,朱智,刘峰,孙华,等。高分蘖和侏儒12通过影响水稻类胡萝卜素的生物合成来调节光合作用和植物结构。J Exp Bot, 2021; 72:1212-24。https://doi.org/10.1093/jxb/eraa497.
周娟,曾玲,刘娟,邢东。叶黄素循环对植物菌核病易感性的调控。科学通报。2015a;11:e1004878。https://doi.org/10.1371/journal.ppat.1004878.
周欣,孙涛,王楠,凌海坤,卢松,李林橙色基因通过抑制叶柄伸长的表达真核释放因子1.新植物,2011;190:89-100。https://doi.org/10.1111/j.1469-8137.2010.03578.x.
周旭,Welsch R,杨毅,Alvarez D, Riediger M,袁宏,等。拟南芥OR蛋白是植物烯合酶在控制类胡萝卜素生物合成中的主要转录后调节因子。中国科学院学报(自然科学版)2015b;https://doi.org/10.1073/pnas.1420831112.
朱凯,孙强,陈辉,梅霞,卢松,叶健,等。新型转录因子CsERF061对类胡萝卜素生物合成的乙烯激活作用。J Exp Bot 2021a; 72:3137-54。https://doi.org/10.1093/jxb/erab047.
朱凯,郑鑫,叶健,黄勇,陈辉,梅霞,等。柑桔中类胡萝卜素和叶绿素池的调节,解剖学上仅在柑橘中发现的独特水果。植物物理学报。2021b; 187:829-45。https://doi.org/10.1093/plphys/kiab291.
致谢
作者非常感谢许多同事和合作者对我们在这里描述的工作所做的贡献。我们感谢Emalee Wrightstone仔细校对了手稿。
资金
这项工作得到了农业和食品研究计划竞赛奖的支持。2019-67013-29162(给LL)和2021-67013-33841(给LL和TS)来自美国农业部国家食品和农业研究所和USDA- ars基地基金。
道德声明
伦理批准并同意参与
不适用。
发表同意书
不适用。
相互竞争的利益
作者声明没有利益竞争。
额外的信息
出版商的注意
伟德体育在线施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条所提供的资料,除非在资料的信用额度中另有说明。
关于本文
引用本文
孙,T,饶,S,周,X。et al。植物类胡萝卜素:最新进展及展望。摩尔园艺2, 3(2022)。https://doi.org/10.1186/s43897-022-00023-2
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s43897-022-00023-2
关键字
- 类胡萝卜素
- 新陈代谢
- 积累
- 监管
- 功能进化