主要内容
在多发性硬化症(MS)、阿尔茨海默病(AD)和帕金森病(PD)等神经退行性疾病的疾病相关脑区,T细胞浸润增强,其中大部分为CD8+T细胞(1,2].克隆扩增增加,T细胞活化和细胞毒性相关基因在克隆扩增的CD8中表达增加+脑脊液(CSF)中的T细胞在MS、AD或PD患者中均有报道。[3.,4,5T细胞的克隆扩增表明T细胞对特定抗原的识别和随后的免疫反应的建立。CD8+T细胞通常被认为是促炎症细胞毒性T淋巴细胞(ctl),即使免疫抑制CD8+调节性T细胞(CD8+treg)已经有半个多世纪的历史了[6].因此,推测这些疾病相关的CD8是可以理解的+T细胞引起免疫反应,并在中枢神经系统(CNS)施加细胞毒性,导致神经退行性变[3.,4].然而,最近的单细胞RNA测序(scRNA-seq)和单细胞t细胞受体测序(scTCR-seq)结合流式细胞术分析表明,两者都克隆扩增了CD8+神经退行性疾病中的T细胞[4,5,7和免疫抑制CD8+亚[8,9是最终分化的效应记忆T细胞(TEMRA)表达高水平的细胞毒性相关分子和共享细胞表面标记,提出了这些克隆扩增的CD8的作用的关键问题+T细胞在神经退行性疾病中起作用。本文讨论克隆扩增CD8的表型和功能+神经退行性疾病中的T细胞和免疫抑制CD8+treg和假设它们在神经退行性变中的作用。
MS患者TCR Vβ谱分析显示CD8克隆扩增+大脑MS病变中的T细胞在外周血和脑脊液中反映,特别是脑脊液[10].因此,分析克隆扩增的CD8+CSF中的T细胞比分析稀疏的脑浸润T细胞更为可行,是研究T细胞在神经退行性疾病中的作用的一种有价值的途径。scTCR-seq和scRNA-seq技术的最新进展使人们能够以单细胞分辨率同时测量TCR和基因表达谱,这不仅可以识别克隆扩增的CD8+在AD、PD和MS中的T细胞,还通过分析相应的全局基因表达谱揭示了这些细胞的功能和生理见解[4,5,7].CD45RA是一个naïve T细胞标记物,但是TEMRA细胞恢复CD45RA的表达,同时保持CD27的表达−CCR7−效应记忆细胞的表面标记特征。因此,TEMRA细胞通常定义为CD45RA+CD27−, CD45RA+CCR7−,或者CD45RA+CD27−CCR7−使用CD45RA、CD27或CCR7特异性荧光偶联抗体的流式细胞术分析可以很容易地识别T细胞。scRNA-seq分析通常不能区分CD45的RA和RO亚型EMRA细胞被定义为记忆(CD27−CCR7−)表达高水平T的T细胞EMRA-相关基因,如GZMA(granzyme),GZMB(granzyme B),PRF1(穿孔素)和NKG7[5].TEMRA细胞具有高度的细胞溶解性,但增殖能力较差。流式细胞术分析显示循环CD8+MS中的T细胞倾向于获得最终分化的表型[10),而CD8+TEMRAAD患者外周血和脑脊液中的细胞也增加,且与认知能力呈负相关[4].scRNA-seq和scTCR-seq分析结合流式细胞术分析脑脊液细胞显示克隆扩增的CD8+AD患者的T细胞是CD45RA+CD27−CCR7−/低CD127−CD161−PD-1−TEMRA表达高水平颗粒酶基因的细胞,NKG7,CST7,亚兰而且CCL5[4].从PD患者分离的CSF细胞的scRNA-seq和scTCR-seq分析显示克隆扩增的T细胞在CD27中富集−CCR7−GZMA嗨GZMB嗨PRF1嗨NKG7嗨CD8+T细胞,这些细胞也表达高水平的CCL5,CST7,GZMH而且GZMK[5].scRNA-seq和scTCR-seq分析表明,MS中克隆扩增的CD8 T细胞表达更高水平的CD8效应功能相关分子,包括颗粒酶A和K,NKG7,PFN1,CST7,CCL5,亚兰表达较低水平的出售(CD62L)CCR7−/低CD127−[7].这些基因表达特征表明,与AD患者一样,CD8克隆扩增+PD或MS患者脑脊液中的T细胞也是T细胞EMRA细胞。然而,基因表达分析并不能揭示这些细胞的细胞功能。的共识,CD8+TEMRA细胞具有高的细胞毒性,通过T细胞受体(TCR)识别相容性MHC分子所呈现的特定肽,将靶细胞裂解为常规的细胞毒性T淋巴细胞(CTL)。因此,我们推测这些克隆扩增的CD8+TEMRA细胞高度促炎,促进神经退行性变[4].
有趣的是,细胞表面标记物克隆扩增CD8的表达+TEMRAAD患者脑脊液中CD161细胞的表达与CD161相似−CD56+CD8+十年前在人类外周血中发现treg [11,12].两者都是CD45RA+CD27−CCR7−/低CD127−CD161−PD-1−虽然没有说明这些细胞是否会克隆扩展CD8+TEMRA细胞CD56+.CD161−CD56+CD8+treg杀死tcr激活的效应因子CD4+T细胞显示功能和细胞表面标记物与最近发现的免疫抑制KIR相似+CD8+T细胞,相当于人类小鼠的Ly49+CD8+预防或抑制自身免疫反应的treg [8,13,14].两个CD161−CD56+CD8+亚吉珥+CD8+T细胞是CD45RA+CD27−CCR7−CD28−CD127−,杀死激活的CD4+T细胞在细胞-细胞接触依赖的方式。据报道,几乎所有的KIR+T细胞是CD56+,以及KIR的大部分+T细胞是CD8+T细胞(15].这些观察结果表明CD161−CD56+CD8+treg和免疫抑制型KIR+CD8+T细胞很可能是相同的免疫调节CD8+T细胞亚群。自从CD161−CD56+CD8+亚吉珥+CD8+T细胞是CD45RA+CD27−CCR7−,应该被认为是CD8+TEMRA按常规分类的细胞。此外,scRNA-seq和scTCR-seq分析表明,与克隆扩增的CD8一样+神经疾病中的T细胞,克隆扩增的KIR+CD8+T细胞表达高水平的GZMH,GZMB,PRF1[8].增加吉珥+CD8+T细胞存在于自身免疫性疾病(包括多发性硬化症)患者的外周血和炎症组织中,也存在于病毒感染期间。然而,吉珥+CD8+T细胞似乎没有被诱导来加重自身免疫。相反,吉珥+CD8+T细胞被证明能特异性地杀死激活的病原性或自反应性CD4+作为免疫抑制调节性T细胞的T细胞[8].此外,与传统的TEMRA终末分化,增殖能力差的细胞,CD161−CD56+CD8+treg经过长期培养后能够增殖并保持其功能特征[11,12].显然,CD161−CD56+CD8+亚吉珥+CD8+T细胞不符合CD8的传统概念+TEMRA细胞。因此,关键问题是是否克隆扩展CD8+TEMRAAD、PD或MS中的细胞是免疫抑制调节细胞,可杀死致病性CD4+T细胞,或者说它们是促炎细胞溶解细胞会加速神经退行性变。
TEMRA细胞更多的是发育阶段的分类,而不是细胞谱系/类型的定义。与CD4+具有明确转录因子、细胞表面标记和细胞因子的T细胞,将人群划分为Th1、Th2、Th17、Tfh、Tregs等亚型,CD8的亚分类+T系仍然很模糊。根据现有的基因表达信息,还不能确定这些克隆扩增的CD8+TEMRA细胞和CD8+treg是完全或部分重叠或不重叠的种群。从理论上讲,CD8+TEMRA受疾病影响的大脑区域的细胞可能是促进有害免疫反应的ctl,也可能是由大脑中不希望的免疫反应诱导的抑制有害免疫反应的调节细胞,或者是两种细胞类型的混合。最终分化ctl和免疫抑制CD8共享的细胞类型定义表面标记+treg标志着新的CD8的必要性+T细胞分类标记。致力于鉴定CD8多样性的研究+TEMRA需要细胞和每个亚群的生物功能来填补免疫学的空白。有趣的是,单细胞轨迹分析显示末端效应子CD8+T细胞(TEMRAPD患者脑脊液中的细胞)表现为两个分化方向,其中一个表达高水平的杀伤细胞样受体(KLRs)和杀伤细胞免疫球蛋白样受体(KIRs) [5],增加了一些克隆扩增的CD8的可能性+神经系统疾病中的T细胞是免疫抑制型KIR+CD8+T细胞(图1).对AD或MS患者脑脊液细胞的单细胞多组学数据集也可进行类似的分析,以探索CD8的多样性+TEMRA细胞。CD161−CD56+CD8+根据克隆CD8的功能特征鉴定treg+T细胞(11,12].克隆CD8+TEMRA从脑脊液中提取细胞,然后进行功能分析,结合整体转录组学分析,可能是确定其多样性和独特分子标记,并了解其在神经退行性变中的作用的一种实用方法。
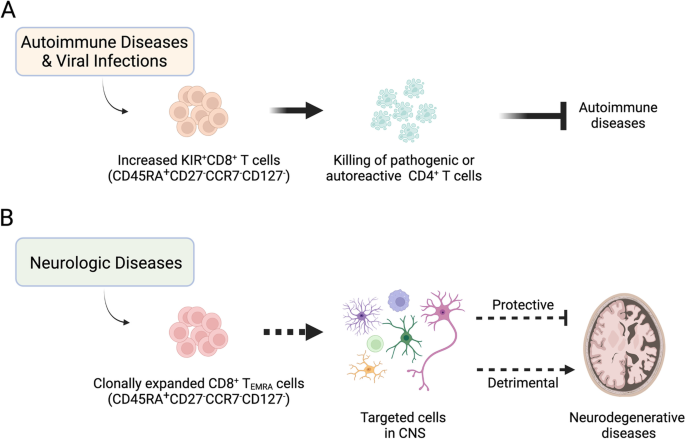
CD45RA+CD27−CCR7−CD127−CD8+TEMRA人类疾病中的细胞。一个在人类自身免疫性疾病,如多发性硬化症和病毒感染期间,如COVID-19, CD45RA+CD27−CCR7−CD127−吉珥+CD8+患者外周血和炎症组织中的T细胞增多。吉珥+CD8+T细胞杀死T细胞受体激活的致病和自反应性CD4+T细胞预防自身免疫性疾病的发展和抑制自身免疫性免疫反应。BCD45RA+CD27−CCR7−CD127−CD8+TEMRA细胞在患有神经退行性疾病(如多发性硬化症(一种自身免疫性疾病)和阿尔茨海默病)的患者的脑脊液中克隆扩增。这些CD8的功能和特定的细胞类型分类+TEMRA细胞是未知的。目前还不清楚它们是像细胞毒性T淋巴细胞一样破坏中枢神经系统,还是像调节性T细胞一样抑制流氓免疫反应。使用BioRender创建(Biorender.com)
数据和材料的可用性
不适用。这项研究包含了公开发表的研究数据。
参考文献
Machado-Santos J,等。多发性硬化症大脑的区隔性炎症反应由组织驻留的CD8+ T淋巴细胞和B细胞组成。大脑。2018;141:2066 - 82。
Dressman D, Elyaman W, Cells t。神经退行性疾病中越来越多的角色。神经学家。2022;28:335-48。
Denic A, Wootla B, Rodriguez M.多发性硬化症中的CD8(+) T细胞。专家意见Ther Targets. 2013; 17:1053-66。
D门,等等。克隆扩增的CD8 T细胞在阿尔茨海默病患者的脑脊液中巡逻。大自然。2020;577:399 - 404。
王鹏,等。单细胞转录组和TCR分析揭示了帕金森病中活化和扩大的T细胞群。细胞。2021;52。
蒋华,张丽娟。活化的CD8+抑制T细胞。Nat Immunol。2004;5:469 - 71。
Pappalardo JL,等。人中枢神经系统中T细胞的转录组学和克隆特性。Sci Immunol。2020;5 (51):eabb8786。https://doi.org/10.1126/sciimmunol.abb8786.
李静,等。KIR(+)CD8(+) T细胞抑制致病T细胞,并在自身免疫性疾病和COVID-19中活跃。科学。2022;376 (6590):eabi9591。
Bjorkstrom NK,等。与NK细胞相比,CD8 T细胞表达随机选择的具有不同特异性的KIRs。血。2012;120:3455 - 65。
Salou M,等。多发性硬化症患者外周和中枢神经系统间CD8 t细胞共享增多。中华神经科杂志2015;2:609-22。
胡东,刘旭,曾伟,魏娜华,李丽娟。人CD8+调节性T细胞克隆模型:激活CD4+ T细胞的不受限制的接触依赖性杀伤。中华免疫学杂志2012;42:69-79。
胡东,魏文华,李丽娟。人外周血中CD161- CD56+调节性CD8 T细胞的鉴定。《公共科学图书馆•综合》。2013;8:e59545。
胡丹,等。qa -1缺陷小鼠中调节性CD8 T细胞的分析。Nat Immunol。2004;5:516-23。
Kim HJ,等。CD8+ T调节细胞表达Ly49 I类MHC受体,在自身免疫易发B6-Yaa小鼠中存在缺陷。中国科学(d辑:自然科学版)2011;
陈伟强,等。多重和全基因组分析揭示了人类血液中KIR+和CD56+ T细胞的独特特性。J Immunol。2013;191:1625-36。
确认
本文仅代表作者个人观点,不代表美国退伍军人事务部或美国政府的观点。
资金
D. H.得到了布里格姆研究所试点基金奖和国家多发性硬化症协会研究基金RG-2111-38681的部分支持。
作者信息
作者和联系
贡献
d.h., w.x和H.L.W.写了手稿。所有作者阅读并批准了最终稿件。
相应的作者
道德声明
伦理批准和同意参与
不适用。这项研究不涉及人类受试者。不需要伦理上的批准和同意。
同意出版
不适用。
相互竞争的利益
作者声明在此手稿中没有竞争性的经济利益。
额外的信息
出版商的注意
伟德体育在线施普林格自然对出版的地图和机构附属的管辖权要求保持中立。
权利和权限
开放获取本文遵循创作共用署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),该协议允许在任何媒体或格式中使用、分享、改编、分发和复制,只要您给予原作者和来源适当的署名,提供创作共用许可协议的链接,并说明是否有更改。本文中的图片或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果材料不包含在文章的创作共用许可中,并且您的预期用途不被法律法规允许或超出了允许的用途,您将需要直接从版权所有者那里获得许可。欲查看此许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献放弃书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信用额度中另有说明。
关于这篇文章
引用这篇文章
胡丹、夏伟、魏纳、李文华、李文华CD8+T细胞在神经退行性变中的作用:朋友还是敌人?摩尔神经退化1759(2022)。https://doi.org/10.1186/s13024-022-00563-7
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s13024-022-00563-7
关键字
- CD8+亚群
- TEMRA细胞
- 神经退化