- 研究文章gydF4y2Ba
- 开放获取gydF4y2Ba
- 发表:gydF4y2Ba
BIN1是小胶质细胞中促炎和神经变性相关激活的关键调节因子gydF4y2Ba
分子神经退化gydF4y2Ba体积gydF4y2Ba17gydF4y2Ba文章编号:gydF4y2Ba33gydF4y2Ba(gydF4y2Ba2022gydF4y2Ba)gydF4y2Ba
摘要gydF4y2Ba
背景gydF4y2Ba
的gydF4y2BaBIN1gydF4y2Ba基因座包含第二重要的迟发性阿尔茨海默病遗传危险因素。gydF4y2BaBIN1gydF4y2Ba经历交替剪接产生组织和细胞类型特异性的BIN1异构体,在一系列关键的细胞过程中调节膜动力学。虽然大脑中BIN1在神经元和少突胶质细胞中的表达已被详细描述,但有关小胶质细胞BIN1表达的信息主要局限于大规模的转录组和蛋白质组数据。值得注意的是,BIN1蛋白的表达及其在小胶质细胞(一种与阿尔茨海默病最相关的细胞类型)中的功能作用尚未得到深入研究。gydF4y2Ba
方法gydF4y2Ba
通过小鼠和人脑免疫染色,以及分离的小胶质细胞或人ipsc衍生的小胶质细胞的免疫印迹和RT-PCR分析小胶质细胞BIN1的表达。gydF4y2BaBin1gydF4y2BasiRNA敲除在体外原代小胶质细胞培养物中的表达,以及在体内Cre-lox介导的成年小鼠大脑小胶质细胞条件缺失。利用NanoString基因板和流式细胞术方法研究了BIN1在体外和体内调节神经炎性小胶质细胞信号的作用。转录组数据通过硅质通路分析和互补分子方法进行验证。gydF4y2Ba
结果gydF4y2Ba
在此,我们研究了小胶质细胞中BIN1的体外和体内表达,并确定了小胶质细胞表达BIN1的异构体。的沉默gydF4y2BaBin1gydF4y2Ba在原代小胶质细胞培养物中,我们证实BIN1通过基因表达和细胞因子产生调节小胶质细胞中促炎和疾病相关反应的激活。我们的转录组分析揭示了关键的内稳态和脂多糖(LPS)诱导的炎症反应途径,以及转录因子PU.1和IRF1,它们受到BIN1的调控。Microglia-specificgydF4y2BaBin1gydF4y2Ba体内条件敲除揭示了BIN1在调节疾病相关基因表达和对抗CX3CR1信号通路方面的新作用。体外和体内研究的一致结果表明gydF4y2BaBin1gydF4y2Ba小胶质细胞加载1型干扰素响应促炎挑战的能力受损,特别是关键的1型免疫反应基因的上调,gydF4y2BaIfitm3gydF4y2Ba.gydF4y2Ba
结论gydF4y2Ba
我们的研究结果为小胶质细胞BIN1的功能提供了新的见解,并证明了小胶质细胞BIN1在调节大脑炎症反应和小胶质细胞表型变化方面的重要作用。此外,我们的研究第一次显示了一种调节关系gydF4y2BaBin1gydF4y2Ba而且gydF4y2BaIfitm3gydF4y2Ba小胶质细胞中有两个与阿尔茨海默病相关的基因。对BIN1进行调节的要求gydF4y2BaIfitm3gydF4y2Ba在许多神经退行性疾病的发病和进展过程中,炎症期间的表达上调对炎症反应具有重要意义。gydF4y2Ba
图形抽象gydF4y2Ba
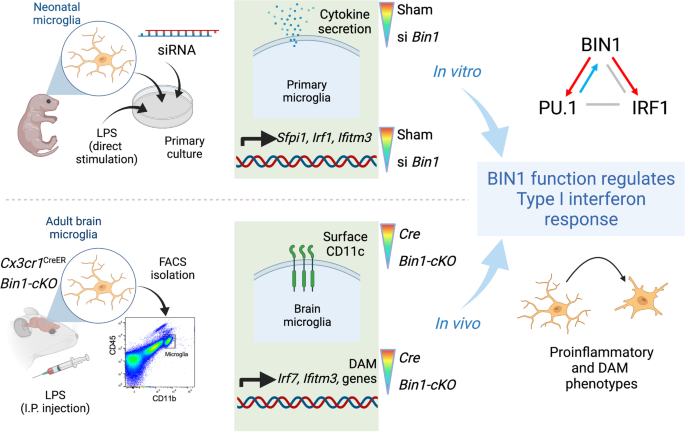
背景gydF4y2Ba
桥接积分器1 (gydF4y2BaBIN1gydF4y2Ba)是全基因组关联研究发现的晚发性阿尔茨海默病(LOAD)的一个重要遗传风险因子位点[gydF4y2Ba1gydF4y2Ba,gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3.gydF4y2Ba].20个中有7个的组织和细胞类型特异性交替剪接gydF4y2BaBIN1gydF4y2Ba外显子产生多个BIN1异构体,其功能域不同,亚细胞定位也不同[gydF4y2Ba4gydF4y2Ba].BIN1亚型参与一系列功能,包括膜重塑、内吞作用、细胞骨架调节和细胞周期[gydF4y2Ba4gydF4y2Ba].神经元BIN1定位于小鼠大脑突触前末梢,通过调节突触囊泡动力学在兴奋性神经传递中发挥不可或缺的作用[gydF4y2Ba5gydF4y2Ba].中央网格蛋白相关蛋白结合区(CLAP结构域)只存在于神经元异构体中,赋予了BIN1与内噬蛋白网格蛋白及其衔接蛋白AP-2相互作用的能力[gydF4y2Ba6gydF4y2Ba].尽管内体途径在β-淀粉样蛋白的产生中具有重要作用,但在阿尔茨海默病(AD)淀粉样变性小鼠模型中,神经元BIN1表达的缺失并不能调节β-淀粉样蛋白病理[gydF4y2Ba7gydF4y2Ba].此外,BIN1可与tau结合,BIN1过表达诱导培养神经元中tau依赖的网络过兴奋性[gydF4y2Ba8gydF4y2Ba,gydF4y2Ba9gydF4y2Ba],提示BIN1可能通过tau发病机制促进AD风险。BIN1也被证明可以限制培养神经元中致病性tau蛋白的神经元间扩散[gydF4y2Ba10gydF4y2Ba].此外,独立研究已经报道了AD个体中神经元BIN1表达的显著降低[gydF4y2Ba11gydF4y2Ba,gydF4y2Ba12gydF4y2Ba].后一项发现与BIN1表达增加导致缠结病理的建议不一致。对于这种表面上的不一致,一个可能的解释可能来自于神经元亚型(iso 1)的减少与无处不在亚型(iso 9)的增加相一致的观察[gydF4y2Ba11gydF4y2Ba,gydF4y2Ba13gydF4y2Ba].gydF4y2Ba
在中枢神经系统中,普遍存在的缺乏CLAP结构域的BIN1异构体在神经元和非神经元细胞中表达,最显著的是在人脑白质中的少突胶质细胞中表达[gydF4y2Ba11gydF4y2Ba,gydF4y2Ba14gydF4y2Ba,gydF4y2Ba15gydF4y2Ba].有趣的是,高层gydF4y2BaBin1gydF4y2Ba在急性分离的小鼠和人类大脑小胶质细胞的大规模数据集中,已经报道了转录物和蛋白的表达(图SgydF4y2Ba1gydF4y2Ba) [gydF4y2Ba16gydF4y2Ba,gydF4y2Ba17gydF4y2Ba,gydF4y2Ba18gydF4y2Ba].此外,在野生型小鼠和AD病理小鼠模型中,gydF4y2BaBin1gydF4y2Ba在定量质谱法测定的丰富小胶质蛋白中处于前20百分位[gydF4y2Ba19gydF4y2Ba,gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba21gydF4y2Ba].然而,从注射了凋亡神经元的小鼠大脑中分离出的吞噬小胶质细胞中,发现其丰度较低[gydF4y2Ba22gydF4y2Ba],与BIN1潜在的内稳态作用一致。gydF4y2Ba
在人脑蛋白质组学研究中,多标记物基因组注释分析(MAGMA)强调,在小胶质细胞标记中富集的蛋白共表达模块也在AD风险基因中富集,暗示了LOAD发病机制中的小胶质细胞功能障碍[gydF4y2Ba23gydF4y2Ba].小胶质细胞是驻留在中枢神经系统中的免疫细胞,在大脑发育和功能中起着关键作用,包括突触修剪、神经发生和大脑的免疫监视[gydF4y2Ba24gydF4y2Ba].此外,小胶质细胞在神经炎症和神经退行性疾病(包括AD)中发挥着重要而复杂的疾病修饰作用,并通过TREM2调节的免疫检查点从稳态状态转变为疾病相关小胶质细胞(DAM)表型[gydF4y2Ba22gydF4y2Ba,gydF4y2Ba25gydF4y2Ba].最近一项对小鼠小胶质细胞转录组数据集的网络分析也揭示了DAM表型的异质性,即促炎和抗炎DAM子图谱[gydF4y2Ba26gydF4y2Ba].在这个内稳态小胶质细胞的框架下,我们发现AD中的亲和抗炎DAMgydF4y2BaBin1gydF4y2Ba在稳态基因模块中ad相关基因的模块成员数最高,这提高了BIN1可能在小胶质细胞中发挥功能性和ad相关作用的可能性[gydF4y2Ba21gydF4y2Ba].gydF4y2Ba
吞噬和增殖是ad样病变的标志性小胶质细胞反应[gydF4y2Ba27gydF4y2Ba,gydF4y2Ba28gydF4y2Ba].尽管BIN1在平衡和病理条件下具有调节关键细胞通路和小胶质功能的潜力,但迄今为止的研究在很大程度上忽视了小胶质BIN1表达的特征。似乎,这一疏忽源于之前的研究未能以明确的方式可视化小胶质细胞中的BIN1免疫反应性。在这方面,少突胶质细胞、髓鞘和突触中BIN1的高水平表达导致了不同细胞群的标记;因此,细长的相互密集重叠的bin1阳性突起在整个组织学切片的深度都紧密地聚集在一起[gydF4y2Ba5gydF4y2Ba,gydF4y2Ba11gydF4y2Ba,gydF4y2Ba15gydF4y2Ba].因此,较少树突胶质细胞和神经元过程更强烈的染色掩盖了小胶质细胞中BIN1的免疫反应性,为清晰显示小胶质细胞中BIN1蛋白的原位表达提出了技术挑战。gydF4y2Ba
鉴于AD发病机制中小胶质细胞功能障碍和DAM转化的诸多发现[gydF4y2Ba29gydF4y2Ba,gydF4y2Ba30.gydF4y2Ba,研究小胶质细胞BIN1的表达和功能至关重要。本文通过记录小鼠大脑中的小胶质BIN1蛋白,并对小胶质BIN1异构体进行表征,实现了第一层分析。随后,我们通过沉默探讨了BIN1的功能作用gydF4y2BaBin1gydF4y2Ba在小鼠小胶质细胞和条件敲除小鼠(cKO)中表达gydF4y2BaBin1gydF4y2Ba等位基因在小胶质细胞。利用神经炎症的转录组分析,我们已经确定BIN1是一种内稳态微胶质调节因子,在激活的促炎症反应上游具有非冗余的作用gydF4y2BaApoegydF4y2Ba,gydF4y2BaTrem2,gydF4y2Ba而且gydF4y2BaTyrobp,gydF4y2BaPU.1和IRF1的上游,两者都是小胶质基因表达和向DAM过渡的主要调控因子[gydF4y2Ba31gydF4y2Ba,gydF4y2Ba32gydF4y2Ba].的损失gydF4y2BaBin1gydF4y2Ba微胶质细胞对LPS的反应能力严重受损,导致细胞因子产生和基因表达测定的促炎反应减弱。在体内,小胶质细胞丧失gydF4y2BaBin1gydF4y2Ba在lps诱导的神经炎症模型中,除了减少几个DAM基因的上调外,还减弱了促炎基因的表达变化。在体内和体外都一致gydF4y2BaBin1gydF4y2Ba操纵研究显示,BIN1可调节小胶质细胞1型干扰素反应。重要的是,BIN1被发现调节炎症诱导的表达gydF4y2BaIfitm3gydF4y2Ba,一种干扰素反应基因,最近与ad相关机制有关[gydF4y2Ba33gydF4y2Ba].IFITM3促进溶酶体酸化[gydF4y2Ba34gydF4y2Ba,gydF4y2Ba35gydF4y2Ba并限制免疫反应细胞因子的产生[gydF4y2Ba36gydF4y2Ba,gydF4y2Ba37gydF4y2Ba].值得注意的是,IFITM3基因网络在AD患者的大脑和外周血单个核细胞中富集[gydF4y2Ba38gydF4y2Ba],提示IFITM3在AD病理的小胶质细胞炎症反应中发挥作用。综上所述,这些发现为研究BIN1在小胶质细胞中的表达和功能提供了重要的见解,证明了小胶质细胞BIN1表达在大脑炎症反应中的重要性。gydF4y2Ba
方法gydF4y2Ba
动物,药物管理和收获gydF4y2Ba
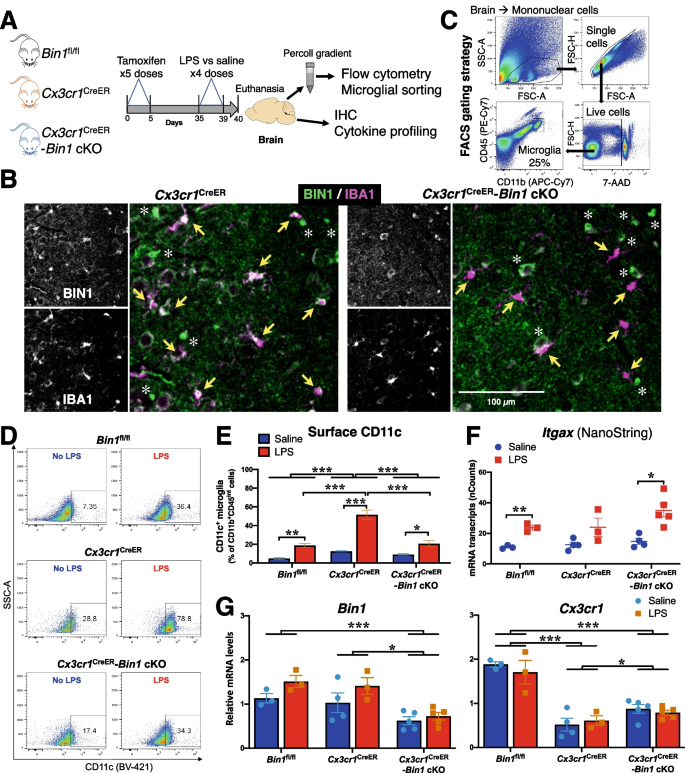
所有涉及动物的实验都是根据南佛罗里达大学IACUC指南进行的。gydF4y2BaBin1gydF4y2Bafl / flgydF4y2Ba株从George C. Prendergast博士(兰克瑙医学研究所)获得[gydF4y2Ba39gydF4y2Ba].gydF4y2BaEmx1gydF4y2Baires -gydF4y2BaCregydF4y2Ba(JAX股票#005628)gydF4y2BaCx3cr1gydF4y2BaLitt tm2.1 (cre / ERT2)gydF4y2BaJAX股票021160;杂合子小鼠被称为gydF4y2BaCx3cr1gydF4y2Ba克里尔gydF4y2Ba)系列从杰克逊实验室(Bar Harbor, ME)购买。gydF4y2BaBin1gydF4y2Bafl / flgydF4y2Ba老鼠与gydF4y2BaEmx1gydF4y2Baires -gydF4y2BaCregydF4y2Ba或gydF4y2BaCx3cr1gydF4y2Ba克里尔gydF4y2Ba动物产生gydF4y2BaEmx1gydF4y2BaCregydF4y2Ba:gydF4y2BaBin1gydF4y2Bafl / flgydF4y2Ba(gydF4y2BaEmxgydF4y2BaCregydF4y2Ba-gydF4y2BaBin1gydF4y2BacKO)和gydF4y2BaCx3cr1gydF4y2Ba克里尔gydF4y2Ba:gydF4y2BaBin1gydF4y2Bafl / flgydF4y2Ba(gydF4y2BaCx3cr1gydF4y2Ba克里尔gydF4y2Ba-gydF4y2BaBin1gydF4y2Ba(cKO)动物gydF4y2Ba5gydF4y2Ba].小鼠维持在C57BL6/J背景下。gydF4y2Ba
他莫西芬(10 mg/mL,在10%乙醇和90%葵花籽油溶液中通过涡流和超声制备)通过腹腔注射(100 mg/kg)连续5天。然后小鼠休息4周,让周围单核细胞重新繁殖。然后,连续4天注射(750 μg/kg) LPS(用250 μg/mL无菌盐水溶解,通过0.22 μm注射器过滤器过滤)。末次给药24 h后处死。在每次注射LPS之前,对小鼠进行称重,并监测其疾病和体重减轻情况。所有动物都被过量异氟醚麻醉,并灌注冰冷的PBS。分离脑组织,进行小胶质细胞分离和免疫染色。gydF4y2Ba
免疫荧光染色及成像gydF4y2Ba
脑组织在4℃含4%多聚甲醛的PBS中固定24 h后,进行石蜡包埋处理。5 μm厚的切片在二甲苯中脱蜡,通过乙醇系列水合,在90°C(含0.05%吐温20,pH 6的10mm柠檬酸钠)中进行抗原提取。在0.25% Triton X-100中洗涤和渗透后,在室温下含有10%驴血清、3% BSA和0.1% Triton X-100的缓冲液中孵育1小时,非特异性结合位点被阻断。用于免疫染色的抗体见补充表5。1次抗体用1% BSA (TBS + 0.1% Triton X-100)稀释,加入载玻片,4℃孵育过夜。冲洗后,将荧光标记二抗体加入载玻片,室温孵育2 h。另外,根据制造商的说明,在表位检索和阻断非特异性结合位点之后,在intelliPATH FLX自动染色系统(Biocare Medical)上进行免疫染色。将载玻片与一、二抗体在室温下孵育1 h。在用VectorShield安装介质安装盖套之前,切片在室温下清洗和干燥。图像是在配备了横河旋转盘场扫描共聚焦系统和Photometrics PRIME 95B sCMOS相机的尼康Eclipse Ti2自动显微镜上获得的,使用20X和100X物镜。 High magnificationzgydF4y2Ba-堆栈图像在nisis - elements软件(尼康)中反卷积,使用Fiji/ImageJ处理,并通过平滑流形提取插件转换为2D投影[gydF4y2Ba40gydF4y2Ba].gydF4y2Ba
荧光激活的小胶质细胞分选gydF4y2Ba
如前所述,用流式细胞术分离小鼠大脑小胶质细胞[gydF4y2Ba41gydF4y2Ba].简单地说,采集的脑组织在冰上切碎,然后通过一个40 μm的尼龙细胞过滤器和冰过滤的PBS。分散细胞悬液在800 x离心gydF4y2BaggydF4y2Ba, 4℃,5分钟,颗粒悬浮在含有1x HBSS的35%等渗Percoll溶液中。髓鞘通过离心分离(800 xgydF4y2BaggydF4y2Ba,在15°C, 25分钟),并从细胞悬浮液顶部取出。Percoll溶液在冰冷的PBS中稀释10倍,800倍离心gydF4y2BaggydF4y2Ba, 4°C, 5分钟。将小胶质细胞颗粒重悬于300 μl冰冷PBS中。用7-氨基放线菌素D[1:1000]在室温PBS中标记死亡细胞30分钟。然后用APC-Cy7大鼠α-CD11b[M1/70] (BD Pharmingen 557,657)、PE-Cy7大鼠α-小鼠CD45[30- f11] (BD Pharmingen 552,848)和BV421亚美尼亚仓鼠α-CD11c[N418] (BD Horizon 565,452)[均稀释为1:100]在PBS中标记细胞30分钟,然后用PBS洗涤两次。流式细胞术在BD FACS Melody细胞分选机上进行。活细胞经7-氨基放线菌素d阴性染色门控。单个核细胞采用FSC-A/SSC-A和FSC-A/FSC-H进行门控。小胶质细胞分离为CD11bgydF4y2Ba+gydF4y2Ba和CD45gydF4y2BaintgydF4y2Ba收集在PBS中,1000倍离心gydF4y2BaggydF4y2Ba使细胞沉淀2分钟。用于免疫印迹分析的细胞球在干冰上速冻,并在- 80°C保存,直到进一步处理。用于NanoString分析的细胞球团立即在RLT缓冲液(Qiagen)中裂解,在干冰上速冻,并在−80°C保存。gydF4y2Ba
原发性新生儿小胶质细胞分离gydF4y2Ba
采用已建立的分离和富集方案建立小鼠原代小胶质细胞培养物[gydF4y2Ba42gydF4y2Ba,gydF4y2Ba43gydF4y2Ba].如前所述[gydF4y2Ba31gydF4y2Ba],处死C57BL/ 6j小鼠(P0-3),解剖脑组织,37°C胰酶消化15min。用20 ml DMEM (Dulbecco’s Modified Eagle Medium)/10%胎牛血清(FBS)和1%青霉素-链霉素-谷氨酰胺(青霉素-链霉素-谷氨酰胺)淬火胰蛋白酶后,清洗细胞颗粒,去除髓磷脂碎片。剩下的细胞悬浮液用40 μm过滤器过滤,然后用CD11b过滤gydF4y2Ba+gydF4y2Ba使用mini-MACS (Miltenyi Biotec Cat#130-042-201)柱进行正向选择。CD11bgydF4y2Ba+gydF4y2Ba富集的结果是> 90%纯度的CD11bgydF4y2Ba+gydF4y2Ba小胶质细胞经流式细胞术验证[gydF4y2Ba42gydF4y2Ba].然后将细胞接种到聚赖氨酸包被孔中,在DMEM中培养。24 h后更换新鲜培养基,细胞用于实验。gydF4y2Ba
人类ipsc衍生的小胶质样细胞gydF4y2Ba
从人类血细胞中生成人类iPSC系及其特性先前已有描述[gydF4y2Ba44gydF4y2Ba,gydF4y2Ba45gydF4y2Ba].人类iPSCs被分化为原始巨噬细胞前体,然后分化为小胶质细胞(iMG),基本上如上所述[gydF4y2Ba44gydF4y2Ba,gydF4y2Ba46gydF4y2Ba].原始巨噬细胞前体最终分化为iMG发生在10天以上,细胞在培养中保持至少1个月,然后收集进行免疫印迹和RT-PCR分析。gydF4y2Ba
一代的gydF4y2BaBin1gydF4y2BaKO BV2池gydF4y2Ba
BV2细胞在添加10%胎牛血清、4 mM l -谷氨酰胺、100 U/ml青霉素和100 μg/ml链霉素的DMEM中培养,37°C和5% COgydF4y2Ba2gydF4y2Ba.用pLentiCRISPRv2质粒(Genscript)产生的慢病毒转导细胞gydF4y2BaBin1gydF4y2BasgRNA (GAAGGATCTTCGGACCTATC)或非目标sgRNA。选择嘌呤霉素中的稳定转导池gydF4y2BaBin1gydF4y2Ba通过gRNA靶位点PCR扩增(f -引物:ACTGAGTGGTGGCTGACAAG;r -引物:TGAGTGCCAGAGAATCAGCG)和测序。PCR产物也被克隆到pGEM-T Easy (Promega)中,每个池中有4个克隆个体被测序,以确认目标区域内的缺失。WT和KO池生长到60 -70%时,血清饥饿16小时,再用LPS (0.5 μg/mL)处理16小时,然后收获用于RNA分离或裂解物制备。gydF4y2Ba
Bin1gydF4y2Ba小干扰RNA (siRNA)转染研究gydF4y2Ba
Bin1gydF4y2Ba沉默了gydF4y2BaBin1gydF4y2BasiRNA (sc-29,805 Santa Cruz Biotechnology)和等量的非特异性伪siRNA (sc-37,007)用于对照。使用Lipofectamine™RNAiMAX (Invitrogen)和Opti-MEM (Invitrogen)转染原代小胶质细胞40nm(终浓度)siRNA。48 h后,通过qRT-PCR验证sirna介导的基因沉默的有效性。LPS (10 ng/ml或100 ng/ml, Sigma-Aldrich Cat#L4391,gydF4y2Ba大肠杆菌gydF4y2Ba在siRNA暴露24小时后加入0111:B4)以激活小胶质细胞。激活24小时后收集细胞进行qRT-PCR、NanoString和吞噬研究,收集上清液进行细胞因子测定。的可行性gydF4y2BaBin1gydF4y2Basirna处理的细胞采用活/死染色(Invitrogen)流式细胞术检测,热处理细胞作为阳性对照。gydF4y2Ba
免疫印迹gydF4y2Ba
在裂解缓冲液(150 mM NaCl, 50 mM Tris-HCl, 0.5% NP-40, 0.5% SDS)中加入1 × Roche cOmplete蛋白酶抑制剂,250 μM PMSF均质提取全脑样品中的蛋白质。DNA是用探头超声器进行超声剪切的。用流式细胞仪分离的小胶质细胞提取蛋白质,用裂解液裂解培养人iMG。用4-20% Bis-Tris凝胶电泳等分蛋白样本,并用兔抗- bin1 (Proteintech 14,647-1-AP, 1:1000)和小鼠抗-β-actin (Proteintech 66,009-1-lg, 1:5万)抗体检测印迹。用IR680-和ir800结合的二抗培养印迹,用奥德赛红外成像系统(Li-COR Biosciences)成像。gydF4y2Ba
RT-PCR和亚型定量gydF4y2Ba
根据制造商的说明,使用DirectZol试剂盒(Zymo)从组织和细胞中提取RNA。使用上标IV (Invitrogen)逆转录RNA,使用Phusion聚合酶(NEB)进行pcr。PCR引物设计跨越外显子7 (6-F: GGATGAAGCCAAAATTGCCAA;10-R: CATCATTGAGGTTCTGATTGAGC)、CLAP结构域和外显子17 (12-F: AF690_CATCCCCAAGTCCCCATCTC;19-R: AATCACCAACACCACATCGC),或外显子11 (10-F: TCAATGATGTCCTGGTCAGC;12-R: GCTCATGGTTCACTCTGATC)。引物也被设计用于扩增人类外显子11序列(Hu_exon 10-F: AGAACCTCAATGATGTGCTGG;Hu_exon 12-R: TCGTGGTTGACTCTGATCTCGG)。扩增的DNA片段通过7.5%的丙烯酰胺凝胶电泳。使用SYTO™60染料(Invitrogen)对凝胶进行染色,并在红外奥德赛扫描仪(LICOR)上进行可视化。 PCR products amplified using Alexa flour 690-modified forward primer were scanned without staining to allow semi-quantification of DNA based on fluorescence intensity relative to the molecular load.
为了计算同工型频率,采用facs分离的小胶质细胞cDNA,引物12-F和19-R进行PCR扩增。产物纯化后克隆于pGEM-T Easy载体(Promega)中,转化为JM109细胞。从单个菌落分离的DNA用PCR重新扩增,并通过5%丙烯酰胺TBE凝胶电泳,通过插入长度区分剪接。所有较大的插入和选择最常见的(容易区分的,最小的)插入通过测序分析,以确定在小鼠大脑小胶质细胞中表达的四种异构体(图SgydF4y2Ba2gydF4y2BaB).计算四个异构体对应克隆的相对频率,数据如图所示。gydF4y2Ba1gydF4y2BaH。gydF4y2Ba
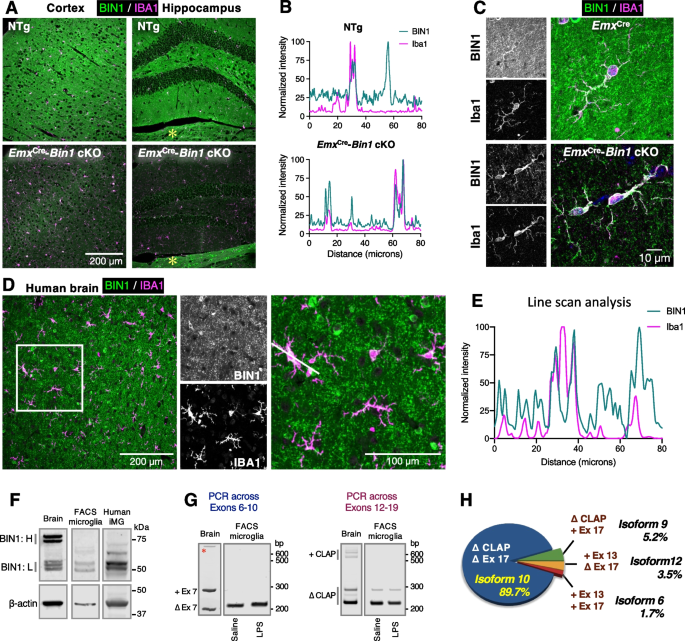
小鼠大脑和人类ipsc衍生的小胶质细胞中BIN1的特征。gydF4y2Ba一个gydF4y2Ba5 μm厚的石蜡切片用抗BIN1抗体(绿色)和抗IBA1抗体(紫红色)染色。WT动物的皮质和海马图像显示iba1阳性小胶质细胞中BIN1表达(上图)。通过从基因上去除兴奋性神经元和少突胶质细胞中Bin1的表达,在Bin1 cKO小鼠中证实了Bin1的表达。星号表示在cKO大脑中齿状回下方的丘脑中预期的未受干扰的BIN1表达[gydF4y2Ba5gydF4y2Ba].gydF4y2BaBgydF4y2Ba行扫描分析显示,在一个细胞子集(WT)中,BIN1和IBA1信号强度一致,并表明BIN1在IBA1+小胶质细胞中的表达。兴奋性神经元和少突胶质细胞中BIN1表达的去除表明,小胶质标记物(IBA1)的高强度谱与BIN1的高强度谱重叠,肯定了小胶质细胞BIN1的表达。gydF4y2BaCgydF4y2Ba高倍率图像证明BIN1在cKO和Emx中位于小胶质体核周区域gydF4y2BaCregydF4y2Ba同窝出生的。在BIN1 cKO小鼠大脑中,小胶质细胞BIN1的定位很明显,可以看到BIN1的免疫反应渗透到细胞分支(底部面板)。gydF4y2BaDgydF4y2Ba人死后大脑切片用抗BIN1抗体(绿色)和IBA1抗体(洋红色)染色。免疫荧光的重叠形态同质性明确地证明了BIN1在人小胶质细胞中的表达。gydF4y2BaEgydF4y2Ba行扫描分析显示d中两个通道重叠表达,两个通道的峰值代表小胶质细胞BIN1的表达。BIN1的峰值仅反映来自少突胶质细胞的信号。IBA1的单个分离峰提示小胶质细胞细胞核中缺乏BIN1的表达。gydF4y2BaFgydF4y2Ba对全脑匀浆中BIN1表达的免疫印迹分析显示,含有CLAP结构域(BIN1: H)的BIN1亚型水平较高,而BIN1:L亚型水平较低。相比之下,facs分离的小鼠小胶质细胞和人类ipsc衍生的iMG主要表达缺乏CLAP结构域的BIN1亚型(BIN1: L)。gydF4y2BaGgydF4y2Ba对分离的facs小胶质细胞的RT-PCR分析表明,在大多数小胶质细胞Bin1转录本中,外显子7(左)和CLAP结构域(右)被排除在外。我们检测到LPS给药后,Bin1亚型没有相对变化(见图。年代gydF4y2Ba2gydF4y2Ba和年代gydF4y2Ba5gydF4y2BaH).星号表示非特异性PCR产物。gydF4y2BaHgydF4y2Ba选择性剪接产生的小胶质细胞Bin1异构体。对PCR产物的克隆和单独分析可以计算出Bin1亚型的频率。约90%的小鼠小胶质细胞Bin1转录本编码isoform 10,连同isoform 9、12和6,约占Bin1转录本的10%。外显子7 (BAR域内),外显子11 (PI域内;看到图年代gydF4y2Ba3.gydF4y2BaA)和外显子14-16(在CLAP区域内)在筛选的任何微胶质异构体中都不存在gydF4y2Ba
定量逆转录酶PCR (qRT-PCR)gydF4y2Ba
如前所述进行RNA提取和cDNA合成[gydF4y2Ba47gydF4y2Ba].定量实时PCR在7500 Fast real-time PCR系统上使用TaqMan PCR master mix (Applied Biosystems)进行。使用了以下基因特异性TaqMan探针:gydF4y2BaTrem2gydF4y2Ba(Mm04209424_g1),gydF4y2BaApoegydF4y2Ba(Mm01307193_g1),gydF4y2BaTyrobpgydF4y2Ba(Mm00449152_m1),gydF4y2BaSpp1gydF4y2Ba(Mm00436767_m1),gydF4y2Ba入库单gydF4y2Ba(Mm00433848_m1),gydF4y2BaLamp1gydF4y2Ba(Mm00495262_m1),gydF4y2BaBin1gydF4y2Ba(Mm00437457_m1),gydF4y2BaGapdhgydF4y2Ba(Mm99999915_g1)。每个样本重复分析,相对基因表达分析用2gydF4y2Ba-ΔΔCtgydF4y2Ba方法比较管家基因gydF4y2BaGapdhgydF4y2Ba[gydF4y2Ba31gydF4y2Ba].或者,RNA提取和cDNA合成采用与RT-PCR相同的方式进行。然后使用QuantStudio™3 Real-Time PCR系统(Applied Biosystems)进行qRT-PCR。使用技术三拷贝(使用补充表6中列出的引物序列)对样本进行扩增gydF4y2Ba——∆∆CtgydF4y2Ba方法,正常gydF4y2BaCotl1gydF4y2Ba.gydF4y2Ba
纳米串神经炎症基因定量表达及数据分析gydF4y2Ba
小胶质细胞暴露于sirnagydF4y2BaBin1gydF4y2Ba24小时后,再进行LPS (10 ng/ml)处理24小时,然后用TRIzol (Invitrogen)溶解细胞。然后使用nCounter低RNA输入试剂盒(NanoString low -RNA-48)分离RNA。对所有样本进行质量控制检查,以确定RNA浓度和完整性(所有样本的RIN得分为> 8.8),并使用NanoString神经炎症板(770个选定基因)对每个样本使用50 ng进行NanoString检测[gydF4y2Ba48gydF4y2Ba].使用NanoString检测基因表达,将计数高于阴性对照几何图形两个标准差的基因纳入最终分析。在小组中代表的770个基因中,有681个基因符合这一标准。然后将每个基因的计数归一化为包含在面板中的8个家务管理基因的几何平均值。首先对表达数据集进行主成分分析(PCA),以确定实验条件是否聚集在一起,并确定Bin1和LPS对数据集的影响。采用Morpheus软件(Broad Institute)进行k均值聚类分析。作为一种正交聚类方法,对NanoString表达数据也进行了tSNE。通过将二维tSNE散点图与K-means聚类成员关系(SPSS Version 24)叠加,确定K-means和tSNE聚类之间的一致性。组间比较采用组间方差分析(ANOVA)和事后Tukey检验。使用所有681个纳入的基因作为参考列表(GOElite, Version 1.2.5),进行基因本体论(GO)分析,在每个聚类中识别丰富的GO术语、Wikipathways和KEGG pathway [gydF4y2Ba48gydF4y2Ba,gydF4y2Ba49gydF4y2Ba].gydF4y2Ba
荧光聚苯乙烯微球吞噬流式细胞术gydF4y2Ba
将藻氰菊酯(PE)共轭聚苯乙烯微球(heat - fisher Fluorospheres, Cat Cat#F13083)添加到初级小胶质细胞[gydF4y2Ba41gydF4y2Ba,gydF4y2Ba50gydF4y2Ba].5 μl微球(≈200微球/细胞)在37°C作用1 h后,胰酶在37°C孵育10 min分离细胞,然后加入含10%胎牛血清的DMEM。这些细胞被置于冰上以阻止吞噬活性。用冰冷PBS洗涤细胞,然后用荧光团标记CD45 (CD45- bv421, BD Biosciences Cat#563890)在室温下标记30分钟,然后在流式细胞术前洗涤。如前所述,用流式细胞仪检测吞噬特性[gydF4y2Ba50gydF4y2Ba].使用FlowJo版本10分析所有流式细胞术数据,并确定显示> 1珠/细胞被吞噬的细胞比例作为吞噬活性的指标。> 2珠/细胞的吞噬被认为是高水平的吞噬。gydF4y2Ba
采用与荧光激活小胶质细胞分选相同的处理方法,在成年小鼠脑细胞(含未纯化的小胶质细胞)中评估吞噬作用。去除髓鞘后,细胞用1 μl黄绿色聚苯乙烯珠(Sigma, Cat#L4655)在100 μl PBS中孵育,在37°C加5% CO的潮湿培养箱中孵育gydF4y2Ba2gydF4y2Ba1 h。然后用PBS洗涤细胞两次,用APC-Cy7大鼠α-CD11b和PE-Cy7大鼠α-CD45染色,流式细胞仪进行荧光激活小胶质细胞分选。gydF4y2Ba
荧光纤维Aβ42吞噬流式细胞仪测定gydF4y2Ba
将100 μg肽(Anaspec Cat#AS-60479)与20 μl 1% NH混合,制备了与HiLyte Fluor 488 (fAβ42-488)结合的Aβ42纤维荧光蛋白gydF4y2Ba4gydF4y2Ba并立即用1XPBS稀释,制备100 μM原液。混合物在室温下孵育6天,然后如前所述用于吞噬试验[gydF4y2Ba41gydF4y2Ba,gydF4y2Ba50gydF4y2Ba].siRNA和/或炎症刺激体外暴露后,在37°C下加入fAβ42-488(终浓度为2 μM) 1 h。按照上面讨论的方法收集细胞,然后用荧光团结合的抗cd45单抗标记细胞(CD45-PE-Cy7, BD Biosciences Cat#552848)。用补偿珠进行了补偿实验。活CD45细胞对荧光fAβ42-488的吞噬吸收gydF4y2Ba+gydF4y2Ba测定小胶质细胞与荧光细胞的比例。我们之前已经证明,细胞松弛素D处理可以抑制这种荧光峰值,这证实了我们的检测测量了肌动蛋白依赖的吞噬过程[gydF4y2Ba50gydF4y2Ba].gydF4y2Ba
细胞因子和趋化因子的多重免疫测定(中观尺度发现平台V-PLEX)gydF4y2Ba
在收集细胞进行转录组学研究之前收集培养上清。将上清离心除去碎片,然后使用120 μl进行多重免疫测定(MSD V-PLEX促炎仪:IFN-γ、IL-10、IL-12p70、IL-1β、IL-2、IL-4、IL-5、IL-6、KC/GRO、TNF-α),按照制造商说明。这些实验在艾莫利多重免疫分析中心(EMIC)进行,所有样本都是重复运行的。为每个细胞因子建立标准曲线。细胞因子数据归一化为总体平均值,并以热图表示(Morpheus软件,Broad Institute)。进行分组方差分析和事后两两统计比较。同样的样本也使用Luminex细胞因子面板(EMD Millipore, 15-plex细胞因子试剂盒:GM-CSF, IFN-γ, IL-10, IL-1α, IL-2, IL-4, IL-6, IP-10/CXCL10, MCP-1/CCL2, MIP-1α/CCL3, TNFα, M-CSF, VEGF-A, G-CSF, RANTES用于体外研究)进行检测。我们还测量了32种细胞因子(EMD Millipore, 32-plex细胞因子试剂盒:G-CSF, Eotaxin, GM-CSF, IFN-g, IL-1a, IL-1b, IL-2, IL-4, IL-3, IL-5, IL-6, IL-7, IL-9, IL-10, IL-12p40, IL-12p70, LIF, IL-13, LIX, IL-15, IL-17, IP-10, KC, MCP-1, MIP-1a, MIP-1b, M-CSF, MIP-2, MIG, RANTES, VEGF, TNF-a,用于活体研究)的水平。这些分析是按照制造商的协议进行的,并在MAGPIX仪器上读出。gydF4y2Ba
小胶质形态学分析gydF4y2Ba
小鼠大脑在4℃下用4%的PFA后固定,然后在30%的蔗糖中平衡,直到大脑下沉。冷冻切片(25 μm)用山羊α-IBA1抗体(Novus biicals)在4℃下染色40 h。二抗(Alexa fluor 555 donkey α-goat, Invitrogen)孵育3 h,细胞核用Hoechst染色30 min。全脑切片的显微图像为4.5 μm厚gydF4y2BazgydF4y2Ba-使用带有20X物镜的尼康Eclipse Ti2显微镜(0.5 μm间隔)堆叠。使用NIS Elements软件(尼康)将图像瓦片拼接在一起并去卷积。生成叠加图像的最大强度投影,并在Fiji/ImageJ中转换为二元掩模。个人IBA1gydF4y2Ba+gydF4y2Ba细胞(特定区域的初级体感觉皮层,CA1和下丘脑)被选为感兴趣的区域。在斐济/ImageJ使用FracLac插件的感兴趣区域扫描功能进行形态测量分析[gydF4y2Ba51gydF4y2Ba].手动检查输出图像(由盲法研究人员),以确保FracLac的凸包检测与原始的最大强度投影相似。用SPSS软件对船体和圆的形态测量数据进行分析。gydF4y2Ba
统计分析gydF4y2Ba
采用GraphPad Prism 8.0版本、Microsoft Excel 2017版本、SPSS 24版本和R(3.5.1版本)进行数据分析和数据表示。数据以均数±均数标准误差(SEM)表示。学生t检验(双尾,假设方差相等)用于两两比较,统计学显著性设为gydF4y2BapgydF4y2Ba除非另有说明,否则< 0.05。所有其他统计方面的考虑都在上面的有关部分讨论。gydF4y2Ba
结果gydF4y2Ba
BIN1在小鼠和人脑小胶质细胞中的表达和亚细胞定位gydF4y2Ba
最初,我们试图明确识别小鼠大脑小胶质细胞中BIN1蛋白的表达。我们用抗BIN1和IBA1抗体对野生型(WT)小鼠大脑切片进行免疫染色,发现在皮质和海马区有几个细胞对这两种蛋白质都呈阳性(图。gydF4y2Ba1gydF4y2Ba,上半部分)。然而,在显微图像中,遍布大脑实质的突触BIN1覆盖了整个视野,形成了较差的对比,无法通过形态学识别细胞特异性。为了明确确认iba1阳性小胶质细胞中BIN1的表达,我们生成gydF4y2BaEmxgydF4y2BaCregydF4y2Ba:gydF4y2BaBin1gydF4y2Bafl / flgydF4y2Ba老鼠的gydF4y2BaBin1gydF4y2Ba海马和皮质的兴奋性神经元和少突胶质细胞的等位基因被删除[gydF4y2Ba5gydF4y2Ba],为未受影响的细胞群(即小胶质细胞)中检测BIN1提供了更好的对比。正如预期的那样,只有低水平的BIN1免疫反应性(可能在抑制突触中)在脑皮层和海马的神经泌中被检测到gydF4y2BaEmxgydF4y2BaCregydF4y2Ba-gydF4y2BaBin1gydF4y2Ba使用bin1特异性抗体的cKO [gydF4y2Ba5gydF4y2Ba(图。gydF4y2Ba1gydF4y2Ba较低的面板)。相比之下,典型的BIN1在少突胶质细胞和有髓纤维束中的表达在中脑中很明显。gydF4y2Ba1gydF4y2BaA,用an表示gydF4y2Ba星号gydF4y2Ba).不同于IBA1的细胞BIN1免疫荧光染色gydF4y2Ba+gydF4y2Ba和IBA1gydF4y2Ba−gydF4y2Ba在WT小鼠中,cKO小鼠皮层和海马区BIN1细胞染色仅限于IBA1gydF4y2Ba+gydF4y2Ba小胶质细胞。通过双通道图像的线扫描分析来评估BIN1和IBA1的细胞共表达情况。gydF4y2Ba1gydF4y2BaB).在WT中,尽管在小胶质细胞BIN1表达的高强度峰值子集中,BIN1和IBA1信号有明显重叠,但其他BIN1峰值中没有IBA1信号,表明BIN1在其他细胞类型中表达(如表达高水平BIN1的少突胶质细胞[gydF4y2Ba4gydF4y2Ba])。相比,gydF4y2BaEmxgydF4y2BaCregydF4y2Ba-gydF4y2BaBin1gydF4y2Ba在WT小鼠中可见高水平的实质BIN1信号。重要的是,来自cKO的测量显示了BIN1和IBA1信号在高强度峰值上的近乎完美的对齐,证明了BIN1蛋白在小胶质细胞中的表达(图1)。gydF4y2Ba1gydF4y2BaB).在高倍镜下,小胶质细胞核周区和分枝过程中可见强烈的BIN1免疫反应性gydF4y2BaEmxgydF4y2BaCregydF4y2Ba-gydF4y2BaBin1gydF4y2BacKO老鼠和gydF4y2BaEmxgydF4y2BaCregydF4y2Ba同窝出生(无花果。gydF4y2Ba1gydF4y2BaC).为了将这一发现与人类小胶质细胞联系起来,我们以同样的方式对非患病人类的死后额叶皮层切片进行了免疫染色。在许多细胞的神经泌体和体细胞中观察到BIN1的免疫反应性,其中一些被鉴定为IBA1gydF4y2Ba+gydF4y2Ba小胶质细胞。与小鼠大脑小胶质细胞一样,BIN1定位于小胶质细胞的核周区域和人类大脑的过程(图。gydF4y2Ba1gydF4y2BaD).横过小胶质细胞体的直线扫描证实了两个通道的重叠和伴随的强度变化(图。gydF4y2Ba1gydF4y2BaE).总之,这些免疫组化研究明确证实了人类和小鼠大脑中的小胶质细胞BIN1的表达。gydF4y2Ba
小胶质细胞BIN1亚型的表征gydF4y2Ba
为了鉴定小胶质细胞BIN1亚型,我们检测了小鼠全脑匀浆和成年小鼠脑源性CD11b的裂解物免疫印迹gydF4y2Ba+gydF4y2BaCD45gydF4y2BaintgydF4y2BaFACS-purified小胶质细胞(gydF4y2Ba41gydF4y2Ba].根据前人对BIN1亚型的分析[gydF4y2Ba5gydF4y2Ba,gydF4y2Ba11gydF4y2Ba],小鼠脑均质印迹主要显示高分子量(~ 75-80 kDa)的BIN1亚型,代表含有CLAP结构域的亚型(以下简称BIN1:H),低分子量(~ 50-55 kDa)的亚型(以下简称BIN1:L)的检测水平较低(图1)。gydF4y2Ba1gydF4y2BaF)。相比之下,荧光激活细胞分选(FACS)分离的小胶质裂解物中的BIN1与BIN1:L相对应,几乎完全缺乏含CLAP结构域的亚型。在小胶质细胞中,在显性BIN1:H和BIN1:L异构体之间迁移的蛋白有明显的低水平表达。这些中等大小的蛋白质可能代表了BIN1:L亚型的翻译后修饰,或者可能是组成CLAP结构域的一个或多个外显子的低水平交替剪接。gydF4y2Ba
为了阐明gydF4y2BaBin1gydF4y2Ba对分离的小鼠脑源性小胶质细胞和小鼠大脑进行RT-PCR分析。一组跨越外显子6-10的反应结果表明,BAR结构域内的外显子7在小胶质细胞中被排除在外gydF4y2BaBin1gydF4y2Ba成绩单(无花果。gydF4y2Ba1gydF4y2BaG,左)。此外,骨骼肌特异性外显子11编码与磷酸肌苷结合的多碱基序列,对bin1诱导的膜管化至关重要[gydF4y2Ba52gydF4y2Ba,是拼接出来的gydF4y2BaBin1gydF4y2Ba成年小鼠大脑小胶质细胞和人诱导的ipscs衍生小胶质细胞的转录本(图SgydF4y2Ba2gydF4y2BaA).结合我们的免疫印迹数据,RT-PCR横跨外显子12-19的区域显示,小胶质细胞gydF4y2BaBin1gydF4y2Ba转录本主要排除与CLAP区域相对应的外显子13-16,在该区域有某种程度的选择性剪接(图。gydF4y2Ba1gydF4y2BaG,右)。正如预期的那样,在全脑RT-PCR中,包含和缺乏CLAP结构域的异构体均得到扩增。gydF4y2Ba1gydF4y2BaG)我们证实了我们的解释gydF4y2BaBin1gydF4y2Ba通过克隆小胶质细胞RT-PCR产物,并通过凝胶电泳(用于显性剪接模式)和/或测序(显性和非显性剪接模式)分析单个克隆的扩增区域,实现小胶质细胞的剪接。绝大多数克隆缺少外显子13-17 (Δ CLAP, Δ外显子17),约占90%gydF4y2BaBin1gydF4y2Ba转录本(亚型10),低频率包含外显子13和17(亚型6、12和9;无花果。gydF4y2Ba1gydF4y2BaH和SgydF4y2Ba2gydF4y2BaB)。gydF4y2Ba
为了将上述小鼠小胶质细胞的发现与人类表达联系起来,我们从人类诱导多能干细胞(iPSC)中生成了分化的小胶质样细胞(iMG) [gydF4y2Ba44gydF4y2Ba,gydF4y2Ba45gydF4y2Ba,gydF4y2Ba46gydF4y2Ba和提取的蛋白质裂解物。免疫印迹分析显示存在BIN1:L亚型,缺乏BIN1:H亚型,并存在一些中等大小的与BIN1相关的多肽。这些跨物种的研究表明,在人类ipsc衍生的小胶质细胞中表达的BIN1异构体的一般模式与在facs分离的成年小鼠大脑小胶质细胞中发现的BIN1异构体相似。gydF4y2Ba1gydF4y2BaF)。gydF4y2Ba
BIN1是原代小鼠小胶质细胞中促炎激活、细胞因子产生和神经变性相关基因表达的调节因子gydF4y2Ba
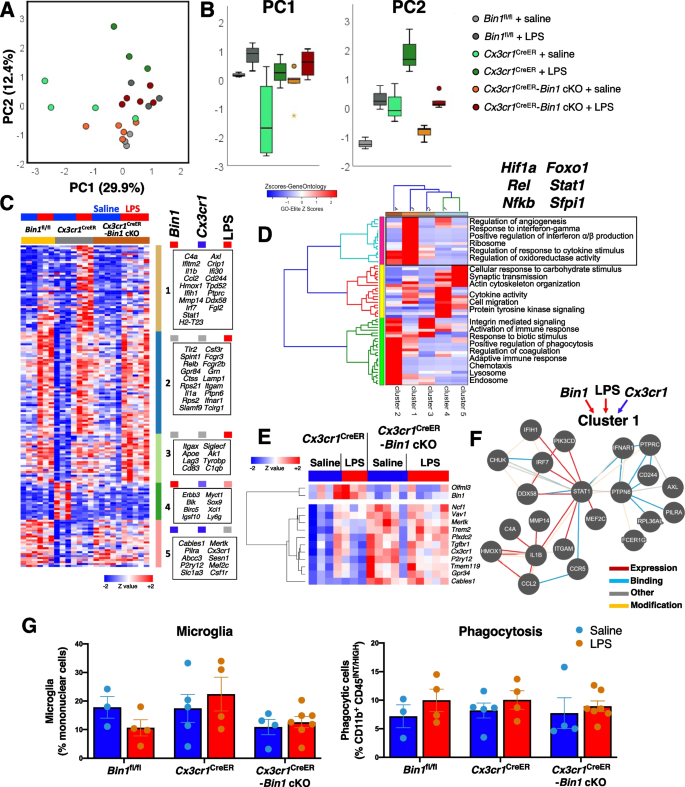
神经炎症和小胶质细胞激活是包括AD在内的几种神经退行性疾病的常见病理特征。培养的小胶质细胞在暴露于LPS (toll样受体激动剂)时启动强大的促炎反应,导致基因特征改变和促炎细胞因子(如IL1b、TNF和IL6)的释放,这与神经退行性疾病有关[gydF4y2Ba53gydF4y2Ba,gydF4y2Ba54gydF4y2Ba].为了研究小胶质细胞BIN1在调节体内平衡信号和炎症反应中的潜在作用,我们对培养的原代小胶质细胞进行了操作。小鼠出生后培养的小胶质细胞gydF4y2BaBin1gydF4y2BasiRNA(或伪siRNA)作用48小时,然后添加或不添加LPS (100 ng/ml)再作用24小时,评估其神经炎症谱(770-基因NanoString神经炎症基因组)[gydF4y2Ba31gydF4y2Ba,gydF4y2Ba48gydF4y2Ba,gydF4y2Ba55gydF4y2Ba].LPS刺激引起的gydF4y2BaBin1gydF4y2Ba成绩单(无花果。SgydF4y2Ba3.gydF4y2BaB)。gydF4y2BaBin1gydF4y2BasiRNA治疗大幅抑制gydF4y2BaBin1gydF4y2Ba转录水平(> 80%,图;gydF4y2Ba2gydF4y2BaA)不影响细胞活力或对LPS的形态响应(图SgydF4y2Ba3.gydF4y2BaA和数据未显示)。在最终分析的681个基因中(补充表1),513个基因在未调整水平上差异表达(ANOVA)gydF4y2BapgydF4y2Ba< 0.05),调整水平498个基因(FDR < 5%)。前两个主成分(pc)共同解释了数据集中71%的方差。PC1主要占gydF4y2BaBin1gydF4y2Ba敲除效应(KD)(42%的方差),这在很大程度上与LPS效应无关(图1)。gydF4y2Ba2gydF4y2Bac)。PC2解释了LPS效应(29%的方差),进一步表明,LPS效应在损失后减弱gydF4y2BaBin1gydF4y2Ba(无花果。gydF4y2Ba2gydF4y2Bac)。gydF4y2Ba
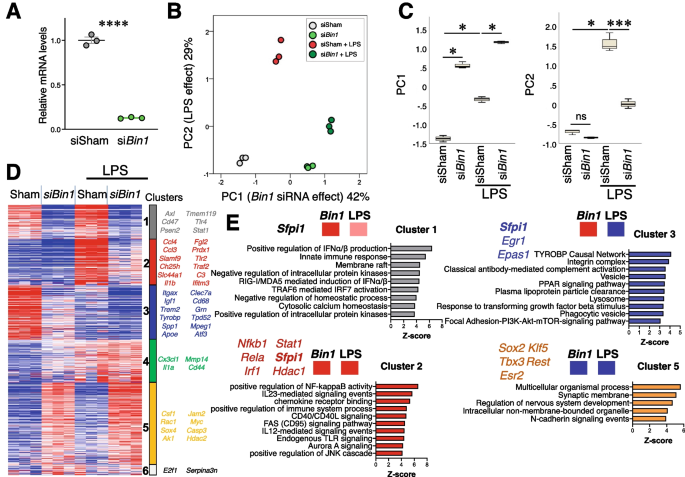
Bin1gydF4y2BaKD在原发性小胶质细胞中调节促炎和pu .1依赖基因异常。gydF4y2Ba一个gydF4y2BaqRT-PCR证实,转染Bin1 siRNA导致>的Bin1转录本减少80%。gydF4y2BaBgydF4y2BaPCA识别出两个pc,占数据集方差的71%。PC1捕获了Bin1丢失的效应(42%),而PC3捕获了LPS效应(29%)。在缺少Bin1的情况下,PC2显示的LPS效应减弱。gydF4y2BaCgydF4y2BaLPS刺激两种pc均增加。bin1kd使静息和lps刺激的小胶质细胞PC1显著增加;在LPS刺激过程中,Bin1 KD只降低了PC2 (*gydF4y2BapgydF4y2Ba< 0.05,* *gydF4y2BapgydF4y2Ba< 0.01,* * *gydF4y2BapgydF4y2Ba邓恩的< 0.001)。gydF4y2BaDgydF4y2BaK-means聚类鉴定出6个基因簇,其中5个在体外操作的基础上表现出不同的表达模式。集群1在稳态中受到BIN1的正调控,lps刺激的上调依赖于BIN1。在LPS刺激过程中,群集2受到BIN1的正调控,但其稳态调节不受BIN1的影响。簇3被BIN1正调控(在内稳态和LPS刺激期间),但在LPS刺激期间下调。群集5受BIN1负调控,LPS刺激不影响。Cluster 4不受BIN1调控,但在LPS刺激过程中上调(图中未显示)。gydF4y2BaEgydF4y2Ba基因本体论富集分析(包括GO、KEGG和Wikipathways)确定了主要的炎症和免疫(簇1和簇2)、内稳态小胶质细胞(簇3)和非小胶质细胞特异性(簇5)途径受原代小胶质细胞培养物体外操作的影响。每个簇预测的上游转录调控因子显示在图中,其中Sfpi1 (PU.1)在簇1、簇2和簇3中共享gydF4y2Ba
K-means聚类发现6组受影响基因,其中5组显示LPS和BIN1调控的不同模式(图1)。gydF4y2Ba2gydF4y2BaD).簇1,在静息和lps刺激条件下都被BIN1正调控,在基因中富集(包括gydF4y2BaSiglec1gydF4y2Ba,gydF4y2BaC3ar1gydF4y2Ba,gydF4y2BaFcgr1gydF4y2Ba,gydF4y2BaTmem119gydF4y2Ba)参与先天免疫反应、调节I型干扰素的产生和信号转导、脂质结合、抗原结合和膜筏定位(图。gydF4y2Ba2gydF4y2BaE和图SgydF4y2Ba4gydF4y2BaC)gydF4y2BaBin1gydF4y2Ba,证实效果gydF4y2BaBin1gydF4y2Ba核。簇2基因被LPS上调,被BIN1正调控,包括典型的促炎基因(包括gydF4y2BaIl1bgydF4y2Ba,gydF4y2Ba马可gydF4y2Ba,gydF4y2BaC3gydF4y2Ba,gydF4y2BaIrak3gydF4y2Ba),参与调节NF-κB信号、细胞因子产生和NLRP3炎症小体功能。簇3基因被LPS下调,被BIN1正调控,包括内稳态(gydF4y2BaCx3cr1gydF4y2Ba,gydF4y2BaGpr34gydF4y2Ba)和DAM基因(gydF4y2BaTrem2gydF4y2Ba,gydF4y2BaTyrobpgydF4y2Ba,gydF4y2BaSpp1gydF4y2Ba,gydF4y2BaApoegydF4y2Ba) [gydF4y2Ba25gydF4y2Ba与内溶酶体功能、脂质代谢、粘附和TGFβ信号通路有关(见图SgydF4y2Ba4gydF4y2BaE).簇4包含LPS上调但独立于BIN1的基因,参与泛素介导的蛋白水解、核糖体和表观遗传调控以及组蛋白甲基化,反映了LPS对小胶质细胞的深远影响。群集5基因通常表达水平较低,被BIN1负调控,不依赖于LPS刺激,包括参与突触传递的基因,通常在神经元中表达(见图SgydF4y2Ba4gydF4y2BaF)。gydF4y2Ba
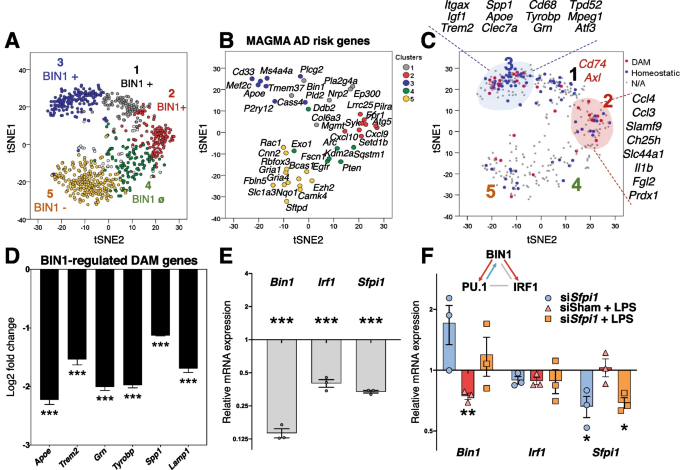
我们还使用t分布随机邻居嵌入(tSNE)分析可视化了我们的基因表达数据,以更好地展示由BIN1正调控的基因(与聚类1、2和3重叠)和由BIN1负调控的基因(聚类4和5),上述通过分层聚类分析确定(图4和5)。gydF4y2Ba3.gydF4y2BaA).在我们数据集的聚类3中,BIN1正向调节几个DAM基因(图。gydF4y2Ba3.gydF4y2BaC)先前通过AD病理小鼠模型中小胶质细胞的单细胞RNAseq识别[gydF4y2Ba25gydF4y2Ba].为了确定小胶质细胞bin1调节基因在AD病理中的意义,我们对AD相关遗传危险因素进行了MAGMA研究[gydF4y2Ba23gydF4y2Ba].这一分析揭示了与我们数据集的大量重叠。gydF4y2Ba3.gydF4y2BaB),表明有几个AD风险基因作用于小胶质细胞中BIN1的下游。有趣的是,在小胶质细胞中具有高内稳态表达的风险基因(gydF4y2BaApoegydF4y2Ba,gydF4y2BaTrem2gydF4y2Ba,gydF4y2BaCd33的gydF4y2Ba,gydF4y2BaMs4a4agydF4y2Ba)被BIN1正调控,而神经元AD风险基因(gydF4y2BaCnn2gydF4y2Ba而且gydF4y2BaGria1gydF4y2Ba)和自噬基因(gydF4y2BaSqstm1gydF4y2Ba)受BIN1负调控。为了验证BIN1在小胶质细胞中对DAM基因的调控,我们使用与NanoString研究相同的条件对初级小胶质细胞进行了qRT-PCR分析。我们证实了BIN1正调控几个选择的DAM基因,包括gydF4y2BaApoegydF4y2Ba,gydF4y2BaTrem2gydF4y2Ba,gydF4y2Ba入库单gydF4y2Ba,gydF4y2BaTyrobpgydF4y2Ba,gydF4y2BaSpp1,gydF4y2Ba而且gydF4y2BaLamp1gydF4y2Ba(无花果。gydF4y2Ba3.gydF4y2BaD和图SgydF4y2Ba3.gydF4y2BaC)。gydF4y2Ba
基因的影响gydF4y2BaBin1gydF4y2BaKD在体外与AD和小胶质表型的调节有关。gydF4y2Ba一个gydF4y2Ba使用t-SNE对体外小胶质细胞转录组数据的可视化显示,基因簇被BIN1正向调节(簇1-3)或负向调节(簇5)。gydF4y2Ba2gydF4y2BaD为簇颜色参考。一个集群不受BIN1表达的影响(集群4)。gydF4y2BaBgydF4y2Baad相关风险基因的MAGMA与我们的数据集重叠,展示了每个集群中关键的ad相关基因,这些基因受小胶质BIN1的下游调控。gydF4y2BaCgydF4y2Ba严重疾病相关(DAM为红色)和内稳态小胶质细胞基因(蓝色)的调节异常gydF4y2BaBin1gydF4y2BaKD在原发性小胶质细胞。DAM和稳态分配基于已发表的文献[gydF4y2Ba25gydF4y2Ba].gydF4y2BaDgydF4y2BaqRT-PCR验证证实BIN1正向调控几个关键DAM基因,包括gydF4y2BaApoegydF4y2Ba,gydF4y2BaTrem2,gydF4y2Ba而且gydF4y2BaTyrobpgydF4y2Ba(例如,理气gydF4y2BaBin1gydF4y2BaKD) (*gydF4y2BapgydF4y2Ba< 0.05,* *gydF4y2BapgydF4y2Ba< 0.01,* * *gydF4y2BapgydF4y2Ba< 0.001,双尾t检验比较假siRNA与gydF4y2BaBin1gydF4y2BasiRNA条件,归一化为gydF4y2BaGapdhgydF4y2Ba,gydF4y2BangydF4y2Ba= 3 /条件)。gydF4y2BaEgydF4y2BaBin1gydF4y2BaKD导致小胶质表型的两个主转录调控因子下调-gydF4y2BaIrf1gydF4y2Ba而且gydF4y2BaSfpi1gydF4y2Ba(编码PU.1)。gydF4y2Ba(F)gydF4y2Ba图描述了q-PCR分析的相对变化gydF4y2BaBin1gydF4y2Ba,gydF4y2BaIrf1gydF4y2Ba,gydF4y2BaSfpi1gydF4y2Ba转录物的丰度与假siRNA条件相比。siRNA KD的gydF4y2BaSfpi1gydF4y2Ba证明了BIN1和pu1之间的相互依赖性gydF4y2Ba
通路分析发现重要的转录因子是bin1调控基因簇的潜在上游调控因子(图。gydF4y2Ba2gydF4y2BaE). PU.1 -小胶质发育和DAM转变的主要转录调控因子-被预测在簇1、簇2和簇3的上游。此外,已知Cluster 2基因受NF-κB、STAT1、IRF1和HDAC1调控。BIN1正向调控的DAM基因通路分析表明ATF3是上游调控因子。BIN1也有直接影响gydF4y2BaAtf3gydF4y2Ba这表明ATF3可能在BIN1控制DAM基因表达中起中介作用。最后,我们的体外qRT-PCR实验证明BIN1正调控转录gydF4y2BaSfpi1gydF4y2Ba(编码PU.1)和gydF4y2BaIrf1gydF4y2Ba(无花果。gydF4y2Ba3.gydF4y2BaE),这两种调节因子在稳态和炎症条件下控制大量小胶质细胞基因。有趣的是,我们还发现了PU.1和BIN1之间的相互关系(图1)。gydF4y2Ba3.gydF4y2BaF),为BIN1参与致病性信号失调增加了另一层复杂性。gydF4y2Ba
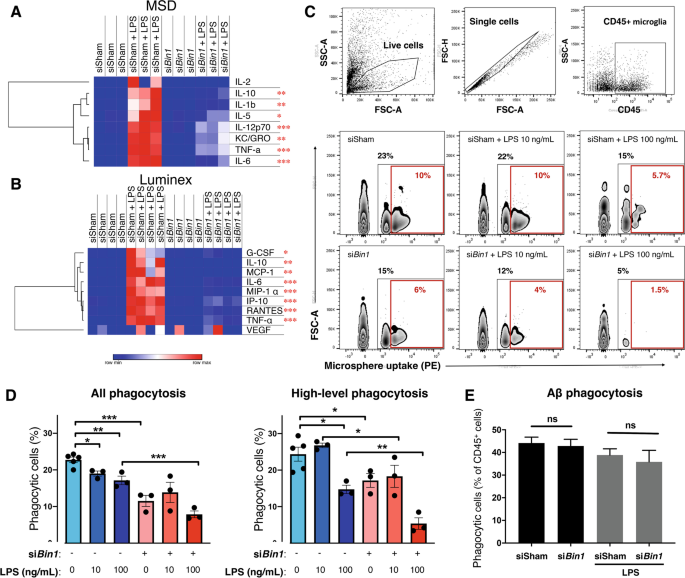
根据BIN1对细胞因子基因表达的转录调控(图。gydF4y2Ba2gydF4y2BaE无花果。SgydF4y2Ba4gydF4y2Ba,以及补充表S1和S2),我们试图在功能水平上证实这一观察结果。测定原代小胶质细胞的细胞因子分泌情况gydF4y2BaBin1gydF4y2BaKD和LPS暴露。在随后的基础条件下,我们没有发现细胞因子分泌的差异gydF4y2BaBin1gydF4y2BaKD;然而,的减少gydF4y2BaBin1gydF4y2Ba在两种不同的检测平台(MSD和Luminex;无花果。gydF4y2Ba4gydF4y2Baa - b)。我们的NanoString面板中包含的6种细胞因子的转录水平分析显示,其中5种(gydF4y2BaIl1bgydF4y2Ba,gydF4y2Ba肿瘤坏死因子gydF4y2Ba,gydF4y2BaCcl2gydF4y2Ba,gydF4y2BaCcl3gydF4y2Ba,gydF4y2BaCcl5gydF4y2Ba).更重要的功能是,由Cluster 3基因编码的几个蛋白质(gydF4y2BaTrem2gydF4y2Ba,gydF4y2BaTyrobpgydF4y2Ba,gydF4y2BaCd68gydF4y2Ba,gydF4y2BaApoegydF4y2Ba;见图。gydF4y2Ba3.gydF4y2BaC)调节小胶质细胞的吞噬作用。为了研究这些基因表达变化的功能意义,我们分析了原代小胶质细胞的吞噬能力gydF4y2BaBin1gydF4y2BaKD(无花果。gydF4y2Ba4gydF4y2Bac - d)。减少gydF4y2BaBin1gydF4y2Ba表达降低了荧光微球的吞噬能力,并增强了高剂量LPS暴露引起的损伤。然而,我们观察到没有影响gydF4y2BaBin1gydF4y2Ba初级小胶质细胞吞噬荧光Aβ能力的损失gydF4y2Ba42gydF4y2Ba原纤维(图gydF4y2Ba4gydF4y2BaE).总的来说,我们的体外研究表明,BIN1调节原代小鼠小胶质细胞中的促炎反应、几种神经退行性疾病相关基因的表达和细胞因子的产生。gydF4y2Ba
功能分析表明,在原代小胶质细胞培养中,BIN1促进炎症诱导细胞因子的产生,以及吞噬作用。gydF4y2Baa - bgydF4y2Ba在未受挑战的小胶质细胞培养中,Bin1 siRNA处理不影响细胞因子的分泌。LPS暴露增加了分泌,但被Bin1的KD减弱。gydF4y2Bac - dgydF4y2Ba荧光微球吞噬的流式细胞术分析发现,无论是未挑战的还是LPS刺激后,Bin1的减少都阻碍了原代小胶质细胞的吞噬能力。gydF4y2BaEgydF4y2BaAβ纤维的吞噬作用gydF4y2Ba42gydF4y2Ba不受Bin1沉默的影响。*,gydF4y2BapgydF4y2Ba< 0.05;**gydF4y2BapgydF4y2Ba< 0.01;* * *,gydF4y2BapgydF4y2Ba< 0.001;采用事后t检验和Bonferroni校正进行多次比较。吞噬数据绘制为平均值±SEMgydF4y2Ba
Microglia-specific消融的gydF4y2BaBin1gydF4y2Ba减轻体内lps介导的促炎激活和DAM基因表达谱gydF4y2Ba
考虑到培养条件和体内小胶质细胞表型的差异,我们继续研究小胶质细胞特异性的影响gydF4y2BaBin1gydF4y2Ba在体内平衡和炎症(系统性LPS)条件下小鼠大脑小胶质细胞转录组的缺失。我们使用了归纳条件gydF4y2BaBin1gydF4y2Ba交叉淘汰赛策略gydF4y2BaCx3cr1gydF4y2BaLitt tm2.1 (cre / ERT2)gydF4y2Ba/ WganJ [gydF4y2Ba56gydF4y2Ba这一系的杂合子动物被称为gydF4y2BaCx3cr1gydF4y2Ba克里尔gydF4y2Ba),gydF4y2BaBin1gydF4y2Bafl / flgydF4y2Ba老鼠。实验小组包括gydF4y2BaBin1gydF4y2Bafl / flgydF4y2Ba作为野生型的等价物,gydF4y2BaCx3cr1gydF4y2Ba克里尔gydF4y2Ba作为主要参照组(因为这些小鼠只有一种功能gydF4y2BaCx3cr1gydF4y2Ba等位基因),gydF4y2BaCx3cr1gydF4y2Ba克里尔gydF4y2Ba;gydF4y2BaBin1gydF4y2Bafl / flgydF4y2Ba(gydF4y2BaCx3cr1gydF4y2Ba克里尔gydF4y2Ba-gydF4y2BaBin1gydF4y2BacKO)为实验组。每天注射他莫西芬5天后,小鼠休息四周,以使外周血单核/巨噬细胞(也表达gydF4y2BaCx3cr1gydF4y2Ba).随后,连续4天给予LPS以诱导特征明确的促炎小胶质细胞反应[gydF4y2Ba57gydF4y2Ba,gydF4y2Ba58gydF4y2Ba],小鼠在末次注射24 h后安乐死(图。gydF4y2Ba5gydF4y2BaA).如预期的那样,LPS诱导了体温过低和体重减轻的疾病反应。有趣的是,我们观察到低温反应减弱的趋势gydF4y2BaBin1gydF4y2Ba没有影响体重减轻(图SgydF4y2Ba5gydF4y2Ba抵扣)。gydF4y2Ba
体内缺失gydF4y2BaBin1gydF4y2Ba影响CD11c表面表达。gydF4y2Ba一个gydF4y2Ba体内实验的实验策略涉及三组小鼠:Bin1gydF4y2Bafl / flgydF4y2Ba(WT当量),Cx3cr1gydF4y2Ba克里尔gydF4y2Ba(主要参考组),Cx3cr1gydF4y2Ba克里尔gydF4y2Ba-Bin1 cKO(实验组)。小鼠连续注射他莫西芬5天,然后休息4周,以补充外周血单核细胞中Bin1的表达。小鼠连续4天接受生理盐水或LPS,在最后一次注射24小时后采集大脑进行流式细胞仪/流式细胞仪、免疫组化和细胞因子测定。gydF4y2BaBgydF4y2Ba梨状皮层免疫荧光染色显示BIN1在正常表达(Cx3cr1)小鼠的小胶质细胞(黄色箭头)、少突胶质细胞(星号)和突触(未标记)中表达gydF4y2Ba克里尔gydF4y2Ba).实验小鼠小胶质细胞(Cx3cr1gydF4y2Ba克里尔gydF4y2Ba-Bin1 cKO),而少突胶质细胞和突触BIN1不受影响。gydF4y2BaCgydF4y2Ba小鼠脑细胞标记有APC-Cy7 α-CD11b、PE-Cy7 α-CD45和BV421 α-CD11c。单核、单核和活细胞被门控,小胶质细胞被分类为CD11bgydF4y2Ba+gydF4y2BaCD45gydF4y2BaINTgydF4y2Ba人口。gydF4y2BaDgydF4y2Ba每个实验组的代表性流式细胞图像被描绘出来。gydF4y2BaEgydF4y2Ba流式细胞术分析表明,LPS在体内给药可使所有基因型中CD11c表面高表达的细胞比例增加。Cx3cr1单倍不足(Cx3cr1gydF4y2Ba克里尔gydF4y2Ba);这种额外的增加被微胶质的Bin1缺失(Cx3cr1gydF4y2Ba克里尔gydF4y2Ba-Bin1 cKO)。双向方差分析发现基因型(FgydF4y2Ba2、17gydF4y2Ba= 32.98,gydF4y2BapgydF4y2Ba< 0.001)和LPS (FgydF4y2Ba1、17gydF4y2Ba= 100.9,gydF4y2BapgydF4y2Ba< 0.001)。存在显著的基因型*LPS相互作用(FgydF4y2Ba2、17gydF4y2Ba= 16.87,gydF4y2BapgydF4y2Ba< 0.001)。gydF4y2BaFgydF4y2BaNanoString mRNA计数显示LPS增加Itgax转录数(FgydF4y2Ba1、16gydF4y2Ba= 27.014,gydF4y2BapgydF4y2Ba< 0.001)。基因型间无差异(FgydF4y2Ba2、16gydF4y2Ba= 3.065,gydF4y2BapgydF4y2Ba= 0.075)和没有基因型*LPS相互作用(FgydF4y2Ba2、16gydF4y2Ba= 1.052,gydF4y2BapgydF4y2Ba= 0.372)。删除Bin1并没有减少Itgax转录数。gydF4y2BaGgydF4y2Ba对排序小胶质细胞mRNA的NanoString分析表明,我们的cKO系统导致了小胶质细胞Bin1表达约50%的下降(FgydF4y2Ba2、17gydF4y2Ba= 13.14,gydF4y2BapgydF4y2Ba< 0.001),不受LPS的影响(FgydF4y2Ba2、17gydF4y2Ba= 0.712,gydF4y2BapgydF4y2Ba= 0.505),尽管LPS增加Bin1转录本的主要作用(FgydF4y2Ba1、17gydF4y2Ba= 5.853,gydF4y2BapgydF4y2Ba= 0.027)。对Cx3cr1转录数的分析发现基因型(FgydF4y2Ba2、17gydF4y2Ba= 43.802,gydF4y2BapgydF4y2Ba< 0.001), Bin1之间存在事后差异gydF4y2Bafl / flgydF4y2Ba和Cx3cr1gydF4y2Ba克里尔gydF4y2Ba(gydF4y2BapgydF4y2BaBin1 < 0.001)gydF4y2Bafl / flgydF4y2Ba和Cx3cr1gydF4y2Ba克里尔gydF4y2Ba-Bin1 cKO (gydF4y2BapgydF4y2Ba< 0.001), Cx3cr1gydF4y2Ba克里尔gydF4y2Ba和Cx3cr1gydF4y2Ba克里尔gydF4y2Ba-Bin1 cKO (gydF4y2BapgydF4y2Ba= 0.043)表明Cre系中Cx3cr1表达的减少因Bin1的缺失而部分减弱。LPS治疗无主要效果(FgydF4y2Ba1、17gydF4y2Ba= 0.303,gydF4y2BapgydF4y2Ba= 0.589)和没有基因型*LPS相互作用(FgydF4y2Ba2、17gydF4y2Ba= 0.515,gydF4y2BapgydF4y2Ba= 0.606)。都是通过双向方差分析。*,gydF4y2BapgydF4y2Ba< 0.05;**gydF4y2BapgydF4y2Ba< 0.01;* * *,gydF4y2BapgydF4y2Ba< 0.001;采用事后t检验和Bonferroni校正进行多次比较。所有数据标为平均值gydF4y2Ba±gydF4y2Ba扫描电镜gydF4y2Ba
LPS给药未引起显著变化gydF4y2BaBin1gydF4y2Ba通过NanoString分析定量了facs分离的脑小胶质细胞的表达(图SgydF4y2Ba5gydF4y2BaG),并且没有变化gydF4y2BaBin1gydF4y2BaRT-PCR检测剪接情况(图5。gydF4y2Ba1gydF4y2BaG,年代gydF4y2Ba2gydF4y2Ba,年代gydF4y2Ba5gydF4y2BaH).通过免疫荧光染色,我们证实了IBA1中BIN1的表达gydF4y2Ba+gydF4y2Ba小胶质细胞的gydF4y2BaCx3cr1gydF4y2Ba克里尔gydF4y2Ba但不是gydF4y2BaCx3cr1gydF4y2Ba克里尔gydF4y2Ba-gydF4y2BaBin1gydF4y2BacKO老鼠(图。gydF4y2Ba5gydF4y2BaB).而LPS给药诱导WT的形态转变为阿米巴样表型(gydF4y2BaBin1gydF4y2Bafl / flgydF4y2Ba小神经胶质细胞,gydF4y2BaCx3cr1gydF4y2Ba单倍不足的小胶质细胞在LPS作用下表现出高度分枝的形态(图SgydF4y2Ba6gydF4y2BaA)。引人注目的是,gydF4y2BaCx3cr1gydF4y2Ba克里尔gydF4y2Ba-gydF4y2BaBin1gydF4y2BacKO小胶质细胞似乎完全保留了静息形态(图SgydF4y2Ba6gydF4y2BaA),表明对炎症反应的功能性无能。然而,小胶质形态的关键参数没有受到显著影响,表明这些异质细胞的形态响应高度变化,在大脑区域之间有显著差异(图SgydF4y2Ba6gydF4y2Bac)。免疫荧光组织学染色显示,LPS给药似乎不影响BIN1在小胶质细胞中的表达或定位gydF4y2BaBin1gydF4y2Bafl / flgydF4y2Ba小鼠大脑(图SgydF4y2Ba5gydF4y2BaF)。gydF4y2Ba
用流式细胞术检测脑单个核细胞表面CD11b、CD45、CD11c、Ly6c的表达。CD11bgydF4y2Ba+gydF4y2BaCD45gydF4y2BaintgydF4y2Ba小胶质细胞经facs纯化后进行NanoString转录组学分析(图。gydF4y2Ba5gydF4y2Ba基于Iba1免疫荧光染色和流式细胞术研究,我们观察到不同基因型的小胶质细胞密度或数量没有差异(图S . CgydF4y2Ba6gydF4y2BaA和数据未显示)。在CD11bgydF4y2Ba+gydF4y2BaCD45gydF4y2BaintgydF4y2Ba小胶质细胞中CD11c的比例明显增加gydF4y2Ba+gydF4y2BaLPS治疗后小胶质细胞明显减少gydF4y2BaCx3cr1gydF4y2Ba克里尔gydF4y2Ba老鼠(图。gydF4y2Ba5gydF4y2BaD和E),可能归因于gydF4y2BaCx3cr1gydF4y2Bahaploinsufficiency。相比gydF4y2BaCx3cr1gydF4y2Ba克里尔gydF4y2Ba老鼠,额外的损失gydF4y2BaBin1gydF4y2Ba(gydF4y2BaCx3cr1gydF4y2Ba克里尔gydF4y2Ba-gydF4y2BaBin1gydF4y2BacKO)消除了这种LPS效应(图。gydF4y2Ba5gydF4y2BaD和E)。因此,高水平的表面CD11c表达,微胶质激活的特征和DAM表型的特征[gydF4y2Ba21gydF4y2Ba,gydF4y2Ba25gydF4y2Ba,gydF4y2Ba59gydF4y2Ba](其中若干基因在LPS暴露后上调[gydF4y2Ba60gydF4y2Ba]),在lps诱导的神经炎症模型中的小胶质细胞中变得明显,并似乎被CX3CR1信号调节。综上所述,这些发现表明BIN1正向调节小胶质细胞表面CD11c水平,并可能控制全身LPS给药后DAM表型的诱导。gydF4y2Ba
然后从facs纯化的小胶质细胞中分析511个转录本的炎症基因表达数据(补充表S3)。小胶质细胞分离gydF4y2BaCx3cr1gydF4y2Ba克里尔gydF4y2Ba-gydF4y2BaBin1gydF4y2BacKO动物的低约50%gydF4y2BaBin1gydF4y2Ba水平比gydF4y2BaCx3cr1gydF4y2Ba克里尔gydF4y2Ba控制(图。gydF4y2Ba5gydF4y2BaG).效率gydF4y2BaBin1gydF4y2Ba损失在性别和lps处理之间没有差异(数据未显示。gydF4y2Ba5gydF4y2BaG).不出所料,小胶质细胞来自gydF4y2BaCx3cr1gydF4y2Ba克里尔gydF4y2Ba老鼠低gydF4y2BaCx3cr1gydF4y2Ba表达,展示了gydF4y2BaCx3cr1gydF4y2Ba该小鼠系的单倍不足(图。gydF4y2Ba5gydF4y2BaG). PCA显示,两个pc解释了数据中43%的方差(PC1 29.9%, PC2 12.4%)。gydF4y2Ba6gydF4y2BaA). PC1捕获的LPS效应在所有三种基因型中都相对相似。PC2捕获的LPS反应被修饰gydF4y2BaCx3cr1gydF4y2Ba基因型和gydF4y2BaBin1gydF4y2Ba删除。在基线,gydF4y2BaCx3cr1gydF4y2Ba克里尔gydF4y2Ba与WT相比,小鼠表现出更高的激活水平(gydF4y2BaBin1gydF4y2Bafl / flgydF4y2Ba老鼠)。PC2捕获的LPS反应在gydF4y2BaCx3cr1gydF4y2Ba克里尔gydF4y2Ba与之前的描述一致,即通过CX3CR1信号通路控制小胶质细胞激活[gydF4y2Ba61gydF4y2Ba].有趣的是,损失gydF4y2BaBin1gydF4y2Ba减轻了LPS引起的应激反应gydF4y2BaCx3cr1gydF4y2Bahaploinsufficiency。这些高水平的转录组学结果与我们的流式细胞术结果一致,表明在炎症期间,CD11cgydF4y2Ba+gydF4y2BaDAM表型由BIN1促进。gydF4y2Ba
在体内小胶质细胞特异性的丧失gydF4y2BaBin1gydF4y2Ba抑制促炎小胶质细胞反应。gydF4y2Ba一个gydF4y2Ba活体facs纯化小鼠脑小胶质细胞基因表达数据的PCA分析gydF4y2BaBin1gydF4y2BacKO研究发现两台pc占数据方差的42%。gydF4y2BaBgydF4y2BaPC1 (LPS的影响与基因型无关)解释了29.9%的方差,PC2 (LPS的影响受基因型影响)解释了12.4%的方差gydF4y2BaBin1gydF4y2BacKO通过Cx3cr1单倍不足缓解调控失调。gydF4y2BaCgydF4y2Ba在我们的数据集中,k -均值聚类确定了五个受影响的基因簇。簇1基因在LPS刺激过程中上调,依赖于BIN1。簇2受LPS刺激上调,受BIN1正调控(受LPS刺激下调)gydF4y2BaBin1gydF4y2BacKO)。Cluster 3被LPS上调,而不依赖于BIN1。在非刺激条件下,簇4被LPS下调,而被BIN1正调控。簇5基因被BIN1负调控,与CX3CR1相反。gydF4y2BaDgydF4y2Ba基因本体富集分析确定了由cluster 1基因调控的干扰素反应通路。gydF4y2BaEgydF4y2BaBIN1抑制了13个小胶质基因的表达gydF4y2BaBin1gydF4y2BacKO)独立于LPS炎症,包括内稳态基因gydF4y2BaP2ry12gydF4y2Ba,gydF4y2BaTmem119,gydF4y2Ba而且gydF4y2BaTgfbr1gydF4y2Ba.gydF4y2BaFgydF4y2Ba通路分析表明STAT1信号通路可能调节簇1基因的表达(基因间相互作用的性质根据关键字中的配色方案显示)。gydF4y2BaGgydF4y2Ba小胶质细胞数量分析发现基因型(FgydF4y2Ba2、21gydF4y2Ba= 2.614,gydF4y2BapgydF4y2Ba= 0.097), LPS处理(FgydF4y2Ba1、21gydF4y2Ba= 0.002,gydF4y2BapgydF4y2Ba= 0.966),或无基因型*LPS相互作用(FgydF4y2Ba2、21gydF4y2Ba= 1.192,gydF4y2BapgydF4y2Ba= 0.323)(通过双向方差分析)。吞噬能力不受LPS的影响(FgydF4y2Ba1、21gydF4y2Ba= 1.939,gydF4y2BapgydF4y2Ba= 0.178)或基因型(FgydF4y2Ba2、21gydF4y2Ba= 0.121,gydF4y2BapgydF4y2Ba= 0.887)gydF4y2BaBin1gydF4y2BacKO研究未发现基因型*LPS相互作用(FgydF4y2Ba2、21gydF4y2Ba= 0.101,gydF4y2BapgydF4y2Ba= 0.904)(双向方差分析)。以平均值表示的数据gydF4y2Ba±gydF4y2Ba扫描电镜。相关生理数据和免疫组化数据见图SgydF4y2Ba5gydF4y2BaB-FgydF4y2Ba
在511个纳入分析的基因中,164个基因表现出群体差异表达(ANOVA)gydF4y2BapgydF4y2Ba< 0.05,补充表S3)。这些差异表达基因的K-means聚类鉴定出5个具有不同表达模式的聚类(图。gydF4y2Ba6gydF4y2BaC).簇1,包含促炎基因(包括gydF4y2BaC4agydF4y2Ba,gydF4y2BaIl1bgydF4y2Ba,gydF4y2BaCcl2gydF4y2Ba,gydF4y2BaIrf7gydF4y2Ba,gydF4y2BaStat1gydF4y2Ba),在LPS后上调,而损失gydF4y2BaBin1gydF4y2Ba抑制这种反应。因此,群集1基因在促炎条件下被BIN1特异正调控,证实了上述体外表型gydF4y2BaBin1gydF4y2BasiRNA KD。簇2基因在所有基因型中都表现出了一致的LPS效应,其中包括一些已知被LPS上调的典型促炎基因(例如,gydF4y2BaTlr2gydF4y2Ba,gydF4y2BaIl1agydF4y2Ba,gydF4y2BaFcgr3gydF4y2Ba),以及gydF4y2BaApoegydF4y2Baε4等位基因变异是LOAD风险的最高预测因子[gydF4y2Ba62gydF4y2Ba].簇3基因表现出与簇2相似的模式,没有明显的BIN1依赖性,并被包括在内gydF4y2BaItgaxgydF4y2Ba(编码CD11c),gydF4y2BaTyrobpgydF4y2Ba,gydF4y2BaRpl9gydF4y2Ba.而增加gydF4y2BaItgaxgydF4y2BaLPS表达与流式细胞仪检测的CD11c增加结果一致gydF4y2Ba+gydF4y2Balps处理小鼠的小胶质细胞(图。gydF4y2Ba5gydF4y2BaD和E),不减弱的表达gydF4y2BaItgaxgydF4y2Ba后gydF4y2BaBin1gydF4y2Ba尽管CD11c减少,但仍然存在缺失gydF4y2Ba+gydF4y2Ba小胶质细胞的研究结果令人惊讶。gydF4y2Ba5gydF4y2BaF).这一发现表明,CD11c表达的转录后或翻译后控制或表面定位需要BIN1功能。簇4基因被LPS抑制,并随着LPS的增加而改善gydF4y2BaBin1gydF4y2Ba缺失,表明炎症期间BIN1正调控。簇5包含BIN1和CX3CR1均负调控的基因,与LPS处理无关。图S总结了聚类水平上基因表达变化的总体轨迹gydF4y2Ba7gydF4y2Baa - b。此外,我们还鉴定了13个基因(包括gydF4y2BaOlfml3gydF4y2Ba,gydF4y2BaTmem119gydF4y2Ba,gydF4y2BaMertkgydF4y2Ba,gydF4y2BaTrem2,gydF4y2Ba而且gydF4y2BaP2ry12gydF4y2Ba)由独立于状态的BIN1调节(图。gydF4y2Ba6gydF4y2BaE)。gydF4y2Ba
Cluster 1基因的基因集富集分析表明I型干扰素(α/β)的表达和产生具有正调控作用(图1)。gydF4y2Ba6gydF4y2BaD).此外,bin1调控的Cluster 1在核糖体基因中富集(gydF4y2BaRpl28gydF4y2Ba,gydF4y2BaRpl29gydF4y2Ba,gydF4y2BaRps10gydF4y2Ba,gydF4y2BaRps9gydF4y2Ba)、细胞因子和对IFNγ基因的响应(gydF4y2BaIl1bgydF4y2Ba,gydF4y2BaCcl2gydF4y2Ba,gydF4y2BaCcl5gydF4y2Ba,gydF4y2BaStat1gydF4y2Ba),以及调节氧化还原酶活性(gydF4y2BaApoegydF4y2Ba,gydF4y2BaIl1bgydF4y2Ba,gydF4y2BaSlamf8gydF4y2Ba).33个lps上调的基因被抑制至少1.5倍gydF4y2BaBin1gydF4y2Ba删除。这些基因及其编码蛋白之间已知相互作用的分析如图所示。gydF4y2Ba6gydF4y2BaF。gydF4y2Ba
总之,我们的体内研究表明BIN1有一定的抵消作用gydF4y2BaCx3cr1gydF4y2Bahaploinsufficiency。CX3CR1信号的丢失已被证明会增加荧光微球的吞噬作用[gydF4y2Ba63gydF4y2Ba].因此,我们设法把损失联系起来gydF4y2BaBin1gydF4y2Ba在具有小胶质细胞功能的小胶质细胞中,重点研究它们吞噬荧光微球的能力[gydF4y2Ba50gydF4y2Ba,询问是否额外损失gydF4y2BaBin1gydF4y2Ba是否足以逆转gydF4y2BaCx3cr1gydF4y2Bahaploinsufficiency。然而,我们发现两者都不是gydF4y2BaCx3cr1gydF4y2Ba单倍体不足或小胶质缺失gydF4y2BaBin1gydF4y2Ba在本研究所采用的实验条件下,对吞噬作用没有任何影响,LPS也没有影响这种细胞功能(图1)。gydF4y2Ba6gydF4y2BaG).缺乏任何观察到的facs分选小胶质细胞的影响gydF4y2BaBin1gydF4y2Ba对吞噬作用的影响与在培养的小胶质细胞中观察到的适度影响是一致的gydF4y2BaBin1gydF4y2BasiRNA KD。gydF4y2Ba
我们还通过Luminex(32细胞因子面板)测量了所有实验小鼠的脑匀浆(取自额叶皮层)中的炎症细胞因子水平(图SgydF4y2Ba7gydF4y2BaC). LPS增加了所有基因型的eotaxin、MIG和IP-10水平,而对gydF4y2BaBin1gydF4y2Ba的损失。然而gydF4y2BaBin1gydF4y2Ba在未受刺激组和lps刺激组中无显著性差异,我们观察到整体效应gydF4y2BaBin1gydF4y2Ba与LPS治疗无关。相比gydF4y2BaCx3cr1gydF4y2Ba克里尔gydF4y2Ba老鼠,gydF4y2BaCx3cr1gydF4y2Ba克里尔gydF4y2Ba-gydF4y2BaBin1gydF4y2BacKO小鼠IFNγ水平较高(gydF4y2BapgydF4y2Ba= 0.017), il4 (gydF4y2BapgydF4y2Ba= 0.026)和IL7 (gydF4y2BapgydF4y2Ba= 0.014)。gydF4y2Ba
BIN1可能通过影响1型干扰素信号传导来介导其在小胶质细胞中的转录组作用gydF4y2Ba
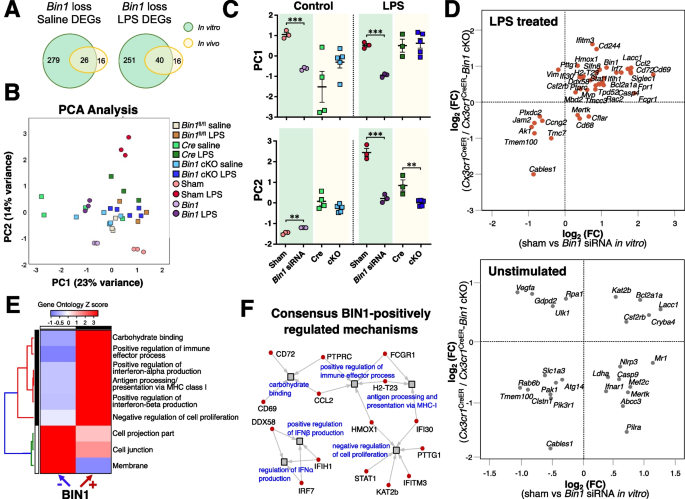
我们的体外研究显示gydF4y2BaBin1gydF4y2Ba微胶质基因表达和炎症细胞因子产生的损失。然而,出生后的小胶质细胞不能完全重现成人的小胶质细胞反应[gydF4y2Ba64gydF4y2Ba].虽然我们的体内实验克服了这些体外研究的局限性,但其效果gydF4y2BaCx3cr1gydF4y2Ba单倍体不足使体内小胶质细胞选择性的解释复杂化gydF4y2BaBin1gydF4y2Ba删除。尽管存在这些局限性,我们从体外和体内研究中观察到bin1介导的基因调控的基因本体论和模式有显著重叠。为了从我们的体外和体内数据中确定最可靠和一致的发现,我们对来自这两组实验的NanoString数据集进行了联合分析。在这两个数据集中,498个表达高于阈值的基因被纳入分析。维恩图显示了在体外和体内数据集中,在基础和lps刺激条件下共享的DEGs的数量。gydF4y2Ba7gydF4y2BaA).对这些共享基因集的PCA显示,LPS刺激后小胶质细胞中LPS诱导的转录组变化受到抑制是LPS降低后的共同特征gydF4y2BaBin1gydF4y2Ba表达式(无花果。gydF4y2Ba7gydF4y2BaB和C)。在非刺激条件下(假siRNA vs。gydF4y2BaBin1gydF4y2Ba体外siRNA,和gydF4y2BaCx3cr1gydF4y2Ba克里尔gydF4y2Bavs。gydF4y2BaCx3cr1gydF4y2Ba克里尔gydF4y2Ba-gydF4y2BaBin1gydF4y2BacKO小胶质细胞的体内研究,都没有LPS处理),我们观察到很少协调的基因调节gydF4y2BaBin1gydF4y2Ba在两个数据集中(图。gydF4y2Ba7gydF4y2BaD)。然而,在LPS刺激条件下(假siRNA+LPS vs。gydF4y2BaBin1gydF4y2BasiRNA+LPS体外,和gydF4y2BaCx3cr1gydF4y2Ba克里尔gydF4y2Ba+ LPS vs。gydF4y2BaCx3cr1gydF4y2Ba克里尔gydF4y2Ba-gydF4y2BaBin1gydF4y2BacKO + LPS小胶质细胞的体内研究),我们观察到两个模型系统之间有更大的一致性(图。gydF4y2Ba7gydF4y2BaD).我们将这些bin1调控基因的和谐列表(31个基因正调控包括gydF4y2BaCd69gydF4y2Ba,gydF4y2BaCcl2gydF4y2Ba,gydF4y2BaIrf7gydF4y2Ba,gydF4y2BaIfitm3gydF4y2Ba;13个基因负调控包括gydF4y2BaCables1gydF4y2Ba而且gydF4y2BaTmem100gydF4y2Ba),并进行氧化石墨烯富集分析,以确定小胶质细胞中bin1调节的本体。BIN1被发现是碳水化合物结合、I型干扰素和免疫途径、通过MHC-I抗原呈递的正向调节因子,以及细胞增殖的负向调节因子。BIN1还负调控位于细胞投射、细胞连接和细胞膜上的基因(图。gydF4y2Ba7gydF4y2BaE).包括参与I型干扰素信号传导的特定bin1调节基因gydF4y2BaDdx58gydF4y2Ba,gydF4y2BaIfih1gydF4y2Ba,gydF4y2BaIrf7gydF4y2Ba,gydF4y2BaIfi30,gydF4y2Ba而且gydF4y2BaIfitm3gydF4y2Ba(无花果。gydF4y2Ba7gydF4y2BaF)。gydF4y2Ba
体外和体内NanoString数据集的一致性分析揭示了BIN1调控小胶质基因的共同模式。gydF4y2Ba一个gydF4y2Ba维恩图说明了在基础和lps刺激条件下体外和体内数据集中重叠的DEGs。gydF4y2BaBgydF4y2Ba主成分分析显示两个主成分占合并数据集方差的37%。gydF4y2BaCgydF4y2BaPCA结果显示了体外和体内系统之间的异同。gydF4y2BaDgydF4y2Ba从未受刺激的小胶质细胞中可以看到体外和体内数据集之间的低一致性,而lps刺激的细胞在我们的模型系统之间的基因表达显示出更高的一致性。gydF4y2BaE-FgydF4y2Ba对体外和体内数据集中协调调控的基因进行基因本体论分析,发现BIN1调控的干扰素和膜相关通路gydF4y2Ba
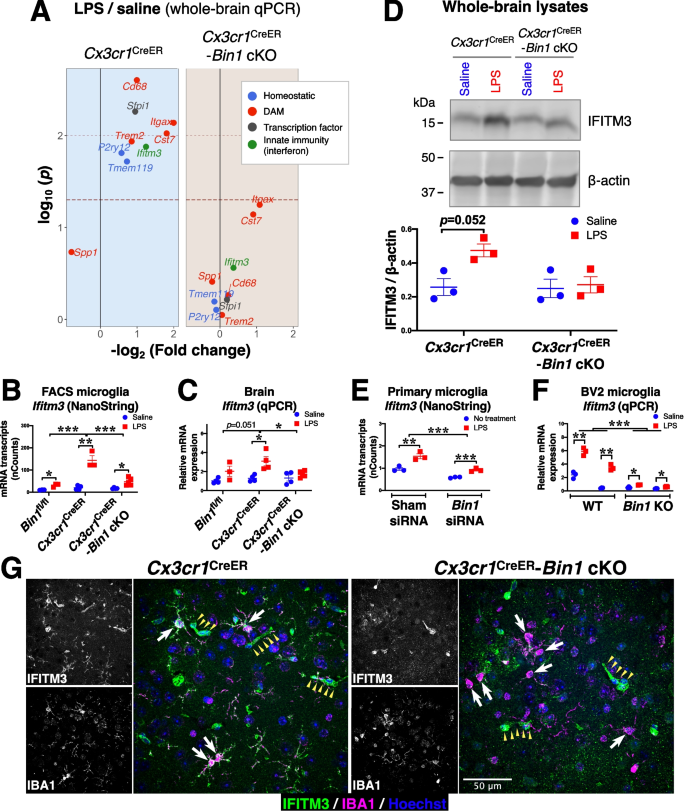
炎症的upregulationgydF4y2BaIfitm3gydF4y2Ba是否依赖于BIN1的表达gydF4y2Ba
鉴于…的深远影响gydF4y2BaBin1gydF4y2Ba在基因转录上的缺失,我们验证了在纳米串面板中识别的关键内稳态和DAM基因gydF4y2BaCst7gydF4y2Ba,一个DAM基因- qRT-PCR(图。gydF4y2Ba8gydF4y2BaA和图SgydF4y2Ba8gydF4y2Ba).我们还发现炎症性转录因子上调gydF4y2BaSfpi1gydF4y2Ba(通过网络分析识别)依赖于BIN1(图1)。gydF4y2Ba8gydF4y2BaA和图SgydF4y2Ba8gydF4y2Ba).基于其在胞浆和过程中的定位,我们推断,小胶质BIN1可能是一种胞浆适配器蛋白,在胞吞和循环的背景下调节受体动态,而不是转录调控因子。因此,我们试图确定BIN1是否通过1型干扰素通路调节信号。在我们的数据集中发现的一个关键基因是溶酶体相关限制因子gydF4y2Ba干扰素诱导跨膜蛋白3gydF4y2Ba(gydF4y2BaIfitm3gydF4y2Ba),其表达被I型和II型干扰素信号激活。为了验证我们从facs分离的小胶质细胞中获得的NanoString数据。gydF4y2Ba8gydF4y2Baa -b),我们对分离的全脑RNA进行了qRT-PCR分析gydF4y2BaCx3cr1gydF4y2Ba克里尔gydF4y2Ba而且gydF4y2BaCx3cr1gydF4y2Ba克里尔gydF4y2Ba-gydF4y2BaBin1gydF4y2BaLPS刺激(或盐水注射)后的cKO小鼠。我们发现了脂多糖诱导的gydF4y2BaIfitm3gydF4y2Ba记录在gydF4y2BaCx3cr1gydF4y2Ba克里尔gydF4y2Ba小鼠,明显减弱gydF4y2BaBin1gydF4y2Ba删除(图。gydF4y2Ba8gydF4y2Baa - c)。我们在全脑蛋白裂解物的免疫印迹分析中进一步验证了这一发现。gydF4y2Ba8gydF4y2BaD). NanoString分析定量培养的小胶质细胞转录水平证实gydF4y2BaIfitm3gydF4y2Ba上调调控被削弱了gydF4y2BaBin1gydF4y2Ba击倒在缺席gydF4y2BaCx3cr1gydF4y2Bahaploinsufficiency(无花果。gydF4y2Ba8gydF4y2BaE).为了进一步验证这一效果而不受gydF4y2BaCx3cr1gydF4y2Ba单倍体不足(体内)或不完全短暂gydF4y2BaBin1gydF4y2Ba还原(siRNA KD),我们产生稳定的池gydF4y2BaBin1gydF4y2Ba通过CRISPR/ cas9介导的基因编辑BV2细胞系中的KO小胶质细胞(图SgydF4y2Ba9gydF4y2Ba).gydF4y2BaBin1gydF4y2BaKO细胞明显钝化gydF4y2BaIfitm3gydF4y2Ba对LPS治疗的应答(图。gydF4y2Ba8gydF4y2BaF)。引人注目的是,用IFITM3抗体对小鼠大脑部分进行免疫荧光标记,显示IFITM3在整个小胶质体和分支中具有强烈的免疫反应性gydF4y2BaCx3cr1gydF4y2Ba克里尔gydF4y2Ba在缺乏BIN1表达的情况下,LPS介导的表达上调很少(如果有的话)。gydF4y2Ba8gydF4y2BaG)。gydF4y2Ba
lps诱导的小胶质细胞IFITM3上调依赖于BIN1。gydF4y2Ba一个gydF4y2Ba全脑cDNA qRT-PCR分析发现炎症诱导的关键内稳态和DAM基因的上调依赖于BIN1。关键髓样转录因子(Sfpi1)以及干扰素诱导的先天免疫基因(Ifitm3)的上调也依赖于bin1。原始数据集如图S所示gydF4y2Ba8gydF4y2Ba.gydF4y2BaBgydF4y2Ba对facs分离的小胶质细胞转录物的NanoString分析表明,体内LPS注射后Ifitm3表达上调。这种效应在Cx3cr1中得到了增强gydF4y2Ba克里尔gydF4y2Ba它依赖于BIN1。基因型(FgydF4y2Ba2、16gydF4y2Ba= 26.538,gydF4y2BapgydF4y2Ba< 0.001)和LPS治疗(FgydF4y2Ba1、16gydF4y2Ba= 66.105,gydF4y2BapgydF4y2Ba< 0.001),发现显著的基因型*LPS相互作用(FgydF4y2Ba2、16gydF4y2Ba= 20.609,gydF4y2BapgydF4y2Ba< 0.001)(通过双向方差分析)。事后配对比较发现Cx3cr1gydF4y2Ba克里尔gydF4y2Ba不同于Bin1gydF4y2Bafl / flgydF4y2Ba(gydF4y2BapgydF4y2Ba< 0.001)和Cx3cr1gydF4y2Ba克里尔gydF4y2Ba-Bin1 cKO (gydF4y2BapgydF4y2Ba< 0.001)(使用费雪的LSD)。gydF4y2BaCgydF4y2Ba全脑转录本的qRT-PCR分析证实了小胶质细胞的表达模式。LPS治疗的主要效果被发现(FgydF4y2Ba1, 18gydF4y2Ba= 17.497,gydF4y2BapgydF4y2Ba< 0.001),但基因型(FgydF4y2Ba2, 18gydF4y2Ba= 3.189,gydF4y2BapgydF4y2Ba= 0.065)和基因型*LPS相互作用(FgydF4y2Ba2, 18gydF4y2Ba= 2.734,gydF4y2BapgydF4y2Ba= 0.092)未达到显著性(双向方差分析)。尽管如此,事后两两比较发现了Cx3cr1gydF4y2Ba克里尔gydF4y2Ba与Cx3cr1不同gydF4y2Ba克里尔gydF4y2Ba-Bin1 cKO (gydF4y2BapgydF4y2Ba= 0.036)。然而,与Bin1的比较gydF4y2Bafl / flgydF4y2Ba基因型未达到显著性(gydF4y2BapgydF4y2Ba= 0.051)(加上费雪的LSD)。gydF4y2BaDgydF4y2Ba全脑裂解物的免疫印迹分析证实了转录调控导致类似IFITM3蛋白水平的变化。同时发现LPS治疗的主要效果(FgydF4y2Ba1, 8gydF4y2Ba= 6.156,gydF4y2BapgydF4y2Ba= 0.038),基因型(FgydF4y2Ba1, 8gydF4y2Ba= 4.788,gydF4y2BapgydF4y2Ba= 0.06)和基因型*LPS相互作用(FgydF4y2Ba1, 8gydF4y2Ba= 4.126,gydF4y2BapgydF4y2Ba= 0.077)在我们的数据中没有达到显著性(通过双向方差分析)。gydF4y2BaEgydF4y2BaNanoString分析原代培养的小胶质细胞转录物显示Ifitm3在bin1kd细胞中的表达钝化。siRNA治疗的主要效果(gydF4y2BaF1, 8gydF4y2Ba= 53.326,gydF4y2BapgydF4y2Ba< 0.001)和LPS (FgydF4y2Ba1, 8gydF4y2Ba= 43.226,gydF4y2BapgydF4y2Ba< 0.001)。siRNA与LPS无相互作用(FgydF4y2Ba1, 8gydF4y2Ba= 3.137,gydF4y2BapgydF4y2Ba= 0.115)。gydF4y2BaFgydF4y2Bacrispr编辑的BIN1 BV2 KO小胶质细胞证实,在BIN1 KO细胞中,Ifitm3对LPS刺激的响应受到了损害,主要影响是BIN1 (FgydF4y2Ba1、20gydF4y2Ba= 44.503,gydF4y2BapgydF4y2Ba< 0.001)和LPS (FgydF4y2Ba1、20gydF4y2Ba= 23.945,gydF4y2BapgydF4y2Ba< 0.001)和显著的Bin1*LPS相互作用(FgydF4y2Ba1、20gydF4y2Ba= 16.023,gydF4y2BapgydF4y2Ba< 0.001)。gydF4y2BaGgydF4y2Ba免疫荧光检测小鼠大脑中IFITM3,显示IFITM3在lps处理的Cx3cr1中表达gydF4y2Ba克里尔gydF4y2Ba但在Cx3cr1中没有gydF4y2Ba克里尔gydF4y2Ba-Bin1 cKO。注意,小胶质细胞用白色箭头表示,血管的IFITM3标记用黄色小箭头表示。*,gydF4y2BapgydF4y2Ba< 0.05;**gydF4y2BapgydF4y2Ba< 0.01;* * *,gydF4y2BapgydF4y2Ba< 0.001;采用事后t检验和Bonferroni校正进行多次比较。所有数据绘制为平均值±SEMgydF4y2Ba
总的来说,我们从小胶质细胞的转录组分析和实验验证研究中得到的一致发现表明,小胶质细胞BIN1正向调节DAM表型转化和1型干扰素网络的关键元素,这可能与体内外差异和体外差异无关gydF4y2BaCx3cr1gydF4y2Bahaploinsufficiency。gydF4y2Ba
讨论gydF4y2Ba
我们的研究首次证明,BIN1是小胶质基因表达和功能的关键调节因子,无论是在稳态还是炎症条件下。通过LPS刺激培养的小胶质细胞的转录分析,我们发现BIN1是促炎激活、细胞因子产生和神经变性相关基因表达的调节因子。通过分析从WT和cKO小鼠中分离的facs成年脑小胶质细胞,证实了体外实验结果,小胶质细胞BIN1在体内是lps介导的促炎激活和DAM基因表达的关键调控因子。gydF4y2Ba
BIN1在小胶质细胞转录组和蛋白质组学数据集中的高水平表达已有报道[gydF4y2Ba16gydF4y2Ba,gydF4y2Ba17gydF4y2Ba,gydF4y2Ba18gydF4y2Ba].然而,只有两篇关于BIN1与小胶质标记物细胞共定位的报道。在AD患者死后脑组织免疫组化分析中发现1个表达BIN1的iba1阳性细胞[gydF4y2Ba8gydF4y2Ba].另一项研究报告在CD45细胞核中检测到BIN1亚型12和6gydF4y2Ba+gydF4y2Ba使用针对BIN1外显子11和13的抗体产生的小胶质细胞;值得注意的是,在之前的研究中,免疫染色没有观察到缺少外显子11和13的主要小胶质BIN1亚型10 [gydF4y2Ba65gydF4y2Ba].在这方面,值得一提的是外显子11,它编码一个多碱基序列,与磷酸肌苷结合,对bin1诱导的膜管化至关重要[gydF4y2Ba66gydF4y2Ba,是拼接出来的gydF4y2BaBin1gydF4y2Ba成年小鼠大脑小胶质细胞和人诱导的ipscs衍生小胶质细胞的转录本(图SgydF4y2Ba2gydF4y2BaA).通过在兴奋性神经元和少突胶质细胞中生成缺乏BIN1表达的小鼠,我们明确证明了BIN1在小胶质细胞中的表达。BIN1亚型10在我们的研究中是最丰富的gydF4y2BaBin1gydF4y2Ba小鼠脑小胶质细胞转录本与人脑小胶质细胞RNAseq数据相一致,并归为BIN1亚型[gydF4y2Ba65gydF4y2Ba].然而,我们对BIN1定位于核周区和小胶质过程的论证与早前关于BIN1在小胶质核中的报道不一致[gydF4y2Ba65gydF4y2Ba].中BIN1的分析gydF4y2BaEmxgydF4y2BaCregydF4y2Ba-gydF4y2BaBin1gydF4y2Ba免疫染色(本研究)和免疫印迹法检测cKO小鼠[gydF4y2Ba5gydF4y2Ba的研究结果表明,在大脑中表达的所有BIN1中,微胶质BIN1只占很小的一部分。然而,值得注意的是,一项大规模的细胞类型特异性启动子-增强子相互作用研究在人类中发现了一种小胶质细胞特异性增强子gydF4y2BaBIN1gydF4y2Ba基因,含有ad风险变异rs6733839 [gydF4y2Ba67gydF4y2Ba].最近的一项研究预测了风险变异rs6733839,以促进转录因子MEF2C与gydF4y2BaBIN1gydF4y2Ba增强子在小胶质细胞中增多gydF4y2BaBIN1gydF4y2Ba表达式[gydF4y2Ba68gydF4y2Ba].因此,在BIN1的AD关联信号似乎是小胶质细胞类型特异性的。gydF4y2Ba
特定的BIN1亚型可能参与与膜动力学相关的不同功能,包括内吞作用。神经元BIN1调节突触囊泡释放[gydF4y2Ba5gydF4y2Ba]并通过调节致病性tau蛋白的内吞吸收来限制神经元间tau蛋白在培养神经元中的扩散[gydF4y2Ba10gydF4y2Ba].与神经元BIN1异构体相比,小鼠大脑小胶质细胞BIN1和人类ipscs衍生的小胶质细胞BIN1异构体缺少中央CLAP结构域,该区域位于BIN1及其同系物Amphiphysin 1之间,包含网格蛋白和AP2适配器结合位点[gydF4y2Ba69gydF4y2Ba].CLAP结构域对BIN1在网格蛋白介导的胞吞作用中起重要作用;然而,所有的微胶质BIN1异构体都有一个SH3结构域,该结构域可以与dynamin I的富含脯氨酸结构域相互作用[gydF4y2Ba70gydF4y2Ba].因此,不能仅根据CLAP结构域的缺失就排除小胶质细胞BIN1在细胞内吞作用中的作用。在非神经元细胞中,BIN1的缺失并不妨碍内吞作用对转铁蛋白的摄取,而是延迟内吞循环[gydF4y2Ba71gydF4y2Ba,gydF4y2Ba72gydF4y2Ba].我们发现BIN1表达的缺失对小胶质细胞的吞噬作用几乎没有影响,这与之前评估小胶质细胞吞噬作用的研究一致gydF4y2BaBin1gydF4y2BaKO巨噬细胞,发现BIN1在这些免疫调节细胞的内吞或吞噬中没有功能性作用[gydF4y2Ba71gydF4y2Ba].外显子13(在早期的出版物中称为外显子12A)和外显子17序列在小胶质细胞子集中被包含gydF4y2BaBin1gydF4y2Ba转录(尽管频率较低)可能与细胞周期调节有关。事实上,此前有报道称,外显子13的包含废除了BIN1与转录因子E2F1的结合,抑制了细胞周期的进展[gydF4y2Ba73gydF4y2Ba,gydF4y2Ba74gydF4y2Ba].此外,外显子13包含I类SH3结合基序(PxxP),可与BIN1自身的SH3结构域进行分子内相互作用,从而隔离其与cMYC的相互作用[gydF4y2Ba75gydF4y2Ba],也可能阻碍与其他SH3域依赖伙伴(如dynamin和tau)的相互作用。此外,外显子17编码了BIN1的一半c-MYC结合基序,调节c-MYC介导的转化和凋亡[gydF4y2Ba76gydF4y2Ba].单个BIN1亚型的小胶质细胞特异性功能,包括包含外显子13和17的次要亚型,为未来的功能研究提供了一个令人兴奋的领域。gydF4y2Ba
我们的神经炎症转录谱分析结果表明,BIN1是一种内稳态小胶质调节因子,在转录因子PU.1上游的免疫反应激活中具有非冗余作用,而PU.1对小胶质的生存能力至关重要[gydF4y2Ba77gydF4y2Ba].PU.1是小胶质细胞基因表达和向DAM表型过渡的主调控因子[gydF4y2Ba32gydF4y2Ba,gydF4y2Ba78gydF4y2Ba,gydF4y2Ba79gydF4y2Ba,gydF4y2Ba80gydF4y2Ba,gydF4y2Ba81gydF4y2Ba].此外,pu - 1调节多个ad相关小胶质基因的表达[gydF4y2Ba32gydF4y2Ba],髓系细胞中较低的PU.1表达已被报道可延迟AD的发生[gydF4y2Ba82gydF4y2Ba].重要的是,我们已经证明了BIN1的调节作用gydF4y2BaSfpi1gydF4y2Ba,编码为PU.1。有趣的是,我们在体外和体内一致发现BIN1不影响小胶质细胞的数量,这表明BIN1的功能对小胶质细胞的维持和存活可能不是必需的。总之,我们发现BIN1正向调节PU.1的转录可能表明BIN1的表达可能是小胶质细胞表型和病理结果的一个重要决定因素,特别是在AD中,这一假设值得未来的研究。gydF4y2Ba
我们的体内模型系统的一个局限性与内在有关gydF4y2BaCx3cr1gydF4y2Bahaploinsufficiency在gydF4y2BaCx3cr1gydF4y2Ba克里尔gydF4y2Ba已知其本身通过衰老的转录组表型的过早上调影响小胶质细胞,包括在AD病理中观察到的一些与疾病相关的小胶质细胞基因[gydF4y2Ba83gydF4y2Ba].两者之间的差异就是例证gydF4y2BaCx3cr1gydF4y2Ba克里尔gydF4y2Ba小鼠和WT等价物(gydF4y2BaBin1gydF4y2Bafl / flgydF4y2Ba)组。这种效果的gydF4y2BaCx3cr1gydF4y2Ba单倍体不足可能部分解释体外和体内效应之间缺乏一致性gydF4y2BaBin1gydF4y2Ba在我们的研究中观察到小胶质细胞的损失。体外培养的出生后原生小胶质细胞与大脑中原生状态的成年小胶质细胞之间的反应差异,以及LPS对体外小胶质细胞的直接作用和LPS对体内小胶质细胞的间接作用,可能也导致了体外和体内实验模式的差异。尽管存在这些差异,但我们观察到在两个模型系统中都有几个依赖于bin1的lps诱导的炎症基因和通路。gydF4y2Ba7gydF4y2Ba对我们体外和体内转录组研究结果的一致分析发现,BIN1在调节小胶质细胞中1型干扰素反应方面发挥了新的作用。我们发现在小胶质细胞中操纵BIN1会影响干扰素调节因子(IRFs)的表达。irf是一类转录调节蛋白,对病原体识别受体触发的信号事件作出反应,可转移到细胞核。然后,核易位的irf调节参与免疫反应和免疫细胞发育的不同基因组的表达。例如,IRF1、IRF5和IRF8在促炎反应中发挥重要作用[gydF4y2Ba84gydF4y2Ba,gydF4y2Ba85gydF4y2Ba,gydF4y2Ba86gydF4y2Ba,gydF4y2Ba87gydF4y2Ba,gydF4y2Ba88gydF4y2Ba],而IRF2和IRF4调节抗炎反应[gydF4y2Ba89gydF4y2Ba].IRF8是小胶质细胞运动的重要调节因子[gydF4y2Ba90gydF4y2Ba], IRF7和IRF8调节小胶质细胞内稳态和反应性[gydF4y2Ba87gydF4y2Ba,gydF4y2Ba91gydF4y2Ba].IRF7是干扰素依赖性免疫反应的主要信号调节因子[gydF4y2Ba92gydF4y2Ba].在AD淀粉样病变的多个小鼠模型中,神经炎症同时激活干扰素信号通路[gydF4y2Ba93gydF4y2Ba].此外,人脑中的IRF7表达与AD临床痴呆、Braak评分和神经淀粉样蛋白负担高度相关[gydF4y2Ba93gydF4y2Ba].在体外研究中,我们发现小胶质细胞中缺失BIN1会降低IRF1和IRF7基因的表达,而不影响IRF、IRF3、IRF4和IRF8的表达。在体内,小胶质细胞中BIN1的缺失抑制了全身LPS对IRF7的上调,与体外结果一致,提供了小胶质细胞中BIN1功能与1型干扰素信号之间的联系。gydF4y2Ba
我们的结果进一步表明gydF4y2BaIfitm3gydF4y2Ba-受I型干扰素以及促炎细胞因子刺激的基因之一,促炎细胞因子是宿主先天免疫反应的关键介质,包括IL-1b、IL-6和TNF [gydF4y2Ba35gydF4y2Ba] -在体内和体外均受到BIN1的正调控。最近的一篇论文发现,IFITM3基因网络在AD患者的tau缠结神经元和外周单个核细胞中丰富[gydF4y2Ba38gydF4y2Ba].IFITM3在AD淀粉样蛋白发病的转基因模型的小胶质细胞中表达也上调[gydF4y2Ba33gydF4y2Ba,gydF4y2Ba94gydF4y2Ba].此外,IFITM3在一个短暂的“干扰素响应”小胶质亚群中上调,该亚群在部分须状病变模型的皮质重映射过程中扩大。在这个小胶质细胞群体中,IFITM3定位于早期吞噬体,被发现是吞噬体成熟的必要条件[gydF4y2Ba94gydF4y2Ba].有趣的是,IFITM3是巨噬细胞溶酶体酸化所必需的[gydF4y2Ba34gydF4y2Ba,gydF4y2Ba35gydF4y2Ba].此外,与外周巨噬细胞(~pH值5)相比,内稳态小胶质细胞中的溶酶体呈弱酸性(~pH值6),炎症激活导致小胶质细胞溶酶体酸化,使其降解纤维Aβ [gydF4y2Ba95gydF4y2Ba].因此,研究IFITM3在小胶质溶酶体中的功能作用对于阐明BIN1调节的病理特异性细胞功能是必要的。gydF4y2Ba
至关重要的是,BIN1在体外和体内转录调控的几个基因都与AD的发病机制独立相关。特别是BIN1正调控ad相关关键基因的转录(包括gydF4y2BaApoegydF4y2Ba,gydF4y2BaTrem2gydF4y2Ba,gydF4y2BaTyropbgydF4y2Ba)在平衡条件下。BIN1和其他AD相关基因之间的这种调控相互作用说明了多病因性疾病的复杂性,以及确定与AD相关的整个病理谱系的特定遗传变异的挑战。然而,BIN1参与体内平衡和炎症特异性信号调节表明,BIN1可能作为小胶质激活状态的中央调节器,与介导DAM转录谱的万花筒有关。已知的BIN1在膜重塑和内吞运输中的功能与调节表型变化的广泛作用一致。事实上,我们的发现证明了这一点,BIN1调节CD11c的表面表达对LPS的响应,独立于gydF4y2BaItgaxgydF4y2Ba转录水平(从相同的facs分离细胞样本中测定)。阐明BIN1和小胶质表面受体在DAM转化中的潜在合作作用是未来研究的关键领域。然而,BIN1与表面受体的关系似乎比胞吞作用或核内体循环的单一功能更为复杂,如我们发现的CX3CR1失调。gydF4y2Ba
尽管由于失去一个功能而有一些限制gydF4y2BaCx3cr1gydF4y2Ba等位基因,通过利用gydF4y2BaCx3cr1gydF4y2BaCregydF4y2Ba驱动线,我们偶然发现BIN1抵消引起的变化gydF4y2BaCx3cr1gydF4y2Ba单倍不足,证明BIN1参与了另一个微胶质功能的中央调节。相比之下,gydF4y2BaBin1gydF4y2Bafl / flgydF4y2Ba老鼠正常gydF4y2BaCx3cr1gydF4y2Ba表达式,gydF4y2BaCx3cr1gydF4y2Ba克里尔gydF4y2Ba小鼠对全身LPS刺激表现出夸张的反应,与先前的观察一致[gydF4y2Ba96gydF4y2Ba].作为gydF4y2BaCx3cr1gydF4y2Ba在第I阶段DAM过渡期间被下调[gydF4y2Ba25gydF4y2Ba的小胶质细胞gydF4y2BaCx3cr1gydF4y2Ba克里尔gydF4y2Ba驱动线可能被引到DAM过渡。当gydF4y2BaBin1gydF4y2Ba被删除的gydF4y2BaCx3cr1gydF4y2Ba克里尔gydF4y2Ba小鼠,我们观察到衰减效应引起gydF4y2BaCx3cr1gydF4y2Bahaploinsufficiency。这一发现表明,BIN1可能是CX3CL1 (fractalkine)-CX3CR1信号轴中CX3CR1受体激活的中介因子。这一结论得到了小胶质细胞群数据的支持,该数据显示lps诱导的DAM CD11c显著增加gydF4y2Ba+gydF4y2Ba(CD11bgydF4y2Ba+gydF4y2BaCD45gydF4y2BaintgydF4y2Ba)gydF4y2BaCx3cr1gydF4y2Ba克里尔gydF4y2Ba小鼠,这是废除后的删除gydF4y2BaBin1gydF4y2Ba等位基因在小胶质细胞。我们的体内转录数据集显示gydF4y2BaBin1gydF4y2Ba以相反的方式调节基因转录gydF4y2BaCx3cr1gydF4y2Ba.正在进行的小胶质细胞特异性BIN1缺失的研究gydF4y2BaTmem119gydF4y2BaCre-ERT2gydF4y2Ba司机(gydF4y2Ba97gydF4y2Ba将有助于确定小胶质细胞BIN1是否具有保护淀粉样蛋白和tau蛋白聚集的功能。gydF4y2Ba
结论gydF4y2Ba
我们的研究表明,BIN1调节小胶质细胞炎症反应的关键元素。重要的是,小胶质细胞表型转变的关键特征,包括gydF4y2BaIfitm3gydF4y2Ba和CD11c的表面表达,都依赖于bin1。我们的结论是,BIN1的表达是小胶质细胞对中枢神经系统挑战做出适当反应的关键,而AD风险可能是通过小胶质细胞中BIN1功能的受损而产生的。gydF4y2Ba
数据和材料的可用性gydF4y2Ba
在这项研究中产生和分析的所有数据都包含在这篇发表的文章及其补充信息文件中。gydF4y2Ba
缩写gydF4y2Ba
- 一个β:gydF4y2Ba
-
-β淀粉样蛋白gydF4y2Ba
- 广告:gydF4y2Ba
-
阿尔茨海默病gydF4y2Ba
- 方差分析:gydF4y2Ba
-
方差分析gydF4y2Ba
- 栏:gydF4y2Ba
-
BIN / amphiphysin /旅游房车绑定gydF4y2Ba
- BIN1:gydF4y2Ba
-
桥接积分器1gydF4y2Ba
- cKO:gydF4y2Ba
-
条件敲除gydF4y2Ba
- 拍:gydF4y2Ba
-
网格蛋白相关蛋白结合区gydF4y2Ba
- 大坝:gydF4y2Ba
-
疾病有关的小胶质细胞gydF4y2Ba
- 流式细胞仪:gydF4y2Ba
-
Fluorescence-activated细胞分类gydF4y2Ba
- 罗斯福:gydF4y2Ba
-
错误发现率gydF4y2Ba
- iPSC:gydF4y2Ba
-
诱导多能干细胞gydF4y2Ba
- iMG:gydF4y2Ba
-
诱导microglial-like细胞gydF4y2Ba
- irf:gydF4y2Ba
-
干扰素调节因子gydF4y2Ba
- Iso:gydF4y2Ba
-
同种型gydF4y2Ba
- KD:gydF4y2Ba
-
可拆卸的gydF4y2Ba
- 负载:gydF4y2Ba
-
晚发性阿尔茨海默病gydF4y2Ba
- 有限合伙人:gydF4y2Ba
-
脂多糖gydF4y2Ba
- mac:gydF4y2Ba
-
Magnetic-activated细胞分类gydF4y2Ba
- 岩浆:gydF4y2Ba
-
基因组注释的多标记分析gydF4y2Ba
- PC:gydF4y2Ba
-
主成分gydF4y2Ba
- SH3:gydF4y2Ba
-
SRC同源3域gydF4y2Ba
- 核:gydF4y2Ba
-
小干扰RNAgydF4y2Ba
- tSNE:gydF4y2Ba
-
t分布随机近邻嵌入gydF4y2Ba
- WT:gydF4y2Ba
-
野生型gydF4y2Ba
参考文献gydF4y2Ba
Seshadri S, Fitzpatrick AL, Ikram MA, DeStefano AL, Gudnason V, Boada M,等。与阿尔茨海默病相关的遗传位点的全基因组分析。《美国医学协会杂志》上。2010;303:1832-40。gydF4y2Ba
Naj AC, Jun G, Beecham GW, Wang LS, Vardarajan BN, Buros J,等。MS4A4/MS4A6E、CD2AP、CD33和EPHA1的常见变异与晚发型阿尔茨海默病相关。Nat麝猫。2011;43:436-41。gydF4y2Ba
李建华,程瑞,Barral S, Reitz C, Medrano M, Lantigua R,等。阿尔茨海默病新基因座的鉴定及CLU、PICALM和BIN1在加勒比海西班牙裔个体中的复制拱神经。2011;68:320-8。gydF4y2Ba
Prokic I, Cowling BS, Laporte J. Amphiphysin 2 (BIN1)在生理学和疾病中的作用。中华分子医学杂志2014;92:453-63。gydF4y2Ba
De Rossi P, Nomura T, Andrew RJ, Masse NY, Sampathkumar V, Musial TF,等。神经元BIN1调节突触前神经递质释放和记忆巩固。细胞众议员2020;30 (3520 - 3535):e3527。gydF4y2Ba
Zabik MJ, Polin D, Underwood M, Wiggers P, Zabik ME。饲粮中添加50 ng/kg浓度的2,3,7,8-四氯二苯并对二恶英的雄性鸡的组织残留物。牛环境污染毒理学1998;61:664-8。gydF4y2Ba
Andrew RJ, De Rossi P, Nguyen P, Kowalski HR, rehado AJ, Guerbette T,等。迟发性阿尔茨海默病(AD)风险因子BIN1表达的减少并不影响AD小鼠模型中的淀粉样蛋白病理。生物化学杂志2019;294:4477-87。gydF4y2Ba
Chapuis J, Hansmannel F, Gistelinck M, Mounier A, Van Cauwenberghe C, Kolen KV,等。BIN1表达增加通过调节tau病理介导阿尔茨海默病遗传风险。摩尔精神病学。2013;18:1225-34。gydF4y2Ba
Voskobiynyk, Roth JR, Cochran JN, Rush T, Carullo NV, Mesina JS,等。阿尔茨海默病风险基因BIN1诱导tau依赖性网络过度兴奋。Elife。2020;9:e57354。gydF4y2Ba
Calafate S, Flavin W, Verstreken P, Moechars D. Bin1缺失促进tau病理的增殖。细胞众议员2016;17:931-40。gydF4y2Ba
De Rossi P, Buggia-Prevot V, Clayton BL, Vasquez JB, van Sanford C, Andrew RJ,等。成熟少突胶质细胞中与阿尔茨海默病相关的BIN1的主要表达及白质束定位。摩尔Neurodegener。2016;12。gydF4y2Ba
McKenzie AT, Moyon S, Wang M, Katsyv I, Song WM, Zhou X,等。少突胶质细胞的多尺度网络建模揭示了阿尔茨海默病中髓鞘失调的分子成分。摩尔Neurodegener。2017;12:82。gydF4y2Ba
霍勒CJ,戴维斯公关,贝克特TL,普拉特TL,韦伯RL, Head E,等。桥接积分器1 (BIN1)蛋白在阿尔茨海默病脑中的表达增加,并与神经纤维缠结病理相关。中华老年痴呆症杂志2014;42:1221-7。gydF4y2Ba
De Rossi P, Buggia-Prevot V, Andrew RJ, Krause SV, Woo E, Nelson PT,等。BIN1定位与阿尔茨海默病中的tau缠结不同。问题(意志)。2017年,0.19185 / matters.201611000018。gydF4y2Ba
Adams SL, Tilton K, Kozubek JA, Seshadri S, Delalle I.阿尔茨海默病病理进展中大脑皮层桥接积分器1蛋白表达的亚细胞变化。神经病理学杂志2016;75:779-790。gydF4y2Ba
张颖,陈凯,Sloan SA, Bennett ML, Scholze AR, O'Keeffe S,等。一个rna测序转录组和剪接数据库的神经胶质,神经元,和大脑皮层的血管细胞。J > 2014; 34:11929-47。gydF4y2Ba
Bennett ML, Bennett FC, Liddelow SA, Ajami B, Zamanian JL, Fernhoff NB,等。研究小鼠和人类中枢神经系统小胶质细胞的新工具。中国生物医学工程学报,2016;29(6):673 - 676。gydF4y2Ba
Zhang Y, Sloan SA, Clarke LE, Caneda C, Plaza CA, Blumenthal PD,等。纯化和鉴定的祖和成熟的人类星形胶质细胞揭示了转录和功能的差异与小鼠。神经元。2016;89:37-53。gydF4y2Ba
Butovsky O, Jedrychowski议员,Moore CS, Cialic R, Lanser AJ, Gabriely G,等。小胶质细胞中一个独特的tgf - β依赖分子和功能特征的鉴定。Nat > 2014; 17:131-43。gydF4y2Ba
Sharma K, Schmitt S, Bergner CG, Tyanova S, Kannaiyan N, Manrique-Hoyos N,等。细胞类型和大脑区域分辨小鼠大脑蛋白质组。Nat > 2015; 18:1819-31。gydF4y2Ba
Rangaraju S, Dammer EB, Raza SA, Rathakrishnan P, Xiao H, Gao T,等。阿尔茨海默病中疾病相关小胶质细胞的促炎亚群的鉴定和治疗调节摩尔Neurodegener。2018;十三24。gydF4y2Ba
Krasemann S, Madore C, Cialic R, Baufeld C, Calcagno N, El Fatimy R,等。TREM2-APOE通路驱动神经退行性疾病中功能障碍小胶质细胞的转录表型。免疫力。2017;47 (566 - 581):e569。gydF4y2Ba
Seyfried NT, Dammer EB, Swarup V, Nandakumar D, Duong DM, Yin L,等。多网络方法识别无症状和有症状阿尔茨海默病中的蛋白特异性共表达。细胞系统。2017;4 (60 - 72):e64。gydF4y2Ba
Crotti A, Ransohoff RM。小神经胶质生理学和病理生理学:来自全基因组转录谱分析的见解。免疫力。2016;44:505-15。gydF4y2Ba
Keren-Shaul H, Spinrad A, Weiner A, Matcovitch-Natan O, Dvir-Szternfeld R, Ulland TK,等。一种与限制阿尔茨海默病发展有关的独特小胶质细胞类型。细胞。2017;169 (1276 - 1290):e1217。gydF4y2Ba
Rangaraju S, Dammer EB, Raza SA, Gao T, Xiao H, Betarbet R,等。急性分离小鼠小胶质细胞的定量蛋白质组学鉴定了新的免疫阿尔茨海默病相关蛋白。摩尔Neurodegener。2018;34。gydF4y2Ba
stander M, Phinney A, Probst A, Sommer B, Staufenbiel M, Jucker M. APP23转基因小鼠大脑中小胶质细胞与淀粉样斑块的关系。中华病理学杂志1999;154:1673-84。gydF4y2Ba
Bornemann KD, Wiederhold KH, Pauli C, Ermini F, Stalder M, Schnell L,等。abeta诱导APP23转基因小鼠小胶质细胞的炎症过程。中华病理学杂志2001;158:63-73。gydF4y2Ba
沈明。小胶质细胞在阿尔茨海默病中的作用。细胞生物学杂志。2018;217:459-72。gydF4y2Ba
阿兹海默氏症中的小胶质细胞。J clinin Invest. 2017; 127:3240-9。gydF4y2Ba
Gao T, Jernigan J, Raza SA, Dammer EB, Xiao H, Seyfried NT,等。IRF1、LXRbeta和CEBPalpha对内稳态和疾病相关小胶质基因的转录调控神经胶质。2019;67:1958 - 75。gydF4y2Ba
Rustenhoven J, Smith AM, Smyth LC, Jansson D, scott EL, Swanson MEV,等。pu1在人原代小胶质细胞中调控阿尔茨海默病相关基因。摩尔Neurodegener。2018;13:44。gydF4y2Ba
胡金勇,Frost GR,吴旭,Crump C,潘世杰,黄娥,等。先天免疫蛋白IFITM3调节阿尔茨海默病的γ -分泌酶。大自然。2020;586:735-40。gydF4y2Ba
Wee YS, Roundy KM, Weis JJ, Weis JH。干扰素诱导的先天性免疫反应跨膜蛋白通过影响网格蛋白和v- atp酶的定位和功能,起到膜组织者的作用。先天Immun。2012;18:834-45。gydF4y2Ba
Ranjbar S, Haridas V, Jasenosky LD, Falvo JV, Goldfeld AE。IFITM蛋白在结核分枝杆菌感染限制中的作用。细胞众议员13:874 2015;83年。gydF4y2Ba
Stacey MA, Clare S, Clement M, Marsden M, Abdul-Karim J, Kane L,等。抗病毒限制因子ifn诱导的跨膜蛋白3可防止细胞因子驱动的CMV发病。J clinin Invest. 2017; 127:1463-74。gydF4y2Ba
Poddar S, Hyde JL, Gorman MJ, Farzan M, Diamond MS.干扰素刺激基因IFITM3限制关节炎和脑炎甲病毒的感染和发病机制。J微生物学报。2016;90:8780 - 94。gydF4y2Ba
Vavougios GD, Nday C, Pelidou SH, Gourgoulianis KI, Stamoulis G, Doskas T,等。在阿尔茨海默病的病理生物学中,包括SARS-CoV-2在内的感染诱导IFITM3运输系统由外向内。脑行为Immun健康杂志。2021;14:100243。gydF4y2Ba
张爱梅,Boulden J, Katz JB,王磊,Meyer TJ, Soler AP,等。Bin1消融增加了衰老过程中患癌症的易感性,尤其是肺癌。实用癌症杂志2007;67:7605-12。gydF4y2Ba
Shihavuddin A, Basu S, Rexhepaj E, Delestro F, Menezes N, Sigoillot SM,等。从3D图像栈中平滑提取2D流形。Nat Commun。2017;8:15554。gydF4y2Ba
流式细胞术检测急性分离成人小胶质细胞和脑巨噬细胞的体外吞噬特性。J Vis Exp. 2020;160:e61467。gydF4y2Ba
Gordon R, Hogan CE, Neal ML, Anantharam V, Kanthasamy AG, Kanthasamy A.一种简单的高收率分离纯初代小胶质细胞的方法。神经科学方法。2011;194:287-96。gydF4y2Ba
Marek R, Caruso M, Rostami A, Grinspan JB, Das Sarma J.磁细胞分选:一种从新生小鼠脑组织中同时分离高纯度活星形胶质细胞和小胶质细胞的快速有效方法。神经科学方法。2008;175:108-18。gydF4y2Ba
Butler Iii RR, Kozlova A, Zhang H, Zhang S, Streit M, Sanders AR,等。人诱导多能干细胞衍生的小胶质细胞与阿尔茨海默病和主要神经精神障碍的遗传相关性。摩尔神经精神病学。2020;5:85 - 96。gydF4y2Ba
张松,张宏,周勇,乔梅,赵松,Kozlova A,等。人类iPSC神经元中的等位基因特异性开放染色质阐明了功能性疾病的变异。科学。2020;369:561-5。gydF4y2Ba
Brownjohn PW, Smith J, Solanki R, Lohmann E, Houlden H, Hardy J,等。人干细胞衍生小胶质细胞中错义TREM2突变的功能研究。干细胞报告。2018;10:1294-307。gydF4y2Ba
Rangaraju S, Raza SA, Pennati A, Deng Q, Dammer EB, Duong D,等。一种基于系统药理学的方法来识别小胶质激活中新的Kv1.3通道依赖机制。J神经炎症。2017;14:128。gydF4y2Ba
Ramesha S, Rayaprolu S, Bowen CA, Giver CR, Bitarafan S, Nguyen HM,等。阿尔茨海默病Kv1.3通道阳性脑髓样细胞的独特分子特征和小胶质起源美国科学院学报2021;118:e2013545118。gydF4y2Ba
Emig D, Salomonis N, Baumbach J, Lengauer T, Conklin BR, Albrecht M. AltAnalyze和DomainGraph:分析和可视化外显子表达数据。核酸学报2010;38:W755-62。gydF4y2Ba
Rangaraju S, Raza SA, Li NX, Betarbet R, Dammer EB, Duong D,等。CD45(低)小胶质细胞和CD45(高)脑单核吞噬细胞激活的差异吞噬特性和年龄相关效应。Immunol前面。2018;9:405。gydF4y2Ba
A K. FracLac for ImageJ。在:书FracLac为ImageJ(编辑编辑^eds.)。城市;1999 - 2013。gydF4y2Ba
Nicot AS, Toussaint A, Tosch V, Kretz C, Wallgren-Pettersson C, Iwarsson E,等。双泡素2 (BIN1)突变破坏了与动力蛋白2的相互作用,导致常染色体隐性中心核肌病。Nat麝猫。2007;39:1134-9。gydF4y2Ba
swwardfager W, Lanctot K, Rothenburg L, Wong A, Cappell J, Herrmann N.阿尔茨海默病细胞因子的meta分析。生物精神病学杂志。2010;68:930-41。gydF4y2Ba
tapa R, das Neves SP, Sousa AL, Fernandes J, Pinto C, Correia AP,等。阿尔茨海默病患者脑脊液中的促炎和抗炎细胞因子及其与认知能力下降的相关性一般人衰老。2019;76:125-32。gydF4y2Ba
陈美美,Ramesha S, Weinstock LD,高涛,平磊,肖华,等。细胞外信号调节激酶调节阿尔茨海默病的小胶质免疫反应。神经科学杂志,2021;99:1704-21gydF4y2Ba
Parkhurst CN, Yang G, Ninan I, Savas JN, Yates JR 3rd, Lafaille JJ,等。小胶质细胞通过脑源性神经营养因子促进学习依赖性突触的形成。细胞。2013;155:1596 - 609。gydF4y2Ba
莱弗利S, Schlichter LC。小胶质细胞对促炎刺激(LPS, IFNgamma+TNFalpha)有反应,并通过分解细胞因子(IL-4, IL-10)重新编程。前沿细胞神经科学。2018;12:215。gydF4y2Ba
叶霞,朱明,车鑫,王辉,梁新军,吴超,等。脂多糖通过激活MTOR通路和下调Vps34抑制自噬体形成诱导小胶质细胞神经炎症。J神经炎症。2020;十七18。gydF4y2Ba
保护小胶质细胞亚群在发育、衰老和疾病中的作用:来自转录组学研究的经验教训。Immunol前面。2020;11:430。gydF4y2Ba
Wendeln AC, Degenhardt K, Kaurani L, Gertig M, Ulas T, Jain G,等。大脑中的先天免疫记忆塑造了神经疾病的特征。大自然。2018;556:332-8。gydF4y2Ba
Cardona AE, Pioro EP, Sasse ME, Kostenko V, Cardona SM, Dijkstra IM,等。fractalkine受体对小胶质神经毒性的控制。Nat > 2006; 9:917-24。gydF4y2Ba
库恩KD,迈尔斯AJ,克雷格DW,韦伯斯特JA,皮尔逊JV,林斯DH,等。高密度全基因组关联研究表明APOE是散发型晚发性阿尔茨海默病的主要易感基因。中华临床精神病学杂志2007;68:613-8。gydF4y2Ba
李s, Varvel NH, Konerth ME, Xu G, Cardona AE, Ransohoff RM,等。在两种阿尔茨海默病小鼠模型中,CX3CR1缺失改变了小胶质细胞激活并减少了β -淀粉样蛋白沉积。中华病理学杂志2010;177:2549-62。gydF4y2Ba
Floden AM, Combs CK。β -淀粉样蛋白以独特的方式刺激小鼠出生后和成体小胶质细胞培养。J > 2006; 26:4644-8。gydF4y2Ba
Taga M, Petyuk VA, White C, Marsh G, Ma Y, Klein HU,等。BIN1蛋白异构体在星形胶质细胞、神经元和小胶质细胞中有差异表达:神经元和星形胶质细胞BIN1与tau病理有关。摩尔Neurodegener。2020;44。gydF4y2Ba
李e, Marcucci M, Daniell, Pypaert M, Weisz OA, Ochoa GC,等。肌肉中两泡素2 (Bin1)和t小管的生物生成。科学。2002;297:1193-6。gydF4y2Ba
Nott A, Holtman IR, Coufal NG, Schlachetzki JCM, Yu M, Hu R,等。脑细胞类型特异性增强子-启动子相互作用组图和疾病风险关联。科学。2019;366:1134-9。gydF4y2Ba
Young AMH, Kumasaka N, Calvert F, Hammond TR, Knights A, Panousis N,等。人类小胶质细胞的转录异质性和调节变异图谱。Nat麝猫。2021;53:861-8。gydF4y2Ba
Ramjaun AR, McPherson PS.多个amphiphysin II剪接变体显示不同的网格蛋白结合:识别两个不同的网格蛋白结合位点。J Neurochem。1998;70:2369 - 76。gydF4y2Ba
Ramjaun AR, Micheva KD, Bouchelet I, McPherson PS.一种神经末梢富集的双泡素亚型的鉴定和表征。生物化学杂志1997;272:16700-6。gydF4y2Ba
Muller AJ, Baker JF, DuHadaway JB, Ge K, Farmer G, Donover PS,等。靶向破坏小鼠Bin1/Amphiphysin II基因不会使胞吞功能失效,但会导致胚胎心肌病和异常肌原纤维形成。分子细胞生物学。2003;23:4295-306。gydF4y2Ba
潘斯,夏玛,帕特尔K, Caplan S,卡尔CM, Grant BD. AMPH-1/Amphiphysin/Bin1与RME-1/Ehd1在内吞循环中的作用。细胞生物学杂志。2009;11:1399-410。gydF4y2Ba
葛K, DuHadaway J,杜W, Herlyn M, Rodeck U, Prendergast GC。消除肿瘤抑制因子的机制:脑特异性外显子的异常剪接导致黑色素瘤中Bin1功能的丧失。中国科学院学报1999;96:9689-94。gydF4y2Ba
Folk WP, Kumari A, Iwasaki T, Pyndiah S, Johnson JC, Cassimere EK,等。肿瘤抑制因子BIN1的缺失使ATM Ser/Thr激酶被核蛋白E2F1激活,使癌细胞对顺铂产生耐药性。生物化学杂志2019;294:5700-19。gydF4y2Ba
基于结构的c-Myc/Bin1蛋白相互作用模型表明,Bin1和c-Myc磷酸化的选择性剪接是关键的结合决定因素。中华分子生物学杂志2005;351:182-94。gydF4y2Ba
Sakamuro D, Elliott KJ, Wechsler-Reya R, Prendergast GC。BIN1是一种新的myc相互作用蛋白,具有肿瘤抑制因子的特征。Nat麝猫。1996;14:69 - 77。gydF4y2Ba
Smith AM, Gibbons HM, Oldfield RL, Bergin PM, Mee EW, Faull RL,等。pu1转录因子对人脑小胶质细胞的活性和功能起着至关重要的作用。神经胶质。2013;61:929-42。gydF4y2Ba
Pimenova AA, Herbinet M, Gupta I, Machlovi SI, Bowles KR, Marcora E,等。阿尔茨海默病相关pu1表达水平调节小胶质细胞炎症反应。一般人说。2021;148:105217。gydF4y2Ba
刘顺生,陈超,傅文英,曲劲勇,毕斌思,傅亚基,等。IL-33-PU.1转录组重编程驱动阿尔茨海默病小胶质细胞的功能状态转变和清除活性。细胞众议员2020;31:107530。gydF4y2Ba
田中T,村上K,班多Y,吉田s干扰素调节因子7参与m1样微胶质极化开关。神经胶质。2015;63:595 - 610。gydF4y2Ba
Cohen M, Matcovitch O, David E, Barnett-Itzhaki Z, Keren-Shaul H, Blecher-Gonen R,等。TGFbeta1的长期暴露通过irf7依赖的方式调节髓细胞炎症反应。EMBO j . 2014; 33:2906-21。gydF4y2Ba
黄kl, Marcora E, Pimenova AA, Di Narzo AF, Kapoor M, Jin SC,等。一种常见的单倍型降低髓细胞中PU.1的表达,延缓阿尔茨海默病的发生。Nat > 2017; 20:1052 - 61。gydF4y2Ba
Gyoneva S, Hosur R, Gosselin D,张B,欧阳Z, Cotleur AC,等。缺乏cx3cr1的小胶质细胞表现出过早老化的转录组。生命科学联盟2019;2:e201900453。gydF4y2Ba
范铮,赵松,朱勇,李铮,刘铮,闫勇,等。干扰素调节因子5介导脂多糖诱导的神经炎症。Immunol前面。2020;11:600479。gydF4y2Ba
增田T,岩本S, Yoshinaga R, Tozaki-Saitoh H, Nishiyama A, Mak TW,等。转录因子IRF5驱动P2X4R+反应性小胶质细胞门控神经性疼痛。Nat Commun。2014;5:3771。gydF4y2Ba
龚亮,王辉,孙旭,刘超,段超,蔡锐,等。toll -白介素1受体结构域适配器蛋白正向调节BV2细胞M1极化。神经科学杂志2016;43:1674-82。gydF4y2Ba
增田T,津田M,吉永R, Tozaki-Saitoh H,小田K,田村T,等。IRF8是将小胶质细胞转化为反应型的关键转录因子。细胞众议员2012;1:334-40。gydF4y2Ba
增田T,岩本S, Mikuriya S, Tozaki-Saitoh H,田村T, Tsuda M,等。转录因子IRF1在反应性小胶质细胞中负责irf8介导的il -1 β的表达。中国药理学杂志2015;128:216-20。gydF4y2Ba
崔红,Banerjee S,郭松,谢宁,刘刚。IFN调节因子2抑制巨噬细胞糖酵解基因的表达和脂多糖诱导的促炎症反应。J Immunol。2018;200:3218-30。gydF4y2Ba
增田T,西本N,富山D,松田T, Tozaki-Saitoh H,田村T,等。IRF8是小胶质细胞运动的转录决定因子。Purinergic信号。2014;10:515-21。gydF4y2Ba
徐松,梅松,卢杰,吴宏,董旭,石磊,等。小胶质细胞的转录组分析显示TLR2/IRF7信号轴介导蛛网膜下腔出血后的神经炎症。老年神经科学。2021;13:645649。gydF4y2Ba
本田K,柳井H,根岸H,浅尻M,佐藤M,水谷T,等。IRF-7是i型干扰素依赖性免疫反应的主要调节因子。大自然。2005;434:772-7。gydF4y2Ba
罗恩尔,王斌,万耀威,赵刚,Cole A,尹卓,等。I型干扰素反应驱动阿尔茨海默病的神经炎症和突触丧失。J clinin Invest. 2020; 130:1912-30。gydF4y2Ba
Dorman LC, Nguyen PT, Escoubas CC, Vainchtein ID, Xiao Y, Lidsky PV,等。I型干扰素反应定义了有效吞噬所需的保守小胶质状态。bioRxiv。2021 2021.2004.2029.441889。gydF4y2Ba
Majumdar A, Cruz D, Asamoah N, Buxbaum A, Sohar I, Lobel P,等。激活小胶质细胞使溶酶体酸化,导致阿尔茨海默淀粉样原纤维降解。分子生物学细胞。2007;18:1490-6。gydF4y2Ba
Corona AW, Huang Y, O'Connor JC, Dantzer R, Kelley KW, Popovich PG,等。Fractalkine受体(CX3CR1)缺乏使小鼠对脂多糖诱导的行为变化敏感。J神经炎症。2010;7:93。gydF4y2Ba
Kaiser T, Feng G. Tmem119-EGFP和Tmem119-CreERT2转基因小鼠的标记和操作小胶质细胞。eNeuro。6: eneuro.0448 2019; 18.2019。gydF4y2Ba
Olah M, Patrick E, Villani AC, Xu J, White CC, Ryan KJ,等。老年人小胶质细胞的转录组学图谱。Nat Commun。2018;9:539。gydF4y2Ba
Rayaprolu S, Gao T, Xiao H, Ramesha S, Weinstock LD, Shah J,等。流式细胞仪小胶质分选结合定量蛋白质组学鉴定moesin是一种与阿尔茨海默病相关的高度丰富的小胶质蛋白。摩尔Neurodegener。2020;15:28。gydF4y2Ba
Lake BB,陈硕,Sos BC,范杰,葛凯泽尔,容永昌,等。成人大脑转录和表观遗传状态的综合单细胞分析。生物科技Nat》。2018;36:70 - 80。gydF4y2Ba
Galatro TF, Holtman IR, Lerario AM, Vainchtein ID, Brouwer N, Sola PR,等。纯化的人皮质小胶质细胞的转录组学分析揭示了年龄相关的变化。Nat > 2017; 20:1162 - 71。gydF4y2Ba
致谢gydF4y2Ba
我们要感谢Ha-Na Shim和Jeffrey Lenz在小鼠群体维护和组织学方面的帮助。gydF4y2Ba
资金gydF4y2Ba
本研究由美国国立卫生研究院资助RF1 AG054223和RF1 AG056061(给G.T.), R01 NS114130-01A1, RF1 AG071587和K08 NS099474(给S.R.), R01 AG063175(给J.D.和G.T.), R01 MH106575(给J.D.), R01 R01NS115994(给L.W.),国家科学基金CAREER 1944053(给L.W.)。gydF4y2Ba
作者信息gydF4y2Ba
作者和联系gydF4y2Ba
贡献gydF4y2Ba
AS、SRamesha (SRa)、GT和SRangaraju (SRu)设计了所有的体内实验并分析了数据。SRa、TG、PK和SRu设计并完成了所有体外原代培养实验并分析了数据。SRa和SRu进行了NanoString测试并分析了数据。AS、MP和GT进行免疫标记、图像采集和图像分析。AS和SW分别进行免疫印迹和qRT-PCR。MH、XZ、LC和AS进行小鼠繁殖和注射。MH、AS和CS对小鼠大脑小胶质细胞进行FACS分离。SRa和SRu分析了流式细胞术数据。AK和JD生成人体iPSC并进行iMG分化。SW生成crispr编辑的BV2细胞。 SW, DBA, and AS performed BV2 experiments. SB and LBW performed Luminex and MSD assays. SRu and GT performed bioinformatic analyses. AS, GT, and SRu wrote the manuscript, and LBW and JD edited the manuscript. All authors read and approved the final manuscript.
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
伦理批准和同意参与gydF4y2Ba
所有的动物实验都是在埃默里大学和南佛罗里达大学按照IACUC的规定批准和进行的。gydF4y2Ba
同意出版gydF4y2Ba
不适用。gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者声明他们没有竞争利益。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Ba
伟德体育在线施普林格自然对出版的地图和机构附属的管辖权要求保持中立。gydF4y2Ba
补充信息gydF4y2Ba
附加文件1:图S1。gydF4y2Ba
BIN1在小鼠和人小胶质细胞中的表达来自转录组和蛋白质组数据集。gydF4y2Ba(a - b)gydF4y2Ba大规模数据集报道的脑细胞中BIN1转录和蛋白质水平。gydF4y2Ba(一)gydF4y2BaZhang等人描述了纯化神经细胞的转录物丰度。[gydF4y2Ba16gydF4y2Ba].OPC,少突胶质前体细胞;NF Oli,新形成的少突胶质细胞;髓奥利,髓鞘化少突胶质细胞;最终,内皮细胞。gydF4y2Ba(B)gydF4y2Ba纯化小鼠神经细胞类型的蛋白质丰度数据(来自无标签定量研究的log2转换丰度值)的比较[gydF4y2Ba20.gydF4y2Ba].gydF4y2Ba(C)gydF4y2Ba人类(死后老年人类脑源性小胶质细胞)和几种小鼠模型之间的BIN1小胶质蛋白水平(百分位丰度)的比较。绘制的数据来自几个独立的定量质谱数据集:来自6至7岁雌性C57BL6J小鼠的CD11b +磁激活细胞分选(MACS),这些小鼠接受对照剂或LPS(4日i.p.剂量),或AD病理的转基因小鼠模型(5XFAD),来自3岁C57BL6J小鼠的CD11b +小胶质细胞,经MACS纯化,或荧光激活细胞分选(FACS),以及长生小胶质BV2细胞(未处理或LPS处理24小时)[gydF4y2Ba26gydF4y2Ba,gydF4y2Ba98gydF4y2Ba,gydF4y2Ba99gydF4y2Ba]gydF4y2Ba(D)gydF4y2Ba单核RNA测序数据表明,在新鲜冷冻的死后人脑组织中的小胶质细胞和少突胶质细胞中发现了高水平的BIN1转录本[gydF4y2BaOne hundred.gydF4y2Ba].(gydF4y2BaE)gydF4y2Ba来自不同年龄组的分离的人类小胶质细胞的RNA测序mRNA丰度(log2转化)显示,在人类大脑的整个生命周期中,小胶质细胞中BIN1 mRNA丰度高[gydF4y2Ba101gydF4y2Ba].gydF4y2Ba
附加文件2:图S2。gydF4y2Ba
小胶质细胞外显子11剪接。gydF4y2Ba(一)gydF4y2BaRT-PCR检测外显子11,发现小鼠大脑facs分离的小胶质细胞中未包含外显子11,LPS注射后剪接没有变化(左)。从人iPSCs中分化出来的iMG细胞显示出可以忽略不计的外显子11(右)。在人死后脑组织灰质样本中,可见少量外显子11的内含。gydF4y2Ba(B)gydF4y2Ba通过外显子7、外显子11和CLAP结构域/外显子17进行RT-PCR扩增的BIN1外显子和引物位置示意图。指出了用于识别外显子13-17交替剪接的策略。在本研究中发现的四种小鼠小胶质细胞Bin1异构体如图所示。BAR, BIN-amphiphysin/Rvs结构域;PI,磷酸肌苷结合基序(由肌肉特异性外显子11编码),CLAP,网格蛋白和AP2结合域,SH3, Src同源性3域。gydF4y2Ba
附加文件3:图S3。gydF4y2Ba
Bin1gydF4y2BasiRNA治疗原发性小胶质细胞可使DAM基因转录异常而不影响细胞活力。将CD11b +富集的原代小鼠小胶质细胞(p0-3)在sham siRNA或Bin1 siRNA(等摩尔浓度)存在下培养48小时。gydF4y2Ba(一)gydF4y2Ba用流式细胞术(活/死固定蓝色活力染料)评估CD45+小胶质细胞群内的细胞活力。gydF4y2BaNgydF4y2Ba=每个条件进行3个独立实验。gydF4y2Ba(B)gydF4y2BaLPS刺激培养的小胶质细胞后,Bin1转录物水平(NanoString)增加。gydF4y2Ba(C)gydF4y2Ba火山图显示在Bin1 KD后差异表达的关键基因。gydF4y2Ba(D)gydF4y2Ba在Bin1表达缺失后,ad相关的关键小胶质基因的转录本表达紊乱,这种影响被lps诱导的炎症信号强化。gydF4y2Ba
附加文件4:图S4。gydF4y2Ba
体外数据集的转录聚类分析证明了转录失调的程度gydF4y2BaBin1gydF4y2BaKD在原代培养的小胶质细胞中。gydF4y2Ba(一)gydF4y2BaLPS暴露后的转录本表达火山图确定了受这种内毒素影响的几个AD和dam相关基因。如Rangaraju等人所述,所描述的配色方案基于小胶质基因共表达模块分配。[gydF4y2Ba21gydF4y2Ba].gydF4y2Ba(B)gydF4y2Ba火山图显示了LPS暴露后BIN1调控的基因,突出了BIN1 siRNA调控失调的几个炎症基因。gydF4y2Ba(氟)gydF4y2Ba基因本体表达分析确定了受错误表达基因簇影响的重要细胞功能。gydF4y2Ba
附加文件5:图S5。gydF4y2Ba
流式细胞术门控策略用于小鼠脑分离小胶质细胞,LPS注射期间的体重和温度分析。gydF4y2Ba(一)gydF4y2Ba从小鼠大脑中分离的细胞被散射(单个单个核细胞)和荧光(CD11b)门控gydF4y2Ba+gydF4y2BaCD45gydF4y2BaintgydF4y2Ba)对小胶质细胞种群进行分类。gydF4y2Ba(c)gydF4y2Ba注射lps的小鼠在注射期间体重显著下降。Cx3cr1表达减少(在Cx3cr1中gydF4y2Ba克里尔gydF4y2Ba)增加了对照组记录的脂多糖诱导的体重减轻(Bin1gydF4y2Bafl / flgydF4y2Ba)动物,通过微胶质Bin1 (Cx3cr1)的额外缺失而减弱gydF4y2Ba克里尔gydF4y2Ba-Bin1 cKO)。gydF4y2Ba(d e)gydF4y2BaLPS注射前后对体温无影响。gydF4y2Ba(F)gydF4y2Ba免疫荧光染色Bin1gydF4y2Bafl / flgydF4y2Ba提示外周LPS注射不影响BIN1的小胶质表达或定位。gydF4y2Ba(G)gydF4y2BaNanoString分析mRNA转录本发现注射LPS后Bin1表达没有变化。gydF4y2Ba(H)gydF4y2Ba在生理盐水或LPS注射后,从facs分离的小胶质细胞中定量了Bin1 iso10 mRNA转录物的相对水平。gydF4y2Ba
附加文件6:图S6。gydF4y2Ba
删除小胶质gydF4y2BaBin1gydF4y2Ba不影响细胞形态。gydF4y2Ba(一)gydF4y2Ba在删除gydF4y2Ba箱子gydF4y2Ba小胶质细胞(gydF4y2BaCx3cr1gydF4y2Ba克里尔gydF4y2Ba-gydF4y2BaBin1gydF4y2BacKO),未见明显的小胶质形态变化。似乎对LPS给药没有任何影响。gydF4y2Ba(B)gydF4y2Balps注射小鼠FracLac壳的定量和小胶质细胞的圆形形态分析。大鼠初级躯体感觉皮层(SSp)中的小胶质细胞gydF4y2BaCx3cr1gydF4y2Ba克里尔gydF4y2Ba-gydF4y2BaBin1gydF4y2BacKO小鼠的跨度比大于gydF4y2BaCx3cr1gydF4y2Ba克里尔gydF4y2Ba控制老鼠。*,gydF4y2BapgydF4y2Ba< 0.05;Mann-Whitney U检验。gydF4y2Ba(C)gydF4y2Bab中数据的代表图像,所有数据以平均值±SEM表示。gydF4y2Ba
附加文件7:图S7。gydF4y2Ba
体内转录变化和细胞因子产生综述。gydF4y2Ba(a - b)gydF4y2Ba由BIN1调控的阳性(A)和阴性(B)基因(即,随着BIN1敲除分别减少和增加)通过原始转录本计数(上面板)和规范化表达(相对于BIN1)从体内NanoString数据集中总结gydF4y2Bafl / flgydF4y2Ba为WT当量;底部面板)。gydF4y2Ba(C)gydF4y2Ba脑裂解液中细胞因子表达的总结(用Luminex测量)。以平均值表示的数据gydF4y2Ba±gydF4y2Ba扫描电镜。gydF4y2Ba
附加文件8:图S8。gydF4y2Ba
全脑qRT-PCR分析选定的内稳态和dam相关基因,并掌握骨髓调节转录因子。图中总结了分析的原始数据集。gydF4y2Ba8gydF4y2BaA.用qRT-PCR方法分析编码内稳态蛋白(P2ry12、Tmem119)、DAM蛋白(Itgax、Cst7、Cd68、Trem2、Spp1)和转录因子(Sfpi1)的基因转录水平。除了dam相关基因Spp1外,所有基因都在LPS刺激后以bin1依赖的方式上调。*,gydF4y2BapgydF4y2Ba< 0.05;**gydF4y2BapgydF4y2Ba< 0.01;未配对t检验。数据绘制为平均值±SEM。*,gydF4y2BapgydF4y2Ba< 0.05。gydF4y2Ba
附加文件9:图S9。gydF4y2Ba
通过CRISPR/Cas9基因编辑生成缺乏BIN1表达的BV2 KO小胶质细胞。gydF4y2Ba(一)gydF4y2Ba慢病毒结构表达一个sgRNA靶向区域内gydF4y2BaBin1gydF4y2Ba使用不变外显子3 (KO)或非靶标sgRNA生成稳定转导的BV2 KO和对照组(WT)细胞池。进一步对WT和KO两个独立的沉积池进行了表征。测序(使用反向引物)跨越两个KO池的目标序列以及PCR产物中单个克隆插入的序列gydF4y2BaBin1gydF4y2Ba外显子3序列。编号基于RefSeq NM_009668.2。gydF4y2Ba(B)gydF4y2BaWT控制和gydF4y2BaBin1gydF4y2BaKO池保留了类似的形态。gydF4y2Ba(C)gydF4y2Ba免疫印迹分析结果表明其稳定gydF4y2BaBin1gydF4y2Ba在基础条件下或LPS刺激后,KO BV2池不表达BIN1蛋白。gydF4y2Ba
权利和权限gydF4y2Ba
本文遵循创作共用署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),该协议允许在任何媒体或格式中使用、分享、改编、分发和复制,只要您给予原作者和来源适当的署名,提供创作共用许可协议的链接,并说明是否有更改。本文中的图片或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果材料不包含在文章的创作共用许可中,并且您的预期用途不被法律法规允许或超出了允许的用途,您将需要直接从版权所有者那里获得许可。欲查看此许可证的副本,请访问gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba.创作共用公共领域奉献放弃书(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)适用于本文提供的数据,除非在数据的信用额度中另有说明。gydF4y2Ba
关于这篇文章gydF4y2Ba
引用这篇文章gydF4y2Ba
苏德华兹,A.,拉梅沙,S.,高,T.。gydF4y2Baet al。gydF4y2BaBIN1是小胶质细胞中促炎和神经变性相关激活的关键调节因子。gydF4y2Ba摩尔神经退化gydF4y2Ba17gydF4y2Ba33岁(2022年)。https://doi.org/10.1186/s13024-022-00535-xgydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s13024-022-00535-xgydF4y2Ba
关键字gydF4y2Ba
- BIN1gydF4y2Ba
- 阿尔茨海默病gydF4y2Ba
- 神经炎症gydF4y2Ba
- 小神经胶质细胞gydF4y2Ba
- 先天免疫gydF4y2Ba
- GWAS风险因素gydF4y2Ba
- 有限合伙人gydF4y2Ba
- IRF1gydF4y2Ba
- IRF7gydF4y2Ba
- PU.1gydF4y2Ba
- IFITM3gydF4y2Ba
- CX3CR1gydF4y2Ba